Method Article
Isolamento ed espansione delle cellule T Killer citotokine indotte da citokine per il trattamento del cancro
In questo articolo
Riepilogo
Qui, presentiamo un protocollo per eseguire l'isolamento e l'espansione delle cellule mononucleari periferiche derivate dalle cellule citochine- indotte CD3-CD56- cellule killer e illustrare il loro effetto di citotossicità contro le cellule tumorali ematologiche e solide utilizzando un sistema di citometria di flusso di diagnosi invitro.
Abstract
L'immunoterapia cellulare adottiva si concentra sul ripristino del riconoscimento del cancro tramite il sistema immunitario e migliora l'uccisione efficace delle cellule tumorali. La terapia con cellule T indotta da citochine (CIK) per esercitare effetti citotossici significativi contro le cellule tumorali e per ridurre gli effetti negativi della chirurgia, delle radiazioni e della chemioterapia nei trattamenti contro il cancro. Il CIK può essere derivato da cellule mononucleari periferiche del sangue (PBMC), midollo osseo e sangue del cordone ombelicale. Le cellule CIK sono una sottopopolazione eterogenea di cellule T con CD3-CD56e caratteristiche fenotipiche natural killer (NK) che includono l'attività antitumorale senza restrizioni del complesso di istocompatibilità (MHC). Questo studio descrive un metodo qualificato, clinicamente applicabile, basato sulla citometria di flusso per la quantificazione della capacità citolytica delle cellule CIK derivate da PBMC contro le cellule tumorali ematologiche e solide. Nel saggio citolitico, le cellule CIK sono co-incubate a diversi rapporti con cellule tumorali bersaglio prestainte. Dopo il periodo di incubazione, il numero di cellule bersaglio è determinato da una macchia legante acido nucleico per rilevare le cellule morte. Questo metodo è applicabile sia alle applicazioni di ricerca che a quella diagnostica. Le cellule CIK possiedono una potente citotossicità che potrebbe essere esplorata come strategia alternativa per il trattamento del cancro dopo la sua valutazione preclinica da parte di un sistema di citometria basato su citometro (CS & T).
Introduzione
I linfociti Citotossici sono una popolazione specifica di cellule eretritarie immunitarie che mediano le risposte immunitarie contro il cancro. Diverse popolazioni di cellule efleganti, tra cui cellule killer attivate da linfocini (LAK), linfociti infiltrati di tumore (TIL), cellule NK , cellule di z T, e cellule killer indotta da citochine (CIK) sono stati sviluppati per scopi di terapia at-cellule adottivi (ACT)1. C'è un crescente interesse per le cellule CIK, perché rappresentano una miscela di popolazioni di cellule citototossiche indotte da citochine espanse da cellule mononucleari del sangue periferico autologhe (PMBC)2.
La crescita incontrollata di cellule progenitrici linfoidi, mieloblasti e linfoblasti porta a tre principali tipi di tumori del sangue (ad esempio leucemia, linfoma e mieloma), tumori solidi, tra cui carcinomi (ad esempio, cancro del polmone, cancro gastrico, cancro cervicale) e sarcomi, tra gli altri cancri3. Le cellule CIK sono una miscela di popolazioni cellulari che presentano una vasta gamma di attività antitumorali unrestricted complex (MHC) -unrestricted e quindi promettono per il trattamento dei tumori ematologici e avanzati4,5,6,7. Le celle CIK sono costituite da una combinazione di celle, tra cui le celle T (CD3,CD56),le cellule NK-T (CD3,CD56) e le cellule NK (CD3–CD56). L'ottimizzazione del protocollo di induzione del CIK mediante l'uso di un programma fisso per l'aggiunta di anticorpi IFN-z, anti-CD3 e IL-2, comporta l'espansione delle cellule CIK8. La capacità citototossica delle cellule CIK contro le cellule tumorali dipende principalmente dall'impegno del membro D del gruppo NK 2 (un membro della famiglia di recettori simili alla lectina di tipo C) ligando NKG2D sulle cellule tumorali e sulle vie mediate da perforina9. I risultati di uno studio preclinico hanno rivelato che le cellule CIK stimolate da IL-15 hanno indotto la potente citotossicità potente contro le linee cellulari della leucemia mieloide primaria e acuta in vitro e hanno mostrato una minore alloreattività contro i normali PBMC e i fibroblasti9. Recentemente, è stato pubblicato il risultato dell'infusione di CIK (1 x 108/kg dicellule CD3) come consolidamento a seguito del trapianto allogeneico non mieloablativo per il trattamento dei neoplasmi mieloidi in uno studio clinico di fase II.
Nel presente studio, abbiamo sviluppato una formula di coltura cellulare ottimizzata composta da ifN-z, IL-1, anticorpi anti-CD3, e IL-2 aggiunto al mezzo cellulare ematopoietico per aumentare la produzione di CIK, e studiato l'effetto citotossico delle cellule CIK contro le malattie umane croniche leucemia mieloide (K562) cellule e cellule tumorali ovariche (OC-3).
Protocollo
Il protocollo clinico è stato eseguito e approvato in conformità con le linee guida del Institutional Review Board della China Medical University and Hospital Research Ethics Committee. Gli esemplari di sangue periferico sono stati raccolti da volontari sani con il loro consenso informato.
1. Preparazione dei materiali
- Conservare reagenti, anticorpi e sostanze chimiche, come mostrato nella scheda dati sulla sicurezza dei materiali (MSDS). Sciogliere i farmaci o le citochine nei solventi come soluzioni di riserva e poi per lo stoccaggio di un valore di -20 o -80 gradi centigradi.
NOTA: informazioni dettagliate per la preparazione dei materiali sono annotate nella Tabella dei materiali.
2. Isolamento PBMC
- Scaldare la soluzione di sfumatura di densità (Tabella dei materiali) a 18-20 gradi centigradi prima dell'uso. Invertire la bottiglia di soluzione più volte per garantire una miscelazione accurata.
- Raccogliere 3 o 5 mL di campione di sangue venoso umano in una fiala eparinizzata e mescolare bene invertendo delicatamente il tubo più volte.
- Preparare 4 mL di soluzione di gradiente di densità in un tubo sterile da 15 mL.
- Con attenzione strato 1 mL del campione di sangue sulla soluzione di gradiente di densità.
- Centrifuga a 400 x g per 30 min a 18-20 gradi (spegni la pausa).
- Aspirare con attenzione e immediatamente lo strato di strato di buffy di cellule mononucleari (circa 1 mL) contemporaneamente per evitare di disturbare gli strati di un tubo sterile da 15 mL utilizzando una pipetta sterile da 1 mL.
- Aggiungete al manio del tubo di centrifuga nel tubo di centrifugare almeno 3 volumi di salina con buffer fosfato. Sospendere le cellule pipettandoli delicatamente su e giù almeno 3x con una pipetta sterile.
- Centrifuga a 400 x g per 10 min a 18-20 gradi centigradi. Aspirare il super-attuoso.
- Sospendere il pellet cellulare con 5 mL di mezzo basale (Tabella dei materiali) e trasferirlo in un pallone. Coltura le cellule in un incubatore di coltura cellulare a 37 gradi centigradi e 5% di CO2.
3. Induzione ed espansione del CIK
- Il giorno 0, colture i PBMC (1 x 106) in un mezzo basale fresco contenente 1.000 IU/mL di IFN-z per 24 h in un'incubatrice di coltura cellulare umida a 37 gradi centigradi e 5% di CO2.
- Il primo giorno, rinfrescare il supporto con un supporto basale fresco contenente 50 ng/mL di anticorpo anti-CD3, 1 ng/mL di rh IL-1 e 1.000 U/mL di rh IL-2. Rinfrescare il supporto ogni 3 giorni.
- Il giorno 7, rinfrescare il supporto con un supporto basale fresco contenente 1.000 U/mL di rh IL-2. Aggiornare il supporto ogni 3 giorni fino alla fine dell'espansione delle celle (Giorno 14).
4. Immunofenotipizzazione per la valutazione delle cellule CIK
- Lavare le cellule CIK con 10 mL di PBS sterile. Centrifuga per 10 min a 300 x g e 18-20 gradi centigradi, aspira il super-natante, e risospende nuovamente le cellule con 10 mL di PBS. Contare il numero di cella e testare la fattibilità della cella utilizzando l'esempio di esclusione blu trypan.
- Aliquote in sei sterili tubi da 1,5 mL ad una densità di 5-10 x 105 cellule/mL PBS. Etichettare e trattare come segue: Tube 1, Blank (nessun anticorpo); Tubo 2, aggiungere 20 L di isotipo IgG1-FITC; Tubo 3, aggiungere 20 L di isotipo IgG1-APC mAbs; Tubo 4, aggiungere 20 l di CD3-FITC; Tubo 5, aggiungere 20 L di CD56-APC mAbs; e Tube 6, aggiungere 20 gradi di CD3-FITC e 20 -L di CD56-APC mAbs.
- Mescolare delicatamente le cellule CIK con gli anticorpi pipeting su e giù almeno 3x con una pipetta sterile da 1 mL, quindi incubare per 30 minuti a temperatura ambiente al buio.
- Centrifugare i tubi per 10 min a 300 x g e 18-20 gradi centigradi. Aspirare il supernatante e sospendere il pellet cellulare una volta con 1 mL di PBS. Convogliarli delicatamente su e giù almeno 3x con una pipetta sterile da 1 mL.
- Ripetere il passaggio 4.4.
- Lasciare i tubi al buio prima dell'analisi citometrica del flusso.
5. Riconoscimento dei marcatori CD
- Trasferire la sospensione cellulare in uno sterile tubo rotondo inferiore in polistirolo da 5 mL con un tappo a colino a celle (100 m di rete) pipettando delicatamente attraverso il tappo. Mettere i tubi sul carosello in ordine.
- Aprire il software di analisi della citometria di flusso e creare una cartella sperimentale. Fare clic sul pulsante Nuovo campione per aggiungere un campione e un tubo all'esperimento e denominare i tubi come segue: Tubo 1, Vuoto; Tubo 2, Isotipo IgG1-CD3; Tubo 3, Isotipo IgG1-CD56; Tubo 4, CD3; Tubo 5, CD56; Tubo 6, CD3CD56.
- Creare un sistema di gating a dispersione per le popolazioni di cellule CIK (Figura 2A).
- Selezionare Tubo 1 (Vuoto) e fare clic sul pulsante Stampa punti per creare un grafico FSC-A/SSC-A. Disegnare un cancello rettangolare sull'intera popolazione di celle con una soglia FSC-A >5 x 104 per escludere i detriti delle cellule.
- Selezionare il parametro SSC-A/SSC-H per il nuovo grafico a punti e disegnare un cancello poligono intorno a tutte le singole celle. Selezionare i parametri Count/FITC (CD3) e Count/APC (CD56) rispettivamente per il nuovo grafico dell'istogramma. Selezionare il parametro FITC (CD3)/APC (CD56) per la nuova stampa a punti e disegnare un gate quadrante a quattro per definire le quattro sottopopolazioni.
- Registrare i dati da 20.000 singole celle in ogni campione. Fare clic sul pulsante Carica campione per analizzare prima l'esempio del controllo Vuoto. Identificare l'intera popolazione di celle CIK utilizzando i parametri dei canali CD56 e CD3.
- Ripetere il passaggio 5.3 per l'indagine di tutti i campioni.
- Aprire i file contenenti i valori statistici del singolo campione per analizzare le popolazioni di cellule CIK e ristamparle in file di analisi.
6. Coltura e colorazione delle cellule di leucemia mieloide cronica umana K562 e cellule OC-3
- Cellule K562
- Coltura cellule K562 in supporti completi (RPMI basale medium contenente 10% siero bovino fetale [FBS] e 50 U/mL antibiotici e regolare il glucosio a 4,5 g/L) ad una densità di 0,5x1 x 106 cellule/mL in una coltura cellulare e incubare in un'incubatrice umidizzata a 37 C e 5% CO2.
- Trasferi i mezzi di coltura contenenti le cellule K562 in tubi sterili da 50 mL e ferma le cellule a 300 x g per 10 min a 18-20 gradi centigradi il giorno dell'esperimento.
- Aspirare il supernatante, rispendere le cellule in 5 mL di PBS sterile, e mescolare bene delicatamente.
- Pellet le cellule a 300 x g per 10 min. Aspirate the supernatant, resuspend the cells in PBS, and adjust the K562 cells to a a concentration of 0.5-1 x 106 cells/mL.
- Aggiungete 0,5 l di colorante CFSE al 1 mL di sospensione cellulare K562 in un tubo sterile da 15 mL ad una concentrazione finale di 5 M. Mescolare delicatamente le sospensioni convogliando su e giù almeno 3x.
- Lasciare il tubo in un'incubatrice a coltura cellulare a 37 gradi centigradi e il 5% di CO2 per 10-15 min.
- Aggiungere 9 mL di PBS al tubo e pellet le cellule a 300 x g per 10 min. Trasferire la sospensione cellulare in un pallone di coltura cellulare e posizionarla nell'incubatrice.
- Celle OC-3
- Coltura OC-3 cellule in un supporto completo (media DMEM/F12 contenente 10% FBS e 50 U/mL antibiotici) ad una densità di 0,5-1 x 106 cellule in un pallone di coltura cellulare a 37 gradi centigradi e 5% di CO2.
- Aspirare i mezzi di coltura e lavare le cellule con PBS 1 giorno prima dell'esperimento.
- Staccare le cellule aggiungendo 1 mL di soluzione enzimatica di dissociazione cellulare (Tabella dei materiali) e incubare per 5 min a 37 .
- Sospendere le celle aggiungendo 5 mL di PBS e mescolare bene delicatamente. Pellet le cellule a 300 x g per 10 min e aspirare il supernatante. Risospendere le cellule in PBS e regolarle a una concentrazione di 0,5–1 x 106 celle/mL.
- Aggiungete 0,5 l di colorante CFSE a 1 mL della sospensione cellulare OC-3 in un tubo sterile da 15 mL ad una concentrazione finale di 5 M. Mescolare delicatamente le sospensioni convogliando su e giù almeno 3x.
- Lasciare il tubo in un'incubatrice a coltura cellulare a 37 gradi centigradi e il 5% di CO2 per 10-15 min.
- Aggiungere 9 mL di PBS al tubo e pellet le cellule a 300 x g per 10 min. Seme 5 x 105 cellule / bene in una piastra 6 pozzi e incubare in un'incubatrice umidificata a 37 c e 5% DI CO2 durante la notte.
7. Ansaggio di Cytotoxic
- Cocultura delle cellule CIK e K562 (CIK-K562)
- Contare le cellule K562 del passaggio 6.1.7 e testare la fattibilità cellulare con il test di esclusione blu trypan. Aggiungere 1 mL di celle K562 a ogni pozzo in una piastra 6 po' a densità di 5 x 105/mL.
- Aggiungere 1 mL di mezzo basale con o senza celle CIK dal passo 3.4 alla piastra 6 del pozzo dal passo 7.1.1 come segue: Beh 1 - Vuoto, Celle K562 da solo (5 x 105); Beh 2 - Cellule K562 macchiate di CFSE da sole (5 x 105); Beh 3 - Celle CIK (E [effettore], 25 x 105) - cellule K562 macchiate CFSE (T [bersaglio], 5 x 105); Cellule 4 - CIK (E, 50 x 105) - cellule K562 colorate CFSE (T, 5 x 105).
- Mescolare le sospensioni cellulari convogliandole delicatamente su e giù almeno 3x. Posizionare la piastra nell'incubatrice per 24 ore.
- Cocultura delle cellule CIK e OC-3 (CIK-OC-3)
- Aggiungere 1 mL di mezzo basale con o senza celle CIK dal passo 3.4 alla piastra 6 del pozzo dal passo 6.2.7 come segue: Beh 1 - Vuoto, OC-3 cellule da solo (5 x 105); Beh 2 - Cellule OC-3 macchiate di CFSE da sole (5 x 105); Beh 3 - Celle CIK (E, 25 x 105) - cellule OC-3 macchiate CFSE (T, 5 x 105); Cellule CIK (E, 50 x 105) - cellule OC-3 colorate CFSE (T, 5 x 105).
- Mescolare le sospensioni cellulari convogliandole delicatamente su e giù almeno 3x. Mettere la piastra nell'incubatrice per 24 ore.
- 7-Aminoactinomycin D (7-AAD) colorazione
- Raccogliere la sospensione cellulare CIK-K562 da passo 7.1.3 direttamente in un tubo sterile da 15 mL.
- Raccogliere le sospensioni e le cellule aderenti dai gruppi CIK-OC-3 dal punto 7.2.2.
- Trasferire la sospensione cellulare in un tubo sterile da 15 mL. Lavare il pozzo con 1 mL di PBS sterile, raccogliere il PBS e aggiungere al tubo. Aggiungere 0,5 mL di soluzione enzimatica di dissociazione cellulare e incubare per 5 min a 37 gradi centigradi.
- Aggiungere 1 mL della soluzione dallo stesso tubo al pozzo corrispondente e mescolare delicatamente le cellule perforandole su e giù almeno 3x con una pipetta sterile da 1 mL. Raccogliere tutte le cellule nello stesso tubo.
- Centrifuga a 300 x g per 10 min, aspirare il supernatante, e risospendere le cellule in 1 mL di PBS sterile. Pellere le cellule a 300 x g per 10 min, aspirare il supernatante, e rimettere in sospensione le cellule in 100 .
- Aggiungete alla sospensione cellulare 5-L l di 7-AAD (50 ng/-L stock). Mescolare delicatamente le cellule pipetting su e giù almeno 3x con una pipetta sterile da 1 mL. Incubare per 10 min e lasciare al buio prima dell'analisi.
- Saggio di capacità citolitica
- Mescolare la sospensione della cella dai passaggi 7.3.4 e ripetere i passaggi 5.1 e 5.2 una volta.
- Fare clic sul pulsante Nuovo esemplare per aggiungere un campione e un tubo all'esperimento e assegnare un nome ai tubi come segue: Solo le celle Tube 1, K562 (o OC-3); Tubo 2, solo cellule K562 (o OC-3) macchiate di CFSE; Tubo 3, E:T - 5:1; Tubo 4, E:T - 10:1.
- Creare un sistema di dispersione per l'esempio citolytico (Figura 3A).
- Selezionare Tubo 1 e fare clic sul pulsante Grafico punti per creare un grafico FSC-A/SSC-A. Disegnare un cancello rettangolare su tutti gli eventi con una soglia FSC-A >5 x 104 per escludere i detriti delle celle.
- Selezionare il parametro SSC-A/CFSE per il nuovo grafico a punti. Selezionare il parametro 7-AAD/CFSE per il nuovo grafico a punti e disegnare un gate a quattro quadranti per definire le quattro sottopopolazioni.
- Fare clic sul pulsante Carica campione per analizzare prima l'esempio di controllo vuoto.
- Regolare la tensione di SSC-A e FSC-A. Identificare la popolazione di cellule morte utilizzando i parametri CFSE e 7-AAD del canale. Registrare i dati da >20.000 CFSE: cellule in ogni campione.
- Ripetere la sezione 7.4.6 per l'indagine di tutti i campioni.
- Aprire i file contenenti i valori statistici di ogni singolo campione per analizzare le popolazioni di cellule non vitali ed esportare i dati in file di analisi.
Risultati
Lo scopo del presente protocollo è quello di isolare ed espandere le cellule T killer indotte da citochine (CIK) dai monociti del sangue periferici e valutare l'effetto citotossico del CIK contro la malignità ematologica e le cellule tumorali solide, rispettivamente. L'induzione del CIK è stata identificata dal riconoscimento CD3/CD56. Figura 1A mostra il protocollo per l'induzione e l'espansione CIK. I risultati rappresentativi della strategia di gating per l'analisi della sottopopolazione di CD3-CD56- cellule T di donatori sani sono illustrati nella Figura 1B. La figura 1C mostra l'analisi statistica della proporzione CIK da tre individui.
Figura 2A mostra che il CD3-CD56- proporzione cellulare (0,65% per il PBMC originale, pannello inferiore sinistro e 27,4% per le cellule CIK raccolte il giorno 14th, pannello inferiore destro) è aumentato in modo significativo dopo 14 giorni di espansione. Nel nostro sistema di coltura, le cellule CIK hanno prodotto circa le modifiche di circa cento volte rispetto al numero originale di PBMC (Figura 2B).
Figura 3 mostra l'effetto citotossico del CIK contro leucemia mieloide cronica umana K562 cellule e cancro ovarico umano OC-3 cellule. Le cellule K562 o OC-3 (bersaglio, T) sono state macchiate con un colorante non fluorescente (CFSE), che è stato fessurato dagli intracellulari all'interno di cellule vitali e poi è diventato un colorante altamente fluorescente. Nello studio sulla cocultura citotototossica, le cellule K562 o OC-3 macchiate di CFSE sono state cotrattate con cellule CIK per 24 h. Alla fine dell'incubazione, le cellule totali sono state raccolte e macchiate con tintura a 7 AAD, che è un colorante nucleico che si lega all'acido che viene utilizzato come sonda di fattibilità per l'esclusione delle cellule morte. Le dimensioni e la granularità dellecelle CIK e CFSE sono illustrate nella Figura 3A. Le cellule K562 colorate CFSE (cellule bersaglio, T) sono state trattate insieme a cellule CIK (cellule efvigoreri, E) con un rapporto rispettivamente di E/T, 5:1 e 10:1. Sono state valutate tutte le celle 7-AADdi CFSEe K562. I risultati statistici sono stati ottenuti da tre esperimenti indipendenti. La lisi basale significa la percentuale di morte cellulare in assenza di cellule efvigoreri (E:T - 0:1). La figura 3B mostra l'evidente citotossicità del CIK nei confronti delle cellule OC-3 (E:T - 10:1) dopo 24 h di incubazione.
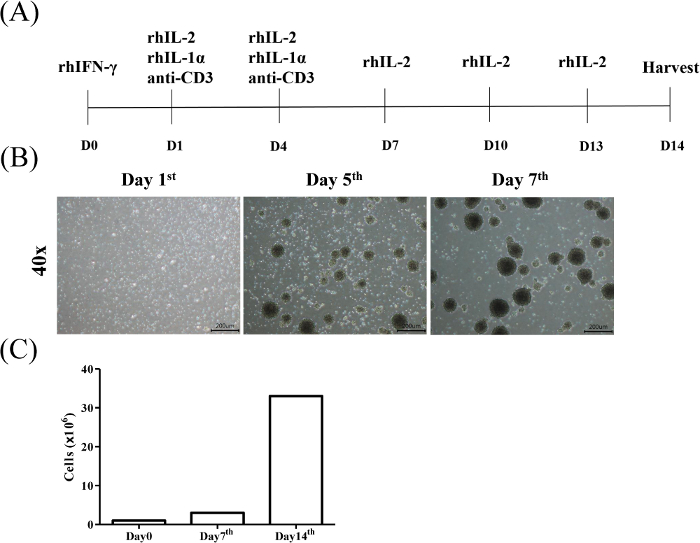
Figura 1: Diagramma di flusso dell'induzione e dell'espansione delle cellule assassine indotte da citochine. (A) I PBMC provenienti da donatori sani acconsentiti sono stati inizialmente esposti a rhIFN-z (giorno 0), seguito da rhIL-2, rhIL-1 e anti-CD3 mAb (giorno 1) ogni 3 giorni (giorno 4). Successivamente, il mezzo è stato aggiornato con un supporto contenente rhIL-2 ogni 3 giorni e le cellule sono state raccolte il giorno 14. (B) Morfologia delle cellule CIK durante 7 giorni di induzione. L'attivazione e l'espansione delle cellule CIK sono state condotte come descritto nel protocollo. Le cellule sono state osservate al microscopio della luce rispettivamente nei giorni 1, 5 e 7 (ingrandimento : 40x, barra di scala - 200 m). (C) I conteggi delle celle sono stati eseguiti settimanalmente. Fare clic qui per visualizzare una versione più grande di questa figura.
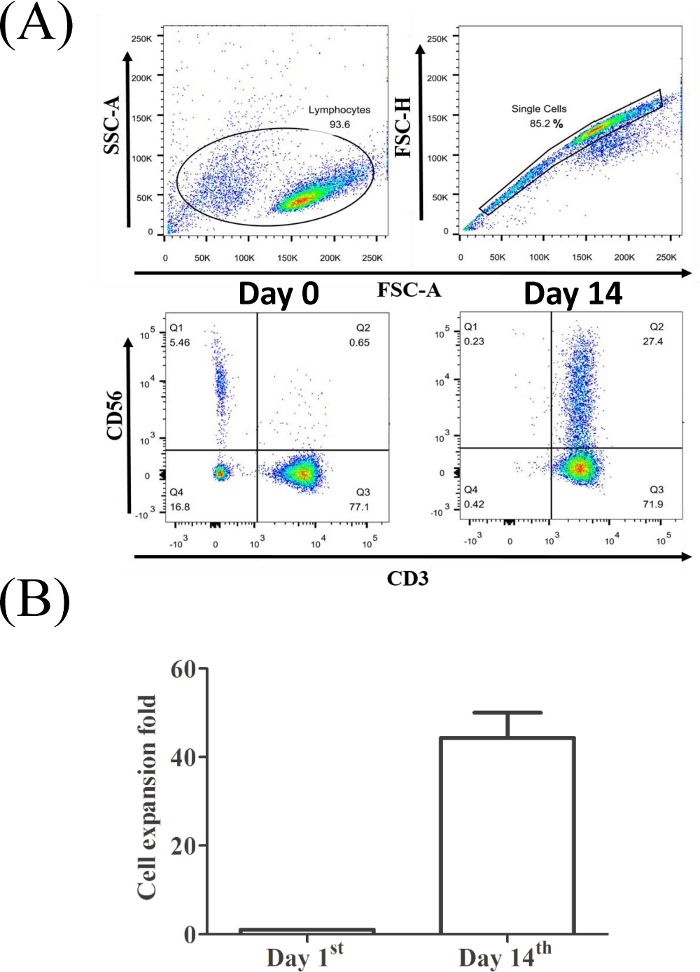
Figura 2: La percentuale di celle CD3-CD56- T da un campione DI PBMC rappresentativo. (A) I linfociti sono stati riconosciuti da dimensioni e granularità specifiche. Popolazione a cella singola selezionata per l'analisi per citometria di flusso. (B) L'analisi statistica dell'efficacia dell'espansione del CIK da parte di tre donatori sani è stata condotta mediante un test t (sezione p < 0,01). Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 3: Effetti citotossici delle cellule CIK contro la leucemia mieloide cronica umana K562 e cellule OC-3 con cancro ovarico umano. (A) A seguito della cocultura con le cellule CIK per 24 ore, le cellule bersaglio K562 sono state riconosciute e recintate in base alla colorazione del CFSE. Quadrante illustrazione della popolazione totale di cellule sotto il parametro 7-AAD/CFSE selezionato e la citotossicità cumulativa delle cellule CIK al rapporto E:T indicato. (B) L'effetto citotossico delle cellule CIK contro le cellule OC-3 con un rapporto E:T - 10:1. Fare clic qui per visualizzare una versione più grande di questa figura.
Discussione
Il metodo descritto è un protocollo veloce, conveniente e affidabile per l'isolamento e l'espansione di cellule T killer citotototossiche indotte da citotozi (CIK) da campioni di t di donatori sani. Mostra anche l'effetto citotossico del CIK contro la leucemia (K562) e le cellule tumorali ovariche (OC-3) utilizzando un sistema di localizzazione e tracciamento della citometria a flusso (CS & T). Le cellule CIK possono essere indotte ed espanse in buone pratiche manufactoryli (GMP) utilizzando citochine di grado GMP e mezzi senza siero per ulteriori infusioni cliniche11. Tuttavia, l'efficacia dell'induzione e dell'espansione del CIK presenta differenze individuali12,13,14. Inoltre, la sicurezza è il vantaggio dell'infusione di cellule CIK derivate dal paziente per la terapia cellulare del cancro. È stato riferito che le cellule CIK esercitano effetti citolitici sulle cellule del cancro solido epiteliale per lo più in modo dipendente da NKG2D. Nelle cellule del cancro ematologico, il blocco di NKG2D con un anticorpo specifico inibisce significativamente la citotossicità indotta da CIK contro le cellule K562 NKG2D-low; tuttavia, questo trattamento non ha alcun effetto sulle cellule HL-60 prive di NKG2D15. Inoltre, le cellule CIK mostrano una minore attività di uccisione delle cellule contro le cellule K562 rispetto alle cellule CD8- CIK16. In questo studio, abbiamo scoperto che il CIK ha mostrato un maggiore potenziale citotossico contro le cellule OC-3 del cancro ovarico rispetto alle cellule leucemia K562. Questi dati suggeriscono che gli esatti meccanismi molecolari attraverso i quali gli effetti CIK uccidono le cellule tumorali non sono ancora chiari.
Il monitoraggio della vitalità delle cellule bersaglio e la valutazione del potenziale citotossico delle cellule effettrici utilizzando la citometria di flusso è diventato un metodo standard e convenzionale per l'esame clinico17. È stato suggerito che si osserva un effetto negativo sulla vitalità cellulare e sull'espressione dei marcatori di attivazione, come il CD3- popolazione in linfociti macchiati di CFSE con citometria di flusso18,19. Pertanto, colorare le cellule tumorali bersaglio è una strategia più efficace per valutare gli effetti citotossici delle cellule primarie ciK. IfN- , OKT3 e IL-2 sono citochine principali o stimolatori per la differenziazione e la proliferazione del CIK. Inoltre, anche altri fattori come la timoglobulina, IL-1, IL-10, IL-15, sono stimolatori. Attualmente, siero umano, plasma ricco di piastrine umane, e anche siero bovino fetale sono utilizzati come integratori medi che possono migliorare la proliferazione delle cellule CIK. Anche se il siero o il plasma sono arricchiti da nutrienti e fattori di crescita, l'aggiunta di prodotti animali allogenici presenta variazioni di origine, lotto e lotto che si traducono in variabilità sperimentale e inevitabilmente sconcertanti studi con esiti terapeutici per le cellule coltivate. In questo studio, abbiamo usato un supporto di qualità GMP senza siero disponibile in commercio, senza albumina e senza xeno, integrato con citochine di grado clinico per colture con successo le cellule CIK. Lo svantaggio dell'utilizzo di integratori xeno-free o allogenici-free è che riducono l'efficacia della proliferazione cellulare.
I metodi di tracciamento delle cellule a due colori forniti nei protocolli calcolati in modo indipendente cellule bersaglio vitale o morto in un saggio diretto citotossicità. Nelle nostre strategie di gating, CFSE- cellule bersaglio possono ovviamente essere distinte dalle cellule eftraenti CIK (Figura 3). Ancora più importante, il processo di induzione e di espansione del CIK deve essere qualificato e mostrare un'elevata redditività. Per ulteriori infusioni a dosaggio multiplo, la condizione di crioconservazione, e la vitalità e la citotossicità dopo lo scongelamento, sono altre sfide critiche. Il rapporto effettivo di un'ilsi specifica è uguale alla proporzione di 100 x (%Sample lysis - %Basal lysis)/(100 - %Basal lysis). A differenza di altri studi18,20, si raccomanda di tutte le cellule bersaglio essere studiati per rivelare la citotossicità esatta ed effettiva delle cellule CIK.
In conclusione, il protocollo descritto in questo studio è progettato per aumentare il numero di cellule CIK derivate da PBMC da donatori sani e per valutare le loro funzioni citotossiche contro le cellule tumorali con sonde fotoattive a due colori per il monitoraggio selettivo cellule bersaglio da una citometria di flusso con un sistema diagnostico in vitro (IVD).
Divulgazioni
Gli autori dichiarano che non esistono conflitti di interesse finanziario concorrenti.
Riconoscimenti
Questo studio è stato supportato dal China Medical University Hospital (DMR-Cell-1809).
Materiali
| Name | Company | Catalog Number | Comments |
| 7-Amino Actinomycin D | BD | 559925 | |
| APC Mouse Anti-Human CD56 antibody | BD | 555518 | B159 |
| APC Mouse IgG1, κ Isotype Control | BD | 555751 | MOPC-21 |
| BD FACSCanto II Flow Cytometer | BD | 338962 | |
| Carboxyfluorescein diacetate succinimidyl ester (CFSE) | BD | 565082 | |
| D-(+)-Glucose solution | SIGMA | G8644 | |
| Dulbecco's Modified Eagle Medium/F12 | HyClone | SH30023.02 | |
| Fetal bovine serum | HyClone | SH30084.03 | |
| Ficoll-Paque Plus | GE Healthcare Life Sciences | 71101700-EK | |
| FITC Mouse Anti-Human CD3 antibody | BD | 555332 | UCHT1 |
| FITC Mouse IgG1, κ Isotype Control | BD | 555748 | MOPC-21 |
| Human anti-CD3 mAb | TaKaRa | T210 | OKT3 |
| Penicillin-Streptomycin | Gibco | 15140122 | |
| Proleukin | NOVARTIS | ||
| Recombinant Human Interferon-gamma | CellGenix | 1425-050 | |
| Recombinant Human Interleukin-1 alpha | PEPROTECH | 200-01A | |
| RPMI1640 medium | Gibco | 11875-085 | |
| Sigma 3-18K Centrifuge | Sigma | 10295 | |
| TrypLE Express Enzyme | Gibco | 12605028 | |
| X-VIVO 15 medium | Lonza | 04-418Q |
Riferimenti
- Cappuzzello, E., et al. Cytokines for the induction of antitumor effectors: The paradigm of Cytokine-Induced Killer (CIK) cells. Cytokine & Growth Factor Reviews. 36, 99-105 (2017).
- Schmidt-Wolf, R. S., et al. Propagation of large numbers of T cells with natural killer cell markers. British Journal of Haematology. 87 (3), 453-458 (1994).
- Grainger, S., et al. Wnt Signaling in Hematological Malignancies. Progress in Molecular Biology and Translational Science. 153, 321-341 (2018).
- Dai, C., et al. Implication of combined PD-L1/PD-1 blockade with cytokine-induced killer cells as a synergistic immunotherapy for gastrointestinal cancer. Oncotarget. 7 (9), 10332-10344 (2016).
- Schmidt-Wolf, I. G., et al. Use of a SCID mouse/human lymphoma model to evaluate cytokine-induced killer cells with potent antitumor cell activity. TheJournal of Experimental Medicine. 174 (1), 139-149 (1991).
- Introna, M., et al. Rapid and massive expansion of cord blood-derived cytokine-induced killer cells: an innovative proposal for the treatment of leukemia relapse after cord blood transplantation. Bone Marrow Transplantation. 38 (9), 621-627 (2006).
- Schmeel, L. C., et al. Cytokine-induced killer (CIK) cells in cancer immunotherapy: report of the international registry on CIK cells (IRCC). Journal of Cancer Research and Clinical Oncology. 141 (5), 839-849 (2015).
- Rutella, S., et al. Adoptive immunotherapy with cytokine-induced killer cells generated with a new good manufacturing practice-grade protocol. Cytotherapy. 14 (7), 841-850 (2012).
- Nausch, N., et al. NKG2D ligands in tumor immunity. Oncogene. 27 (45), 5944-5958 (2008).
- Gammaitoni, L., et al. Effective activity of cytokine-induced killer cells against autologous metastatic melanoma including cells with stemness features. Clinical Cancer Research. 19 (16), 4347-4358 (2013).
- Rettinger, E., et al. The cytotoxic potential of interleukin-15-stimulated cytokine-induced killer cells against leukemia cells. Cytotherapy. 14 (1), 91-103 (2012).
- Narayan, R., et al. Donor-derived cytokine-induced killer cell infusion as consolidation after nonmyeloablative allogeneic transplantation for myeloid neoplasms. Biology of Blood and Marrow Transplantation. 19, 1083 (2019).
- Castiglia, S., et al. Cytokines induced killer cells produced in good manufacturing practices conditions: identification of the most advantageous and safest expansion method in terms of viability, cellular growth and identity. Journal of Translational Medicine. 16 (1), 237 (2018).
- Bonanno, G., et al. Thymoglobulin, interferon-γ and interleukin-2 efficiently expand cytokine-induced killer (CIK) cells in clinical-grade cultures. Journal of Translational Medicine. 8, 129 (2010).
- Iudicone, P., et al. Interleukin-15 enhances cytokine induced killer (CIK) cytotoxic potential against epithelial cancer cell lines via an innate pathway. Human Immunology. 77 (12), 1239-1247 (2016).
- Liu, J., et al. Phenotypic characterization and anticancer capacity of CD8+ cytokine-induced killer cells after antigen-induced expansion. PLoS One. 12 (4), 0175704 (2017).
- Chen, D., et al. Cytokine-induced killer cells as a feasible adoptive immunotherapy for the treatment of lung cancer. Cell Death & Disease. 9 (3), 366 (2018).
- Tario, J. D. Monitoring cell proliferation by dye dilution: considerations for probe selection. Methods in Molecular Biology. 1678, 249-299 (2018).
- Last'ovicka, J., et al. Assessment of lymphocyte proliferation: CFSE kills dividing cells and modulates expression of activation markers. Cellular Immunology. 256 (1-2), 79-85 (2009).
- Yoshida, T., et al. Characterization of natural killer cells in tamarins: a technical basis for studies of innate immunity. Frontiers in Microbiology. 1, 1-9 (2010).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon