Method Article
Isolement et expansion des cellules T tueuses cytotoxiques induites par Cytokine pour le traitement du cancer
Dans cet article
Résumé
Ici, nous présentons un protocole pour exécuter l'isolement et l'expansion des cellules mononucléaires périphériques mononucléaires CD3-CD56- cellules tueuses et pour illustrer leur effet de cytotoxicité contre les cellules cancéreuses hématologiques et solides en utilisant un système de cytométrie de flux de diagnostic in vitro.
Résumé
L'immunothérapie cellulaire adoptive se concentre sur la restauration de la reconnaissance du cancer par l'intermédiaire du système immunitaire et améliore l'abattage efficace des cellules tumorales. La thérapie de cellules T induite par Cytokine (CIK) a été rapportée pour exercer des effets cytotoxiques significatifs contre des cellules cancéreuses et pour réduire les effets défavorables de la chirurgie, de la radiothérapie, et de la chimiothérapie dans des traitements de cancer. CiK peut être dérivé des cellules mononucléaires périphériques de sang (PBMCs), de la moelle, et du sang de cordon ombilical. Les cellules CIK sont une sous-population hétérogène de lymphocytes T avec cD3-CD56- et les caractéristiques phénotypiques du tueur naturel (NK) qui incluent le complexe d'histocompatibilité majeur (MHC) -activité antitumorale sans restriction. Cette étude décrit une méthode qualifiée, cliniquement applicable, basée sur la cytométrie de flux pour la quantification de la capacité cytolytique des cellules CIK dérivées de PBMC contre les cellules cancéreuses hématologiques et solides. Dans l'assay cytolytique, les cellules CIK sont co-incubées à différents rapports avec les cellules tumorales cibles présatyables. Après la période d'incubation, le nombre de cellules cibles est déterminé par une tache liant l'acide nucléique pour détecter les cellules mortes. Cette méthode s'applique à la fois aux applications de recherche et de diagnostic. Les cellules ciK possèdent la cytotoxicité puissante qui pourrait être explorée comme stratégie alternative pour le traitement de cancer sur son évaluation préclinique par une configuration et suivi de cytomètre (CS et T)-basé système de cytométrie de flux.
Introduction
Les lymphocytes T cytotoxiques sont une population spécifique de cellules d'effetmor immunitaire qui médiatise les réponses immunitaires contre le cancer. Plusieurs populations de cellules effectrices, y compris les cellules tueuses activées par la lymphokine (LAK), les lymphocytes infiltrants par tumeur (TL), les cellules tueuses naturelles (NK), les lymphocytes T et les cellules tueuses induites par la cytokine (CIK) ont été développées à des fins de thérapie cellulaire T (ACT)adoptive1. Il y a un intérêt croissant pour les cellules CIK, parce qu'elles représentent un mélange des populations cytotoxiques cytotoxiques cytokine-induites s'est développée des cellules mononucléaires périphériques autologues de sang (PMBCs)2.
La croissance incontrôlée des cellules progénitrices lymphoïdes, des myéloblastes et des lymphoblastes mène à trois principaux types de cancers du sang (c.-à-d. leucémie, lymphome et myélome), tumeurs solides, y compris les carcinomes (p. ex. cancer du poumon, cancer gastrique, cancer du col de l'utérus) et sarcomes, entre autres cancers3. Les cellules CIK sont un mélange de populations cellulaires qui présentent un large éventail de complexe d'histocompatibilité majeure (MHC) - activité antitumorale sans restriction et sont donc prometteuses pour le traitement des tumeurs hématologiques et avancées4,5,6,7. Les cellules CIK comprennent une combinaison de cellules, y compris les lymphocytes T, y compris les lymphocytes T(CD3etCD56), les cellules NK-T (CD3etCD56) et les cellules NK (CD3etCD56). L'optimisation du protocole d'induction CIK par l'utilisation d'un calendrier fixe pour l'ajout d'anticorps IFN, anti-CD3 et IL-2, entraîne l'expansion des cellules CIK8. La capacité cytotoxique des cellules de CIK contre des cellules cancéreuses dépend principalement de l'engagement du membre d'un groupe de NK 2 D (un membre de la famille de récepteurs de type C de lectine)NKG2D sur des cellules de tumeur, et sur des voies perforin-négociées9. Les résultats d'une étude préclinique ont indiqué que les cellules CIK IL-15-stimulées ont induit la cytotoxicité puissante contre les lignes primaires et aigues de cellules de leucémie myéloïde in vitro et ont montré une alloreactivity inférieure contre pbMCs normal et fibroblastes9. Récemment, les résultats de l'infusion de CIK untemps sain de donneur-dérivé (1 x 108/kg CD3- cellules) comme consolidation suivant la transplantation allogeneic nonmyeloablative pour le traitement myéloïde de néoplasmes dans une étude clinique de phase II a été édité10.
Dans la présente étude, nous avons développé une formule optimisée de culture cellulaire composée d'IFN-, d'IL-1, d'anticorps anti-CD3 et d'IL-2 ajoutés au milieu hématopoïétique de cellules pour augmenter la production de CIK, et avons étudié l'effet cytotoxique des cellules de CIK contre le milieu chronique humain cellules de leucémie myéloïde (K562) et cellules de cancer de l'ovaire (OC-3).
Protocole
Le protocole clinique a été exécuté et approuvé conformément aux lignes directrices du Comité d'examen institutionnel de l'Université médicale de Chine et du Comité d'éthique de la recherche hospitalière. Des échantillons de sang périphériques ont été prélevés auprès de volontaires en bonne santé avec leur consentement éclairé.
1. Préparation des matériaux
- Stockez les réactifs, les anticorps et les produits chimiques comme le montre la fiche de données sur la sécurité des matériaux (SDM). Dissoudre les médicaments ou les cytokines dans les solvants comme solutions de stock, puis aliquot pour le stockage à -20 oC ou -80 oC.
REMARQUE : Des renseignements détaillés pour la préparation des matériaux sont indiqués dans le Tableau des matériaux.
2. Isolement PBMC
- Réchauffer la solution de gradient de densité (Tableau des Matériaux) à 18'20 oC avant utilisation. Inverser la bouteille de solution plusieurs fois pour assurer un mélange complet.
- Recueillir 3 à 5 ml d'échantillon de sang veineux humain dans un flacon héparinisé et bien mélanger en inversant doucement le tube plusieurs fois.
- Préparer 4 ml de solution de gradient de densité dans un tube stérile de 15 ml.
- Couchez soigneusement 1 ml de l'échantillon de sang sur la solution de gradient de densité.
- Centrifugeuse à 400 x g pendant 30 min à 18'20 'C (éteindre la rupture).
- Aspirez soigneusement et immédiatement la couche de couches bouffies de cellules mononucléaires (environ 1 ml) à la fois pour éviter de déranger les couches à un tube stérile de 15 ml à l'aide d'une pipette stérile de 1 ml.
- Ajouter au moins 3 volumes (3 ml) de saline tamponnée par phosphate (PBS) à la couche chauffie du tube de centrifugeuse. Suspendre les cellules en les pipetilage doucement de haut en bas au moins 3x avec une pipette stérile.
- Centrifugeuse à 400 x g pendant 10 min à 18'20 'C. Aspirez le supernatant.
- Suspendre le granule cellulaire avec 5 ml de milieu basal (Tableau des matériaux) et transférer dans un flacon. Culture des cellules dans un incubateur de culture cellulaire à 37 oC et 5% CO2.
3. Induction et expansion CIK
- Le jour 0, culture les PBMC (1 x 106) dans le milieu basal frais contenant 1.000 UI/mL d'IFN-pour 24 h dans un incubateur de culture cellulaire humidifié e à 37 oC et 5% CO2.
- Le jour 1, rafraîchissez le milieu avec un milieu basal frais contenant 50 ng/mL d'anticorps anti-CD3, 1 ng/mL de rh IL-1, et 1 000 U/mL de rh IL-2. Rafraîchir le milieu tous les 3 jours.
- Le jour 7, rafraîchir le milieu avec un milieu basal frais contenant 1 000 U/mL de rh IL-2. Rafraîchir le milieu tous les 3 jours jusqu'à la fin de l'expansion cellulaire (Jour 14).
4. Immunophénotypage pour l'évaluation des cellules CIK
- Laver les cellules CIK avec 10 ml de PBS stérile. Centrifugeuse pendant 10 min à 300 x g et 18 à 20 oC, aspirez le supernatant, et resuspend les cellules avec 10 ml de PBS. Comptez le nombre de cellules et testez la viabilité des cellules à l'aide de l'essai d'exclusion bleu trypan.
- Aliquot les cellules CIK en six tubes stériles de 1,5 ml à une densité de 5 à 10 x 105 cellules/mL PBS. Étiqueter et traiter comme suit: Tube 1, Blank (pas d'anticorps); Tube 2, ajouter 20 l d'isotype IgG1-FITC; Tube 3, ajouter 20 l d'isotype IgG1-APC mAbs; Tube 4, ajouter 20 l de CD3-FITC; Tube 5, ajouter 20 l de MAbs CD56-APC; et Tube 6, ajouter 20 oL de CD3-FITC et 20 'L de MAbs CD56-APC.
- Mélanger délicatement les cellules CIK avec les anticorps en les faisant doucement monter et descendre au moins 3 fois avec une pipette stérile de 1 ml, puis incuber pendant 30 min à température ambiante dans l'obscurité.
- Centrifuger les tubes pendant 10 min à 300 x g et 18 à 20 oC. Aspirer le supernatant et suspendre le granule cellulaire une fois avec 1 ml de PBS. Les épileper doucement d'au moins 3x avec une pipette stérile de 1 ml.
- Répétez l'étape 4.4.
- Laissez les tubes dans l'obscurité avant l'analyse cytométrique du débit.
5. Reconnaissance de marqueur de CD
- Transférer la suspension cellulaire dans un tube stérile en polystyrène de 5 ml à fond rond avec un bouchon de passoire cellulaire (100 m de maille) en passant doucement le tuyautisme à travers le bouchon. Mettez les tubes sur le carrousel dans l'ordre.
- Ouvrez le logiciel d'analyse de cytométrie de flux et créez un dossier expérimental. Cliquez sur le bouton New Specimen pour ajouter un spécimen et un tube à l'expérience et nommer les tubes comme suit: Tube 1, Blank; Tube 2, Isotype IgG1-CD3; Tube 3, Isotype IgG1-CD56; Tube 4, CD3; Tube 5, CD56; Tube 6, CD3CD56.
- Créer un système de filtilation par dispersion pour les populations cellulaires ciK (figure 2A).
- Sélectionnez Tube 1 (Blank) et cliquez sur le bouton Dot Plot pour créer une parcelle FSC-A/SSC-A. Dessinez une porte de rectangle au-dessus de la population entière de cellules avec un seuil de FSC-A 'gt.5 x 104 pour exclure des débris de cellules.
- Sélectionnez le paramètre SSC-A/SSC-H pour la nouvelle parcelle de point et dessinez une porte en polygone autour de toutes les cellules individuelles. Sélectionnez respectivement le paramètre Count/FITC (CD3) et Count/APC (CD56) pour la nouvelle parcelle histogramme. Sélectionnez le paramètre FITC (CD3)/APC (CD56) pour la nouvelle parcelle de point et dessinez une porte à quatre quadrants pour définir les quatre sous-populations.
- Enregistrez les données de 20 000 cellules individuelles dans chaque spécimen. Cliquez d'abord sur le bouton Échantillon de charge pour analyser l'échantillon de contrôle vierge. Identifiez l'ensemble de la population de cellules CIK en utilisant les paramètres du canal CD56 et CD3.
- Répétez l'étape 5.3 pour l'enquête sur tous les spécimens.
- Ouvrez les fichiers contenant les valeurs statistiques de chaque spécimen pour analyser les populations cellulaires de CIK et réimprimer en fichiers d'analyse.
6. Cultiver et tacher les cellules humaines chroniques de leucémie myéloïde K562 et les cellules OC-3 du cancer de l'ovaire
- Cellules K562
- Culture Cellules K562 dans un milieu complet (rpMI milieu basal contenant 10% de sérum bovin fœtal [FBS] et 50 antibiotiques U/mL et ajuster le glucose à 4,5 g/L) à une densité de 0,5 x 1 x 106 cellules/mL dans un flacon de culture cellulaire et incuber dans un incubateur humidifié à 37 oC et 5% CO2.
- Transférer le support de culture contenant les cellules K562 dans des tubes stériles de 50 ml et granuler les cellules à 300 x g pendant 10 min à 18-20 oC le jour de l'expérience.
- Aspirer le supernatant, resuspendre les cellules en 5 ml de PBS stérile, et bien mélanger doucement.
- Pelleter les cellules à 300 x g pendant 10 min. Aspirez le supernatant, suspendez les cellules dans PBS, et ajustez les cellules K562 à une concentration de 0,5-1 x 106 cellules/mL.
- Ajouter 0,5 l de colorant CFSE à la suspension de 1 ml de cellules K562 dans un tube stérile de 15 ml à une concentration finale de 5 M. Mélanger délicatement la suspension en faisant monter et descendre au moins 3 fois.
- Laisser le tube dans un incubateur de culture cellulaire à 37 oC et 5 % de CO2 pendant 10 à 15 min.
- Ajouter 9 ml de PBS au tube et granuler les cellules à 300 x g pendant 10 min. Décant le supernatant, puis suspendre le granule cellulaire dans 10 ml de support complet. Transférer la suspension cellulaire dans un flacon de culture cellulaire et placer dans l'incubateur.
- Cellules OC-3
- Culture CELLULES OC-3 dans des milieux complets (dMEM/F12 milieu contenant 10% FBS et 50 U/mL antibiotiques) à une densité de 0,5 x 1 x 106 cellules dans une flacon de culture cellulaire à 37 oC et 5% CO2.
- Aspirez le média culturel et lavez les cellules avec PBS 1 jour avant l'expérience.
- Détachez les cellules en ajoutant 1 ml de solution enzymatique de dissociation cellulaire(Tableau des matériaux)et incubez pendant 5 min à 37 oC.
- Suspendre les cellules en ajoutant 5 ml de PBS et bien mélanger doucement. Pelleter les cellules à 300 x g pendant 10 min et aspirer le supernatant. Resuspendre les cellules dans PBS et ajuster les cellules à une concentration de 0,5 x 1x 106 cellules/mL.
- Ajouter 0,5 l de colorant CFSE à 1 ml de la suspension de la cellule OC-3 dans un tube stérile de 15 ml à une concentration finale de 5 M. Mélanger délicatement la suspension en faisant monter et descendre au moins 3 fois.
- Laisser le tube dans un incubateur de culture cellulaire à 37 oC et 5 % de CO2 pendant 10 à 15 min.
- Ajouter 9 ml de PBS au tube et granuler les cellules à 300 x g pendant 10 min. Décant le supernatant, puis suspendre le granule cellulaire avec un support complet. Seed 5 x 105 cellules/bien dans une plaque de 6 puits et incuber dans un incubateur humidifié à 37 oC et 5 % de CO2 pendant la nuit.
7. L'assay cytotoxique
- Coculture des cellules CIK et K562 (CIK-K562)
- Comptez les cellules K562 de l'étape 6.1.7 et testez la viabilité de la cellule par essai d'exclusion bleue trypan. Ajouter 1 ml de cellules K562 à chaque puits dans une plaque de 6 puits à une densité de 5 x 105/mL.
- Ajouter 1 ml de milieu basal avec ou sans cellules CIK de l'étape 3.4 à la plaque de 6 puits à partir de l'étape 7.1.1 comme suit: Eh bien 1 - Blank, K562 cellules seules (5 x 105); Eh bien 2 cellules K562 tachées de CFSE seules (5 x 105); Eh bien 3 cellules CIK (E [effector], 25 x 105) - CFSE-stained K562 cells (T [cible], 5 x 105); Eh bien 4 cellules CIK (E, 50 x 105) - CFSE-souillé souillé cellules K562 (T, 5 x 105).
- Mélanger les suspensions cellulaires en les pipetilage doucement de haut en bas au moins 3x. Placer l'assiette dans l'incubateur pendant 24 h.
- Coculture des cellules CIK et OC-3 (CIK-OC-3)
- Ajouter 1 ml de milieu basal avec ou sans cellules CIK de l'étape 3.4 à la plaque de 6 puits à partir de l'étape 6.2.7 comme suit: Eh bien 1 - Blank, OC-3 cellules seules (5 x 105); Eh bien 2 cellules D'OC-3 tachées de CFSE seules (5 x 105); Eh bien 3 cellules CIK (E, 25 x 105) - CFSE-stained OC-3 cellules (T, 5 x 105); Eh bien 4 cellules CIK (E, 50 x 105) - CFSE-stained OC-3 cellules (T, 5 x 105).
- Mélanger les suspensions cellulaires en les pipetilage doucement de haut en bas au moins 3x. Mettre l'assiette dans l'incubateur pendant 24 h.
- 7-Aminoactinomycine D (7-AAD) teinture tainingtaining
- Récoltez la suspension de la cellule CIK-K562 de l'étape 7.1.3 directement dans un tube stérile de 15 ml.
- Récoltez les cellules de suspension et les cellules adhérentes des groupes CIK-OC-3 à partir de l'étape 7.2.2.
- Transférer la suspension cellulaire dans un tube stérile de 15 ml. Laver le puits avec 1 ml de PBS stérile, recueillir le PBS, et ajouter au tube. Ajouter 0,5 ml de solution enzymatique de dissociation cellulaire et incuber pendant 5 min à 37 oC.
- Ajouter 1 ml de la solution du même tube au puits correspondant et mélanger délicatement les cellules en les pipetilant vers le haut et vers le bas au moins 3x avec une pipette stérile de 1 ml. Recueillir toutes les cellules dans le même tube.
- Centrifugeuse à 300 x g pendant 10 min, aspirez le supernatant, et resuspend les cellules dans 1 ml de PBS stérile. Pelleter les cellules à 300 x g pendant 10 min, aspirer le supernatant, et resuspendre les cellules dans 100 L de PBS stérile.
- Ajouter 5 ll de colorant 7-AAD (50 ng/L de bouillon) à la suspension cellulaire. Mélanger délicatement les cellules en les faisant monter et descendre au moins 3 fois avec une pipette stérile de 1 ml. Incuber pendant 10 min et laisser dans l'obscurité avant l'analyse.
- Analyse des capacités cytolytiques
- Mélanger la suspension cellulaire de l'étape 7.3.4 et répéter les étapes 5.1 et 5.2 une fois.
- Cliquez sur le bouton New Specimen pour ajouter un spécimen et un tube à l'expérience et nommer les tubes comme suit: Tube 1, K562 (ou OC-3) cellules seulement; Tube 2, cellules K562 (ou OC-3) tachées de CFSE seulement; Tube 3, E:T 5:1; Tube 4, E:T 10:1.
- Créer un système de diffusion pour l'astro-lytique (Figure 3A).
- Sélectionnez Tube 1 et cliquez sur le bouton Dot Plot pour créer une parcelle FSC-A/SSC-A. Dessinez une porte de rectangle sur tous les événements avec un seuil FSC-A 'gt'5 x 104 pour exclure les débris cellulaires.
- Sélectionnez le paramètre SSC-A/CFSE pour la nouvelle parcelle de point. Sélectionnez le paramètre 7-AAD/CFSE pour la nouvelle parcelle de point et dessinez une porte à quatre quadrants pour définir les quatre sous-populations.
- Cliquez d'abord sur le bouton Échantillon de charge pour analyser l'échantillon de contrôle vierge.
- Ajuster la tension de SSC-A et FSC-A. Identifiez la population de cellules mortes en utilisant les paramètres du canal CFSE et 7-AAD. Enregistrez les données descellules CFSE de 20 000 cfSE dans chaque spécimen.
- Répétez la section 7.4.6 pour l'enquête sur tous les spécimens.
- Ouvrez les fichiers contenant les valeurs statistiques de chaque spécimen pour analyser les populations cellulaires non viables et exporter les données dans des fichiers d'analyse.
Résultats
Le but du protocole actuel est d'isoler et d'étendre les cellules T de tueur induite par la cytokine (CIK) des monocytes périphériques de sang et d'évaluer l'effet cytotoxique de CIK contre la malignité hématologique et les cellules cancéreuses pleines, respectivement. L'induction de CIK a été identifiée par la reconnaissance CD3/CD56. La figure 1A montre le protocole d'induction et d'expansion du CIK. Les résultats représentatifs de la stratégie de gating pour l'analyse de la sous-population de CD3etCD56- lymphocytes T provenant de donneurs sains sont illustrés dans la figure 1B. La figure 1C montre l'analyse statistique de la proportion de CIK de trois individus.
La figure 2A montre que la proportion decellules CD3etCD56 (0,65 % pour le PBMC d'origine, panneau inférieur gauche et 27,4 % pour les cellules CIK récoltées le14ejour, panneau inférieur droit) a considérablement augmenté après 14 jours d'expansion. Dans notre système de culture, les cellules CIK ont produit environ un demi-cent fois plus de changements par rapport au nombre initial de PBMC (figure 2B).
La figure 3 montre l'effet cytotoxique de CIK contre les cellules chroniques de leucémie myéloïde K562 et les cellules humaines de cancer de l'ovaire OC-3. Les cellules K562 ou OC-3 (cible, T) ont été tachées d'un colorant non fluorescent (CFSE), qui a été clivé par des estérases intracellulaires dans des cellules viables et est ensuite devenu un colorant très fluorescent. Dans l'étude de coculture cytotoxique, les cellules K562 ou OC-3 souillées par CFSE ont été cotraitées avec des cellules CIK pendant 24 h. À la fin de l'incubation, les cellules totales ont été récoltées et tachées avec du colorant 7-AAD, qui est un colorant liant l'acide nucléique qui est utilisé comme une sonde de viabilité pour l'exclusion des cellules mortes. La taille et la granularité des cellules CIK et CFSEsont illustrées dans la figure 3A. Les cellules K562 souillées par CFSE (cellules cibles, T) ont été co-traitées avec des cellules CIK (cellules effectrices, E) à un rapport de E/T - 0:1, 5:1, et 10:1, respectivement. Les cellules 7-AADde CFSEet K562 ont toutes été évaluées. Les résultats statistiques provenaient de trois expériences indépendantes. La lyse basale signifie le pourcentage de la mort cellulaire en l'absence de cellules effectrices (E:T ' 0:1). La figure 3B montre la cytotoxicité évidente du CIK par rapport aux cellules OC-3 (E:T et 10:1) après 24 heures d'incubation.
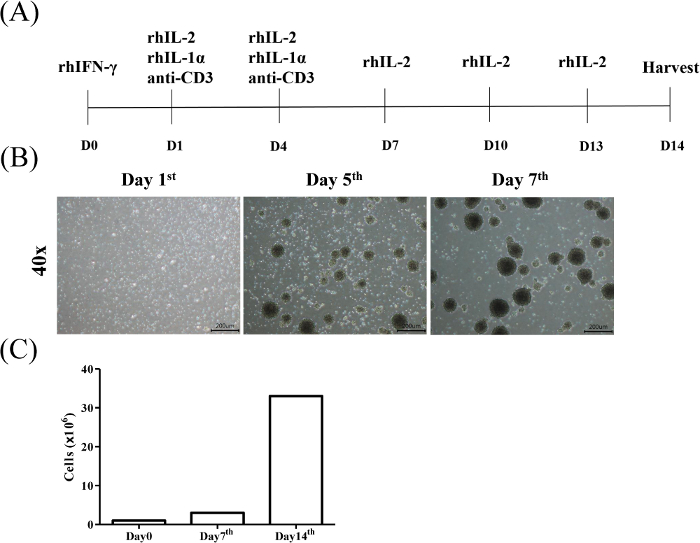
Figure 1 : Graphique de flux de cellules tueuses induites par la cytokine induction et expansion. (A) Les PBMC des donneurs sains consentis ont d'abord été exposés au rhIFN-MD (Jour 0), suivis du rhIL-2, du rhIL-1et et de l'anti-CD3 mAb (Jour 1) tous les 3 jours (Jour 4). Par la suite, le milieu a été rafraîchi avec le milieu rhIL-2-contenant tous les 3 jours et les cellules ont été moissonnées le jour 14. (B) Morphologie des cellules CIK pendant 7 jours d'induction. L'activation et l'expansion des cellules CIK ont été menées comme décrit dans le protocole. Des cellules ont été observées sous un microscope léger les jours 1, 5 et 7, respectivement (agrandissement de 40x, barre d'échelle de 200 m). (C) Les comptes cellulaires ont été effectués chaque semaine. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
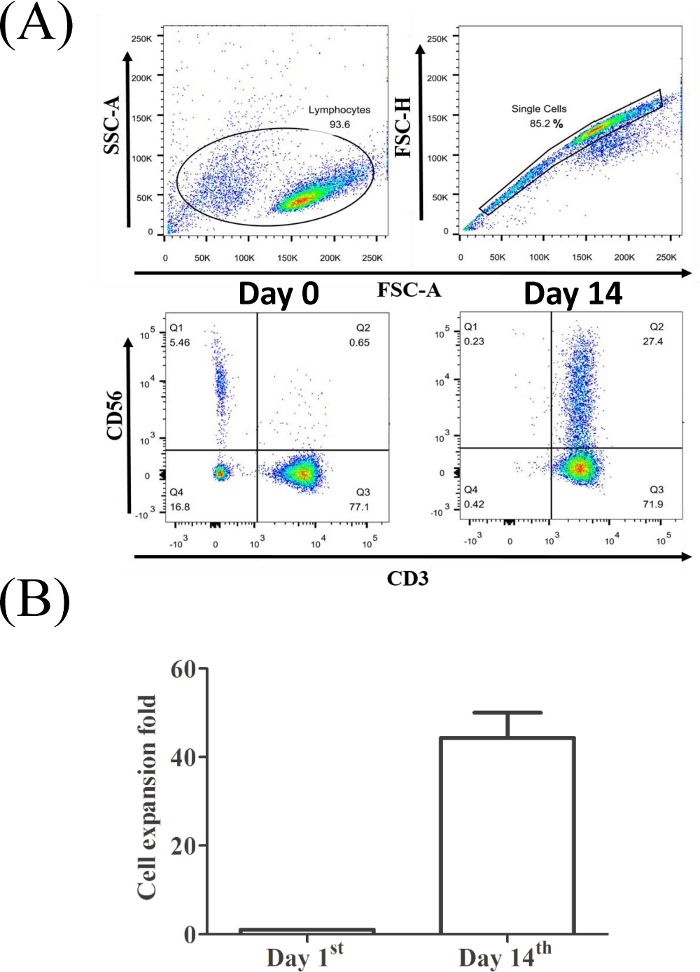
Figure 2 : Proportion de CD3etde cD56et de lymphocytes T provenant d'un échantillon PBMC représentatif. (A) Les lymphocytes ont été reconnus par la taille et la granularité spécifiques. Population de cellules individuelles sélectionnées pour analyse par cytométrie de flux. (B) L'analyse statistique de l'efficacité de l'expansion du CIK auprès de trois donneurs en bonne santé a été effectuée à l'aide d'un test t (md, p et lt; 0,01). Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 3 : Effets cytotoxiques des cellules CIK contre la leucémie myéloïde chronique humaine K562 et les cellules OC-3 du cancer de l'ovaire humain. (A) Après la coculture avec les cellules CIK pendant 24 h, les cellules cibles K562 ont été reconnues et fermées en fonction de la coloration du colorant CFSE. Illustration de quadrant de la population cellulaire totale sous le paramètre 7-AAD/CFSE sélectionné et de la cytotoxicité cumulative des cellules CIK au rapport E:T indiqué. (B) L'effet cytotoxique des cellules CIK contre les cellules OC-3 à un rapport E:T -10:1. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
Discussion
La méthode décrite est un protocole rapide, pratique et fiable pour l'isolement et l'expansion des cellules T cytotoxiques induites par la cytokine (CIK) à partir d'échantillons de sang entier de donneurs sains. Il montre également l'effet cytotoxique de CIK contre la leucémie (K562) et les cellules cancéreuses ovariennes (OC-3) à l'aide d'un système de configuration et de suivi de la cytométrie du débit (CS et T). Les cellules CIK peuvent être induites et étendues dans de bonnes pratiques manuusines (GMP) conditions en utilisant des cytokines de catégorie GMP et milieu sans sérum pour d'autres perfusion clinique11. Cependant, l'efficacité de l'induction et de l'expansion de CIK présente des différences individuelles12,13,14. En outre, la sécurité est l'avantage de l'infusion de cellules CIK dérivées du patient pour la thérapie cellulaire du cancer. Il a été rapporté que les cellules ciK exercent des effets cytolytiques sur les cellules cancéreuses solides épithéliales la plupart du temps d'une manière NKG2D-dépendante. Dans les cellules cancéreuses hématologiques, le blocage de NKG2D avec un anticorps spécifique inhibe de manière significative la cytotoxicité CIK-induite contre les cellules K562 NKG2D-bas ; cependant, ce traitement n'a aucun effet sur les cellules HL-60 dépourvues de NKG2D15. En outre, les cellules CIK présentent moins d'activité de mise à mort cellulaire contre les cellules K562 par rapport aux cellules CD8et CIK16. Dans cette étude, nous avons constaté que CIK a montré un plus grand potentiel cytotoxique contre les cellules oc-3 de cancer de l'ovaire comparées aux cellules de leucémie K562. Ces données suggèrent que les mécanismes moléculaires exacts par lesquels les effecteurs de CIK tuent des cellules de tumeur ne sont pas encore clairs.
Le suivi de la viabilité des cellules cibles et l'évaluation du potentiel cytotoxique des cellules effectrices à l'aide de la cytométrie du débit sont devenus une méthode standard et conventionnelle pour l'examen clinique17. Il a été suggéré qu'un effet négatif est observé sur la viabilité cellulaire et l'expression de marqueurs d'activation, tels que la population cD3dans les lymphocytes tachés de CFSE avec cytométrie de flux18,19. Ainsi, la coloration des cellules cancéreuses cibles est une stratégie plus efficace pour évaluer les effets cytotoxiques des cellules CIK primaires. IFN-MD, OKT3 et IL-2 sont des cytokines ou stimulateurs majeurs pour la différenciation et la prolifération de CIK. En outre, d'autres facteurs tels que la thymoglobuline, il-1, IL-10, IL-15, sont également stimulateurs. Actuellement, le sérum humain, le plasma humain riche en plaquettes, et même le sérum bovin foetal sont utilisés comme suppléments moyens qui peuvent améliorer la prolifération des cellules CIK. Bien que le sérum ou le plasma soient enrichis en nutriments et en facteurs de croissance, l'ajout de produits animaux allogéniques présente des variations de source, de lots et de lots qui entraînent une variabilité expérimentale, et déconcertent inévitablement les études avec des résultats thérapeutiques pour les cellules cultivées. Dans cette étude, nous avons utilisé un média de qualité GMP sans sérum, sans albumine et sans xéno disponible dans le commerce, complété par des cytokines de qualité clinique pour réussir à culturener les cellules CIK. L'inconvénient d'utiliser des suppléments sans xéno ou allogéniques est qu'ils réduisent l'efficacité de la prolifération cellulaire.
Les méthodes de suivi des cellules bicolores fournies dans les protocoles ont calculé indépendamment les cellules cibles viables ou mortes de l'effecteur dans un analyse directe de cytotoxicité. Dans nos stratégies de gating, les cellulescibles de CFSE peuvent évidemment être distinguées des cellules effectrices ciK (figure 3). Plus important encore, le processus d'induction et d'expansion du CIK doit être qualifié et présenter une grande viabilité. Pour d'autres perfusions à ossains multiples, l'état de la cryoconservation, et la viabilité et la cytotoxicité après la décongélation, sont d'autres défis critiques. Le rapport réel de lyse spécifique est égal à la proportion de 100 x (%Lyse échantillon - %lyse basale)/(100 - %lyse basale). Contrairement à d'autres études18,20, il est recommandé que toutes les cellules cibles soient étudiées pour révéler la cytotoxicité exacte et réelle des cellules CIK.
En conclusion, le protocole décrit dans cette étude est conçu pour augmenter le nombre de cellules CIK dérivées de PBMC à partir de donneurs sains et pour évaluer leurs fonctions cytotoxiques contre les cellules cancéreuses avec des sondes photoactivatable bicolores pour le suivi sélectif de cellules cibles par une cytométrie de flux avec un système de diagnostic in vitro (DIV).
Déclarations de divulgation
Les auteurs ne déclarent aucun conflit d'intérêts financier contradictoire.
Remerciements
Cette étude a été soutenue par le China Medical University Hospital (DMR-Cell-1809).
matériels
| Name | Company | Catalog Number | Comments |
| 7-Amino Actinomycin D | BD | 559925 | |
| APC Mouse Anti-Human CD56 antibody | BD | 555518 | B159 |
| APC Mouse IgG1, κ Isotype Control | BD | 555751 | MOPC-21 |
| BD FACSCanto II Flow Cytometer | BD | 338962 | |
| Carboxyfluorescein diacetate succinimidyl ester (CFSE) | BD | 565082 | |
| D-(+)-Glucose solution | SIGMA | G8644 | |
| Dulbecco's Modified Eagle Medium/F12 | HyClone | SH30023.02 | |
| Fetal bovine serum | HyClone | SH30084.03 | |
| Ficoll-Paque Plus | GE Healthcare Life Sciences | 71101700-EK | |
| FITC Mouse Anti-Human CD3 antibody | BD | 555332 | UCHT1 |
| FITC Mouse IgG1, κ Isotype Control | BD | 555748 | MOPC-21 |
| Human anti-CD3 mAb | TaKaRa | T210 | OKT3 |
| Penicillin-Streptomycin | Gibco | 15140122 | |
| Proleukin | NOVARTIS | ||
| Recombinant Human Interferon-gamma | CellGenix | 1425-050 | |
| Recombinant Human Interleukin-1 alpha | PEPROTECH | 200-01A | |
| RPMI1640 medium | Gibco | 11875-085 | |
| Sigma 3-18K Centrifuge | Sigma | 10295 | |
| TrypLE Express Enzyme | Gibco | 12605028 | |
| X-VIVO 15 medium | Lonza | 04-418Q |
Références
- Cappuzzello, E., et al. Cytokines for the induction of antitumor effectors: The paradigm of Cytokine-Induced Killer (CIK) cells. Cytokine & Growth Factor Reviews. 36, 99-105 (2017).
- Schmidt-Wolf, R. S., et al. Propagation of large numbers of T cells with natural killer cell markers. British Journal of Haematology. 87 (3), 453-458 (1994).
- Grainger, S., et al. Wnt Signaling in Hematological Malignancies. Progress in Molecular Biology and Translational Science. 153, 321-341 (2018).
- Dai, C., et al. Implication of combined PD-L1/PD-1 blockade with cytokine-induced killer cells as a synergistic immunotherapy for gastrointestinal cancer. Oncotarget. 7 (9), 10332-10344 (2016).
- Schmidt-Wolf, I. G., et al. Use of a SCID mouse/human lymphoma model to evaluate cytokine-induced killer cells with potent antitumor cell activity. TheJournal of Experimental Medicine. 174 (1), 139-149 (1991).
- Introna, M., et al. Rapid and massive expansion of cord blood-derived cytokine-induced killer cells: an innovative proposal for the treatment of leukemia relapse after cord blood transplantation. Bone Marrow Transplantation. 38 (9), 621-627 (2006).
- Schmeel, L. C., et al. Cytokine-induced killer (CIK) cells in cancer immunotherapy: report of the international registry on CIK cells (IRCC). Journal of Cancer Research and Clinical Oncology. 141 (5), 839-849 (2015).
- Rutella, S., et al. Adoptive immunotherapy with cytokine-induced killer cells generated with a new good manufacturing practice-grade protocol. Cytotherapy. 14 (7), 841-850 (2012).
- Nausch, N., et al. NKG2D ligands in tumor immunity. Oncogene. 27 (45), 5944-5958 (2008).
- Gammaitoni, L., et al. Effective activity of cytokine-induced killer cells against autologous metastatic melanoma including cells with stemness features. Clinical Cancer Research. 19 (16), 4347-4358 (2013).
- Rettinger, E., et al. The cytotoxic potential of interleukin-15-stimulated cytokine-induced killer cells against leukemia cells. Cytotherapy. 14 (1), 91-103 (2012).
- Narayan, R., et al. Donor-derived cytokine-induced killer cell infusion as consolidation after nonmyeloablative allogeneic transplantation for myeloid neoplasms. Biology of Blood and Marrow Transplantation. 19, 1083 (2019).
- Castiglia, S., et al. Cytokines induced killer cells produced in good manufacturing practices conditions: identification of the most advantageous and safest expansion method in terms of viability, cellular growth and identity. Journal of Translational Medicine. 16 (1), 237 (2018).
- Bonanno, G., et al. Thymoglobulin, interferon-γ and interleukin-2 efficiently expand cytokine-induced killer (CIK) cells in clinical-grade cultures. Journal of Translational Medicine. 8, 129 (2010).
- Iudicone, P., et al. Interleukin-15 enhances cytokine induced killer (CIK) cytotoxic potential against epithelial cancer cell lines via an innate pathway. Human Immunology. 77 (12), 1239-1247 (2016).
- Liu, J., et al. Phenotypic characterization and anticancer capacity of CD8+ cytokine-induced killer cells after antigen-induced expansion. PLoS One. 12 (4), 0175704 (2017).
- Chen, D., et al. Cytokine-induced killer cells as a feasible adoptive immunotherapy for the treatment of lung cancer. Cell Death & Disease. 9 (3), 366 (2018).
- Tario, J. D. Monitoring cell proliferation by dye dilution: considerations for probe selection. Methods in Molecular Biology. 1678, 249-299 (2018).
- Last'ovicka, J., et al. Assessment of lymphocyte proliferation: CFSE kills dividing cells and modulates expression of activation markers. Cellular Immunology. 256 (1-2), 79-85 (2009).
- Yoshida, T., et al. Characterization of natural killer cells in tamarins: a technical basis for studies of innate immunity. Frontiers in Microbiology. 1, 1-9 (2010).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon