Method Article
Aislamiento y expansión de células T asesinas inducidas por citoquinas citotóxicas para el tratamiento del cáncer
En este artículo
Resumen
Aquí, presentamos un protocolo para realizar el aislamiento y expansión de células mononucleares de sangre periférica-inducidas por citoquinas CD3+CD56+ células asesinas e ilustrar su efecto de citotoxicidad contra las células cancerosas hematológicas y sólidas mediante el uso de un sistema de citometría de flujo de diagnóstico in vitro.
Resumen
La inmunoterapia celular adoptiva se centra en restaurar el reconocimiento del cáncer a través del sistema inmunitario y mejora la matanza efectiva de células tumorales. Se ha informado que la terapia con células T por el asesino de citoquinas (CIK) ejerce efectos citotóxicos significativos contra las células cancerosas y reduce los efectos adversos de la cirugía, la radiación y la quimioterapia en los tratamientos oncológicos. El CIK se puede derivar de células mononucleares de sangre periférica (PPBM), médula ósea y sangre del cordón umbilical. Las células CIK son una subpoblación heterogénea de células T con CD3+CD56+ y características fenotípicas de asesino natural (NK) que incluyen actividad antitumoral no restringida del complejo de histocompatibilidad principal (MHC). Este estudio describe un método calificado, clínicamente aplicable, basado en citometría de flujo para la cuantificación de la capacidad citolítica de las células CIK derivadas de PBMC contra células cancerosas hematológicas y sólidas. En el ensayo citolítico, las células CIK se entrenan en diferentes proporciones con células tumorales diana prestadas. Después del período de incubación, el número de células diana se determina mediante una mancha de unión a ácido nucleico para detectar células muertas. Este método es aplicable tanto a aplicaciones de investigación como de diagnóstico. Las células CIK poseen una potente citotoxicidad que podría ser explorada como una estrategia alternativa para el tratamiento del cáncer tras su evaluación preclínica mediante una configuración y seguimiento del citometro (cS y T) sistema de citometría de flujo basado.
Introducción
Los linfocitos T citotóxicos son una población específica de células efectogenitas inmunes que media respuestas inmunitarias contra el cáncer. Varias poblaciones de células efectoras, incluidas las células asesinas activadas por linfina (LAK), los linfocitos infiltrantes tumorales (TIL), las células asesinas naturales (NK), las células T y las células asesinas inducidas por citoquinas (CIK), se han desarrollado con fines de terapia adoptiva de células T (ACT)1. Existe un creciente interés en las células CIK, ya que representan una mezcla de poblaciones de células citotóxicas inducidas por citoquinas expandidas a partir de células mononucleares de sangre periférica autóloga (PMBC)2.
El crecimiento incontrolado de células progenitoras linfoides, mieloblastos y linfoblastos conduce a tres tipos principales de cánceres de sangre (es decir, leucemia, linfoma y mieloma), tumores sólidos, incluyendo carcinomas (por ejemplo, cáncer de pulmón, cáncer gástrico, cáncer de cuello uterino) y sarcomas, entre otros cánceres3. Las células CIK son una mezcla de poblaciones celulares que presentan una amplia gama de actividad antitumoral no restringida del complejo de histocompatibilidad (MHC) y, por lo tanto, son prometedoras para el tratamiento de tumores hematológicos y avanzados4,5,6,7. Las células CIK comprenden una combinación de células, incluyendo células T (CD3+CD56), celdas NK-T (CD3+CD56+), y celdas NK (CD3–CD56+). La optimización del protocolo de inducción CIK mediante el uso de un cronograma fijo para la adición de anticuerpos IFN-o, anti-CD3 e IL-2, da como resultado la expansión de las células CIK8. La capacidad citotóxica de las células CIK contra las células cancerosas depende principalmente de la participación del grupo NK 2 miembro D (un miembro de la familia de receptores similares a la lectina de tipo C) ligandos NKG2D en las células tumorales, y en las vías mediadas por perforina9. Los resultados de un estudio preclínico revelaron que las células CIK estimuladas por IL-15 indujeron citotoxicidad potente contra las líneas celulares de leucemia mieloide primaria sin efecto sin vitro y mostraron una menor aleeactividad contra los PBMU normales y los fibroblastos9. Recientemente, se publicó el resultado de la perfusión de CIK de un donante sano (1 x 108/kg CD3+ células) como consolidación tras el trasplante alogénico no mieloablativo para el tratamiento de neoplasias mieloides en un estudio clínico de fase II10.
En el presente estudio, desarrollamos una fórmula de cultivo celular optimizada compuesta por IFN-, IL-1, anticuerpo anti-CD3 e IL-2 añadido al medio celular hematopoyético para aumentar la producción de CIK, e investigamos el efecto citotóxico de las células CIK contra la crónica humana leucemia mieloide (K562) y células de cáncer de ovario (OC-3).
Protocolo
El protocolo clínico se realizó y aprobó de acuerdo con las directrices de la Junta de Revisión Institucional del Comité de ética de la Universidad Médica y de Investigación Hospitalaria de China. Los especímenes de sangre periférica fueron cosechados de voluntarios sanos con su consentimiento informado.
1. Preparación de materiales
- Almacene reactivos, anticuerpos y productos químicos como se muestra en la Ficha de datos de seguridad de materiales (MSDS). Disolver los fármacos o citoquinas en disolventes como soluciones de stock y luego alícuota para su almacenamiento a -20 oC o -80 oC.
NOTA: La información detallada para la preparación de materiales se indica en la Tabla de materiales.
2. Aislamiento PBMC
- Caliente la solución de gradiente de densidad(Tabla de materiales)a 18–20 oC antes de su uso. Invierta el frasco de solución varias veces para asegurar una mezcla completa.
- Recoger 3 x 5 ml de muestra de sangre venosa humana en un vial heparinizado y mezclar bien invirtiendo suavemente el tubo varias veces.
- Preparar 4 ml de solución de gradiente de densidad en un tubo estéril de 15 ml.
- Capa cuidadosamente 1 ml de la muestra de sangre en la solución de gradiente de densidad.
- Centrífuga a 400 x g durante 30 min a 18 o20 oC (apague la rotura).
- Aspirar cuidadosamente e inmediatamente la capa de capa de color beige de las células mononucleares (aproximadamente 1 ml) a la vez para evitar perturbar las capas a un tubo estéril de 15 ml utilizando una pipeta estéril de 1 ml.
- Agregue al menos 3 volúmenes (3 ml) de solución salina con fosfato (PBS) a la capa de color buffy en el tubo centrífugo. Suspenda las células pipetándolas suavemente hacia arriba y hacia abajo al menos 3 veces con una pipeta estéril.
- Centrífuga a 400 x g durante 10 min a 18 o20 oC. Aspira al sobrenadante.
- Suspenda el pellet celular con 5 ml de medio basal(Tabla de Materiales)y transfiera a un matraz. Cultivo de las células en una incubadora de cultivo celular a 37 oC y 5% co2.
3. Inducción y expansión del CIK
- En el día 0, el cultivo de los PPB (1 x 106) en un medio basal fresco que contenga 1.000 UI/ml de IFN-o durante 24 h en una incubadora de cultivo celular humidificado a 37oC y 5% deCO2.
- En el día 1, refresque el medio con un medio basal fresco que contenga 50 ng/ml de anticuerpo anti-CD3, 1 ng/ml de rh IL-1, y 1.000 U/ml de rh IL-2. Actualice el medio cada 3 días.
- El día 7, refresque el medio con un medio basal fresco que contenga 1.000 U/ml de rh IL-2. Actualice el medio cada 3 días hasta el final de la expansión celular (Día 14).
4. Inmunofenotipado para la evaluación de células CIK
- Lave las células CIK con 10 ml de PBS estéril. Centrifugar durante 10 min a 300 x g y 18 o2 oC, aspirar el sobrenadante y resuspender las células con 10 ml de PBS. Cuente el número de celda y pruebe la viabilidad celular utilizando el ensayo de exclusión de color azul trypan.
- Alícuota las células CIK en seis tubos estériles de 1,5 ml a una densidad de 5-10 x 105 células/ml PBS. Etiquetar y tratar de la siguiente manera: Tubo 1, En blanco (sin anticuerpo); Tubo 2, añadir 20 l de isotipo IgG1-FITC; Tubo 3, añadir 20 l de isotipo IgG1-APC mAbs; Tubo 4, añadir 20 s de CD3-FITC; Tubo 5, añadir 20 l de CD56-APC mAbs; y El Tubo 6, añadir 20 l de CD3-FITC y 20 l de CD56-APC mAbs.
- Mezcle suavemente las células CIK con los anticuerpos inticulándolas suavemente hacia arriba y hacia abajo al menos 3 veces con una pipeta estéril de 1 ml, y luego incubar durante 30 minutos a temperatura ambiente en la oscuridad.
- Centrifugar los tubos durante 10 min a 300 x g y 18 o20 oC. Aspirar el sobrenadante y suspender el pellet celular una vez con 1 ml de PBS. Canalizarlos suavemente hacia arriba y hacia abajo al menos 3 veces con una pipeta estéril de 1 ml.
- Repita el paso 4.4.
- Deje los tubos en la oscuridad antes del análisis citométrico de flujo.
5. Reconocimiento de marcadores de CD
- Transfiera la suspensión celular a un tubo inferior redondo de poliestireno estéril de 5 ml con una tapa de colador de celda (malla de 100 m) pipeteando suavemente a través de la tapa. Ponga los tubos en el carrusel en orden.
- Abra el software de análisis de citometría de flujo y cree una carpeta experimental. Haga clic en el botón Nuevo espécimen para agregar una muestra y un tubo al experimento y asignar un nombre a los tubos de la siguiente manera: Tubo 1, En blanco; Tube 2, Isotipo IgG1-CD3; Tube 3, Isotipo IgG1-CD56; Tubo 4, CD3; Tubo 5, CD56; Tubo 6, CD3CD56.
- Cree un sistema de gating de dispersión para las poblaciones de células CIK(Figura 2A).
- Seleccione Tubo 1 (en blanco) y haga clic en el botón Trazado de puntos para crear una gráfica FSC-A/SSC-A. Dibuje una puerta rectangular sobre toda la población celular con un umbral FSC-A >5 x 104 para excluir los desechos celulares.
- Seleccione el parámetro SSC-A/SSC-H para la nueva gráfica de puntos y dibuje una puerta poligonal alrededor de todas las celdas individuales. Seleccione el parámetro Count/FITC (CD3) y Count/APC (CD56) para la nueva gráfica de histograma, respectivamente. Seleccione el parámetro FITC (CD3)/APC (CD56) para la nueva gráfica de puntos y dibuje una puerta de cuatro cuadrantes para definir las cuatro subpoblaciones.
- Registre los datos de 20.000 células individuales en cada muestra. Haga clic en el botón Cargar muestra para analizar primero el ejemplo de control en blanco. Identifique toda la población de células CIK utilizando los parámetros de canal CD56 y CD3.
- Repita el paso 5.3 para la investigación de todos los especímenes.
- Abra los archivos que contienen los valores estadísticos de la muestra individual para analizar las poblaciones de células CIK y volver a imprimirlas en archivos de análisis.
6. Cultivo y tinción de la leucemia mieloide crónica humana Células K562 y cáncer de ovario CÉLULAs OC-3
- Células K562
- Cultivo de células K562 en medios completos (medio basal RPMI que contiene 10% suero bovino fetal [FBS] y 50 antibióticos U/ml y ajustar la glucosa a 4,5 g/L) a una densidad de 0,5 x 1 x 106 células/ml en un matraz de cultivo celular e incubar en una incubadora humidificada a 37 oC y 5% deCO2.
- Transfiera los medios de cultivo que contienen las células K562 en tubos estériles de 50 ml y peletizar las células a 300 x g durante 10 minutos a 18 o20 oC el día del experimento.
- Aspirar el sobrenadante, resuspender las células en 5 ml de PBS estéril, y mezclar suavemente.
- Repete las células a 300 x g durante 10 min. Aspirar el sobrenadante, resuspender las células en PBS, y ajustar las células K562 a una concentración de 0.5-1 x 106 células/ml.
- Añadir 0,5 ml de tinte CFSE a la suspensión celular de 1 ml de K562 en un tubo estéril de 15 ml a una concentración final de 5 m. Mezcle suavemente la suspensión pipeteando hacia arriba y hacia abajo al menos 3 veces.
- Dejar el tubo en una incubadora de cultivo celular a 37oC y 5%CO2 durante 10-15 min.
- Añadir 9 ml de PBS al tubo y peletizar las células a 300 x g durante 10 min. Decant el sobrenadante y luego suspender el pellet celular en 10 mL de medios completos. Transfiera la suspensión celular a un matraz de cultivo celular y colóquela en la incubadora.
- Células OC-3
- Cultivo de células OC-3 en medios completos (medio DMEM/F12 que contiene 10% DE FBS y 50 antibióticos U/ml) a una densidad de 0,5–1 x 106 células en un matraz de cultivo celular a 37oC y 5% de CO2.
- Aspirar los medios de cultivo y lavar las células con PBS 1 día antes del experimento.
- Separar las células añadiendo 1 ml de solución enzimática de disociación celular(Tabla de Materiales)e incubar durante 5 min a 37 oC.
- Suspenda las células añadiendo 5 ml de PBS y mezcle bien suavemente. Peletizar las células a 300 x g durante 10 min y aspirar el sobrenadante. Resuspenda las células en PBS y ajuste las células a una concentración de 0.5–1 x 106 células/ml.
- Añadir 0,5 ml de tinte CFSE a 1 ml de la suspensión celular OC-3 en un tubo estéril de 15 ml a una concentración final de 5 m. Mezcle suavemente la suspensión pipeteando hacia arriba y hacia abajo al menos 3 veces.
- Dejar el tubo en una incubadora de cultivo celular a 37oC y 5%CO2 durante 10-15 min.
- Añadir 9 ml de PBS al tubo y peletizar las células a 300 x g durante 10 min. Decant el sobrenadante y luego suspender el pellet celular con medios completos. Semilla 5 x 105 células/bien en una placa de 6 pocillos e incubar en una incubadora humidificada a 37oC y 5% deCO2 durante la noche.
7. Ensayo citotóxico
- Cocultura de células CIK y K562 (CIK-K562)
- Cuente las celdas K562 del paso 6.1.7 y pruebe la viabilidad celular mediante el ensayo de exclusión azul trypan. Añadir 1 mL de celdas K562 a cada pocal en una placa de 6 pozos a una densidad de 5 x 105/mL.
- Añadir 1 mL de medio basal con o sin células CIK desde el paso 3.4 a la placa de 6 pozos del paso 7.1.1 de la siguiente manera: Bueno 1 - Células en blanco, K562 solas (5 x 105); Bueno 2 - Células K562 teñidas con CFSE solas (5 x 105); Bien 3 - Células CIK (E [efector], 25 x 105) + células K562 teñidas con CFSE (T [objetivo], 5 x 105); Bien 4 - Células CIK (E, 50 x 105) + células K562 teñidas con CFSE (T, 5 x 105).
- Mezcle las suspensiones de las células pipetándolas suavemente hacia arriba y hacia abajo al menos 3 veces. Coloque la placa en la incubadora durante 24 h.
- Cocultura de células CIK y OC-3 (CIK-OC-3)
- Añadir 1 mL de medio basal con o sin células CIK desde el paso 3.4 a la placa de 6 pozos del paso 6.2.7 de la siguiente manera: Bueno 1o En blanco, células OC-3 solas (5 x 105); Bueno 2 - Células OC-3 teñidas por CFSE solas (5 x 105); Bien 3 - Células CIK (E, 25 x 105) + células OC-3 teñidas por CFSE (T, 5 x 105); Bien 4 - Células CIK (E, 50 x 105) + células OC-3 teñidas por CFSE (T, 5 x 105).
- Mezcle las suspensiones de las células pipetándolas suavemente hacia arriba y hacia abajo al menos 3 veces. Coloque la placa en la incubadora durante 24 h.
- 7-Aminoactinomicina D (7-AAD) tinción de tinte
- Corerice la suspensión de la célula CIK-K562 del paso 7.1.3 directamente en un tubo estéril de 15 ml.
- Cosecha tanto la suspensión como las células adherentes de los grupos CIK-OC-3 del paso 7.2.2.
- Transfiera la suspensión celular a un tubo estéril de 15 ml. Lavar el pozo con 1 ml de PBS estéril, recoger el PBS y añadir al tubo. Añadir 0,5 ml de solución enzimática de disociación celular e incubar durante 5 min a 37 oC.
- Añadir 1 ml de la solución desde el mismo tubo al pozo correspondiente y mezclar suavemente las células clasificadas hacia arriba y hacia abajo al menos 3 veces con una pipeta estéril de 1 ml. Recoger todas las células en el mismo tubo.
- Centrifugar a 300 x g durante 10 min, aspirar el sobrenadante y resuspender las células en 1 ml de PBS estéril. Peletizar las células a 300 x g durante 10 minutos, aspirar el sobrenadante, y resuspender las células en 100 éL de PBS estéril.
- Añadir 5 l de tinte 7-AAD (50 ng /L de stock) a la suspensión celular. Mezcle suavemente las células pipetándolas hacia arriba y hacia abajo al menos 3 veces con una pipeta estéril de 1 ml. Incubar durante 10 min y dejar en la oscuridad antes del análisis.
- Ensayo de capacidad citolítica
- Mezcle la suspensión celular del paso 7.3.4 y repita los pasos 5.1 y 5.2 una vez.
- Haga clic en el botón Nuevo espécimen para agregar una muestra y un tubo al experimento y asignar un nombre a los tubos de la siguiente manera: Tubo 1, K562 (u OC-3) solo células; Tubo 2, células K562 (u OC-3) teñidas por CFSE solamente; Tubo 3, E:T a 5:1; Tubo 4, E:T a 10:1.
- Cree un sistema de gaseo de dispersión para el ensayo citolítico(Figura 3A).
- Seleccione El Tubo 1 y haga clic en el botón Trazado de puntos para crear una gráfica FSC-A/SSC-A. Dibuje una puerta rectangular sobre todos los eventos con un umbral FSC-A >5 x 104 para excluir los residuos celulares.
- Seleccione el parámetro SSC-A/CFSE para la nueva gráfica de puntos. Seleccione el parámetro 7-AAD/CFSE para la nueva gráfica de puntos y dibuje una puerta de cuatro cuadrantes para definir las cuatro subpoblaciones.
- Haga clic en el botón Cargar muestra para analizar primero la muestra de control en blanco.
- Ajuste el voltaje de SSC-A y FSC-A. Identifique la población de células muertas utilizando los parámetros del canal CFSE y 7-AAD. Registre los datos de >20.000 CFSE+ células en cada espécimen.
- Repita la sección 7.4.6 para la investigación de todos los especímenes.
- Abra los archivos que contienen los valores estadísticos de cada muestra individual para analizar las poblaciones de células no viables y exportar los datos a archivos de análisis.
Resultados
El propósito del presente protocolo es aislar y expandir las células T asesinas inducidas por citoquinas (CIK) de los monocitos sanguíneos periféricos y evaluar el efecto citotóxico de la CIK contra la neoplasia maligna hematológica y las células cancerosas sólidas, respectivamente. La inducción de CIK fue identificada por el reconocimiento CD3/CD56. La Figura 1A muestra el protocolo para la inducción y expansión de CIK. Los resultados representativos de la estrategia de medición para analizar la subpoblación de células CD3+CD56+ T de donantes sanos se ilustran en la Figura 1B. La Figura 1C muestra el análisis estadístico de la proporción CIK de tres individuos.
La Figura 2A muestra que el CD3+CD56+ proporción celular (0,65% para el PBMC original, panel inferior izquierdo y 27,4% para las células CIK cosechadas el día14,panel inferior derecho) aumentó significativamente después de 14 días de expansión. En nuestro sistema de cultivo, las células CIK produjeron aproximadamente medio centenar de cambios en comparación con el número original de PPM(Figura 2B).
La Figura 3 muestra el efecto citotóxico de CIK contra las células de la leucemia mieloide crónica humana K562 y las células del cáncer de ovario humano OC-3. Las células K562 u OC-3 (objetivo, T) se teñían con un tinte no fluorescente (CFSE), que fue cegado por esterasas intracelulares dentro de células viables y luego se convirtió en un tinte altamente fluorescente. En el estudio de cocultivo citotóxico, las células K562 u OC-3 teñidas por CFSE fueron cotratadas con células CIK durante 24 horas. Al final de la incubación, las células totales fueron cosechadas y teñidas con un tinte 7-AAD, que es un tinte de unión a ácido nucleico que se utiliza como sonda de viabilidad para la exclusión de células muertas. El tamaño y la granularidad de las células CIK y CFSE+ se ilustran en la Figura 3A. Las células K562 teñidas con CFSE (células objetivo, T) fueron co-tratadas con células CIK (células de efector, E) en una proporción de E/T a 0:1, 5:1 y 10:1, respectivamente. Se evaluaron las celdas 7-AAD+ de CFSE+ K562. Los resultados estadísticos fueron de tres experimentos independientes. Lisis basal significa el porcentaje de muerte celular en ausencia de células efectoras (E:T a 0:1). La Figura 3B muestra la citotoxicidad obvia de CIK contra las células OC-3 (E:T a 10:1) después de 24 h de incubación.
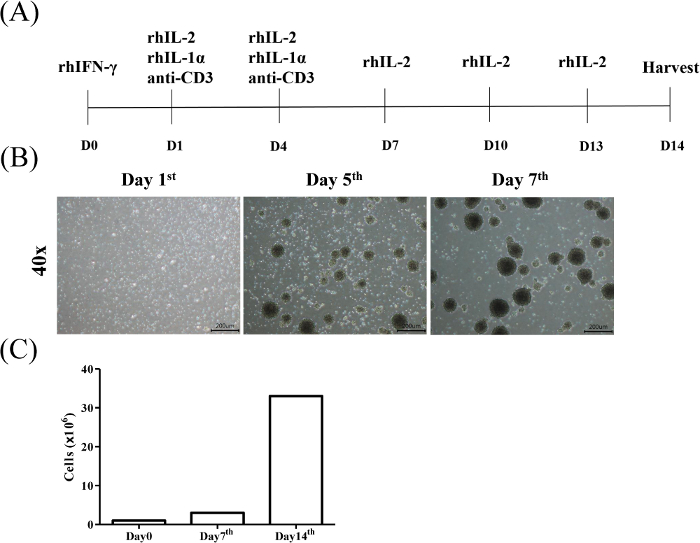
Figura 1: Gráfico de flujo de inducción y expansión de células asesinas inducidas por citoquinas. (A) Los PBMAM de donantes sanos consentidos fueron expuestos inicialmente a rhIFN-o (Día 0), seguidos de rhIL-2, rhIL-1 y anti-CD3 mAb (Día 1) cada 3 días (Día 4). Posteriormente, el medio se refrestó con medio que contiene rhIL-2 cada 3 días y las células se cosecharon el día 14. (B) Morfología de las células CIK durante 7 días de inducción. La activación y expansión de las células CIK se llevaron a cabo como se describe en el protocolo. Las células se observaron bajo un microscopio de luz en los días 1, 5 y 7, respectivamente (magnificación de 40x, barra de escala a 200 m). (C) Los recuentos de celdas se realizaban semanalmente. Haga clic aquí para ver una versión más grande de esta figura.
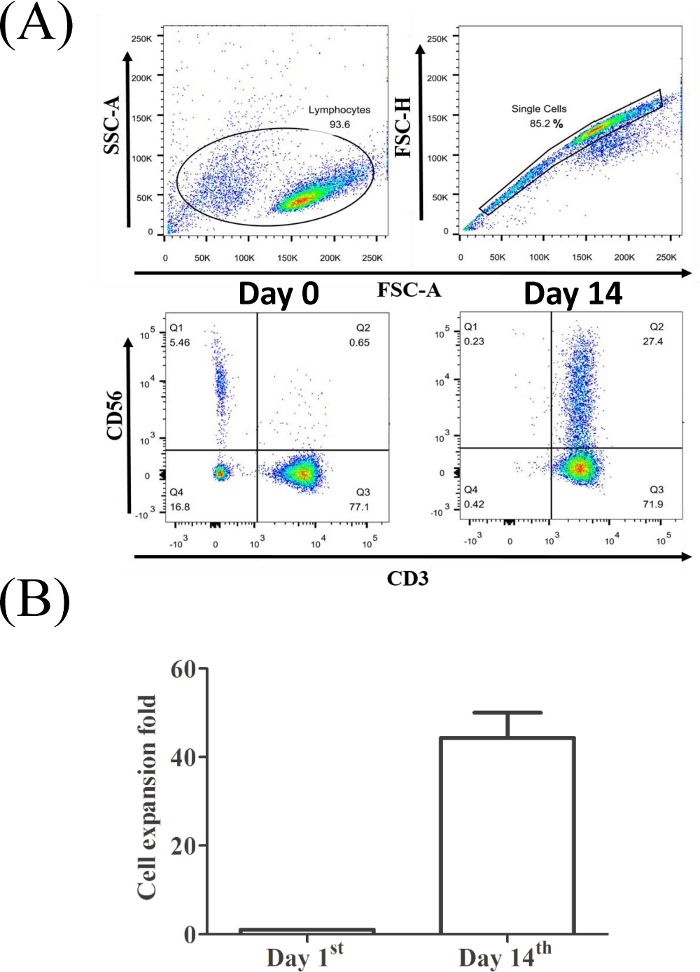
Figura 2: La proporción de células CD3+CD56+ T de una muestra representativa de PBMC. (A) Los linfocitos fueron reconocidos por tamaño y granularidad específicos. Población de una sola célula seleccionada para el análisis por citometría de flujo. (B) Se realizó un análisis estadístico de la eficacia de la expansión de CIK de tres donantes sanos utilizando una prueba t (*, p < 0,01). Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Efectos citotóxicos de las células CIK contra la leucemia mieloide crónica humana K562 y las células del cáncer de ovario humano OC-3. (A) Después de la cocultura con las células CIK durante 24 h, las células diana K562 fueron reconocidas y cerradas en función de la tinción del tinte CFSE. Ilustración cuadrante de la población celular total bajo el parámetro 7-AAD/CFSE seleccionado y la citotoxicidad acumulativa de las células CIK en la relación E:T indicada. (B) El efecto citotóxico de las células CIK contra las células OC-3 en una relación E:T a 10:1. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
El método descrito es un protocolo rápido, conveniente y confiable para el aislamiento y expansión de células T asesinas de citoquinas (CIK) inducidas por citoquinas (CIK) de muestras de sangre entera de donantes sanos. También muestra el efecto citotóxico de CIK contra la leucemia (K562) y las células cancerosas de ovario (OC-3) utilizando un sistema de configuración y seguimiento de citometría de flujo (CS & T). Las células CIK pueden ser inducidas y ampliadas en buenas prácticas de fabricación (GMP) mediante el uso de citoquinas de grado GMP y medio libre de suero para una perfusión clínica adicional11. Sin embargo, la eficacia de la inducción y expansión de CIK presenta diferencias individuales12,13,14. Además, la seguridad es la ventaja de la infusión de células CIK derivadas del paciente para la terapia con células cancerosas. Se ha informado que las células CIK ejercen efectos citolíticos sobre las células de cáncer sólido epitelial sobre todo de una manera dependiente de NKG2D. En las células cancerosas hematológicas, el bloqueo de NKG2D con un anticuerpo específico inhibe significativamente la citotoxicidad inducida por CIK contra las células K562 bajas en NKG2D; sin embargo, este tratamiento no tiene ningún efecto sobre las células HL-60 que carecen de NKG2D15. Además, las células CIK exhiben menos actividad de matanza de células contra las células K562 en comparación con CD8+ células CIK16. En este estudio, encontramos que CIK exhibió un mayor potencial citotóxico contra el cáncer de ovario OC-3 células en comparación con la leucemia K562 células. Estos datos sugieren que los mecanismos moleculares exactos a través de los cuales los efectores CIK matan las células tumorales aún no están claros.
El seguimiento de la viabilidad celular objetivo y la evaluación del potencial citotóxico de las células efectoras que utilizan citometría de flujo se ha convertido en un método estándar y convencional para el examen clínico17. Se ha sugerido que se observa un efecto negativo en la viabilidad celular y la expresión de marcadores de activación, como la población CD3+ en linfocitos teñidos con CFSE con citometría de flujo18,19. Por lo tanto, la tinción de las células cancerosas diana es una estrategia más eficaz para evaluar los efectos citotóxicos de las células CIK primarias. IfN-o, OKT3 e IL-2 son citoquinas o estimuladores importantes para la diferenciación y proliferación de CIK. Además, otros factores como la timoglobulina, IL-1, IL-10, IL-15, también son estimuladores. Actualmente, suero humano, plasma rico en plaquetas humana, e incluso suero bovino fetal se utilizan como suplementos medios que pueden mejorar la proliferación de células CIK. Aunque el suero o el plasma están enriquecidos con nutrientes y factores de crecimiento, la adición de productos animales alogénicos presenta variaciones de fuente, lote y lote que resultan en variabilidad experimental, e inevitablemente desconcertan estudios con resultados terapéuticos para células cultivadas. En este estudio, utilizamos un medio de grado GMP libre de suero, aalbúmina y sin xeno disponible comercialmente complementado con citoquinas de grado clínico para cultivar con éxito las células CIK. La desventaja de usar suplementos libres de xeno o sin alogénicos es que reducen la eficacia de la proliferación celular.
Los métodos de seguimiento de celdas de dos colores proporcionados en los protocolos calcularon de forma independiente las células objetivo de efector viables o muertos en un ensayo directo de citotoxicidad. En nuestras estrategias de gating, CFSE+ celdas de destino se pueden distinguir obviamente de las células efectoras CIK(Figura 3). Lo más importante es que el proceso de inducción y expansión de CIK debe ser calificado y mostrar alta viabilidad. Para otras infusiones de dosis múltiples, la condición de criopreservación, y la viabilidad y la citotoxicidad después de la descongelación, son otros desafíos críticos. La proporción real de lisis específica es igual a la proporción de 100 x (%Lysis de muestra - %Lisis basal)/(100 - %Lisis basal). A diferencia de otros estudios18,20, se recomienda que todas las células diana sean investigadas para revelar la citotoxicidad exacta y real de las células CIK.
En conclusión, el protocolo descrito en este estudio está diseñado para aumentar el número de células CIK derivadas de PBMC de donantes sanos y evaluar sus funciones citotóxicas frente a las células cancerosas con sondas fotoactivas de dos colores para el seguimiento selectivo de células diana mediante una citometría de flujo con un sistema de diagnóstico in vitro (IVD).
Divulgaciones
Los autores no declaran conflictos de interés financiero en conflicto.
Agradecimientos
Este estudio fue apoyado por el Hospital Universitario Médico de China (DMR-Cell-1809).
Materiales
| Name | Company | Catalog Number | Comments |
| 7-Amino Actinomycin D | BD | 559925 | |
| APC Mouse Anti-Human CD56 antibody | BD | 555518 | B159 |
| APC Mouse IgG1, κ Isotype Control | BD | 555751 | MOPC-21 |
| BD FACSCanto II Flow Cytometer | BD | 338962 | |
| Carboxyfluorescein diacetate succinimidyl ester (CFSE) | BD | 565082 | |
| D-(+)-Glucose solution | SIGMA | G8644 | |
| Dulbecco's Modified Eagle Medium/F12 | HyClone | SH30023.02 | |
| Fetal bovine serum | HyClone | SH30084.03 | |
| Ficoll-Paque Plus | GE Healthcare Life Sciences | 71101700-EK | |
| FITC Mouse Anti-Human CD3 antibody | BD | 555332 | UCHT1 |
| FITC Mouse IgG1, κ Isotype Control | BD | 555748 | MOPC-21 |
| Human anti-CD3 mAb | TaKaRa | T210 | OKT3 |
| Penicillin-Streptomycin | Gibco | 15140122 | |
| Proleukin | NOVARTIS | ||
| Recombinant Human Interferon-gamma | CellGenix | 1425-050 | |
| Recombinant Human Interleukin-1 alpha | PEPROTECH | 200-01A | |
| RPMI1640 medium | Gibco | 11875-085 | |
| Sigma 3-18K Centrifuge | Sigma | 10295 | |
| TrypLE Express Enzyme | Gibco | 12605028 | |
| X-VIVO 15 medium | Lonza | 04-418Q |
Referencias
- Cappuzzello, E., et al. Cytokines for the induction of antitumor effectors: The paradigm of Cytokine-Induced Killer (CIK) cells. Cytokine & Growth Factor Reviews. 36, 99-105 (2017).
- Schmidt-Wolf, R. S., et al. Propagation of large numbers of T cells with natural killer cell markers. British Journal of Haematology. 87 (3), 453-458 (1994).
- Grainger, S., et al. Wnt Signaling in Hematological Malignancies. Progress in Molecular Biology and Translational Science. 153, 321-341 (2018).
- Dai, C., et al. Implication of combined PD-L1/PD-1 blockade with cytokine-induced killer cells as a synergistic immunotherapy for gastrointestinal cancer. Oncotarget. 7 (9), 10332-10344 (2016).
- Schmidt-Wolf, I. G., et al. Use of a SCID mouse/human lymphoma model to evaluate cytokine-induced killer cells with potent antitumor cell activity. TheJournal of Experimental Medicine. 174 (1), 139-149 (1991).
- Introna, M., et al. Rapid and massive expansion of cord blood-derived cytokine-induced killer cells: an innovative proposal for the treatment of leukemia relapse after cord blood transplantation. Bone Marrow Transplantation. 38 (9), 621-627 (2006).
- Schmeel, L. C., et al. Cytokine-induced killer (CIK) cells in cancer immunotherapy: report of the international registry on CIK cells (IRCC). Journal of Cancer Research and Clinical Oncology. 141 (5), 839-849 (2015).
- Rutella, S., et al. Adoptive immunotherapy with cytokine-induced killer cells generated with a new good manufacturing practice-grade protocol. Cytotherapy. 14 (7), 841-850 (2012).
- Nausch, N., et al. NKG2D ligands in tumor immunity. Oncogene. 27 (45), 5944-5958 (2008).
- Gammaitoni, L., et al. Effective activity of cytokine-induced killer cells against autologous metastatic melanoma including cells with stemness features. Clinical Cancer Research. 19 (16), 4347-4358 (2013).
- Rettinger, E., et al. The cytotoxic potential of interleukin-15-stimulated cytokine-induced killer cells against leukemia cells. Cytotherapy. 14 (1), 91-103 (2012).
- Narayan, R., et al. Donor-derived cytokine-induced killer cell infusion as consolidation after nonmyeloablative allogeneic transplantation for myeloid neoplasms. Biology of Blood and Marrow Transplantation. 19, 1083 (2019).
- Castiglia, S., et al. Cytokines induced killer cells produced in good manufacturing practices conditions: identification of the most advantageous and safest expansion method in terms of viability, cellular growth and identity. Journal of Translational Medicine. 16 (1), 237 (2018).
- Bonanno, G., et al. Thymoglobulin, interferon-γ and interleukin-2 efficiently expand cytokine-induced killer (CIK) cells in clinical-grade cultures. Journal of Translational Medicine. 8, 129 (2010).
- Iudicone, P., et al. Interleukin-15 enhances cytokine induced killer (CIK) cytotoxic potential against epithelial cancer cell lines via an innate pathway. Human Immunology. 77 (12), 1239-1247 (2016).
- Liu, J., et al. Phenotypic characterization and anticancer capacity of CD8+ cytokine-induced killer cells after antigen-induced expansion. PLoS One. 12 (4), 0175704 (2017).
- Chen, D., et al. Cytokine-induced killer cells as a feasible adoptive immunotherapy for the treatment of lung cancer. Cell Death & Disease. 9 (3), 366 (2018).
- Tario, J. D. Monitoring cell proliferation by dye dilution: considerations for probe selection. Methods in Molecular Biology. 1678, 249-299 (2018).
- Last'ovicka, J., et al. Assessment of lymphocyte proliferation: CFSE kills dividing cells and modulates expression of activation markers. Cellular Immunology. 256 (1-2), 79-85 (2009).
- Yoshida, T., et al. Characterization of natural killer cells in tamarins: a technical basis for studies of innate immunity. Frontiers in Microbiology. 1, 1-9 (2010).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados