Method Article
Isolierung und Erweiterung zytotoxischer Cytokin-induzierter Killer-T-Zellen zur Krebsbehandlung
In diesem Artikel
Zusammenfassung
Hier stellen wir ein Protokoll zur Isolierung und Ausdehnung von peripheren mononukleären Blutzellen dar, die von Zytokin-induzierten CD3+CD56+ Killerzellen abgeleitet wurden, und ihre Zytotoxizitätswirkung gegen hämatologische und feste Krebszellen anhand eines in vitro-diagnosebasierten Durchflusszytometriesystems zu veranschaulichen.
Zusammenfassung
Die Adoptivzellimmuntherapie konzentriert sich auf die Wiederherstellung der Krebserkennung über das Immunsystem und verbessert die effektive Tötung von Tumorzellen. Zytokin-induzierte Killer (CIK) T-Zell-Therapie wurde berichtet, um erhebliche zytotoxische Wirkungen gegen Krebszellen ausüben und die Nebenwirkungen von Chirurgie, Bestrahlung, und Chemotherapie in Krebsbehandlungen zu reduzieren. CIK kann aus peripheren mononukleären Blutzellen (PBMCs), Knochenmark und Nabelschnurblut gewonnen werden. KIK-Zellen sind eine heterogene Subpopulation von T-Zellen mit CD3+CD56+ und natürlichen Killer (NK) phänotypic Eigenschaften, die großen Histokompatibilitätskomplex (MHC) -unbeschränkte Antitumoraktivität enthalten. Diese Studie beschreibt eine qualifizierte, klinisch anwendbare, strömungszytometriebasierte Methode zur Quantifizierung der zytolytischen Fähigkeit von PBMC-abgeleiteten CIK-Zellen gegen hämatologische und feste Krebszellen. Im zytolytischen Assay werden KIK-Zellen in unterschiedlichen Verhältnissen mit vorgefärbten Zieltumorzellen kokubiert. Nach der Inkubationszeit wird die Anzahl der Zielzellen durch einen Nukleinsäure-bindenden Fleck bestimmt, um abgestorbene Zellen zu erkennen. Diese Methode ist sowohl für Forschungs- als auch für Diagnoseanwendungen anwendbar. KIK-Zellen besitzen eine starke Zytotoxizität, die als alternative Strategie für die Krebsbehandlung nach ihrer präklinischen Bewertung durch ein Zytometer-Setup- und Tracking-basiertes Durchflusszytometriesystem (CS & T) untersucht werden könnte.
Einleitung
Zytotoxische T-Lymphozyten sind eine spezifische Immuneffektor-Zellpopulation, die Immunreaktionen gegen Krebs vermittelt. Mehrere Effektorzellpopulationen, einschließlich Lymphokin-aktivierte Killerzellen (LAK), tumorinfiltrierende Lymphozyten (TILs), natürliche Killerzellen (NK), T-Zellen und Zytokin-induzierte Killerzellen (CIK) wurden für die Adoptiv-T-Zelltherapie (ACT) entwickelt1. Das Interesse an KIK-Zellen wächst, da sie eine Mischung aus zytokininduzierten zytotoxischen Zellpopulationen darstellen, die aus autologen peripheren mononukleären Blutzellen (PMBCs)2erweitert werden.
Das unkontrollierte Wachstum von lymphoiden Vorläuferzellen, Myeloblasten und Lymphoblasten führt zu drei Haupttypen von Blutkrebs (z. B. Leukämie, Lymphom und Myelom), soliden Tumoren, einschließlich Karzinome (z. B. Lungenkrebs, Magenkrebs, Gebärmutterhalskrebs) und Sarkome, unter anderemKrebs3. KIK-Zellen sind eine Mischung von Zellpopulationen, die eine breite Palette von großen Histokompatibilitätskomplex (MHC) -unbeschränkte Antitumor-Aktivität aufweisen und damit Versprechen für die Behandlung von hämatologischen und fortgeschrittenen Tumoren4,5,6,7. KIK-Zellen bestehen aus einer Kombination von Zellen, einschließlich T-Zellen (CD3+CD56),NK-T-Zellen (CD3+CD56+), und NK-Zellen (CD3–CD56+). Die Optimierung des CIK-Induktionsprotokolls durch Verwendung eines festen Zeitplans für die Zugabe von IFN-, Anti-CD3-Antikörpern und IL-2 führt zur Erweiterung der CIK-Zellen8. Die zytotoxische Fähigkeit von CIK-Zellen gegen Krebszellen hängt hauptsächlich von der Beteiligung von NK-Gruppe 2-Mitglied D (ein Mitglied der C-Typ-Lektin-ähnlichen Rezeptorfamilie) NKG2D Liganden auf Tumorzellen und von Perforin-vermittelten Bahnen9ab. Die Ergebnisse einer präklinischen Studie zeigten, dass IL-15-stimulierte CIK-Zellen eine starke Zytotoxizität gegen primäre und akute myeloische Leukämie-Zelllinien in vitro induzierten und eine geringere Alloreaktivität gegen normale PBMCs und Fibroblasten9zeigten. Kürzlich wurde das Ergebnis einer einmaligen gesunden, von Spendern abgeleiteten CIK (1 x 108/kg CD3+ Zellen) ineiner Infusion als Konsolidierung nach nichtmyeloablativer allogener Transplantation zur Behandlung myeloider Neoplasmen in einer klinischen Phase-II-Studie veröffentlicht10.
In der vorliegenden Studie entwickelten wir eine optimierte Zellkulturformel, die aus IFN-, IL-1,, Anti-CD3-Antikörpern und IL-2 besteht, die dem hämatopoetischen Zellmedium hinzugefügt wurden, um die KIK-Produktion zu erhöhen, und untersuchten die zytotoxische Wirkung von CIK-Zellen gegen menschliche chronische myeloische Leukämie (K562) und Eierstockkrebs (OC-3).
Protokoll
Das klinische Protokoll wurde in Übereinstimmung mit den Richtlinien des Institutional Review Board der China Medical University and Hospital Research Ethics Committee durchgeführt und genehmigt. Periphere Blutproben wurden von gesunden Probanden mit ihrer informierten Zustimmung geerntet.
1. Herstellung von Materialien
- Bewahren Sie Reagenzien, Antikörper und Chemikalien auf, wie im Sicherheitsdatenblatt (MSDS) dargestellt. Die Medikamente oder Zytokine in Lösungsmitteln als Stofflösungen auflösen und dann bei -20 °C oder -80 °C lagern.
ANMERKUNG: Detaillierte Informationen zur Materialaufbereitung sind in der Materialtabelleaufgeführt.
2. PBMC-Isolierung
- Erwärmen Sie die Dichtegradientenlösung (Materialtabelle) vor der Verwendung auf 18–20 °C. Invertieren Sie die Lösungsflasche mehrmals, um eine gründliche Durchmischung zu gewährleisten.
- Sammeln Sie 3-5 ml menschliche venöse Blutprobe in einer heparinisierten Durchstechflasche und mischen Sie gut, indem Sie die Röhre mehrmals sanft invertieren.
- Bereiten Sie 4 ml Dichtegradientenlösung in einem 15 ml sterilen Rohr vor.
- Schicht 1 ml der Blutprobe vorsichtig auf die Dichtegradientenlösung.
- Zentrifuge bei 400 x g für 30 min bei 18 bis 20 °C (Pause ausschalten).
- Die buffy Schicht der mononukleären Zellen (ca. 1 ml) sofort vorsichtig und sofort ansaugen, um zu vermeiden, dass die Schichten mit einer 1 ml sterilen Pipette zu einem sterilen 15 ml-Rohr gestört werden.
- Fügen Sie dem Buffy-Mantel im Zentrifugenrohr mindestens 3 Bände (ca. 3 ml) Phosphat-gepufferte Saline (PBS) hinzu. Hängen Sie die Zellen an, indem Sie sie mindestens 3x mit einer sterilen Pipette auf und ab pfeifen.
- Zentrifuge bei 400 x g für 10 min bei 18 bis 20 °C. Aspirieren Sie den Überstand.
- Das Zellpellet mit 5 ml Basalmedium (Materialtabelle) aufhängen und in einen Kolben geben. Kultur die Zellen in einem Zellkultur-Inkubator bei 37 °C und 5%CO2.
3. CIK-Induktion und -Erweiterung
- An Tag 0 die PBMCs (1 x 106) in frischem Basalmedium mit 1.000 I.E./ml IFN-N für 24 h in einem befeuchteten Zellkultur-Inkubator bei 37 °C und 5%CO2kulturieren.
- Erfrischen Sie am 1. Tag das Medium mit einem frischen Basalmedium, das 50 ng/ml Anti-CD3-Antikörper, 1 ng/ml rh IL-1 und 1.000 U/ml rh IL-2 enthält. Erfrischen Sie das Medium alle 3 Tage.
- Erfrischen Sie das Medium an Tag 7 mit einem frischen Basalmedium, das 1.000 U/ml rh IL-2 enthält. Erfrischen Sie das Medium alle 3 Tage bis zum Ende der Zellexpansion (Tag 14).
4. Immunophenotypisierung zur Beurteilung von KIK-Zellen
- Waschen Sie die CIK-Zellen mit 10 ml sterilem PBS. Zentrifugieren Sie 10 min bei 300 x g und 18 x 20 °C, aspirieren Sie den Überstand und setzen Sie die Zellen mit 10 ml PBS wieder auf. Zählen Sie die Zellzahl und die Lebensfähigkeit der Testzelle mit dem Trypan-Blau-Ausschluss-Assay.
- Aliquot die CIK-Zellen in sechs sterile 1,5 ml-Röhren mit einer Dichte von 5–10 x 105 Zellen/ml PBS. Etikettieren und behandeln Sie wie folgt: Tube 1, Blank (kein Antikörper); Tube 2, fügen Sie 20 l Isotyp IgG1-FITC hinzu; Tube 3, fügen Sie 20 l Isotyp IgG1-APC mAbs hinzu; Tube 4, fügen Sie 20 L CD3-FITC hinzu; Tube 5, fügen Sie 20 L CD56-APC mAbs hinzu; und Tube 6, fügen Sie 20 l CD3-FITC und 20 l CD56-APC mAbs hinzu.
- Mischen Sie die CIK-Zellen vorsichtig mit den Antikörpern, indem Sie sie mindestens 3x mit einer 1 ml sterilen Pipette nach oben und unten pfeifen und dann 30 min bei Raumtemperatur im Dunkeln inkubieren.
- Zentrifugieren Sie die Rohre für 10 min bei 300 x g und 18 x 20 °C. Aspirieren Sie den Überstand und hängen Sie das Zellpellet einmal mit 1 ml PBS aus. Pfeifen Sie sie mindestens 3x mit einer 1 ml sterilen Pipette nach oben und unten.
- Wiederholen Sie Schritt 4.4.
- Lassen Sie die Rohre im Dunkeln, bevor Sie zytometrische Analysen durchfließen.
5. CD-Marker-Erkennung
- Übertragen Sie die Zellsuspension auf ein steriles 5 ml Polystyrol-Rundbodenrohr mit einer Zellsiebkappe (100 m Netz), indem Sie sanft durch die Kappe pipetieren. Setzen Sie die Rohre auf das Karussell in Ordnung.
- Öffnen Sie die Flow-Cytometrie-Analysesoftware, und erstellen Sie einen experimentellen Ordner. Klicken Sie auf die Schaltfläche "Neue Probe", um dem Experiment eine Probe und ein Rohr hinzuzufügen, und benennen Sie die Rohre wie folgt: Tube 1, Blank; Rohr 2, Isotype IgG1-CD3; Rohr 3, Isotype IgG1-CD56; Tube 4, CD3; Tube 5, CD56; Tube 6, CD3CD56.
- Erstellen Sie ein Streuungs-Gating-System für die CIK-Zellpopulationen (Abbildung 2A).
- Wählen Sie Tube 1 (Blank) und klicken Sie auf die Schaltfläche Punktdiagramm, um ein FSC-A/SSC-A-Plot zu erstellen. Zeichnen Sie ein Rechtecktor über die gesamte Zellpopulation mit einem FSC-A-Schwellenwert >5 x 104, um Zellablagerungen auszuschließen.
- Wählen Sie den Parameter SSC-A/SSC-H für das neue Punktdiagramm aus, und zeichnen Sie ein Polygontor um alle einzelnen Zellen. Wählen Sie den Parameter Count/FITC (CD3) und Count/APC (CD56) für das neue Histogrammdiagramm aus. Wählen Sie den Parameter FITC (CD3)/APC (CD56) für das neue Punktdiagramm aus, und zeichnen Sie ein Vier-Quadranten-Gate, um die vier Subpopulationen zu definieren.
- Zeichnen Sie die Daten von 20.000 Einzelzellen in jeder Probe auf. Klicken Sie auf die Schaltfläche Sample laden, um zuerst das Blank-Steuerelementbeispiel zu analysieren. Identifizieren Sie die gesamte CIK-Zellpopulation mithilfe der Kanalparameter CD56 und CD3.
- Wiederholen Sie Schritt 5.3 für die Untersuchung aller Proben.
- Öffnen Sie die Dateien, die die statistischen Werte der einzelnen Probe enthalten, um CIK-Zellpopulationen zu analysieren, und drucken Sie sie in Analysedateien neu aus.
6. Kultivieren und Färben von humanen chronischen myeloischen Leukämie K562 Zellen und Eierstockkrebs OC-3 Zellen
- K562-Zellen
- Kultur K562-Zellen in vollständigen Medien (RPMI-Basalmedium mit 10% fetalem Rinderserum [FBS] und 50 U/ml Antibiotika und Anpassung der Glukose auf 4,5 g/L) mit einer Dichte von 0,5 x 106 Zellen/ml in einem Zellkulturkolben und inkubieren in einem befeuchteten Inkubator bei 37 °C und 5%CO2.
- Übertragen Sie die Kulturmedien, die die K562-Zellen enthalten, in 50 ml sterile Schläuche und pelleten Sie die Zellen am Tag des Experiments bei 300 x g für 10 min bei 18 bis 20 °C.
- Aspirieren Sie den Überstand, setzen Sie die Zellen in 5 ml sterilem PBS wieder auf und mischen Sie sie gut.
- Pellet die Zellen bei 300 x g für 10 min. Aspirieren Sie den Überstand, suspendieren Sie die Zellen in PBS, und passen Sie die K562-Zellen auf eine Konzentration von 0,5-1 x 106 Zellen/ml an.
- Fügen Sie 0,5 l CFSE-Farbstoff in die 1 ml K562-Zellsuspension in einem 15 ml sterilen Rohr mit einer Endkonzentration von 5 m hinzu. Mischen Sie die Aufhängung vorsichtig, indem Sie mindestens 3x nach oben und unten pfeifen.
- Lassen Sie die Röhre in einem Zellkultur-Inkubator bei 37 °C und 5%CO2 für 10–15 min.
- Fügen Sie 9 ml PBS in das Rohr und Pellet die Zellen bei 300 x g für 10 min. Dekant den Überstand und dann hängen Sie das Zellpellet in 10 ml der gesamten Medien. Übertragen Sie die Zellsuspension in einen Zellkulturkolben und legen Sie sie in den Inkubator.
- OC-3-Zellen
- Kultur OC-3-Zellen in vollständigen Medien (DMEM/F12-Medium mit 10% FBS und 50 U/ml Antibiotika) mit einer Dichte von 0,5–1 x 106 Zellen in einem Zellkulturkolben bei 37 °C und 5%CO2.
- Saugen Sie die Kulturmedien und waschen Sie die Zellen mit PBS 1 Tag vor dem Experiment.
- Lösen Sie die Zellen durch Zugabe von 1 ml Zelldissoziationsenzymlösung (Materialtabelle) und inkubieren Sie sie 5 min bei 37 °C.
- Setzen Sie die Zellen durch Hinzufügen von 5 ml PBS und mischen Sie gut sanft. Pellet die Zellen bei 300 x g für 10 min und aspirieren den Überstand. Setzen Sie die Zellen in PBS wieder aus und passen Sie die Zellen auf eine Konzentration von 0,5–1 x 106 Zellen/ml an.
- Fügen Sie 0,5 l CFSE-Farbstoff zu 1 ml der OC-3-Zellsuspension in einem 15 ml sterilen Rohr bei einer Endkonzentration von 5 m hinzu. Mischen Sie die Aufhängung vorsichtig, indem Sie mindestens 3x nach oben und unten pfeifen.
- Lassen Sie die Röhre in einem Zellkultur-Inkubator bei 37 °C und 5%CO2 für 10–15 min.
- Fügen Sie 9 ml PBS in das Rohr und Pellet die Zellen bei 300 x g für 10 min. Dekant den Überstand und dann hängen Sie das Zellpellet mit vollständigen Medien. 5 x 105 Zellen/gut in eine 6-Well-Platte geben und in einem befeuchteten Inkubator bei 37 °C und 5%CO2 über Nacht inkubieren.
7. Zytotoxischer Assay
- Kokultur von CIK- und K562-Zellen (CIK-K562)
- Zählen Sie die K562-Zellen aus Schritt 6.1.7 und testen Sie die Zelllebensfähigkeit durch Trypan-Blau-Ausschluss-Assay. Fügen Sie 1 ml K562-Zellen zu jedem Brunnen in eine 6-Well-Platte mit einer Dichte von 5 x 105/ml hinzu.
- 1 ml Basalmedium mit oder ohne KIK-Zellen ab Schritt 3.4 zur 6-Well-Platte ab Schritt 7.1.1 wie folgt hinzufügen: Gut 1 = Leer, K562-Zellen allein (5 x 105); Gut 2 = CFSE-gefärbte K562-Zellen allein (5 x 105); Gut 3 = KIK-Zellen (E [Effektor], 25 x 105) + CFSE-gefärbte K562-Zellen (T [Ziel], 5 x 105); Gut 4 = KIK-Zellen (E, 50 x 105) + CFSE-gebeizte K562-Zellen (T, 5 x 105).
- Mischen Sie die Zellsuspensionen, indem Sie sie mindestens 3x nach oben und unten pfeifen. Legen Sie die Platte 24 h im Inkubator auf.
- Kokultur von CIK- und OC-3-Zellen (CIK-OC-3)
- 1 ml Basalmedium mit oder ohne KIK-Zellen ab Schritt 3.4 zur 6-Well-Platte ab Schritt 6.2.7 wie folgt hinzufügen: Gut 1 = Leer, OC-3-Zellen allein (5 x 105); Gut 2 = CFSE-gefärbte OC-3-Zellen allein (5 x 105); Gut 3 = KIK-Zellen (E, 25 x 105) + CFSE-gebeiztoc-3-Zellen (T, 5 x 105); Gut 4 = KIK-Zellen (E, 50 x 105) + CFSE-gefleckte OC-3-Zellen (T, 5 x 105).
- Mischen Sie die Zellsuspensionen, indem Sie sie mindestens 3x nach oben und unten pfeifen. Legen Sie die Platte in den Inkubator für 24 h.
- 7-Aminoactinomycin D (7-AAD) Farbstofffärbung
- Die CIK-K562 Zellsuspension ab Schritt 7.1.3 direkt in ein 15 ml steriles Rohr ernten.
- Ernte sowohl die Suspension sondienen als auch die anhaftenden Zellen aus den CIK-OC-3-Gruppen ab Schritt 7.2.2.
- Übertragen Sie die Zellsuspension in ein 15 ml steriles Rohr. Waschen Sie den Brunnen mit 1 ml sterilem PBS, sammeln Sie das PBS, und fügen Sie das Rohr hinzu. Fügen Sie 0,5 ml Zelldissoziationsenzymlösung hinzu und brüten Sie 5 min bei 37 °C.
- Fügen Sie 1 ml der Lösung aus dem gleichen Rohr in den entsprechenden Brunnen und mischen Sie die Zellen sanft, indem Sie sie mindestens 3x mit einer 1 ml sterilen Pipette nach oben und unten pipetieren. Sammeln Sie alle Zellen in der gleichen Röhre.
- Zentrifugieren Sie bei 300 x g für 10 min, aspirieren Sie den Überstand und setzen Sie die Zellen in 1 ml sterilem PBS wieder aus. Pellet die Zellen bei 300 x g für 10 min, aspirieren Sie den Überstand, und resuspendieren Zellen in 100 l sterilen PBS.
- Fügen Sie der Zellsuspension 5 l 7-AAD-Farbstoff (50 ng/L-Bestand) hinzu. Mischen Sie die Zellen vorsichtig, indem Sie sie mindestens 3x mit einer 1 ml sterilen Pipette nach oben und unten pfeifen. 10 min inkubieren und vor der Analyse im Dunkeln lassen.
- Zytolytische Fähigkeit Assay
- Mischen Sie die Zellsuspension ab Schritt 7.3.4 und wiederholen Sie die Schritte 5.1 und 5.2 einmal.
- Klicken Sie auf die Schaltfläche Neue Probe, um dem Experiment eine Probe und ein Rohr hinzuzufügen, und benennen Sie die Röhren wie folgt: nur Tube 1, K562 (oder OC-3); Tube 2, CFSE-gebeizt K562 (oder OC-3) Zellen nur; Rohr 3, E:T = 5:1; Rohr 4, E:T = 10:1.
- Erstellen Sie ein Streuungs-Gating-System für den zytolytischen Assay (Abbildung 3A).
- Wählen Sie Tube 1 und klicken Sie auf die Schaltfläche Punktdiagramm, um ein FSC-A/SSC-A-Plot zu erstellen. Zeichnen Sie ein Rechtecktor über alle Ereignisse mit einem FSC-A-Schwellenwert >5 x 104, um Zellablagerungen auszuschließen.
- Wählen Sie den Parameter SSC-A/CFSE für das neue Punktdiagramm aus. Wählen Sie den 7-AAD/CFSE-Parameter für das neue Punktdiagramm aus, und zeichnen Sie ein Vier-Quadranten-Gate, um die vier Subpopulationen zu definieren.
- Klicken Sie auf die Schaltfläche Sample laden, um zuerst das leere Steuerelementbeispiel zu analysieren.
- Stellen Sie die Spannung von SSC-A und FSC-A ein. Identifizieren Sie die Totzellenpopulation mithilfe der CFSE- und 7-AAD-Kanalparameter. Zeichnen Sie die Daten aus >20.000 CFSE+ Zellen in jeder Probe auf.
- Wiederholen Sie Abschnitt 7.4.6 für die Untersuchung aller Proben.
- Öffnen Sie die Dateien, die die statistischen Werte der einzelnen Proben enthalten, um die nicht lebensfähigen Zellpopulationen zu analysieren und die Daten in Analysedateien zu exportieren.
Ergebnisse
Ziel dieses Protokolls ist es, Zytokin-induzierte Killerzellen (CIK) t-Zellen aus peripheren Blutmonozyten zu isolieren und zu erweitern und die zytotoxische Wirkung von CIK gegen hämatologische Malignität bzw. feste Krebszellen zu bewerten. Die Induktion von CIK wurde durch die CD3/CD56-Erkennung identifiziert. Abbildung 1A zeigt das Protokoll für DIE CIK-Induktion und -Erweiterung. Die repräsentativen Ergebnisse der Gating-Strategie zur Analyse der Teilpopulation von CD3+CD56+ T-Zellen von gesunden Spendern sind in Abbildung 1Bdargestellt. Abbildung 1C zeigt die statistische Analyse des KIK-Anteils von drei Individuen.
Abbildung 2A zeigt, dass der CD3+CD56+ Zellanteil (0,65 % für die ursprüngliche PBMC, linke untere Platte und 27,4 % für die AM14.Tag geernteten CIK-Zellen) nach 14 Tagen Expansion signifikant angestiegen ist. In unserem Kultursystem ergaben die KIK-Zellen etwa ein hundertfaches Changes im Vergleich zur ursprünglichen Anzahl von PBMCs (Abbildung 2B).
Abbildung 3 zeigt die zytotoxische Wirkung von CIK gegen die chronische myeloische Leukämie k562 und den menschlichen Eierstockkrebs OC-3-Zellen. K562- oder OC-3-Zellen (Ziel, T) wurden mit einem nicht fluoreszierenden Farbstoff (CFSE) gefärbt, der durch intrazelluläre Esterasen in lebensfähigen Zellen zerlegt wurde und dann zu einem hochfluoreszierenden Farbstoff wurde. In der zytotoxischen Cokulturstudie wurden CFSE-gefleckte K562- oder OC-3-Zellen 24 h lang mit KIK-Zellen kobehandelt. Am Ende der Inkubation wurden die Gesamtzellen geerntet und mit 7-AAD-Farbstoff gefärbt, einem Nukleinsäure-bindenden Farbstoff, der als Lebensfähigkeitssonde für den Ausschluss toter Zellen verwendet wird. Die Größe und Granularität der ZELLEN CIK und CFSE+ sind in Abbildung 3Adargestellt. Die CFSE-gefleckten K562-Zellen (Zielzellen, T) wurden mit KIK-Zellen (Effektorzellen, E) im Verhältnis E/T = 0:1, 5:1 bzw. 10:1 kobehandelt. Die 7-AAD+ Zellen der CFSE+ K562-Zellen wurden alle ausgewertet. Die statistischen Ergebnisse stammen aus drei unabhängigen Experimenten. Basallyse bezeichnet den Prozentsatz des Zelltodes in Abwesenheit von Effektorzellen (E:T = 0:1). Abbildung 3B zeigt die offensichtliche Zytotoxizität von CIK gegen OC-3-Zellen (E:T = 10:1) nach 24 h Inkubation.
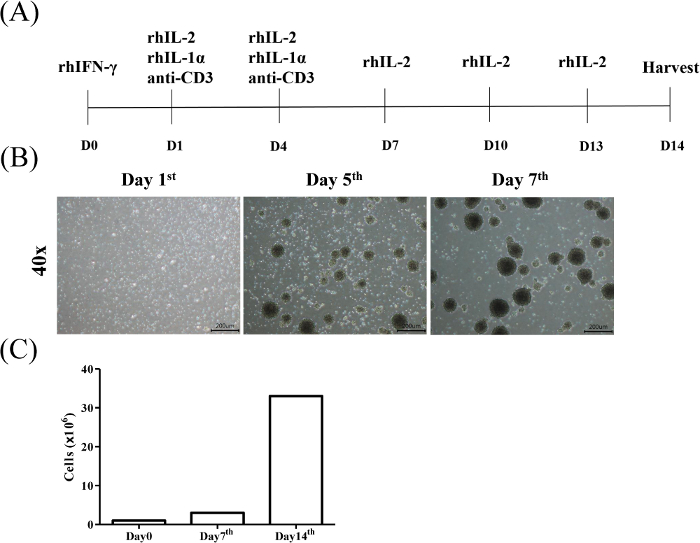
Abbildung 1: Flussdiagramm der Zytokin-induzierten Killerzellen Induktion und Expansion. (A) PBMCs von eingewilligten gesunden Spendern wurden zunächst rhIFN--N (Tag 0) ausgesetzt, gefolgt von rhIL-2, rhIL-1 und Anti-CD3 mAb (Tag 1) alle 3 Tage (Tag 4). Anschließend wurde das Medium alle 3 Tage mit rhIL-2-haltigem Medium aufgefrischt und die Zellen am 14. Tag geerntet. (B) Morphologie von KIK-Zellen während 7 Tagen Induktion. Die Aktivierung und Erweiterung von CIK-Zellen wurde wie im Protokoll beschrieben durchgeführt. Die Zellen wurden unter einem Lichtmikroskop an den Tagen 1, 5 bzw. 7 beobachtet (Vergrößerung = 40x, Skalenbalken = 200 m). (C) Die Anzahl der Zellen wurde wöchentlich durchgeführt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
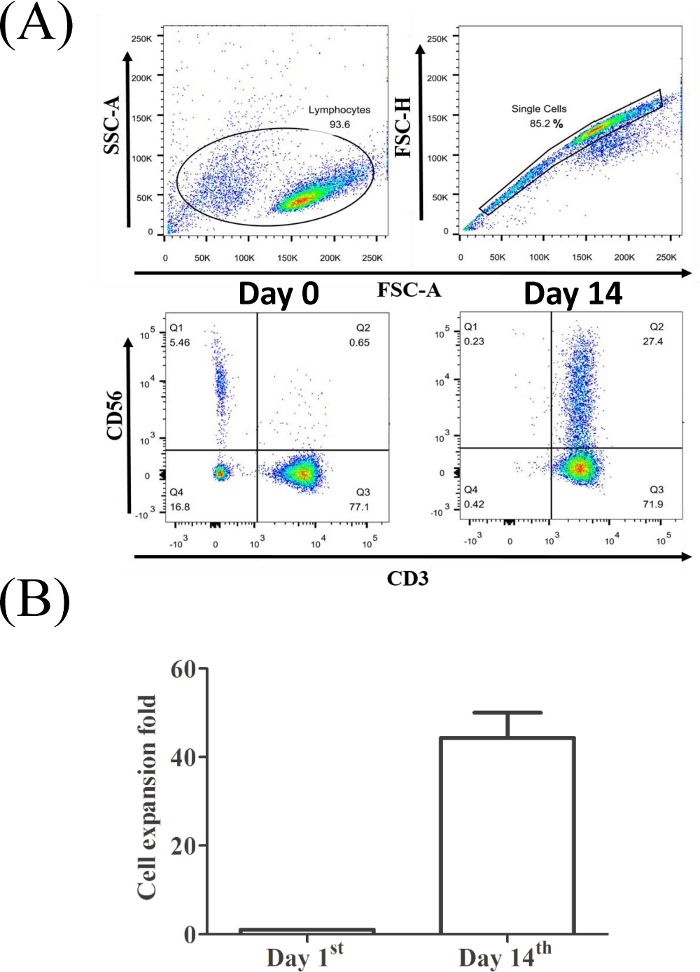
Abbildung 2: Der Anteil der CD3+CD56+ T-Zellen aus einem repräsentativen PBMC-Beispiel. (A) Lymphozyten wurden durch spezifische Größe und Granularität erkannt. Ausgewählte Einzelzellpopulation für die Analyse durch Durchflusszytometrie. (B) Die statistische Analyse der Wirksamkeit der CIK-Expansion von drei gesunden Spendern wurde mit einem t-Test (*, p < 0,01) durchgeführt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3: Zytotoxische Wirkungen von CIK-Zellen gegen die chronische myeloische Leukämie k562 und den menschlichen Eierstockkrebs OC-3-Zellen. (A) Nach der Kokultur mit den KIK-Zellen für 24 h wurden K562-Zielzellen erkannt und auf der Grundlage der Färbung von CFSE-Farbstoffen abgegrenzt. Quadrantendarstellung der gesamten Zellpopulation unter dem ausgewählten 7-AAD/CFSE-Parameter und der kumulativen Zytotoxizität von CIK-Zellen im angegebenen E:T-Verhältnis. (B) Die zytotoxische Wirkung von KIK-Zellen gegen OC-3-Zellen im E:T = 10:1-Verhältnis. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Die beschriebene Methode ist ein schnelles, bequemes und zuverlässiges Protokoll zur Isolierung und Ausdehnung von zytotoxischen Zytokin-induzierten Killer-T-Zellen aus Vollblutproben gesunder Spender. Es zeigt auch die zytotoxische Wirkung von CIK gegen Leukämie (K562) und Eierstockkrebszellen (OC-3) mit einem Flow-Zytometrie-Setup und Tracking-System (CS & T). KIK-Zellen können unter guten manufakturen Praktiken (GMP) induziert und erweitert werden, indem GMP-Grade-Zytokine und serumfreies Medium für weitere klinische Infusionen verwendet werden11. Die Wirksamkeit der CIK-Induktion und -Expansion weist jedoch individuelle Unterschiedeauf 12,13,14. Darüber hinaus ist die Sicherheit der Vorteil der Infusion von vom Patienten abgeleiteten KIK-Zellen für die Krebszelltherapie. Es wurde berichtet, dass KIK-Zellen zytolytische Wirkungen auf epitheliale festige Krebszellen meist in einer NKG2D-abhängigen Weise ausüben. In hämatologischen Krebszellen hemmt die Blockierung von NKG2D mit einem spezifischen Antikörper signifikant die CIK-induzierte Zytotoxizität gegen NKG2D-niedrige K562-Zellen; diese Behandlung hat jedoch keine Auswirkungen auf HL-60-Zellen ohne NKG2D15. Darüber hinaus weisen KIK-Zellen eine geringere Zelltötungsaktivität gegenüber K562-Zellen auf als CD8+ KIK-Zellen16. In dieser Studie fanden wir heraus, dass CIK ein größeres zytotoxisches Potenzial gegen Eierstockkrebs OC-3-Zellen im Vergleich zu Leukämie-K562-Zellen zeigte. Diese Daten deuten darauf hin, dass die genauen molekularen Mechanismen, durch die KIK-Effektoren Tumorzellen abtöten, noch nicht klar sind.
Die Verfolgung der Lebensfähigkeit von Zielzellen und die Bewertung des zytotoxischen Potenzials von Effektorzellen mit Flusszytometrie ist zu einer Standardmethode und konventionellemethode für die klinische Untersuchung geworden17. Es wird vermutet, dass ein negativer Effekt auf die Zelllebensfähigkeit und die Expression von Aktivierungsmarkern beobachtet wird, wie die CD3+ Population in CFSE-gefärbten Lymphozyten mit Durchflusszytometrie18,19. Daher ist die Färbung der Zielkrebszellen eine effektivere Strategie zur Bewertung der zytotoxischen Wirkungen primärer KIK-Zellen. IFN-, OKT3 und IL-2 sind wichtige Zytokine oder Stimulatoren für die CIK-Differenzierung und -Proliferation. Darüber hinaus sind auch andere Faktoren wie Thymoglobulin, IL-1, IL-10, IL-15, Stimulatoren. Derzeit werden menschliches Serum, menschliches Thrombozyten-reiches Plasma und sogar fetales Rinderserum als mittlere Ergänzungen verwendet, die die Proliferation von KIK-Zellen verbessern können. Obwohl Serum oder Plasma mit Nährstoffen und Wachstumsfaktoren angereichert sind, stellt die Zugabe allogener tierischer Produkte Quellen-, Chargen- und Losvariationen dar, die zu experimentellen Variabilität führen, und unweigerlich beunruhigende Studien mit therapeutischen Ergebnissen für kultivierte Zellen. In dieser Studie verwendeten wir ein kommerziell erhältliches serumfreies, albuminfreies und xenofreies GMP-Medien, das mit klinisch hochwertigen Zytokinen ergänzt wurde, um die CIK-Zellen erfolgreich zu kultiieren. Der Nachteil der Verwendung von xeno-freien oder allogen-freien Ergänzungen ist, dass sie die Wirksamkeit der Zellproliferation reduzieren.
Die in den Protokollen bereitgestellten zweifarbigen Zellverfolgungsmethoden berechneten unabhängig voneinander lebensfähige oder abgestorbene Effektor-Zielzellen in einem direkten Zytotoxizitätstest. In unseren Gating-Strategien können CFSE+ Zielzellen offensichtlich von KIK-Effektorzellen unterschieden werden (Abbildung 3). Am wichtigsten ist, dass der Prozess der CIK-Induktion und -Expansion qualifiziert sein und eine hohe Lebensfähigkeit aufweisen muss. Für weitere Multiple-Dosierung-Infusionen, der Zustand der Kryokonservierung, und die Lebensfähigkeit und die Zytotoxizität nach dem Auftauen, sind weitere kritische Herausforderungen. Das tatsächliche Verhältnis der spezifischen Lyse entspricht dem Anteil von 100 x (%Sample Lyse - %Basallyse)/(100 - %Basallyse). Im Gegensatz zu anderen Studien18,20wird empfohlen, alle Zielzellen zu untersuchen, um die genaue und tatsächliche Zytotoxizität von KIK-Zellen aufzudecken.
Zusammenfassend lässt sich sagen, dass das in dieser Studie beschriebene Protokoll darauf abzielt, die Anzahl der VON PBMC abgeleiteten CIK-Zellen von gesunden Spendern zu erhöhen und ihre zytotoxischen Funktionen gegen Krebszellen mit zweifarbigen photoaktivierbaren Sonden zur selektiven Durch eine Durchflusszytometrie mit einem In-vitro-Diagnostiksystem (IVD).
Offenlegungen
Die Autoren erklären keine konkurrierenden Konflikte von finanziellen Interessen.
Danksagungen
Diese Studie wurde vom China Medical University Hospital (DMR-Cell-1809) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| 7-Amino Actinomycin D | BD | 559925 | |
| APC Mouse Anti-Human CD56 antibody | BD | 555518 | B159 |
| APC Mouse IgG1, κ Isotype Control | BD | 555751 | MOPC-21 |
| BD FACSCanto II Flow Cytometer | BD | 338962 | |
| Carboxyfluorescein diacetate succinimidyl ester (CFSE) | BD | 565082 | |
| D-(+)-Glucose solution | SIGMA | G8644 | |
| Dulbecco's Modified Eagle Medium/F12 | HyClone | SH30023.02 | |
| Fetal bovine serum | HyClone | SH30084.03 | |
| Ficoll-Paque Plus | GE Healthcare Life Sciences | 71101700-EK | |
| FITC Mouse Anti-Human CD3 antibody | BD | 555332 | UCHT1 |
| FITC Mouse IgG1, κ Isotype Control | BD | 555748 | MOPC-21 |
| Human anti-CD3 mAb | TaKaRa | T210 | OKT3 |
| Penicillin-Streptomycin | Gibco | 15140122 | |
| Proleukin | NOVARTIS | ||
| Recombinant Human Interferon-gamma | CellGenix | 1425-050 | |
| Recombinant Human Interleukin-1 alpha | PEPROTECH | 200-01A | |
| RPMI1640 medium | Gibco | 11875-085 | |
| Sigma 3-18K Centrifuge | Sigma | 10295 | |
| TrypLE Express Enzyme | Gibco | 12605028 | |
| X-VIVO 15 medium | Lonza | 04-418Q |
Referenzen
- Cappuzzello, E., et al. Cytokines for the induction of antitumor effectors: The paradigm of Cytokine-Induced Killer (CIK) cells. Cytokine & Growth Factor Reviews. 36, 99-105 (2017).
- Schmidt-Wolf, R. S., et al. Propagation of large numbers of T cells with natural killer cell markers. British Journal of Haematology. 87 (3), 453-458 (1994).
- Grainger, S., et al. Wnt Signaling in Hematological Malignancies. Progress in Molecular Biology and Translational Science. 153, 321-341 (2018).
- Dai, C., et al. Implication of combined PD-L1/PD-1 blockade with cytokine-induced killer cells as a synergistic immunotherapy for gastrointestinal cancer. Oncotarget. 7 (9), 10332-10344 (2016).
- Schmidt-Wolf, I. G., et al. Use of a SCID mouse/human lymphoma model to evaluate cytokine-induced killer cells with potent antitumor cell activity. TheJournal of Experimental Medicine. 174 (1), 139-149 (1991).
- Introna, M., et al. Rapid and massive expansion of cord blood-derived cytokine-induced killer cells: an innovative proposal for the treatment of leukemia relapse after cord blood transplantation. Bone Marrow Transplantation. 38 (9), 621-627 (2006).
- Schmeel, L. C., et al. Cytokine-induced killer (CIK) cells in cancer immunotherapy: report of the international registry on CIK cells (IRCC). Journal of Cancer Research and Clinical Oncology. 141 (5), 839-849 (2015).
- Rutella, S., et al. Adoptive immunotherapy with cytokine-induced killer cells generated with a new good manufacturing practice-grade protocol. Cytotherapy. 14 (7), 841-850 (2012).
- Nausch, N., et al. NKG2D ligands in tumor immunity. Oncogene. 27 (45), 5944-5958 (2008).
- Gammaitoni, L., et al. Effective activity of cytokine-induced killer cells against autologous metastatic melanoma including cells with stemness features. Clinical Cancer Research. 19 (16), 4347-4358 (2013).
- Rettinger, E., et al. The cytotoxic potential of interleukin-15-stimulated cytokine-induced killer cells against leukemia cells. Cytotherapy. 14 (1), 91-103 (2012).
- Narayan, R., et al. Donor-derived cytokine-induced killer cell infusion as consolidation after nonmyeloablative allogeneic transplantation for myeloid neoplasms. Biology of Blood and Marrow Transplantation. 19, 1083 (2019).
- Castiglia, S., et al. Cytokines induced killer cells produced in good manufacturing practices conditions: identification of the most advantageous and safest expansion method in terms of viability, cellular growth and identity. Journal of Translational Medicine. 16 (1), 237 (2018).
- Bonanno, G., et al. Thymoglobulin, interferon-γ and interleukin-2 efficiently expand cytokine-induced killer (CIK) cells in clinical-grade cultures. Journal of Translational Medicine. 8, 129 (2010).
- Iudicone, P., et al. Interleukin-15 enhances cytokine induced killer (CIK) cytotoxic potential against epithelial cancer cell lines via an innate pathway. Human Immunology. 77 (12), 1239-1247 (2016).
- Liu, J., et al. Phenotypic characterization and anticancer capacity of CD8+ cytokine-induced killer cells after antigen-induced expansion. PLoS One. 12 (4), 0175704 (2017).
- Chen, D., et al. Cytokine-induced killer cells as a feasible adoptive immunotherapy for the treatment of lung cancer. Cell Death & Disease. 9 (3), 366 (2018).
- Tario, J. D. Monitoring cell proliferation by dye dilution: considerations for probe selection. Methods in Molecular Biology. 1678, 249-299 (2018).
- Last'ovicka, J., et al. Assessment of lymphocyte proliferation: CFSE kills dividing cells and modulates expression of activation markers. Cellular Immunology. 256 (1-2), 79-85 (2009).
- Yoshida, T., et al. Characterization of natural killer cells in tamarins: a technical basis for studies of innate immunity. Frontiers in Microbiology. 1, 1-9 (2010).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten