Method Article
Эктопическая модель экспрессии хемокина для тестирования макрофагов набора в Vivo
В этой статье
Резюме
Чтобы проверить влияние хемокина на набор макрофагов in vivo, для обнаружения эктопического выражения хемокина использовалась вся монтация на макрофаг. Для наблюдения макрофагов в режиме реального времени использовалась живая визуализация.
Аннотация
Зебрафиш широко используется в фундаментальных и биомедицинских исследованиях. Многие трансгенные линии зебры в настоящее время доступны для обозначения различных типов клеток. Благодаря прозрачному эмбриональному телу зебры, нам удобно изучать влияние одного хемокина на поведение определенного типа клеток in vivo. Здесь мы предоставили рабочий процесс для изучения функции хемокина по миграции макрофагов in vivo. Мы построили ткани конкретных переэкспрессии плазмид для переэкспресса IL-34 и вводили плазмид в одной-клеточной стадии трансгенных эмбрионов рыб, макрофаги которых были специально помечены флуоресцентным белком. Затем мы использовали целые флуоресцентные установки на месте гибридизации и иммуно-стинеризм для обнаружения картины экспрессии хемокина и количество или расположение макрофагов. Инъекционные эмбрионы WT были подняты для создания стабильной трансгенной линии. Наконец, мы использовали конфокальные живые изображения, чтобы непосредственно наблюдать за поведением макрофагов в стабильных трансгенных рыб для изучения функции IL-34 на макрофагах in vivo.
Введение
Зебрафиш — небольшая тропическая пресноводная рыба, зародившаяся в Индии. Что касается сохранения генов, зебрафиш имеют сходство 87% с человеком1. Он может дать нам представление о смежных предметах человека, изучая регуляцию генов, функцию белка и поведение клеток, такие как миграция, пролиферация et.al у зебры. Эмбрион зебры может быть использован для наблюдения за развитием ранних эмбрионов на разных стадиях после ингибирования пигмента. Между тем, это занимает всего три месяца для зебры развиваться в половой зрелости, то зебрафиш может производить сотни яиц каждые 4 дня. Мини-размер, простое разведение, сильная репродуктивная способность, эти преимущества делают культуру зебры очень экономной, способствующей крупномасштабной культуре. Традиционная модель мыши млекопитающих имеет более высокие расходы на техническое обслуживание, чем зебрафиш, таким образом, ограничивая масштабы поднятия мыши. В аспекте раннего развития эмбриона, эмбрион мыши трудно наблюдать в живом состоянии из-за характеристик развития эмбриона мыши в утробе матери. Напротив, эмбрионы зебры развиваются внешне и прозрачны, поэтому их легко наблюдать под микроскопом. Кроме того, зебрафиш очень легко построить различные трансгенные линии для связанных исследований функции генов. В настоящее время, различные трансгенные линии зебры доступны для обозначения различных типов клеток. Это очень удобно сейчас, чтобы построить трансгенные линии для переэкспресса хемокинов в конкретных местах и изучить функции хемокинов на поведение клеток у зебры.
Здесь мы предоставили рабочий процесс для использования трансгенной линии зебры для исследования функции IL-34 на поведение макрофагов in vivo2,3,4,5,6,7. Во-первых, мы построили печени конкретных переэкспрессии плазмид гена il34 и вводили плазмид в одноклеточной стадии Tg (mpeg1: GFP) рыбных эмбрионов, которые специально помечены макрофагов флуоресцентным белком GFP. Затем мы использовали целые флуоресцентные установки на месте гибридизации и иммуно-стинеризм для обнаружения картины экспрессии il34 и числа или расположения макрофагов. Инъекционные эмбрионы WT были подняты для создания стабильной трансгенной линии. В этих шагах мы установили и проверили линию производства цитокинов и визуально оценили эффекты, которые можно увидеть на распределении макрофагов. Наконец, для изучения поведения макрофагов в ответ на цитокин, мы использовали конфокальные живые изображения, чтобы непосредственно наблюдать миграцию макрофагов, чтобы подтвердить функцию il34 на миграции макрофагов in vivo.
протокол
ПРИМЕЧАНИЕ: Все образцы были обработаны фенилтиуреа (PTU) яичной воды для ингибирования пигмента.
1. Поколение Tg (fabp10a:il34) Трансгенные конструкции и инъекции рыбы
- Клон 2,8 кб fabp10a промоутер8 и Ил-34 кодирования регионов (ENSDART00000126460.3) зебры в вектор pTol2 для создания fabp10a-il34 конструкции. Впрысните конструкции в одноклеточную стадию Tg (mpeg1: GFP)и WT эмбрионы рыб вместе с транспозазом мРНК. Поднимите fabp10a-il34 вводили эмбрионы WT взрослым9 и определите трансгенного основателя по гибридизации на месте.
ПРИМЕЧАНИЕ: Инъекция конструкции Tol2 непосредственно в другой трансгенной может быть проблематичной, если другая трансгенная линия производится с той же транспозонной системой. Общая практика будет заключаться в том, чтобы сделать независимую трансгенную линию и впоследствии пересечь новую линию с другой линией репортера. Это гарантирует, что не будет никакого влияния нового трансгенеза на ранее вставленный трансген.
2. Флуоресцентная целая гора на ситу Гибридизация (WISH) В сочетании с иммуностоингом
- Фиксация образцов
- Сбор эмбрионов переходной инъекции или стабильной трансгенной линии IL-34, которая пересекалась с Tg (mpeg1: GFP) на желаемых стадиях.
ПРИМЕЧАНИЕ: Для этого случая эмбрионы были собраны при 4 d после оплодотворении (dpf). (При необходимости) удалите хор шприц шприцем. - Исправить эмбрионы с 4% параформальдегида (PFA) на ночь при температуре 4 кв или 2 ч при комнатной температуре (RT) (около 25 градусов по Цельсию).
- Вымойте эмбрионы с фосфатами буферного солья плюс Tween 20 (PBST) 3x 5 мин.
- Обезвоживать эмбрионы отдельно с 50% метанола в PBST (50% метанол / PBST) и 100% метанола, 1x 5 мин каждый. Затем переоденьте на свежий 100% метанол и храните при -20 градусов по Цельсию (не менее 2 ч).
ПРИМЕЧАНИЕ: Протокол можно приложить здесь.
- Сбор эмбрионов переходной инъекции или стабильной трансгенной линии IL-34, которая пересекалась с Tg (mpeg1: GFP) на желаемых стадиях.
- Гибридизация зонда (День I)
- Увлажните эмбрионы в предыдущих шагах с 50% метанолом в PBST (50% метанол / PBST), затем мыть с PBST 3x 5 мин.
- Дайджест эмбрионов с протеиназа K в PBST на RT (окончательная концентрация: 10 мкг/мл; 1:2000 в PBST).
ПРИМЕЧАНИЕ: Время пищеварения зависит от стадии эмбрионов: менее 36 ч после оплодотворения (hpf), нет необходимости; 36 л.с. 2 dpf эмбриона, 3-5 мин; 2-3 dpf эмбриона, 10 мин; 3-4 dpf эмбриона, 15 мин; 4-5 dpf эмбриона, 15-20 мин; 5-6 dpf эмбриона, 20-27 мин; 6 dpf эмбриона, 25-30 мин на RT (около 25 градусов по Цельсию). - Откажитесь от раствора пищеварения и выполнить фиксацию снова с 4% PFA, в течение 20 минут на RT.
- Вымойте эмбрионы с PBST 2x 10 мин.
- Откажитесь от PBST, выполните предварительную гибридизацию с нагретым буфером гибридизации (HB буфер) при 65 градусах По Цельсия в течение 5 минут, утилизировать буфер HB в исходную трубку.
- Выполните предварительную гибридизацию с новым нагретым буфером HB при уровне 65 градусов по Цельсию по крайней мере 1 ч.
- Предварительно нагреть зонд9 (для этого случая был зонд il34, 1 ng/mL) на 65 c по крайней мере 10 min. Затем переработать буфер HB в исходную трубку. Выполните гибридизацию с предварительно нагретым зондом при 65 градусах Цельсия в одночасье.
- Лечение антителами (День II)
- Предварительно нагреть 50% формамид/2x солен натрия цитрат плюс Tween 20 (SSCT), 2x SSCT, 0.2x SSCT при 65 градусах По Цельсия.
- Утилизировать зонд в исходную трубку и хранить зонд при -20 градусов по Цельсию.
- Вымойте эмбрионы отдельно с 50% формамида/2x SSCT; 2x SSCT; 0.2x SSCT, 3x 20 мин или 2x 30 мин каждый при 65 градусах По Цельсию.
- Вымойте эмбрионы с PBST 3x 5 мин.
- Блокируйте образцы с 600 злителком блокирующего буфера (5% фильтрованную сыворотку крупного рогатого скота плода (FBS) в PBST) на 1 ч на RT.
- Добавьте 400 зл антител Anti-digoxigenin-HRP (1:1,000-1:2,000 в блокирующий буфер) и инкубировать эмбрионы при 4 градусах Цельсия за одну ночь. Если сигналы слабы, используйте 1:500 разбавления антител.
- Окраска и первичное инкубирование антител (День III)
- Удалите антитела; мыть эмбрионы с PBST, 6x 20 мин на RT.
- Промыть образец с 30 зл 1x Плюс Усиление Разбавитель в течение 5 минут на RT.
- Отбросьте разбавив разбавив трубацией; разбавлять флюорофор тирамид ный запас решение (Cyanine 3 Плюс усиление реагент (Cy3) или Cyanine 5 Плюс усиление реагент (Cy5), для этого случая Cy3 был использован) 1:50 в 1x Plus Усиление Диалюент, чтобы сделать флюорофор тирамид Рабочее решение. Подготовьте 50-100 л рабочего раствора для каждого образца.
- Инкубировать образец в флюорофоре Тирамид Рабочее решение в течение 5-15 мин в темноте на RT. Если сигналы слабы, утяните время инкубации до 30 мин.
- Остановите реакцию, изменив рабочее решение с помощью PBST и изучите сигналы.
- Вымойте эмбрионы с PBST 3x 10 мин на RT.
- Инкубировать образец с первичными антителами при 4 градусах Цельсия в одночасье. В этом случае используйте антитела Коза-Анти-GFP в качестве основного антитела.
- Вторичное окрашивание антител (День IV)
- Вымойте эмбрионы с PBST в течение 4x 30 мин.
- Инкубировать эмбрионы вторичными антителами при 4 градусах Цельсия в течение ночи. Для этого случая используйте антитела Alexa 488-Anti-Goat в качестве вторичного антитела.
- Сфотографируйте (День V)
- Вымойте эмбрионы с PBST 3x 10 мин на RT.
- Храните эмбрионы в 70% глицерола в темноте при 4 градусах Цельсия на ночь или -20 градусов по Цельсию дольше.
3. Live Изображений
-
Выбор примеров
ПРИМЕЧАНИЕ: Используйте живое изображение, чтобы непосредственно наблюдать ли макрофаги Tg (fabp10a: il34; fabp10a: DsRed; mpeg1: GFP) рыба будет мигрировать в печень под IL-34 индукции в течение 3-3,5 dpf. Здесь Tg (fabp10a-DsRed)трансгенная линия используется для обозначения области печени и сделать ее видимой, чтобы облегчить локализацию печени и определить, мигрируют ли макрофаги в печень. Перед визуализацией используйте флуоресцентный микроскоп для выбора двойных положительных эмбрионов DsRed и GFP. -
Установка рыбы
- Используйте металлическую ванну для нагрева 1 мл 1% низкой плавления агарозы выше 90 градусов по Цельсию, чтобы полностью расплавить его.
- После низкого плавления агарозы охлаждается до температуры тела, добавьте 50 л 0,2% трикаина и равномерно смешать трикаин с агарозой.
- Переместите обезболированные эмбрионы в небольшое блюдо, установленное с крышкой слайдна на дне, удалить окружающую воду, медленно падение низкого плавления агарозы на эмбрионы, тщательно установить положение рыбы до агарозы затвердевает, держать область печени близко к крышка слайд на дне блюда.
- После низкого плавления агарозы затвердевает, тщательно покрыть его другим слоем агарозы, чтобы укрепить его.
- Поместите блюдо на конфокальный микроскоп несущий стол, накройте рыбу раствором E210 с трикаином и начните визуализацию.
-
Программное обеспечение работы конфокального микроскопа
- Откройте программное обеспечение zen black 2.3, установите рабочую скамейку для живых клеток на таблицу носителя микроскопа.
- Нажмите Найдите-сайт Инкубация Температура, чтобы установить температуру до 29 градусов по Цельсию.
- Поместите блюдо в центр живой рабочей скамейке клетки, накройте рыбу раствором E210 с трикаином.
- Нажмите меню Приобретения, выберите необходимый режим сканирования и лазеры в меню Smart Setup, а затем выберите меню «Стек» и «Позиция».
- Нажмите меню Experiment Designer, выберите Включить Multi Block Эксперимент, в первом блоке, чтобы найти образец под низким увеличением, а затем переключиться на высокое увеличение, пусть наблюдаемая область в центре поля зрения.
- Установите позицию и информацию о Стеке, выберите соответствующую интенсивность лазера, слои сканирования и скорость изображения.
- Создайте новый блок и повторите вышеперечисленные шаги. После настройки всех блоков установите соответствующее количество петель и начните запись(рисунок 1).
Результаты
Шаги, участвующие в протоколе зебры, иллюстрируются на рисунке 2. Во-первых, мы создали pBLK-fabp10a-il34-sv40 конструкции, в которой il34 был обусловлен fabp10a промоутер (Рисунок 2). Конструкция была микровведена в одноклеточную стадию Tg (mpeg1: GFP) эмбрионы зебры, которые могут маркировать макрофаги с эмбрионами GFP и WT, которые были подняты для взрослых для создания трансгенной стабильной линии (Рисунок 2). Выражение il34 было проанализировано целым плапотя флуоресценции на месте гибридизации(Рисунок 2 и Рисунок 3). Макрофаги, помеченные GFP, были проанализированы иммуностоингом(рисунок 2 и рисунок 3). Мы использовали живое изображение, чтобы непосредственно наблюдать ли макрофаги будут мигрировать в печень под индукцией il34 в течение 3-3,5 dpf(Рисунок 2, Рисунок 4, Дополнительный фильм 1 и дополнительный фильм 2) .
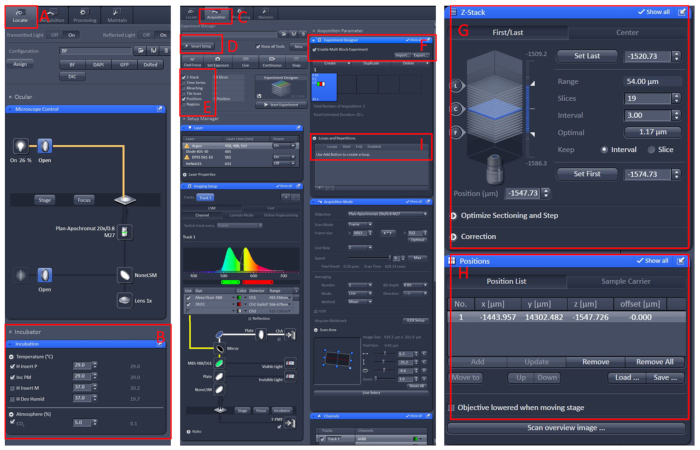
Рисунок 1: Программное обеспечение работы конфокального микроскопа живой визуализации. Откройте программное обеспечение для черных 2.3, установите рабочую скамейку для живых клеток на таблицу носителя микроскопа, а затем нажмите Locate (A) Инкубация Температура воздуха (B)установить температуру до 29 градусов по Цельсию. Поместите блюдо в центр живой рабочей скамейке клетки, накройте рыбу раствором E210 с трикаином. После всех этих, нажмите На приобретение (C) меню, выберите необходимый режим сканирования и лазеры в меню Smart Setup (D), а затем выберите - Стек и позиция (E). Наконец, нажмите на меню Experiment Designer (F), выберите Включани Multi Block Experiment, в первом блоке, чтобы найти образец под низким увеличением, затем переключитесь на высокое увеличение, пусть наблюдаемая область в центр поля зрения, установите положение и информацию о Ги Н, выберите соответствующую интенсивность лазера, сканирующие слои и скорость изображения. Создайте новый блок и повторите вышеперечисленные шаги. После настройки всех блоков установите соответствующее количество петель(I)и начните запись. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
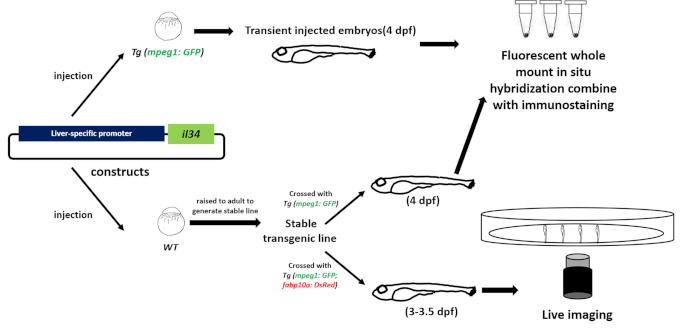
Рисунок 2: Рабочий процесс для изучения функции хемокина на миграции макрофагов in vivo. Мы построили ткани конкретных (печень) переэкспрессии плазмы для переэкспресса IL-34 и вводили плазмид в одноклеточной стадии трансгенных эмбрионов рыб, макрофаги которых были специально помечены флуоресцентным белком (Tg: (mpeg1: GFP )). Инъекционные эмбрионы WT были подняты для создания стабильной трансгенной линии. Затем мы использовали целые флуоресцентные установки на месте гибридизации и иммуно-стинеризм для обнаружения модели экспрессии гена и количество или расположение макрофагов переходных инъекционных эмбрионов или стабильных эмбрионов линии (4 dpf). Наконец, мы использовали конфокальные живые изображения для непосредственного наблюдения за поведением макрофагов в стабильной трансгенной рыбе (3-3,5 dpf) для изучения функции ИЛ-34 на макрофагах in vivo. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
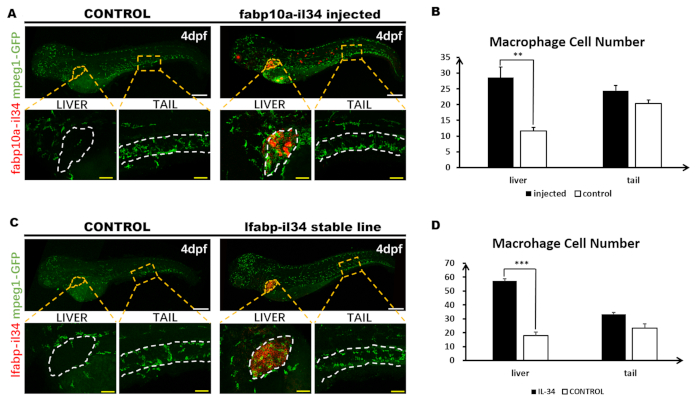
Рисунок 3: Флуоресцентные WISH в сочетании с иммуностоингом. Эта цифра была изменена из Цзян и др.11. В общей сложности 1,8 нл (30 нг /Л) конструкции pBLK-fabp10a-il34-sv40 была микроинъекционирована в одноклеточную стадию Tg (mpeg1: GFP) эмбрионов зебры. (A) WISH выражения il34 (красный) и цельномонтаж антитела окрашивания выражения GFP (зеленый) в 4 dpf эмбриона (6x). Все тело изображение рыбы состоит из двух отдельных изображений, сделанных confocal и сшитые вместе в Photoshop. Вставками являются высокое увеличение (20x) соответствующих коробок регионов (оранжевые пунктирные области). (B) Количественный анализ номеров макрофаговных клеток в невпрядемых и построить вводили эмбрионов печени (показано в белой пунктирной области) и хвостовой области (примерно между 13-м и 17-м сомита, показано между двумя белыми пунктирными линиями). Данные были проанализированы тестом Mann Whitney U, п.л.; 0,01 по сравнению с управлением. n No 5, 5 для 4 dpf вводили и контролировать рыбу. Бары: 200 мкм (белая линия); 50 мкм (желтая линия). (C) WISH выражения il34 и цельномонтаж антитела окрашивания экспрессии GFP в 4 dpf стабильной линии эмбриона (6x). Все тело изображение рыбы состоит из двух отдельных изображений, сделанных confocal и сшитые вместе в Photoshop. Вставками являются высокое увеличение (20x) соответствующих коробок регионов (оранжевые пунктирные области). (D) Количественный анализ номеров макрофаговных клеток в Tg (mpeg1: GFP)и Tg (fabp10a: il34; mpeg1: GFP)печень эмбрионов (показано в белой пунктирной области) и хвостовой области (примерно между 13-й и 17-й сомит, показанный между двумя белыми пунктирными линиями). Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
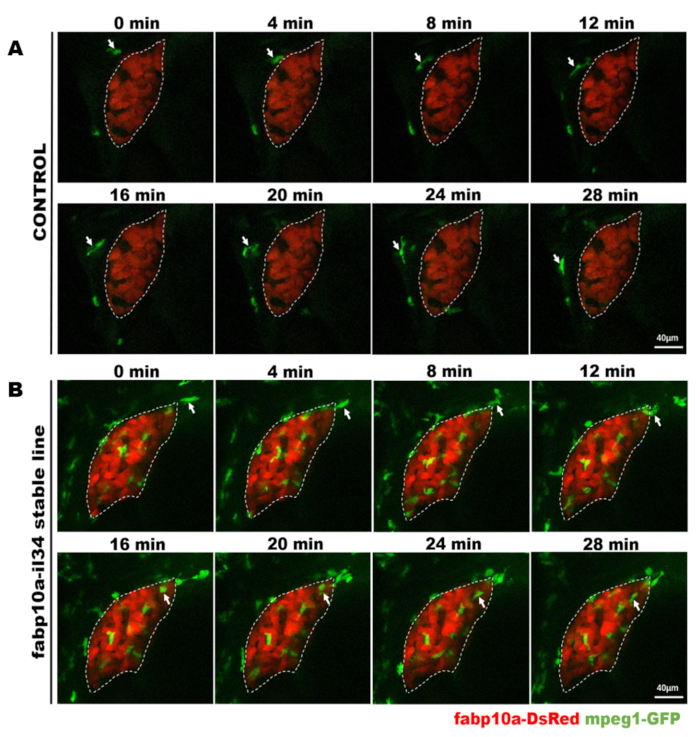
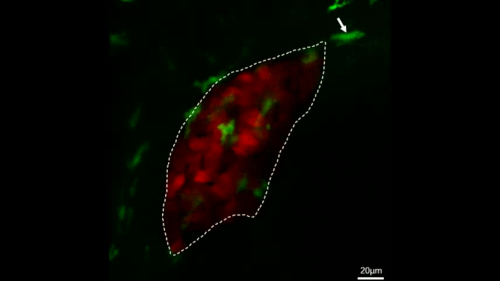
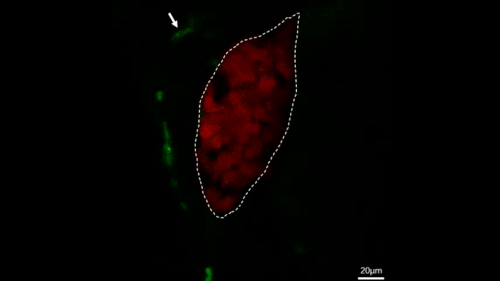
Рисунок 4: Конфокальные живые изображения непосредственно наблюдать макрофагов поведение в стабильной трансгенной рыбы. Эта цифра была изменена из Цзян и др.11. Микрографы живой визуализации показывают процесс макрофага (зеленый, помеченный белыми стрелками), проходящих мимо печени (красный) в течение 28 минут в контроль рыбы (A) и процесс макрофаг (зеленый, помечены белыми стрелками) мигрируют в печень (красный) в течение 28 мин в Ил-34 переэкспрессии рыбы (B). Шкала баров 40 мкм (белая линия). Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
Дополнительный фильм 1: Live изображения, показывающие процесс макрофагов (зеленый, помечены белыми стрелками) мигрируют в печень (красный) в течение 2 ч в IL-34 overexpressing рыбы. Шкала баров 20 мкм (белая линия). Этот фильм был переиздан из Цзян и др.11. Пожалуйста, нажмите здесь, чтобы посмотреть это видео. (Право нажмите, чтобы скачать.)
Дополнительный фильм 2: Live изображений, показывающих процесс макрофагов (зеленый, помечены белыми стрелками) блуждающих вокруг печени (красный) в течение 2 ч в контроль рыбы. Шкала баров 20 мкм (белая линия). Этот фильм был переиздан из Цзян и др.11. Пожалуйста, нажмите здесь, чтобы посмотреть это видео. (Право нажмите, чтобы скачать.)
Обсуждение
Описанный здесь протокол позволяет исследовать функцию хемокина о поведении макрофагеина vivo и процедура требует некоторых технических знаний. Таким образом, существует несколько важных шагов, чтобы избежать осложнений в протоколе: 1) выбрать подходящую трансгенную линию, которая показывает специфический и сильный трансгенный сигнал для обозначения ячейки интереса; 2) выбрать соответствующую ткань, которая доступна для визуализации и трансгенной экспрессии генов; 3) сделать чувствительный и специфический зонд RNA; 4) выберите соответствующее время наблюдения, чтобы точно захватить поведение ячейки.
В процедуре целой флуоресценции на месте гибридизации в сочетании с иммуностоингом, РНК-зонд, используемый для обнаружения экспрессии генов, должен быть чувствительным, и сигнал должен быть достаточно сильным. Для того, чтобы захватить функцию гена на поведение клеток, ряд точек времени должны быть проверены. Например, при наблюдении влияния il34 на миграцию макрофагов, хотя промоутер fabp10a начал выражаться при 2-3 dpf, накопление макрофагов в печени в то время было неочевидным. Только к 4 дпфу становится очевидным обогащение макрофагов в печени. Кроме того, после гибридизации на месте, интенсивность сигнала последующего иммуностоинга будет затронута. Например, по сравнению с GFP, DsRed трудно окрасить в иммунофлуоресцентное окрашивание после гибридизации на месте, вероятно, из-за различных белковых структур. Вообще говоря, интенсивность сигнала иммуностоинга после целой флуоресценции на месте гибридизации будет меньше, чем у одного иммуносохранения.
В шаге живой визуализации с конфокальным микроскопом, необходимо держать образец близко к нижней части блюда. Когда эмбрионы плавают в агарозе, рабочая дистанция цели может быть недостаточной, также агароз между целью и образцом повлияет на качество визуализации. Кроме того, количество образцов для визуализации в каждое время должно быть установлено должным образом. Нужно убедиться, что промежуток времени между двумя сканами каждой рыбы не будет слишком долго, чтобы потерять детали поведения клеток. Так что этот метод не подходит для отслеживания клеток, которые быстро перемещаются в толстых тканях.
В заключение, этот протокол может быть использован для наблюдения за функцией хемокинов на поведение различных клеток, таких как макрофаги, нейтрофилы и Т-клетки. Здесь мы использовали IL-34, недавно идентифицированный лиганд функции CSF-1R в химиотаксисе6,7, в качестве эктопического выраженного хемокина, чтобы вызвать миграцию макрофагов. Большинство существующих экспериментальных моделей клеточного хемотаксиса основаны на экспериментах в пробирке, но эксперименты в пробирке иногда слишком просты для моделирования сложной среды in vivo. Кроме того, трудно изображение химио-притяжения способность vivo, когда просто смотреть на in vitro ситуации. Этот метод использовал специфические преимущества зебры для прямого наблюдения поведения клетки который трудн для мышей. Нынешний метод позволил нам быстро проверить функции хемокина на поведении клеток в течение нескольких дней и сделать зебры мощной моделью для изучения молекулярной и клеточной биологии.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Мы благодарим д-ра Jingrong Пэн для обмена Tg (fabp10a: DsRed) трансгенной линии; Д-р Зилонг Вэнь для обмена Tg (mpeg1: GFP) трансгенных линий; Д-р Коити Каваками за предоставление вектора pTol2. Эта работа была поддержана Национальным фондом естественных наук Китая (31771594), проектами научно-технического плана Гуандун (2019A030317001) и Фондами фундаментальных исследований для центральных университетов (D2191450).
Материалы
| Name | Company | Catalog Number | Comments |
| Antibody | |||
| Alexa 488-Anti-Goat antibody | Invitrogen | A11055 | |
| Anti-Digoxigenin-HRP | perkinelmer | NEF832001EA | |
| Goat-Anti-GFP antibody | Abcam | ab6658 | |
| Reagent | |||
| CaCl2· 2H2O | Sigma | 21097 | |
| Cyanine 3 Plus Amplification Reagent | perkinelmer | NEL745001KT | |
| E2 solution | 15 mM NaCl +0.5 mM KCl +1.0 mM MgSO4+150 µM KH2PO4 + 50 µM Na2HPO4 +1.0 mM CaCl2 + 0.7 mM NaHCO3 | ||
| Fetal Bovine Serum (FBS) | Life | 10099-133 | |
| Formamide | Diamond | A100314 | |
| Glycerol | Sigma | V900860 | |
| Heparin sodium | Sigma | H3149 | |
| Hybridization buffer(HB) | 50% formamide+ 5×SSC+9 mM sodium citrate+50 μg/ml heparin sodium+ 500 μg/mL tRNA+ 0.1% Tween20 | ||
| KCl | Sigma | P5405 | |
| KH2PO4 | Sigma | P5655 | |
| Low melting agarose | Sigma | A9414 | |
| Methanol | GHTECH | 1.17112.023 | |
| Methylene blue | Sigma | M9140 | |
| MgSO4 | Sigma | M2643 | |
| Na2HPO4 | Sigma | S5136 | |
| NaCl | Sigma | S5886 | |
| NaHCO3 | Sigma | S5761 | |
| Paraformaldehyde (PFA) | Sigma | 158127 | Suspend 16 g of PFA in 400 ml of 1x PBS, heat at 60 °C to dissolve about 30 min. This solution can be prepared in advance and stored at -4 °C. Caution. Manipulate with mask. |
| 10×PBS | 14.2 g Na2HPO4+80 g NaCl+2 g KCl+ 2.4 g KH2PO4 in 1L ddH2O | ||
| Phenylthiourea (PTU) | Sigma | P7629 | |
| 1×Plus Amplification Diluent | perkinelmer | NEL745001KT | |
| Proteinase K | Fermentas | E00492 | |
| 20×Saline sodium citrate(SSC) | 175.3 g NaCl+ 88.2 g sodium citrate in 1 L ddH2O, PH 7.0 | ||
| Sodium citrate | Sigma | A5040 | |
| Tricaine | Sigma | E10521 | |
| tRNA | Sigma | R6625 | |
| Tween20 | Sigma | P2287 | |
| Plasmid | |||
| pBLK-fabp10a-il34-sv40 | For Tg (fab10a:il34) transgenic line generation | ||
| pBSK-il34 | For il34 probe preparation | ||
| Fish | |||
| Tg (mpeg1: GFP) | Label macrophages with GFP | ||
| Tg (fabp10a: DsRed) | Label liver cells with DsRed | ||
| Tg (fab10a:il34) | Over-expression IL-34 in liver cells |
Ссылки
- Howe, K., et al. The zebrafish reference genome sequence and its relationship to the human genome. Nature. 496 (7446), 498-503 (2013).
- Wang, Y., et al. IL-34 is a tissue-restricted ligand of CSF1R required for the development of Langerhans cells and microglia. Nature Immunology. 13 (8), 753-760 (2012).
- Lin, H., et al. Discovery of a cytokine and its receptor by functional screening of the extracellular proteome. Science. 320 (5877), 807-811 (2008).
- Wei, S., et al. Functional overlap but differential expression of CSF-1 and IL-34 in their CSF-1 receptor-mediated regulation of myeloid cells. Journal of leukocyte biology. 88 (3), 495-505 (2010).
- Etienne, D., Foucher, S. B. L. P., Norbert Ifrah, P. G. Y. D. IL-34 Induces the Differentiation of Human Monocytes into Immunosuppressive Macrophages. Antagonistic Effects of GM-CSF and IFNc. PLoS One. 8 (2), e56045 (2013).
- Segaliny, A. I., et al. Syndecan-1 regulates the biological activities of interleukin-34. Biochimica et Biophysica Acta. 1853 (5), 1010-1021 (2015).
- Zhou, S. L., et al. miR-28-5p-IL-34-macrophage feedback loop modulates hepatocellular carcinoma metastasis. Hepatology. 63 (5), 1560-1575 (2016).
- Gordon, J. I., et al. Tissue specific expression and developmental regulation of two genes coding for rat fatty acid binding proteins. Journal of Biological Chemistry. 260 (4), 1995-1998 (1985).
- Westerfield, M. . The Zebrafish Book: A Guide for the Laboratory Use of Zebrafish (Danio rerio). , (2000).
- Nüsslein-Volhard, C., Dahm, R. . Zebrafish: a practical approach. , (2002).
- Jiang, Y., Chen, J., Yen, K., Xu, J. Ectopically Expressed IL-34 Can Efficiently Induce Macrophage Migration to the Liver in Zebrafish. Zebrafish. 16 (2), 165-170 (2019).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены