Method Article
כימוקין חוץ רחמי ביטוי מודל לבדיקת גיוס מקרופאג ב Vivo
In This Article
Summary
כדי לבדוק את ההשפעה של כימוקין על גיוס מקרופאג ב vivo, את כל הר היברידיזציה באתרו שימש כדי לזהות את הביטוי החוץ רחמי של כימוקין, וכתמים חיסוני שימש תוויות מקרופאגים. הדמיה חיה שימש התבוננות בזמן אמת של הגירה מקרופאג.
Abstract
זברפיש משמשים רבות במחקר בסיסי וביורפואי. קווים הטרנסגניים רבים הזמינים כעת כדי לתייג סוגים שונים של תאים. בשל הגוף עובריים שקוף של דג zebrafish, זה נוח לנו ללמוד את ההשפעה של כימוקין אחד על ההתנהגות של סוג מסוים של תאים בvivo. כאן סיפקנו זרימת עבודה כדי לחקור את הפונקציה של כימוקין על הגירה מקרופאג ב vivo. בנינו ביטוי מופרז רקמות מוגזם כדי overexpression IL-34 והזריק את הפלבאמצע לתוך השלב תא אחד העוברים דגים מקרופאגים שסומנו במפורש על ידי חלבון פלורסנט. לאחר מכן השתמשנו פלואורסצנט הר שלם ב היברידיזציה באתרו ו חיסוני כדי לזהות את התבנית של הביטוי כימוקין ואת מספר או מיקום של מקרופאגים. עוברי WT מוזרק הועלו כדי ליצור קו טרנסגניים יציב. בסופו של דבר, השתמשנו קונפוקלית וקד חי הדמיה כדי להתבונן ישירות התנהגות מקרופאג בדגים טרנסגניים יציבה כדי ללמוד את הפונקציה של IL-34 על מקרופאגים ב vivo.
Introduction
Zebrafish הוא קטן טרופי קשה עצמות מתוקים דגים מקורו בהודו. בנוגע לשימור הגנים, יש דמיון של 87% לאדם1. זה יכול לספק לנו תובנות על נושאים קשורים של בני אדם על ידי לימוד רגולציה גנים, חלבון תפקוד והתנהגות התא כגון הגירה, הפצת et.al ב zebrafish. העובר מדגים ניתן להשתמש כדי להתבונן התפתחות של עוברים מוקדם בשלבים שונים לאחר פיגמנט מעכב. בינתיים, זה לוקח רק שלושה חודשים כדי להתפתח בגרות מינית, אז דג הדגים יכול לייצר מאות ביצים כל 4 ימים. מיני גודל, רבייה פשוטה, קיבולת הרבייה חזקה, יתרונות אלה להפוך תרבות דג זברה מאוד חיסכון בחלל, תורם לתרבות בקנה מידה גדול. העכבר מודל היונקים המסורתי יש עלויות תחזוקה גבוהה יותר מאשר zebrafish, ולכן הגבלת היקף העלאת העכבר. בהיבט של התפתחות העובר המוקדם, העובר העכבר קשה להתבונן במצב חי בשל מאפייני התפתחות העובר העכבר ברחם האם. להיפך, עוברי דג מפתחים מבחוץ ושקופים, לכן קל להתבונן מתחת למיקרוסקופ. יתר על כן, דג זברה הוא קל מאוד לבנות מגוון של קווים טרנסגניים למחקר הקשורים לפונקציות גן. כיום, קווים טרנסגניים שונים הניתנים להוספת תוויות לסוגים שונים של תאים. זה מאוד נוח עכשיו לבנות קווים טרנסגניים כדי overexpress נוגדנים במיקומים ספציפיים וללמוד את הפונקציה נוגדנים על התנהגות התא ב-zebrafish.
כאן, סיפקנו זרימת עבודה כדי להשתמש בשורה הטרנסגניים של הדגים כדי לחקור את הפונקציה של IL-34 על התנהגות מקרופאג ב vivo2,3,4,5,6,7. ראשית, אנו בנינו ביטוי מופרז של הכבד היתר פלבאמצע של הגן il34 והזריק את הפלבאמצע לשלב של תא אחד Tg (MPEG1: gfp) עוברי דגים אשר במפורש מתויג מקרופאגים על ידי חלבון פלורסנט gfp. אז, השתמשנו פלורסנט כל הר באתרו היברידיזציה החיסונית כדי לזהות את התבנית של הביטוי il34 ואת מספר או מיקום של מקרופאגים. עוברי WT מוזרק הועלו כדי ליצור קו טרנסגניים יציב. בשלבים אלה, הקמנו ובנו אימות של קו הייצור cytokine ויזואלית העריכו את ההשפעות שניתן לראות על התפלגות מקרופאג. לבסוף, כדי לחקור התנהגות מקרופאג בתגובה cytokine, השתמשנו הדמיה חיה קונפוקלית וקד להתבונן ישירות מקרופאג הגירה כדי לאשר את הפונקציה של il34 על הגירה מקרופאג בvivo.
Protocol
הערה: כל הדגימות טופלו על ידי פנילטימאוראה (PTU) מי ביצים כדי לעכב פיגמנט.
1. יצירת מבנים Tg (fabp10a: il34) והזרקת דגים
- לשכפל את 2.8 kb fabp10a יזם8 ו-IL-34 באזורי הקידוד (ensdart 00000126460.3) של דג דג זברה לתוך וקטור pTol2 כדי ליצור את fabp10a il34 בניית. הכנס את המבנה לשלב האחד של התאים Tg (mpeg1: gfp) ו WT של העוברים והדגים יחד עם הטרנספזדאז mrna. העלה את fabp10a-il34 הזריק העוברים WT למבוגר9 ולזהות את המייסד הטרנסגניים על ידי היברידיזציה באתרו.
הערה: ההזרקה של Tol2 לבנות ישירות לתוך טרנסגניים אחרת יכול להיות בעייתי אם הקו השני הטרנסגניים נעשה עם אותו מערכת טרנספסון. תרגול כללי יהיה ליצור קו טרנסגניים בלתי תלוי ולאחר מכן לחצות את הקו החדש עם קו אחר של כתב. דבר זה מבטיח שלא יהיו השפעות של הטרנסגנזה החדשה על-ידי העברה שנוספה בעבר.
2. הר פלורסנט שלם באתרו היברידיזציה (מאחל) לשלב עם כתמים חיסוני
- קיבוע דגימה
- לאסוף עוברים של הזרקה ארעית או יציבה IL-34 העברת קו שחצה עם Tg (mpeg1: GFP) בשלבים הרצויים.
הערה: עבור מקרה זה, העוברים נאספו ב 4 הפריה פוסט מימדית (dpf). (אם יש צורך) להסיר את chorion על ידי מזרק. - לתקן את העוברים עם 4% פאראפורמלדהיד (בכיתה) ב -4 ° צ' או 2 h בטמפרטורת החדר (RT) (כ-25 ° c).
- לשטוף את העוברים עם מלוחים באגירה פוספט בתוספת רצף 20 (PBST) 3x 5 דקות.
- הדהים את העוברים בנפרד עם 50% מתנול ב-PBST (50% מתנול/PBST) ו 100% מתנול, 1x 5 דקות כל אחד. לאחר מכן, לשנות את 100 טרי% המתנול ו לאחסן ב-20 ° צ' (לפחות 2 h).
הערה: הפרוטוקול יכול להיות מושהה כאן.
- לאסוף עוברים של הזרקה ארעית או יציבה IL-34 העברת קו שחצה עם Tg (mpeg1: GFP) בשלבים הרצויים.
- הכלאה בדיקה (יום I)
- העברה מחדש של העוברים בשלבים הקודמים עם 50% מתנול ב PBST (50% מתנול/PBST), ולאחר מכן לשטוף עם PBST 3x 5 דקות.
- לעכל את העוברים עם פרוטאינאז K ב PBST at RT (ריכוז סופי: 10 μg/mL; 1:2000 ב PBST).
הערה: זמן העיכול תלוי בשלב העוברים: פחות מ 36 h לאחר הפריה (hpf), אין צורך; 36 hpf-2 dpf העובר, 3-5 דקות; 2-3 dpf העובר, 10 דקות; 3-4 dpf העובר, 15 דקות; 4-5 dpf העובר, 15-20 דקות; 5-6 dpf העובר, 20-27 דקות; > 6 dpf העובר, 25-30 דקות at RT (כ 25 ° c). - התעלם מפתרון העיכול ובצע את הקיבעון שוב עם 4% לפחות, עבור 20 דקות ב-RT.
- לשטוף את העוברים עם PBST 2x 10 דקות.
- להיפטר PBST, לבצע טרום היברידיזציה עם מאגר היברידיזציה מחומם (HB מאגר) ב 65 ° c עבור 5 דקות, למחזר את מאגר HB לתוך השפופרת המקורית.
- בצע טרום היברידיזציה עם מאגר HB מחומם חדש ב 65 ° c לפחות 1 h.
- לפני החום החללית9 (עבור המקרה הזה היה il34 בדיקה, 1 ng/ML) ב 65 ° c לפחות 10 דקות. לאחר מכן מחזר את מאגר ה-HB לתוך השפופרת המקורית. לבצע הכלאה עם המקדח מחומם מראש ב 65 ° c בלילה.
- נוגדן טיפול (יום II)
- מחממים את 50% בתוספת העירוי/2x מלוחים נתרן ציטראט ועוד רצף 20 (SSCT), 2x SSCT, 0.2 x SSCT ב 65 ° c.
- למחזר את המקדח לתוך הצינור המקורי ולאחסן את הגשוש ב-20 ° c.
- שטוף את העוברים בנפרד עם 50% טופסSSCT; 2x SSCT; 0.2 x SSCT, 3x 20 דקות או 2 x 30 דקות כל אחד ב 65 ° c.
- לשטוף את העוברים עם PBST 3x 5 דקות.
- לחסום את הדגימות עם 600 μL של חסימת מאגר (5% סרום העובר מסוננים (FBS) ב PBST) עבור 1 h ב RT.
- להוסיף 400 μL של אנטי digoxigenin-HRP הפתרון הנוגדן (1:1000-1:2000 במאגר חסימת) ו הדגירה של העוברים ב 4 ° c לילה. אם אותות חלשים, להשתמש 1:500 דילול של נוגדן.
- צביעה ונוגדן ראשי הדגירה (יום III)
- להסיר את הנוגדן; לשטוף את העוברים עם PBST, 6x 20 דקות ב RT.
- לשטוף את המדגם עם 30 μL של 1x פלוס הגברה דילול עבור 5 דקות ב RT.
- להיפטר הדילול על ידי ליטוף; לדלל את Fluorophore מניות הפתרון המלאי (Cyanine 3 פלוס מגיב הגברה (Cy3) או Cyanine 5 פלוס הגברה מגיב (Cy5), עבור מקרה זה Cy3 שימש) 1:50 ב 1x פלוס הגברה מדלל לעשות את Fluorophore הפתרון העבודה. הכינו 50-100 μL של פתרון עבודה עבור כל דוגמה.
- מודטה את המדגם של הפתרון העובד Fluorophore טירמידה עבור 5-15 דקות בחושך ב-RT. אם האותות חלשים, הארך את זמן הדגירה ל-30 דקות.
- עצור את התגובה על ידי שינוי פתרון העבודה עם PBST ובדוק את האותות.
- לשטוף את העוברים עם PBST 3x 10 דקות ב RT.
- מודאת המדגם עם הנוגדן העיקרי ב 4 ° c לילה. במקרה זה, השתמש נוגדן אנטי GFP כמו הנוגדן העיקרי.
- מכתים נוגדן משני (יום IV)
- לשטוף את העוברים עם PBST עבור 4x 30 דקות.
- מודיית את העוברים עם נוגדן משני ב 4 ° c לילה. במקרה זה, להשתמש באלקסה 488-נוגדן נגד עז כמו הנוגדן המשני.
- צלם תמונות (יום חמישי)
- לשטוף את העוברים עם PBST 3x 10 דקות ב RT.
- לאחסן את העוברים ב 70% גליצרול בחשיכה ב -4 ° c ללילה או-20 ° צ' למשך זמן רב יותר.
3. הדמיה חיה
-
בחירת דוגמה
הערה: השתמש בתמונה חיה כדי להתבונן ישירות אם מקרופאגים של Tg (fabp10a: Il34; fabp10a: dsred; mpeg1: gfp) דג היה להגר לתוך הכבד תחת IL-34 אינדוקציה במהלך 3-3.5 dpf. כאן קו הטרנסגניים Tg (Fabp10a-dsred) משמש כדי לתייג את אזור הכבד ולהפוך אותו לגלוי, כדי להקל על לוקליזציה של הכבד כדי לקבוע אם מקרופאגים להגר לתוך הכבד. לפני הדמיה, השתמש במיקרוסקופ פלואורסצנטית כדי לבחור את ה-DsRed ו-GFP כפול עוברים חיוביים. -
הרכבה על דגים
- השתמש באמבט מתכת כדי לחמם 1 מ ל של 1% ההיתוך נמוך התכה עד מעל 90 ° צ' כדי להמיס לחלוטין את זה.
- לאחר המסת ההיתוך נמוכה הוא מקורר טמפרטורת הגוף, להוסיף 50 μL של 0.2% tricaine, ו לערבב אחיד tricaine עם agarose.
- הזיזו את העוברים הכהקטנים לצלוחית קטנה שנטענה עם שקופית כיסוי בתחתית, הסירו את המים שמסביב, הורידו לאט את האגקם הנמוך הנמס על העוברים, הציבו בזהירות את מיקום הדג לפני שהאגקם מתחזק, שמרו על אזור הכבד קרוב ל שקופית הכיסוי בתחתית המנה.
- לאחר המסת ההיתוך נמוך הוא מתחזק, בזהירות לכסות את זה עם שכבה נוספת של agarose כדי לחזק אותו.
- מניחים את המנה על השולחן המוביל במיקרוסקופ, כיסו את הדג בפתרון E210 עם tricaine והתחלת הדמיה.
-
הפעלת תוכנה של המיקרוסקופ הקונקלית
- פתח את התוכנה זן שחור 2.3 , להתקין את העבודה התא חי על הטבלה נושאת המיקרוסקופ.
- לחץ על אתר | דגירה | טמפרטורה לקביעת טמפרטורה 29 ° c.
- מניחים את המנה במרכז העבודה של התא החי, כיסו את הדג בפתרון E210 עם טריקיין.
- לחצו על תפריט הרכישה , בחרו במצב הסריקה הנדרש ולייזרים בתפריט ' הגדרה חכמה ', ולאחר מכן בחרו Z-מחסנית ומיקום.
- לחץ על תפריט מעצב הניסוי , בחר באפשרות הפעל ניסוי בלוק מרובה, בבלוק הראשון, כדי למצוא את המדגם תחת ההגדלה הנמוכה, ולאחר מכן עבור להגדלה הגבוהה, הנח לאזור הנצפה במרכז השדה החזותי.
- הגדר את מידע המיקום וערימת ה-Z, בחר את עוצמת הלייזר המתאימה, סריקת שכבות ומהירות הדמיה.
- צור בלוק חדש וחזור על השלבים שלעיל. לאחר הגדרת כל הבלוקים, להגדיר את המספר המתאים של לולאות ולהתחיל הקלטה (איור 1).
תוצאות
השלבים המעורבים בפרוטוקול הדגים מאוירים באיור 2. ראשית, יצרנו את pBLK-fabp10a-il34-sv40 המבנה שבו il34 היה מונע על ידי היזם fabp10a (איור 2). המבנה היה microinjected לתוך תא אחד בשלב Tg (mpeg1: gfp) דג זברה עוברים אשר יכול לתייג מקרופאגים עם עוברי gfp ו WT אשר הועלו למבוגרים כדי ליצור קו יציב טרנסגניים (איור 2). הביטוי של il34 נותחו על ידי הזריחה כל הר היברידיזציה באתרו (איור 2 ואיור 3). מקרופאגים המסומנים על ידי GFP נותחו על ידי מכתים (איור 2 ואיור 3). השתמשנו הדמיה חיה כדי להתבונן ישירות אם מקרופאגים היו להגר לתוך הכבד תחת il34 אינדוקציה במהלך 3-3.5 dpf (איור 2, איור 4, המשלים סרט 1 ו סרט משלים 2) .
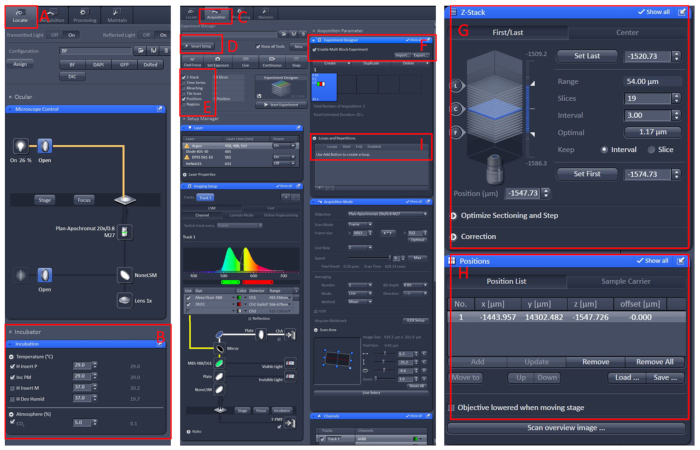
איור 1: הפעלת תוכנה של הדמיה של המיקרוסקופ הקונמוקד. פתח את התוכנה זן שחור 2.3 , להתקין את העבודה התא החי על הטבלה נושאת המיקרוסקופ, ולאחר מכן לחץ על לאתר (א) | דגירה | טמפ ' (ב) לכוון את הטמפרטורה ל -29 ° c. מניחים את המנה במרכז העבודה של התא החי, כיסו את הדג בפתרון E210 עם טריקיין. לאחר כל אלה, לחץ על תפריט רכישה (C), בחר את מצב הסריקה הנדרש ולייזרים בתפריט התקנה חכמה (D), ולאחר מכן בחר Z-מחסנית ומיקום (E). לבסוף, לחץ על תפריט מעצב הניסוי (F), בחר את האפשרות הפעל ניסוי בלוק מרובה, בבלוק הראשון, כדי למצוא את המדגם תחת ההגדלה הנמוכה, ולאחר מכן עבור להגדלה הגבוהה, הנח לאזור הנצפה ב מרכז השדה החזותי, הגדר את המיקום ואת המידע של מחסנית Z (G ו- H), בחר את עוצמת הלייזר המתאימה, סריקת שכבות ומהירות הדמיה. צור בלוק חדש וחזור על השלבים שלעיל. לאחר הגדרת כל הבלוקים, הגדר את המספר המתאים של לולאות (I) והתחל להקליט. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
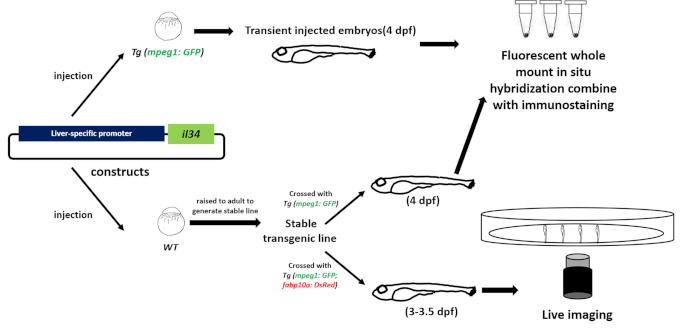
איור 2: זרימת עבודה לחקור את הפונקציה של כימוקין על הגירה מקרופאג ב vivo. בנינו הרקמה הספציפית (כבד) overexpression יטוי מופרז כדי overexpression IL-34 והזריק את הפלביניים לתוך השלב תא אחד העוברים דגים אשר מקרופאגים שסומנו במפורש על ידי חלבון פלורסנט (Tg: (mpeg1: gfp )). עוברי WT מוזרק הועלו כדי ליצור קו טרנסגניים יציב. לאחר מכן השתמשנו פלואורסצנט הר שלם ב היברידיזציה באתרו ו חיסוני כדי לזהות את התבנית של ביטוי הגנים ואת מספר או מיקום של מקרופאגים של העוברים הזריקו חולף או העוברים קו יציב (4 dpf). בסופו של דבר, השתמשנו קונפוקלית וקד חי הדמיה כדי להתבונן ישירות התנהגות מקרופאג בדגים הטרנסגניים יציבה (3-3.5 dpf) כדי ללמוד את הפונקציה של IL-34 על מקרופאגים ב vivo. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
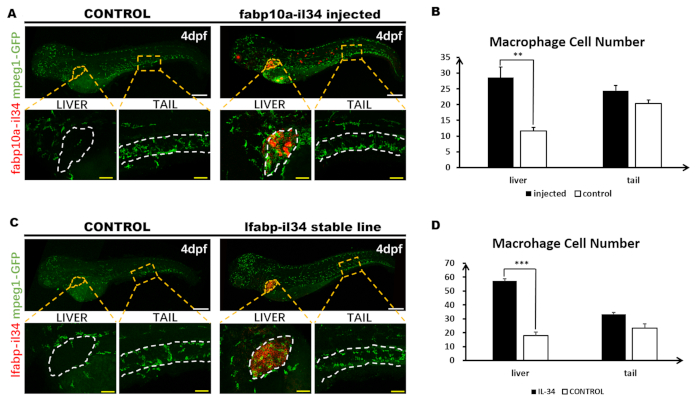
איור 3: משאלה פלורסנט לשלב עם כתמים חיסוני. דמות זו שונתה מ-ג'יאנג ואח '11. סך של 1.8 nL (30 ng/μL) של מבנה pBLK-fabp10a-il34-sv40 היה microinjected לשלב של תא אחד Tg (mpeg1: GFP) עוברי דג. (A) הרצון של il34 ביטוי (אדום) ו-הר הנוגדן כתמים של ביטוי gfp (ירוק) ב 4 dpf העובר (6x). כל תמונת הגוף של הדג מורכבת משתי תמונות נפרדות שצולמו על ידי קונפוקלית וקד ותפורות יחד ב-Photoshop. מערכות insets הן הגדלה גבוהה (20x) של האזורים הסגורים המתאימים (אזורים כתומים מנוקדים). (ב) ניתוח כמותי של מספרי תאים מקרופאג בלתי מוזרק ובניית העוברים המוזרקים (המוצג באזור המנוקד הלבן) ובאזור הזנב (בערך בין הסוניט ה -13 ל -17, המוצג בין שני קווים מנוקדים לבנים). הנתונים נותחו על ידי מבחן מאן ויטני U, * * p < 0.01 לעומת שליטה. n = 5, 5 על הזרקת הדגים המוזרקים והשולטים 4. סורגים: 200 יקרומטר (קו לבן); 50 יקרומטר (הקו הצהוב). (ג) המשאלה של ביטוי il34 ו-הר הנוגדן כתמים של ביטוי gfp ב 4 העובר יציב קו יציבה (6x). כל תמונת הגוף של הדג מורכבת משתי תמונות נפרדות שצולמו על ידי קונפוקלית וקד ותפורות יחד ב-Photoshop. מערכות insets הן הגדלה גבוהה (20x) של האזורים הסגורים המתאימים (אזורים כתומים מנוקדים). (ד) ניתוח כמותי של מספרי תאים מקרופאג ב- tg (mpeg1: Gfp) ו- tg (fabp10a: il34; mpeg1: gfp) העוברים (מוצג באזור המנוקד הלבן) ובאזור הזנב (בערך בין ה -13 והסומניט ה -17, המוצג בין שני קווים מנוקדים לבנים). אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
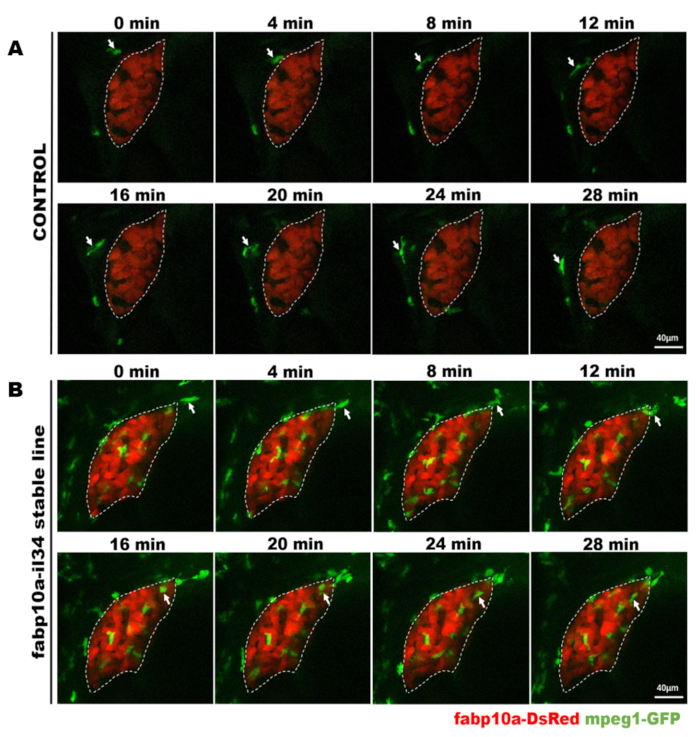
איור 4: הדמיה מרכזית לחיות כדי להתבונן ישירות בהתנהגות מקרופאג בדגי הטרנסגניים היציבים. דמות זו שונתה מ-ג'יאנג ואח '11. מיקרוגרפים של הדמיה חיה להראות את התהליך של מקרופאג (ירוק, המסומן על ידי חיצים לבנים) עובר על ידי הכבד (אדום) בתוך 28 דקות של דג שליטה (א) ואת התהליך של מקרופאג (ירוק, המסומן על ידי חיצים לבנים) הגירה לתוך הכבד (אדום) בתוך 28 מינימום ב-IL-34 מבטא דגים (ב). קנה מידה ברים = 40 יקרומטר (קו לבן). אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
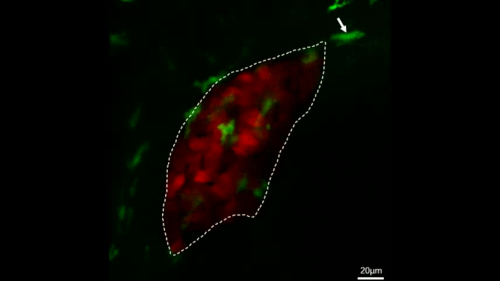
סרט משלים 1: הדמיה חיה המציגה את התהליך של מקרופאגים (ירוק, המסומן על ידי חיצים לבנים) מגירה לתוך הכבד (אדום) בתוך 2 h ב IL-34 מבטא דגים. קנה מידה של סרגלים = 20 יקרומטר (קו לבן). הסרט פורסם שוב מג ואח '11. אנא לחץ כאן כדי לצפות בסרטון וידאו זה. (לחץ לחיצה ימנית להורדה).
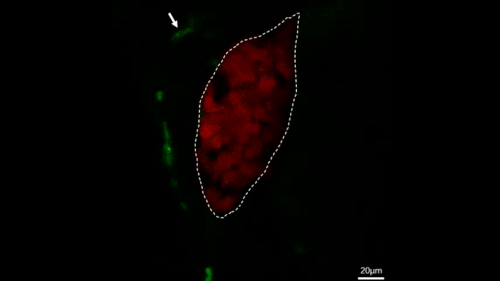
סרט משלים 2: הדמיה חיה המציגה את התהליך של מקרופאגים (ירוק, המסומן על ידי חיצים לבנים) משוטט סביב הכבד (אדום) בתוך 2 h ב דג שליטה. קנה מידה של סרגלים = 20 יקרומטר (קו לבן). הסרט פורסם שוב מג ואח '11. אנא לחץ כאן כדי לצפות בסרטון וידאו זה. (לחץ לחיצה ימנית להורדה).
Discussion
הפרוטוקול המתואר כאן מאפשר לנו לחקור את הפונקציה של כימוקין על ההתנהגות של macrophagein vivo וההליך דורש מומחיות טכנית מסוימת. לסיכום, ישנם מספר שלבים קריטיים כדי למנוע סיבוכים בפרוטוקול: 1) לבחור קו טרנסגניים מתאים אשר מציג אות הטרנסגניים ספציפיים וחזקים כדי לתייג את תא הריבית; 2) לבחור את הרקמה המתאימה אשר נגיש עבור הדמיה של גן ההדמיה הטרנסגניים; 3) להפוך לווין רגיש וספציפי RNA; 4) בחר חלון זמן התבוננות מתאים כדי ללכוד במדויק את התנהגות התא.
בהליך של הר הקרינה הפלואורסצנטית באתרו היברידיזציה בשילוב עם כתמים חיסוני, בדיקה RNA המשמש כדי לזהות ביטוי גנים צריך להיות רגיש האות צריך להיות חזק מספיק. כדי ללכוד את פונקציית הגן על התנהגות התא, יש לבדוק סדרה של נקודות זמן. לדוגמה, בהתבוננות ההשפעה של il34 על מקרופאג הגירה, למרות היזם fabp10a החלה לבטא ב 2-3 dpf, הצטברות מקרופאגים בכבד לא היה ברור באותו זמן. רק על ידי 4 dpf כי העשרת המקרופאג בכבד מתברר. בנוסף, לאחר היברידיזציה באתרו, עוצמת האות של כתמים חיסוני הבאים יושפעו. לדוגמה, השוואת עם GFP, DsRed הוא קשה צבע בתוך הכלאה החיסונית לאחר היברידיזציה באתרו, כנראה בגלל מבני חלבון שונים. באופן כללי, עוצמת האות של הנוגדנים לאחר הזריחה כל הר הכלאה באתרו יהיה פחות מזה של כתמים בודדים חיסוני.
בשלב הדמיה חיה עם המיקרוסקופ קונפוקלית וקד, יש צורך לשמור את המדגם קרוב לתחתית המנה. כאשר העוברים מרחפים בתוך הצמח, מרחק העבודה של המטרה עשוי להיות בלתי מספיק, גם האגקם בין המטרה לבין המדגם ישפיע על איכות ההדמיה. בנוסף, יש להגדיר כראוי את מספר הדגימות עבור הדמיה בכל פעם. יש לוודא שטווח הזמן בין שתי סריקות של כל דג לא יהיה ארוך מכדי לאבד את פרטי התנהגות התא. לכן שיטה זו אינה מתאימה למעקב אחר תאים הזזים מהר ברקמות עבות.
לסיכום, פרוטוקול זה יכול לשמש כדי להתבונן בפונקציה של נוגדנים על התנהגות של מגוון תאים כגון מקרופאגים, נויטרופילים, ו-T-תאים. כאן, השתמשנו IL-34, מזוהה לאחרונה ליגושל הפונקציה 1r שדרתי ב כימוטקאס6,7, כמו כימוקין חוץ רחמי כדי לגרום הגירה מקרופאגים. רוב המודלים הניסיוניים הקיימים של כימוטיוניות התאים מבוססים על ניסויים בתאי מבחנה, אבל בניסויים מחוץ ללפעמים הם פשוטים מדי כדי לדגמן את הסביבה המורכבת בvivo. כמו כן, קשה לצלם את מוקד הכימותרפיה בvivo כאשר פשוט מסתכלים במצב של מבחנה. שיטה זו מנוצל את היתרונות הספציפיים של דג דג זברה להתבוננות ישירה התנהגות התא אשר קשה לעכברים. השיטה הנוכחית אפשרה לנו לבדוק במהירות את הפונקציות כימוקין על התנהגויות תא בתוך מספר ימים ולהפוך מודל רב עוצמה כדי ללמוד את הביולוגיה המולקולרית ואת התא.
Disclosures
. למחברים אין מה לגלות
Acknowledgements
אנו מודים לד ר ג'ינגרן פנג על שיתוף הקו הטרנסגניים של Tg (fabp10a: DsRed) ; ד ר זילונג וון על שיתוף הקווים הטרנסגניים של Tg (mpeg1: GFP) ; ד ר קואיצ'י קווקאמי על אספקת וקטור pTol2. עבודה זו נתמכת על ידי הקרן הלאומית למדע הטבע של סין (31771594), גואנג-דונג מדעי וטכנולוגיה תוכנית פרויקטים (2019A030317001) ואת קרנות המחקר הבסיסי של האוניברסיטאות המרכזיות (D2191450).
Materials
| Name | Company | Catalog Number | Comments |
| Antibody | |||
| Alexa 488-Anti-Goat antibody | Invitrogen | A11055 | |
| Anti-Digoxigenin-HRP | perkinelmer | NEF832001EA | |
| Goat-Anti-GFP antibody | Abcam | ab6658 | |
| Reagent | |||
| CaCl2· 2H2O | Sigma | 21097 | |
| Cyanine 3 Plus Amplification Reagent | perkinelmer | NEL745001KT | |
| E2 solution | 15 mM NaCl +0.5 mM KCl +1.0 mM MgSO4+150 µM KH2PO4 + 50 µM Na2HPO4 +1.0 mM CaCl2 + 0.7 mM NaHCO3 | ||
| Fetal Bovine Serum (FBS) | Life | 10099-133 | |
| Formamide | Diamond | A100314 | |
| Glycerol | Sigma | V900860 | |
| Heparin sodium | Sigma | H3149 | |
| Hybridization buffer(HB) | 50% formamide+ 5×SSC+9 mM sodium citrate+50 μg/ml heparin sodium+ 500 μg/mL tRNA+ 0.1% Tween20 | ||
| KCl | Sigma | P5405 | |
| KH2PO4 | Sigma | P5655 | |
| Low melting agarose | Sigma | A9414 | |
| Methanol | GHTECH | 1.17112.023 | |
| Methylene blue | Sigma | M9140 | |
| MgSO4 | Sigma | M2643 | |
| Na2HPO4 | Sigma | S5136 | |
| NaCl | Sigma | S5886 | |
| NaHCO3 | Sigma | S5761 | |
| Paraformaldehyde (PFA) | Sigma | 158127 | Suspend 16 g of PFA in 400 ml of 1x PBS, heat at 60 °C to dissolve about 30 min. This solution can be prepared in advance and stored at -4 °C. Caution. Manipulate with mask. |
| 10×PBS | 14.2 g Na2HPO4+80 g NaCl+2 g KCl+ 2.4 g KH2PO4 in 1L ddH2O | ||
| Phenylthiourea (PTU) | Sigma | P7629 | |
| 1×Plus Amplification Diluent | perkinelmer | NEL745001KT | |
| Proteinase K | Fermentas | E00492 | |
| 20×Saline sodium citrate(SSC) | 175.3 g NaCl+ 88.2 g sodium citrate in 1 L ddH2O, PH 7.0 | ||
| Sodium citrate | Sigma | A5040 | |
| Tricaine | Sigma | E10521 | |
| tRNA | Sigma | R6625 | |
| Tween20 | Sigma | P2287 | |
| Plasmid | |||
| pBLK-fabp10a-il34-sv40 | For Tg (fab10a:il34) transgenic line generation | ||
| pBSK-il34 | For il34 probe preparation | ||
| Fish | |||
| Tg (mpeg1: GFP) | Label macrophages with GFP | ||
| Tg (fabp10a: DsRed) | Label liver cells with DsRed | ||
| Tg (fab10a:il34) | Over-expression IL-34 in liver cells |
References
- Howe, K., et al. The zebrafish reference genome sequence and its relationship to the human genome. Nature. 496 (7446), 498-503 (2013).
- Wang, Y., et al. IL-34 is a tissue-restricted ligand of CSF1R required for the development of Langerhans cells and microglia. Nature Immunology. 13 (8), 753-760 (2012).
- Lin, H., et al. Discovery of a cytokine and its receptor by functional screening of the extracellular proteome. Science. 320 (5877), 807-811 (2008).
- Wei, S., et al. Functional overlap but differential expression of CSF-1 and IL-34 in their CSF-1 receptor-mediated regulation of myeloid cells. Journal of leukocyte biology. 88 (3), 495-505 (2010).
- Etienne, D., Foucher, S. B. L. P., Norbert Ifrah, P. G. Y. D. IL-34 Induces the Differentiation of Human Monocytes into Immunosuppressive Macrophages. Antagonistic Effects of GM-CSF and IFNc. PLoS One. 8 (2), e56045 (2013).
- Segaliny, A. I., et al. Syndecan-1 regulates the biological activities of interleukin-34. Biochimica et Biophysica Acta. 1853 (5), 1010-1021 (2015).
- Zhou, S. L., et al. miR-28-5p-IL-34-macrophage feedback loop modulates hepatocellular carcinoma metastasis. Hepatology. 63 (5), 1560-1575 (2016).
- Gordon, J. I., et al. Tissue specific expression and developmental regulation of two genes coding for rat fatty acid binding proteins. Journal of Biological Chemistry. 260 (4), 1995-1998 (1985).
- Westerfield, M. . The Zebrafish Book: A Guide for the Laboratory Use of Zebrafish (Danio rerio). , (2000).
- Nüsslein-Volhard, C., Dahm, R. . Zebrafish: a practical approach. , (2002).
- Jiang, Y., Chen, J., Yen, K., Xu, J. Ectopically Expressed IL-34 Can Efficiently Induce Macrophage Migration to the Liver in Zebrafish. Zebrafish. 16 (2), 165-170 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved