Method Article
Гибридная система микроdrive с восстанавливаемым Opto-Silicon зондом и Tetrode для двойной-сайта высокой плотности записи в свободно движущихся мышей
В этой статье
Резюме
Этот протокол описывает конструкцию гибридного массива микропривода, который позволяет имплантировать девять независимо регулируемых тетродов и один регулируемый опитро-кремний зонд в двух областях мозга в свободно движущихся мышах. Также продемонстрирован метод безопасного восстановления и повторного использования опито-кремниевого зонда для различных целей.
Аннотация
Многорегиональные нейронные записи могут предоставить важную информацию для понимания тонковременных взаимодействий между несколькими областями мозга. Тем не менее, обычные конструкции микропривода часто позволяют использовать только один тип электрода для записи из одного или нескольких регионов, ограничивая выход записей одного блока или глубины профиля. Он также часто ограничивает возможность комдота записей с оптогенетическими инструментами для целевой пути и / или типа клеток конкретной деятельности. Представлено здесь гибридный массив микроприводов для свободно движущихся мышей для оптимизации урожайности и описание его изготовления и повторного использования микропривода массива. Текущий дизайн использует девять тетродов и один опто-силиконовый зонд имплантируется в двух различных областях мозга одновременно в свободно движущихся мышей. тетроды и опто-силиконовый зонд независимо регулируются вдоль дорсовентальной оси в головном мозге, чтобы максимизировать выход единицы и колеи. Этот массив микроприводов также включает в себя настройку для света, посредничество оптогенетических манипуляций для изучения региональных или клеточных типов конкретных реакций и функций нейронных цепей дальнего радиуса действия. Кроме того, опто-силиконовый зонд можно безопасно восстановить и повторно использовать после каждого эксперимента. Поскольку массив микроприводов состоит из деталей, напечатанных на 3D-принтере, дизайн микродисков можно легко модифицировать с учетом различных параметров. Первый описан дизайн массива микропривода и как прикрепить оптическое волокно к кремниевому зонду для экспериментов оптогенетики, а затем изготовление тетродерас пучка и имплантации массива в мозг мыши. Запись локальных полевых потенциалов и единицы спайкинга в сочетании с оптогенетической стимуляцией также демонстрирует осуществимость системы микроприводов у свободно движущихся мышей.
Введение
Очень важно понять, как нейронная активность поддерживает когнитивные процессы, такие как обучение и память, исследуя, как различные регионы мозга динамически взаимодействуют друг с другом. Для выяснения динамики нейронной активности, лежащей в основе когнитивных задач, крупномасштабная внеклеточнаяэлектрофизиология была проведена у свободно движущихся животных с помощью микроприводных массивов 1,2,3, 4. В последние два десятилетия, несколько типов микроdrive массив арантом были разработаны для имплантации электродов в нескольких областях мозга для крыс5,6,7,8 и мышей9, 10 Лет , 11 Год , 12. Тем не менее, текущие конструкции микропривода, как правило, не позволяют использовать несколько типов зондов, заставляя исследователей выбирать единый тип электрода с конкретными преимуществами и ограничениями. Например, тетроде массивы хорошо работают для густонаселенных областей мозга, таких как дорсальный гиппокамп CA11,13, в то время как кремниевые зонды дают лучший геометрический профиль для изучения анатомических связей14 , 15.
Тетроды и кремниевые зонды часто используются для хронической записи in vivo, и каждый из них имеет свои преимущества и недостатки. Тетроды, как было доказано, имеют значительные преимущества в лучшей изоляции одного блока, чем одиночные электроды16,17, в дополнение к экономической эффективности и механической жесткости. Они также обеспечивают более высокую урожайность однойединицы деятельности в сочетании с микродисками 8,18,19,20. Важно увеличить количество одновременно зарегистрированных нейронов для понимания функции нейронных цепей21. Например, большое количество клеток необходимо для исследования небольших популяций функционально неоднородных типов клеток, таких как связанные с временем22 или вознаграждение кодирования23 ячеек. Гораздо больше ежеклеток требуется для улучшения качества расшифровки последовательностей шипов13,24,25.
Тетроды, однако, имеют недостаток в записи пространственно распределенных клеток, таких как в коре головного мозга или таламус. В отличие от тетродов, кремниевые зонды могут обеспечить пространственное распределение и взаимодействие локальных полевых потенциалов (LFPs) и пики деятельности в рамках локальной структуры14,26. Multi-хвостак кремния зонды дальнейшего увеличения числа записи сайтов и позволяют записи через отдельные или соседние структуры27. Однако такие массивы менее гибки в позиционировании участков электродов по сравнению с тетродами. Кроме того, в зондах высокой плотности требуются сложные алгоритмы сортировки шипов для извлечения информации о потенциалах действия соседних каналов для отражения данных, полученных тетродами28,29,30. Таким образом, общая доходность отдельных единиц часто меньше, чем тетроды. Кроме того, кремниевые зонды являются невыгодными из-за их хрупкости и высокой стоимости. Таким образом, выбор тетродпротив кремниевых зондов зависит от цели записи, которая заключается в том, является ли получение высокой доходности одноъюмносного или пространственного профилирования на сайтах записи приоритетом.
В дополнение к записи нейронной активности, оптогенетические манипуляции стал одним из наиболее мощных инструментов в неврологии, чтобы изучить, как конкретные типы клеток и / или пути способствуют нейронной цепи функции13,31, 32,33. Тем не менее, оптогенетические эксперименты требуют дополнительного рассмотрения в микроdrive массив астратива для присоединения волокна разъем для стимуляции источников света34,35,36. Часто соединение волоконно-оптической требует относительно большой силы, что может привести к механическому сдвигу зонда в головном мозге. Поэтому совместить имплантируемое оптическое волокно с обычными массивами микроприводов не является тривиальной задачей.
По вышеуказанным причинам исследователи должны оптимизировать выбор типа электрода или имплантировать оптическое волокно в зависимости от цели записи. Например тетроды используются для достижения более высокой урожайности единицы в гиппокампе1,13, в то время как кремниевые зонды используются для исследования ламинаров глубины профиля корковых областей, таких как медиальной энторинальной коры (MEC)37. В настоящее время, микродиски для одновременной имплантации тетродов и кремниевых зондов были зарегистрированы для крыс5,11. Тем не менее, это чрезвычайно сложно имплантировать несколько тетрод и кремниевых зондов в мышей из-за веса микродисков, ограниченное пространство на голове мыши, и пространственные требования для проектирования микропривода использовать различные зонды. Хотя можно имплантировать кремниевые зонды без микропривода, эта процедура не позволяет регулировки зонда и снижает скорость успеха восстановления кремниевого зонда12,38. Кроме того, оптогенетические эксперименты требуют дополнительных соображений при проектировании микроприводных массивов. Этот протокол демонстрирует, как построить и имплантировать микроприводный массив для хронической записи у свободно движущихся мышей, что позволяет имплантировать девять независимо регулируемых тетродов и один регулируемый опитро-кремний зонд. Этот массив микроприводов также облегчает оптогенетические эксперименты и восстановление кремниевого зонда.
протокол
Все методы, описанные здесь, были одобрены Институциональным Комитетом по уходу за животными и использованию (IACUC) Университета Техаса Southwestern Medical Center.
1. Подготовка деталей микроприводного массива
- Печать деталей массива микропривода с помощью 3D-принтера с использованием зубной модели мелины(рисунок 1A,B). Убедитесь, что толщина отдельных 3D печатных слоев составляет менее 50 мкм, чтобы держать небольшие отверстия на печатных частях ясно и жизнеспособно.
ПРИМЕЧАНИЕ: Массив микропривода состоит из пяти частей(Рисунок 1C):(1) основной корпус массива микропривода, который включает в себя девять микроприводных винтов для тетродов и один винт для кремниевого зонда (рисунок1Ca-d). Координация тетрод расслоения и отверстия для опто-силиконового зонда внизу зависит от координат области головного мозга(рисунок1Cd); (2) шаттл, чтобы прикрепить кремниевый зонд или optrode(Рисунок1Ce); (3) зонд электрического разъема крепления для хранения разъема кремниевого зонда(рисунок 1Cf); (4) держатель волокна ferrule который зажимы к центральной части тела для того чтобы предотвратить нежелательные движения имплантированного оптико-силиконового зонда затыкая/отключать разъем оптического волокна(рисунок1Cg); и (5) экранный конус, обеспечивающий физическую и электрическую защиту массива микроприводов для стабильной записи(рисунок 1Ch). Общий вес массива микропривода составляет 5,9 г, включая экранный конус(таблица 1). Если отверстия забиты в печатных частях, просверлить отверстия с помощью сверла бит: #76 для внутренних отверстий и #68 для внешних отверстий для тетрод-микропривод винты, #71 для tetrode микропривод-винт сторонник отверстие, и #77 для отверстий для направляющих столбов в нижней части тела. - Вставка направляющих столбов в корпус массива микропривода.
- Вырежьте два 16 мм длины 26-Ga нержавеющей стали проволоки. Аккуратно оттачивать кончики проводов с помощью вращающейся шлифовальной машины.
- Вставьте провода в нижние отверстия тела(рисунок 2A). Нанесите небольшое количество клея цианоакрилата в нижней части тела, чтобы обеспечить руководство должностей.
2. Подготовка опто-силиконового зонда
- Подготовьте винт микропривода для кремниевого зонда.
ПРИМЕЧАНИЕ: Микроприводный винт для кремниевого зонда состоит из пользовательского винта (300 мкм шаг), поддерживая поддержку трубки, и L-образная трубка (Рисунок 2B).- Подготовка формы для микропривода голову(рисунок 2C). Чтобы построить форму, подготовить 3D-печать пластиковый узор микропривода(рисунок 2Ca). Затем, залить жидкий силиконовый гель после принятия височной стенки, поставив ленты вокруг картины. Удалить пузырьки воздуха, встряхивая осторожно, подождите, пока он вылечить, а затем удалить силиконовый гель формы из шаблона(рисунок 2Cb).
- Вырезать 18 мм и 9,5 мм длины 23 G нержавеющей проволоки с помощью роторной шлифовальной машины. Измельчите верхние 2-3 мм проводов с помощью роторной шлифовальной машины для повышения адгезии акрила зубов.
- Возьмите один пользовательский винт и применить небольшое количество кремниевого масла, чтобы уменьшить трение с акрилом зубов. Установите провода и пользовательский винт к плесени.
- Налейте зубной акрил в форму с помощью шприца для устранения пузырьков воздуха вокруг проводов и винтов. Загрязнение воздушного пузыря сделает микропривод хрупким. Подождите, пока акрил зубов полностью вылечить, а затем снять микропривод винты из формы. Согните 6 мм более длинного кончика провода под углом 60 градусов с помощью плоскогубцев.
- Проверьте качество винтов микропривода (например, трещины, пузырьки воздуха и трение), чтобы повернуть винт. Если есть высокое трение, поверните винт, пока они не станут гладкими с помощью электрического водителя винта с индивидуальным кончиком водителя, который соединяется с микроприводом винта.
- Установите винт микропривода в корпус массива микропривода, чтобы проверить, движется ли он вверх и вниз плавно, поворачивая винт. Нити для винта автоматически создаются при вставке винта в отверстие тела.
- Подготовка шаттла(рисунок 3Aa).
- Вырезать две 5 мм длины полиэтерэктона (PEEK) трубки с помощью острых ножниц. Выровнять трубы с обеих сторон шаттла. Клей трубки и шаттл с использованием эпоксидной смолы.
- Нанесите небольшое количество кремниевого масла на направляющие столбы. Проверьте качество шаттла, вставив на направляющие столбы корпуса микроприводного массива. Убедитесь, что шаттл движется плавно без чрезмерного трения.
- Подготовка оптород(Рисунок 3Ab). Этот шаг можно пропустить, если оптогенетический эксперимент не требуется.
- Расщепляйте оптическое волокно до 21 мм в длину с помощью рубиного резака. Измельчить кончик волокна, чтобы сделать кончик плоским и блестящим.
- Аккуратно поместите оптическое волокно на переднюю сторону кремниевого зонда. Наконечник волокна расположен на 200-300 мкм над верхней частью электродов. Временно удерживайте волокно прозрачной лентой.
- Приклейте оптическое волокно к основанию кремниевого зонда, используя небольшое количество эпоксидной смолы. Подождите, по крайней мере 5 ч, пока эпоксидная кислота полностью вылечить.
ПРИМЕЧАНИЕ: Рекомендуется прикрепить оптическое волокно на той же стороне, что и электродные участки. Прикрепление волокна на задней стороне может предотвратить свет от правильного освещения записи сайтов.
- Прикрепите шаттл к кремниевому зонду(рисунок 3Ac):нанесите небольшое количество эпоксидной смолы в задней части основания кремниевого зонда. Прикрепите нижнюю часть шаттла к основанию кремниевого зонда и осторожно удерживайте в положении 2-3 мин, чтобы избежать образования зазора между шаттлом и базой кремниевого зонда во время первоначального лечения эпоксидной смолы. Подождите, по крайней мере 5 ч, пока эпоксидная кислота полностью вылечить.
- Аккуратно вставьте челночные трубки на направляющие столбы основного тела под микроскопом(рисунок 3B). Во время этой процедуры, удерживайте паз шаттла с тонкими пинцетом.
- Вставьте микропривод-винт в винтовую скважину, повернув винт. Занимайте кремниевый зонд и микропривод-винт, вставив кончик L-образной проволоки в паз головки шаттла(рисунок 3C).
- Прикрепите держатель электрического разъема зонда к корпусу массива микропривода(рисунок 3D).
- Вырезать два винта #0 до 3,5 мм длиной нити. Измельчить советы, чтобы удалить заусенцы.
- Поместите держатель разъема зонда на корпус. Поместите электрический разъем кремниевого зонда в держатель.
- Закрепите разъем кремния зонда в держателе с помощью эпоксидной смолы, и не приклеить его к корпусу массива микропривода, чтобы обеспечить процедуру восстановления кремниевого зонда. Вставьте винты, чтобы держать держатель разъема зонда.
- Прикрепите держатель феррула к опито-кремниевому зонду и корпусу массива микропривода(рисунок 3D).
- Вырезать два винта #0 до 6 мм длиной нити. Измельчить советы, чтобы удалить заусенцы.
- Измельчить за пределами двух #0 винтовка гайки, чтобы сделать небольшие гекс орехи с 2,5-3,0 мм внешнего диаметра, чтобы уменьшить вес и пространство.
- Вставьте винты в компонент А держателя. Клей винт головы с помощью эпоксидной смолы.
- Нанесите небольшое количество кремниевой смазки на компонент A и B, чтобы уменьшить трение с телом. Вставьте компонент А в тело, затем временно удерживайте с помощью обратных пинцетов.
- Поместите компонент B на винты компонента А. Нить настроенных орехов в винты. Используйте плоскогубцы, чтобы затянуть гайки, чтобы обеспечить феррульное держатель на теле.
- Вставьте волокна ferrule в паз волокна ferrule держатель (компонент B). Убедитесь, что волокна ferrule торчит 4-5 мм из держателя.
- Нанесите небольшое количество эпоксидной смолы между феррулем и держателем паз. Подождите, пока эпоксидная кислота полностью вылечится и убедитесь, что ферруле не двигается. Проверьте шаттл и феррульное держатель для плавного движения, ослабив гайки перед поворотом микропривод-винт.
- Проверьте рабочую дистанцию зонда. Убедитесь, что наконечник зонда полностью втягивается в тело, когда держатель феррула находится в верхнем положении, в то время как челночные трубы все еще связаны с направляющими столбами. Максимальное рабочее расстояние определяется длиной силиконового зонда и областью мозга цели.
- Если микропривод-винт свободен, нанесите небольшое количество зубного акрила вокруг винта, чтобы добавить больше нитей для поддержки. Когда он вылечится, поверните винт, чтобы проверить герметичность и стабильность.
3. Тетроде препарат
ПРИМЕЧАНИЕ: Эта процедура похожа на ранее опубликованные статьи8,19,20,39.
- Подготовьте винты микропривода для тетрода. Микропривод для тетрода состоит из винта на заказ и 23 G трубки(рисунок 2B). Эта процедура аналогична разделу 2.1.
- Сделать пучок 30 G трубки из нержавеющей стали, который имеет 5,5 млн проволоки внутри. В этом случае было использовано в общей сложности девять труб 30 G (восемь записывающих тетродов и один эталонный электрод).
- Нить 30 G расслоение из нижней части корпуса привода, и закрепите их с 20 G тонкостенки труб к основному телу. Обрезать нижней части расслоения с роторной шлифовальной машины, чтобы сделать кончик даже и флеш. Обрезать верхнюю часть 30 G труб с роторной шлифовальной машины так, что 30 G трубки торчит около 0,5 мм от основного тела.
- Загрузите 5,5 млн полиимидных изоляционных труб в трубку 30 G. Подготовьте тетроды и загрузите их в 32-канальный электрический интерфейс (EIB). Проверьте электрическую связь с тестером impedance перед окончательным разрезом точности.
- Нижний электрод наконечник impedance до 250-350 кЗ с золотым покрытием раствора. Исправить все тетроды с суперклеем.
- Заполните чрезмерный зазор между полиимидной трубкой и тетрод минеральным маслом для герметизации и смазки. Маршрут наземного провода к ЕИБ.
ПРИМЕЧАНИЕ: При необходимости оптическое волокно может быть интегрировано вдоль тетродовых проводов12.
4. Присоединение защитного конуса
- Краска серебра проводящих экранирования краски на внутренней стороне печатного конуса. Поместите массив микропривода внутри конуса(рисунок 3E).
- Вырезать два винта #0 до 3,5 мм длиной нити. Закрепите винты с внешней стороны конуса, чтобы удерживать массив микропривода на месте.
- Нанесите серебряную краску вокруг винта головой, чтобы электрически соединить экранирование конуса с электрической землей. Проверьте электрическую связь между наземным проводом и конусом. Нанесите небольшое количество эпоксидной смолы между телом массива микропривода и экранным конусом, чтобы надежно прикрепить тело.
ПРИМЕЧАНИЕ: Еще один способ подготовить щито-конус заключается в использовании алюминиевой ленты40 (рисунок 3F). Во-первых, подготовить шаблон бумаги для щито-конуса после прилипания алюминиевой фольги на бумаге(Рисунок 3Fa). Затем свернуть бумагу и прикрепить ее к корпусу микропривода, используя небольшое количество клея цианоакрилата(рисунок 3Fb). Вес этого конуса составляет 0,72 г, а общий вес массива микропривода уменьшается до 4,7 г(таблица1).
5. Имплантная хирургия
ПРИМЕЧАНИЕ: Эта процедура изменена из ранее опубликованных статей18,39,41 для двойной имплантации сайта. Убедитесь, что вес животного составляет более 25 г для микроприводного имплантата для более быстрого восстановления после операции.
- Подготовка
- Для подготовки молотого винта прикрепите серебряную проволоку к черепному винту и нанесите серебряную краску. Затем прикрепите золотую булавку к противоположной стороне провода, используя серебряную краску.
- Подготовьте адаптер диска для удержания массива микропривода к стереотаксическому устройству. Прикрепите мужской разъем к нержавеющей ручке с помощью эпоксидной смолы. Убедитесь, что выравнивание разъема и нержавеющей ручки является прямым.
- В случае, если гистологическое подтверждение необходимо после записи, применить Di-I к тетродам или задней части кремния-зонд38.
- Нижняя кремниевый зонд вниз, чтобы быть желаемой глубины. Освободите гайки держателя феррула с помощью плоскогубцев, опустите кремниевый зонд (опто-кремниевый зонд), повернув микропривод-винт кремниевого зонда, затем закрепите гайки, чтобы обеспечить держатель феррула. При имплантации тетродов в гиппокампе CA1 и кремниевого зонда в MEC расстояние между тетродейной канюлей и наконечником кремниевого зонда составляет 3-4 мм.
- Установите анестезирующую мышь (0,8%-1,5% изолюранивая) в стереотаксическом устройстве. Обезопажие состояние мыши подтверждается отсутствием рефлекса ног и щепотки. Нанесите на глаза чистую мазь, чтобы предотвратить высыхание. Обложка глаза с куском фольги для защиты от сильного хирургического воздействия света.
- Дезинфицировать кожу головы мыши с йодом и изопропанол после бритья меха. Сделайте разрез 1,5-2,0 см на коже головы с помощью стандартных хирургических ножниц, и удалить ткань над черепом с помощью ватных тампонов после подкожного применения лидокаина.
- Выровнять голову мыши со стереотаксическим инструментом. Убедитесь, что разница в высоте между брегма и лямбда составляет менее 100 мкм. Определите место расположения краниотомии с помощью атласа и пометьте эти места стерилизованными карандашами.
- Якорь черепа винты (0,8 мм в диаметре, 0,200 мм нить шаг) путем вращения их 1,5 поворотов (0,3 мм) на черепе, используя хирургические пинцеты и отвертку после бурения 8-11 отверстий в черепе с помощью 0,5 мм сверло бит.
ПРИМЕЧАНИЕ: 2-4 отверстия в лобном черепе, 2-3 отверстия в каждой стороне теменной черепа, и 1-2 отверстия в межпалиетальном черепе предложены. - Прикрепите наземный винт к отверстию, вращая его на один оборот (0,2 мм) после просверливания отверстия в межподерной кости. Убедитесь, что это отверстие не проникает через кость в мозг случае; в противном случае мозжечковые сигналы загрязнят запись. Убедитесь, что импедация составляет менее 20 кЗ на 1 кГц между наземным винтом и черепом винты с помощью impedance метр.
ПРИМЕЧАНИЕ: Более большие impedance причинят введение артефактов движения во время записи. - Выполните краниотомию в отмеченных местах. Дура может быть оставлена нетронутой у мышей.
- Соедините мужской штифт наземного винта и наземный разъем микроприводного массива. Проверьте подключение с помощью счетчика импеданса, измеряя между наземным винтом и экранированием.
- Установите массив микропривода в адаптер, установите его на стереотаксисическое устройство и медленно опустите кремниевый зонд до нужной глубины. Убедитесь, что тетрод пучки находятся над поверхностью мозга, но все еще внутри массива микропривода, когда кремний зонд вставляется в мозг(рисунок 4A).
- Тщательно нанесите кремниевую смазку, чтобы запечатать область кремниевого зонда и тетрод пучка(рисунок 4B). Положите небольшое количество кремниевой смазки на кончике 20 G иглы и применить жир вокруг зондов с помощью иглы. Повторяйте до тех пор, пока кремниевая смазка полностью не покроет область вокруг зонда, чтобы акрил зубов не потечет на или под электродами/зондами. Будьте осторожны, чтобы не позволить жир коснуться электродов сайтов, в противном случае это резко увеличит препятствие записи сайтов.
- Применить акрила для фиксации микропривода массива на якорь винты в черепе.
ПРИМЕЧАНИЕ: Рекомендуется применять акрил зубов в трех слоях, чтобы избежать чрезмерного тепла, вырабатываемого во время лечения акрила. - Тщательно удалите адаптер из массива микроприводов. Вводят 1 мл PBS подкожно для предотвращения обезвоживания. Вводят 5 мг/кг мелоксикама подкожно в качестве обезболиваще.
- Обложка кремниевый зонд разъем кусок ленты, чтобы предотвратить любую грязь от попадания внутрь электрических соединений. Обложка микроприводмассива с помощью пластиковой парафина пленки и ленты его на месте.
- Администрирование надлежащего обезболивающее лечение в течение 3 дней (например, подкожные инъекции 2 мг/кг мелоксикама один раз в день). Разрешить 3-5 дней для восстановления до начала тетрод корректировки. Имплантированная мышь после восстановительного периода показана на рисунке 4C.
6. Восстановление кремниевого зонда (рисунок 4D)
- Вводят кетамин (75 мг/кг) и дексмедетомидин (1 мг/кг) анестезии интраперитонеально и подтвердили отсутствие рефлекса ног и щепотки. Исправить анестезирующую мышь, непосредственно пронизывая 4% параформальдегида через сердце с помощью капюшона. Хирургические методы для грызунов описаны ранее42.
- Освободите гайки держателя феррула с помощью плоскогубца. Затем осторожно переместите его в верхней части тела, повернув регулирующий винт, чтобы полностью втянуть кремниевый зонд внутрь тела массива микропривода. Закрепите гайки, чтобы держать зонд в верхней позиции.
- Возьмите мыши мозга из нижней части, растрескивая череп со стороны. Массив микропривода теперь отделен от животного.
- Полностью удалите L-образный микропривод-винт, который управляет кремниевым зондом. Освободить и вынуть орехи держателя ферруля с помощью плоскогубцев. Вынизвим компонент А держателя феррула.
- Отвинтите разъем зонда крепления и отсоединить от корпуса привода. Убедитесь, что монтирование разъема зонда может оторваться от корпуса массива микропривода.
- Держите верхнюю часть шаттла с помощью пинцета, а затем осторожно сдвиньте сборку кремниевого зонда из массива микропривода.
- Очистите кончик зонда с контактной линзы чище (сначала с ферментом, то 3% перекиси водорода) по крайней мере 1 день. Тщательно протрите наконечник электрода с помощью изопропанола прокладки под микроскопом. Храните зонд в коробке для хранения без статик.
ПРИМЕЧАНИЕ: Шаттл и зонд разъем крепления остаются прикреплены к кремниевый зонд и могут быть повторно использованы в следующей имплантации.
ПРИМЕЧАНИЕ: Некоторые кремниевые зонды не терпимы с перекисью водорода. В этом случае используйте раствор контактных линз, содержащий только протеолитический фермент. - Для повторного использования микроприводного массива тела для следующей операции, удалить акрил зубов с помощью комбинации тонкой наконечник сверла и щипцы. Затем, восстановить черепа винты, погрузив удаленный акрил зубного в ацетон. Обратите внимание, что ацетон растворит пластиковые части массива микропривода.
- Удалите эпоксидную кислоту между телом микропривода и экранируя конус с помощью скальпеля.
ПРИМЕЧАНИЕ: Никакие дополнительные детали не должны быть напечатаны снова для следующей операции, если микропривод не сломан.
Результаты
Микроприводный массив был построен в течение 5 дней. Хронология подготовки микропривода описана в таблице 2. Используя этот микродрайв, девять тетродов и один кремниевый зонд были имплантированы в гиппокампа CA1 и MEC мыши 21 недели старый/29 г массы тела мужского pOxr1-Cre (C57BL/6 фон)», соответственно. Эта трансгенная мышь выражает Cre в слое III MEC пирамидальных нейронов. Мышь была введена с 200 nL AAV5-DIO-ChR2-YFP (титр: 7,7 х 1012 gc/mL) в MEC 10 недель до имплантата электрода. LFPs были записаны с помощью фильтра с низким проходом (1-500 Гц), а спайки были обнаружены с помощью фильтра высокого прохода (0,8-5 кГц). Световая стимуляция (450 нм) была выполнена с использованием 1 мс ширины импульса при интенсивности 10,6 мВт, измеренной в конце разъема волокна. Эталонный электрод для записи тетрода был помещен в белое вещество с помощью выделенного тетроде провода. Ссылка на запись кремниевого зонда была установлена в качестве верхнего канала зонда.
После корректировки тетроде, поведенческая производительность была протестирована на линейной дорожке(рисунок 5A) и в открытом поле (рисунок5B). В обоих экспериментах мышь исследовала свободно в течение 30 мин(рисунок 5Аа, б,c; Рисунок 5Ba,b,c). Электрофизиологические сигналы были успешно записаны без серьезного шума, связанного с движением, на протяжении всего сеанса записи(рисунок 5Ad,e; Рисунок 5 Bd,e). Далее, свет стимуляции была выполнена в MEC, чтобы стимулировать MEC слой III нейронов, которые проектируют на CA143 (Рисунок 6A). Спонтанные пики деятельности(Рисунок 6B, C) и LFPs (Рисунок 6D) были записаны из тетродов и кремния зонда, когда мышь спала. LFPs, зарегистрированные в тетродах, показали большую рябь, что свидетельствует о том, что все тетроды расположены в непосредственной близости от пирамидального клеточного слоя CA1. Светиндуцированные отзывчивые мероприятия были впервые отмечены в MEC, а затем в CA1 с 13-18 мс задержкой(рисунок 6E).

Рисунок 1: Обзор массива microdrive. (A) Вид скелета массива микропривода, со стороны тетроде (а) и кремниевого зонда (b). (B) реальное изображение загруженного массива микроприводов, просматриваемого со стороны тетроде (а) и со стороны кремниевого зонда (b). Массив микропривода размещается на стадии джига в панели (b). (C) Отдельные 3D-печатные микроприводные детали массива. (a-d) Корпус массива микропривода, рассматриваемый с четырех разных углов (a: тетроде вид сбоку; b: вид сбоку кремния-зонда; c: вид сверху; d: вид снизу). Увеличенное представление пунктирной линии в панели (c) отображается на рисунке 2A. e) шаттл, который удерживает и позволяет регулировать кремниевый зонд. Кремниевый зонд крепится на пунктирной линии в панели (e). f) держатель зонда-коннектора, в котором находится 32-канальный кремниевый зонд-разъем. g) держатель волокна ferrule, который держит оптическое ферруле волокна для того чтобы предотвратить от движения зонда затыкая/отключать разъем волокна с свет-источником. Эта часть состоит из двух компонентов: «панель (g) и компоненты A и B. h) печатный экранный конус, который обеспечивает физическую и электрическую защиту при окрашении проводящих материалов. Конус ночлоокно позволяет видеть внутри структуры во время подготовки микроприводного массива, который в конечном итоге покрывается куском ленты или 3D-печатным материалом. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
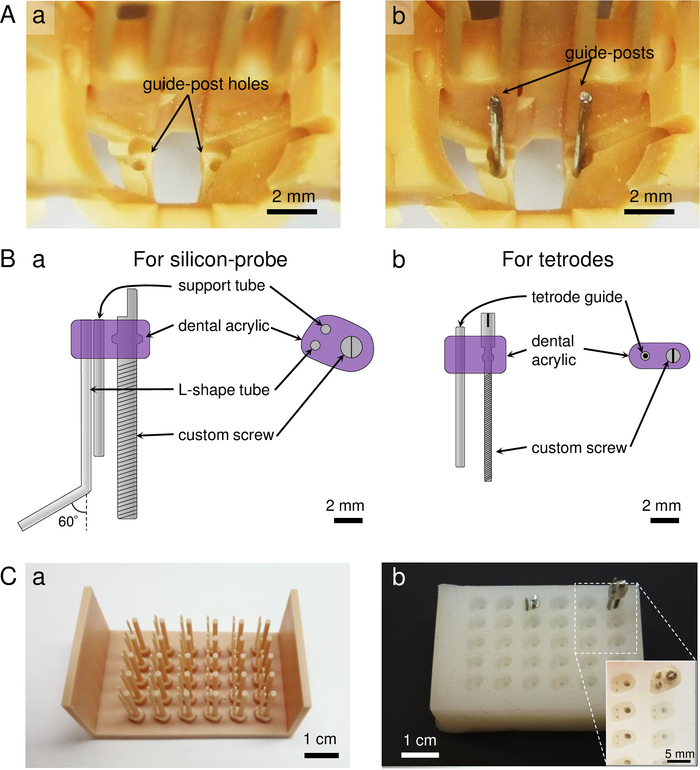
Рисунок 2: Подготовка направляющих столбов и винтов микропривода на основной корпус. (A) Руководство после подготовки. а) Увеличенное представление тела массива микроприводов, показанное на рисунке 1Cc. b) Руководство после вставки в отверстия тела. (B) Конструкции микропривода-винта. а) микропривод-винт для кремниевого зонда, который состоит из 300 мкм шаг пользовательский винт, поддерживающий трубки, и L-образной трубки. b) микропривод-винт для тетрода, который состоит из 160 мкм шаг пользовательский винт и 30 G нержавеющей направляющей трубки. (C) Изготовление верхней части микроприводных винтов: а) Подготовка 3D-печатных узоров антиплезой для микропривода-винта. На рисунке показан аккредитив для кремниевого зонда microdrive-винта. b) плесень, изготовленная с использованием анти-формы шаблона (а) и кремниево-резиновый материал. Собранные микроприводные винты производятся путем вставки пользовательских винтов и проводов/труб, а также заливки акрила зубов в каждом колодце. Вливка: увеличенный вид колодцев плесени. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 3: Сборка массива Microdrive. (A) Подготовка опито-силиконового зонда. а) присоединение двух пластиковых направляющих труб к шаттлу. b) склеивание оптического волокна к кремниевому зонду. c) присоединение шаттла к опито-кремниевому зонду. На этом снимке нижняя часть шаттла (пунктированная линия) прикреплена к основанию кремниевого зонда (б) . Шаттл и хвостовик кремния зонда должны быть параллельно. (B) Загрузка опикремикон-зонд челнока сборки в направляющих столбов микропривода массива тела. (C) Относительное положение микропривода кремниевого зонда, когда зонд полностью втягивается в тело (а) и когда расположен на самом низком уровне в корпусе диска (b). L-образный провод вставляется в паз на шаттле. (D) Взорванный вид держателя волокна феррула и крепления разъема зонда. (E) Прикрепленный щитконус. Проводящий материал окрашен внутри конуса. (F) Альтернативный экранный конус с использованием бумаги и алюминиевой ленты. а) бумага для шаблонов. b) присоединенный альтернативный экранный конус, который уменьшает 1,1 г веса по сравнению с 3D-печатной версией. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 4: Запечатывание зондов во время операции и восстановления кремниевого зонда. (A) Массив микропривода и череп мыши после краниотомии, перед нанесением кремния-смазки. Силиконовый зонд вставляется около 2 мм в мозг в это время. (B) Применение кремниевого жира вокруг кремниевых зондов и тетрод ныхпуки для защиты зондов от зубного акрила. (C) Хронически имплантированная мышь после периода восстановления, когда мышь идет (a), уход (b), и при подключении к записывающему кабелю с противобалансирующей системой шкива (c). (D) Восстановленный кремниевый зонд, до (а) и после (б) погружения в чистящий раствор. Биологические ткани в (a) удаляются после процесса очистки (b). Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 5: Примеры одновременной записи тетрода/кремниевого зонда в гиппокампе CA1 и медиальной энторхинальной коре (MEC) от себя мыши. (A) Запись на линейном треке. а) линейный трек, используемый для перекодирования. b) Траектории исследования мыши в течение 30 минут на трассе. c) Поведенческая производительность на линейном треке. (d-e) Представитель LFP записи из тетрод (d) и кремниевый зонд (e). (B) Запись в открытом поле. a) открытая полевая камера, используемая для кодирования. b) Траектории исследования мыши в течение 30 минут в камере. c) Поведенческая производительность в открытом поле. (d,e) Представитель LFP записи из тетрод (d) и кремниевый зонд (e). Светодиод крепится к головному усилительу для записи положения мыши. Линейная дорожка и камера открытого поля соединены с электрическим грунтом для уменьшения электростатического шума. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
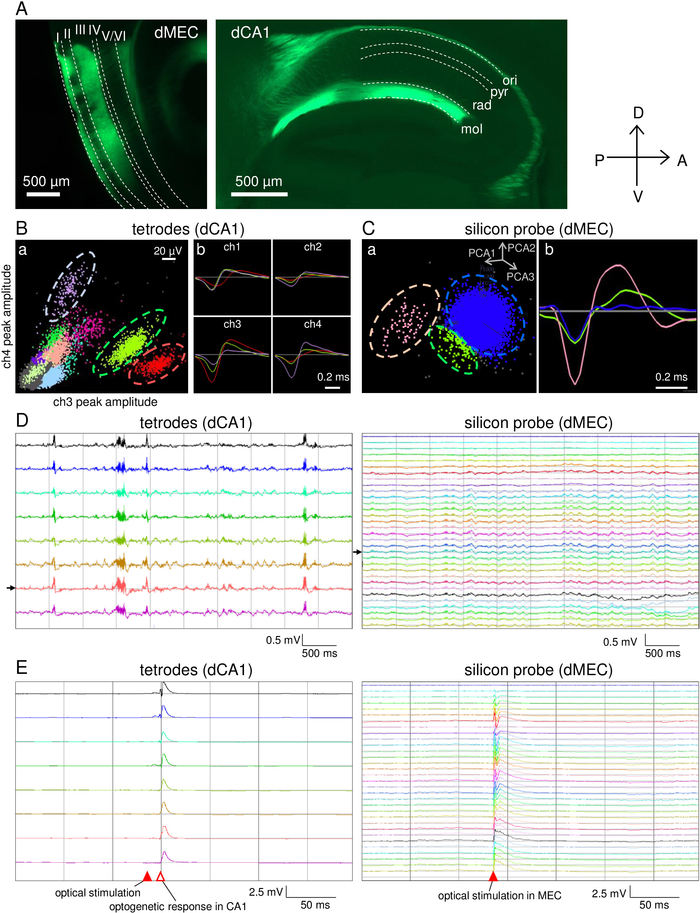
Рисунок 6: Репрезентативные результаты одновременных записей в CA1 и MEC и оптогенетической стимуляции. (A) Выражение AAV5-DIO-ChR2-YFP после 4 недель инъекции. MEC слой III пирамидальных нейронов, которые проектировать свои аксоны из дорсала MEC в дорсальный CA1. Dashed линии: ори, слой oriens; поди, прослойка пирамидальной; рад, слой радиата; mol, слой лачуносума молекулярного. (B) Представитель записи шипа с одного из тетродов. а) 2D кластерные проекции шипов, зарегистрированных с тетрода. b) примеры средней формы волны шипа трех кластеров, которые указываются пунктирными линиями в а). (C) Представитель записи шипа с одного из кремниевых зондов электродов сайтов. а) 2D кластерные прогнозы основных компонентов шипов. b) примеры средней формы волны всплеска трех кластеров. Спайк-кластеры (розовые и зеленые) отделены от шумовых кластеров (синий). Кластеры в (B,C) рассчитываются с использованием программного обеспечения KlustaKwik. (D) Следы спонтанных ЛФП одновременно, записанные из тетродов в CA1 (a) и кремниевого зонда в MEC (b). Черные стрелки указывают на тетрод, показанный в (B) и электроде кремния-зонда, показанном в (C). (E) lfP реагирует на импульсную оптическую стимуляцию (10,6 мВт, 1 мс; заполненную красную наконечник стрелки) из тетродов в CA1 (a) и кремниевый зонд в MEC (b). Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
| граммов/один | Номер | сумма (грамм) | ||
| основное тело | 1.25 | 1 | 1.25 | |
| Трансфер от / до | 0.04 | 1 | 0.04 | |
| зонд разъем крепления | 0.19 | 1 | 0.19 | |
| волокно ferrule держатель | 0.1 | 1 | 0.1 | |
| экранирование конуса | 1.82 | 1 | 1.82 | (0.72)* |
| проводящий пасты | 0.2 | 1 | 0.2 | |
| винт (#00, 2 мм), чтобы держать EIB | 0.05 | 2 | 0.1 | |
| винт машины (#0-80, 3.5 мм) | 0.06 | 4 | 0.24 | |
| винт машины (#0-80, 6mm) | 0.09 | 2 | 0.18 | |
| Гайка | 0.03 | 2 | 0.06 | |
| микропривод (тетрод) | 0.05 | 9 | 0.45 | |
| микропривод (кремний зонд) | 0.29 | 1 | 0.29 | |
| кремниевый зонд | 0.28 | 1 | 0.28 | |
| электрическая интерфейсная доска | 0.6 | 1 | 0.6 | |
| Общая | 5.8 | (4.7)* | ||
Таблица 1: Индивидуальный вес каждой части массива микропривода. Общий вес массива микропривода составил 5,9 г после фиксации защитного конуса эпоксидной смолой (в случае использования альтернативного защитного конуса с использованием бумаги и алюминиевой ленты).
| Процедуры | Время |
| подготовка микропривода | |
| Печать 3D частей | 1 день |
| оптопаная подготовка | |
| Подготовка формы для микропривода голову | 1 день |
| Подготовка головы microdrive | 3 ч |
| Прикрепление оптического волокна | 3 ч |
| Прикрепление шаттла | 3 ч |
| тетрод подготовки | |
| Подготовка формы для микропривода голову | 1 день |
| Подготовка голов microdrive | 3 ч |
| Загрузка тетродовых проводов | 1 день |
| Прикрепление защитного конуса | |
| Картина щито-краска | на ночь» |
| Прикрепление к корпусу микропривода | 3 ч |
| эти процедуры могут проводиться параллельно | |
Таблица 2: Хронология подготовки микропривода. Печать 3D-частей, ожидая лечения силиконовой резины/ зубной акриловой/ эпоксидной, и загрузка тетродовых проводов занимает большую часть времени подготовки микроприводного массива, в общей сложности 4-5 дней.
Дополнительные файлы: Дополнительные файлы включают данные 3D-модели пяти деталей микропривода как в формате .sldprt, так и в формате .stl. Оригинальные файлы 3D-модели были созданы с помощью программного обеспечения Solidworks2003. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
Протокол демонстрирует, как построить и имплантировать гибридный массив микропривода, который позволяет записывать нейронные действия из двух областей мозга с помощью независимых регулируемых тетродов и кремния-зонда в свободно мейков. Он также демонстрирует оптогенетические эксперименты и восстановление кремниевого зонда после экспериментов. В то время как регулируемый кремниевый зонд33 или опто-силиконовый зонд36 имплантации ранее продемонстрированы у мышей, этот протокол имеет явные преимущества в одновременных tetrode массива и опто-силиконовый зонд имплантации, чтобы обеспечить гибкую выбор имплантированных типов зонда. Тип имплантированного зонда может быть переключен в зависимости от цели эксперимента, таких как многохвостые зонды27,44 или ультра-плотности Neuropixels21,45. Координация и угол имплантации7 могут быть легко изменены на стадии проектирования 3D-объекта по мере необходимости. Например, двойной сайт или даже тройной сайт записи возможно во время обучения задач по памяти, связанных с структурами мозга, таких как гиппокамп46, энторинальная кора47, префронтальной коры48, миндалины49, и cingulate коры50.
Существует несколько критических процедур для успешного имплантации и записи. Из-за хрупкости кремниевых зондов, любые механические вибрации или удары на массив микропривода должны быть сведены к минимуму во время сборки. Например, перед загрузкой кремниевого зонда в массив микропривода необходимо завершить вскрытие забитых отверстий с помощью сверла. Кроме того, следует подчеркнуть, чтобы тщательно проверить наземное соединение на каждом шагу во время строительства микропривода массива и имплантата хирургии для обеспечения стабильности записанных данных. Нестабильные или высоко-импедачные соединения с землей вызывают сильный шум и связанные с движением артефакты во время сеанса записи. Для стабильных записей рекомендуется ждать 1-2 недели после операции, чтобы избежать дрейфа электрода, потому что ткань мозга негативно влияет на операцию имплантата. Тем не менее, качество сигнала на кремниевый зонд восстанавливается после 1-2 недель после хирургической травмы на основе предыдущего опыта. Рекомендуется использовать однокорпусное жилье для предотвращения повреждения имплантированного микропривода другими мышами. Для оптогенетического эксперимента, важно отметить, что большинство кремниевых зондов индуцировать фото-артефакты в ответ на свет-стимуляции51, в то время как другие предназначены для минимизации фото-артефакты52 (есть фото-артефакт сокращены кремниевые зонды, которые доступны на коммерческой основе).
Вес массива микроприводов (5,9 г) тяжелее, чем типичные микроприводы, описанные в предыдущих статьях12,53, в основном из-за корпуса массива микропривода (21% от общего веса), экранирования конуса (31%), и металлических деталей (винты и орехи: 22%). Рекомендуется использовать мышей с весом более 25 г (2-3 месяца для мышей C57BL/654,55) для имплантации хирургии, потому что мыши с адекватной массой тела, как правило, восстановить раньше. По этой причине, этот массив микроприводов может быть не лучшим решением для несовершеннолетних мышей. В то время как устройства, которые 5%-10% массы тела мыши часто руководствуются, чтобы быть переносится для имплантатов12,56 (хотя нет поддержки опубликованных данных для этого57), это микропривод массив весит 24% от веса тела 25 г мышей (19% при использовании альтернативного конуса, описанного ниже).
Тем не менее, имплантированные взрослые мыши смогли свободно передвигаться и прыгать в домашних клетках. Мыши, имплантированные с аналогичным весом массива микропривода (4,5 г), ранее были показаны для выполнения поведенческой задачи (линейный лабиринт задачи) даже при ограничении пищи13,17. Недостатком веса не является проблемой при записи, так как противовес балансировки системы18,34,58 или головной убор системы59 будет поддерживать микропривод массива. Кроме того, общий вес массива микроприводов может быть уменьшен за счет снижения высоты или уменьшения толщины щитового конуса и изменения конструкции с использованием меньших винтов.
Используя текущий материал 3D-печати, толщина защитного конуса может быть уменьшена до 0,3 мм (от текущей толщины 0,6 мм). Высота конуса может быть уменьшена на 5 мм до тех пор, пока провода тетрод все еще могут быть покрыты. Воздействие тетродовых проводов приведет к поломке проводов и отказу в длительной записи. Кроме того, подготовка защитного конуса с использованием бумаги и алюминиевой ленты может снизить вес конуса до 0,7 г (15% от общего веса; уменьшена на 20% от общего веса оригинального массива микропривода); хотя, это компромисс с физической силой. Кроме того, размер микропривода (текущий экранирующий конус: 4,2 х 4,0 х 2,6 см. До тех пор, как они предоставляются на полу клетки или от боковины, микропривод не нарушает естественное поведение мышей, таких как еда, питье, уход, воспитание, или гнездования60.
В заключение, этот протокол микроdrive предоставляет исследователям гибкий выбор для записи из нескольких областей мозга в свободно движущихся мышей для понимания динамики и функций длинных нейронных цепей.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Эта работа была частично поддержана Японским обществом содействия научным стипендиям научных исследований (HO), Наделенной стипендией (ТЗ), Программой науки о границах человека (ТЗ), Фондом исследований мозга (ТЗ), Факультетом науки и технологий Приобретение и Приобретение Программа удержания (TK), Фонд исследований мозга и поведения (TK), и Грант исследований Фонда Sumitomo (JY), NARSAD Молодой исследователь исследований Грант (JY). Мы благодарим В. Маркса за ценные замечания и предложения во время подготовки рукописи.
Материалы
| Name | Company | Catalog Number | Comments |
| #00-90 screw | J.I. Morris | #00-90-1/8 | EIB screws |
| #0-80 nut | Small Parts | B00DGB7CT2 | brass nut for holding fiber ferrule holder |
| #0-80 screw | Small Parts | B000FMZ57G | brass machine screw for probe connector mount, fiber ferrule holder, and shielding cone |
| 22 Ga polyetheretherketone tubes | Small Parts | SLPT-22-24 | for attaching to the shuttle, 0.025 inches inner diameter |
| 23 Ga stainless tubing | Small Parts | HTX-23R | for tetrode |
| 23 Ga stainless wire | Small Parts | HTX-23R-24-10 | for L-shape/support wire |
| 26 Ga stainless wire | Small Parts | GWX-0200 | for guide-posts |
| 30 Ga stainless wire | Small Parts | HTX-30R | for tetrode |
| 3-D CAD software package | Dassault Systèmes | SolidWorks 2003 | |
| 3D printer | FormLab | Form2 | |
| 5.5mil polyimide insulating tubes | HPC Medical | 72113900001-012 | |
| aluminum foil tape | Tyco | Tyco Adhesives 617022 Aluminum Foil Tape | for the alternative shielding cone |
| conductive paste | YSHIELD | HSF54 | for shielding cone |
| customized screws for silicon-probe microdrive | AMT | UNM1.25-HalfMoon | half-moon stainless screw, 1.5 mm diameter, 300 µm thread pitch |
| customized screws for tetrode microdrive | AMT | Yamamoto_0000-160_9mm | slotted stainless screw, 0.5 mm diameter, 160 µm thread pitch, custom-made to order for our design |
| dental acrylic | Stoelting | 51459 | |
| dental model resin | FormLab | RS-F2-DMBE-02 | |
| Dremel rotary tool | Dremel | model 800 | a grinder |
| drill bit | Fine Science Tool | 19007-05 | |
| electric interface board | Neuralynx | EIB-36-Narrow | |
| epoxy | Devcon | GLU-735.90 | 5 minutes epoxy |
| eye ointment | Dechra | Puralube Ophthalmic Ointment | to prevent mice eyes from drying during surgery |
| fiber polishing sheet | Thorlabs | LFG5P | for polishing the optical fiber |
| fine tweezers | Protech International | 15-368 | for loading/recovering the silicon probe |
| gold pins | Neuralynx | EIB Pins Small | |
| ground wire | A-M Systems | 781500 | 0.010 inch bare silver wire |
| headstage preamp | Neuralynx | HS-36 | |
| impedance meter | BAK electronics | Model IMP-2 | 1 kHz testing frequency |
| mineral oil | ZONA | 36-105 | for lubricating screws and wires |
| optical fiber | Doric | MFC_200/260-0.22_50mm_ZF1.25(G)_FLT | |
| Recording system | Neuralynx | Digital Lynx 4SX | |
| ruby fiber scribe | Thorlabs | S90R | for cleaving the optical fiber |
| silicon grease | Fine Science Tool | 29051-45 | |
| silicon probe | Neuronexus | A1x32-Edge-5mm-20-177 | Fig. 3, 4A, 4B, 5 |
| silicon probe | Neuronexus | A1x32-6mm-50-177 | Fig. 4C |
| silicon probe washing solution | Alcon | AL10078844 | contact lens cleaner |
| silicone lubber | Smooth-On | Dragon Skin 10 FAST | for preparation of microdrive mold |
| silver paint | GC electronic | 22-023 | silver print II coating, used for ground wires |
| skull screw | Otto Frei | 2647-10AC | 0.8 mm diameter, 0.200 mm thread pitch |
| standard surgical scissors | ROBOZ | RS-5880 | |
| stereotaxic apparatus | Kopf | Model 942 | |
| super glue | Loctite | LOC230992 | for applying to guide-posts |
| surgical tweezers | ROBOZ | RS-5135 | |
| Tetrode Twister | Jun Yamamoto | TT-01 | |
| tetrode wires | Sandvik | PX000004 |
Ссылки
- Wilson, M. A., McNaughton, B. L. Dynamics of the hippocampal ensemble code for space. Science. 261 (5124), 1055-1058 (1993).
- Gothard, K. M., Skaggs, W. E., Moore, K. M., McNaughton, B. L. Binding of hippocampal CA1 neural activity to multiple reference frames in a landmark-based navigation task. The Journal of Neuroscience. 16 (2), 823-835 (1996).
- Keating, J. G., Gerstein, G. L. A chronic multi-electrode microdrive for small animals. Journal of Neuroscience Methods. 117 (2), 201-206 (2002).
- Winson, J. A compact micro-electrode assembly for recording from the freely moving rat. Electroencephalography and Clinical Neurophysiology. 35 (2), 215-217 (1973).
- Michon, F., et al. Integration of silicon-based neural probes and micro-drive arrays for chronic recording of large populations of neurons in behaving animals. Journal of Neural Engineering. 13 (4), 046018 (2016).
- Lansink, C. S., et al. A split microdrive for simultaneous multi-electrode recordings from two brain areas in awake small animals. Journal of Neuroscience Methods. 162 (1-2), 129-138 (2007).
- Billard, M. W., Bahari, F., Kimbugwe, J., Alloway, K. D., Gluckman, B. J. The systemDrive: a Multisite, Multiregion Microdrive with Independent Drive Axis Angling for Chronic Multimodal Systems Neuroscience Recordings in Freely Behaving Animals. eNeuro. 5 (6), (2018).
- Kloosterman, F., et al. Micro-drive array for chronic in vivo recording: drive fabrication. Journal of Visualized Experiments. (26), (2009).
- Lu, P. L., et al. Microdrive with Two Independent Moveable Sets for Wide-Ranging, Multi-Site, Multi-Channel Brain Recordings. Journal of Medical and Biological Engineering. 34 (4), 341-346 (2014).
- Haiss, F., Butovas, S. A miniaturized chronic microelectrode drive for awake behaving head restrained mice and rats. Journal of Neuroscience Methods. 187 (1), 67-72 (2010).
- Headley, D. B., DeLucca, M. V., Haufler, D., Pare, D. Incorporating 3D-printing technology in the design of head-caps and electrode drives for recording neurons in multiple brain regions. Journal of Neurophysiology. 113 (7), 2721-2732 (2015).
- Voigts, J., Siegle, J. H., Pritchett, D. L., Moore, C. I. The flexDrive: an ultra-light implant for optical control and highly parallel chronic recording of neuronal ensembles in freely moving mice. Frontiers in Systems Neuroscience. 7, 8 (2013).
- Yamamoto, J., Tonegawa, S. Direct Medial Entorhinal Cortex Input to Hippocampal CA1 Is Crucial for Extended Quiet Awake Replay. Neuron. 96 (1), 217-227 (2017).
- Schomburg, E. W., et al. Theta phase segregation of input-specific gamma patterns in entorhinal-hippocampal networks. Neuron. 84 (2), 470-485 (2014).
- Fernandez-Ruiz, A., et al. Entorhinal-CA3 Dual-Input Control of Spike Timing in the Hippocampus by Theta-Gamma Coupling. Neuron. 93 (5), 1213-1226 (2017).
- Rey, H. G., Pedreira, C., Quian Quiroga, R. Past, present and future of spike sorting techniques. Brain Research Bulletin. 119 (Pt B), 106-117 (2015).
- Gray, C. M., Maldonado, P. E., Wilson, M., McNaughton, B. Tetrodes markedly improve the reliability and yield of multiple single-unit isolation from multi-unit recordings in cat striate cortex. Journal of Neuroscience Methods. 63 (1-2), 43-54 (1995).
- Yamamoto, J., Wilson, M. A. Large-scale chronically implantable precision motorized microdrive array for freely behaving animals. Journal of Neurophysiology. 100 (4), 2430-2440 (2008).
- Nguyen, D. P., et al. Micro-drive array for chronic in vivo recording: tetrode assembly. Journal of Visualized Experiments. (26), (2009).
- Lu, L., Popeney, B., Dickman, J. D., Angelaki, D. E. Construction of an Improved Multi-Tetrode Hyperdrive for Large-Scale Neural Recording in Behaving Rats. Journal of Visualized Experiments. (135), (2018).
- Jun, J. J., et al. Fully integrated silicon probes for high-density recording of neural activity. Nature. 551 (7679), 232-236 (2017).
- Pastalkova, E., Itskov, V., Amarasingham, A., Buzsaki, G. Internally generated cell assembly sequences in the rat hippocampus. Science. 321 (5894), 1322-1327 (2008).
- Gauthier, J. L., Tank, D. W. A Dedicated Population for Reward Coding in the Hippocampus. Neuron. 99 (1), 179-193 (2018).
- Davidson, T. J., Kloosterman, F., Wilson, M. A. Hippocampal replay of extended experience. Neuron. 63 (4), 497-507 (2009).
- Gerwinn, S., Macke, J., Bethge, M. Bayesian population decoding of spiking neurons. Frontiers in Computational Neuroscience. 3, 21 (2009).
- Sakata, S., Harris, K. D. Laminar structure of spontaneous and sensory-evoked population activity in auditory cortex. Neuron. 64 (3), 404-418 (2009).
- Csicsvari, J., et al. Massively parallel recording of unit and local field potentials with silicon-based electrodes. Journal of Neurophysiology. 90 (2), 1314-1323 (2003).
- Harris, K. D., Quiroga, R. Q., Freeman, J., Smith, S. L. Improving data quality in neuronal population recordings. Nature Neuroscience. 19 (9), 1165-1174 (2016).
- Hilgen, G., et al. Unsupervised Spike Sorting for Large-Scale, High-Density Multielectrode Arrays. Cell Reports. 18 (10), 2521-2532 (2017).
- Rossant, C., et al. Spike sorting for large, dense electrode arrays. Nature neuroscience. 19 (4), 634-641 (2016).
- Iseri, E., Kuzum, D. Implantable optoelectronic probes for in vivo optogenetics. Journal of Neural Engineering. 14 (3), 031001 (2017).
- Klapoetke, N. C., et al. Independent optical excitation of distinct neural populations. Nature Methods. 11 (3), 338-346 (2014).
- Yamamoto, J., Suh, J., Takeuchi, D., Tonegawa, S. Successful execution of working memory linked to synchronized high-frequency gamma oscillations. Cell. 157 (4), 845-857 (2014).
- Rangel Guerrero, D. K., Donnett, J. G., Csicsvari, J., Kovacs, K. A. Tetrode Recording from the Hippocampus of Behaving Mice Coupled with Four-Point-Irradiation Closed-Loop Optogenetics: A Technique to Study the Contribution of Hippocampal SWR Events to Learning. eNeuro. 5 (4), (2018).
- Liang, L., et al. Integrated and Quick-to-Assemble (SLIQ) Hyperdrives for Functional Circuit Dissection. Frontiers in Neural Circuits. 11, 8 (2017).
- Chung, J., Sharif, F., Jung, D., Kim, S., Royer, S. Micro-drive and headgear for chronic implant and recovery of optoelectronic probes. Scientific Reports. 7 (1), 2773 (2017).
- Quilichini, P., Sirota, A., Buzsaki, G. Intrinsic circuit organization and theta-gamma oscillation dynamics in the entorhinal cortex of the rat. The Journal of Neuroscience. 30 (33), 11128-11142 (2010).
- Sauer, J. F., Struber, M., Bartos, M. Recording Spatially Restricted Oscillations in the Hippocampus of Behaving Mice. Journal of Visualized Experiments. (137), (2018).
- Shikano, Y., Sasaki, T., Ikegaya, Y. Simultaneous Recordings of Cortical Local Field Potentials, Electrocardiogram, Electromyogram, and Breathing Rhythm from a Freely Moving Rat. Journal of Visualized Experiments. (134), (2018).
- Brunetti, P. M., et al. Design and fabrication of ultralight weight, adjustable multi-electrode probes for electrophysiological recordings in mice. Journal of Visualized Experiments. 91 (91), e51675 (2014).
- Battaglia, F. P., et al. The Lantern: an ultra-light micro-drive for multi-tetrode recordings in mice and other small animals. Journal of Neuroscience Methods. 178 (2), 291-300 (2009).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of Visualized Experiments. (65), (2012).
- Suh, J., Rivest, A. J., Nakashiba, T., Tominaga, T., Tonegawa, S. Entorhinal cortex layer III input to the hippocampus is crucial for temporal association memory. Science. 334 (6061), 1415-1420 (2011).
- Royer, S., et al. Multi-array silicon probes with integrated optical fibers: light-assisted perturbation and recording of local neural circuits in the behaving animal. The European Journal of Neuroscience. 31 (12), 2279-2291 (2010).
- Steinmetz, N. A., Koch, C., Harris, K. D., Carandini, M. Challenges and opportunities for large-scale electrophysiology with Neuropixels probes. Current Opinion in Neurobiology. 50, 92-100 (2018).
- Jones, M. W., Wilson, M. A. Theta rhythms coordinate hippocampal-prefrontal interactions in a spatial memory task. PLoS Biology. 3 (12), e402 (2005).
- Frank, L. M., Brown, E. N., Wilson, M. A. A comparison of the firing properties of putative excitatory and inhibitory neurons from CA1 and the entorhinal cortex. Journal of Neurophysiology. 86 (4), 2029-2040 (2001).
- Kitamura, T., et al. Eng and circuits crucial for systems consolidation of a memory. Science. 356 (6333), 73-78 (2017).
- McGaugh, J. L., Cahill, L., Roozendaal, B. Involvement of the amygdala in memory storage: interaction with other brain systems. Proceedings of the National Academy of Sciences of the United States of America. 93 (24), 13508-13514 (1996).
- Frankland, P. W., Bontempi, B., Talton, L. E., Kaczmarek, L., Silva, A. J. The involvement of the anterior cingulate cortex in remote contextual fear memory. Science. 304 (5672), 881-883 (2004).
- Mikulovic, S., et al. On the photovoltaic effect in local field potential recordings. Neurophotonics. 3 (1), 015002 (2016).
- Kuleshova, E. P. Optogenetics – New Potentials for Electrophysiology. Neuroscience and Behavioral Physiology. 49 (2), 169-177 (2019).
- Meng, E., Hoang, T. MEMS-enabled implantable drug infusion pumps for laboratory animal research, preclinical, and clinical applications. Advanced Drug Delivery Reviews. 64 (14), 1628-1638 (2012).
- Hu, S., et al. Dietary Fat, but Not Protein or Carbohydrate, Regulates Energy Intake and Causes Adiposity in Mice. Cell Metabolism. 28 (3), 415-431 (2018).
- Yang, Y., Smith, D. L., Keating, K. D., Allison, D. B., Nagy, T. R. Variations in body weight, food intake and body composition after long-term high-fat diet feeding in C57BL/6J mice. Obesity. 22 (10), 2147-2155 (2014).
- Morton, D. B., et al. Refinements in telemetry procedures. Seventh report of the BVAAWF/FRAME/RSPCA/UFAW Joint Working Group on Refinement, Part A. Laboratory Animals. 37 (4), 261-299 (2003).
- Lidster, K., et al. Opportunities for improving animal welfare in rodent models of epilepsy and seizures. Journal of Neuroscience Methods. 260, 2-25 (2016).
- Lin, L., et al. Large-scale neural ensemble recording in the brains of freely behaving mice. Journal of Neuroscience Methods. 155 (1), 28-38 (2006).
- Kislin, M., et al. Flat-floored air-lifted platform: a new method for combining behavior with microscopy or electrophysiology on awake freely moving rodents. Journal of Visualized Experiments. (88), e51869 (2014).
- Gaskill, B. N., Karas, A. Z., Garner, J. P., Pritchett-Corning, K. R. Nest building as an indicator of health and welfare in laboratory mice. Journal of Visualized Experiments. (82), 51012 (2013).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены