Method Article
Hybrid Microdrive System mit wiederherstellbarer Opto-Silikon-Sonde und Tetrode für Dual-Site High Density Recording in frei beweglichen Mäusen
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt die Konstruktion eines Hybrid-Mikroantriebs-Arrays, das die Implantation von neun unabhängig einstellbaren Tetroden und einer einstellbaren Opto-Silizium-Sonde in zwei Hirnregionen in frei beweglichen Mäusen ermöglicht. Ebenfalls demonstriert ist eine Methode zur sicheren Wiederherstellung und Wiederverwendung der Opto-Silizium-Sonde für mehrere Zwecke.
Zusammenfassung
Multiregionale neuronale Aufnahmen können wichtige Informationen liefern, um Interaktionen zwischen mehreren Hirnregionen zu verstehen. Herkömmliche Microdrive-Designs erlauben jedoch oft nur die Verwendung einer Elektrode, um aus einzelnen oder mehreren Regionen aufzunehmen, wodurch die Ausbeute von Einzel- oder Tiefenprofilaufzeichnungen begrenzt wird. Es schränkt auch oft die Fähigkeit ein, Elektrodenaufnahmen mit optogenetischen Werkzeugen zu kombinieren, um Wege und/oder zelltypspezifische Aktivität zu zielen. Hier wird ein Hybrid-Mikrodrive-Array für frei bewegliche Mäuse zur Optimierung der Ausbeute und eine Beschreibung ihrer Herstellung und Wiederverwendung des Microdrive-Arrays vorgestellt. Das aktuelle Design verwendet neun Tetrodes und eine Opto-Silizium-Sonde, die in zwei verschiedenen Gehirnbereichen gleichzeitig in frei bewegliche Mäuse implantiert werden. Die Tetroden und die Opto-Silizium-Sonde sind unabhängig entlang der dorsoventralen Achse im Gehirn einstellbar, um die Ausbeute von Einheiten- und Oszillatoraktivitäten zu maximieren. Dieses Microdrive-Array enthält auch eine Einrichtung für Licht, die optogenetische Manipulation vermittelt, um die regional- oder zelltypspezifischen Reaktionen und Funktionen von langräumigen neuronalen Schaltkreisen zu untersuchen. Darüber hinaus kann die Opto-Silizium-Sonde nach jedem Experiment sicher zurückgewonnen und wiederverwendet werden. Da das Microdrive-Array aus 3D-gedruckten Teilen besteht, kann das Design von Microdrives einfach an verschiedene Einstellungen angepasst werden. Zuerst wird das Design des Microdrive-Arrays beschrieben und wie die optische Faser an eine Siliziumsonde für Optogenetik-Experimente befestigt wird, gefolgt von der Herstellung des Tetro-Bündels und der Implantation des Arrays in ein Maushirn. Die Erfassung lokaler Feldpotentiale und Unit Spiking in Kombination mit optogenetischer Stimulation zeigen auch die Machbarkeit des Microdrive-Array-Systems bei frei beweglichen Mäusen.
Einleitung
Es ist wichtig zu verstehen, wie neuronale Aktivität kognitive Prozesse unterstützt, wie Lernen und Gedächtnis, indem sie untersuchen, wie verschiedene Gehirnregionen dynamisch miteinander interagieren. Um die Dynamik der neuronalen Aktivität, die kognitiven Aufgaben zugrunde liegt, zu klären, wurde eine groß angelegte extrazelluläre Elektrophysiologie bei frei beweglichen Tieren mit Hilfe von Microdrive-Arrays1,2,3, 4. In den letzten zwei Jahrzehnten wurden verschiedene Arten von Mikroantriebs-Arrays entwickelt,um Elektroden in mehrere Hirnregionen für Ratten 5,6,7,8 und Mäuse9zu implantieren. 10 , 11 , 12. Dennoch erlauben aktuelle Microdrive-Designs in der Regel nicht die Verwendung mehrerer Sondentypen, was die Forscher zwingt, einen einzelnen Elektrodentyp mit spezifischen Vorteilen und Einschränkungen zu wählen. Z. B. funktionieren Tetrode-Arrays gut für dicht besiedelte Hirnregionen wie den dorsalen Hippocampus CA11,13, während Siliziumsonden ein besseres geometrisches Profil für die Untersuchung anatomischer Verbindungen bieten14 , 15.
Tetrodes und Siliziumsonden werden häufig für die in vivo chronische Aufzeichnung verwendet, und jede hat ihre eigenen Vor- und Nachteile. Tetrodes haben nachweislich erhebliche Vorteile in einer besseren Einzeleinheitsisolierung als Einzelelektroden16,17, zusätzlich zu Wirtschaftlichkeit und mechanischer Steifigkeit. Sie bieten auch höhere Erträge von Einzeleinheiten-Aktivitäten in Kombination mit Mikroantrieben8,18,19,20. Es ist wichtig, die Anzahl der gleichzeitig aufgezeichneten Neuronen für das Verständnis der Funktion der neuronalen Schaltkreise zu erhöhen21. Beispielsweise wird eine große Anzahl von Zellen benötigt, um kleine Populationen funktionell heterogener Zelltypen zu untersuchen, wie z. B. zeitbezogene22 oder Belohnungscodierung23 Zellen. Viel höhere Zellzahlen sind erforderlich, um die Dekodierungsqualität von Spike-Sequenzen13,24,25zu verbessern.
Tetrodes haben jedoch einen Nachteil bei der Aufzeichnung räumlich verteilter Zellen, z. B. im Kortex oder Thalamus. Im Gegensatz zu Tetroden können Siliziumsonden räumliche Verteilung und Interaktion von lokalen Feldpotentialen (LFPs) und Spiking-Aktivitäten innerhalb einer lokalen Struktur14,26ermöglichen. Mehrschaftige Siliziumsonden erhöhen die Anzahl der Aufnahmestellen weiter und ermöglichen die Aufzeichnung über einzelne oder benachbarte Strukturen27. Solche Arrays sind jedoch weniger flexibel in der Positionierung von Elektrodenstellen im Vergleich zu Tetroden. Darüber hinaus sind komplexe Spike-Sortieralgorithmen in Sonden mit hoher Dichte erforderlich, um Informationen über Aktionspotenziale benachbarter Kanäle zu extrahieren, um die von tetrodes28,29,30erfassten Daten zu spiegeln. Daher ist die Gesamtausbeute einzelner Einheiten oft geringer als tetrodes. Darüber hinaus sind Siliziumsonden aufgrund ihrer Fragilität und hohen Kosten nachteilig. Die Wahl von Tetroden vs. Siliziumsonden hängt also vom Ziel der Aufzeichnung ab, bei der es darum geht, ob die Erzielung einer hohen Ausbeute an Einzeleinheiten oder räumlicheprofilierung an den Aufnahmestellen priorisiert wird.
Neben der Aufzeichnung neuronaler Aktivität ist die optogenetische Manipulation zu einem der leistungsstärkeren Werkzeuge in der Neurowissenschaft geworden, um zu untersuchen, wie bestimmte Zelltypen und/oder -wege zu den neuronalen Schaltkreisfunktionen beitragen13,31, 32,33. Optogenetische Experimente erfordern jedoch zusätzliche Berücksichtigung im Mikroantriebs-Array-Design, um den Faserstecker an Stimulationslichtquellen34,35,36zu befestigen. Oft erfordert die Verbindung von Fiberoptik eine relativ große Kraft, was zu einer mechanischen Verschiebung der Sonde im Gehirn führen kann. Daher ist es keine triviale Aufgabe, eine implantierbare Glasfaser mit herkömmlichen Microdrive-Arrays zu kombinieren.
Aus den oben genannten Gründen sind die Forscher verpflichtet, die Auswahl der Art der Elektrode zu optimieren oder eine optische Faser je nach Ziel der Aufzeichnung zu implantieren. Zum Beispiel werden Tetroden verwendet, um eine höhere Einheitsausbeute im Hippocampus1,13zu erreichen, während Siliziumsonden verwendet werden, um das laminare Tiefenprofil von kortikalen Bereichen zu untersuchen, wie z. B. dem medialen entorhinalen Kortex (MEC)37. Derzeit wurden Mikroantriebe zur gleichzeitigen Implantation von Tetroden und Siliziumsonden für Ratten5,11berichtet. Aufgrund des Gewichts der Mikroantriebe, des begrenzten Platzes auf dem Mauskopf und der räumlichen Anforderungen für die Konstruktion des Mikroantriebs für den Einsatz verschiedener Sonden ist es jedoch äußerst schwierig, mehrere Tetrodes und Siliziumsonden in Mäuse zu implantieren. Obwohl es möglich ist, Siliziumsonden ohne Mikroantrieb zu implantieren, erlaubt dieses Verfahren keine Einstellung der Sonde und senkt die Erfolgsrate der Silizium-Sonde-Rückgewinnung12,38. Darüber hinaus erfordern optogenetische Experimente zusätzliche Überlegungen im Microdrive-Array-Design. Dieses Protokoll zeigt, wie man ein Mikroantriebs-Array für die chronische Aufzeichnung in frei beweglichen Mäusen konstruiert und implantt, das die Implantation von neun unabhängig einstellbaren Tetroden und einer einstellbaren Opto-Silizium-Sonde ermöglicht. Dieses Microdrive-Array erleichtert auch optogenetische Experimente und die Wiederherstellung der Siliziumsonde.
Protokoll
Alle hier beschriebenen Methoden wurden vom Institutional Animal Care and Use Committee (IACUC) des University of Texas Southwestern Medical Center genehmigt.
1. Vorbereitung von Microdrive-Array-Teilen
- Drucken Sie die Microdrive-Arrayteile mit einem 3D-Drucker mit Zahnmodellharz (Abbildung 1A,B). Stellen Sie sicher, dass die Dicke der einzelnen 3D-gedruckten Schichten weniger als 50 m beträgt, um die kleinen Löcher auf den bedruckten Teilen klar und lebensfähig zu halten.
HINWEIS: Das Microdrive-Array besteht aus fünf Teilen (Abbildung1C): (1) der Hauptkörper des Microdrive-Arrays, das neun Mikroantriebsschrauben für Tetrodes und eine Schraube für eine Siliziumsonde enthält (Abbildung 1Ca-d). Die Koordination des Tetrodenbündels und des Lochs für die Opto-Silizium-Sonde unten hängt von den Koordinaten des Zielhirnbereichs ab (Abbildung 1Cd); (2) ein Shuttle zur Befestigung einer Siliziumsonde oder Optrode (Abbildung 1Ce); (3) eine elektrische Sondenanschlusshalterung für den Silizium-Sondenanschluss (Abbildung 1Cf); (4) ein Faserferrule-Halter, der an den mittleren Teil des Körpers klemmt, um unerwünschte Bewegungen der implantierten Opto-Silizium-Sonde beim Stecken/Trennen eines optischen Fasersteckers zu verhindern (Abbildung 1Cg); und (5) ein Abschirmkegel, der dem Microdrive-Array physische und elektrische Abschirmung für eine stabile Aufzeichnung bietet (Abbildung 1Ch). Das Gesamtgewicht des Microdrive-Arrays beträgt 5,9 g, einschließlich des Abschirmkegels (Tabelle 1). Wenn Löcher in den bedruckten Teilen verstopft sind, bohren Sie die Löcher mit Bohrern aus: #76 für die innenlöcher und #68 für die äußeren Löcher für Tetrode-Mikroantriebsschrauben, #71 für tetrode Microdrive-Schrauben-Unterstützerloch und #77 für die Löcher für die Führungspfosten an der Unterseite der Körper. - Einfügen von Führungspfosten in den Microdrive-Array-Körper.
- Schneiden Sie zwei 16 mm Längen von 26-Ga Edelstahldraht. Schärfen Sie die Drahtspitzen vorsichtig mit einem Drehschleifer.
- Setzen Sie die Drähte in die unteren Löcher des Körpers ein (Abbildung 2A). Tragen Sie eine kleine Menge Cyanoacrylatkleber an der Unterseite des Körpers auf, um die Führungspfosten zu sichern.
2. Opto-Silizium-Sondenvorbereitung
- Bereiten Sie die Microdrive-Schraube für eine Siliziumsonde vor.
HINWEIS: Die Mikroantriebsschraube für die Siliziumsonde besteht aus einer benutzerdefinierten Schraube (300 m Steigung), die ein Stützrohr unterstützt, und einem L-förmigen Rohr (Abbildung 2B).- Bereiten Sie die Form für den Mikroantriebskopf vor (Abbildung 2C). Um die Form zu konstruieren, bereiten Sie das 3D-gedruckte Kunststoffmuster des Mikroantriebs vor (Abbildung 2Ca). Dann gießen Sie flüssiges Silikon-Gel nach der Herstellung einer zeitlichen Wand, indem Sie Bänder um das Muster. Entfernen Sie Luftblasen durch sanftes Schütteln, warten Sie, bis sie ausgehärtet ist, und entfernen Sie dann die Silikon-Gel-Form aus dem Muster (Abbildung 2Cb).
- Schneiden Sie 18 mm und 9,5 mm Längen von 23 G Edelstahldraht mit einem Drehschleifer. Rauen Sie die oberen 2–3 mm der Drähte mit einem Drehschleifer, um die Haftung des Zahnacryls zu verbessern.
- Nehmen Sie eine benutzerdefinierte Schraube und wenden Sie eine kleine Menge Siliziumöl, um die Reibung mit dem Dental-Acryl zu reduzieren. Stellen Sie die Drähte und eine kundenspezifische Schraube auf die Form.
- Gießen Sie Dental-Acryl in die Form mit einer Spritze, um Luftblasen um die Drähte und die Schrauben zu beseitigen. Luftblasenkontamination macht den Microdrive zerbrechlich. Warten Sie, bis das Zahnacryl vollständig ausgehärtet ist, und nehmen Sie dann die Mikroantriebsschrauben aus der Form. Biegen Sie 6 mm der längeren Drahtspitze mit einer Zange in einen 60°-Winkel.
- Überprüfen Sie die Qualität der Mikroantriebsschrauben (z. B. Risse, Luftblasen und Reibung), um die Schraube zu drehen. Bei hoher Reibung drehen Sie die Schraube, bis sie mit einem elektrischen Schraubendreher mit einer kundenspezifischen Treiberspitze, die sich mit der Microdrive-Schraube koppelt, glatt werden.
- Installieren Sie die Microdrive-Schraube in den Microdrive-Array-Körper, um zu überprüfen, ob sie sich durch Drehen der Schraube sanft nach oben und unten bewegt. Gewinde für die Schraube werden automatisch erstellt, wenn die Schraube in die Bohrung des Körpers eingesetzt wird.
- Bereiten Sie den Shuttle vor (Abbildung 3Aa).
- Schneiden Sie zwei 5 mm Längen von Polyetheretherketon (PEEK) Schläuchen mit einer scharfen Schere. Richten Sie die Rohre auf beiden Seiten des Shuttles aus. Kleben Sie die Rohre und Shuttle mit Epoxid.
- Tragen Sie eine kleine Menge Siliziumöl auf die Leitpfosten auf. Überprüfen Sie die Qualität des Shuttles, indem Sie auf die Leitpfosten des Microdrive-Array-Körpers einstecken. Stellen Sie sicher, dass sich der Shuttle reibungslos ohne übermäßige Reibung bewegt.
- Vorbereiten einer Optorode (Abbildung 3Ab). Dieser Schritt kann übersprungen werden, wenn kein optogenetisches Experiment erforderlich ist.
- Mit einem Rubinschneider lassen Sie die Glasfaser auf 21 mm Länge. Schleifen Sie die Faserspitze, um die Spitze flach und glänzend zu machen.
- Legen Sie die Glasfaser vorsichtig auf die Vorderseite der Siliziumsonde. Die Faserspitze befindet sich 200–300 m über der Oberseite der Elektrodenstellen. Halten Sie die Faser vorübergehend mit transparentem Klebeband.
- Kleben Sie die optische Faser mit einer geringen Menge Epoxid an die Basis der Siliziumsonde. Warten Sie mindestens 5 h, bis das Epoxid vollständig ausgehärtet ist.
HINWEIS: Es wird empfohlen, die Glasfaser auf der gleichen Seite wie die Elektrodenstellen zu befestigen. Das Anbringen der Faser an der Rückseite kann verhindern, dass Licht die Aufnahmestellen richtig beleuchtet.
- Befestigen Sie den Shuttle an der Siliziumsonde (Abbildung 3Ac): Tragen Sie eine kleine Menge Epoxid auf der Rückseite der Basis der Siliziumsonde auf. Befestigen Sie den unteren Teil des Shuttles an der Basis der Siliziumsonde und halten Sie sich vorsichtig für 2–3 min in Position, um die Bildung eines Spalts zwischen Shuttle- und Siliziumsondenbasis während der Erstaushärtung des Epoxids zu vermeiden. Warten Sie mindestens 5 h, bis das Epoxid vollständig ausgehärtet ist.
- Setzen Sie die Shuttle-Röhren vorsichtig auf die Führungspfosten des Hauptkörpers unter dem Mikroskop (Abbildung 3B). Halten Sie dabei die Nut des Shuttles mit feiner Pinzette.
- Stecken Sie die Microdrive-Schraube in das Schraubloch, indem Sie die Schraube drehen. Betätigen Sie die Siliziumsonde und die Mikroantriebsschraube, indem Sie die Spitze des L-förmigen Drahtes in die Nut des Pendelkopfes einsetzen (Abbildung 3C).
- Befestigen Sie den elektrischen Anschlusshalter der Sonde am Microdrive-Array-Körper (Abbildung 3D).
- Schneiden Sie zwei #0 Schrauben auf 3,5 mm Gewindelänge. Schleifen Sie die Spitzen, um Grate zu entfernen.
- Legen Sie den Sondenanschlusshalter auf den Körper. Legen Sie den elektrischen Silizium-Sonden-Stecker in den Halter.
- Sichern Sie den Silizium-Sondenstecker im Halter mit Epoxid, und kleben Sie ihn nicht an den Microdrive-Array-Körper, um den Wiederherstellungsvorgang der Siliziumsonde zu ermöglichen. Setzen Sie die Schrauben ein, um den Sondenanschlusshalter zu halten.
- Befestigen Sie den Ferrule-Halter an der Opto-Silizium-Sonde und dem Microdrive-Array-Körper (Abbildung 3D).
- Schneiden Sie zwei #0 Schrauben auf 6 mm Gewindelänge. Schleifen Sie die Spitzen, um Grate zu entfernen.
- Schleifen Sie die Außenseite von zwei #0 Maschine Schraubenmuttern, um kleine Sechskantmuttern mit 2,5–3,0 mm Außendurchmesser zu machen, um das Gewicht und den Platz zu reduzieren.
- Setzen Sie die Schrauben in Komponente A des Halters ein. Kleben Sie die Schraubenköpfe mit Epoxid.
- Tragen Sie eine kleine Menge Siliziumfett auf Komponente A und B auf, um die Reibung mit dem Körper zu reduzieren. Fügen Sie Komponente A in den Körper ein, dann halten Sie sie zeitlich mit einer inversen Pinzette.
- Setzen Sie Komponente B auf die Schrauben von Komponente A. Die kundenspezifischen Muttern in die Schrauben einfädeln. Verwenden Sie zangen, um die Muttern zu straffen, um den Ferrule-Halter am Körper zu sichern.
- Setzen Sie die Faserferrule in die Nut des Faserferrulehalters (Komponente B). Stellen Sie sicher, dass die Faserferrule 4–5 mm vom Halter herausklebt.
- Tragen Sie eine kleine Menge Epoxid zwischen der Ferrule und der Halternut auf. Warten Sie, bis das Epoxid vollständig ausgehärtet ist, und überprüfen Sie, ob sich die Ferrule nicht bewegt. Überprüfen Sie den Shuttle- und Ferrule-Halter auf reibungslose Bewegung, indem Sie die Muttern vor dem Drehen der Microdrive-Schraube lösen.
- Überprüfen Sie den Arbeitsabstand der Sonde. Stellen Sie sicher, dass sich die Sondenspitze vollständig in den Körper zurückzieht, wenn sich der Ferrule-Halter an der obersten Position befindet, während die Shuttle-Rohre noch mit den Führungspfosten verbunden sind. Der maximale Arbeitsabstand wird durch die Länge der Silikonsonde und die Zielhirnregion bestimmt.
- Wenn die Microdrive-Schraube lose ist, tragen Sie eine kleine Menge zahnärztliches Acryl um die Schraube auf, um mehr Fäden für die Unterstützung hinzuzufügen. Wenn es ausgehärtet ist, drehen Sie die Schraube, um die Dichtheit und Stabilität zu überprüfen.
3. Tetrode Vorbereitung
HINWEIS: Dieses Verfahren ähnelt den zuvor veröffentlichten Artikeln8,19,20,39.
- Bereiten Sie die Microdrive-Schrauben für die Tetrode vor. Der Mikroantrieb für eine Tetrode besteht aus einer kundenspezifisch bearbeiteten Schraube und einem 23 G Schlauch (Abbildung 2B). Dieses Verfahren ähnelt Abschnitt 2.1.
- Machen Sie ein Bündel von 30 G Edelstahlrohre, die einen 5,5 mil Draht innen hat. In diesem Fall wurden insgesamt neun 30 G-Schläuche (acht Aufnahme-Tetroden und eine Referenzelektrode) verwendet.
- Verfädeln Sie das 30 G-Bündel von der Unterseite des Antriebskörpers und sichern Sie es mit 20 G dünnwandigen Schläuchen am Hauptkörper. Schneiden Sie den Boden des Bündels mit einem Drehschleifer, um die Spitze gleichmäßig und bündig zu machen. Oberen Teil der 30 G Rohre mit einem Drehschleifer beschneiden, so dass das 30 G Rohr etwa 0,5 mm vom Hauptkörper entfernt ist.
- 5,5-Mil-Polyimid-Isolierrohre in die 30 G Rohre eintragen. Bereiten Sie Tetrode-Drähte vor und laden Sie sie in eine 32-Kanal-Stromschnittstellenplatine (EIB). Überprüfen Sie den elektrischen Anschluss mit dem Impedanzprüfer vor dem abschließenden Präzisionsschnitt.
- Niedrigere Elektrodenspitzenimpedanz bis 250–350 k' mit Vergoldungslösung. Fix alle Tetrodes mit Superkleber.
- Füllen Sie übermäßigen Spalt zwischen Polyimidrohr und Tetrode mit Mineralöl zum Abdichten und Schmieren. Den Erddraht an die EIB weiterleiten.
HINWEIS: Bei Bedarf kann die Glasfaser entlang derTetroden12 integriert werden.
4. Anbringen des Abschirmkegels
- Lackieren Sie silberne leitfähige Abschirmfarbe auf der Innenseite des bedruckten Kegels. Platzieren Sie das Microdrive-Array innerhalb des Kegels (Abbildung 3E).
- Schneiden Sie zwei #0 Schrauben auf 3,5 mm Gewindelänge. Befestigen Sie die Schrauben von der Außenseite des Kegels, um das Microdrive-Array an Ort und Stelle zu halten.
- Tragen Sie silberne Farbe um den Schraubenkopf auf, um den Abschirmkegel elektrisch mit elektrischem Boden zu verbinden. Überprüfen Sie die elektrische Verbindung zwischen Erddraht und Kegel. Tragen Sie eine kleine Menge Epoxid zwischen dem Microdrive-Array-Körper und dem Abschirmkegel auf, um den Körper sicher zu befestigen.
HINWEIS: Eine weitere Möglichkeit, den Abschirmkegel vorzubereiten, ist die Verwendung von Aluminiumband40 (Abbildung 3F). Bereiten Sie zunächst das Musterpapier für den Abschirmkegel vor, nachdem Sie Aluminiumfolie auf das Papier geklebt haben (Abbildung 3Fa). Dann rollen Sie das Papier und befestigen Sie es mit einer kleinen Menge Cyanoacrylatkleber (Abbildung3Fb). Das Gewicht dieses Kegels beträgt 0,72 g und das Gesamtgewicht des Microdrive-Arrays wird auf 4,7 g reduziert (Tabelle 1).
5. Implantatchirurgie
HINWEIS: Dieses Verfahren wird von den zuvor veröffentlichten Artikeln18,39,41 für die Implantation an zwei Stellen geändert. Stellen Sie sicher, dass das Gewicht des Tieres über 25 g für das Mikroantriebsimplantat für eine schnellere Genesung nach der Operation ist.
- vorbereitung
- Um eine Masseschraube vorzubereiten, befestigen Sie den Silberdraht an einer Schädelschraube und tragen Sie Silberfarbe auf. Befestigen Sie dann einen goldenen Stift mit silberfarbener Farbe an der gegenüberliegenden Seite des Drahtes.
- Bereiten Sie den Laufwerkhalteadapter vor, um das Microdrive-Array an einem stereotaktischen Gerät zu halten. Befestigen Sie einen männlichen Connecter mit Epoxid an einem Rostgriff. Stellen Sie sicher, dass die Ausrichtung des Verbindungs- und Edelstahlgriffs gerade ist.
- Für den Fall, dass nach der Aufnahme eine histologische Bestätigung erforderlich ist, wenden Sie Di-I auf die Tetrodes oder die Rückseite der Siliziumsonde38an.
- Senken Sie die Siliziumsonde nach unten, um die gewünschte Tiefe zu erhalten. Lösen Sie die Muttern des Ferrule-Halters mit einer Zange, senken Sie die Siliziumsonde (Opto-Silizium-Sonde), indem Sie die Mikroantriebsschraube der Siliziumsonde drehen, und befestigen Sie dann die Muttern, um den Ferrule-Halter zu sichern. Bei der Implantation von Tetroden im Hippocampusbereich CA1 und einer Siliziumsonde in MEC beträgt der Abstand zwischen der Tetrode-Kanüle und der Spitze der Siliziumsonde 3–4 mm.
- Stellen Sie die anästhesierte Maus (0,8 % –1,5 % Isofluran) in einem stereotaxic-Gerät ein. Der anästhetische Zustand der Maus wird durch das Fehlen des Zehen-Pinch-Reflexes bestätigt. Tragen Sie eine klare Salbe auf die Augen auf, um ein Trocknen zu verhindern. Bedecken Sie die Augen mit einem Stück Folie, um vor starker chirurgischer Lichteinwirkung zu schützen.
- Desinfizieren Sie die Kopfhaut der Maus mit Jod und Isopropanol nach der Rasur des Fells. Machen Sie einen 1,5–2,0 cm Schnitt an der Kopfhaut mit einer Standard-Chirurgischen Schere, und entfernen Sie das Gewebe über dem Schädel mit Wattestäbchen nach subkutaner Anwendung von Lidocain.
- Richten Sie den Mauskopf mit dem stereotaxic Werkzeug aus. Stellen Sie sicher, dass der Höhenunterschied zwischen Bregma und Lambda kleiner als 100 m ist. Bestimmen Sie die Kraniotomie-Position mit einem Atlas und markieren Sie diese Standorte mit einem sterilisierten Bleistift.
- Verankern Sie die Schädelschrauben (0,8 mm Durchmesser, 0,200 mm Gewindeabstand), indem Sie sie mit 0,5 mm Bohrer mit 0,5 mm Bohrer auf den Schädel drehen.
HINWEIS: 2–4 Löcher im frontalen Schädel, 2–3 Löcher in jeder Seite des Parietalschädels und 1–2 Löcher im interparietalen Schädel werden vorgeschlagen. - Befestigen Sie die Bodenschraube an der Bohrung, indem Sie sie eine Drehung (0,2 mm) drehen, nachdem Sie ein Loch in den interparietalen Knochen gebohrt haben. Stellen Sie sicher, dass dieses Loch nicht durch den Knochen in das Gehirn Fall eindringen; Andernfalls verunreinigen Kleinhirnsignale die Aufnahme. Stellen Sie mit einem Impedanzmesser vor, dass die Impedanz zwischen der Masseschraube und den Schädelschrauben weniger als 20 k' bei 1 kHz beträgt.
HINWEIS: Größere Impedanz führt zur Einführung von Bewegungsartefakten während der Aufnahme. - Führen Sie die Kraniotomie an den markierten Stellen durch. Die Dura kann bei Mäusen intakt gelassen werden.
- Schließen Sie den Stecker der Masseschraube und den Massestecker des Microdrive-Arrays an. Überprüfen Sie die Konnektivität mit dem Impedanzmesser, indem Sie zwischen der Masseschraube und der Abschirmung messen.
- Stellen Sie das Microdrive-Array auf den Adapter ein, stellen Sie es auf das stereotaxic-Gerät ein, und senken Sie die Siliziumsonde langsam bis zur gewünschten Tiefe. Stellen Sie sicher, dass die Tetrode-Bündel über der Gehirnoberfläche platziert werden, aber immer noch innerhalb des Microdrive-Arrays, wenn die Siliziumsonde in das Gehirn eingeführt wird (Abbildung 4A).
- Tragen Sie das Siliziumfett vorsichtig auf, um den Bereich der Siliziumsonde und des Tetrodenbündels zu versiegeln (Abbildung 4B). Legen Sie eine kleine Menge des Siliziumfetts an die Spitze einer 20 G Nadel und tragen Sie das Fett mit der Nadel um die Sonden auf. Wiederholen Sie dies, bis Siliziumfett den Bereich um die Sonde vollständig bedeckt, so dass Zahnacryl nicht auf oder unter die Elektroden/Sonden fließt. Achten Sie darauf, dass das Fett die Elektrodenstellen nicht berührt, sonst erhöht es die Impedanz der Aufnahmestellen dramatisch.
- Tragen Sie Zahnacryl auf, um das Microdrive-Array an den Verankerungsschrauben im Schädel zu fixieren.
HINWEIS: Es wird empfohlen, Zahnacryl in drei Schichten aufzutragen, um die übermäßige Hitze zu vermeiden, die während der Aushärtung des Acryls entsteht. - Entfernen Sie den Adapter vorsichtig aus dem Microdrive-Array. 1 ml PBS subkutan injizieren, um Austrocknung zu verhindern. Injizieren Sie 5 mg/kg Meloxicam subkutan als schmerzlindernde Behandlung.
- Bedecken Sie den Silizium-Sonden-Stecker mit einem Stück Klebeband, um zu verhindern, dass Schmutz in die elektrischen Anschlüsse gelangt. Bedecken Sie das Microdrive-Array mit einer Kunststoff-Paraffinfolie und kleben Sie es an Ort und Stelle.
- Verabreichen Sie eine geeignete schmerzstillende Behandlung für 3 Tage (z. B. subkutane Injektionen von 2 mg/kg Meloxicam einmal pro Tag). Erlauben Sie 3–5 Tage für die Wiederherstellung, bevor Sie mit der Tetrode-Anpassung beginnen. Die implantierte Maus nach der Erholungsphase ist in Abbildung 4Cdargestellt.
6. Wiederherstellung der Siliziumsonde (Abbildung 4D)
- Injektion von Ketamin (75 mg/kg) und Dexmedetomidin (1 mg/kg) Anästhetika intraperitoneal und bestätigtes Fehlen des Zehen-Pinch-Reflexes. Befestigen Sie die anästhesierte Maus, indem Sie 4% Paraformaldehyd direkt mit einer Kapuze durch das Herz durchdringen. Chirurgische Methoden für Nagetiere werden zuvor beschrieben42.
- Lösen Sie die Muttern des Ferrule-Halters mit einer Zange. Bewegen Sie es dann vorsichtig an die Oberseite des Körpers, indem Sie die Einstellschraube drehen, um die Siliziumsonde vollständig in Richtung innerhalb des Microdrive-Arraykörpers zurückzuziehen. Befestigen Sie die Muttern, um die Sonde an der oberen Position zu halten.
- Nehmen Sie das Maushirn von unten heraus, indem Sie den Schädel von der Seite knacken. Das Microdrive-Array ist nun vom Tier getrennt.
- Entfernen Sie die L-förmige Mikroantriebsschraube, die die Siliziumsonde antreibt, vollständig. Lösen und nehmen Sie die Nüsse des Ferrule-Halters mit einer Zange heraus. Nehmen Sie die Komponente A des Ferrule-Halters heraus.
- Lösen Sie die Sondensteckerhalterung und lösen Sie sie vom Laufwerksgehäuse. Überprüfen Sie, ob die Sondensteckerhalterung vom Microdrive-Array-Körper ausausgelöst werden kann.
- Halten Sie den oberen Teil des Shuttles mit einer Pinzette und schieben Sie die Silizium-Sonden-Baugruppe vorsichtig aus dem Microdrive-Array.
- Reinigen Sie die Sondenspitze mit Kontaktlinsenreiniger (erst mit Enzym, dann 3% Wasserstoffperoxid) für mindestens 1 Tag. Wischen Sie die Elektrodenspitze vorsichtig mit Isopropanol-Pads unter dem Mikroskop ab. Bewahren Sie die Sonde in einer statisch freien Aufbewahrungsbox auf.
HINWEIS: Die Shuttle- und Sondensteckerhalterung bleibt an der Siliziumsonde befestigt und kann bei der nächsten Implantation wiederverwendet werden.
HINWEIS: Einige Siliziumsonden sind mit Wasserstoffperoxid nicht tolerierbar. Verwenden Sie in diesem Fall nur die Kontaktlinsenlösung, die proteolytisches Enzym enthält. - Um den Microdrive-Array-Körper für die nächste Operation wiederzuverwenden, entfernen Sie das Zahnacryl mit einer Kombination aus Feinspitzenbohrern und Nippern. Dann erholen Sie die Schädelschrauben, indem Sie das entfernte Zahnacryl in Aceton eintauchen. Beachten Sie, dass das Aceton Kunststoffteile des Microdrive-Arrays auflöst.
- Entfernen Sie das Epoxid zwischen dem Microdrive-Körper und abschirmen Kegel mit einem Skalpell.
HINWEIS: Für die nächste Operation müssen keine zusätzlichen Teile mehr gedruckt werden, wenn der Microdrive nicht defekt ist.
Ergebnisse
Das Microdrive-Array wurde innerhalb von 5 Tagen erstellt. Der Zeitplan der Mikroantriebsvorbereitung ist in Tabelle 2beschrieben. Mit diesem Mikroantrieb wurden neun Tetroden und eine Siliziumsonde in das Hippocampus CA1 bzw. MEC der Maus implantiert [21 Wochen alt/29 g Körpergewicht männlich pOxr1-Cre (C57BL/6 Hintergrund)]. Diese transgene Maus drückt Cre in MEC-Schicht III Pyramidenneuronen aus. Die Maus wurde 10 Wochen vor dem Elektrodenimplantat mit 200 nL AAV5-DIO-ChR2-YFP (Titer: 7,7 x 1012 gc/ml) in das MEC injiziert. LFPs wurden mit einem Tiefpassfilter (1-500 Hz) erfasst, und Spiking-Einheiten wurden mit einem Hochpassfilter (0,8-5 kHz) erfasst. Die Lichtstimulation (n = 450 nm) wurde mit einer Impulsbreite von 1 ms bei einer Intensität von 10,6 mW durchgeführt, die am Ende des Faserverbinders gemessen wurde. Die Referenzelektrode für die Tetrode-Aufnahme wurde mit einem speziellen Tetro-Draht in die weiße Materie gelegt. Die Referenz für die Silizium-Sondenaufnahme wurde als oberer Kanal der Sonde eingestellt.
Nach der Tetro-Anpassung wurde die Verhaltensleistung auf einer linearen Spur (Abbildung 5A) und in einem offenen Feld (Abbildung 5B) getestet. In beiden Experimenten erkundete die Maus 30 min lang frei (Abbildung5Aa,b,c; Abbildung 5Ba,b,c). Die elektrophysiologischen Signale wurden während der Aufzeichnungssitzung erfolgreich ohne schweres bewegungsbedingtes Rauschen aufgezeichnet (Abbildung5Ad,e; Abbildung 5 Bd,e). Als nächstes wurde eine Lichtstimulation am MEC durchgeführt, um MEC-Schicht-III-Neuronen zu stimulieren, die auf die CA143 projizieren (Abbildung 6A). Spontane Spiking-Aktivitäten (Abbildung 6B,C) und LFPs (Abbildung 6D) wurden von den Tetrodes und Silizium-Sonde aufgezeichnet, wenn die Maus schlief. LfPs, die in den Tetroden aufgezeichnet wurden, zeigten große Wellenaktivitäten, was darauf hindeutet, dass alle Tetrodes in der Nähe der PYRAMIDalen Zellschicht CA1 positioniert waren. Leichte reaktionsbedingte Aktivitäten wurden zuerst bei MEC beobachtet, gefolgt von CA1 mit 13-18 ms Latenzzeit (Abbildung6E).

Abbildung 1: Übersicht über Microdrive-Arrays. (A) Eine Skelettansicht des Mikroantriebs-Arrays von der Tetrode-Seite (a) und der Siliziumsondenseite (b). (B) Ein reales Bild des geladenen Microdrive-Arrays, von der Tetro-Seite (a) und von der Siliziumsondenseite (b) aus gesehen. Das Microdrive-Array wird auf der Jig-Stufe im Panel (b) platziert. (C) Individuelle 3D-gedruckte Microdrive-Arrayteile. (a-d) Der Microdrive-Array-Körper, aus vier verschiedenen Winkeln betrachtet (a: Tetrode Seitenansicht; b: Silizium-Sonden-Seitenansicht; c: obere Ansicht; d: Bodenansicht). Eine vergrößerte Ansicht der gestrichelten Linie im Panel (c) ist in Abbildung 2Adargestellt. e) Der Shuttle, der die Siliziumsonde hält und ermöglicht. An der gestrichelten Linie im Panel (e) ist eine Siliziumsonde angebracht. f) Der Sonden-Connecter-Halter, der einen 32-Kanal-Silizium-Sonden-Connecter hält. g) Der Faserferrule-Halter, der eine Glasfaserferrule enthält, um die Bewegung der Sonde beim Einstecken/Trennen des Fasersteckers mit der Lichtquelle zu verhindern. Dieser Teil besteht aus zwei Komponenten: [Panel (g) und Komponenten A und B]. h) Der bedruckte Abschirmkegel, der eine physikalische und elektrische Abschirmung bietet, wenn er mit leitfähigem Material bemalt wird. Das Kegelfenster ermöglicht es, während der Vorbereitung von Microdrive-Arrays in der Struktur zu sehen, die schließlich von einem Stück Klebeband oder 3D-gedrucktem Material bedeckt wird. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
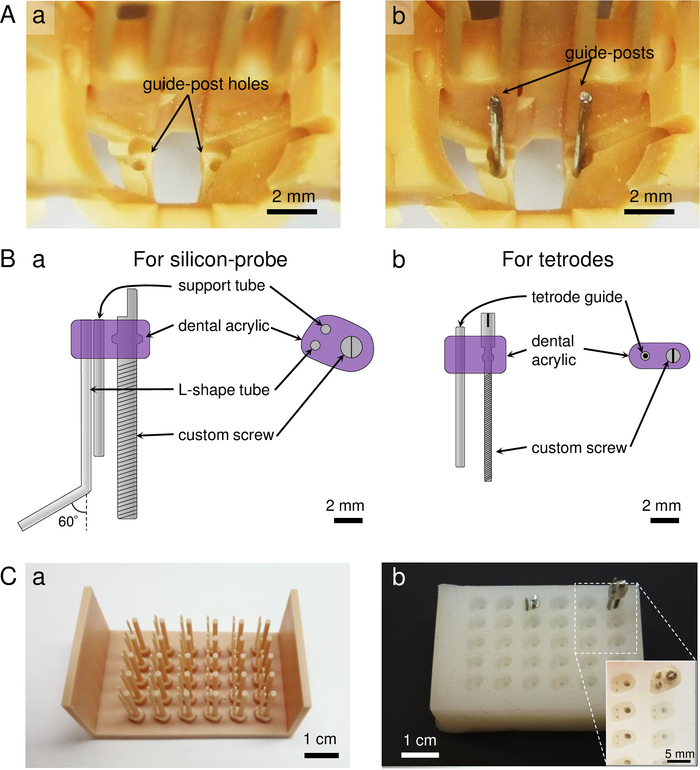
Abbildung 2: Vorbereitung von Führungspfosten und Mikroantriebsschrauben am Hauptkörper. (A) Leitfaden nach der Vorbereitung. a) Vergrößerte Ansicht des In Abbildung 1Ccdargestellten Mikroantriebs-Arraykörpers . b) Führen Sie das Post-Insertion in die Löcher des Körpers. (B) Die Mikroantriebsschraubenkonstruktionen. a) Die Mikroantriebsschraube für eine Siliziumsonde, die aus einer 300-mm-Pitch-Sonderschraube, einem Stützrohr und einem L-förmigen Rohr besteht. b) Die Mikroantriebsschraube für eine Tetrode, die aus einer 160-mm-Pitch-Sonderschraube und einem 30 G-Edelstahl-Führungsrohr besteht. (C) Herstellung des oberen Teils der Mikroantriebsschrauben: a) Vorbereitung von 3D-gedruckten Mustern der Antiform für die Mikroantriebsschraube. Das Bild zeigt ein Muster für die Silizium-Sonden-Mikroantriebsschraube. b) Die Form, die aus dem Anti-Form-Muster (a) und Silizium-Gummi-Material hergestellt wird. Die montierten Mikroantriebsschrauben werden durch Einsetzen von Kundenspezifischschrauben und Drähten/Rohren und dem Gießen von Dental-Acryl in jedem Brunnen hergestellt. Einset: vergrößerte Ansicht der Brunnen der Form. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3: Microdrive-Array-Baugruppe. (A) Herstellung einer Optosiliziumsonde. a) Anbringen von zwei Kunststoff-Führungsrohren am Shuttle. b) Verkleben der optischen Faser an die Siliziumsonde. c) Anbringen des Shuttles an der Opto-Silizium-Sonde. In diesem Bild ist der untere Teil des Shuttles (gestrichelte Linie) an der Basis der Siliziumsonde befestigt [Rückseite von (b)]. Der Shuttle und der Silikon-Sondenschaft sollten parallel sein. (B) Laden der Opto-Silizium-Sonden-Shuttle-Baugruppe in die Leitpfosten des Microdrive-Arraykörpers. (C) Relative Position des Silizium-Sonden-Mikroantriebs, wenn die Sonde vollständig in den Körper eingezogen wird (a) und wenn sie am niedrigsten im Antriebskörper (b) positioniert ist. Der L-förmige Draht wird am Shuttle in die Nut eingesetzt. (D) Eine explosionsartige Ansicht des Faserferrulehalters und der Sondensteckerhalterung. (E) Anh. Das leitfähige Material ist im Inneren des Kegels lackiert. (F) Alternativer Schutzkegel mit Einem Papier- und Aluminiumband. a) Ein Musterpapier. b) Ein angehängter alternativer Abschirmkegel, der 1,1 g Gewicht im Vergleich zur 3D-gedruckten Version reduziert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 4: Versiegelung der Sonden während der Operation und Wiederherstellung der Siliziumsonde. (A) Das Microdrive-Array und der Mausschädel nach der Kraniotomie vor dem Auftragen von Siliziumfett. Die Siliziumsonde wird zu diesem Zeitpunkt ca. 2mm in das Gehirn eingeführt. (B) Auftragen von Siliziumfett um die Siliziumsonden- und Tetrodebündel, um die Sonden vor Zahnacryl zu schützen. (C) Die chronisch implantierte Maus nach der Erholungsphase, wenn die Maus geht (a), pflege (b) und wenn sie mit dem Gegenausgleichs-Rollensystem (c) mit dem Aufnahmekabel verbunden ist. (D) Die zurückgewonnene Siliziumsonde vor (a) und nach (b) Eintauchen in die Reinigungslösung. Die biologischen Gewebe in (a) werden nach dem Reinigungsprozess (b) entfernt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 5: Beispiele für die gleichzeitige Tetrode/Silizium-Sonden-Aufnahme im Hippocampus CA1 und medial entorhinalen Kortex (MEC) von der Benahmemaus. (A) Aufnahme auf der linearen Spur. (a) Die für die Umcodierung verwendete lineare Spur. b) Flugbahnen der Mausexploration für 30 min auf der Strecke. c) Verhaltensleistung auf der linearen Schiene. (d-e) Repräsentative LFP-Aufnahmen von der Tetrode (d) und der Siliziumsonde (e). (B) Aufzeichnung im offenen Feld. (a) Die für die Umcodierung verwendete offene Feldkammer. b) Trajektorien der Mausexploration für 30 min in der Kammer. (c) Verhaltensleistung im offenen Feld. (d,e) Repräsentative LFP-Aufnahmen von der Tetrode (d) und der Siliziumsonde (e). LED ist am Kopfverstärker befestigt, um die Positionen der Maus aufzuzeichnen. Die Linealbahn und die Freifeldkammer sind mit dem elektrischen Boden verbunden, um elektrostatisches Rauschen zu reduzieren. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
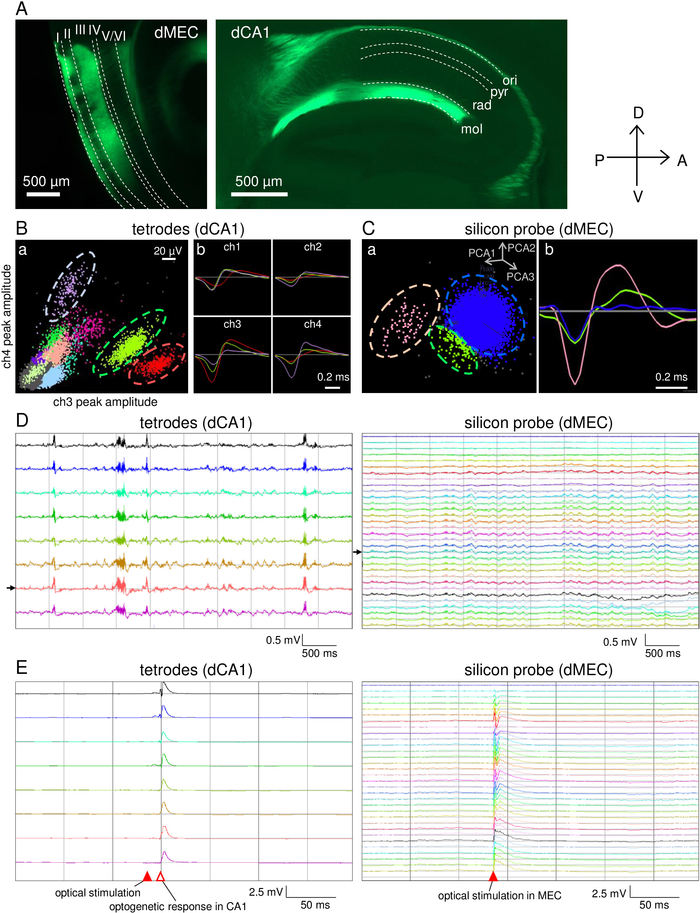
Abbildung 6: Repräsentative Ergebnisse simultaner Aufnahmen im CA1 und MEC und optogenetische Stimulation. (A) Expression von AAV5-DIO-ChR2-YFP nach 4 Wochen Injektion. MEC-Schicht III Pyramidenneuronen, die ihre Axone von dorsalem MEC auf dorsale CA1 projizieren. Gestrichelte Linien: ori, stratum oriens; pry, stratum pyramidale; rad, stratum radiatum; mol, stratum lacunosum moleculare. (B) Repräsentative Spike-Aufzeichnung von einem der Tetrodes. a) 2D-Clusterprojektionen von Spitzen, die aus der Tetrode aufgezeichnet wurden. b) Beispiele für die durchschnittliche Spitzenwellenform von drei Clustern, die durch gestrichelte Linien in (a) angezeigt werden. (C) Repräsentative Spike-Aufzeichnung von einer der Silizium-Sonden-Elektrodenstellen. a) 2D-Clusterprojektionen von Spitzenhauptkomponenten. b) Beispiele für die durchschnittliche Spitzenwellenform von drei Clustern. Spike-Cluster (rosa und grün) sind von den Rauschclustern (blau) getrennt. Die Cluster in (B,C) werden mit der KlustaKwik-Software berechnet. (D) Spuren spontaner LFPs, die gleichzeitig von den Tetroden in CA1 (a) und der Siliziumsonde in MEC (b) aufgezeichnet wurden. Schwarze Pfeile zeigen die tetrode in (B) und Silizium-Sonde-Elektroden-Stelle in (C) gezeigt. (E) LFP-Antworten auf gepulste optische Stimulation (10,6 mW, 1 ms; gefüllte rote Pfeilspitze) von den Tetroden in CA1 (a) und Siliziumsonde in MEC (b). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Gramm/eins | nummer | Summe [Gramm] | ||
| Hauptkörper | 1.25 | 1 | 1.25 | |
| schiffchen | 0.04 | 1 | 0.04 | |
| Sonden-Connecter-Halterung | 0.19 | 1 | 0.19 | |
| Faserferrule-Halter | 0.1 | 1 | 0.1 | |
| Abschirmkegel | 1.82 | 1 | 1.82 | (0.72)* |
| leitfähige Paste | 0.2 | 1 | 0.2 | |
| Maschinenschraube (#00, 2 mm), um die EIB | 0.05 | 2 | 0.1 | |
| Maschinenschraube (#0-80, 3,5 mm) | 0.06 | 4 | 0.24 | |
| Maschinenschraube (#0-80, 6mm) | 0.09 | 2 | 0.18 | |
| nuss | 0.03 | 2 | 0.06 | |
| Microdrive (Tetrode) | 0.05 | 9 | 0.45 | |
| Microdrive (Siliziumsonde) | 0.29 | 1 | 0.29 | |
| Siliziumsonde | 0.28 | 1 | 0.28 | |
| elektrische Schnittstelle Platine | 0.6 | 1 | 0.6 | |
| gesamt | 5.8 | (4.7)* | ||
Tabelle 1: Individuelles Gewicht jedes Microdrive-Arrayteils. Das Gesamtgewicht des Microdrive-Arrays betrug 5,9 g nach Befestigung des Schutzkegels mit Epoxid (*bei Verwendung eines alternativen Abschirmkegels mit Einem Papier- und Aluminiumband).
| Verfahren | zeit |
| Microdrive-Vorbereitung | |
| 3D-Teiledruck | 1 Tag |
| optrode Vorbereitung | |
| Bereiten Sie die Form für den Mikroantriebskopf vor | 1 Tag* |
| Microdrive Kopfvorbereitung | 3 h |
| Anbringen einer Optischen Faser | 3 h |
| Anbringen eines Shuttles | 3 h |
| Tetrode-Vorbereitung | |
| Bereiten Sie die Form für den Mikroantriebskopf vor | 1 Tag* |
| Microdrive-Köpfe-Vorbereitung | 3 h |
| Laden von Tetrodedrähten | 1 Tag |
| Anbringen des Abschirmkegels | |
| Malerei Abschirmfarbe | Über Nacht* |
| Anbringen am Microdrive-Körper | 3 h |
| * Dieses Verfahren kann parallel durchgeführt werden | |
Tabelle 2: Die Zeitleiste der Mikroantriebsvorbereitung. Der 3D-Teiledruck, der auf die Aushärtung des Silikonkautschuks/Dentalacryls/Epoxids und das Beladen der Tetro-Drähte wartet, nimmt den Großteil der Zeit der Microdrive-Array-Vorbereitung insgesamt 4-5 Tage in Anspruch.
Ergänzende Dateien: Die zusätzlichen Dateien enthalten 3D-Modelldaten von fünf Microdrive-Teilen im .sldprt- und .stl-Format. Die ursprünglichen 3D-Modelldateien wurden mit der Software Solidworks2003 erstellt. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Diskussion
Das Protokoll zeigt, wie ein hybrides Mikroantriebs-Array zu konstruieren und zu implantieren, das die Aufzeichnung neuronaler Aktivitäten aus zwei Gehirnbereichen mit unabhängigen einstellbaren Tetroden und einer Siliziumsonde in frei verhaltenden Mäusen ermöglicht. Es zeigt auch optogenetische Experimente und die Wiederherstellung der Siliziumsonde nach Experimenten. Während die verstellbare Siliziumsonde33 oder die Opto-Silizium-Sonde 36-Implantation zuvor bei Mäusen nachgewiesen wurde, hat dieses Protokoll klare Vorteile im simultanen Tetrode-Array und der Opto-Silizium-Sondenimplantation, um flexible Auswahl der implantierten Sondentypen. Die Art der implantierten Sonde kann je nach Ziel des Experiments geschaltet werden, wie z. B. Multi-Shank-Sonden27,44 oder Ultradichte-Neuropixel21,45. Die Koordination und der Winkel der Implantation7 können in der 3D-Objektentwurfsphase bei Bedarf leicht modifiziert werden. Zum Beispiel ist dual-site oder sogar Triple-Site-Aufzeichnung während Lernaufgaben über speicherbezogene Gehirnstrukturen, wie den Hippocampus46, entorhinal cortex47, präfrontalen Kortex48, amygdala49, und cingulate Cortex50.
Es gibt mehrere kritische Verfahren für eine erfolgreiche Implantat- und Aufzeichnung. Aufgrund der Fragilität von Silizium-basierten Sonden sollten mechanische Vibrationen oder Stöße auf das Microdrive-Array während der Montage minimiert werden. Beispielsweise sollte das Öffnen der verstopften Löcher mit einem Bohrer abgeschlossen sein, bevor die Siliziumsonde in das Microdrive-Array geladen wird. Außerdem sollte betont werden, die Bodenverbindung in jedem Schritt während des Microdrive-Array-Baus und der Implantatchirurgie sorgfältig zu überprüfen, um die Stabilität der aufgezeichneten Daten zu gewährleisten. Instabile oder hochimpedatonische Verbindungen zum Boden verursachen während der Aufnahmesitzung starke Geräusche und bewegungsbezogene Artefakte. Für stabile Aufnahmen wird empfohlen, 1-2 Wochen nach der Operation zu warten, um Elektrodendrift zu vermeiden, da das Hirngewebe durch die Implantatoperation negativ beeinflusst wird. Die Signalqualität der Siliziumsonde erholt sich jedoch nach 1-2 Wochen von dem chirurgischen Trauma, basierend auf früheren Erfahrungen. Es wird empfohlen, Single-Gehäuse zu verwenden, um Schäden am implantierten Mikroantriebs-Array durch andere Mäuse zu verhindern. Für das optogenetische Experiment ist es wichtig zu beachten, dass die meisten Silizium-Sonden Als Reaktion auf Lichtstimulationen51photo-artefakte induzieren, während andere entworfen wurden, um Fotoartefakte zu minimieren52 (es gibt Foto-Artefakt reduziert Silizium-Sonden, die im Handel erhältlich sind).
Das Gewicht des Microdrive-Arrays (5,9 g) ist schwerer als die in den vorherigen Artikeln12,53beschriebenen typischen Mikroantriebe , hauptsächlich aufgrund des Microdrive-Array-Körpers (ca. 21 % des Gesamtgewichts), des Abschirmkegels (31 %) und metallerlösender (Schrauben) und Nüsse: 22 %). Es wird empfohlen, Mäuse mit Gewichten von über 25 g (für C57BL/6-Mäuse54,55) für die Implantatchirurgie zu verwenden, da Mäuse mit ausreichenden Körpergewichten dazu neigen, sich früher zu erholen. Aus diesem Grund ist dieses Microdrive-Array möglicherweise nicht die beste Lösung für jugendliche Mäuse. Während Geräte, die 5%-10% des Körpergewichts der Maus ausmachen, oft dazu geführt werden, für Implantate toleriert zu werden12,56 (obwohl es keine unterstützenden veröffentlichten Daten für diese57) gibt, wiegt dieses Microdrive-Array 24 % des 25 g Mäuse (bei Verwendung des unten beschriebenen alternativen Kegels) (ca. 19 %).
Die implantierten erwachsenen Mäuse konnten sich jedoch frei bewegen und in den heimischen Käfigen herumspringen. Mäuse, die mit einem ähnlichen Mikroantriebs-Arraygewicht (ca. 4,5 g) implantiert wurden, haben zuvor gezeigt, dass sie die Verhaltensaufgabe (lineare Labyrinthaufgabe) auch unter Nahrungseinschränkung13,17ausführen. Der Nachteil des Gewichts ist kein Problem bei der Aufnahme, da ein Gegengewichtsausgleichssystem18,34,58 oder Headpost System59 das Microdrive-Array unterstützen wird. Darüber hinaus kann das Gesamtgewicht des Microdrive-Arrays reduziert werden, indem die Höhe verringert oder die Dicke des Abschirmkegels reduziert und das Design geändert wird, um kleinere Schrauben zu verwenden.
Mit dem aktuellen 3D-Druckmaterial kann die Dicke des Abschirmkegels bis zu 0,3 mm reduziert werden (ab der aktuellen Dicke von 0,6 mm). Die Kegelhöhe kann um 5 mm reduziert werden, solange die Tetro-Drähte noch abgedeckt werden können. Die Belichtung der Tetrodenführt führt zu einem Bruch der Drähte und zum Ausfall der Langzeitaufzeichnung. Alternativ kann die Vorbereitung des Abschirmkegels mit Papier- und Aluminiumband das Kegelgewicht auf 0,7 g reduzieren (15 % des Gesamtgewichts; reduziert um 20 % gegenüber dem Gesamtgewicht des ursprünglichen Microdrive-Arrays); obwohl, dies sind ein Kompromiss mit der körperlichen Stärke. Darüber hinaus kann die Größe des Mikroantriebs (Stromschutzkegel: 4,2 x 4,0 x 2,6 cm = Hauptachse x Nebenachse x Höhe) ein Hindernis für den Zugang zu Nahrung und Wasser darstellen, wenn sie von der Oberseite des Tierkäfigs bereitgestellt werden. Solange sie auf dem Käfigboden oder von der Seitenwand zur Verfügung gestellt werden, stört der Microdrive nicht das natürliche Verhalten von Mäusen, wie Essen, Trinken, Pflege, Aufzucht oder Verschachteln60.
Zusammenfassend lässt sich sagen, dass dieses Microdrive-Protokoll Forschern flexible Möglichkeiten für die Aufzeichnung von mehreren Hirnbereichen in frei beweglichen Mäusen bietet, um die Dynamik und Funktionen von lang reichen den neuronalen Schaltkreisen zu verstehen.
Offenlegungen
Die Autoren haben nichts zu verraten.
Danksagungen
Diese Arbeit wurde teilweise von der Japan Society for the Promotion of Science Overseas Research Fellowships (HO), Endowed Scholar Program (TK), Human Frontier Science Program (TK), Brain Research Foundation (TK), Faculty Science and Technology Acquisition und Retention Program (TK), Brain & Behavior Research Foundation (TK) und von The Sumitomo Foundation Research Grant (JY), NARSAD Young Investigator Research Grant (JY). Wir danken W. Marks für wertvolle Kommentare und Anregungen bei der Erstellung des Manuskripts.
Materialien
| Name | Company | Catalog Number | Comments |
| #00-90 screw | J.I. Morris | #00-90-1/8 | EIB screws |
| #0-80 nut | Small Parts | B00DGB7CT2 | brass nut for holding fiber ferrule holder |
| #0-80 screw | Small Parts | B000FMZ57G | brass machine screw for probe connector mount, fiber ferrule holder, and shielding cone |
| 22 Ga polyetheretherketone tubes | Small Parts | SLPT-22-24 | for attaching to the shuttle, 0.025 inches inner diameter |
| 23 Ga stainless tubing | Small Parts | HTX-23R | for tetrode |
| 23 Ga stainless wire | Small Parts | HTX-23R-24-10 | for L-shape/support wire |
| 26 Ga stainless wire | Small Parts | GWX-0200 | for guide-posts |
| 30 Ga stainless wire | Small Parts | HTX-30R | for tetrode |
| 3-D CAD software package | Dassault Systèmes | SolidWorks 2003 | |
| 3D printer | FormLab | Form2 | |
| 5.5mil polyimide insulating tubes | HPC Medical | 72113900001-012 | |
| aluminum foil tape | Tyco | Tyco Adhesives 617022 Aluminum Foil Tape | for the alternative shielding cone |
| conductive paste | YSHIELD | HSF54 | for shielding cone |
| customized screws for silicon-probe microdrive | AMT | UNM1.25-HalfMoon | half-moon stainless screw, 1.5 mm diameter, 300 µm thread pitch |
| customized screws for tetrode microdrive | AMT | Yamamoto_0000-160_9mm | slotted stainless screw, 0.5 mm diameter, 160 µm thread pitch, custom-made to order for our design |
| dental acrylic | Stoelting | 51459 | |
| dental model resin | FormLab | RS-F2-DMBE-02 | |
| Dremel rotary tool | Dremel | model 800 | a grinder |
| drill bit | Fine Science Tool | 19007-05 | |
| electric interface board | Neuralynx | EIB-36-Narrow | |
| epoxy | Devcon | GLU-735.90 | 5 minutes epoxy |
| eye ointment | Dechra | Puralube Ophthalmic Ointment | to prevent mice eyes from drying during surgery |
| fiber polishing sheet | Thorlabs | LFG5P | for polishing the optical fiber |
| fine tweezers | Protech International | 15-368 | for loading/recovering the silicon probe |
| gold pins | Neuralynx | EIB Pins Small | |
| ground wire | A-M Systems | 781500 | 0.010 inch bare silver wire |
| headstage preamp | Neuralynx | HS-36 | |
| impedance meter | BAK electronics | Model IMP-2 | 1 kHz testing frequency |
| mineral oil | ZONA | 36-105 | for lubricating screws and wires |
| optical fiber | Doric | MFC_200/260-0.22_50mm_ZF1.25(G)_FLT | |
| Recording system | Neuralynx | Digital Lynx 4SX | |
| ruby fiber scribe | Thorlabs | S90R | for cleaving the optical fiber |
| silicon grease | Fine Science Tool | 29051-45 | |
| silicon probe | Neuronexus | A1x32-Edge-5mm-20-177 | Fig. 3, 4A, 4B, 5 |
| silicon probe | Neuronexus | A1x32-6mm-50-177 | Fig. 4C |
| silicon probe washing solution | Alcon | AL10078844 | contact lens cleaner |
| silicone lubber | Smooth-On | Dragon Skin 10 FAST | for preparation of microdrive mold |
| silver paint | GC electronic | 22-023 | silver print II coating, used for ground wires |
| skull screw | Otto Frei | 2647-10AC | 0.8 mm diameter, 0.200 mm thread pitch |
| standard surgical scissors | ROBOZ | RS-5880 | |
| stereotaxic apparatus | Kopf | Model 942 | |
| super glue | Loctite | LOC230992 | for applying to guide-posts |
| surgical tweezers | ROBOZ | RS-5135 | |
| Tetrode Twister | Jun Yamamoto | TT-01 | |
| tetrode wires | Sandvik | PX000004 |
Referenzen
- Wilson, M. A., McNaughton, B. L. Dynamics of the hippocampal ensemble code for space. Science. 261 (5124), 1055-1058 (1993).
- Gothard, K. M., Skaggs, W. E., Moore, K. M., McNaughton, B. L. Binding of hippocampal CA1 neural activity to multiple reference frames in a landmark-based navigation task. The Journal of Neuroscience. 16 (2), 823-835 (1996).
- Keating, J. G., Gerstein, G. L. A chronic multi-electrode microdrive for small animals. Journal of Neuroscience Methods. 117 (2), 201-206 (2002).
- Winson, J. A compact micro-electrode assembly for recording from the freely moving rat. Electroencephalography and Clinical Neurophysiology. 35 (2), 215-217 (1973).
- Michon, F., et al. Integration of silicon-based neural probes and micro-drive arrays for chronic recording of large populations of neurons in behaving animals. Journal of Neural Engineering. 13 (4), 046018 (2016).
- Lansink, C. S., et al. A split microdrive for simultaneous multi-electrode recordings from two brain areas in awake small animals. Journal of Neuroscience Methods. 162 (1-2), 129-138 (2007).
- Billard, M. W., Bahari, F., Kimbugwe, J., Alloway, K. D., Gluckman, B. J. The systemDrive: a Multisite, Multiregion Microdrive with Independent Drive Axis Angling for Chronic Multimodal Systems Neuroscience Recordings in Freely Behaving Animals. eNeuro. 5 (6), (2018).
- Kloosterman, F., et al. Micro-drive array for chronic in vivo recording: drive fabrication. Journal of Visualized Experiments. (26), (2009).
- Lu, P. L., et al. Microdrive with Two Independent Moveable Sets for Wide-Ranging, Multi-Site, Multi-Channel Brain Recordings. Journal of Medical and Biological Engineering. 34 (4), 341-346 (2014).
- Haiss, F., Butovas, S. A miniaturized chronic microelectrode drive for awake behaving head restrained mice and rats. Journal of Neuroscience Methods. 187 (1), 67-72 (2010).
- Headley, D. B., DeLucca, M. V., Haufler, D., Pare, D. Incorporating 3D-printing technology in the design of head-caps and electrode drives for recording neurons in multiple brain regions. Journal of Neurophysiology. 113 (7), 2721-2732 (2015).
- Voigts, J., Siegle, J. H., Pritchett, D. L., Moore, C. I. The flexDrive: an ultra-light implant for optical control and highly parallel chronic recording of neuronal ensembles in freely moving mice. Frontiers in Systems Neuroscience. 7, 8 (2013).
- Yamamoto, J., Tonegawa, S. Direct Medial Entorhinal Cortex Input to Hippocampal CA1 Is Crucial for Extended Quiet Awake Replay. Neuron. 96 (1), 217-227 (2017).
- Schomburg, E. W., et al. Theta phase segregation of input-specific gamma patterns in entorhinal-hippocampal networks. Neuron. 84 (2), 470-485 (2014).
- Fernandez-Ruiz, A., et al. Entorhinal-CA3 Dual-Input Control of Spike Timing in the Hippocampus by Theta-Gamma Coupling. Neuron. 93 (5), 1213-1226 (2017).
- Rey, H. G., Pedreira, C., Quian Quiroga, R. Past, present and future of spike sorting techniques. Brain Research Bulletin. 119 (Pt B), 106-117 (2015).
- Gray, C. M., Maldonado, P. E., Wilson, M., McNaughton, B. Tetrodes markedly improve the reliability and yield of multiple single-unit isolation from multi-unit recordings in cat striate cortex. Journal of Neuroscience Methods. 63 (1-2), 43-54 (1995).
- Yamamoto, J., Wilson, M. A. Large-scale chronically implantable precision motorized microdrive array for freely behaving animals. Journal of Neurophysiology. 100 (4), 2430-2440 (2008).
- Nguyen, D. P., et al. Micro-drive array for chronic in vivo recording: tetrode assembly. Journal of Visualized Experiments. (26), (2009).
- Lu, L., Popeney, B., Dickman, J. D., Angelaki, D. E. Construction of an Improved Multi-Tetrode Hyperdrive for Large-Scale Neural Recording in Behaving Rats. Journal of Visualized Experiments. (135), (2018).
- Jun, J. J., et al. Fully integrated silicon probes for high-density recording of neural activity. Nature. 551 (7679), 232-236 (2017).
- Pastalkova, E., Itskov, V., Amarasingham, A., Buzsaki, G. Internally generated cell assembly sequences in the rat hippocampus. Science. 321 (5894), 1322-1327 (2008).
- Gauthier, J. L., Tank, D. W. A Dedicated Population for Reward Coding in the Hippocampus. Neuron. 99 (1), 179-193 (2018).
- Davidson, T. J., Kloosterman, F., Wilson, M. A. Hippocampal replay of extended experience. Neuron. 63 (4), 497-507 (2009).
- Gerwinn, S., Macke, J., Bethge, M. Bayesian population decoding of spiking neurons. Frontiers in Computational Neuroscience. 3, 21 (2009).
- Sakata, S., Harris, K. D. Laminar structure of spontaneous and sensory-evoked population activity in auditory cortex. Neuron. 64 (3), 404-418 (2009).
- Csicsvari, J., et al. Massively parallel recording of unit and local field potentials with silicon-based electrodes. Journal of Neurophysiology. 90 (2), 1314-1323 (2003).
- Harris, K. D., Quiroga, R. Q., Freeman, J., Smith, S. L. Improving data quality in neuronal population recordings. Nature Neuroscience. 19 (9), 1165-1174 (2016).
- Hilgen, G., et al. Unsupervised Spike Sorting for Large-Scale, High-Density Multielectrode Arrays. Cell Reports. 18 (10), 2521-2532 (2017).
- Rossant, C., et al. Spike sorting for large, dense electrode arrays. Nature neuroscience. 19 (4), 634-641 (2016).
- Iseri, E., Kuzum, D. Implantable optoelectronic probes for in vivo optogenetics. Journal of Neural Engineering. 14 (3), 031001 (2017).
- Klapoetke, N. C., et al. Independent optical excitation of distinct neural populations. Nature Methods. 11 (3), 338-346 (2014).
- Yamamoto, J., Suh, J., Takeuchi, D., Tonegawa, S. Successful execution of working memory linked to synchronized high-frequency gamma oscillations. Cell. 157 (4), 845-857 (2014).
- Rangel Guerrero, D. K., Donnett, J. G., Csicsvari, J., Kovacs, K. A. Tetrode Recording from the Hippocampus of Behaving Mice Coupled with Four-Point-Irradiation Closed-Loop Optogenetics: A Technique to Study the Contribution of Hippocampal SWR Events to Learning. eNeuro. 5 (4), (2018).
- Liang, L., et al. Integrated and Quick-to-Assemble (SLIQ) Hyperdrives for Functional Circuit Dissection. Frontiers in Neural Circuits. 11, 8 (2017).
- Chung, J., Sharif, F., Jung, D., Kim, S., Royer, S. Micro-drive and headgear for chronic implant and recovery of optoelectronic probes. Scientific Reports. 7 (1), 2773 (2017).
- Quilichini, P., Sirota, A., Buzsaki, G. Intrinsic circuit organization and theta-gamma oscillation dynamics in the entorhinal cortex of the rat. The Journal of Neuroscience. 30 (33), 11128-11142 (2010).
- Sauer, J. F., Struber, M., Bartos, M. Recording Spatially Restricted Oscillations in the Hippocampus of Behaving Mice. Journal of Visualized Experiments. (137), (2018).
- Shikano, Y., Sasaki, T., Ikegaya, Y. Simultaneous Recordings of Cortical Local Field Potentials, Electrocardiogram, Electromyogram, and Breathing Rhythm from a Freely Moving Rat. Journal of Visualized Experiments. (134), (2018).
- Brunetti, P. M., et al. Design and fabrication of ultralight weight, adjustable multi-electrode probes for electrophysiological recordings in mice. Journal of Visualized Experiments. 91 (91), e51675 (2014).
- Battaglia, F. P., et al. The Lantern: an ultra-light micro-drive for multi-tetrode recordings in mice and other small animals. Journal of Neuroscience Methods. 178 (2), 291-300 (2009).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of Visualized Experiments. (65), (2012).
- Suh, J., Rivest, A. J., Nakashiba, T., Tominaga, T., Tonegawa, S. Entorhinal cortex layer III input to the hippocampus is crucial for temporal association memory. Science. 334 (6061), 1415-1420 (2011).
- Royer, S., et al. Multi-array silicon probes with integrated optical fibers: light-assisted perturbation and recording of local neural circuits in the behaving animal. The European Journal of Neuroscience. 31 (12), 2279-2291 (2010).
- Steinmetz, N. A., Koch, C., Harris, K. D., Carandini, M. Challenges and opportunities for large-scale electrophysiology with Neuropixels probes. Current Opinion in Neurobiology. 50, 92-100 (2018).
- Jones, M. W., Wilson, M. A. Theta rhythms coordinate hippocampal-prefrontal interactions in a spatial memory task. PLoS Biology. 3 (12), e402 (2005).
- Frank, L. M., Brown, E. N., Wilson, M. A. A comparison of the firing properties of putative excitatory and inhibitory neurons from CA1 and the entorhinal cortex. Journal of Neurophysiology. 86 (4), 2029-2040 (2001).
- Kitamura, T., et al. Eng and circuits crucial for systems consolidation of a memory. Science. 356 (6333), 73-78 (2017).
- McGaugh, J. L., Cahill, L., Roozendaal, B. Involvement of the amygdala in memory storage: interaction with other brain systems. Proceedings of the National Academy of Sciences of the United States of America. 93 (24), 13508-13514 (1996).
- Frankland, P. W., Bontempi, B., Talton, L. E., Kaczmarek, L., Silva, A. J. The involvement of the anterior cingulate cortex in remote contextual fear memory. Science. 304 (5672), 881-883 (2004).
- Mikulovic, S., et al. On the photovoltaic effect in local field potential recordings. Neurophotonics. 3 (1), 015002 (2016).
- Kuleshova, E. P. Optogenetics – New Potentials for Electrophysiology. Neuroscience and Behavioral Physiology. 49 (2), 169-177 (2019).
- Meng, E., Hoang, T. MEMS-enabled implantable drug infusion pumps for laboratory animal research, preclinical, and clinical applications. Advanced Drug Delivery Reviews. 64 (14), 1628-1638 (2012).
- Hu, S., et al. Dietary Fat, but Not Protein or Carbohydrate, Regulates Energy Intake and Causes Adiposity in Mice. Cell Metabolism. 28 (3), 415-431 (2018).
- Yang, Y., Smith, D. L., Keating, K. D., Allison, D. B., Nagy, T. R. Variations in body weight, food intake and body composition after long-term high-fat diet feeding in C57BL/6J mice. Obesity. 22 (10), 2147-2155 (2014).
- Morton, D. B., et al. Refinements in telemetry procedures. Seventh report of the BVAAWF/FRAME/RSPCA/UFAW Joint Working Group on Refinement, Part A. Laboratory Animals. 37 (4), 261-299 (2003).
- Lidster, K., et al. Opportunities for improving animal welfare in rodent models of epilepsy and seizures. Journal of Neuroscience Methods. 260, 2-25 (2016).
- Lin, L., et al. Large-scale neural ensemble recording in the brains of freely behaving mice. Journal of Neuroscience Methods. 155 (1), 28-38 (2006).
- Kislin, M., et al. Flat-floored air-lifted platform: a new method for combining behavior with microscopy or electrophysiology on awake freely moving rodents. Journal of Visualized Experiments. (88), e51869 (2014).
- Gaskill, B. N., Karas, A. Z., Garner, J. P., Pritchett-Corning, K. R. Nest building as an indicator of health and welfare in laboratory mice. Journal of Visualized Experiments. (82), 51012 (2013).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten