Method Article
Sistema microdrive ibrido con sonda Opto-Silicon recuperabile e tetrode per la registrazione ad alta densità a doppio sito in mouse in movimento libero
In questo articolo
Riepilogo
Questo protocollo descrive la costruzione di un array ibrido di microdrive che consente l'impianto di nove tetrodi regolabili in modo indipendente e una sonda opto-silicone regolabile in due regioni cerebrali in topi in movimento libero. Di dimostrato è anche un metodo per recuperare e riutilizzare in modo sicuro la sonda opto-silicone per molteplici scopi.
Abstract
Le registrazioni neurali multi-regionali possono fornire informazioni cruciali per comprendere le interazioni della scala cronologica fine tra più regioni del cervello. Tuttavia, i progetti di microtrasmissioni convenzionali spesso consentono l'uso di un solo tipo di elettrodo per registrare da regioni singole o multiple, limitando la resa delle registrazioni del profilo a unità singola o di profondità. Spesso limita anche la capacità di combinare le registrazioni degli elettrodi con strumenti optogenetici per indirizzare l'attività specifica del percorso e/o del tipo di cellula. Qui è presentato un array di microdrive ibrido per mouse liberamente in movimento per ottimizzare la resa e una descrizione della sua fabbricazione e riutilizzo dell'array di microdrive. L'attuale progetto impiega nove tetrodi e una sonda opto-silicone impiantata in due diverse aree cerebrali contemporaneamente in topi liberamente in movimento. I tetrodi e la sonda opto-silicone sono regolabili in modo indipendente lungo l'asse dorsoventrale nel cervello per massimizzare la resa delle attività di unità e oscillatorie. Questo array di microdrive incorpora anche un set-up per la manipolazione optogenetica leggera e di mediazione per studiare le risposte e le funzioni specifiche del tipo di cellule o regionali o dei circuiti neurali dei circuiti neurali a lungo raggio. Inoltre, la sonda opto-silicone può essere recuperata in modo sicuro e riutilizzata in modo sicuro dopo ogni esperimento. Poiché l'array di microdrive è costituito da parti stampate in 3D, la progettazione di microdrive può essere facilmente modificata per adattarsi a varie impostazioni. Primo descritto è la progettazione dell'array di microdrive e come collegare la fibra ottica a una sonda di silicio per esperimenti di optogenetica, seguita dalla fabbricazione del fascio di tetrodo e dall'impianto dell'array in un cervello di topo. La registrazione dei potenziali sul campo locale e dell'unità di spinking combinata con la stimolazione optogenetica dimostrano anche la fattibilità del sistema di micro-operatori in topi in movimento libero.
Introduzione
È fondamentale capire come l'attività neuronale supporta il processo cognitivo, come l'apprendimento e la memoria, studiando come diverse regioni del cervello interagiscono dinamicamente tra loro. Per chiarire le dinamiche dell'attività neurale alla base dei compiti cognitivi, l'elettrofisiologia extracellulare su larga scala è stata condotta in animali liberamente in movimento con l'aiuto di array di microdrive1,2,3, 4. Negli ultimi due decenni, diversi tipi di array di microdrive sono stati sviluppati per impiantare elettrodi in più regioni cerebrali per ratti5,6,7,8 e topi9, 10 del sistema , 11 Del sistema di , 12.Tuttavia, gli attuali progetti di microtrasmissioni generalmente non consentono l'uso di più tipi di sonde, costringendo i ricercatori a scegliere un singolo tipo di elettrodo con vantaggi e limitazioni specifici. Ad esempio, gli array di tetrodo funzionano bene per regioni cerebrali densamente popolate come l'ippocampo dorsale CA11,13, mentre le sonde in silicio danno un profilo geometrico migliore per studiare le connessioni anatomiche14 , 15.
Tetrodi e sonde in silicio sono spesso utilizzati per la registrazione cronica in vivo, e ognuno ha i propri vantaggi e svantaggi. Tetrode hanno dimostrato di avere vantaggi significativi in un migliore isolamento unità singola rispetto agli elettrodi singoli16,17, oltre all'efficacia dei costi e rigidità meccanica. Forniscono inoltre maggiori rese di attività a unità singola se combinate con microdioni8,18,19,20. È essenziale aumentare il numero di neuroni registrati contemporaneamente per comprendere la funzione dei circuiti neurali21. Ad esempio, è necessario un gran numero di cellule per studiare piccole popolazioni di tipi di cellule funzionalmente eterogenee, come22 celle correlate al tempo o codici di ricompensa23 celle. Sono necessari numeri di cella molto più alti per migliorare la qualità di decodifica delle sequenze di picco13,24,25.
I tetrodi, tuttavia, hanno uno svantaggio nella registrazione di cellule distribuite spazialmente, come nella corteccia o nel talamo. A differenza dei tetrodi, le sonde in silicio possono fornire la distribuzione spaziale e l'interazione dei potenziali di campo locale (LFP) e le attività di chiodare all'interno di una struttura locale14,26. Le sonde in silicio multi-shank aumentano ulteriormente il numero di siti di registrazione e consentono la registrazione su strutture singole o vicine27. Tuttavia, tali array sono meno flessibili nel posizionamento dei siti di elettrodi rispetto ai tetrodi. Inoltre, sono necessari complessi algoritmi di ordinamento dei picchi nelle sonde ad alta densità per estrarre informazioni sui potenziali d'azione dei canali vicini per specchiare i dati acquisiti dai tetrodi28,29,30. Di conseguenza, la resa complessiva delle singole unità è spesso inferiore a i tetrodi. Inoltre, le sonde in silicio sono svantaggiose a causa della loro fragilità e dei costi elevati. Pertanto, la scelta delle sonde tetrodi contro silicio dipende dall'obiettivo della registrazione, che è una questione di ottenere un alto rendimento di unità singole o profilazione spaziale nei siti di registrazione è prioritaria.
Oltre a registrare l'attività neurale, la manipolazione optogenetica è diventata uno degli strumenti più potenti in neuroscienza per esaminare come specifici tipi di cellule e/o percorsi contribuiscono alle funzioni del circuito neurale13,31, 32,33. Tuttavia, gli esperimenti optogenetici richiedono un'ulteriore considerazione nella progettazione di array di microdrive per collegare il connettore in fibra per stimolare le sorgenti luminose34,35,36. Spesso, il collegamento di fibre ottiche richiede una forza relativamente grande, che può portare a uno spostamento meccanico della sonda nel cervello. Pertanto, non è un compito banale combinare una fibra ottica impiantabile agli array di microdrive convenzionali.
Per i motivi di cui sopra, i ricercatori sono tenuti a ottimizzare la selezione del tipo di elettrodo o per impiantare una fibra ottica a seconda dello scopo della registrazione. Ad esempio i tetrodi vengono utilizzati per ottenere una maggiore resa unitaria nell'ippocampo1,13, mentre le sonde di silicio vengono utilizzate per studiare il profilo di profondità laminare delle aree corticali, come la corteccia entorinale medianale (MEC)37. Attualmente, microdrive per l'impianto simultaneo di tetrodi e sonde di silicio erano stati segnalati per i ratti5,11. Tuttavia, è estremamente difficile impiantare più tetrodi e sonde in silicio nei topi a causa del peso dei microdrive, dello spazio limitato sulla testa del mouse e dei requisiti spaziali per la progettazione del microdrive per impiegare sonde diverse. Sebbene sia possibile impiantare sonde in silicio senza micromotore, questa procedura non consente la regolazione della sonda e abbassa il tasso di successo del recupero della sonda di silicio12,38. Inoltre, gli esperimenti optogenetici richiedono considerazioni aggiuntive nella progettazione di array di microdrive. Questo protocollo dimostra come costruire e impiantare un array di microdrive per la registrazione cronica in topi liberamente in movimento, che consente l'impianto di nove tetrodi regolabili in modo indipendente e una sonda opto-silicone regolabile. Questo array di microdrive facilita anche gli esperimenti optogenetici e il recupero della sonda di silicio.
Protocollo
Tutti i metodi qui descritti sono stati approvati dall'Institutional Animal Care and Use Committee (IACUC) del Southwestern Medical Center dell'Università del Texas.
1. Preparazione delle parti dell'array di microdrive
- Stampare le parti dell'array di microdrive utilizzando una stampante 3D utilizzando la resina del modello dentale (Figura 1A,B). Assicurarsi che lo spessore dei singoli livelli stampati in 3D sia inferiore a 50 m per mantenere i piccoli fori sulle parti stampate chiari e vitali.
NOTA: l'array di microdrive è costituito da cinque parti (Figura 1C): (1) il corpo principale dell'array di microdrive, che comprende nove micro-vite per tetrodes e una vite per una sonda di silicio (Figura 1Ca-d). La coordinazione del fascio di tetrodo e del foro per la sonda opto-silicio nella parte inferiore dipende dalle coordinate dell'area del cervello di destinazione (Figura 1Cd); (2) una navetta per collegare una sonda di silicio o optrode (Figura1Ce); (3) un supporto per collegatori elettrici a sonda per contenere il collegatore alla sonda in silicio (Figura1Cf); (4) un supporto ferrule in fibra che blocca la parte centrale del corpo per evitare movimenti indesiderati della sonda opto-silicio impiantata durante l'altro/ scollegamento di un connettore a fibra ottica (Figura1Cg); e (5) un cono di schermatura che fornisce schermatura fisica ed elettrica all'array di microdrive per la registrazione stabile (Figura 1Ch). Il peso totale dell'array di microdrive è di 5,9 g, incluso il cono di schermatura (Tabella 1). Se i fori sono intasati nelle parti stampate, forare i fori utilizzando punte di foro: #76 per i fori interni e #68 per i fori esterni per le viti tetrode-microdrive, #71 per il foro di supporto tetrode micro-vite e #77 per i fori per le montante guida nella parte inferiore del il corpo. - Inserimento di pali guida nel corpo dell'array di microdrive.
- Tagliare due lunghezze da 16 mm di filo in acciaio inossidabile da 26-Ga. Affilare delicatamente le punte del filo utilizzando una smerigliatrice rotante.
- Inserire i fili nei fori inferiori del corpo (Figura 2A). Applicare una piccola quantità di colla cianoacrilata nella parte inferiore del corpo per fissare i pali guida.
2. Preparazione della sonda Opto-silicon
- Preparare la vite microguida per una sonda di silicio.
NOTA: La vite microguida per la sonda di silicio è costituita da una vite personalizzata (passo di 300 m), un tubo di supporto e un tubo a forma di L (Figura 2B).- Preparare lo stampo per la testa del microdrive (Figura 2C). Per costruire lo stampo, preparare il modello di plastica stampato in 3D del microdrive (Figura 2Ca). Quindi, versare gel liquido di silicone dopo aver fatto una parete temporale mettendo nastri intorno al modello. Rimuovere le bolle d'aria agitando delicatamente, attendere fino a quando non è guarito, quindi rimuovere lo stampo silicone-gel dal modello (Figura 2Cb).
- Tagliare 18 mm e 9,5 mm di lunghezza di 23 G filo inossidabile utilizzando una smerigliatrice rotante. Sgrossare i primi 2-3 mm dei fili con una smerigliatrice rotante per migliorare l'adesione dell'acrilico dentale.
- Prendere una vite personalizzata e applicare una piccola quantità di olio di silicio per ridurre l'attrito con l'acrilico dentale. Impostare i fili e una vite personalizzata per lo stampo.
- Versare l'acrilico dentale nello stampo utilizzando una siringa per eliminare le bolle d'aria intorno ai fili e alle viti. La contaminazione da bolle d'aria renderà fragile il microguida. Attendere fino a quando l'acrilico dentale è completamente guarito, quindi togliere le viti microdrive dallo stampo. Piegare 6 mm della punta di filo più lunga ad un angolo di 60 gradi utilizzando le pinze.
- Controllare la qualità delle viti microguida (ad esempio, crepe, bolle d'aria e attrito) per ruotare la vite. Se c'è un attrito elevato, ruotare la vite fino a quando non diventano lisci utilizzando un driver a vite elettrica con una punta del driver personalizzata, che coppie con la vite microdrive.
- Installare la vite microdrive nel corpo dell'array di microdrive per verificare se si muove su e giù senza intoppi ruotando la vite. Le filettature per la vite vengono create automaticamente quando si inserisce la vite nel foro del corpo.
- Preparare lo shuttle (Figura 3Aa).
- Tagliare due tubi di 5 mm di polietheretherketone (PEEK) utilizzando forbici affilate. Allineare i tubi su entrambi i lati della navetta. Incollare i tubi e navetta con resina epossidica.
- Applicare una piccola quantità di olio di silicio sui pali della guida. Controllare la qualità della navetta inserendo sui pali guida del corpo dell'array di microdrive. Assicurarsi che la navetta si muova senza attrito eccessivo.
- Preparare un'optorode (Figura 3Ab). Questo passaggio può essere saltato se non è necessario un esperimento optogenetico.
- Fender la fibra ottica a 21 mm di lunghezza utilizzando una taglierina rubino. Macinare la punta della fibra per rendere la punta piatta e lucida.
- Posizionare delicatamente la fibra ottica sul lato anteriore della sonda di silicio. La punta in fibra è posizionata a 200-300 m sopra la parte superiore dei siti degli elettrodi. Tenere temporaneamente la fibra con nastro trasparente.
- Incollare la fibra ottica alla base della sonda di silicio utilizzando una piccola quantità di resina epossidica. Attendere almeno 5 h fino a quando la resina epossidica è completamente guarita.
NOTA: Si consiglia di attaccare la fibra ottica sullo stesso lato dei siti degli elettrodi. Attaccare la fibra sul retro può impedire alla luce di illuminare correttamente i siti di registrazione.
- Fissare la navetta alla sonda di silicio (Figura3Ac): applicare una piccola quantità di resina epossidica sul retro della base della sonda di silicio. Attaccare la parte inferiore della navetta alla base della sonda di silicio e tenere delicatamente in posizione per 2-3 min per evitare la formazione di un divario tra la navetta e la base silicio-probe durante la cura iniziale della resina epossidica. Attendere almeno 5 h fino a quando la resina epossidica è completamente guarita.
- Inserire con attenzione i tubi navetta sui pali guida del corpo principale al microscopio (Figura 3B). Durante questa procedura, tenere la scanalatura della navetta con una pinzetta fine.
- Inserire la vite microdrive nel foro della vite ruotando la vite. Impegnare la sonda di silicio e micro-vite inserendo la punta del filo a forma di L nella scanalatura della testa dello shuttle (Figura 3C).
- Collegare il supporto del collegamento elettrico sonda al corpo dell'array di microdrive (Figura 3D).
- Tagliare due viti #0 a 3,5 mm di lunghezza del filo. Macinare le punte per rimuovere le bave.
- Posizionare il supporto del collegatore della sonda sul corpo. Posizionare il connettore elettrico della sonda in silicio nel supporto.
- Fissare il connettore della sonda in silicio nel supporto con resina epossidica e assicurarsi di non incollarlo al corpo dell'array di microdrive per consentire la procedura di recupero della sonda di silicio. Inserire le viti per tenere il supporto del collegatore della sonda.
- Attaccare il supporto ferrule alla sonda opto-silicon e al corpo dell'array microdrive (Figura 3D).
- Tagliare due viti #0 a 6 mm di lunghezza del filo. Macinare le punte per rimuovere le bave.
- Macinare l'esterno di due dadi a vite #0 macchina per fare piccoli dadi esagoni con un diametro esterno di 2,5-3,0 mm per ridurre il peso e lo spazio.
- Inserire le viti nel componente A del supporto. Incollare le teste di vite con resina epossidica.
- Applicare una piccola quantità di grasso di silicio ai componenti A e B per ridurre l'attrito con il corpo. Inserire il componente A nel corpo, quindi tenere temporaneamente utilizzando una pinzetta inversa.
- Posizionare il componente B sulle viti del componente A. Infilare i dadi personalizzati nelle viti. Utilizzare le pinze per stringere i dadi per fissare il supporto ferrule sul corpo.
- Inserire la fibra ferrule nella scanalatura del supporto ferrule fibra (componente B). Assicurarsi che la fibra ferrule sia attaccata 4-5 mm dal supporto.
- Applicare una piccola quantità di resina epossidica tra il ferrule e la scanalatura del supporto. Attendere che la resina epossidica sia completamente curata e verificare che il ferrule non si muova. Controllare la navetta e il supporto ferrule per un movimento fluido allentando i dadi prima di girare la vite microdrive.
- Controllare la distanza di lavoro della sonda. Assicurarsi che la punta della sonda si ritragga completamente nel corpo quando il supporto ferruleo è nella posizione superiore mentre i tubi navetta sono ancora associati con le guide-post. La distanza massima di lavoro è determinata dalla lunghezza della sonda in silicone e della regione cerebrale di destinazione.
- Se la vite microdrive è allentata, applicare una piccola quantità di acrilico dentale intorno alla vite per aggiungere più fili per il supporto. Quando è curata, ruotare la vite per verificare la tenuta e la stabilità.
3. Preparazione del tetrode
NOTA: questa procedura è simile agli articoli pubblicati in precedenza8,19,20,39.
- Preparare le viti microdrive per la tetrode. Il microdrive per una tetrode è costituito da una vite su misura e un tubo da 23 G (Figura 2B). Questa procedura è simile alla sezione 2.1.
- Fare un fascio di 30 G tubi in acciaio inox che ha un filo di 5,5 mil all'interno. In questo caso, sono stati utilizzati un totale di nove tubi da 30 G (otto tetrodi di registrazione e un elettrodo di riferimento).
- Infilare il fascio da 30 G dal fondo del corpo dell'unità e fissarli con tubi a parete sottile da 20 G al corpo principale. Tagliare il fondo del fascio con una smerigliatrice rotante per rendere la punta uniforme e lavare. Tagliare la parte superiore dei tubi da 30 G con una smerigliatrice rotante in modo che il tubo da 30 G sporge a circa 0,5 mm dal corpo principale.
- Caricare tubi isolanti in poliimide da 5,5 mil nel tubo da 30 G. Preparare i fili tetrode e caricarli in una scheda di interfaccia elettrica a 32 canali (EIB). Controllare la connessione elettrica con il tester di impotenza prima del taglio di precisione finale.
- La punta dell'elettrodo inferiore impedi a 250-350 k, con una soluzione di placcatura in oro. Fissare tutti i tetrodi con supercolla.
- Riempire il divario eccessivo tra tubo di poliimide e tetrode con olio minerale per la sigillazione e la lubrificazione. Instradare il filo di terra alla BEI.
NOTA: Se necessario, la fibra ottica può essere integrata lungo i fili tetrodi12.
4. Attaccare il cono di schermatura
- Vernice argento vernice schermatura conduttiva all'interno del cono stampato. Posizionare l'array di microdrive all'interno del cono (Figura 3E).
- Tagliare due viti #0 a 3,5 mm di lunghezza del filo. Fissare le viti dall'esterno del cono per tenere in posizione l'array di microdrive.
- Applicare vernice d'argento intorno alla testa della vite per collegare elettricamente il cono di schermatura con il terreno elettrico. Controllare la connettività elettrica tra il filo di terra e il cono. Applicare una piccola quantità di resina epossidica tra il corpo dell'array di microdrive e il cono di schermatura per attaccare saldamente il corpo.
NOTA: Un altro modo per preparare il cono di schermatura è quello di utilizzare nastro in alluminio40 (Figura 3F). In primo luogo, preparare la carta modello per il cono di schermatura dopo aver incollato un foglio di alluminio alla carta (Figura 3Fa). Quindi, arrotolare la carta e attaccarla al corpo del microdrive utilizzando una piccola quantità di colla cianoacrilata (Figura 3Fb). Il peso di questo cono è di 0,72 g e il peso totale dell'array di microdrive è ridotto a 4,7 g (tabella 1).
5. Chirurgia implantare
NOTA: questa procedura viene modificata rispetto agli articoli pubblicati in precedenza18,39,41 per l'impianto a doppio sito. Assicurarsi che il peso dell'animale sia superiore a 25 g per l'impianto microdrive per un recupero più rapido dopo l'intervento chirurgico.
- preparazione
- Per preparare una vite a terra, attaccare il filo d'argento a una vite di teschio e applicare vernice d'argento. Quindi, attaccare un perno d'oro al lato opposto del filo utilizzando vernice d'argento.
- Preparare l'adattatore di contenimento dell'unità per contenere l'array di microdrive su un dispositivo stereotassico. Fissare un collegatore maschio a una maniglia inossidabile usando la resina epossidica. Assicurarsi che l'allineamento del collegatore e della maniglia inossidabile sia dritto.
- Nel caso in cui sia necessaria una conferma istologica dopo la registrazione, applicare Di-I ai tetrodi o alla parte posteriore della silicio-sonda38.
- Abbassare la sonda di silicio fino alla profondità desiderata. Allentare i dadi del supporto ferrule utilizzando le pinze, abbassare la sonda di silicio (sonda opto-silicio) ruotando la vite microguida della sonda di silicio, quindi fissare i dadi per fissare il supporto ferrule. Quando si impiantano tetrodi nell'area ippocampale CA1 e una sonda di silicio in MEC, la distanza tra la cannula tetrode e la punta della sonda di silicio è di 3-4 mm.
- Impostare il mouse anestesizzato (0,8%–1,5% isoflurane) in un dispositivo stereotassico. La condizione anestetica del mouse è confermata dall'assenza del riflesso del pizzico. Applicare unguento chiaro agli occhi per evitare l'essiccazione. Coprire gli occhi con un pezzo di lamina per proteggere da una forte esposizione chirurgica alla luce.
- Disinfettare il cuoio capelluto del topo con iodio e isopropanolo dopo aver rasato la pelliccia. Fare un'incisione di 1,5–2,0 cm sul cuoio capelluto utilizzando forbici chirurgiche standard, e rimuovere il tessuto sopra il cranio utilizzando tamponi di cotone dopo aver sottocutaneamente applicato lidocaina.
- Allineare la testa del mouse con lo strumento stereotassico. Assicurarsi che la differenza di altezza tra bregma e lambda sia inferiore a 100 m. Determinare la posizione craniotomia utilizzando un atlante e contrassegnare questi luoghi con una matita sterilizzata.
- Ancorare le viti del cranio (0,8 mm di diametro, passo filo 0,200 mm) ruotandole di 1,5 giri (0,3 mm) sul cranio, utilizzando pinzette chirurgiche e un cacciavite dopo aver forato 8-11 fori nel cranio utilizzando una punta di perforazione da 0,5 mm.
NOTA: si suggeriscono 2-4 fori nel cranio frontale, 2-3 fori in ogni lato del cranio parietale e 1–2 fori nel cranio interparietale. - Fissare la vite a terra al foro ruotandolo di un giro (0,2 mm) dopo aver forato un foro nell'osso interparietale. Assicurarsi che questo foro non penetri attraverso l'osso nel caso del cervello; in caso contrario, i segnali cerebellari contaminano la registrazione. Controllare che l'impedimenti sia inferiore a 20 ka a 1 kHz tra la vite a terra e le viti del cranio utilizzando un misuratore di impeditto.
NOTA: Un impulso più ampio causerà l'introduzione di artefatti di movimento durante la registrazione. - Eseguire la craniotomia nelle posizioni contrassegnate. La dura può essere lasciata intatta nei topi.
- Collegare il perno maschile della vite a terra e il connettore a terra dell'array di microdrive. Controllare la connettività utilizzando il misuratore di impedimento misurando tra la vite del terreno e la schermatura.
- Impostare l'array di microdrive sull'adattatore, impostarlo sul dispositivo stereotassico e abbassare lentamente la sonda di silicio fino alla profondità desiderata. Assicurarsi che i fasci di tetrode siano posizionati sopra la superficie del cervello, ma ancora all'interno dell'array di microdrive quando la sonda di silicio viene inserita nel cervello (Figura 4A).
- Applicare con attenzione il grasso di silicio per sigillare l'area della sonda di silicio e del fascio di tetrode (Figura 4B). Mettere una piccola quantità di grasso di silicio sulla punta di un ago da 20 G e applicare il grasso intorno alle sonde utilizzando l'ago. Ripetere fino a quando il grasso di silicio copre completamente l'area intorno alla sonda in modo che l'acrilico dentale non scorra sopra o sotto gli elettrodi/sonde. Fare attenzione a non lasciare che il grasso tocchi i siti degli elettrodi, altrimenti aumenterà drasticamente l'impedimenti dei siti di registrazione.
- Applicare l'acrilico dentale per fissare l'array di microdrive alle viti di ancoraggio nel cranio.
NOTA: Si raccomanda di applicare l'acrilico dentale in tre strati per evitare l'eccessivo calore prodotto durante la stagionatura dell'acrilico. - Rimuovere l'adattatore dall'array microdrive con attenzione. Iniettare 1 mL di PBS sottocutaneamente per prevenire la disidratazione. Iniettare 5 mg/kg di melosticam sottocutaneamente come trattamento analgesico.
- Coprire il connettore della sonda di silicio con un pezzo di nastro adesivo per evitare che lo sporco entri nei collegamenti elettrici. Coprire l'array di microdrive utilizzando una pellicola di paraffina di plastica e nastro adesivo in posizione.
- Somministrare un trattamento analgesico appropriato per 3 giorni (ad esempio, iniezioni sottocutanee di 2 mg/kg di melossicam una volta al giorno). Lasciare 3-5 giorni per il recupero prima di iniziare la regolazione tetrode. Il mouse impiantato dopo il periodo di recupero è mostrato nella figura 4C.
6. Recupero della sonda di silicio (Figura 4D)
- Iniettare chetamina (75 mg/kg) e anestetici dexmedetomidine (1 mg/kg) intraperiti intraperitonealmente e confermata l'assenza del riflesso del pizzico della dita dei i perpe. Fissare il topo anetizzato perfondendo direttamente 4% paraformaldeide attraverso il cuore utilizzando un cappuccio. I metodi chirurgici per i roditori sono descritti in precedenza42.
- Allentare i dadi del supporto ferrule utilizzando una pinza. Quindi, spostarla con attenzione nella parte superiore del corpo ruotando la vite di regolazione per ritrarre completamente la sonda di silicio verso l'interno del corpo dell'array di microdrive. Fissare i dadi per tenere la sonda nella posizione superiore.
- Togli il cervello del topo dal basso spaccando il cranio dal lato. L'array di microdrive è ora separato dall'animale.
- Rimuovere completamente la vite microdrive a forma di L che guida la sonda di silicio. Allentare e togliere i dadi del portaferrule usando le pinze. Estrarre il componente A del supporto ferrule.
- Svitare il supporto del connettore della sonda e staccarsi dal corpo dell'azionamento. Verificare che il supporto del connettore della sonda possa staccarsi dal corpo dell'array di microdrive.
- Tenere la parte superiore della navetta con una pinzetta, quindi far scorrere attentamente l'assieme sonda di silicio fuori dall'array di microdrive.
- Pulire la punta della sonda con il detergente per lenti a contatto (prima con enzima, poi 3% di perossido di idrogeno) per almeno 1 giorno. Pulire con cura la punta dell'elettrodo utilizzando cuscinetti isopropanolo al microscopio. Conservare la sonda in una scatola di archiviazione statica.
NOTA: il supporto della navetta e del connettore della sonda rimane collegato alla sonda in silicio e può essere riutilizzato nell'impianto successivo.
NOTA: Alcune sonde in silicio non sono tollerabili con perossido di idrogeno. In questo caso, utilizzare la soluzione della lente a contatto contenente solo enzimi proteolitici. - Per riutilizzare il corpo dell'array di microdrive per il prossimo intervento chirurgico, rimuovere l'acrilico dentale utilizzando una combinazione di trapani e pinne a punta fine. Quindi, recuperare le viti cranica immergendo l'acrilico dentale rimosso in acetone. Si noti che l'acetone dissolverà le parti in plastica dell'array microdrive.
- Rimuovere la resina epossidica tra il corpo della microguida e il cono di schermatura utilizzando un bisturi.
NOTA: Nessuna parte aggiuntiva deve essere stampata di nuovo per l'intervento chirurgico successivo se il microdrive non è rotto.
Risultati
L'array di microdrive è stato costruito entro 5 giorni. La tempistica della preparazione del microdrive è descritta nella Tabella 2. Utilizzando questo microdrive, nove tetrodi e una sonda di silicio sono stati impiantati nell'ippocampo CA1 e MEC del topo [21 settimana prima/29 g peso corporeo maschio pOxr1-Cre (C57BL/6 sfondo)], rispettivamente. Questo topo transgenico esprime Cre nei neuroni piramidali dello strato MEC III. Il topo è stato iniettato con 200 nL di AAV5-DIO-ChR2-YFP (titro: 7,7 x 1012 gc/mL) nel MEC 10 settimane prima dell'impianto di elettrodi. Gli LFP sono stati registrati utilizzando un filtro passa-basso (1-500 Hz) e le unità di puntamento sono state rilevate utilizzando un filtro passa-alto (0,8-5 kHz). La stimolazione della luce (450 nm) è stata eseguita utilizzando una larghezza dell'impulso di 1 ms a 10,6 mW di intensità misurata alla fine del connettore a fibra. L'elettrodo di riferimento per la registrazione dei tetrodi è stato collocato nella materia bianca utilizzando un filo tetrodo dedicato. Il riferimento per la registrazione della sonda in silicio è stato impostato come canale superiore della sonda.
Dopo la regolazione della tetrode, le prestazioni comportamentali sono state testate su una traccia lineare (Figura 5A) e in un campo aperto (Figura 5B). In entrambi gli esperimenti, il topo esplorato liberamente per 30 min (Figura5Aa,b,c; Figura 5Ba,b;c). I segnali elettrofisiologici sono stati registrati con successo senza gravi rumori legati al movimento durante la sessione di registrazione (Figura5Ad,e; Figura 5 Bd,e). Successivamente, la stimolazione della luce è stata eseguita al MEC per stimolare i neuroni dello strato III MEC che proiettano al CA143 (Figura 6A). Le attività spontanea di bloccamento (Figura 6B,C) e Gli LFP (Figura 6D) sono state registrate dalla tetrode e dalla sonda di silicio durante il sonno. Gli LFP registrati nei tetrodi mostravano grandi attività di increspatura, suggerendo che tutti i tetrodi erano posizionati nelle vicinanze dello strato di cellule piramidali CA1. Le attività reattive indotte dalla luce sono state osservate per la prima volta in MEC, seguite da CA1 con latenza di 13-18 ms (Figura 6E).

Figura 1: Panoramica dell'array Microdrive. (A) Una vista scheletro dell'array di microdrive, dal lato tetrode (a) e dal lato silicio-probe (b). (B) Un'immagine reale dell'array di microdrive caricato, vista dal lato tetrode (a) e dal lato silicio-sonda (b). L'array di microdrive è posto sullo stadio jig nel pannello (b). (C) Singole parti di microdrive stampate in 3D. (a-d) Il corpo dell'array di microdrive, visto da quattro diverse angolazioni (a: vista laterale tetrode; b: vista laterale silicio-probe; c: vista dall'alto; d: vista inferiore). Nella figura 2Aè illustrata una visualizzazione ingrandita della linea tratteggiata nel pannello (c). (e) La navetta, che tiene e consente la regolazione della sonda di silicio. Una sonda in silicio è attaccata alla linea tratteggiata nel pannello (e). (f) Il supporto sonda-collegatore, che contiene un collegatore a sonda in silicio a 32 canali. (g) Il supporto ferrule in fibra, che contiene un ferrule in fibra ottica per impedire il movimento della sonda quando si collega/scollega il connettore in fibra con la sorgente luminosa. Questa parte è costituita da due componenti: [pannello (g) e componenti A e B]. (h) Il cono di schermatura stampato, che fornisce schermatura fisica ed elettrica quando verniciato con materiale conduttivo. La finestra a cono permette di vedere all'interno della struttura durante la preparazione dell'array di microdrive, che alla fine viene coperto da un pezzo di nastro o materiale stampato in 3D. Fare clic qui per visualizzare una versione più grande di questa figura.
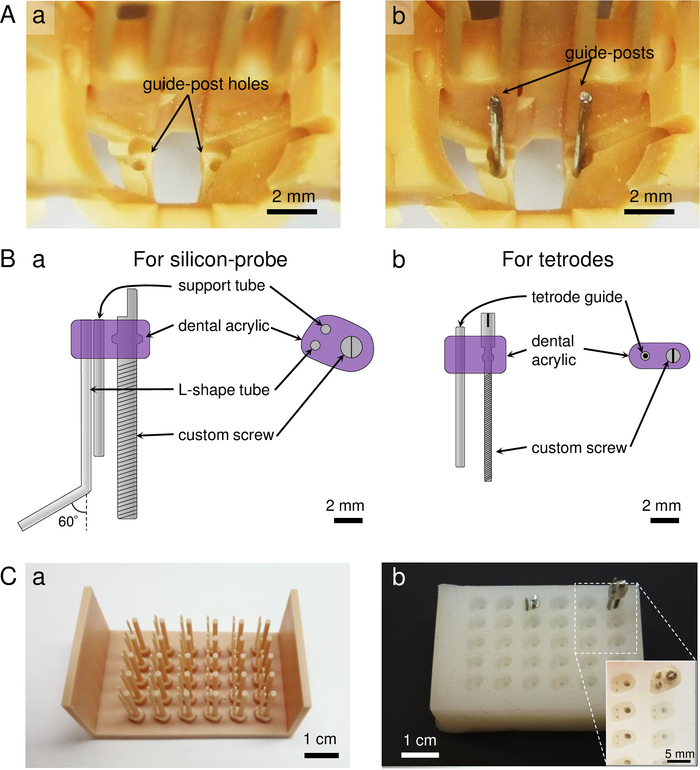
Figura 2: Preparazione di guide-post e viti microguida sul corpo principale. (A) Guida post-preparazione. (a) Vista ingrandita del corpo dell'array di microdrive illustrato nella Figura 1Cc. (b) Guidare il post-inserimento nei fori del corpo. (B) I disegni a vite microdrive. (a) La vite microguida per una sonda di silicio, che consiste in una vite personalizzata da passo di 300 m, un tubo di supporto e un tubo a forma di L. (b) La micro-vite per una tetrode, che consiste in una vite personalizzata da 160 m e da un tubo guida inossidabile da 30 G. (C) Fabbricazione del pezzo superiore delle viti microdrive: (a) Preparazione dei modelli stampati in 3D dell'anti-stampo per la micro-vite. L'immagine mostra un modello per la micro-vite microdrive silicio-sonda. (b) Lo stampo realizzato utilizzando il modello anti-stampo (a) e il materiale in gomma silicio. Le viti microdrive assemblate sono prodotte inserendo viti personalizzate e fili/tubi, e versando acrilico dentale in ogni pozzo. Rientro: vista ingrandita dei pozze dello stampo. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 3: Assembly dell'array Microdrive. (A) Preparazione di una sonda opto-silicone. (a) Attaccando due tubi guida in plastica alla navetta. b) Incollare la fibra ottica alla sonda di silicio. (c) Attacco della navetta alla sonda opto-silicio. In questa immagine, la parte inferiore della navetta (linea tratteggiata) è attaccata alla base della silicio-sonda [lato posteriore di (b)]. La navetta e il gambo della sonda in silicio devono essere in parallelo. (B) Caricamento dell'assieme della sonda opto-siliconneista nelle guide-post del corpo dell'array di microdrive. (C) Posizione relativa del microdrive silicio-sonda quando la sonda è completamente ritratta nel corpo (a) e quando posizionata al minimo nel corpo di azionamento (b). Il filo a forma di L viene inserito nella scanalatura della navetta. (D) Una vista esplosa del supporto ferrule in fibra e del supporto del connettore della sonda. (E) Cono di schermatura attaccato. Il materiale conduttivo viene verniciato all'interno del cono. (F) Cono di schermatura alternativo utilizzando carta e nastro adesivo in alluminio. (a) Una carta modello. (b) Un cono di schermatura alternativo collegato, che riduce 1,1 g di peso rispetto alla versione stampata in 3D. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 4: Sigillare le sonde durante l'intervento chirurgico e il recupero della sonda di silicio. (A) L'array di microdrive e il cranio del topo dopo craniotomia, prima di applicare il silicio-grasso. La sonda di silicio viene inserita a circa 2 mm nel cervello in questo momento. (B) Applicazione di grasso di silicio intorno ai fasci di silicio e tetrode per proteggere le sonde dall'acrilico dentale. (C) Il mouse impiantato cronicamente dopo il periodo di recupero, quando il mouse cammina (a), la toelettatura (b), e quando è collegato al cavo di registrazione con il sistema di puleggia controbilanciante (c). (D) La sonda di silicio recuperata, prima (a) e dopo (b) l'immersione nella soluzione di pulizia. I tessuti biologici in (a) vengono rimossi dopo il processo di pulizia (b). Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 5: Esempi di registrazione simultanea della tetrode/silicio nella ca1 ippocampale e nella corteccia entorhinale mediale (MEC) del mouse che si comporta. (A) Registrazione sulla traccia lineare. (a) La traccia lineare utilizzata per la ricodifica. (b) Traiettorie dell'esplorazione del topo per 30 min in pista. (c) Prestazioni comportamentali sulla pista lineare. (d-e) Rappresentativo registrazioni LFP dalla tetrode (d) e dalla sonda di silicio (e). (B) Registrazione nel campo aperto. (a) La camera a campo aperto utilizzata per la ricodifica. (b) Traiettorie dell'esplorazione del topo per 30 min nella camera. (c) Prestazioni comportamentali nel campo aperto. (d,e) Rappresentativo registrazioni LFP dalla tetrode (d) e dalla sonda di silicio (e). Il LED è collegato all'amplificatore della testa per registrare le posizioni del mouse. La pista lineare e la camera a campo aperto sono collegate al terreno elettrico per ridurre il rumore elettrostatico. Fare clic qui per visualizzare una versione più grande di questa figura.
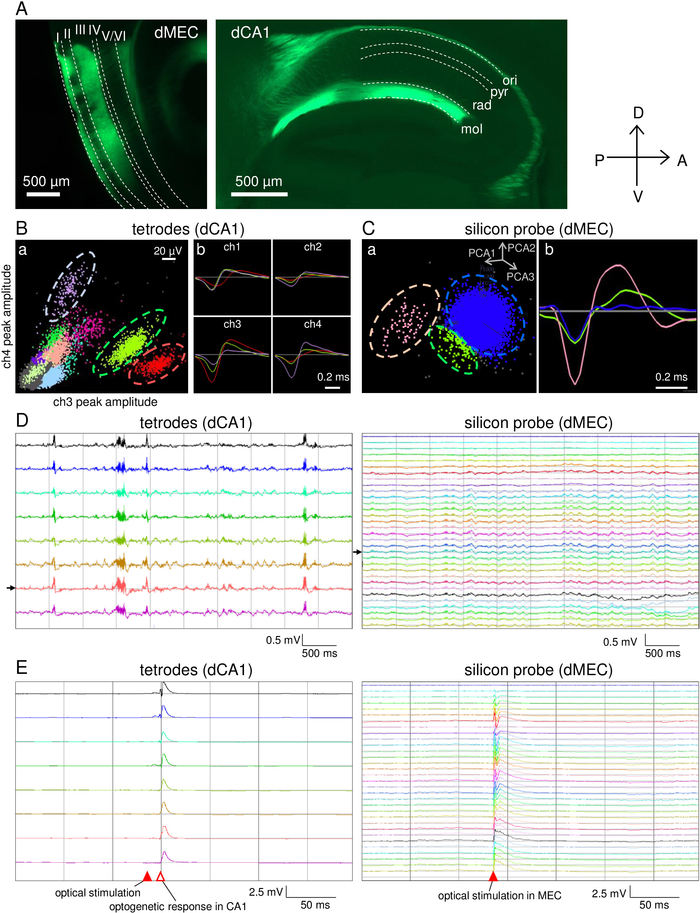
Figura 6: Risultati rappresentativi delle registrazioni simultanee nel CA1 e MEC e nella stimolazione optogenetica. (A) Espressione di AAV5-DIO-ChR2-YFP dopo 4 settimane di iniezione. I neuroni piramidali dello strato III MEC che proiettano i loro assoni da MEC dorsale a CA1 dorsale. Linee tratteggiate: ori, strati oriens; pry, piramidale strato; rad, radiato strato; mol, stratum lacunosum molecolare. (B) Registrazione rappresentativa dei picchi da uno dei tetrodi. (a) Proiezioni a grappolo 2D dei picchi registrati dalla tetrode. (b) Esempi della forma d'onda media di tre gruppi, indicati da linee tratteggiate in (a). (C) Registrazione del picco rappresentativa da uno dei siti di elettrodi a sonda di silicio. (a) Proiezioni cluster 2D di componenti principali di picco. (b) Esempi della forma d'onda media di tre grappoli. I gruppi di picchi (rosa e verde) sono separati dai gruppi di rumore (blu). I cluster in (B,C) vengono calcolati utilizzando il software KlustaKwik. (D) Tracce di LFP spontanei registrate simultaneamente dalle tetrodi in CA1 (a) e dalla sonda di silicio in MEC (b). Le frecce nere indicano il tetrode mostrato nel sito (B) e il sito di elettrodi silicio mostrati in (C). (E) Risposte LFP alla stimolazione ottica pulsata (10,6 mW, 1 ms; punta della freccia rossa riempita) dalla tetrode in CA1 (a) e dalla sonda in silicio in MEC (b). Fare clic qui per visualizzare una versione più grande di questa figura.
| grammi/uno | numero | somma [grammo] | ||
| corpo principale | 1.25 | 1 | 1.25 | |
| navetta | 0.04 | 1 | 0.04 | |
| montaggio del pernettotore a sonda | 0.19 | 1 | 0.19 | |
| portaferrule in fibra | 0.1 | 1 | 0.1 | |
| cono di schermatura | 1.82 | 1 | 1.82 | (0.72)* |
| pasta conduttiva | 0.2 | 1 | 0.2 | |
| vite macchina (#00, 2 mm), per contenere la BE | 0.05 | 2 | 0.1 | |
| vite macchina (#0-80, 3,5 mm) | 0.06 | 4 | 0.24 | |
| vite macchina (#0-80, 6mm) | 0.09 | 2 | 0.18 | |
| noce | 0.03 | 2 | 0.06 | |
| microdrive (tetrode) | 0.05 | 9 | 0.45 | |
| microdrive (sonda di silicio) | 0.29 | 1 | 0.29 | |
| sonda in silici | 0.28 | 1 | 0.28 | |
| scheda di interfaccia elettrica | 0.6 | 1 | 0.6 | |
| totale | 5.8 | (4.7)* | ||
Tabella 1: Peso individuale di ogni parte dell'array di microdrive. Il peso totale dell'array di microdrive è stato di 5,9 g dopo aver fissato il cono protettivo con resina epossidica (in caso di utilizzo di un cono di schermatura alternativo utilizzando un nastro di carta e alluminio).
| Procedure | ora |
| preparazione microdrive | |
| Stampa di parti 3D | 1 giorno |
| preparazione optrode | |
| Preparare lo stampo per la testa del microdrive | 1 giorno |
| Preparazione della testa del microdrive | 3 h |
| Attacco di una fibra ottica | 3 h |
| Collegamento di una navetta | 3 h |
| preparazione tetrode | |
| Preparare lo stampo per la testa del microdrive | 1 giorno |
| Preparazione delle teste di microguida | 3 h |
| Caricamento dei fili tetrodi | 1 giorno |
| Attacco del cono di schermatura | |
| Vernice di schermatura pittura | durante la notte |
| Attacco al corpo della microguida | 3 h |
| - queste procedure possono essere condotte in parallelo | |
Tabella 2: La linea temporale della preparazione del microdrive. La stampa di parti 3D, in attesa di curare la gomma in silicone / acrilico dentale / posinia, e il caricamento dei fili tetrode prendere la maggior parte del tempo della preparazione della matrice microdrive, in totale 4-5 giorni.
File supplementari: I file supplementari includono i dati del modello 3D di cinque parti microdrive in formato .sldprt e .stl. I file di modello 3D originali sono stati creati con il software Solidworks2003. Fare clic qui per scaricare questo file.
Discussione
Il protocollo dimostra come costruire e impiantare un array ibrido di microdrive che consente la registrazione di attività neurali da due aree cerebrali utilizzando tetrodi regolabili indipendenti e una sonda di silicio in topi che si comportano liberamente. Dimostra anche esperimenti optogenetici e il recupero della sonda di silicio dopo gli esperimenti. Mentre la sonda in silicone regolabile33 o l'impianto 36 della sonda opto-silicio sono dimostrati in precedenza nei topi, questo protocollo presenta chiari vantaggi nell'array di tetrodi simultanei e nell'impianto della sonda opto-silicio per fornire scelta dei tipi di sonde impiantate. Il tipo di sonda impiantata può essere commutato a seconda dello scopo dell'esperimento, come sonde multi-shank27,44 o Ultra-density Neuropixels21,45. La coordinazione e l'angolo di impianto7 possono essere facilmente modificati in fase di progettazione dell'oggetto 3D in base alle esigenze. Ad esempio, la registrazione a doppio sito o anche in triplo sito è possibile durante le attività di apprendimento attraverso strutture cerebrali legate alla memoria, come l'ippocampo46, corteccia entorinale47, corteccia prefrontale48, amigdala49, e la corteccia cingulate50.
Ci sono diverse procedure critiche per il successo dell'impianto e della registrazione. A causa della fragilità delle sonde a base di silicio, eventuali vibrazioni meccaniche o impatti sull'array di microtrasmissioni devono essere ridotte al minimo durante l'assemblaggio. Ad esempio, l'apertura dei fori intasati utilizzando un trapano deve essere terminata prima di caricare la sonda di silicio nell'array di microdrive. Inoltre, va sottolineato di controllare attentamente la connessione a terra in ogni fase durante la costruzione di microdrive array e la chirurgia dell'impianto per garantire la stabilità dei dati registrati. Le connessioni instabili o ad alta impedizione al suolo causano forti artefatti correlati al rumore e al movimento durante la sessione di registrazione. Per le registrazioni stabili, si consiglia di attendere 1-2 settimane dopo l'intervento chirurgico per evitare la deriva degli elettrodi perché il tessuto cerebrale è influenzato negativamente dalla chirurgia dell'impianto. Tuttavia, la qualità del segnale sulla sonda di silicio si riprende dopo 1-2 settimane dal trauma chirurgico sulla base dell'esperienza precedente. Si raccomanda di utilizzare un alloggiamento singolo per evitare danni all'array di microdrive impiantati da altri topi. Per l'esperimento optogenetico, è importante notare che la maggior parte delle sonde di silicio induce foto-artefatti in risposta a stimolazioni della luce51, mentre altre sono progettate per ridurre al minimo i foto-artefatti52 (ci sono foto-artifatti ridotti sonde in silicio disponibili in commercio).
Il peso dell'array di microdrive (5,9 g) è più pesante dei microdrive tipici descritti negli articoli precedenti12,53, principalmente a causa del corpo dell'array di microdrive (-21% del peso totale), del cono di schermatura (-31%) e delle parti metalliche (vite e noci: 22 dollari. Si raccomanda di utilizzare topi con un peso superiore a 25 g (2-3 mesi per i topi C57BL/654,55) per la chirurgia implantare, perché i topi con pesi corporei adeguati tendono a recuperare prima. Per questo motivo, questo array di microdrive potrebbe non essere la soluzione migliore per i topi giovani. Mentre i dispositivi che sono il 5%-10% del peso corporeo del mouse sono spesso guidati per essere tollerati per gli impianti12,56 (anche se non ci sono dati pubblicati di supporto per questo57),questo array di microdrive pesa il 24% del peso corporeo di 25 g di topi (19% quando si utilizza il cono alternativo descritto di seguito).
Tuttavia, i topi adulti impiantati sono stati in grado di muoversi liberamente e saltare nelle gabbie domestiche. I topi impiantati con un peso simile dell'array di microdrive (4,5 g) hanno dimostrato in precedenza di eseguire il compito comportamentale (attività labirinto lineare) anche sotto restrizione alimentare13,17. Lo svantaggio del peso non è un problema durante la registrazione, come un sistema di bilanciamento del contrappeso18,34,58 o sistema headpost59 supporterà l'array microdrive. Inoltre, il peso totale dell'array di microdrive può essere ridotto abbassando l'altezza o riducendo lo spessore del cono di schermatura e modificando il disegno per utilizzare viti più piccole.
Utilizzando il materiale di stampa 3D corrente, lo spessore del cono di schermatura può essere ridotto fino a 0,3 mm (dallo spessore attuale di 0,6 mm). L'altezza del cono può essere ridotta di 5 mm, purché i fili di tetrodo possano ancora essere coperti. L'esposizione dei fili tetrode si tradurrà in rottura dei fili e fallimento della registrazione a lungo termine. In alternativa, la preparazione del cono di schermatura con carta e nastro di alluminio può ridurre il peso del cono a 0,7 g di ,7 g (15% del peso totale; ridotto del 20% dal peso totale dell'array originale di microdrive); anche se, questi sono un compromesso con la forza fisica. Inoltre, la dimensione del microdrive (cono di schermatura corrente: 4,2 x 4,0 x 2,6 cm - asse maggiore x asse minore x altezza) può essere un ostacolo al cibo e all'accesso all'acqua se sono forniti dalla parte superiore della gabbia animale. Finché sono forniti sul pavimento della gabbia o dalla parete laterale, il microdrive non disturba i comportamenti naturali dei topi, come mangiare, bere, toelettare, allevare o nidificare60.
In conclusione, questo protocollo di microdrive fornisce ai ricercatori scelte flessibili per la registrazione da più aree cerebrali in topi liberamente in movimento per comprendere le dinamiche e le funzioni dei circuiti neurali di lunga data.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questo lavoro è stato sostenuto in parte dalla Japan Society for the Promotion of Science Overseas Research Fellowships (HO), Endowed Scholar Program (TK), Human Frontier Science Program (TK), Brain Research Foundation (TK), Faculty Science and Technology Acquisition e Retention Program (TK), Brain & Behavior Research Foundation (TK), e dalla Sumitomo Foundation Research Grant (JY), NARSAD Young Investigator Research Grant (JY). Ringraziamo W. Marks per preziosi commenti e suggerimenti durante la preparazione del manoscritto.
Materiali
| Name | Company | Catalog Number | Comments |
| #00-90 screw | J.I. Morris | #00-90-1/8 | EIB screws |
| #0-80 nut | Small Parts | B00DGB7CT2 | brass nut for holding fiber ferrule holder |
| #0-80 screw | Small Parts | B000FMZ57G | brass machine screw for probe connector mount, fiber ferrule holder, and shielding cone |
| 22 Ga polyetheretherketone tubes | Small Parts | SLPT-22-24 | for attaching to the shuttle, 0.025 inches inner diameter |
| 23 Ga stainless tubing | Small Parts | HTX-23R | for tetrode |
| 23 Ga stainless wire | Small Parts | HTX-23R-24-10 | for L-shape/support wire |
| 26 Ga stainless wire | Small Parts | GWX-0200 | for guide-posts |
| 30 Ga stainless wire | Small Parts | HTX-30R | for tetrode |
| 3-D CAD software package | Dassault Systèmes | SolidWorks 2003 | |
| 3D printer | FormLab | Form2 | |
| 5.5mil polyimide insulating tubes | HPC Medical | 72113900001-012 | |
| aluminum foil tape | Tyco | Tyco Adhesives 617022 Aluminum Foil Tape | for the alternative shielding cone |
| conductive paste | YSHIELD | HSF54 | for shielding cone |
| customized screws for silicon-probe microdrive | AMT | UNM1.25-HalfMoon | half-moon stainless screw, 1.5 mm diameter, 300 µm thread pitch |
| customized screws for tetrode microdrive | AMT | Yamamoto_0000-160_9mm | slotted stainless screw, 0.5 mm diameter, 160 µm thread pitch, custom-made to order for our design |
| dental acrylic | Stoelting | 51459 | |
| dental model resin | FormLab | RS-F2-DMBE-02 | |
| Dremel rotary tool | Dremel | model 800 | a grinder |
| drill bit | Fine Science Tool | 19007-05 | |
| electric interface board | Neuralynx | EIB-36-Narrow | |
| epoxy | Devcon | GLU-735.90 | 5 minutes epoxy |
| eye ointment | Dechra | Puralube Ophthalmic Ointment | to prevent mice eyes from drying during surgery |
| fiber polishing sheet | Thorlabs | LFG5P | for polishing the optical fiber |
| fine tweezers | Protech International | 15-368 | for loading/recovering the silicon probe |
| gold pins | Neuralynx | EIB Pins Small | |
| ground wire | A-M Systems | 781500 | 0.010 inch bare silver wire |
| headstage preamp | Neuralynx | HS-36 | |
| impedance meter | BAK electronics | Model IMP-2 | 1 kHz testing frequency |
| mineral oil | ZONA | 36-105 | for lubricating screws and wires |
| optical fiber | Doric | MFC_200/260-0.22_50mm_ZF1.25(G)_FLT | |
| Recording system | Neuralynx | Digital Lynx 4SX | |
| ruby fiber scribe | Thorlabs | S90R | for cleaving the optical fiber |
| silicon grease | Fine Science Tool | 29051-45 | |
| silicon probe | Neuronexus | A1x32-Edge-5mm-20-177 | Fig. 3, 4A, 4B, 5 |
| silicon probe | Neuronexus | A1x32-6mm-50-177 | Fig. 4C |
| silicon probe washing solution | Alcon | AL10078844 | contact lens cleaner |
| silicone lubber | Smooth-On | Dragon Skin 10 FAST | for preparation of microdrive mold |
| silver paint | GC electronic | 22-023 | silver print II coating, used for ground wires |
| skull screw | Otto Frei | 2647-10AC | 0.8 mm diameter, 0.200 mm thread pitch |
| standard surgical scissors | ROBOZ | RS-5880 | |
| stereotaxic apparatus | Kopf | Model 942 | |
| super glue | Loctite | LOC230992 | for applying to guide-posts |
| surgical tweezers | ROBOZ | RS-5135 | |
| Tetrode Twister | Jun Yamamoto | TT-01 | |
| tetrode wires | Sandvik | PX000004 |
Riferimenti
- Wilson, M. A., McNaughton, B. L. Dynamics of the hippocampal ensemble code for space. Science. 261 (5124), 1055-1058 (1993).
- Gothard, K. M., Skaggs, W. E., Moore, K. M., McNaughton, B. L. Binding of hippocampal CA1 neural activity to multiple reference frames in a landmark-based navigation task. The Journal of Neuroscience. 16 (2), 823-835 (1996).
- Keating, J. G., Gerstein, G. L. A chronic multi-electrode microdrive for small animals. Journal of Neuroscience Methods. 117 (2), 201-206 (2002).
- Winson, J. A compact micro-electrode assembly for recording from the freely moving rat. Electroencephalography and Clinical Neurophysiology. 35 (2), 215-217 (1973).
- Michon, F., et al. Integration of silicon-based neural probes and micro-drive arrays for chronic recording of large populations of neurons in behaving animals. Journal of Neural Engineering. 13 (4), 046018 (2016).
- Lansink, C. S., et al. A split microdrive for simultaneous multi-electrode recordings from two brain areas in awake small animals. Journal of Neuroscience Methods. 162 (1-2), 129-138 (2007).
- Billard, M. W., Bahari, F., Kimbugwe, J., Alloway, K. D., Gluckman, B. J. The systemDrive: a Multisite, Multiregion Microdrive with Independent Drive Axis Angling for Chronic Multimodal Systems Neuroscience Recordings in Freely Behaving Animals. eNeuro. 5 (6), (2018).
- Kloosterman, F., et al. Micro-drive array for chronic in vivo recording: drive fabrication. Journal of Visualized Experiments. (26), (2009).
- Lu, P. L., et al. Microdrive with Two Independent Moveable Sets for Wide-Ranging, Multi-Site, Multi-Channel Brain Recordings. Journal of Medical and Biological Engineering. 34 (4), 341-346 (2014).
- Haiss, F., Butovas, S. A miniaturized chronic microelectrode drive for awake behaving head restrained mice and rats. Journal of Neuroscience Methods. 187 (1), 67-72 (2010).
- Headley, D. B., DeLucca, M. V., Haufler, D., Pare, D. Incorporating 3D-printing technology in the design of head-caps and electrode drives for recording neurons in multiple brain regions. Journal of Neurophysiology. 113 (7), 2721-2732 (2015).
- Voigts, J., Siegle, J. H., Pritchett, D. L., Moore, C. I. The flexDrive: an ultra-light implant for optical control and highly parallel chronic recording of neuronal ensembles in freely moving mice. Frontiers in Systems Neuroscience. 7, 8 (2013).
- Yamamoto, J., Tonegawa, S. Direct Medial Entorhinal Cortex Input to Hippocampal CA1 Is Crucial for Extended Quiet Awake Replay. Neuron. 96 (1), 217-227 (2017).
- Schomburg, E. W., et al. Theta phase segregation of input-specific gamma patterns in entorhinal-hippocampal networks. Neuron. 84 (2), 470-485 (2014).
- Fernandez-Ruiz, A., et al. Entorhinal-CA3 Dual-Input Control of Spike Timing in the Hippocampus by Theta-Gamma Coupling. Neuron. 93 (5), 1213-1226 (2017).
- Rey, H. G., Pedreira, C., Quian Quiroga, R. Past, present and future of spike sorting techniques. Brain Research Bulletin. 119 (Pt B), 106-117 (2015).
- Gray, C. M., Maldonado, P. E., Wilson, M., McNaughton, B. Tetrodes markedly improve the reliability and yield of multiple single-unit isolation from multi-unit recordings in cat striate cortex. Journal of Neuroscience Methods. 63 (1-2), 43-54 (1995).
- Yamamoto, J., Wilson, M. A. Large-scale chronically implantable precision motorized microdrive array for freely behaving animals. Journal of Neurophysiology. 100 (4), 2430-2440 (2008).
- Nguyen, D. P., et al. Micro-drive array for chronic in vivo recording: tetrode assembly. Journal of Visualized Experiments. (26), (2009).
- Lu, L., Popeney, B., Dickman, J. D., Angelaki, D. E. Construction of an Improved Multi-Tetrode Hyperdrive for Large-Scale Neural Recording in Behaving Rats. Journal of Visualized Experiments. (135), (2018).
- Jun, J. J., et al. Fully integrated silicon probes for high-density recording of neural activity. Nature. 551 (7679), 232-236 (2017).
- Pastalkova, E., Itskov, V., Amarasingham, A., Buzsaki, G. Internally generated cell assembly sequences in the rat hippocampus. Science. 321 (5894), 1322-1327 (2008).
- Gauthier, J. L., Tank, D. W. A Dedicated Population for Reward Coding in the Hippocampus. Neuron. 99 (1), 179-193 (2018).
- Davidson, T. J., Kloosterman, F., Wilson, M. A. Hippocampal replay of extended experience. Neuron. 63 (4), 497-507 (2009).
- Gerwinn, S., Macke, J., Bethge, M. Bayesian population decoding of spiking neurons. Frontiers in Computational Neuroscience. 3, 21 (2009).
- Sakata, S., Harris, K. D. Laminar structure of spontaneous and sensory-evoked population activity in auditory cortex. Neuron. 64 (3), 404-418 (2009).
- Csicsvari, J., et al. Massively parallel recording of unit and local field potentials with silicon-based electrodes. Journal of Neurophysiology. 90 (2), 1314-1323 (2003).
- Harris, K. D., Quiroga, R. Q., Freeman, J., Smith, S. L. Improving data quality in neuronal population recordings. Nature Neuroscience. 19 (9), 1165-1174 (2016).
- Hilgen, G., et al. Unsupervised Spike Sorting for Large-Scale, High-Density Multielectrode Arrays. Cell Reports. 18 (10), 2521-2532 (2017).
- Rossant, C., et al. Spike sorting for large, dense electrode arrays. Nature neuroscience. 19 (4), 634-641 (2016).
- Iseri, E., Kuzum, D. Implantable optoelectronic probes for in vivo optogenetics. Journal of Neural Engineering. 14 (3), 031001 (2017).
- Klapoetke, N. C., et al. Independent optical excitation of distinct neural populations. Nature Methods. 11 (3), 338-346 (2014).
- Yamamoto, J., Suh, J., Takeuchi, D., Tonegawa, S. Successful execution of working memory linked to synchronized high-frequency gamma oscillations. Cell. 157 (4), 845-857 (2014).
- Rangel Guerrero, D. K., Donnett, J. G., Csicsvari, J., Kovacs, K. A. Tetrode Recording from the Hippocampus of Behaving Mice Coupled with Four-Point-Irradiation Closed-Loop Optogenetics: A Technique to Study the Contribution of Hippocampal SWR Events to Learning. eNeuro. 5 (4), (2018).
- Liang, L., et al. Integrated and Quick-to-Assemble (SLIQ) Hyperdrives for Functional Circuit Dissection. Frontiers in Neural Circuits. 11, 8 (2017).
- Chung, J., Sharif, F., Jung, D., Kim, S., Royer, S. Micro-drive and headgear for chronic implant and recovery of optoelectronic probes. Scientific Reports. 7 (1), 2773 (2017).
- Quilichini, P., Sirota, A., Buzsaki, G. Intrinsic circuit organization and theta-gamma oscillation dynamics in the entorhinal cortex of the rat. The Journal of Neuroscience. 30 (33), 11128-11142 (2010).
- Sauer, J. F., Struber, M., Bartos, M. Recording Spatially Restricted Oscillations in the Hippocampus of Behaving Mice. Journal of Visualized Experiments. (137), (2018).
- Shikano, Y., Sasaki, T., Ikegaya, Y. Simultaneous Recordings of Cortical Local Field Potentials, Electrocardiogram, Electromyogram, and Breathing Rhythm from a Freely Moving Rat. Journal of Visualized Experiments. (134), (2018).
- Brunetti, P. M., et al. Design and fabrication of ultralight weight, adjustable multi-electrode probes for electrophysiological recordings in mice. Journal of Visualized Experiments. 91 (91), e51675 (2014).
- Battaglia, F. P., et al. The Lantern: an ultra-light micro-drive for multi-tetrode recordings in mice and other small animals. Journal of Neuroscience Methods. 178 (2), 291-300 (2009).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of Visualized Experiments. (65), (2012).
- Suh, J., Rivest, A. J., Nakashiba, T., Tominaga, T., Tonegawa, S. Entorhinal cortex layer III input to the hippocampus is crucial for temporal association memory. Science. 334 (6061), 1415-1420 (2011).
- Royer, S., et al. Multi-array silicon probes with integrated optical fibers: light-assisted perturbation and recording of local neural circuits in the behaving animal. The European Journal of Neuroscience. 31 (12), 2279-2291 (2010).
- Steinmetz, N. A., Koch, C., Harris, K. D., Carandini, M. Challenges and opportunities for large-scale electrophysiology with Neuropixels probes. Current Opinion in Neurobiology. 50, 92-100 (2018).
- Jones, M. W., Wilson, M. A. Theta rhythms coordinate hippocampal-prefrontal interactions in a spatial memory task. PLoS Biology. 3 (12), e402 (2005).
- Frank, L. M., Brown, E. N., Wilson, M. A. A comparison of the firing properties of putative excitatory and inhibitory neurons from CA1 and the entorhinal cortex. Journal of Neurophysiology. 86 (4), 2029-2040 (2001).
- Kitamura, T., et al. Eng and circuits crucial for systems consolidation of a memory. Science. 356 (6333), 73-78 (2017).
- McGaugh, J. L., Cahill, L., Roozendaal, B. Involvement of the amygdala in memory storage: interaction with other brain systems. Proceedings of the National Academy of Sciences of the United States of America. 93 (24), 13508-13514 (1996).
- Frankland, P. W., Bontempi, B., Talton, L. E., Kaczmarek, L., Silva, A. J. The involvement of the anterior cingulate cortex in remote contextual fear memory. Science. 304 (5672), 881-883 (2004).
- Mikulovic, S., et al. On the photovoltaic effect in local field potential recordings. Neurophotonics. 3 (1), 015002 (2016).
- Kuleshova, E. P. Optogenetics – New Potentials for Electrophysiology. Neuroscience and Behavioral Physiology. 49 (2), 169-177 (2019).
- Meng, E., Hoang, T. MEMS-enabled implantable drug infusion pumps for laboratory animal research, preclinical, and clinical applications. Advanced Drug Delivery Reviews. 64 (14), 1628-1638 (2012).
- Hu, S., et al. Dietary Fat, but Not Protein or Carbohydrate, Regulates Energy Intake and Causes Adiposity in Mice. Cell Metabolism. 28 (3), 415-431 (2018).
- Yang, Y., Smith, D. L., Keating, K. D., Allison, D. B., Nagy, T. R. Variations in body weight, food intake and body composition after long-term high-fat diet feeding in C57BL/6J mice. Obesity. 22 (10), 2147-2155 (2014).
- Morton, D. B., et al. Refinements in telemetry procedures. Seventh report of the BVAAWF/FRAME/RSPCA/UFAW Joint Working Group on Refinement, Part A. Laboratory Animals. 37 (4), 261-299 (2003).
- Lidster, K., et al. Opportunities for improving animal welfare in rodent models of epilepsy and seizures. Journal of Neuroscience Methods. 260, 2-25 (2016).
- Lin, L., et al. Large-scale neural ensemble recording in the brains of freely behaving mice. Journal of Neuroscience Methods. 155 (1), 28-38 (2006).
- Kislin, M., et al. Flat-floored air-lifted platform: a new method for combining behavior with microscopy or electrophysiology on awake freely moving rodents. Journal of Visualized Experiments. (88), e51869 (2014).
- Gaskill, B. N., Karas, A. Z., Garner, J. P., Pritchett-Corning, K. R. Nest building as an indicator of health and welfare in laboratory mice. Journal of Visualized Experiments. (82), 51012 (2013).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon