Method Article
Système hybride de micropropulsion avec sonde opto-Silicon récupérable et tetrode pour l'enregistrement à haute densité de dual-Site dans les souris en mouvement libre
Dans cet article
Résumé
Ce protocole décrit la construction d'un réseau hybride de micropropulsion qui permet l'implantation de neuf tétrodes réglables indépendamment et d'une sonde opto-silicium réglable dans deux régions du cerveau chez des souris en mouvement libre. Une méthode de récupération et de réutilisation sécuritaire de la sonde opto-silicium à des fins multiples est également démontrée.
Résumé
Les enregistrements neuronaux multirégionaux peuvent fournir des informations cruciales pour comprendre les interactions à l'échelle des temps fins entre plusieurs régions du cerveau. Cependant, les conceptions conventionnelles de micropropulsion permettent souvent seulement l'utilisation d'un type d'électrode pour enregistrer à partir de régions simples ou multiples, limitant le rendement des enregistrements de profil d'une unité ou de profondeur. Il limite également souvent la capacité de combiner des enregistrements d'électrodes avec des outils optogénétiques pour cibler l'activité spécifique de la voie et/ou du type cellulaire. Présenté ici est un tableau hybride de microdrive pour les souris en mouvement libre pour optimiser le rendement et une description de sa fabrication et la réutilisation du tableau de microdrive. La conception actuelle utilise neuf tétrodes et une sonde opto-silicium implantée dans deux zones cérébrales différentes simultanément chez des souris en mouvement libre. Les tétrodes et la sonde opto-silicium sont réglables indépendamment le long de l'axe dorsoventral dans le cerveau pour maximiser le rendement des activités unitaires et oscillatoires. Ce tableau de micropropulsion intègre également une configuration pour la lumière, la médiation de la manipulation optogénétique pour étudier les réponses régionales ou de type cellulaire-spécifiques et les fonctions des circuits neuronaux à longue portée. En outre, la sonde opto-silicium peut être récupérée et réutilisée en toute sécurité après chaque expérience. Étant donné que le réseau de micropropulsions se compose de pièces imprimées en 3D, la conception des microdrives peut être facilement modifiée pour s'adapter à divers paramètres. La conception du réseau de micropropulsions et la façon d'attacher la fibre optique à une sonde de silicium pour des expériences d'optogénétique, suivies de la fabrication du faisceau de tétrodes et de l'implantation du tableau dans un cerveau de souris. L'enregistrement des potentiels locaux de champ et de l'unité de pointe combiné avec la stimulation optogénétique démontrent également la faisabilité du système de réseau de microdrive chez les souris librement en mouvement.
Introduction
Il est crucial de comprendre comment l'activité neuronale soutient le processus cognitif, comme l'apprentissage et la mémoire, en étudiant comment différentes régions du cerveau interagissent dynamiquement les unes avec les autres. Pour élucider la dynamique de l'activité neuronale sous-jacente aux tâches cognitives, l'électrophysiologie extracellulaire à grande échelle a été menée chez des animaux en mouvement libre à l'aide de réseaux de micropropulsion s'ilsnesontpasdotés de 2,3, 4. Au cours des deux dernières décennies, plusieurs types de micropropulsion ont été développés pour implanter des électrodes dans de multiples régions du cerveau pour les rats5,6,7,8 et les souris9, 10 Ans et plus , 11 Ans, états-unis ( , 12. Néanmoins, les conceptions actuelles de micropropulsion ne permettent généralement pas l'utilisation de plusieurs types de sondes, ce qui oblige les chercheurs à choisir un seul type d'électrode avec des avantages et des limitations spécifiques. Par exemple, les tableaux de tétrode fonctionnent bien pour les régions du cerveau densément peuplées telles que l'hippocampe dorsal CA11,13, tandis que les sondes de silicium donnent un meilleur profil géométrique pour l'étude des connexions anatomiques14 , 15.
Les tetrodes et les sondes de silicium sont souvent utilisées pour l'enregistrement chronique in vivo, et chacune a ses propres avantages et inconvénients. Il a été prouvé que les tetrodes présentent des avantagessignificatifs dans un meilleur isolement unitaire que les électrodes 16,17, en plus de la rentabilité et de la rigidité mécanique. Ils fournissent également des rendements plus élevés des activités unitaires lorsqu'ils sont combinés avec des microdrives8,18,19,20. Il est essentiel d'augmenter le nombre de neurones enregistrés simultanément pour comprendre la fonction des circuits neuronaux21. Par exemple, un grand nombre de cellules sont nécessaires pour étudier de petites populations de types de cellules fonctionnellement hétérogènes telles que le temps liéà 22 ou la récompense codant23 cellules. Des nombres de cellules beaucoup plus élevés sont nécessaires pour améliorer la qualité de décodage des séquences de pointes13,24,25.
Les tétrodes, cependant, ont un inconvénient dans l'enregistrement des cellules spatialement distribuées, comme dans le cortex ou le thalamus. Contrairement aux tétrodes, les sondes de silicium peuvent fournir la distribution spatiale et l'interaction des potentiels locaux de champ (LFP) et des activités de pointe au sein d'une structure locale14,26. Les sondes de silicium multi-tiges augmentent encore le nombre de sites d'enregistrement et permettent l'enregistrement à travers les structures simples ou voisines27. Cependant, ces tableaux sont moins flexibles dans le positionnement des sites d'électrodes par rapport aux tétrodes. En outre, des algorithmes complexes de tri des pointes sont nécessaires dans les sondes à haute densité pour extraire des informations sur les potentiels d'action des canaux voisins pour refléter les données acquises par les tétrodes28,29,30. Par conséquent, le rendement global des unités individuelles est souvent inférieur à celui des tétrodes. De plus, les sondes de silicium sont désavantageuses en raison de leur fragilité et de leur coût élevé. Ainsi, le choix des sondes de tetrodes vs de silicium dépend de l'objectif de l'enregistrement, qui est une question de savoir si l'obtention d'un rendement élevé d'unités uniques ou de profilage spatial sur les sites d'enregistrement est prioritaire.
En plus d'enregistrer l'activité neuronale, la manipulation optogénétique est devenue l'un des outils les plus puissants en neurosciences pour examiner comment des types de cellules spécifiques et / ou des voies contribuent aux fonctions du circuit neuronal13,31, 32,33. Cependant, les expériences optogénétiques exigent la considération additionnelle dans la conception de réseau de microdrive pour attacher le connecteur de fibre aux sources lumineuses de stimulation34,35,36. Souvent, la connexion de la fibre optique nécessite une force relativement importante, ce qui peut conduire à un changement mécanique de la sonde dans le cerveau. Par conséquent, il n'est pas une tâche triviale de combiner une fibre optique implantable à des réseaux de micropropulsion conventionnels.
Pour les raisons ci-dessus, les chercheurs sont tenus d'optimiser le choix du type d'électrode ou d'implanter une fibre optique en fonction de l'objectif de l'enregistrement. Par exemple, les tétrodes sont utilisées pour obtenir un rendement unitaire plus élevé dans l'hippocampe1,13, tandis que les sondes de silicium sont utilisées pour étudier le profil de profondeur laminaire des zones corticales, telles que le cortex entorhinal médial (MEC)37. Actuellement, des microdrives pour l'implantation simultanée de tétrodes et de sondes de silicium avaient été signalés pour les rats5,11. Cependant, il est extrêmement difficile d'implanter plusieurs tétrodes et sondes de silicium chez la souris en raison du poids des microdrives, de l'espace limité sur la tête de la souris et des exigences spatiales pour concevoir le microdrive pour employer différentes sondes. Bien qu'il soit possible d'implanter des sondes de silicium sans micropropulsion, cette procédure ne permet pas l'ajustement de la sonde et abaisse le taux de réussite de la récupération de silicium-sonde12,38. En outre, les expériences optogénétiques nécessitent des considérations supplémentaires dans la conception de réseaux de micropropulsions. Ce protocole montre comment construire et implanter un réseau de micropropulsion pour l'enregistrement chronique chez les souris en mouvement libre, ce qui permet l'implantation de neuf tétrodes réglables indépendamment et d'une sonde opto-silicium réglable. Ce réseau de micropropulsionfacilite également les expériences optogénétiques et la récupération de la sonde de silicium.
Protocole
Toutes les méthodes décrites ici ont été approuvées par l'Institutional Animal Care and Use Committee (IACUC) de l'University of Texas Southwestern Medical Center.
1. Préparation des pièces de réseau de micropropulsion
- Imprimez les pièces du tableau de micropropulsion à l'aide d'une imprimante 3D à l'aide de résine de modèle dentaire (Figure 1A,B). Assurez-vous que l'épaisseur des couches imprimées en 3D est inférieure à 50 m pour garder les petits trous sur les pièces imprimées clairs et viables.
REMARQUE: Le réseau de micropropulsion se compose de cinq parties (Figure 1C):(1) le corps principal du tableau de micropropulsion, qui comprend neuf vis microdrive pour les tétrodes et une vis pour un silicium-sonde (Figure 1Ca-d). La coordination du faisceau et du trou tétrode pour la sonde opto-silicium au fond dépend des coordonnées de la zone cérébrale cible (figure 1Cd); (2) une navette pour attacher une sonde de silicium ou optrode (figure 1Ce); (3) une monture électrique connecteur de sonde pour tenir le connecteur de sonde de silicium (figure 1Cf); (4) un support de ferrule de fibre qui serre à la partie centrale du corps pour empêcher des mouvements indésirables de la sonde implantée d'opto-silicium en branchant/débrancher un connecteur de fibre optique (figure 1Cg); et (5) un cône de blindage qui fournit un blindage physique et électrique au réseau de micropropulsion pour un enregistrement stable (Figure 1Ch). Le poids total du réseau de micropropulsion est de 5,9 g, y compris le cône de blindage (tableau 1). Si les trous sont obstrués dans les pièces imprimées, percer les trous à l'aide de bits de forage: #76 pour les trous intérieurs et #68 pour les trous externes pour les vis tétrode-microdrive, #71 pour le trou de support de microdrive-vis tétrode, et #77 pour les trous pour les postes de guidage au bas de le corps. - Insertion de poteaux de guidage dans le corps du tableau de micropropulsion.
- Coupez deux longueurs de 16 mm de fil d'acier inoxydable 26-Ga. Aiguisez délicatement les pointes de fil à l'aide d'un broyeur rotatif.
- Insérer les fils dans les trous inférieurs du corps (Figure 2A). Appliquer une petite quantité de colle cyanoacrylate au fond du corps pour fixer les poteaux de guidage.
2. Préparation de sonde opto-silicium
- Préparer la vis microdrive pour une sonde de silicium.
REMARQUE : La vis de micropropulsion de la sonde de silicium se compose d'une vis personnalisée (300 m de hauteur), supportant un tube de soutien, et d'un tube en forme de L (Figure 2B).- Préparer le moule pour la tête de microdrive (Figure 2C). Pour construire le moule, préparez le motif en plastique imprimé en 3D du microdrive (Figure 2Ca). Ensuite, versez gel de silicone liquide après avoir fait un mur temporel en mettant des bandes autour du modèle. Enlever les bulles d'air en secouant doucement, attendre jusqu'à ce qu'il soit guéri, puis retirer le moule en silicone-gel du modèle (Figure 2Cb).
- Couper 18 mm et 9,5 mm de longueurs de fil inoxydable de 23 G à l'aide d'un broyeur rotatif. Roughen le haut 2 -3 mm des fils avec un broyeur rotatif pour améliorer l'adhérence de l'acrylique dentaire.
- Prenez une vis personnalisée et appliquez une petite quantité d'huile de silicium pour réduire le frottement avec l'acrylique dentaire. Fixez les fils et une vis personnalisée sur le moule.
- Verser l'acrylique dentaire dans le moule à l'aide d'une seringue pour éliminer les bulles d'air autour des fils et des vis. La contamination par les bulles d'air fragilisera le microdrive. Attendez que l'acrylique dentaire soit entièrement guéri, puis enlevez les vis de micropropulsion du moule. Pliez 6 mm de la pointe de fil plus longue à un angle de 60 degrés à l'aide de pinces.
- Vérifiez la qualité des vis micromotrices (p. ex. fissures, bulles d'air et frottement) pour faire pivoter la vis. S'il y a une forte friction, faites pivoter la vis jusqu'à ce qu'elle devienne lisse à l'aide d'un tournevis électrique avec une pointe de conducteur personnalisée, qui se couple avec la vis microdrive.
- Installez la vis de microdrive dans le corps de réseau de microdrive pour vérifier si elle se déplace vers le haut et vers le bas en douceur en tournant la vis. Les fils de la vis sont automatiquement créés lors de l'insertion de la vis dans le trou du corps.
- Préparer la navette (Figure 3Aa).
- Couper deux tubes de 5 mm de polyetheretherketone (PEEK) à l'aide de ciseaux pointus. Aligner les tubes des deux côtés de la navette. Coller les tubes et la navette à l'aide d'époxy.
- Appliquer une petite quantité d'huile de silicium sur les poteaux de guidage. Vérifiez la qualité de la navette en insérant sur les poteaux de guidage du corps du tableau de microdrive. Assurez-vous que la navette se déplace en douceur sans friction excessive.
- Préparer un optorode (Figure 3Ab). Cette étape peut être ignorée si une expérience optogénétique n'est pas nécessaire.
- Couper la fibre optique à 21 mm de longueur à l'aide d'un coupeur rubis. Broyer la pointe de fibre pour rendre la pointe plate et brillante.
- Placez délicatement la fibre optique sur le côté avant de la sonde de silicium. L'extrémité de la fibre est positionnée à 200 à 300 m au-dessus du sommet des sites d'électrodes. Maintenez la fibre temporairement avec du ruban transparent.
- Collez la fibre optique à la base de la sonde de silicium en utilisant une petite quantité d'époxy. Attendre au moins 5 h jusqu'à ce que l'époxy soit entièrement guéri.
REMARQUE: Il est recommandé d'attacher la fibre optique sur le même côté que les sites d'électrodes. L'attachement de la fibre à l'arrière peut empêcher la lumière d'éclairer correctement les sites d'enregistrement.
- Fixez la navette à la sonde de silicium (Figure 3Ac): appliquez une petite quantité d'époxy à l'arrière de la base de la sonde de silicium. Fixez la partie inférieure de la navette à la base de la sonde de silicium, et maintenez doucement en position pendant 2 à 3 min pour éviter la formation d'un espace entre la navette et la base de la sonde de silicium pendant le traitement initial de l'époxy. Attendre au moins 5 h jusqu'à ce que l'époxy soit complètement guéri.
- Insérez soigneusement les tubes de la navette sur les postes de guidage du corps principal sous le microscope (Figure 3B). Pendant cette procédure, maintenez la rainure de la navette avec de fines pinces.
- Insérez la vis microdrive dans le trou de vis en tournant la vis. Engagez la sonde de silicium et la vis microdrive en insérant la pointe du fil en forme de L dans la rainure de la tête de la navette (Figure 3C).
- Attachez le porte-connecteur électrique de sonde au corps de réseau de microdrive (figure 3D).
- Couper deux vis #0 à 3,5 mm de longueur de fil. Broyer les pointes pour enlever les bavures.
- Placez le porte-sonde sur le corps. Placez le connecteur électrique de sonde de silicium dans le support.
- Sécurisez le connecteur de sonde de silicium dans le support utilisant l'époxy, et assurez-vous de ne pas le coller au corps de réseau de microdrive pour permettre la procédure de récupération de la sonde de silicium. Insérez les vis pour tenir le porte-sonde.
- Attachez le porte-ferrule à la sonde opto-silicium et au corps du réseau de micropropulsions (Figure 3D).
- Couper deux vis #0 à 6 mm de longueur de fil. Broyer les pointes pour enlever les bavures.
- Broyer l'extérieur de deux #0 les écrous à vis de machine pour faire de petites noix d'hexagone avec 2,5 à 3,0 mm de diamètre extérieur pour réduire le poids et l'espace.
- Insérer les vis dans le composant A du support. Coller les têtes de vis à l'aide d'époxy.
- Appliquer une petite quantité de graisse de silicium sur les composants A et B pour réduire la friction avec le corps. Insérez le composant A dans le corps, puis tenez-le temporellement à l'aide d'une pince à épiler inverse.
- Placez le composant B sur les vis du composant A. Enfiler les noix personnalisées dans les vis. Utilisez des pinces pour serrer les noix pour fixer le porte-ferrule sur le corps.
- Insérer la ferrule de fibre dans la rainure du support de ferrule de fibre (composant B). Assurez-vous que la ferrule de fibre colle 4-5 mm hors du support.
- Appliquer une petite quantité d'époxy entre la ferrule et la rainure du support. Attendez que l'époxy soit entièrement guéri et vérifiez que la ferrule ne bouge pas. Vérifiez le porte-navette et le support de ferrule pour le mouvement lisse en desserrant les écrous avant de tourner le microdrive-vis.
- Vérifiez la distance de travail de la sonde. Assurez-vous que la pointe de la sonde se rétracte complètement dans le corps lorsque le porte-ferrule est en position supérieure pendant que les tubes de la navette sont toujours associés aux postes de guidage. La distance de travail maximale est déterminée par la longueur de la sonde de silicone et la région du cerveau cible.
- Si la vis microdrive est lâche, appliquez une petite quantité d'acrylique dentaire autour de la vis pour ajouter plus de fils pour le soutien. Lorsqu'elle est guérie, faites pivoter la vis pour vérifier l'étanchéité et la stabilité.
3. Préparation tetrode
REMARQUE: Cette procédure est similaire aux articles déjà publiés8,19,20,39.
- Préparer les vis microdrive pour la tétrode. Le microdrive pour un tétrode se compose d'une vis sur mesure et d'un tube de 23 G (Figure 2B). Cette procédure est semblable à l'article 2.1.
- Faire un paquet de 30 G tube en acier inoxydable qui a un fil de 5,5 mil à l'intérieur. Dans ce cas, un total de neuf tubes de 30 G (huit tétrodes d'enregistrement et une électrode de référence) ont été utilisés.
- Enfilez le faisceau de 30 G du bas du corps d'entraînement, et fixez-les avec un tube à parois minces de 20 G au corps principal. Couper le fond du paquet avec un broyeur rotatif pour que la pointe soit uniforme et rincer. Couper la partie supérieure des tubes de 30 G avec un broyeur rotatif de sorte que le tube de 30 G sort à environ 0,5 mm du corps principal.
- Chargez des tubes isolants polyimides de 5,5 mil dans les tubes de 30 G. Préparer les fils tétrodes et les charger dans une carte d'interface électrique (BEI) de 32 canaux. Vérifiez la connexion électrique avec le testeur d'impédance avant la coupe de précision finale.
- Baisse de l'impedance de pointe d'électrode à 250-350 kô avec la solution de plaquage d'or. Fixer tous les tétrodes avec de la superglue.
- Combler l'écart excessif entre le tube de polyimide et le tétrode avec de l'huile minérale pour l'étanchéité et la lubrification. Achemine le fil de terre vers la BEI.
REMARQUE: Si nécessaire, la fibre optique peut être intégrée le long des fils tétrodes12.
4. Fixation du cône de blindage
- Peignez la peinture conductrice argentée de blindage à l'intérieur du cône imprimé. Placez le réseau de micropropulsion à l'intérieur du cône (Figure 3E).
- Couper deux vis #0 à 3,5 mm de longueur de fil. Attachez les vis de l'extérieur du cône pour maintenir le tableau de microdrive en place.
- Appliquez de la peinture argentée autour de la tête de vis pour connecter électriquement le cône de blindage avec le sol électrique. Vérifiez la connectivité électrique entre le fil du sol et le cône. Appliquer une petite quantité d'époxy entre le corps du tableau de micropropulsion et le cône de blindage pour attacher solidement le corps.
REMARQUE: Une autre façon de préparer le cône de blindage est d'utiliser du ruban en aluminium40 (Figure 3F). Tout d'abord, préparer le papier modèle pour le cône de blindage après avoir collé du papier d'aluminium sur le papier (Figure 3Fa). Ensuite, rouler le papier et l'attacher au corps microdrive à l'aide d'une petite quantité de colle cyanoacrylate (Figure 3Fb). Le poids de ce cône est de 0,72 g et le poids total du réseau de micropropulsion est réduit à 4,7 g (tableau 1).
5. Chirurgie implantaire
REMARQUE: Cette procédure est modifiée à partir d'articles précédemment publiés18,39,41 pour l'implantation à double site. Assurez-vous que le poids de l'animal est de plus de 25 g pour l'implant microdrive pour une récupération plus rapide après la chirurgie.
- préparation
- Pour préparer une vis moulue, attachez le fil d'argent à une vis de crâne et appliquez la peinture argentée. Ensuite, attachez une épingle d'or sur le côté opposé du fil à l'aide de peinture argentée.
- Préparer l'adaptateur de fixation d'entraînement pour tenir le tableau de microdrive à un dispositif stéréotaxique. Fixer un connecteur mâle à une poignée en acier inoxydable à l'aide d'époxy. Assurez-vous que l'alignement du connecteur et de la poignée en acier inoxydable est droit.
- Dans le cas où la confirmation histologique est nécessaire après l'enregistrement, appliquer Di-I aux tétrodes ou à l'arrière de la sonde de silicium38.
- Abaissez la sonde de silicium vers le bas pour être désirée profondeur. Desserrer les écrous du porte-ferrule à l'aide de pinces, abaisser la sonde de silicium (sonde d'opto-silicium) en tournant la vis microdrive-screw de la sonde de silicium, puis attacher les écrous pour fixer le support de ferrule. Lors de l'implantation de tétrodes dans la zone hippocampique CA1 et d'une sonde de silicium dans MEC, la distance entre la canule tétrode et la pointe de la sonde de silicium est de 3 à 4 mm.
- Définir la souris anesthésié (0,8% à 1,5% isoflurane) dans un dispositif stéréotaxique. L'état anesthésique de la souris est confirmé par l'absence du réflexe de pincement des orteils. Appliquer une pommade claire sur les yeux pour éviter le séchage. Couvrez les yeux d'un morceau de papier d'aluminium pour vous protéger contre une forte exposition à la lumière chirurgicale.
- Désinfecter le cuir chevelu de la souris avec de l'iode et de l'isopropanol après avoir rasé la fourrure. Faire une incision de 1,5 à 2,0 cm au cuir chevelu à l'aide de ciseaux chirurgicaux standard, et enlever le tissu sur le crâne à l'aide d'écouvillons de coton après l'application sous-cutanée de la lidocaïne.
- Alignez la tête de la souris avec l'outil stéréotaxique. Assurez-vous que la différence de hauteur entre bregma et lambda est inférieure à 100 m. Déterminez l'emplacement de la craniotomie à l'aide d'un atlas et marquez ces endroits à l'aide d'un crayon stérilisé.
- Ancrer les vis du crâne (0,8 mm de diamètre, 0,200 mm de fil) en les tournant 1,5 virage (0,3 mm) sur le crâne, à l'aide de pinces chirurgicales et d'un tournevis après avoir percé 8 à 11 trous dans le crâne à l'aide d'une foreuse de 0,5 mm.
REMARQUE : On suggère 2 à 4 trous dans le crâne frontal, 2 à 3 trous de chaque côté du crâne pariétal et 1 à 2 trous dans le crâne interpariétal. - Fixez la vis du sol au trou en la tournant d'un tour (0,2 mm) après avoir percé un trou dans l'os interpariétal. Assurez-vous que ce trou ne pénètre pas à travers l'os dans le boîtier du cerveau; autrement, les signaux céréveleux contamineront l'enregistrement. Vérifiez que l'impédance est inférieure à 20 k 'à 1 kHz entre la vis au sol et les vis du crâne à l'aide d'un compteur d'impédance.
REMARQUE : Une plus grande impédance entraînera l'introduction d'artefacts de mouvement pendant l'enregistrement. - Effectuer la craniotomie aux endroits marqués. Le dura peut être laissé intact chez la souris.
- Connectez la broche mâle de la vis au sol et le connecteur au sol du réseau de micropropulsions. Vérifiez la connectivité à l'aide du compteur d'impédance en mesurant entre la vis au sol et le blindage.
- Fixez le tableau de micropropulsion à l'adaptateur, fixez-le à l'appareil stéréotaxique et abaissez lentement la sonde de silicium jusqu'à la profondeur désirée. Assurez-vous que les faisceaux de tétrodes sont placés au-dessus de la surface du cerveau, mais toujours à l'intérieur du réseau de micropropulsion lorsque la sonde de silicium est insérée dans le cerveau (Figure 4A).
- Appliquer soigneusement la graisse de silicium pour sceller la zone de la sonde de silicium et le faisceau de tétrode (Figure 4B). Placez une petite quantité de graisse de silicium à l'extrémité d'une aiguille de 20 G et appliquez la graisse autour des sondes à l'aide de l'aiguille. Répétez jusqu'à ce que la graisse de silicium recouvre complètement la zone autour de la sonde afin que l'acrylique dentaire ne coule pas sur ou sous les électrodes/sondes. Veillez à ne pas laisser la graisse toucher les sites d'électrodes, sinon elle augmentera considérablement l'impédance des sites d'enregistrement.
- Appliquer l'acrylique dentaire pour fixer le tableau de microdrive aux vis d'ancrage dans le crâne.
REMARQUE : Il est recommandé d'appliquer l'acrylique dentaire en trois couches pour éviter la chaleur excessive produite pendant le durcissement de l'acrylique. - Retirez soigneusement l'adaptateur du tableau de micropropulsion. Injecter 1 ml de PBS sous-cutané pour prévenir la déshydratation. Injecter 5 mg/kg méloxicam sous-cutané comme traitement analgésique.
- Couvrez le connecteur de sonde de silicium par un morceau de ruban adhésif pour empêcher toute saleté d'entrer à l'intérieur des connexions électriques. Couvrez le tableau de microdrive à l'aide d'un film de paraffine en plastique et collez-le en place.
- Administrer un traitement analgésique approprié pendant 3 jours (p. ex., injections sous-cutanées de 2 mg/kg de méloxicam une fois par jour). Prévoyez de 3 à 5 jours pour la récupération avant de commencer l'ajustement du tétrode. La souris implantée après la période de récupération est indiquée dans la figure 4C.
6. Récupération de la sonde de silicium (figure 4D)
- Injecter de la kétamine (75 mg/kg) et de la dexmédetomidine (1 mg/kg) anesthésiques par voie intrapéritoyte et l'absence confirmée du réflexe de pincement des orteils. Fixez la souris anesthésiée en persinant directement 4% de paraformaldéhyde à travers le cœur à l'aide d'une capuche. Les méthodes chirurgicales pour les rongeurs sont décrites précédemment42.
- Desserrer les écrous du porte-ferrule à l'aide d'une pince. Ensuite, déplacez-le soigneusement vers le haut du corps en tournant la vis d'ajustement pour rétracter complètement le silicium-sonde vers l'intérieur du corps de tableau de microdrive. Attachez les écrous pour maintenir la sonde en position supérieure.
- Sortez le cerveau de la souris du fond en craquant le crâne par le côté. Le réseau de micropropulsion est maintenant séparé de l'animal.
- Retirez complètement la vis microdrive en forme de L qui conduit la sonde de silicium. Enroulez et sortez les écrous du porte-ferrule à l'aide de pinces. Sortez le composant A du porte-ferrule.
- Dévisser le connecteur de la sonde monter et détacher du corps d'entraînement. Vérifiez que le montage du connecteur de la sonde peut se détacher du corps du réseau de micropropulsions.
- Tenez la partie supérieure de la navette avec des pinces, puis faites glisser soigneusement l'assemblage de sonde de silicium à partir du tableau de micropropulsion.
- Nettoyez l'extrémité de la sonde avec le nettoyant de lentille de contact (d'abord avec l'enzyme, puis 3% peroxyde d'hydrogène) pendant au moins 1 jour. Essuyez soigneusement la pointe de l'électrode à l'aide de tampons à isopropanol sous le microscope. Gardez la sonde dans une boîte de rangement sans statique.
REMARQUE : Le montage de connecteur de navette et de sonde reste attaché à la sonde de silicium et peut être réutilisé dans la prochaine implantation.
REMARQUE : Certaines sondes de silicium ne sont pas tolérables avec du peroxyde d'hydrogène. Dans ce cas, utilisez la solution de lentille de contact contenant l'enzyme protéolytique seulement. - Pour réutiliser le corps du tableau de micropropulsion pour la prochaine chirurgie, retirez l'acrylique dentaire à l'aide d'une combinaison de perceuses à pointe fine et de pinces. Ensuite, récupérer les vis de crâne en immergeant l'acrylique dentaire enlevé dans l'acétone. Notez que l'acétone va dissoudre les parties en plastique du tableau de microdrive.
- Enlever l'époxy entre le corps de microdrive et le cône de blindage à l'aide d'un scalpel.
REMARQUE : Aucune partie supplémentaire n'a besoin d'être imprimée à nouveau pour la prochaine chirurgie si le microdrive n'est pas cassé.
Résultats
Le réseau de micropropulsion a été construit dans les 5 jours. La chronologie de la préparation des micropropulsions est décrite dans le tableau 2. Utilisant ce microdrive, neuf tétrodes et une sonde de silicium ont été implantées dans le CA1 hippocampal et le MEC de la souris [21 semaines/29 g de poids corporel mâle pOxr1-Cre (C57BL/6 fond)], respectivement. Cette souris transgénique exprime Cre dans mec couche III neurones pyramidaux. La souris a été injectée avec 200 nL d'AAV5-DIO-ChR2-YFP (titer: 7.7 x 1012 gc/mL) dans le MEC 10 semaines avant l'implant d'électrode. Les LFP ont été enregistrés à l'aide d'un filtre à faible passage (1-500 Hz), et des unités de pointe ont été détectées à l'aide d'un filtre à passage élevé (0,8 à 5 kHz). La stimulation lumineuse (450 nm) a été réalisée à l'aide d'une largeur d'impulsion de 1 ms à une intensité de 10,6 mW mesurée à l'extrémité du connecteur de fibres. L'électrode de référence pour l'enregistrement du tétrode a été placée dans la matière blanche à l'aide d'un fil de tétrode dédié. La référence pour l'enregistrement de la sonde de silicium a été fixée comme le canal supérieur de la sonde.
Après l'ajustement du tétrode, les performances comportementales ont été testées sur une piste linéaire (Figure 5A) et dans un champ ouvert (Figure 5B). Dans les deux expériences, la souris a exploré librement pendant 30 min (Figure 5Aa,b,c; Figure 5Ba,b,c). Les signaux électrophysiologiques ont été enregistrés avec succès sans bruit grave lié au mouvement tout au long de la séance d'enregistrement (figure5Ad,e; Figure 5 Bd,e). Ensuite, la stimulation de la lumière a été effectuée au MEC pour stimuler les neurones mec couche III qui projettent à la CA143 (Figure 6A). Des activités spontanées de pieux (figure6B,C) et lFPs (figure 6D) ont été enregistrées à partir des tétrodes et de la sonde de silicium lorsque la souris dormait. Les LFP enregistrés dans les tétrodes présentaient de grandes activités d'ondulation, ce qui suggère que tous les tétrodes étaient positionnés à proximité de la couche cellulaire pyramidale CA1. Des activités réactives induites par la lumière ont d'abord été observées chez MEC, suivies de CA1 avec une latence de 13 à 18 ms (figure6E).

Figure 1 : Aperçu du tableau Microdrive. (A) Une vue squelette du réseau de micropropulsion, du côté tétrode (a) et du côté de la sonde de silicium (b). (B) Une image réelle du réseau de micropropulsion chargé, vue du côté tétrode (a) et du côté de la sonde de silicium (b). Le tableau de microdrive est placé sur la scène de gabarit dans le panneau (b). (C) Pièces de micropropulsion imprimées en 3D. (a-d) Le corps du tableau de micropropulsion, vu sous quatre angles différents (a: vue latérale tétrode; b: vue latérale de silicium-probe; c: vue du haut; d: vue du bas). Une vue agrandie de la ligne pointillée dans le panneau (c) est indiquée à la figure 2A. (e) La navette, qui tient et permet d'ajuster la sonde de silicium. Une sonde de silicium est fixée à la ligne pointillée dans le panneau (e). f) Le porte-sonde, qui contient un connecteur de sonde de silicium de 32 canaux. g) Le support de ferrule de fibre, qui tient une ferrule optique de fibre pour empêcher du mouvement de la sonde en branchant/débranchant le connecteur de fibre avec la source de lumière. Cette partie se compose de deux composants : [panel (g) et composants A et B]. h) Le cône de blindage imprimé, qui fournit un blindage physique et électrique lorsqu'il est peint avec du matériau conducteur. La fenêtre de cône permet de voir à l'intérieur de la structure pendant la préparation du tableau de microdrive, qui est finalement couvert par un morceau de ruban adhésif ou de matériel imprimé en 3D. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
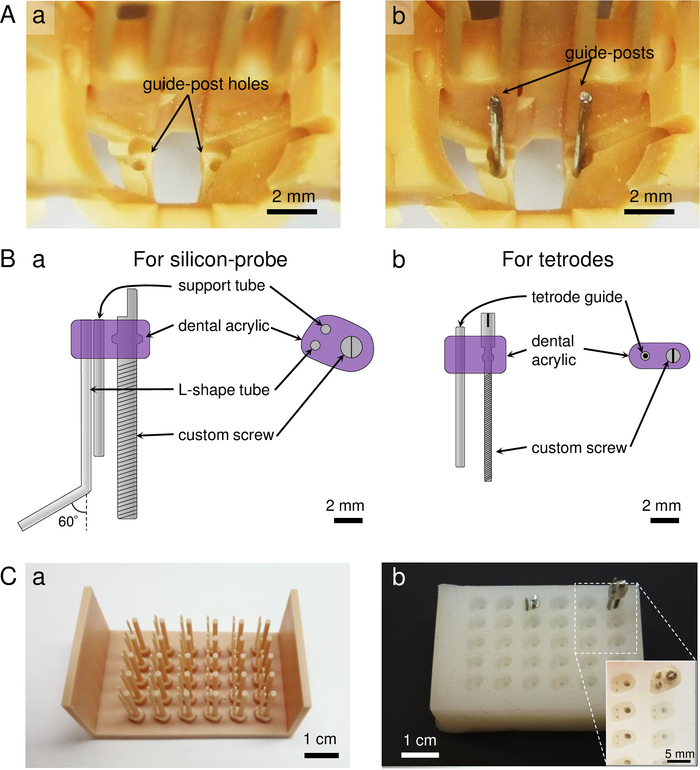
Figure 2 : Préparation des poteaux de guidage et des vis micromotrices sur le corps principal. (A) Guide après la préparation. a) Vue agrandie du corps du réseau de micropropulsions indiquée dans la figure 1Cc. b Guide après l'insertion dans les trous du corps. (B) Les conceptions de microdrive-vis. (a) La vis microdrive pour une sonde de silicium, qui se compose d'une vis personnalisée de 300 m, d'un tube de soutien et d'un tube en forme de L. b La vis microdrive pour un tétrode, qui se compose d'une vis personnalisée de 160 m et d'un tube guide en acier inoxydable de 30 G. (C) Fabrication de la partie supérieure des vis micromotrices : a) Préparation des motifs imprimés en 3D de l'anti-moule pour la vis microdrive. L'image montre un modèle pour le silicium-probe microdrive-vis. (b) Le moule fabriqué à l'aide du motif anti-moule (a) et du matériau silicium-caoutchouc. Les vis de micropropulsion assemblées sont produites en insérant des vis et des fils/tubes sur mesure, et en versant de l'acrylique dentaire dans chaque puits. Enset : vue agrandie des puits du moule. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 3 : Assemblage de tableau Microdrive. (A) Préparation d'une sonde opto-silicium. a) Attacher deux tubes de guidage en plastique à la navette. (b) Coller la fibre optique à la sonde de silicium. c) Attacher la navette à la sonde opto-silicium. Sur cette photo, la partie inférieure de la navette (ligne en pointillé) est fixée à la base de la sonde de silicium [à l'arrière de (b)]. La navette et la tige de la sonde de silicium doivent être en parallèle. (B) Chargement de l'assemblage de la navette de la sonde opto-silicium dans les poteaux-guides du corps du réseau de micropropulsions. (C) Position relative du microdrive de sonde de silicium lorsque la sonde est complètement rétractée dans le corps (a) et lorsqu'elle est placée au plus bas dans le corps d'entraînement (b). Le fil en forme de L est inséré dans la rainure de la navette. (D) Une vue explosée du support de ferrule de fibre et du montage de connecteur de sonde. (E) Cône de blindage attaché. Le matériau conducteur est peint à l'intérieur du cône. (F) Cône de blindage alternatif à l'aide d'un ruban en papier et en aluminium. a) Un papier à motif. b) Cône de blindage alternatif ci-joint, qui réduit 1,1 g de poids par rapport à la version imprimée en 3D. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 4 : Sceller les sondes pendant la chirurgie et la récupération de la sonde de silicium. (A) Le tableau de micropropulsion et le crâne de souris après la craniotomie, avant d'appliquer le silicium-graisse. La sonde de silicium est insérée environ 2mm dans le cerveau en ce moment. (B) Appliquer du silicium-graisse autour des faisceaux de sonde de silicium et de tétrode pour protéger les sondes de l'acrylique dentaire. (C) La souris implantée de façon chronique après la période de récupération, lorsque la souris marche (a), le toilettage (b), et lorsqu'elle est connectée au câble d'enregistrement avec le système de poulie contre-équilibrant (c). (D) La sonde de silicium récupérée, avant (a) et après (b) immersion dans la solution de nettoyage. Les tissus biologiques dans (a) sont enlevés après le processus de nettoyage (b). Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 5 : Exemples d'enregistrement simultané de tetrode/silicium-probe dans le CA1 hippocampal et le cortex entorhinal médial (MEC) de la souris se comportant. (A) Enregistrement sur la piste linéaire. a) La voie linéaire utilisée pour le recodage. b) Trajectoires de l'exploration de la souris pendant 30 min sur la piste. c) Performance comportementale sur la piste linéaire. (d-e) Enregistrements LFP représentatifs de la tétrode (d) et de la sonde de silicium (e). (B) Enregistrement en champ ouvert. a) La chambre à champ ouvert utilisée pour le recodage. b) Trajectoires de l'exploration de la souris pendant 30 min dans la chambre. c) Performance comportementale en champ ouvert. (d,e) Enregistrements LFP représentatifs de la tétrode (d) et de la sonde de silicium (e). LeD est fixé à l'amplificateur de tête pour enregistrer les positions de la souris. La voie linéaire et la chambre à champ ouvert sont reliées au sol électrique pour réduire le bruit électrostatique. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
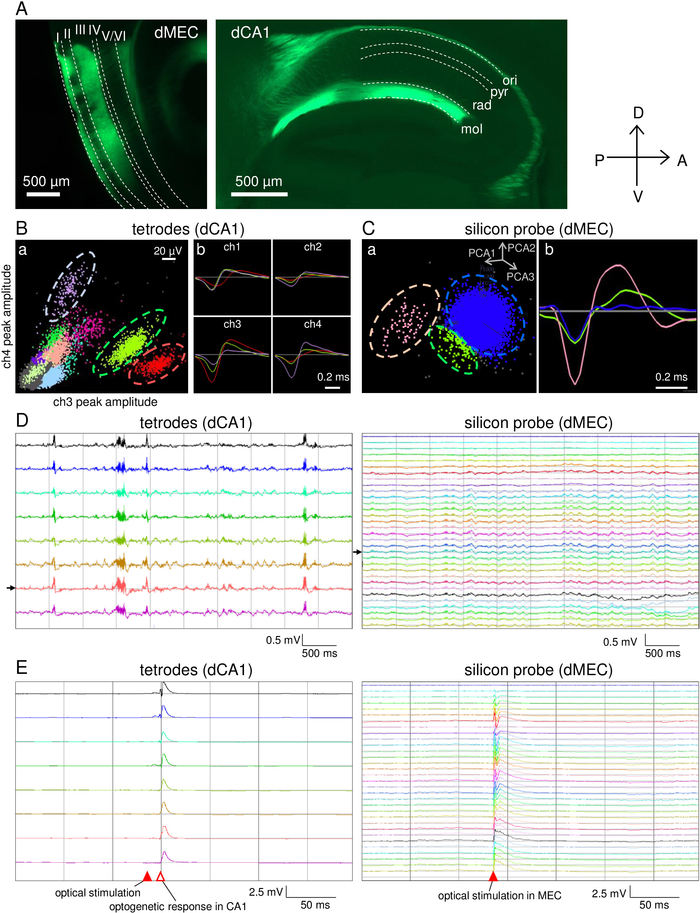
Figure 6 : Résultats représentatifs des enregistrements simultanés dans le CA1 et le MEC et de la stimulation optogénétique. (A) Expression de AAV5-DIO-ChR2-YFP après 4 semaines d'injection. MEC couches III neurones pyramidaux qui projettent leurs axones de MEC dorsal à CA1 dorsal. Lignes en pointillés : ori, stratum oriens; pry, stratum pyramidale; rad, stratum radiatum; mol, stratum lacunosum moléculaire. (B) Enregistrement de pointe représentatif de l'un des tétrodes. a) Projections 2D des transitoires enregistrées à partir du tétrode. b Exemples de la forme moyenne d'ondes de pointe de trois amas, qui sont indiquées par des lignes pointillées dans (a). (C) Enregistrement de pointes représentatives à partir d'un des sites d'électrodes de sonde de silicium. a) Projections de grappes 2D des principaux composants de pointe. b Exemples de la forme moyenne d'ondes de pointe de trois amas. Les grappes de pointes (rose et vert) sont séparées des grappes sonores (bleues). Les clusters (B,C) sont calculés à l'aide du logiciel KlustaKwik. (D) Traces de LFP spontanés enregistrées simultanément à partir des tétrodes en CA1 (a) et de la sonde de silicium dans MEC (b). Les flèches noires indiquent le tetrode montré dans (B) et le site d'électrode de silicium-probe montré dans (C). (E) Réponses LFP à la stimulation optique pulsée (10,6 mW, 1 ms; pointe de flèche rouge remplie) des tétrodes de CA1 (a) et de la sonde de silicium dans MEC (b). Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
| grammes/un | nombre | somme [gramme] | ||
| corps principal | 1.25 | 1 | 1.25 | |
| navette | 0.04 | 1 | 0.04 | |
| sonde connecte monture | 0.19 | 1 | 0.19 | |
| porte-ferrule de fibre | 0.1 | 1 | 0.1 | |
| cône de protection | 1.82 | 1 | 1.82 | (0.72)* |
| pâte conductrice | 0.2 | 1 | 0.2 | |
| vis de la machine (#00, 2 mm), pour contenir la BEI | 0.05 | 2 | 0.1 | |
| vis de machine (#0-80, 3.5 mm) | 0.06 | 4 | 0.24 | |
| vis de machine (#0-80, 6mm) | 0.09 | 2 | 0.18 | |
| fruit sec oléagineux | 0.03 | 2 | 0.06 | |
| microdrive (tétrode) | 0.05 | 9 | 0.45 | |
| microdrive (sonde de silicium) | 0.29 | 1 | 0.29 | |
| sonde de silicium | 0.28 | 1 | 0.28 | |
| carte d'interface électrique | 0.6 | 1 | 0.6 | |
| total | 5.8 | (4.7)* | ||
Tableau 1 : Poids individuel de chaque partie du tableau de micropropulsion. Le poids total du réseau de micropropulsion était de 5,9 g après fixation du cône protecteur avec de l'époxy (dans le cas d'un cône de blindage alternatif à l'aide d'un ruban en papier et en aluminium).
| Procédures | temps |
| préparation microdrive | |
| Impression de pièces 3D | 1 jour |
| préparation optrode | |
| Préparer le moule pour la tête de microdrive | 1 jour et plus |
| Préparation de la tête Microdrive | 3 h |
| Fixation d'une fibre optique | 3 h |
| Fixation d'une navette | 3 h |
| préparation tetrode | |
| Préparer le moule pour la tête de microdrive | 1 jour et plus |
| Préparation des têtes de micropropulsion | 3 h |
| Chargement des fils tétrodes | 1 jour |
| Fixation du cône de blindage | |
| Peinture de blindage de peinture | du jour au lendemain |
| Attachement au corps du microdrive | 3 h |
| Ces procédures peuvent être menées en parallèle | |
Tableau 2 : La chronologie de la préparation du micropropulsion. L'impression 3D-pièces, en attente pour guérir le caoutchouc de silicone / acrylique dentaire / époxy, et le chargement des fils tétrodes prendre la majorité du temps de la préparation du tableau microdrive, au total 4-5 jours.
Fichiers supplémentaires: Les fichiers supplémentaires comprennent des données de modèle 3D de cinq pièces de micropropulsion dans les deux format .sldprt et .stl. Les fichiers de modèle 3D originaux ont été créés avec le logiciel Solidworks2003. Veuillez cliquer ici pour télécharger ce fichier.
Discussion
Le protocole montre comment construire et implanter un réseau hybride de micropropulsion qui permet l'enregistrement des activités neuronales à partir de deux zones du cerveau à l'aide de tétrodes réglables indépendantes et d'une sonde de silicium chez les souris qui se comportent librement. Il démontre également des expériences optogénétiques et la récupération de la sonde de silicium après des expériences. Tandis que la sonde de silicium réglable33 ou l'implantation de sonde d'opto-silicium36 sont précédemment démontrées chez les souris, ce protocole a des avantages clairs dans le tableau simultané de tetrode et l'implantation de sonde d'opto-silicium pour fournir flexible choix de types de sondes implantées. Le type de sonde implantée peut être commuté en fonction de l'objectif de l'expérience, comme les sondes multi-shank27,44 ou neuropixels ultra-densité21,45. La coordination et l'angle d'implantation7 peuvent être facilement modifiés au stade de conception de l'objet 3D au besoin. Par exemple, l'enregistrement à double site ou même triple site est possible lors de tâches d'apprentissage à travers les structures cérébrales liées à la mémoire, telles que l'hippocampe46, cortex entorhinal47, cortex préfrontal48, amygdale49, et cingulate cortex50.
Il existe plusieurs procédures critiques pour le succès de l'implant et de l'enregistrement. En raison de la fragilité des sondes à base de silicium, toute vibration mécanique ou impact sur le réseau de micropropulsions doit être minimisée lors de l'assemblage. Par exemple, l'ouverture des trous obstrués à l'aide d'une perceuse doit être terminée avant de charger la sonde de silicium dans le réseau de micropropulsion. En outre, il convient de mettre l'accent sur le contrôle minutieux de la connexion au sol à chaque étape pendant la construction de micropropulsion sillonnez et la chirurgie des implants afin d'assurer la stabilité des données enregistrées. Les connexions instables ou à haute impédance au sol causent un bruit intense et des artefacts liés au mouvement pendant la session d'enregistrement. Pour les enregistrements stables, il est recommandé d'attendre 1-2 semaines après la chirurgie pour éviter la dérive des électrodes parce que le tissu cérébral est affecté négativement par la chirurgie implantaire. Cependant, la qualité de signal sur la sonde de silicium récupère après 1-2 semaines du trauma chirurgical basé sur l'expérience précédente. Il est recommandé d'utiliser un seul logement pour prévenir les dommages au réseau de micropropulsion implantés par d'autres souris. Pour l'expérience optogénétique, il est important de noter que la plupart des sondes de silicium induisent des photo-artefacts en réponse aux stimulations lumineuses51, tandis que d'autres sont conçus pour minimiser les photo-artefacts52 (il y a photo-artefact réduit sondes de silicium qui sont disponibles dans le commerce).
Le poids du réseau de micropropulsions (5,9 g) est plus lourd que les microdrives typiques décrits dans les articles précédents12,53, principalement en raison du corps du tableau de micropropulsion (21 % du poids total), du cône de blindage (31 %), et des pièces métalliques (vis et les noix: 22%). Il est recommandé d'utiliser des souris avec des poids de plus de 25 g (2-3 mois pour C57BL/6 souris54,55) pour la chirurgie implantaire, parce que les souris avec des poids corporels adéquats ont tendance à récupérer plus tôt. Pour cette raison, ce tableau de micropropulsion peut ne pas être la meilleure solution pour les souris juvéniles. Alors que les appareils qui sont de 5%-10% du poids corporel de la souris sont souvent guidés pour être tolérés pour les implants12,56 (bien qu'il n'y ait pas de données publiées à l'appui pour ce57), ce tableau de micropropulsion pèse 24% du poids corporel de 25 g de souris (19 % lors de l'utilisation du cône alternatif décrit ci-dessous).
Cependant, les souris adultes implantées ont pu se déplacer librement et sauter dans les cages de la maison. Des souris implantées avec un poids de tableau de micropropulsion similaire (4,5 g) ont déjà été montrées pour effectuer la tâche comportementale (tâche linéaire de labyrinthe) même sous la restriction alimentaire13,17. L'inconvénient du poids n'est pas un problème lors de l'enregistrement, comme un système d'équilibrage contrepoids18,34,58 ou le système de poteau59 prendra en charge le tableau microdrive. En outre, le poids total du réseau de micropropulsion peut être réduit en abaissant la hauteur ou en réduisant l'épaisseur du cône de blindage et en modifiant la conception pour utiliser des vis plus petites.
À l'aide du matériau d'impression 3D actuel, l'épaisseur du cône de blindage peut être réduite jusqu'à 0,3 mm (à partir de l'épaisseur actuelle de 0,6 mm). La hauteur du cône peut être réduite de 5 mm tant que les fils tétrodes peuvent encore être couverts. L'exposition des fils tétrodes entraînera la rupture des fils et la défaillance de l'enregistrement à long terme. Alternativement, la préparation du cône de blindage à l'aide de papier et de ruban d'aluminium peut réduire le poids du cône à 0,7 g (15 % du poids total; réduit de 20 % par rapport au poids total du réseau de micropropulsion d'origine); bien que, ce sont un compromis avec la force physique. En outre, la taille du microdrive (cône de blindage actuel : 4,2 x 4,0 x 2,6 cm - axe majeur x axe mineur x hauteur) peut être un obstacle à l'accès à la nourriture et à l'eau s'ils sont fournis du haut de la cage animale. Tant qu'ils sont fournis sur le plancher de la cage ou de la paroi latérale, le microdrive ne perturbe pas les comportements naturels des souris, tels que manger, boire, toilettage, élevage, ou la nidation60.
En conclusion, ce protocole de micropropulsion fournit aux chercheurs des choix flexibles pour l'enregistrement à partir de plusieurs zones du cerveau chez des souris en mouvement libre pour comprendre la dynamique et les fonctions des circuits neuronaux de longue durée.
Déclarations de divulgation
Les auteurs n'ont rien à révéler.
Remerciements
Ce travail a été soutenu en partie par la Japan Society for the Promotion of Science Overseas Research Fellowships (HO), Le Programme des boursiers dotés (TK), le Human Frontier Science Program (TK), la Brain Research Foundation (TK), faculty Science and Technology Acquisition et Le Programme de rétention (TK), la Fondation pour la recherche sur le cerveau et le comportement (TK) et la subvention de recherche de la Fondation Sumitomo (JY), la subvention de recherche pour les jeunes chercheurs du NARSAD (JY). Nous remercions W. Marks pour ses précieux commentaires et suggestions lors de la préparation du manuscrit.
matériels
| Name | Company | Catalog Number | Comments |
| #00-90 screw | J.I. Morris | #00-90-1/8 | EIB screws |
| #0-80 nut | Small Parts | B00DGB7CT2 | brass nut for holding fiber ferrule holder |
| #0-80 screw | Small Parts | B000FMZ57G | brass machine screw for probe connector mount, fiber ferrule holder, and shielding cone |
| 22 Ga polyetheretherketone tubes | Small Parts | SLPT-22-24 | for attaching to the shuttle, 0.025 inches inner diameter |
| 23 Ga stainless tubing | Small Parts | HTX-23R | for tetrode |
| 23 Ga stainless wire | Small Parts | HTX-23R-24-10 | for L-shape/support wire |
| 26 Ga stainless wire | Small Parts | GWX-0200 | for guide-posts |
| 30 Ga stainless wire | Small Parts | HTX-30R | for tetrode |
| 3-D CAD software package | Dassault Systèmes | SolidWorks 2003 | |
| 3D printer | FormLab | Form2 | |
| 5.5mil polyimide insulating tubes | HPC Medical | 72113900001-012 | |
| aluminum foil tape | Tyco | Tyco Adhesives 617022 Aluminum Foil Tape | for the alternative shielding cone |
| conductive paste | YSHIELD | HSF54 | for shielding cone |
| customized screws for silicon-probe microdrive | AMT | UNM1.25-HalfMoon | half-moon stainless screw, 1.5 mm diameter, 300 µm thread pitch |
| customized screws for tetrode microdrive | AMT | Yamamoto_0000-160_9mm | slotted stainless screw, 0.5 mm diameter, 160 µm thread pitch, custom-made to order for our design |
| dental acrylic | Stoelting | 51459 | |
| dental model resin | FormLab | RS-F2-DMBE-02 | |
| Dremel rotary tool | Dremel | model 800 | a grinder |
| drill bit | Fine Science Tool | 19007-05 | |
| electric interface board | Neuralynx | EIB-36-Narrow | |
| epoxy | Devcon | GLU-735.90 | 5 minutes epoxy |
| eye ointment | Dechra | Puralube Ophthalmic Ointment | to prevent mice eyes from drying during surgery |
| fiber polishing sheet | Thorlabs | LFG5P | for polishing the optical fiber |
| fine tweezers | Protech International | 15-368 | for loading/recovering the silicon probe |
| gold pins | Neuralynx | EIB Pins Small | |
| ground wire | A-M Systems | 781500 | 0.010 inch bare silver wire |
| headstage preamp | Neuralynx | HS-36 | |
| impedance meter | BAK electronics | Model IMP-2 | 1 kHz testing frequency |
| mineral oil | ZONA | 36-105 | for lubricating screws and wires |
| optical fiber | Doric | MFC_200/260-0.22_50mm_ZF1.25(G)_FLT | |
| Recording system | Neuralynx | Digital Lynx 4SX | |
| ruby fiber scribe | Thorlabs | S90R | for cleaving the optical fiber |
| silicon grease | Fine Science Tool | 29051-45 | |
| silicon probe | Neuronexus | A1x32-Edge-5mm-20-177 | Fig. 3, 4A, 4B, 5 |
| silicon probe | Neuronexus | A1x32-6mm-50-177 | Fig. 4C |
| silicon probe washing solution | Alcon | AL10078844 | contact lens cleaner |
| silicone lubber | Smooth-On | Dragon Skin 10 FAST | for preparation of microdrive mold |
| silver paint | GC electronic | 22-023 | silver print II coating, used for ground wires |
| skull screw | Otto Frei | 2647-10AC | 0.8 mm diameter, 0.200 mm thread pitch |
| standard surgical scissors | ROBOZ | RS-5880 | |
| stereotaxic apparatus | Kopf | Model 942 | |
| super glue | Loctite | LOC230992 | for applying to guide-posts |
| surgical tweezers | ROBOZ | RS-5135 | |
| Tetrode Twister | Jun Yamamoto | TT-01 | |
| tetrode wires | Sandvik | PX000004 |
Références
- Wilson, M. A., McNaughton, B. L. Dynamics of the hippocampal ensemble code for space. Science. 261 (5124), 1055-1058 (1993).
- Gothard, K. M., Skaggs, W. E., Moore, K. M., McNaughton, B. L. Binding of hippocampal CA1 neural activity to multiple reference frames in a landmark-based navigation task. The Journal of Neuroscience. 16 (2), 823-835 (1996).
- Keating, J. G., Gerstein, G. L. A chronic multi-electrode microdrive for small animals. Journal of Neuroscience Methods. 117 (2), 201-206 (2002).
- Winson, J. A compact micro-electrode assembly for recording from the freely moving rat. Electroencephalography and Clinical Neurophysiology. 35 (2), 215-217 (1973).
- Michon, F., et al. Integration of silicon-based neural probes and micro-drive arrays for chronic recording of large populations of neurons in behaving animals. Journal of Neural Engineering. 13 (4), 046018 (2016).
- Lansink, C. S., et al. A split microdrive for simultaneous multi-electrode recordings from two brain areas in awake small animals. Journal of Neuroscience Methods. 162 (1-2), 129-138 (2007).
- Billard, M. W., Bahari, F., Kimbugwe, J., Alloway, K. D., Gluckman, B. J. The systemDrive: a Multisite, Multiregion Microdrive with Independent Drive Axis Angling for Chronic Multimodal Systems Neuroscience Recordings in Freely Behaving Animals. eNeuro. 5 (6), (2018).
- Kloosterman, F., et al. Micro-drive array for chronic in vivo recording: drive fabrication. Journal of Visualized Experiments. (26), (2009).
- Lu, P. L., et al. Microdrive with Two Independent Moveable Sets for Wide-Ranging, Multi-Site, Multi-Channel Brain Recordings. Journal of Medical and Biological Engineering. 34 (4), 341-346 (2014).
- Haiss, F., Butovas, S. A miniaturized chronic microelectrode drive for awake behaving head restrained mice and rats. Journal of Neuroscience Methods. 187 (1), 67-72 (2010).
- Headley, D. B., DeLucca, M. V., Haufler, D., Pare, D. Incorporating 3D-printing technology in the design of head-caps and electrode drives for recording neurons in multiple brain regions. Journal of Neurophysiology. 113 (7), 2721-2732 (2015).
- Voigts, J., Siegle, J. H., Pritchett, D. L., Moore, C. I. The flexDrive: an ultra-light implant for optical control and highly parallel chronic recording of neuronal ensembles in freely moving mice. Frontiers in Systems Neuroscience. 7, 8 (2013).
- Yamamoto, J., Tonegawa, S. Direct Medial Entorhinal Cortex Input to Hippocampal CA1 Is Crucial for Extended Quiet Awake Replay. Neuron. 96 (1), 217-227 (2017).
- Schomburg, E. W., et al. Theta phase segregation of input-specific gamma patterns in entorhinal-hippocampal networks. Neuron. 84 (2), 470-485 (2014).
- Fernandez-Ruiz, A., et al. Entorhinal-CA3 Dual-Input Control of Spike Timing in the Hippocampus by Theta-Gamma Coupling. Neuron. 93 (5), 1213-1226 (2017).
- Rey, H. G., Pedreira, C., Quian Quiroga, R. Past, present and future of spike sorting techniques. Brain Research Bulletin. 119 (Pt B), 106-117 (2015).
- Gray, C. M., Maldonado, P. E., Wilson, M., McNaughton, B. Tetrodes markedly improve the reliability and yield of multiple single-unit isolation from multi-unit recordings in cat striate cortex. Journal of Neuroscience Methods. 63 (1-2), 43-54 (1995).
- Yamamoto, J., Wilson, M. A. Large-scale chronically implantable precision motorized microdrive array for freely behaving animals. Journal of Neurophysiology. 100 (4), 2430-2440 (2008).
- Nguyen, D. P., et al. Micro-drive array for chronic in vivo recording: tetrode assembly. Journal of Visualized Experiments. (26), (2009).
- Lu, L., Popeney, B., Dickman, J. D., Angelaki, D. E. Construction of an Improved Multi-Tetrode Hyperdrive for Large-Scale Neural Recording in Behaving Rats. Journal of Visualized Experiments. (135), (2018).
- Jun, J. J., et al. Fully integrated silicon probes for high-density recording of neural activity. Nature. 551 (7679), 232-236 (2017).
- Pastalkova, E., Itskov, V., Amarasingham, A., Buzsaki, G. Internally generated cell assembly sequences in the rat hippocampus. Science. 321 (5894), 1322-1327 (2008).
- Gauthier, J. L., Tank, D. W. A Dedicated Population for Reward Coding in the Hippocampus. Neuron. 99 (1), 179-193 (2018).
- Davidson, T. J., Kloosterman, F., Wilson, M. A. Hippocampal replay of extended experience. Neuron. 63 (4), 497-507 (2009).
- Gerwinn, S., Macke, J., Bethge, M. Bayesian population decoding of spiking neurons. Frontiers in Computational Neuroscience. 3, 21 (2009).
- Sakata, S., Harris, K. D. Laminar structure of spontaneous and sensory-evoked population activity in auditory cortex. Neuron. 64 (3), 404-418 (2009).
- Csicsvari, J., et al. Massively parallel recording of unit and local field potentials with silicon-based electrodes. Journal of Neurophysiology. 90 (2), 1314-1323 (2003).
- Harris, K. D., Quiroga, R. Q., Freeman, J., Smith, S. L. Improving data quality in neuronal population recordings. Nature Neuroscience. 19 (9), 1165-1174 (2016).
- Hilgen, G., et al. Unsupervised Spike Sorting for Large-Scale, High-Density Multielectrode Arrays. Cell Reports. 18 (10), 2521-2532 (2017).
- Rossant, C., et al. Spike sorting for large, dense electrode arrays. Nature neuroscience. 19 (4), 634-641 (2016).
- Iseri, E., Kuzum, D. Implantable optoelectronic probes for in vivo optogenetics. Journal of Neural Engineering. 14 (3), 031001 (2017).
- Klapoetke, N. C., et al. Independent optical excitation of distinct neural populations. Nature Methods. 11 (3), 338-346 (2014).
- Yamamoto, J., Suh, J., Takeuchi, D., Tonegawa, S. Successful execution of working memory linked to synchronized high-frequency gamma oscillations. Cell. 157 (4), 845-857 (2014).
- Rangel Guerrero, D. K., Donnett, J. G., Csicsvari, J., Kovacs, K. A. Tetrode Recording from the Hippocampus of Behaving Mice Coupled with Four-Point-Irradiation Closed-Loop Optogenetics: A Technique to Study the Contribution of Hippocampal SWR Events to Learning. eNeuro. 5 (4), (2018).
- Liang, L., et al. Integrated and Quick-to-Assemble (SLIQ) Hyperdrives for Functional Circuit Dissection. Frontiers in Neural Circuits. 11, 8 (2017).
- Chung, J., Sharif, F., Jung, D., Kim, S., Royer, S. Micro-drive and headgear for chronic implant and recovery of optoelectronic probes. Scientific Reports. 7 (1), 2773 (2017).
- Quilichini, P., Sirota, A., Buzsaki, G. Intrinsic circuit organization and theta-gamma oscillation dynamics in the entorhinal cortex of the rat. The Journal of Neuroscience. 30 (33), 11128-11142 (2010).
- Sauer, J. F., Struber, M., Bartos, M. Recording Spatially Restricted Oscillations in the Hippocampus of Behaving Mice. Journal of Visualized Experiments. (137), (2018).
- Shikano, Y., Sasaki, T., Ikegaya, Y. Simultaneous Recordings of Cortical Local Field Potentials, Electrocardiogram, Electromyogram, and Breathing Rhythm from a Freely Moving Rat. Journal of Visualized Experiments. (134), (2018).
- Brunetti, P. M., et al. Design and fabrication of ultralight weight, adjustable multi-electrode probes for electrophysiological recordings in mice. Journal of Visualized Experiments. 91 (91), e51675 (2014).
- Battaglia, F. P., et al. The Lantern: an ultra-light micro-drive for multi-tetrode recordings in mice and other small animals. Journal of Neuroscience Methods. 178 (2), 291-300 (2009).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of Visualized Experiments. (65), (2012).
- Suh, J., Rivest, A. J., Nakashiba, T., Tominaga, T., Tonegawa, S. Entorhinal cortex layer III input to the hippocampus is crucial for temporal association memory. Science. 334 (6061), 1415-1420 (2011).
- Royer, S., et al. Multi-array silicon probes with integrated optical fibers: light-assisted perturbation and recording of local neural circuits in the behaving animal. The European Journal of Neuroscience. 31 (12), 2279-2291 (2010).
- Steinmetz, N. A., Koch, C., Harris, K. D., Carandini, M. Challenges and opportunities for large-scale electrophysiology with Neuropixels probes. Current Opinion in Neurobiology. 50, 92-100 (2018).
- Jones, M. W., Wilson, M. A. Theta rhythms coordinate hippocampal-prefrontal interactions in a spatial memory task. PLoS Biology. 3 (12), e402 (2005).
- Frank, L. M., Brown, E. N., Wilson, M. A. A comparison of the firing properties of putative excitatory and inhibitory neurons from CA1 and the entorhinal cortex. Journal of Neurophysiology. 86 (4), 2029-2040 (2001).
- Kitamura, T., et al. Eng and circuits crucial for systems consolidation of a memory. Science. 356 (6333), 73-78 (2017).
- McGaugh, J. L., Cahill, L., Roozendaal, B. Involvement of the amygdala in memory storage: interaction with other brain systems. Proceedings of the National Academy of Sciences of the United States of America. 93 (24), 13508-13514 (1996).
- Frankland, P. W., Bontempi, B., Talton, L. E., Kaczmarek, L., Silva, A. J. The involvement of the anterior cingulate cortex in remote contextual fear memory. Science. 304 (5672), 881-883 (2004).
- Mikulovic, S., et al. On the photovoltaic effect in local field potential recordings. Neurophotonics. 3 (1), 015002 (2016).
- Kuleshova, E. P. Optogenetics – New Potentials for Electrophysiology. Neuroscience and Behavioral Physiology. 49 (2), 169-177 (2019).
- Meng, E., Hoang, T. MEMS-enabled implantable drug infusion pumps for laboratory animal research, preclinical, and clinical applications. Advanced Drug Delivery Reviews. 64 (14), 1628-1638 (2012).
- Hu, S., et al. Dietary Fat, but Not Protein or Carbohydrate, Regulates Energy Intake and Causes Adiposity in Mice. Cell Metabolism. 28 (3), 415-431 (2018).
- Yang, Y., Smith, D. L., Keating, K. D., Allison, D. B., Nagy, T. R. Variations in body weight, food intake and body composition after long-term high-fat diet feeding in C57BL/6J mice. Obesity. 22 (10), 2147-2155 (2014).
- Morton, D. B., et al. Refinements in telemetry procedures. Seventh report of the BVAAWF/FRAME/RSPCA/UFAW Joint Working Group on Refinement, Part A. Laboratory Animals. 37 (4), 261-299 (2003).
- Lidster, K., et al. Opportunities for improving animal welfare in rodent models of epilepsy and seizures. Journal of Neuroscience Methods. 260, 2-25 (2016).
- Lin, L., et al. Large-scale neural ensemble recording in the brains of freely behaving mice. Journal of Neuroscience Methods. 155 (1), 28-38 (2006).
- Kislin, M., et al. Flat-floored air-lifted platform: a new method for combining behavior with microscopy or electrophysiology on awake freely moving rodents. Journal of Visualized Experiments. (88), e51869 (2014).
- Gaskill, B. N., Karas, A. Z., Garner, J. P., Pritchett-Corning, K. R. Nest building as an indicator of health and welfare in laboratory mice. Journal of Visualized Experiments. (82), 51012 (2013).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon