Method Article
Специфическая маркировка митохондриальных нуклеоидов для time-lapse Структурированная микроскопия освещения
В этой статье
Резюме
Протокол описывает специфическую маркировку митохондриальных нуклеоидов с коммерчески доступным пятном геля ДНК, приобретение временной промежутки серии живых помеченных клеток с помощью сверх-разрешения структурированной иллюминаторной микроскопии (SR-SIM) и автоматическое отслеживание движения нуклеоидов.
Аннотация
Митохондриальные нуклеоиды – это компактные частицы, образованные молекулами митохондриальной ДНК, покрытыми белками. Митохондриальная ДНК кодирует тРНК, рРНК и несколько основных митохондриальных полипептидов. Митохондриальные нуклеоиды делятся и распределяются в динамической митохондриальной сети, которая подвергается делению/слиянию и другим морфологическим изменениям. Высокое разрешение живой флуоресценции микроскопии является простой метод, чтобы охарактеризовать положение и движение нуклеоидов. Для этого метода, нуклеоиды обычно помечены через флуоресцентные метки их белковых компонентов, а именно транскрипционный фактор a (TFAM). Тем не менее, эта стратегия нуждается в переэкспрессии флуоресцентного белка помечены построить, что может привести к артефактов (сообщил и для TFAM), и не представляется возможным во многих случаях. Органические ДНК-связывающие красители не имеют этих недостатков. Тем не менее, они всегда показывают окрашивание как ядерных, так и митохондриальных ДНС, при этом не хватает специфичности митохондриальных нуклеоидов. Принимая во внимание физико-химические свойства таких красителей, мы выбрали пятно геля нуклеиновой кислоты (SYBR Gold) и добились преференциальной маркировки митохондриальных нуклетодов в живых клетках. Свойства красителя, в частности его высокая яркость при привязке к ДНК, позволяют последующую количественную оценку движения митохондриальных нуклеоидов с использованием временных рядов структурированных изображений освещения супер-разрешения.
Введение
Циркулярные молекулы ДНК 16,5 кбит/с составляют генетический материал митохондрий, кодирующих 22 тРНК, 2 РНК и 13 полипептидов, необходимых для митохондриальных окислительных фосфорилированных комплексов. Митохондриальная ДНК связана с митохондриальным транскрипционным фактором а (TFAM) и несколькими другими белками, образующих митохондриальные нуклеоиды1,,2,,3,4. Митохондриальные нуклеоиды перемещаются и перераспределяются между компонентами митохондриальной сети5,,6 во время его морфологической реконструкции, деления или синтеза в зависимости от фазы клеточного цикла, стресса и других факторов (рассмотрено в Pernas et al.7). Кроме того, движение митохондриальных нуклеоидов, замешано в системной волчанке эритематосовой болезни8 и может играть определенную роль в других заболеваниях. Флуоресценция микроскопия является простой метод для живых клеток исследования органелл, но техника имеет разрешение йgt;200 нм, который больше, чем размер митохондриальных нуклеоидов (100 нм9,10,11,12). Этот предел был обойден так называемыми методами «суперразрешения», такими как стимулируемое истощение выбросов (STED) и микроскопия локализации одной молекулы (SMLM)13,14. До сих пор митохондриальные нуклеоиды и другие ДНК были изображены в живых клетках прямой стохастической оптической реконструкцией микроскопии (dSTORM)15. Тонкие субмитохондриальные структуры с позициями, коррелирующие с мтДНК, наблюдались STED в живых клетках16. Тем не менее, эти супер-разрешение методы требуют высокой интенсивности освещения, что вызывает фототоксическое воздействие на живые клетки17. Таким образом, промежуток времени изображения митохондриальных нуклеоидов с разрешением за пределы дифракции является сложной задачей. Для решения этой проблемы мы использовали сверхразрешение структурированной иллюминаторной микроскопии (SR-SIM)18. SIM требует гораздо более низкой дозы энергии освещения, чем STED и SMLM19. Кроме того, в отличие от методов STED и SMLM, SIM позволяет простой многоцветной трехмерной (3D) визуализации, и это не требует особых фотофизических свойств флюорофоров или изображения буфера состава19.
Традиционной стратегией маркировки митохондриальных нуклеоидов в живых клетках является флуоресцентная маркировка митохондриального нуклеоидного белка, такого как TFAM20. Однако во многих случаях эта стратегия не подходит. Кроме того, переэкспрессия флуоресцентного белка помечены TFAM производит серьезный артефакт21. Маркировка ДНК органическими красителями имеет преимущества по сравнению со стратегией на основе флуоресцентного белка (FP). Органические красители не имеют ограничений, связанных с пометкой FP: они могут быть использованы для любого типа клеток или тканей, которые могут быть применены в любой момент эксперимента. Изображения клеток живых клеток митохондриальных нуклеоидов было сообщено с несколькими ДНК-связывающих красителей: DAPI22, SYBR Зеленый23, Vybrant DyeCycle24, и picoGreen15,25,26. Существенным недостатком большинства ДНК-связывающих красителей для обозначения нуклеоидов является то, что они окрашивают всю ДНК в клетку. Ориентация на краситель исключительно на митохондриальную ДНК очень желательна. Для этого необходим тщательный отбор красителя, обладающего подходящими физико-химическими свойствами. Липобильные красители, обладающие делокализованным положительным зарядом, такие как родамин 123, как известно, накапливаются в живых митохондриях, которые сохраняют их отрицательный мембранный потенциал. Кроме того, идеальный краситель для специфической маркировки митохондриальных нуклеоидов должен связывать ДНК с высоким сродством и излучать яркую флуоресценцию при связывании ДНК. Учитывая эти требования, некоторые цианины являются перспективными (например, picoGreen), но ядерная ДНК обильно окрашенных этими красителей одновременно с митохондриальной ДНК15,25,26. Настоящий протокол описывает специфическую маркировку митохондриальных нуклеоидов в живых клетках другим цианиновой красителем, SYBR Gold (SG), и отслеживание нуклеоидов в промежуток времени супер-разрешение SIM-видео. Кроме того, Окрашенные SG живые клетки могут быть изображены любым типом перевернутого флуоресцентного микроскопа (конфокальный, вращающийся диск, эпифлюоресценция и т.д.), подходящих для живых клеток и оснащенных источником света 488 нм.
протокол
ПРИМЕЧАНИЕ: Все линии клеток, упомянутые здесь, были культивированы в среде модифицированного орла Dulbecco (DMEM) с 10% сыворотки крупного рогатого скота плода (FBS), глутамина, пенициллина/стрептомицина и пирувата. Уравновешивать все носители и добавки, которые будут использоваться в день маркировки и визуализации, разогревая их до 37 градусов по Цельсию в инкубаторе, установленном до 5% CO2. Вся работа клеточной культуры, включая маркировку, происходит в стерильных условиях под ламинарным капотом потока.
1. Маркировка сотовой связи
- За день до процедуры маркировки, культура 4 х 105 HeLa клеток в 2 мл среднего в 35 мм Петри блюдо с #1,5 стеклянного дна. Можно использовать многоцветные камерные слайды, но объемы должны корректироваться пропорционально объему скважины. Разбавить клеточной подвеской, чтобы иметь приблизительно 50 000 клеток/мл и семена 2 мл клеточной подвески в 35-мм чашке Петри.
- Подготовьте следующее разбавление коммерческого акционерного решения SYBR Gold (SG): 1:5,000. Подготовка Mitotracker Deep Red (дальнее красное пятно) или Mitotracker CMXRos Red (красное пятно)(Таблица материалов;коммерческий запас разбавлен1:2,000) в фенол красно-свободной среде культуры. Подготовка же набор разбавления picoGreen как для SG.
ПРИМЕЧАНИЕ: Решения, описанные в шаге 1.2, являются решениями 2x маркировки. Защитите все растворы, содержащие флуоресцентные красители от света как можно больше. - Вымойте клетки адепта с 2 мл PBS один раз. Добавьте 1 мл фенола без красной культуры среды к 35 мм чашке Петри. Для 8-хорошего камерного слайда используйте объем, равный 1/2 от общей мощности скважины (например, добавьте 125 л,если общая емкость скважины составляет 250 л).
- Добавьте 1 мл раствор 2x маркировки, приготовленный в шаге 1,2 до 35 мм чашку Петри. Для 8-хорошего камерного слайда используйте объем, равный 1/2 от общей вместимости скважины. Инкубировать клетки в течение 30 мин при 37 градусах Цельсия под 5% CO2.
ПРИМЕЧАНИЕ: Не инкубировать клетки с SG маркировки раствор дольше, чем 1 ч, потому что более длительная инкубация вызовет маркировку ядерной ДНК. - Тщательно аспирируйте среду, содержащую флуоресцентные красители и мыть клетки один раз с PBS.
- Добавить фенол красно-свободной клеточной культуры среды и держать клетки в темноте в CO2 инкубатора при 37 градусов по Цельсию до изображения.
- Изображение живых клеток на микроскопе SR-SIM, оборудованном инкубационным блоком (см. ниже).
2. Приобретение изображения SR-SIM
- Установите инкубатор на стадии микроскопа. Установите желаемую температуру и концентрацию CO2 (например, 37 градусов по Цельсию и 5% для клеток млекопитающих) и держите в тепле не менее 1 ч до начала создания изображения.
- Включите все компоненты SR-SIM-микроскопа, включая лазеры, и оставьте их нагреваться не менее 1 ч.
- Выберите высокое увеличение, высокочисленное числовая диафрагма (NA) цель погружения (например, 100x 1.46 NA масло), рекомендованное для SR-SIM производителем микроскопа.
- Установите камерную горку или 35-мм тарелку с маркированными клетками (от шага 1.6) на стадии инкубированного микроскопа.
- Найдите область интереса на образце, предпочтительно с окулярами. Для достижения наилучшего качества изображения SR-SIM выберите ячейки, которые хорошо прикреплены к стеклу.
- Используйте заднюю тонированную высококачественную электронную камеру, умножающую зарядную камеру (EM-CCD), для получения изображений SR-SIM.
- Используя программное обеспечение для приобретения изображений, установите высокий EM-прибыль, рекомендуемый для используемой камеры (например, 300).
- Перед приобретением серии промежуток времени для нуклеоидного слежения приобретите двухцветное изображение SR-SIM одного и того же поля зрения: один канал для митохондриального окрашивания и другой для SG. Установите первый цветной канал, соответствующий используемому митохондриальному пятну (например, для дальнего красного митохондриального пятна, установите возбуждение на уровне 633 нм или дольше и 650 нм длиннопроходного излучения фильтра). Для сигнала SG установите возбуждение на уровне 488 нм и фильтр амплуа 500-550 нм.
- Используя программное обеспечение, установите самую низкую лазерную мощность, возможную как для 488 нм, так и для красных линий пятна.
ПРИМЕЧАНИЕ: Типичная настройка 1% лазерной мощности выход регулируется acousto-оптический tunable фильтр (AOTF). - Если SIM-микроскоп приобретает каналы только последовательно (однокамерная настройка), то выключите далеко-красный канал обнаружения пятен.
- Установите приобретение одного фокусного плоскости, выключив приобретение стеков, отключив коробку стека в программном обеспечении.
- Установите кратчайшее время экспозиции камеры EM-CCD.
- Установите три вращения сетки, а не пять вращений.
- Чтобы увеличить частоту кадров, в вкладке Приобретение программного обеспечения, установите камеру для чтения данных только из центральной области датчика камеры вместо "Полный чип".
ПРИМЕЧАНИЕ: Например, переход от чтения области 1000 х 1000 пикселей полный датчик для чтения только 256 х 256 пикселей позволяет сократить время экспозиции камеры от 50 мс до 13,4 мс и общее время кадра от 1,8 с до 1,2 с. Если считывать только центральную часть датчика камеры, то поле зрения будет очень маленьким для цели 63x или 100x, обычно используемой для SR-SIM. Более короткое время экспозиции снизит соотношение сигнала к шуму изображений. - Оптимизация мощности лазера и время экспозиции камеры: приобретение двухмерных (2D) изображений маркированных клеток с несколькими значениями мощности лазера (например, 0,5%, 1%, 1,5%, 2%) и несколько раз экспозиции (например, 13,4 мс, 25 мс, 50 мс).
- Обработайте необработанные наборы SIM-данных (см. шаг 3.1).
- Выберите лазерную мощность и время экспозиции камеры, которые дают SIM-изображения с яркими пятнами в митохондриях (т.е. нуклеоидов) с небольшим или вообще без артефактов, генерируемых обработкой SIM. Осмотрите области за пределами митохондрий (например, 1% мощности лазера с твердым состоянием 488 нм и 25 мс экспозиции камеры EM-CCD).
- Начните с гостевой серии тайм-замедленного действия, используя настройки, оптимизированные в шагах 2.15-2.17.
3. Обработка и анализ данных
- Обработайте необработанные наборы SIM-данных со структурированным модулем освещения подходящего программного обеспечения(Таблица материалов):выберите автоматический флажок для параметров обработки SIM. Для автоматической обработки нескольких файлов используйте инструмент обработки пакетов, отображайте в режиме от века использования для пакета,щелкните Run Batch и выберите несколько файлов для обработки SIM-
- Преобразуйте наборы данных временных рядов SIM-карт в формат ims с программным обеспечением конвертера Imaris (т.е. версия, соответствующая версии программного обеспечения Imaris).
- Откройте преобразованный файл в программном обеспечении (версия 8.4.1 или позже), который имеет лицензию на модуль Lineage (или Track).
- Начните мастер создания«Пятна»,нажав значок Добавить новые пятна. Мастер для создания будет запущен.
- Выберите вкладку «Создание мастера».
- На первом этапе мастера щелкните Track Spots (с течением времени) и переходите ко второму этапу мастера.
- Установите расчетный диаметр XY до 0,1-0,15 мкм, нажмите фоновое вычитание и переходите к третьему шагу.
- Отрегулируйте порог в фильтре«Качество»,перетащив вертикальную линию в гистограмме так, чтобы большинство нуклеоидов были обнаружены как «пятна», в то время как артефакты не обнаруживаются (т.е. обнаруженные пятна помечаются как шарики, наложенные на изображение). Проверьте, так ли это на каждом кадре, и при необходимости отредкните порог. Перейдите к четвертой, а затем к пятой ступени мастера.
- Выберите алгоритм авторегрессивного движения. Установите Расстояние Max до 0,5 мкм. Установите размер max Gap до 0.
- Посмотрите на каждый кадр в серии таймеров и проверьте, если какие-либо ложные треки нарисованы, и если какие-либо пробелы между треками введены (треки, построенные мастером с текущими настройками мгновенно помечены как линии, наложенные на изображение). При необходимости отрегулируйте"Max Distance". Переходим к шестой ступени мастера. Выберите фильтр Track Duration и установите порог 3-5 с.
- Если обнаруженные в настоящее время пятна или треки не являются оптимальными, вернитесь к предыдущим шагам мастера с помощью навигационных кнопок (в нижней части окна мастера), необходимых для точной настройки любого параметра для создания пятен или треков.
- Когда отлаженных параметров позволит программному обеспечению обнаружить все пятна и правильно построить треки, нажмите кнопку навигации зеленой стрелки в мастере, чтобы подтвердить создание треков.
- Извлеките статистику следов, нажав окно значка Статистическое управление. Выберите необходимые параметры статистики(подробные и средние значения вкладок в статистике)и экспортируйте значения в виде файлов csv, нажав значок Floppy Drive для количественной оценки и визуализации.
ПРИМЕЧАНИЕ: Максимальная скорость трека, средняя скорость трека, длина трека и смещение трека являются примерами параметров, которые важны. - Если набор данных изображений должен быть представлен или опубликован, создавайте снимки и/или видеофайлы, представляющие серию таймшеров с опционально наложенными треками с помощью инструментов Snapshot или Animation.
4. Приобретение изображений Конфокального изображения
- Установите инкубатор на стадии микроскопа, установите желаемую температуру и концентрацию CO2 (т.е. 37 градусов по Цельсию и 5% для клеток млекопитающих) и держите в тепле не менее 1 ч до начала создания изображения.
- Включите все компоненты конфокального лазерного сканирующего микроскопа, включая лазеры, и оставьте их нагреваться не менее 1 ч.
- Выберите желаемую цель среднего и высокого увеличения и пространственную выборку в соответствии с критериями Nyquist.
- Для канала SG установите возбуждение на уровне 488 нм и диапазон обнаружения 500-550 нм. Для митохондриального пятен канала, установлен на 561 нм и 570-630 нм выбросов для красного красителя, или 633 нм возбуждение и 650 нм выбросов для далеко гораздо красный краситель.
- Установите наименьшую возможную мощность лазера (обычно 1% или меньше), что позволяет присваивать сигналы с помощью детектора PMT, прироста 700 мВ.
- Приобретите двухцветные конфокальные изображения клеток, где митохондриальные нуклеоиды обнаруживаются в "канале SG", а митохондрии обнаруживаются в "красном" или "дальнем красном" канале.
Результаты
Характеристика маркировки живых клеток с помощью SG
Во-первых, распределение SG в клетках при инкубации с красителем при различных разбавлениях характеризовалось конфокальной микроскопией. После инкубации с высокой концентрацией SG или picoGreen, оба красителя в основном помечены ядра и показал пунктуат окрашивания в цитоплазме (Рисунок 1), подобно опубликованным данным для другого положительно заряженных цианина красителя (т.е. picoGreen)15. Однако при инкубации с Помощью SG в 1:10 000 разбавления в ядрах появилось слабое окрашивание, а в цитоплазме мы наблюдали узор ярких пятен(рисунок 1). С другой стороны, инкубация с пикозеленым краситель разбавленной 1:10,000 дали в основном ядерное окрашивание. Сигнал SG был гораздо ярче, чем у picoGreen в той же концентрации. Данные показали, что SG больше подходит для визуализации митохондриальной ДНК, чем другие аналогичные ДНК-связывающие красители.
Чтобы подтвердить, что яркие точки локализованы в митохондриях, мы окрашивали живые клетки одновременно с SG и далеко красным митохондриальным пятном. Последний является положительно заряженным органическим красителем, который накапливается в митохондриях живых клеток. При инкубации с SG в 1:10,000 и 1:50,000 разбавления, почти все SG окрашивания произошло в митохондриях, в то время как при маркировке в 1:500 и 1:1000 разбавления, значительное окрашивание ядер и цитоплазмы произошло(Рисунок 2).
Кроме того, мы охарактеризовали временной ход окрашивания живых клеток с помощью SG по промедляющей повремени микроскопией(рисунок 3). Участки интенсивности флуоресценции SG в митохондриях против времени(рисунок 3B) показали, что после 45 мин, нуклеоидное окрашивание было близко к насыщению. Таким образом, мы рекомендуем время инкубации в размере 30-60 мин.
Мы проверили, как внутриклеточного распределения SG изменяется при фиксации и/или пермяке клеток. Фиксация (2% параформальдегида) живых окрашенных клеток вызвала небольшое перераспределение красителя в ядро(рисунок 4A,B). Пермякизацию фиксированных клеток (0,1% Triton X100) устранили пунктирную схему SG в митохондриях, и окрашивание ядер было доминирующим(рисунок 4C). Если SG был добавлен в клетки после фиксации и пермяки, он равномерно распределенпо по цитоплазме и ядрам(рисунок 4D). Таким образом, SG помеченные клетки могут быть исправлены при необходимости, но краситель не подходит для протоколов, которые требуют permeabilization.
Отслеживание живых клеток SR-SIM и митохондриальных нуклеоидов
Клетки живых клеток, коокрашенные с SG и далеко красный митохондриальный пятно (Таблица материалов) были 3D изображения супер-разрешение SIM техники. Как и на конфокальных изображениях(рисунок 2), митохондриальные нуклеоиды появились как яркие пятна в митохондриях(рисунок 5А). Кроме того, мы приобрели временные ряды 2D SIM-изображений и отслеживали положение нуклеоидов в разрешении за пределами предела дифракции. Непосредственно перед началом временных серий мы приобрели SIM 3D стеки в SG и митохондриальных пятен каналов. Затем мы приобрели временные ряды только в канале SG и отслеживали митохондриальные нуклеоиды, чтобы количественно осмотреть их движения. Средняя скорость трассы составила 0,042 мкм/с, а максимальная мгновенная скорость трека составила 0,078 и 0,012 мкм/с. Большинство нуклеоидов не вытеснять далеко от своих первоначальных позиций, но показал короткие расстояния случайных движений, которые, вероятно, ограничивается митохондриальной сети, как наложение треков на митохондриальных изображений предполагает (Рисунок 5B). Немногие быстрые смещения направления произошли во время типичной серии времени(Фильм 1).
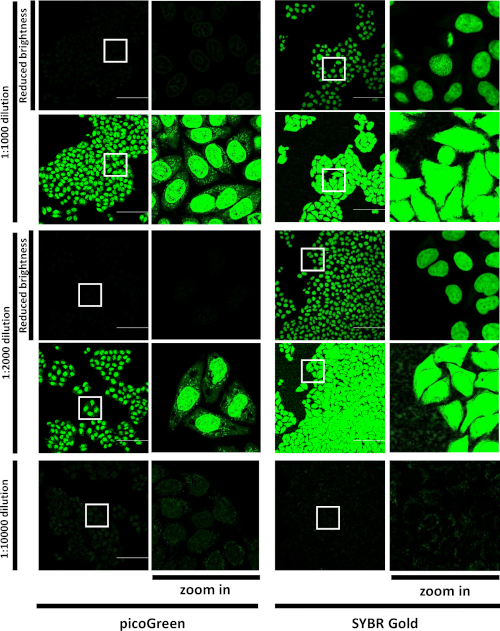
Рисунок 1: Сравнение маркировки клеток picoGreen и SG live cell. A549 клетки были инкубированы с picoGreen или SG на указанные разбавления и изображения. Представитель поля зрения помеченных ячеек в зеленом канале. LSM880 Airyscan FAST, 20x/air objective, Шкала бар 50 мкм. Одиночные оптические секции. Белые квадраты отмечают области, показанные при более высоком увеличении справа от всех полей обзора 423 x 423 мкм. Для разбавления 1:1 000 и 1:2,000 одни и те же изображения отображаются при двух настройках яркости: настройках яркости "по умолчанию", оптимизированных для 1:10 000 разбавления, и настройках "уменьшенной яркости", скорректированных во избежание насыщения детектора. Эта цифра была изменена с Evtic et al.27. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
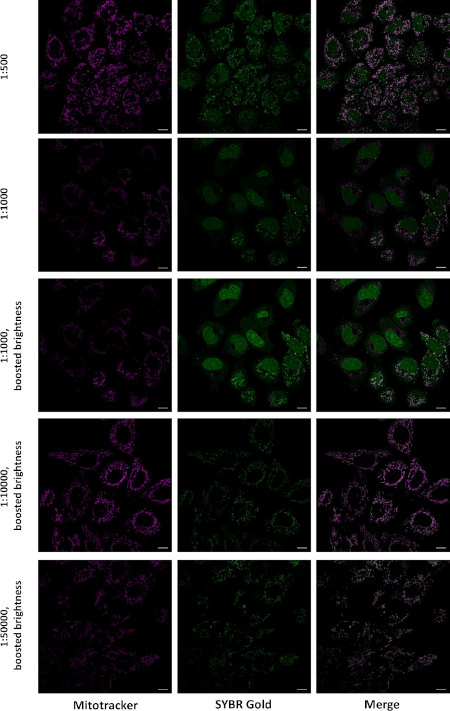
Рисунок 2: Локализация SG в живых клетках при маркировке в разных концентрациях. Клетки HeLa были инкубированы в течение 30 мин со смесью 0,25 мкм Mitotracker CMXRos Red и указанным разбавлением SG. Решение было заменено на DMEM, и изображения были приобретены на LSM880 Airyscan микроскоп, 63x 1.4 нефти цель, с последовательным приобретением цветовых каналов. Одиночные оптические ломтики показаны шкала бар 10 мкм). Эта цифра была изменена с Evtic et al.27. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 3: Клетки HeLa во время маркировки с sYBR Gold (SG). Во-первых, живые клетки HeLa были помечены Mitotracker CMXRos Red и вымыты. SG (окончательное разбавление 1:10,000 в DMEM) был добавлен в клетки и промежуток времени серии был приобретен. LSM880 микроскоп, 63x 1.4 Нефть цель, последовательное приобретение. В каждый момент времени приобретались стеки. Показаны проекции максимальной интенсивности. (A) Средняя интенсивность флуоресценции SG с течением времени в нескольких регионах, представляющих интерес. (B) Представитель поля зрения, показывающие области, представляющие интерес, где SG флуоресценция была измерена (цветные прямоугольники). (C) Поле зрения в несколько точек времени во время инкубации с SG. Квадратная область, отмеченная белой линией, отображается при более высоком увеличении в правой колонке. Эта цифра была изменена с Evtic et al.27. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 4: Влияние фиксации и пермяки на локализацию SG в клетках. Клетки HeLa были окрашены SG (запас разбавлен1:10 000) и Mitotracker CMXRos Red (0,25 мкм) в течение 30 мин. Однооптические ломтики были приобретены на вращающемся дисковом микроскопе; последовательное приобретение; шкала бар No 10 мкм. (A) Live HeLa клетки окрашенных SG. (B) Live HeLa клетки окрашенные SG, а затем фиксированной с 2% PFA в PBS в течение 30 мин. (C) Live HeLa клетки окрашенные SG, а затем фиксированной с 2% PFA в PBS в течение 30 мин и permeabilized с 0,1% Тритон X100 в течение 15 минут. На нижней панели отображается то же изображение, но яркость в зеленом канале установлена выше. (D) HeLa клетки фиксированной с 2% PFA, permeabilized с 0,1% Triton X100 в течение 15 минут, а затем окрашенные СГ и Mitotracker CMXRos Red. Для получения изображений, показанных в (D), EMCCD получить камеру для зеленого канала была сокращена в 12 раз по сравнению с A-C, чтобы избежать передержки. Эта цифра была изменена с Evtic et al.27. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 5: Нуклеоидное отслеживание на живых SIM-изображениях. Репрезентативные изображения поля зрения окрашенных ячеек SG. Внизу: двухцветное SIM-изображение, сделанное до приобретения серии промежуток времени. Зеленый канал SG; magenta и mitotracker канал. Вверху: нуклеоидные треки из 50-кадровой sim-серии sim-времени в канале SG(фильм 1); время кадра 1,8 с; отслеживания по Imaris 8.4.1 программного обеспечения. Треки закодированы по максимальной скорости трека (мкм/с); Elyra PS.1, режим SIM, 100x/1.46 Нефть цель; Шкала бар 10 мкм. Эта цифра была изменена с Evtic et al.27. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Фильм 1: SIM промежуток времени серии показаны представитель SG-окрашенные ячейки. Шкала бар No 5 мкм. Обнаруженные митохондриальные нуклеоиды помечены как белые сферы. Треки визуализированы как "Dragon хвосты" (8 кадров длиной) и цветом в соответствии с их максимальной мгновенной скоростью (цветбарв в правом нижнем углу показывает скорость в мкм /с). Митохондриальные нуклеоиды слежения и визуализации Imaris 8.4.1 программного обеспечения. Это видео было опубликовано в Jevtic et al.27. Пожалуйста, нажмите здесь, чтобы посмотреть это видео (Право нажмите, чтобы скачать).
Обсуждение
Есть несколько важнейших компонентов протокола: Для достижения преференциальной маркировки митохондриальной ДНК, концентрация ДНК связывающего красителя во время инкубации должна быть очень низкой (например, 1:10,000 разбавления типичного коммерческого запаса), а инкубационное время должно быть 30 мин. Инкубационное время никогда не должно превышать 1 ч. Золотой краситель SYBR должен быть использован; другие ДНК-связывающие красители не являются достаточно яркими, чтобы генерировать сильный сигнал при маркировке при низкой концентрации.
Ограничение нашего протокола заключается в том, что краситель вымывается из митохондриальных нуклеоидов во время шага пермяки. Поэтому описанная процедура не подходит для обычных протоколов иммунофлуоресценции. В этом случае нуклеоиды в фиксированных клетках могут быть эффективно помечены другими методами, такими как антитела против ДНК или митохондриальных транскрипционных факторов (TFAM).
Прямая маркировка митохондриальных нуклеоидов с помощью связывающего ДНК органического красителя имеет преимущества перед флуоресцентной маркировкой белка: любой тип клеток может быть помечен в пределах lt;1 h, без временных или других ограничений преходящего или стабильного выражения флуоресцентных белковых конструкций. Кроме того, в текущих протоколах, обычные флуоресцентные протеин-теги TFAM, как сообщается, вызывают артефакты. Кроме того, SG эффективно окрашивает нуклеоиды только в том случае, если потенциал митохондриальной мембраны не поврежден. Это предотвращает получение изображения биологически нерелевантных "больных" и мертвых клеток, которые не могут быть избежать с FP основе окрашивания. Наконец, ранее опубликованные протоколы, основанные на днк-связывающих красителей, не достигли преференциального окрашивания митохондриальной ДНК.
Предлагаемый протокол является быстрым и простым, таким образом, мы предполагаем, что он будет широко использоваться для живой визуализации митохондриальных нуклеоидов различными методами флуоресценции, как дифракция ограничена (например, лазерное сканирование confocal, TIRF и т.д.), а также супер-разрешение SIM.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Авторы признают Асифу Ахтар и Анжелику Рамболд (оба Института иммунобиологии и эпигенетики Макса Планка) за предоставление клеток HeLa.
Материалы
| Name | Company | Catalog Number | Comments |
| Elyra PS1 | Carl Zeiss | multi-modal super-resolution microscope containing module for super-resolution structured illumination microscopy (SR-SIM) | |
| High glucose DMEM | GIBCO/ThermoFisher | 31966021 | |
| ibidi 35 mm dish, glass bottom | Ibidi Gmbh | 81158 | |
| ibidi 8-well microSlide, glass bottom | Ibidi Gmbh | 80827 | |
| Imaris 8.4.1 | Bitplane/Oxford Instruments | image porcessing and visualisation software package | |
| iXon 885 | Andor Technologies | EMCCD camera with back-illuminated sensor | |
| LSM880 Airyscan | Carl Zeiss | laser scanning confocal microscope with array detector | |
| Mitotracker CMXRos Red | ThermoFischer | M7512 | red live cell mitochondrial stain |
| Mitotracker Deep Red FM | ThermoFischer | M22426 | far red live cell mitochondrial stain |
| picoGreen | ThermoFischer | P7581 | cell permeant DNA stain |
| Plan Apochromat 100x/1.46 Oil objective | Carl Zeiss | ||
| SYBR Gold | ThermoFischer | S11494 | cell permeant DNA stain |
| Zen Black 2012 software | Carl Zeiss | image acquisition and processing software |
Ссылки
- Kaufman, B. A., et al. The mitochondrial transcription factor TFAM coordinates the assembly of multiple DNA molecules into nucleoid-like structures. Molecular Biology of the Cell. 18 (9), 3225-3236 (2007).
- Farge, G., et al. Protein sliding and DNA denaturation are essential for DNA organization by human mitochondrial transcription factor A. Nature Communications. 3, 1013(2012).
- Bogenhagen, D. F. Mitochondrial DNA nucleoid structure. Biochimica et Biophysica Acta. 1819 (9-10), 914-920 (2012).
- Kang, D., Kim, S. H., Hamasaki, N. Mitochondrial transcription factor A (TFAM): roles in maintenance of mtDNA and cellular functions. Mitochondrion. 7 (1-2), 39-44 (2007).
- Tauber, J., et al. Distribution of mitochondrial nucleoids upon mitochondrial network fragmentation and network reintegration in HEPG2 cells. International Journal of Biochemistry & Cell Biology. 45 (3), 593-603 (2013).
- Garrido, N., et al. Composition and dynamics of human mitochondrial nucleoids. Molecular Biology of the Cell. 14 (4), 1583-1596 (2003).
- Pernas, L., Scorrano, L. Mito-Morphosis: Mitochondrial Fusion, Fission, and Cristae Remodeling as Key Mediators of Cellular Function. Annual Review of Physiology. 78, 505-531 (2016).
- Caielli, S., et al. Oxidized mitochondrial nucleoids released by neutrophils drive type I interferon production in human lupus. Journal of Experimental Medicine. 213 (5), 697-713 (2016).
- Okayama, S., Ohta, K., Higashi, R., Nakamura, K. Correlative light and electron microscopic observation of mitochondrial DNA in mammalian cells by using focused-ion beam scanning electron microscopy. Microscopy (Oxf). 63 (Suppl 1), i35(2014).
- Alan, L., Spacek, T., Jezek, P. Delaunay algorithm and principal component analysis for 3D visualization of mitochondrial DNA nucleoids by Biplane FPALM/dSTORM. European Biophysics Journal. 45 (5), 443-461 (2016).
- Kukat, C., et al. Super-resolution microscopy reveals that mammalian mitochondrial nucleoids have a uniform size and frequently contain a single copy of mtDNA. Proceedings of the National Academy of Sciences of the United States of America. 108 (33), 13534-13539 (2011).
- Kukat, C., Larsson, N. G. mtDNA makes a U-turn for the mitochondrial nucleoid. Trends in Cell Biology. 23 (9), 457-463 (2013).
- Betzig, E., et al. Imaging intracellular fluorescent proteins at nanometer resolution. Science. 313 (5793), 1642-1645 (2006).
- Rust, M. J., Bates, M., Zhuang, X. Sub-diffraction-limit imaging by stochastic optical reconstruction microscopy (STORM). Nature Methods. 3 (10), 793-795 (2006).
- Benke, A., Manley, S. Live-cell dSTORM of cellular DNA based on direct DNA labeling. ChemBioChem. 13 (2), 298-301 (2012).
- Ishigaki, M., et al. STED super-resolution imaging of mitochondria labeled with TMRM in living cells. Mitochondrion. 28, 79-87 (2016).
- Waldchen, S., Lehmann, J., Klein, T., van de Linde, S., Sauer, M. Light-induced cell damage in live-cell super-resolution microscopy. Scientific Reports. 5, 15348(2015).
- Gustafsson, M. G., et al. Three-dimensional resolution doubling in wide-field fluorescence microscopy by structured illumination. Biophysical Journal. 94 (12), 4957-4970 (2008).
- Hirano, Y., Matsuda, A., Hiraoka, Y. Recent advancements in structured-illumination microscopy toward live-cell imaging. Microscopy (Oxf). 64 (4), 237-249 (2015).
- Brown, T. A., et al. Superresolution fluorescence imaging of mitochondrial nucleoids reveals their spatial range, limits, and membrane interaction. Molecular and Cellular Biology. 31 (24), 4994-5010 (2011).
- Lewis, S. C., Uchiyama, L. F., Nunnari, J. ER-mitochondria contacts couple mtDNA synthesis with mitochondrial division in human cells. Science. 353 (6296), aaf5549(2016).
- Dellinger, M., Geze, M. Detection of mitochondrial DNA in living animal cells with fluorescence microscopy. Journal of Microscopy. 204 (Pt 3), 196-202 (2001).
- Ban-Ishihara, R., Ishihara, T., Sasaki, N., Mihara, K., Ishihara, N. Dynamics of nucleoid structure regulated by mitochondrial fission contributes to cristae reformation and release of cytochrome c. Proceedings of the National Academy of Sciences of the United States of America. 110 (29), 11863-11868 (2013).
- Zurek-Biesiada, D., et al. Localization microscopy of DNA in situ using Vybrant((R)) DyeCycle Violet fluorescent probe: A new approach to study nuclear nanostructure at single molecule resolution. Experimental Cell Research. 343 (2), 97-106 (2016).
- He, J. Y., et al. The AAA(+) protein ATAD3 has displacement loop binding properties and is involved in mitochondrial nucleoid organization. Journal of Cell Biology. 176 (2), 141-146 (2007).
- Ashley, N., Harris, D., Poulton, J. Detection of mitochondrial DNA depletion in living human cells using PicoGreen staining. Experimental Cell Research. 303 (2), 432-446 (2005).
- Jevtic, V., Kindle, P., Avilov, S. V. SYBR Gold dye enables preferential labeling of mitochondrial nucleoids and their time-lapse imaging by structured illumination microscopy. PLoS One. 13 (9), e0203956(2018).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены