Method Article
タイムラプス構造照明顕微鏡のためのミトコンドリアヌクレオイドの特異的標識
要約
このプロトコルは、市販のDNAゲル染色を有するミトコンドリアヌクレオイドの特異的標識、超分解能構造照明顕微鏡(SR-SIM)による生細胞のタイムラプスシリーズの取得、およびヌクロイド運動の自動追跡を記述する。
要約
ミトコンドリアヌクレオイドは、ミトコンドリアDNA分子によって形成されるコンパクトな粒子であり、タンパク質で被覆される。ミトコンドリアDNAは、tRNA、rRNA、およびいくつかの必須のミトコンドリアポリペプチドをコードする。ミトコンドリア核は、核分裂/融合および他の形態学的変化を受ける動的ミトコンドリアネットワーク内で分裂し、分布する。高解像度ライブ蛍光顕微鏡は、核酸の位置と動きを特徴付けるための簡単な技術です。この技術では、ヌクレオイドは、一般に、それらのタンパク質成分、すなわち転写因子a(TFAM)の蛍光タグを介して標識される。しかし、この戦略は、蛍光タンパク質タグ付き構築物の過剰発現を必要とし、アーティファクト(TFAMについて報告)を引き起こす可能性があり、多くの場合実現不可能である。有機DNA結合色素はこれらの欠点を有しない。しかし、彼らは常に核およびミトコンドリアDNAの染色を示し、したがってミトコンドリアヌクレオイドに特異性を欠いている。このような色素の物理化学的性質を考慮して、核酸ゲル染色(SYBR Gold)を選択し、生細胞におけるミトコンドリアヌクレオイドの優先標識を達成した。色素の特性、特にDNAに結合する際の高輝度は、超解像構造照明画像の時系列を用いてミトコンドリア核体運動のその後の定量化を可能にする。
概要
円形の16.5kbp DNA分子はミトコンドリアの遺伝物質を構成し、ミトコンドリア酸化リン酸化複合体に必要な22のtRNA、2つのrRNA、および13のポリペプチドをコードする。ミトコンドリア転写因子a(TFAM)および他のいくつかのタンパク質に結合したミトコンドリアDNAは、ミトコンドリアヌクレオイド11、2、3、42,3,4を形成する。ミトコンドリア核は、ミトコンドリアネットワーク55、66の成分間で移動し、再分配し、その形態学的改変、分裂または融合は細胞周期相、応力、および他の要因に応じて(Pernas et7.また、ミトコンドリアヌクレオイドの運動は、全身性エリテマトーデス病8に関与し、他の疾患に関与しうる。蛍光顕微鏡は、オルガネラの生細胞研究のための簡単な技術であるが、この技術は、ミトコンドリアヌクレオイドのサイズよりも大きい>200nmの解像度を有する(〜100 nm99、10、11、12)。10,11,12この限界は、刺激放出枯渇(STED)および単一分子局在化顕微鏡(SMLM)13,14のようないわゆる「超解像」技術によって回避された。13,14これまで、ミトコンドリアヌクレオイドおよび他のDNAは、直接確率的光学再構成顕微鏡(dSTORM)15によって生細胞で画像化された。15mtDNAと相関する位置を有する微細なサブミトコンドリア構造は、生細胞16においてSTEDにより観察された。しかしながら、これらの超解像技術は高い照明強度を必要とし、生細胞17に光毒性作用を引き起こす。したがって、回折限界を超える解像度を有するミトコンドリアヌクレオイドのタイムラプスイメージングは困難である。これに対処するために、我々は超解像構造照明顕微鏡(SR-SIM)1818を使用した。SIM は、STED および SMLM19よりもはるかに低い照明電力線量を必要とします。さらに、STEDおよびSMLM技術とは対照的に、SIMは単純な多色三次元(3D)イメージングを可能にし、フルオロフォアまたはイメージングバッファ組成物19の特定の光物性を必要としない。
生細胞におけるミトコンドリアヌクレオイドの標識に関する従来の戦略は、TFAM20のようなミトコンドリアヌクレオイドタンパク質の蛍光タグ付けである。しかし、多くの場合、この戦略は適していません。さらに、蛍光タンパク質タグ付きTFAMの過剰発現は、深刻な人工物21を生成する。有機色素によるDNAの標識は、蛍光タンパク質(FP)ベースの戦略よりも優れた効果があります。有機色素はFPタグに関連する制約がない:それらは細胞または組織の任意のタイプに使用することができ、実験の任意の時点で適用することができる。ミトコンドリアヌクレオイドの生細胞イメージングは、いくつかのDNA結合色素で報告されている:DAPI2222、SYBRグリーン23、ヴィブラントDyeCycle24、およびピコグリーン15、25、26。15,25,26ヌクレオイド標識のためのほとんどのDNA結合色素の実質的な欠点は、それらが細胞内のすべてのDNAを染色することです。ミトコンドリアDNAのみに対する色素の標的化は非常に望ましい。そのためには、適切な物理化学的性質を有する色素を慎重に選択することが必要である。ローダミン123のような非局所陽性電荷を有する親油性染料は、その陰性膜電位を保持する生のミトコンドリアに蓄積することが知られている。さらに、ミトコンドリアヌクレオイドの特異的標識に理想的な色素は、高い親和性を持つDNAを結合し、DNA結合時に明るい蛍光を発する必要があります。これらの要件を考慮すると、特定のシアニン(例えば、ピコグリーン)が有望であるが、核DNAはミトコンドリアDNA15、25、26,25,26と同時にこれらの染料によって豊富に染色される。本プロトコルは、別のシアニン色素を有する生細胞におけるミトコンドリアヌクレオイドの特異的標識、SYBR Gold(SG)、および時間経過超解像SIMビデオにおける核oidの追跡について説明する。また、SG染色された生細胞は、生細胞に適したあらゆる種類の反転蛍光顕微鏡(共焦点、紡績円盤、蛍光等)で、488nmの光源を備えて画像化することができます。
プロトコル
注:ここで言及したすべての細胞株は、10%のウシ胎児血清(FBS)、グルタミン、ペニシリン/ストレプトマイシン、ピルビン酸を添加した高グルコースダルベックの修飾イーグル培地(DMEM)で培養した。5%CO2に設定したインキュベーターで37°Cまで温めることにより、ラベリングおよび画像化の日に使用されるすべての培地およびサプリメントを平衡化する。2ラベリングを含むすべての細胞培養作業は、層流フードの下で無菌条件で行われます。
1. ライブセルラベリング
- ラベリング手順の前日、4 x 105 HeLa細胞を2mLの培地で35mmペトリ皿に#1.5ガラス底で培養する。マルチウェルチャンバースライドを使用できますが、ボリュームはウェルの体積に比例して調整する必要があります。細胞懸濁液を希釈して約50,000個の細胞/mLを持ち、35mmのペトリ皿に細胞懸濁液の2mLをシードします。
- SYBRゴールド(SG)商用在庫ソリューションの次の希釈液を準備します: 1:5,000.ミトトラッカーディープレッド(遠赤色染色)またはミトトラッカーCMXRosレッド(赤い汚れ)(材料表;市販株希釈1:2,000)をフェノール赤自由培養培地で準備します。SGと同じピコグリーンの希釈液を準備します。
注:ステップ 1.2 で説明されているソリューションは、2x ラベル付けソリューションです。蛍光色素を含むすべての溶液を光から可能な限り保護します。 - 接着細胞を2 mL PBSで1回洗います。35mmペトリ皿に1mlのフェノール赤入り培養培地を加えます。8ウェルチャンバースライドの場合、総ウェル容量の1/2に等しいボリュームを使用します(例えば、総ウェル容量が250μLの場合は125 μLを追加します)。
- ステップ1.2~35mmのペトリ皿で調製した2xラベリング溶液を1 mL加えます。8ウェルチャンバースライドの場合は、総ウェル容量の1/2に等しいボリュームを使用してください。5%CO2の下で37°Cで30分間細胞をインキュ2ベートする。
注:長いインキュベーションは核DNAの標識を引き起こすので、1時間以上SG標識溶液で細胞をインキュベートしないでください。 - 蛍光染料を含む培地を慎重に吸引し、PBSで細胞を一度洗います。
- フェノールを赤自由な細胞培養培地に添加し、細胞をイメージングまで37°CのCO2インキュベーターで暗闇の中に保管します。
- インキュベーションユニットを搭載したSR-SIM顕微鏡上の細胞の画像(下記参照)。
2. SR-SIM画像取得
- 顕微鏡ステージにステージトップインキュベーターを取り付ける。所望の温度とCO2濃度(例えば、哺乳動物細胞の場合は37°Cおよび5%)を設定し、画像取得を開始する前に少なくとも1時間暖かく保ちます。
- レーザーを含むSR-SIM顕微鏡のすべてのコンポーネントのスイッチを入れ、少なくとも1時間温めます。
- 顕微鏡メーカーがSR-SIMに推奨する高倍率、高い開口(NA)浸漬目的(例えば、100x 1.46 NA油)を選択してください。
- インキュベートされた顕微鏡の段階に(ステップ1.6から)ラベル付きの細胞とチャンバースライドまたは35 mm皿を取付ける。
- 好ましくは眼で、サンプル上の関心領域を見つける。SR-SIMイメージングの品質を最適に達成するには、ガラスに適切に取り付けられているセルを選択します。
- SR-SIM 画像を取得するには、バックスチンドハイエンド電子乗算電荷結合デバイス(EM-CCD)カメラを使用します。
- 画像取得ソフトウェアを使用して、使用するカメラに推奨される高いEMゲイン(例えば、300)を設定します。
- ヌクレオイド追跡用のタイムラプスシリーズを取得する前に、同じ視野の2色SR-SIM画像を取得します:ミトコンドリア染色用のチャネルとSG用のチャンネル。使用するミトコンドリア染色に適した第1のカラーチャンネルを設定する(例えば、遠赤色ミトコンドリア染色の場合、励起を633nm以上に設定し、650nmロングパス発光フィルタを設定する)。SG信号の場合、励起を488 nmに、500~550 nmのバンドパス放出フィルタを設定します。
- ソフトウェアを使用して、488 nmと遠赤色の汚れラインの両方に可能な限り低いレーザーパワーを設定します。
注:典型的な設定は、アフュースト光光チューナブルフィルタ(AOTF)によって調整された1%のレーザー出力電力です。 - SIM顕微鏡がチャンネルをシーケンシャルに取得する場合(シングルカメラ設定)、遠赤色の汚れ検出チャネルをオフにします。
- ソフトウェアの Z スタックボックスのチェックを外して Z スタックの取得をオフにして、単一焦点面の取得を設定します。
- EM-CCD カメラの露出時間を最短に設定します。
- グリッドの回転を 5 回ではなく 3 回転に設定します。
- フレームレートを上げるには、ソフトウェアの取得タブで、カメラセンサーの中央領域からのみデータを読み取るようにカメラを設定します。
注:たとえば、1,000 x 1,000 ピクセルのフルセンサーの領域を読み取りから 256 x 256 ピクセルのみを読み取るように切り替えると、カメラの露出時間を 50 ms から 13.4 ms に、フレーム全体の時間を 1.8 秒から 1.2 秒に短縮できます。カメラセンサーの中央部分のみが読み取られる場合、SR-SIMに通常使用される63倍または100倍の目標では、視野は非常に小さくなります。露光時間を短くすると、画像の信号対雑音比が低下します。 - レーザーパワーとカメラの露出時間を最適化する:複数のレーザーパワー値(例えば、0.5%、1%、1.5%、2%)で標識された細胞のSR-SIM2次元(2D)画像を取得するそして、数回の暴露時間(例えば、13.4 ms、25 ms、50 ms)。
- 生の SIM データセットを処理します (ステップ 3.1 を参照)。
- SIM処理によって生成されるアーティファクトがほとんどまたはまったくないミトコンドリア(すなわち、核状の核状)に明るいスポットを持つSIM画像を得るレーザーパワーとカメラの露出時間を選択してください。ミトコンドリアの外側の領域を検査します(例えば、488 nmの固体レーザーの1%のパワーとEM-CCDカメラの25 ms露光)。
- ステップ2.15-2.17で最適化された設定を使用して、タイムラプスシリーズの取得を開始します。
3. データ処理と分析
- 適切なソフトウェアの構造化された照明モジュールを使用して生 SIM データセットを処理する (材料表): SIM 処理パラメータの[自動] チェックボックスを選択します。複数のファイルの自動処理を行う場合は、バッチ処理ツールを使用し、[バッチに現在を使用] を選択解除し、[バッチの実行] をクリックして、SIM 処理用に複数のファイルを選択します。
- SIM 処理された時系列データセットを、Imaris ファイル コンバータ ソフトウェア (つまり、Imaris ソフトウェアのバージョンに対応するバージョン) を使用してims形式に変換します。
- リネージュ (またはトラック) モジュールのライセンスを持つソフトウェア (バージョン 8.4.1 以降) で変換されたファイルを開きます。
- [新しいスポットの追加] アイコンをクリックして、[スポット] の作成ウィザードを開始します。作成用のウィザードが起動します。
- ウィザードの [作成] タブを選択します。
- ウィザードの最初の手順で、[スポットの追跡(時間の経過) をクリックし、ウィザードの 2 番目の手順に進みます。
- 推定 XY 直径を 0.1 ~0.15 μm に設定し、[背景減算]をクリックして、3 番目のステップに進みます。
- ヒストグラムの垂直線をドラッグしてフィルターの「品質」のしきい値を調整し、大部分の核OIDが「斑点」として検出される一方で、アーティファクトは検出されません(つまり、検出されたスポットは画像上に重ね合わせてボールとしてマークされます)。これが各フレームに当てはまるかどうかを確認し、必要に応じてしきい値を再調整します。4 番目に進み、ウィザードの 5 番目の手順に進みます。
- 自己回帰モーションアルゴリズムを選択します。最大距離を 0.5 μm に設定し、[最大ギャップ サイズ]を 0 に設定します。
- 時系列の各フレームを確認し、誤ったトラックが描画されているか、トラック間にギャップが生じたかどうかを確認します(現在の設定でウィザードによって構築されたトラックは、瞬時に画像上に線としてマークされます)。必要に応じて「最大距離」を調整します。ウィザードの 6 番目の手順に進みます。[トラック期間] フィルターを選択し、しきい値を 3 ~ 5 s に設定します。
- 現在検出されているスポットまたはトラックが最適でない場合は、(ウィザード ウィンドウの下部にある) ナビゲーション ボタンを使用して、スポットまたはトラックの作成に必要なパラメーターを微調整するウィザードの前の手順に戻ります。
- 微調整されたパラメーターにより、ソフトウェアがすべてのスポットを検出してトラックを正しく作成できる場合は、ウィザードの緑色の矢印ナビゲーションボタンをクリックしてトラックの作成を確認します。
- [統計] アイコン ウィンドウをクリックして、トラックの統計情報を抽出します。必要な統計パラメーター ([統計] の下の[詳細]タブと[平均値] タブ) を選択し、数値化と視覚化のためにフロッピー ドライブアイコンをクリックして値を csv ファイルとしてエクスポートします。
注:最大トラック速度、平均トラック速度、トラック長、およびトラック変位は重要なパラメータの例です。 - 画像データセットを表示または公開する必要がある場合は、[スナップショット]または[アニメーション]ツールを使用して、オプションでオーバーレイされたトラックを使用して、タイムラプスシリーズを表すスナップショットやビデオファイルを作成します。
4. 共焦点画像の取得
- 顕微鏡ステージにステージトップインキュベーターを設置し、所望の温度とCO2濃度(哺乳類細胞の場合は37°Cおよび5%)を設定し、画像取得を開始する前に少なくとも1時間暖かく保ちます。
- レーザーを含む共焦点レーザー走査顕微鏡のすべてのコンポーネントのスイッチを入れ、少なくとも1時間温めます。
- ナイキストの基準に従って、目的の中から高の倍率および空間サンプリングを選択します。
- SG チャネルの場合、励起を 488 nm に、検出範囲を 500 ~ 550 nm に設定します。ミトコンドリア染色チャネルの場合、赤色色素の場合は561 nmおよび570〜630 nmの発光、遠赤色色素では633 nmの励起および>650 nmの放出に設定します。
- PMT検出器のゲイン700mVで信号の取得を可能にする、可能な限り低いレーザーパワー(通常は1%以下)を設定します。
- 「SGチャネル」でミトコンドリア核OIDが検出され、ミトコンドリアが「赤」または「遠赤色」チャネルで検出される細胞の2色共焦点画像を取得する。
結果
SGを用いて生細胞ラベリングを特徴づけ
まず、種々の希釈液における色素とのインキュベーション時の細胞内のSGの分布は、共焦点顕微鏡によって特徴付けられた。SGまたはpicoGreenの高濃度でインキュベーションした後、両方の染料は主に核を標識し、細胞質にパンクチット染色を示した(図1)、同様に別の正に帯電したシアニン色素(すなわち、ピコグリーン)15に関する公表されたデータと同様である。しかし、1:10,000希釈時にSGとのインキュベーションを行った際、核内にかすかな染色が現れ、細胞質では明るいスポットのパターンを観察した(図1)。一方、ピコグリーン染料を希釈してインキュベーションを1:10,000で、主に核染色を行った。SG信号は、同じ濃度でピコグリーンのそれよりもはるかに明るかった。データは、SGが他の同様のDNA結合色素よりもミトコンドリアDNAをイメージングするのに適していることを示した。
明るい点がミトコンドリアに局在していることを確認するために、SGと遠赤色ミトコンドリア染色と同時に生きた細胞を染色した。後者は、生細胞のミトコンドリアに蓄積する正に帯電した細胞透過性有機色素である。1:10,000および1:50,000の希釈でSGとのインキュベーションを行ったところ、ミトコンドリアでほぼすべてのSG染色が起こり、1:500および1:1,000の希釈で標識すると、核と細胞質の有意な染色が起こった(図2)。
また、経時顕微鏡によるSGによる生細胞染色の経時経過を特徴付けた(図3)。ミトコンドリアと時間のSG蛍光強度のプロット(図3B)は、45分後にヌクレオイド染色が飽和に近いことを示唆した。したがって、〜30〜60分のインキュベーション時間をお勧めします。
細胞の固定および/または透過に伴い、SG細胞内分布がどのように変化するかを試験した。生きた染色された細胞の固定(2%パラホルムアルデヒド[PFA])は、色素の核へのわずかな再分配を引き起こした(図4A,B)。固定細胞の透過性(0.1%トリトンX100)は、ミトコンドリアにおけるSG点線パターンを排除し、かつ核の染色が優勢であった(図4C)。SGを固定および透過後に細胞に添加した場合、細胞質と核に均一に分布した(図4D)。したがって、SG標識細胞は必要に応じて固定することができるが、色素はパーメアビライゼーションを必要とするプロトコルには適さない。
生細胞SR-SIMおよびミトコンドリアヌクレオイド追跡
SGと遠赤色ミトコンドリア染色(材料表)を用いた生細胞を、超解像SIM技術により3D画像化した。共焦点画像(図2)のように、ミトコンドリアヌクレオイドはミトコンドリア内の明るいスポットとして現れた(図5A)。また、2D SIM画像の時系列を取得し、回折限界を超えた解像度で核状の位置を追跡しました。時系列を開始する直前に、SGとミトコンドリア染色チャネルでSIM 3Dスタックを取得しました。その後、SGチャンネルのみで時系列を取得し、ミトコンドリアヌクレオイドを追跡して動きを定量化しました。トラック平均速度は0.042 μm/sで、最大瞬時の速度は0.078 ± 0.012 μm/sでした。核状の大部分は元の位置から遠く離れず、ミトコンドリア画像上のトラックのオーバーレイが示唆するように、ミトコンドリアネットワークに限定された短距離のランダムな動きを示した(図5B)。一般的な時系列(Movie 1)では、急速な方向の変位が少ししか発生しません。
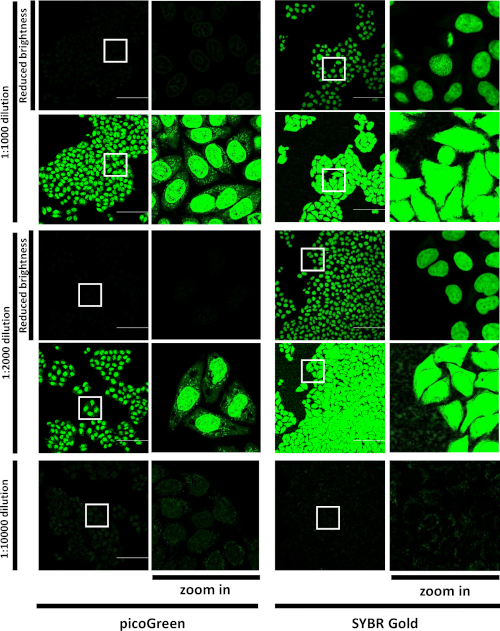
図1:ピコグリーンとSGライブセルラベリングの比較。A549細胞を、示された希釈液でピコグリーンまたはSGでインキュベートし、画像化した。緑色チャネル内のラベル付きセルの代表的な視野。LSM880エアリックスカンFAST、20x/空気目標、スケールバー= 50 μm.単一の光学セクション。白い四角形は、423 x 423 μm の視野全体の右側に表示される領域を示します。1:1,000 および 1:200 希釈の場合、同じ画像は、1:10,000 希釈用に最適化された「デフォルト」の明るさ設定と、検出器の飽和を避けるために調整された「明るさの低下」設定の 2 つの明るさ設定で表示されます。この図は Jevtic ら27. から変更されました。この図の大きなバージョンを表示するには、ここをクリックしてください。
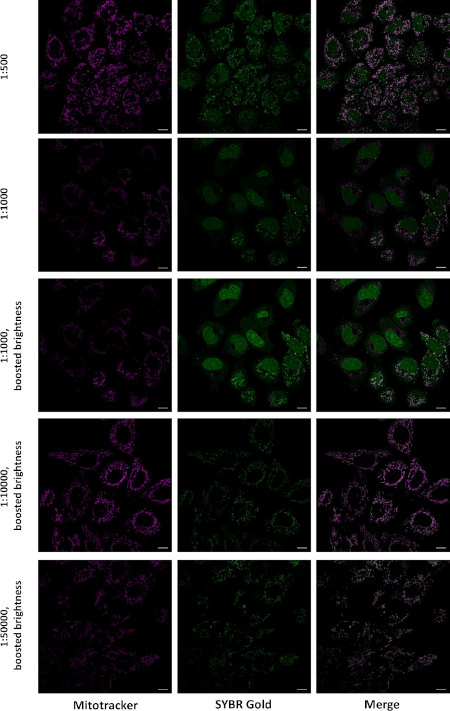
図2:異なる濃度での標識時の生細胞におけるSGの局在化。HeLa細胞を0.25 μMのミトトラッカーCMXRosレッドと示されたSG希釈液と混合して30分間インキュベートした。この溶液をDMEMに置き換え、画像はLSM880 Airyscan顕微鏡63x 1.4のオイル目的で取得し、カラーチャンネルをシーケンシャルに取得しました。単一の光学スライスはスケールバー= 10 μm) を示しています。この図は Jevtic ら27. から変更されました。この図の大きなバージョンを表示するには、ここをクリックしてください。

図3:SYBRゴールド(SG)でのラベリング中のHeLa細胞。まず、生糸球菌細胞を、マイトトラッカーCMXRosレッドで標識し、洗浄した。SG(DMEMでの最終希釈1:10,000)を細胞に添加し、タイムラプス系列を取得した。LSM880顕微鏡、63x 1.4オイル目的、シーケンシャルな取得。Zスタックは各時点で取得されました。最大強度の投影が表示されます。(A) 関心のあるいくつかの領域におけるSG蛍光の平均強度が時間の経過に及ぼす。(B)SG蛍光が測定された対象領域を示す代表的な視野(着色長方形)。B(C)SGでのインキュベーション中に、いくつかの時点での視野。白い線でマークされた正方形の領域は、右の列の拡大率で表示されます。この図は Jevtic ら27. から変更されました。この図の大きなバージョンを表示するには、ここをクリックしてください。

図4:細胞内のSG局在に及ぼす固定化および透過化の効果HeLa細胞はSG(ストック希釈1:10,000)とミトトラッカーCMXRosレッド(0.25 μM)で30分間染色され、単一の光学スライスを回転ディスク顕微鏡で取得した。逐次取得。スケールバー= 10 μm(A) SG で染色されたライブ HeLa 細胞。(B)生ヒラ細胞はSGで染色し、30分間PBSで2%PFAで固定し、その後、SGで染色されたライブHeLa細胞をPBSで2%PFAで30分間固定し、0.1%トリトンX100で15分間透過させた。下のパネルでは同じ画像が表示されますが、緑のチャンネルの明るさは高くなります。(D)HeLa細胞を2%PFAで固定し、0.1%トリトンX100で15分間透過し、SGおよびミトトラッカーCMXRosレッドで染色した。(D)に示す画像を取得するために、グリーンチャンネルのカメラのEMCCDゲインはA-Cと比較して12倍に減少し、露出過ぎを避けました。この図は Jevtic ら27. から変更されました。この図の大きなバージョンを表示するには、ここをクリックしてください。

図 5: ライブ SIM 画像のヌクレオイドトラッキングSG染色された細胞の視野の代表的な画像。下:タイムラプスシリーズの取得前に撮影した2色SIM画像。緑 = SG チャネル;マゼンタ = ミトトラッカーチャンネル。トップ:SGチャンネル(ムービー1)の50フレームSIM時系列からのヌクレオイドトラック。フレーム時間 = 1.8 s;Imaris 8.4.1 ソフトウェアによるトラッキング。トラックは最大トラック速度(μm/s)で色分けされます。エリラPS.1、SIMモード、100x / 1.46オイルの目的。スケールバー= 10 μmこの図は Jevtic ら27. から変更されました。この図の大きなバージョンを表示するには、ここをクリックしてください。

動画1:代表的なSG染色細胞を示すSIMタイムラプスシリーズ。スケールバー= 5 μm. 検出されたミトコンドリアヌクレオイドは白球としてマークされます。トラックは「ドラゴンテール」(8フレーム長)として視覚化され、最大瞬時速度に従って色分けされます(右下のカラーバーはμm/sの速度を示しています)。ミトコンドリア核OIDは、イマリス8.4.1ソフトウェアによる追跡と可視化を行う。このビデオは Jevtic ら27で公開されています。こちらをクリックしてこのビデオを見てください(右クリックしてダウンロードしてください)。
ディスカッション
プロトコルにはいくつかの重要な要素があります:ミトコンドリアDNAの優先標識を達成するために、インキュベーション中のDNA結合色素の濃度は非常に低く(例えば、典型的な商業ストックの1:10,000希釈)、およびインキュベーション時間は30分であるべきです。インキュベーション時間は1時間を超えてはならない SYBR ゴールド染料を使用する必要があります。他のDNA結合色素は、低濃度で標識すると強いシグナルを生成するほど明るくない。
我々のプロトコルの限界は、色素が透過性のステップの間にミトコンドリアヌクレオイドから洗い流されるということです。したがって、記載された手順は、従来の免疫蛍光プロトコルには適していない。この場合、固定細胞内のヌクレオイドは、DNAまたはミトコンドリア転写因子(TFAM)に対する抗体などの他の技術で効率的に標識することができる。
DNA結合性有機色素を用いたミトコンドリアヌクレオイドの直接標識は、蛍光タンパク質標識よりも利点があります:任意のタイプの細胞は、蛍光タンパク質タグ付き構築物の一時的または安定した発現の一時的または他の制約なしに、<1時間内に標識することができます。また、現行のプロトコルでは、TFAMの従来の蛍光タンパク質タグ付けが、人工物を引き起こすことが報告された。また、SGはミトコンドリア膜電位がそのままの場合にのみ、効率的にヌクレオイドを染色する。これは、FPベースの染色では避けられない生物学的に無関係な「病気」および死んだ細胞の画像取得を防ぎます。最後に、DNA結合色素に基づいて以前に公開されたプロトコルは、ミトコンドリアDNAの優先染色を達成しなかった。
提案されたプロトコルは高速かつ単純であり、したがって、我々はそれが広く、様々な蛍光技術、両方の限定された(例えば、レーザー走査共焦点、TIRFなど)と超解像SIMによってミトコンドリア核のライブイメージングに使用されると仮定する。
開示事項
著者らは開示するものは何もない。
謝辞
著者らは、HeLa細胞を提供したアシファ・アフタールとアンジェリカ・ランボルト(マックス・プランク免疫生物学・エピジェネティクス研究所の両方)を認めている。
資料
| Name | Company | Catalog Number | Comments |
| Elyra PS1 | Carl Zeiss | multi-modal super-resolution microscope containing module for super-resolution structured illumination microscopy (SR-SIM) | |
| High glucose DMEM | GIBCO/ThermoFisher | 31966021 | |
| ibidi 35 mm dish, glass bottom | Ibidi Gmbh | 81158 | |
| ibidi 8-well microSlide, glass bottom | Ibidi Gmbh | 80827 | |
| Imaris 8.4.1 | Bitplane/Oxford Instruments | image porcessing and visualisation software package | |
| iXon 885 | Andor Technologies | EMCCD camera with back-illuminated sensor | |
| LSM880 Airyscan | Carl Zeiss | laser scanning confocal microscope with array detector | |
| Mitotracker CMXRos Red | ThermoFischer | M7512 | red live cell mitochondrial stain |
| Mitotracker Deep Red FM | ThermoFischer | M22426 | far red live cell mitochondrial stain |
| picoGreen | ThermoFischer | P7581 | cell permeant DNA stain |
| Plan Apochromat 100x/1.46 Oil objective | Carl Zeiss | ||
| SYBR Gold | ThermoFischer | S11494 | cell permeant DNA stain |
| Zen Black 2012 software | Carl Zeiss | image acquisition and processing software |
参考文献
- Kaufman, B. A., et al. The mitochondrial transcription factor TFAM coordinates the assembly of multiple DNA molecules into nucleoid-like structures. Molecular Biology of the Cell. 18 (9), 3225-3236 (2007).
- Farge, G., et al. Protein sliding and DNA denaturation are essential for DNA organization by human mitochondrial transcription factor A. Nature Communications. 3, 1013(2012).
- Bogenhagen, D. F. Mitochondrial DNA nucleoid structure. Biochimica et Biophysica Acta. 1819 (9-10), 914-920 (2012).
- Kang, D., Kim, S. H., Hamasaki, N. Mitochondrial transcription factor A (TFAM): roles in maintenance of mtDNA and cellular functions. Mitochondrion. 7 (1-2), 39-44 (2007).
- Tauber, J., et al. Distribution of mitochondrial nucleoids upon mitochondrial network fragmentation and network reintegration in HEPG2 cells. International Journal of Biochemistry & Cell Biology. 45 (3), 593-603 (2013).
- Garrido, N., et al. Composition and dynamics of human mitochondrial nucleoids. Molecular Biology of the Cell. 14 (4), 1583-1596 (2003).
- Pernas, L., Scorrano, L. Mito-Morphosis: Mitochondrial Fusion, Fission, and Cristae Remodeling as Key Mediators of Cellular Function. Annual Review of Physiology. 78, 505-531 (2016).
- Caielli, S., et al. Oxidized mitochondrial nucleoids released by neutrophils drive type I interferon production in human lupus. Journal of Experimental Medicine. 213 (5), 697-713 (2016).
- Okayama, S., Ohta, K., Higashi, R., Nakamura, K. Correlative light and electron microscopic observation of mitochondrial DNA in mammalian cells by using focused-ion beam scanning electron microscopy. Microscopy (Oxf). 63 (Suppl 1), i35(2014).
- Alan, L., Spacek, T., Jezek, P. Delaunay algorithm and principal component analysis for 3D visualization of mitochondrial DNA nucleoids by Biplane FPALM/dSTORM. European Biophysics Journal. 45 (5), 443-461 (2016).
- Kukat, C., et al. Super-resolution microscopy reveals that mammalian mitochondrial nucleoids have a uniform size and frequently contain a single copy of mtDNA. Proceedings of the National Academy of Sciences of the United States of America. 108 (33), 13534-13539 (2011).
- Kukat, C., Larsson, N. G. mtDNA makes a U-turn for the mitochondrial nucleoid. Trends in Cell Biology. 23 (9), 457-463 (2013).
- Betzig, E., et al. Imaging intracellular fluorescent proteins at nanometer resolution. Science. 313 (5793), 1642-1645 (2006).
- Rust, M. J., Bates, M., Zhuang, X. Sub-diffraction-limit imaging by stochastic optical reconstruction microscopy (STORM). Nature Methods. 3 (10), 793-795 (2006).
- Benke, A., Manley, S. Live-cell dSTORM of cellular DNA based on direct DNA labeling. ChemBioChem. 13 (2), 298-301 (2012).
- Ishigaki, M., et al. STED super-resolution imaging of mitochondria labeled with TMRM in living cells. Mitochondrion. 28, 79-87 (2016).
- Waldchen, S., Lehmann, J., Klein, T., van de Linde, S., Sauer, M. Light-induced cell damage in live-cell super-resolution microscopy. Scientific Reports. 5, 15348(2015).
- Gustafsson, M. G., et al. Three-dimensional resolution doubling in wide-field fluorescence microscopy by structured illumination. Biophysical Journal. 94 (12), 4957-4970 (2008).
- Hirano, Y., Matsuda, A., Hiraoka, Y. Recent advancements in structured-illumination microscopy toward live-cell imaging. Microscopy (Oxf). 64 (4), 237-249 (2015).
- Brown, T. A., et al. Superresolution fluorescence imaging of mitochondrial nucleoids reveals their spatial range, limits, and membrane interaction. Molecular and Cellular Biology. 31 (24), 4994-5010 (2011).
- Lewis, S. C., Uchiyama, L. F., Nunnari, J. ER-mitochondria contacts couple mtDNA synthesis with mitochondrial division in human cells. Science. 353 (6296), aaf5549(2016).
- Dellinger, M., Geze, M. Detection of mitochondrial DNA in living animal cells with fluorescence microscopy. Journal of Microscopy. 204 (Pt 3), 196-202 (2001).
- Ban-Ishihara, R., Ishihara, T., Sasaki, N., Mihara, K., Ishihara, N. Dynamics of nucleoid structure regulated by mitochondrial fission contributes to cristae reformation and release of cytochrome c. Proceedings of the National Academy of Sciences of the United States of America. 110 (29), 11863-11868 (2013).
- Zurek-Biesiada, D., et al. Localization microscopy of DNA in situ using Vybrant((R)) DyeCycle Violet fluorescent probe: A new approach to study nuclear nanostructure at single molecule resolution. Experimental Cell Research. 343 (2), 97-106 (2016).
- He, J. Y., et al. The AAA(+) protein ATAD3 has displacement loop binding properties and is involved in mitochondrial nucleoid organization. Journal of Cell Biology. 176 (2), 141-146 (2007).
- Ashley, N., Harris, D., Poulton, J. Detection of mitochondrial DNA depletion in living human cells using PicoGreen staining. Experimental Cell Research. 303 (2), 432-446 (2005).
- Jevtic, V., Kindle, P., Avilov, S. V. SYBR Gold dye enables preferential labeling of mitochondrial nucleoids and their time-lapse imaging by structured illumination microscopy. PLoS One. 13 (9), e0203956(2018).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved