Method Article
延时结构照明显微镜线粒体核素的特定标签
摘要
该协议描述了线粒体核物与商业上可用的DNA凝胶染色的具体标记,通过超高分辨率结构化照明显微镜(SR-SIM)获取活标记细胞的延时序列,以及自动跟踪核素运动。
摘要
线粒体核物是由涂有蛋白质的线粒体DNA分子形成的紧凑颗粒。线粒体DNA编码tRNA、rRNA和几种必需的线粒体多肽。线粒体核素在经历裂变/融合和其他形态变化的动态线粒体网络中分裂和分布。高分辨率活荧光显微镜是一种描述核素位置和运动的简单技术。对于此技术,核素通常通过其蛋白质成分的荧光标记进行标记,即转录因子 a (TFAM)。然而,此策略需要过度表达荧光蛋白标记构造,这可能导致伪影(为 TFAM 报告),并且在许多情况下不可行。有机DNA结合染料没有这些缺点。然而,它们总是显示核和线粒体DNA的染色,因此缺乏线粒体核物的特异性。通过考虑这种染料的物理化学性质,我们选择了核酸凝胶染色(SYBR Gold),并在活细胞中实现了线粒体核物的优待标记。染料的特性,特别是与DNA结合时的高亮度,允许使用超高分辨率结构化照明图像的时间序列对线粒体核物运动进行后续定量。
引言
循环16.5 kbp DNA分子构成线粒体的遗传物质,编码22个tRNA、2个rRNA和13个线粒体氧化磷酸化复合物所需的13个多肽。线粒体DNA结合线粒体转录因子a(TFAM)和其他几个蛋白质形成线粒体核素1,1,2,3,4。2,3,4线粒体核素在线粒体网络5的成分之间移动和重新分配,66在其形态重塑、裂变或融合过程中根据细胞周期相、应力和其他因素(在Pernas等7中回顾)。此外,线粒体核物的运动,与系统性红斑狼疮病8有关,并可能在其他疾病中发挥作用。荧光显微镜是细胞器活细胞研究的一种简单技术,但该技术的分辨率为>200 nm,比线粒体核物(+100 nm9、10、11、12)10,11,12的大小大。9这种限制被所谓的"超分辨率"技术所规避,如刺激发射消耗(STED)和单分子定位显微镜(SMLM)13,14。13,14到目前为止,线粒体核素和其他DNA通过直接随机光学重建显微镜(dSTORM)15在活细胞中成像。STED在活细胞16中观察到与mtDNA相关的位置的细子线粒体结构。然而,这些超分辨率技术需要高照明强度,这会导致光毒性作用活细胞17。因此,分辨率超过衍射极限的线粒体核物的延时成像具有挑战性。为了解决这个问题,我们使用超高分辨率结构化照明显微镜(SR-SIM)18。18SIM 需要比 STED 和 SMLM19低得多的照明功率剂量。此外,与STED和SMLM技术相比,SIM允许直接的多色三维(3D)成像,它不需要氟波或成像缓冲组合19的特定光物理特性。
在活细胞中标记线粒体核物的传统策略是线粒体核素蛋白的荧光标记,如TFAM20。然而,在许多情况下,这种策略并不合适。此外,荧光蛋白标记TFAM的过度表达会产生严重的伪影21。用有机染料标记DNA比荧光蛋白(FP)为基础的策略有优势。有机染料不含与FP标记相关的约束:它们可用于任何类型的细胞或组织,可在实验的任何时间点应用。线粒体核物的活细胞成像报告有几种DNA结合染料:DAPI 22、SYBR Green2223、Vybrant23DyeCycle24和皮科格林15、25、26。15,25,26大多数DNA结合染料用于核素标签的一个重大缺点是,它们染色细胞内的所有DNA。将染料仅针对线粒体DNA是非常可取的。为此,必须仔细选择具有适当物理化学特性的染料。具有非局部正电荷的脂质染料,如红胺123,已知在活线粒体中积累,从而保持其负膜电位。此外,用于线粒体核物特定标记的理想染料应结合具有高亲和力的DNA,并在DNA结合上发出明亮的荧光。考虑到这些要求,某些氰化物是有希望的(例如,皮科格林),但核DNA被这些染料大量染色,同时与线粒体DNA15,25,26。15,25,26本协议描述了使用另一种氰化物染料SYBR Gold (SG)在活细胞中跟踪线粒体核物的具体标签,以及跟踪时间推移超分辨率 SIM 视频中的核素。此外,SG染色活细胞可以通过任何类型的倒置荧光显微镜(共聚焦、旋转盘、外皮等)进行成像,适合活细胞,并配备488nm光源。
研究方案
注:这里提到的所有细胞系都培养在高葡萄糖Dulbecco的改良鹰的介质(DMEM),辅以10%的胎儿牛血清(FBS),谷氨酰胺,青霉素/链霉素,和丙酮。在标签和成像当天使用的所有介质和补充剂均以加热至37°C的培养箱中加热至5%CO2。所有细胞培养工作,包括标签,都在不育条件下进行层流罩。
1. 活细胞标签
- 在标签程序的前一天,在35毫米的培养皿中培养4 x 105 HeLa细胞,在35毫米的培养皿中,#1.5玻璃底。可以使用多井室滑轨,但体积应根据井的体积按比例调整。稀释细胞悬浮液,在35毫米培养皿中产生大约50,000个细胞/mL和2 mL的细胞悬浮液种子。
- 准备以下SYBR黄金(SG)商业股票解决方案稀释:1:5,000。在酚类无红培养介质中制备线粒度追踪器深红色(远红色污渍)或Mitotracker CMXRos红(红色污渍)(材料表;商业库存稀释1:2,000)。准备与 SG 相同的皮果格林集稀释。
注:步骤 1.2 中描述的解决方案是 2x 标签解决方案。尽可能保护所有含有荧光染料的溶液免受光的照射。 - 用 2 mL PBS 清洗一次粘附细胞。在35毫米培养皿中加入1ml酚类无红培养基。对于 8 井室滑道,使用等于总井容量 1/2 的体积(例如,如果总井容量为 250 μL,则添加 125 μL)。
- 加入步骤 1.2 至 35 mm Petri 盘中准备的 2x 贴标溶液的 1 mL。对于 8 井室幻灯片,请使用等于总井容量 1/2 的体积。在5%CO2以下的37°C下孵育细胞30分钟2。
注:不要用SG标记溶液孵育细胞超过1小时,因为更长的孵育将导致核DNA标记。 - 小心地吸气含有荧光染料的介质,用PBS清洗细胞一次。
- 加入无酚无红细胞培养基,将细胞保持在CO2培养箱中,在37°C下保持黑暗,直到成像。
- 在装有孵化单元的SR-SIM显微镜上成像活细胞(见下文)。
2. SR-SIM 图像采集
- 在显微镜舞台上安装舞台顶培养箱。设定所需的温度和CO2浓度(例如,哺乳动物细胞为37°C和5%),在开始图像采集之前至少保持1小时的温暖。
- 打开 SR-SIM 显微镜的所有部件(包括激光),使其预热至少 1 小时。
- 选择显微镜制造商为 SR-SIM 推荐的高放大倍率高数值孔径 (NA) 浸入目标(例如,100x 1.46 NA 油)。
- 在孵化显微镜阶段安装带有标记细胞的室式幻灯片或 35 mm 盘(从步骤 1.6 起)。
- 找到样品上感兴趣的区域,最好用眼部。要达到最佳的 SR-SIM 成像质量,请选择与玻璃相连的电池。
- 使用后镀锡高端电子倍增电荷耦合装置 (EM-CCD) 摄像机获取 SR-SIM 图像。
- 使用图像采集软件,为所使用的相机(例如 300)设置推荐的高 EM 增益。
- 在获取核素跟踪的延时序列之前,获取同一视场的双色 SR-SIM 图像:一个线粒体染色通道,另一个用于 SG 通道。设置适用于所使用的线粒体染色的第一个颜色通道(例如,对于远红色的线粒体污渍,将激发设置为 633 nm 或更长,以及 650 nm 长通发射滤镜)。对于 SG 信号,将激励设置为 488 nm 和 500-550 nm 带通发射滤光片。
- 使用该软件,设置488纳米和远红色染色线的最低激光功率。
注:典型的设置是 1% 激光输出功率由同心光可调滤波器 (AOTF) 调节。 - 如果 SIM 显微镜仅按顺序获取通道(单摄像机设置),则关闭远红色的污渍检测通道。
- 通过取消在软件中的Z 堆栈框进行勾选,从而关闭 Z 堆栈采集,从而设置单个焦点平面的采集。
- 设置尽可能短的 EM-CCD 摄像机曝光时间。
- 设置网格的三个旋转,而不是五个旋转。
- 要提高帧速率,在软件的"采集"选项卡中,将摄像机设置为仅从摄像机传感器的中心区域读取数据,而不是"全芯片"。
注:例如,从读取 1,000 x 1,000 像素完整传感器的区域切换到仅读取 256 x 256 像素,可将摄像机曝光时间从 50 毫秒缩短到 13.4 毫秒,总帧时间从 1.8 s 减少到 1.2 s。如果只读取摄像机传感器的中心部分,则通常用于 SR-SIM 的 63 倍或 100 倍目标的视场将非常小。更短的曝光时间将降低图像的信号噪声比。 - 优化激光功率和摄像机曝光时间:以多个激光功率值(例如,0.5%、1.5%、1.5%、2%)获取标记电池的 SR-SIM 二维 (2D) 图像和几次曝光时间(例如,13.4 ms,25 ms,50 ms)。
- 处理原始 SIM 数据集(请参阅步骤 3.1)。
- 选择激光功率和相机曝光时间,以产生线粒体(即核素)中具有亮点的 SIM 图像,而 SIM 处理产生的伪影很少或根本没有。检查线粒体以外的区域(例如,488 nm 固态激光器的 1% 功率和 EM-CCD 摄像机的 25 毫秒曝光)。
- 使用步骤 2.15_2.17 中优化的设置开始获取延时序列。
3. 数据处理和分析
- 使用适当软件的结构化照明模块(材料表)处理原始 SIM 数据集:选择 SIM 处理参数的自动复选框。对于多个文件的自动处理,请使用批处理工具,取消选择"批量使用当前",单击"运行批处理"并选择多个文件进行 SIM 处理。
- 使用 Imaris 文件转换器软件(即与 Imaris 软件版本对应的版本)将 SIM 处理的时间序列数据集转换为ims格式。
- 在具有"线系(或轨道)模块许可证的软件(版本 8.4.1 或更高版本)中打开转换后的文件。
- 单击"添加新点"图标,启动"点"创建向导。将启动用于创建的向导。
- 选择向导的"创建"选项卡。
- 在向导的第一步中,单击"跟踪点"(随时间而长),然后继续向导的第二步。
- 将估计 XY 直径设置为 0.1-0.15 μm,单击背景减法并继续第三步。
- 通过拖动直方图中的垂直线来调整滤波器"质量"中的阈值,以便检测到大多数核素为"点",而未检测到伪影(即检测到的斑点被标记为叠加在图像上的球)。检查每个帧上是否如此,并在必要时重新调整阈值。继续执行向导的第四步,然后转到向导的第五步。
- 选择自回归运动算法。将最大距离设置为 0.5 μm。将最大间隙大小设置为 0。
- 查看时间序列中的每个帧,并检查是否绘制了任何假轨道,以及轨道之间是否引入了任何间隙(向导构建的当前设置的轨道会立即标记为覆盖在图像上的线条)。如有必要,调整"最大距离"。继续向导的第六步。选择"跟踪持续时间"筛选器并设置 3~5 s 的阈值。
- 如果当前检测到的点或轨道不是最佳的,请使用所需的导航按钮(向导窗口底部)返回向导的上述步骤,以微调任何参数以创建点或轨道。
- 当微调的参数允许软件检测所有斑点并正确构建轨道时,单击向导中的绿色箭头导航按钮以确认轨道的创建。
- 通过单击"统计信息"图标窗口提取轨道的统计信息。选择所需的统计信息参数("统计下的详细值"和"平均值"选项卡),并通过单击Floppy Drive图标进行量化和可视化,将值导出为 csv 文件。
注:最大轨道速度、平均轨道速度、轨道长度和轨道位移是重要参数的示例。 - 如果需要显示或发布图像数据集,则使用快照或动画工具创建表示延时序列的快照和/或视频文件,并选择性地覆盖轨道。
4. 共聚焦图像采集
- 在显微镜舞台上安装舞台顶培养箱,设定所需的温度和CO2浓度(即哺乳动物细胞为37°C和5%),在开始图像采集之前至少保持1小时的温暖。
- 打开共聚焦激光扫描显微镜的所有组件(包括激光),并让他们预热至少 1 小时。
- 根据奈奎斯特标准选择所需的中到高放大倍率目标和空间采样。
- 对于 SG 通道,将激发设置为 488 nm,检测范围为 500-550 nm。对于线粒体染色通道,红色染料的发射设置为 561 nm 和 570-630 nm,或 633 nm 激励和 >650 nm 发射,用于远红色染料。
- 设置尽可能低的激光功率(通常为 1% 或更少),允许获取 PMT 探测器增益为 700 mV 的信号。
- 获取细胞的双色共聚焦图像,在"SG通道"中检测到线粒体核素,在"红色"或"远红"通道中检测到线粒体。
结果
使用 SG 对活细胞标签的定性
首先,SG在各种稀释剂中与染料孵育时在细胞中分布,其特征是共聚焦显微镜。在高浓度SG或皮果格林孵育后,两种染料大多标有核,并在细胞质中出现松痛染色(图1),类似于另一种带正电荷的氰化物(即皮微)15的已公布数据。然而,在1:10,000稀释时,在SG孵育时,核中出现了微弱的染色,而在细胞质中,我们观察到一个亮点模式(图1)。另一方面,与皮果绿染料稀释1:10,000的孵育产生了大部分核染色。SG信号比同浓度的皮果格林信号亮得多。数据显示,与其他类似的DNA结合染料相比,SG更适合成像线粒体DNA。
为了确认光点在线粒体中局部化,我们同时用SG和远红色的线粒体染色染色活细胞。后者是一种带正电荷的细胞渗透有机染料,在活细胞的线粒体中积累。在1:10,000和1:50,000稀释与SG孵育时,几乎所有的SG染色都发生在线粒体中,而在1:500和1:1,000稀释标记时,核和细胞质发生了显著染色(图2)。
此外,我们通过延时显微镜对活细胞染色的时间过程(图3)。线粒体中的SG荧光强度与时间(图3B)的地块表明,45分钟后,核素染色接近饱和。因此,我们建议孵育时间为±30~60分钟。
我们测试了SG细胞内分布在细胞固定和/或渗透时的变化。活染色细胞的固定(2%对甲醛[PFA])导致染料稍微重新分布到细胞核(图4A,B)。固定细胞的渗透(0.1% Triton X100)消除了线粒体中的SG虚线模式,并且核染色占主导地位(图4CC)。如果SG在固定和渗透后被添加到细胞中,则SG均匀地分布在细胞质和核上(图4D)。因此,SG标记的细胞可以固定,如有必要,但染料不适合需要渗透的协议。
活细胞SR-SIM和线粒体核物跟踪
与SG共同染色的活细胞和远红色的线粒体染色(材料表)是由超分辨率SIM技术拍摄的3D图像。如同在共聚焦图像(图2)中一样,线粒体核物在线粒体内作为亮点出现(图5A)。此外,我们获得了 2D SIM 图像的时间序列,并跟踪了超过衍射极限的分辨率的四核素的位置。在开始时间序列之前,我们在 SG 和线粒体染色通道中收购了 SIM 3D 堆栈。然后,我们仅在 SG 通道中获取了时间序列,并跟踪线粒体核物,以量化其运动。轨道平均速度为0.042 μm/s,轨道最大即时速度为0.078±0.012μm/s。大多数核素没有取代远离其原始位置,而是显示短距离随机运动,可能局限于线粒体网络,如线粒体图像上的轨道叠加所示(图5B)。在典型的时间序列(电影 1)中很少发生快速方向位移。
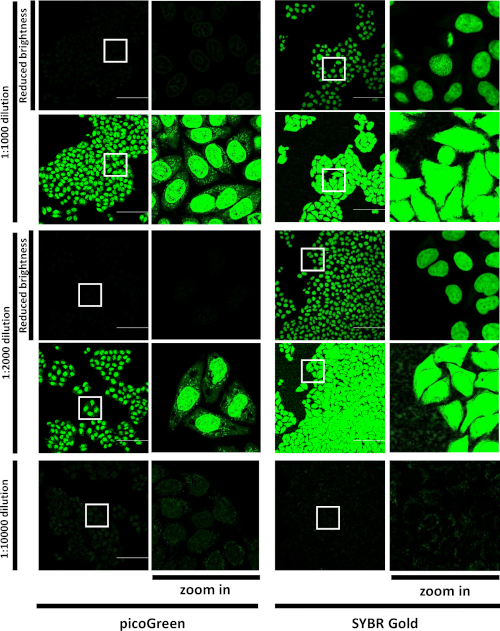
图1:比较皮绿和SG活细胞标签。A549细胞在指示的稀释处用皮绿或SG孵育并成像。绿通道中标记的单元格的代表性视图字段。LSM880 气化学快速,20 倍/空气目标,刻度条 = 50 μm。 单个光学部分。白色方块标记整个 423 x 423 μm 视场右侧以较高放大倍数显示的区域。对于 1:1,000 和 1:2,000 稀释,相同的图像显示在两个亮度设置:为 1:10,000 稀释优化的"默认"亮度设置,以及调整"亮度降低"设置以避免探测器饱和。这个数字是从Jevtic等人27号修改的。请点击此处查看此图形的较大版本。
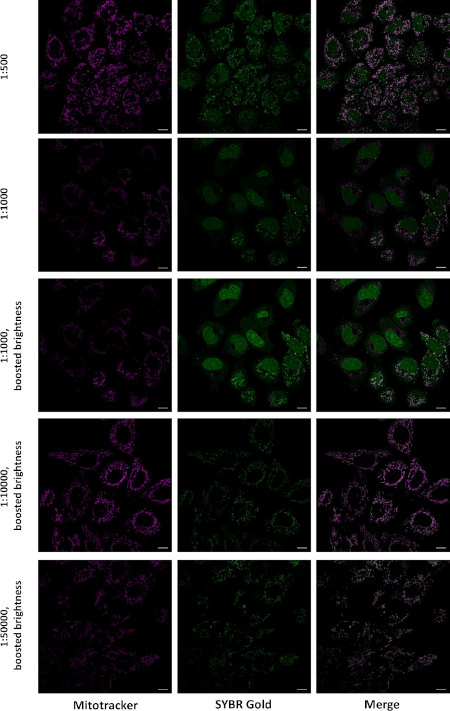
图2:在不同浓度下标记时,活细胞中的SG本地化。HeLa细胞孵育30分钟,混合物为0.25μMMitotrackerCMXRos Red和指示的SG稀释。该解决方案被DMEM取代,图像是在LSM880 Airyscan显微镜上采集的,63x 1.4油目标,并连续采集了彩色通道。显示单个光学切片缩放条 = 10 μm)。这个数字是从Jevtic等人27号修改的。请点击此处查看此图形的较大版本。

图 3:使用 SYBR 金 (SG) 标记过程中的 HeLa 细胞。首先,活的HeLa细胞标有线粒体CMXRos Red并洗涤。SG(DMEM 中最终稀释 1:10,000)被添加到细胞中,并获得了延时序列。LSM880显微镜,63x 1.4 油目标,顺序采集。每个时间点都获取 Z 堆栈。将显示最大强度投影。(A) 在几个感兴趣的区域,SG 荧光的均值强度随时间而久之。(B) 显示测量 SG 荧光的感兴趣区域(彩色矩形)的代表性视场。(C) 与 SG 一起孵育期间多个时间点的视场。用白线标记的正方形区域显示在右列的较高放大倍率下。这个数字是从Jevtic等人27号修改的。请点击此处查看此图形的较大版本。

图 4:固定和渗透对单元格中 SG 本地化的影响。HeLa细胞被SG(库存稀释1:10,000)和MitotrackerCMXRos Red(0.25 μM)染色30分钟。顺序采集;刻度杆 = 10 μm. (A) 带 SG 染色的活希拉细胞。(B) 活的 HeLa 细胞沾染 SG,然后在 PBS 中固定 2% PFA 30 分钟 (C) 活 HeLa 细胞染色 SG, 然后在 PBS 中用 2% PFA 固定 30 分钟,渗透 0.1% Triton X100 15 分钟。在下面板上,将显示相同的图像,但绿色通道中的亮度设置得更高。(D) HeLa 细胞固定与 2% PFA, 渗透与 0.1% Triton X100 15 分钟, 然后染色 SG 和 Mitotracker CMXRos 红色.为了获取(D)中显示的图像,与A-C相比,绿色通道摄像机的 EMCCD 增益减少了 12 倍,以避免过度曝光。这个数字是从Jevtic等人27号修改的。请点击此处查看此图形的较大版本。

图 5:实时 SIM 图像上的核素跟踪。SG 染色细胞视野的代表性图像。底部:获取延时序列之前拍摄的双色 SIM 图像。绿色 = SG 通道;洋红色 = 线粒体通道。顶部:来自 SG 通道中 50 帧 SIM 时间序列的四核轨道(影片 1);帧时间 = 1.8 s;Imaris 8.4.1 软件跟踪。轨道按最大轨道速度(μm/s)进行颜色编码;Elyra PS.1,SIM模式,100x/1.46 油目标;刻度柱 = 10 μm。这个数字是从Jevtic等人27号修改的。请点击此处查看此图形的较大版本。

电影 1:SIM 时差系列,显示具有代表性的 SG 染色细胞。刻度杆 = 5 μm. 检测到的线粒体核物被标记为白色球体。轨道被可视化为"龙尾"(8 帧长度)和颜色编码根据其最大即时速度(右下角的色条显示速度以 μm/s 为单位)。线粒体核物跟踪和可视化由Imaris 8.4.1软件。这段视频已经发表在《Jevtic等人》27日。请点击此处查看此视频(右键单击以下载)。
讨论
该协议有几个关键成分:为了优先标记线粒体DNA,孵育过程中的DNA结合染料浓度应保持在非常低(例如,一个典型的商业库存的1:10,000稀释),孵育时间应为30分钟。孵育时间不应超过1小时,应使用SYBR金染料;其他DNA结合染料不够亮,在低浓度标记时产生强烈的信号。
我们协议的局限性是,在渗透步骤中,染料从线粒体核物中被冲走。因此,所述程序不适用于传统的免疫荧光方案。在这种情况下,固定细胞中的核素可以通过其他技术(如针对DNA或线粒体转录因子(TFAM)的抗体)有效地标记。
与荧光蛋白标签(ea)标签(Nor-lt;1 h)起,线粒体核物直接标记具有荧光蛋白标签的优点:任何类型的细胞都可以在 <1 h 内标记,而不会对荧光蛋白标记构造的瞬态或稳定表达进行暂时性或其他限制。此外,在目前的协议中,传统的荧光蛋白标记TFAM被报告引起伪影。此外,只有当线粒体膜电位完好无损时,SG才能有效地染色核素。这可以防止图像采集与生物无关的"病"和死细胞,这是无法避免的基于FP的染色。最后,以前公布的基于DNA结合染料的协议没有实现线粒体DNA的优待染色。
建议的协议是快速和简单的,因此,我们假设它将被广泛用于线粒体核物的实时成像通过各种荧光技术,既衍射有限(例如,激光扫描共聚焦,TIRF等),以及超分辨率SIM。
披露声明
作者没有什么可透露的。
致谢
作者承认阿西法·阿赫塔尔和安吉莉卡·拉姆博尔德(马克斯·普朗克免疫生物学和表观遗传学研究所)提供HeLa细胞。
材料
| Name | Company | Catalog Number | Comments |
| Elyra PS1 | Carl Zeiss | multi-modal super-resolution microscope containing module for super-resolution structured illumination microscopy (SR-SIM) | |
| High glucose DMEM | GIBCO/ThermoFisher | 31966021 | |
| ibidi 35 mm dish, glass bottom | Ibidi Gmbh | 81158 | |
| ibidi 8-well microSlide, glass bottom | Ibidi Gmbh | 80827 | |
| Imaris 8.4.1 | Bitplane/Oxford Instruments | image porcessing and visualisation software package | |
| iXon 885 | Andor Technologies | EMCCD camera with back-illuminated sensor | |
| LSM880 Airyscan | Carl Zeiss | laser scanning confocal microscope with array detector | |
| Mitotracker CMXRos Red | ThermoFischer | M7512 | red live cell mitochondrial stain |
| Mitotracker Deep Red FM | ThermoFischer | M22426 | far red live cell mitochondrial stain |
| picoGreen | ThermoFischer | P7581 | cell permeant DNA stain |
| Plan Apochromat 100x/1.46 Oil objective | Carl Zeiss | ||
| SYBR Gold | ThermoFischer | S11494 | cell permeant DNA stain |
| Zen Black 2012 software | Carl Zeiss | image acquisition and processing software |
参考文献
- Kaufman, B. A., et al. The mitochondrial transcription factor TFAM coordinates the assembly of multiple DNA molecules into nucleoid-like structures. Molecular Biology of the Cell. 18 (9), 3225-3236 (2007).
- Farge, G., et al. Protein sliding and DNA denaturation are essential for DNA organization by human mitochondrial transcription factor A. Nature Communications. 3, 1013(2012).
- Bogenhagen, D. F. Mitochondrial DNA nucleoid structure. Biochimica et Biophysica Acta. 1819 (9-10), 914-920 (2012).
- Kang, D., Kim, S. H., Hamasaki, N. Mitochondrial transcription factor A (TFAM): roles in maintenance of mtDNA and cellular functions. Mitochondrion. 7 (1-2), 39-44 (2007).
- Tauber, J., et al. Distribution of mitochondrial nucleoids upon mitochondrial network fragmentation and network reintegration in HEPG2 cells. International Journal of Biochemistry & Cell Biology. 45 (3), 593-603 (2013).
- Garrido, N., et al. Composition and dynamics of human mitochondrial nucleoids. Molecular Biology of the Cell. 14 (4), 1583-1596 (2003).
- Pernas, L., Scorrano, L. Mito-Morphosis: Mitochondrial Fusion, Fission, and Cristae Remodeling as Key Mediators of Cellular Function. Annual Review of Physiology. 78, 505-531 (2016).
- Caielli, S., et al. Oxidized mitochondrial nucleoids released by neutrophils drive type I interferon production in human lupus. Journal of Experimental Medicine. 213 (5), 697-713 (2016).
- Okayama, S., Ohta, K., Higashi, R., Nakamura, K. Correlative light and electron microscopic observation of mitochondrial DNA in mammalian cells by using focused-ion beam scanning electron microscopy. Microscopy (Oxf). 63 (Suppl 1), i35(2014).
- Alan, L., Spacek, T., Jezek, P. Delaunay algorithm and principal component analysis for 3D visualization of mitochondrial DNA nucleoids by Biplane FPALM/dSTORM. European Biophysics Journal. 45 (5), 443-461 (2016).
- Kukat, C., et al. Super-resolution microscopy reveals that mammalian mitochondrial nucleoids have a uniform size and frequently contain a single copy of mtDNA. Proceedings of the National Academy of Sciences of the United States of America. 108 (33), 13534-13539 (2011).
- Kukat, C., Larsson, N. G. mtDNA makes a U-turn for the mitochondrial nucleoid. Trends in Cell Biology. 23 (9), 457-463 (2013).
- Betzig, E., et al. Imaging intracellular fluorescent proteins at nanometer resolution. Science. 313 (5793), 1642-1645 (2006).
- Rust, M. J., Bates, M., Zhuang, X. Sub-diffraction-limit imaging by stochastic optical reconstruction microscopy (STORM). Nature Methods. 3 (10), 793-795 (2006).
- Benke, A., Manley, S. Live-cell dSTORM of cellular DNA based on direct DNA labeling. ChemBioChem. 13 (2), 298-301 (2012).
- Ishigaki, M., et al. STED super-resolution imaging of mitochondria labeled with TMRM in living cells. Mitochondrion. 28, 79-87 (2016).
- Waldchen, S., Lehmann, J., Klein, T., van de Linde, S., Sauer, M. Light-induced cell damage in live-cell super-resolution microscopy. Scientific Reports. 5, 15348(2015).
- Gustafsson, M. G., et al. Three-dimensional resolution doubling in wide-field fluorescence microscopy by structured illumination. Biophysical Journal. 94 (12), 4957-4970 (2008).
- Hirano, Y., Matsuda, A., Hiraoka, Y. Recent advancements in structured-illumination microscopy toward live-cell imaging. Microscopy (Oxf). 64 (4), 237-249 (2015).
- Brown, T. A., et al. Superresolution fluorescence imaging of mitochondrial nucleoids reveals their spatial range, limits, and membrane interaction. Molecular and Cellular Biology. 31 (24), 4994-5010 (2011).
- Lewis, S. C., Uchiyama, L. F., Nunnari, J. ER-mitochondria contacts couple mtDNA synthesis with mitochondrial division in human cells. Science. 353 (6296), aaf5549(2016).
- Dellinger, M., Geze, M. Detection of mitochondrial DNA in living animal cells with fluorescence microscopy. Journal of Microscopy. 204 (Pt 3), 196-202 (2001).
- Ban-Ishihara, R., Ishihara, T., Sasaki, N., Mihara, K., Ishihara, N. Dynamics of nucleoid structure regulated by mitochondrial fission contributes to cristae reformation and release of cytochrome c. Proceedings of the National Academy of Sciences of the United States of America. 110 (29), 11863-11868 (2013).
- Zurek-Biesiada, D., et al. Localization microscopy of DNA in situ using Vybrant((R)) DyeCycle Violet fluorescent probe: A new approach to study nuclear nanostructure at single molecule resolution. Experimental Cell Research. 343 (2), 97-106 (2016).
- He, J. Y., et al. The AAA(+) protein ATAD3 has displacement loop binding properties and is involved in mitochondrial nucleoid organization. Journal of Cell Biology. 176 (2), 141-146 (2007).
- Ashley, N., Harris, D., Poulton, J. Detection of mitochondrial DNA depletion in living human cells using PicoGreen staining. Experimental Cell Research. 303 (2), 432-446 (2005).
- Jevtic, V., Kindle, P., Avilov, S. V. SYBR Gold dye enables preferential labeling of mitochondrial nucleoids and their time-lapse imaging by structured illumination microscopy. PLoS One. 13 (9), e0203956(2018).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。