Method Article
Идентификация фосфата инозитола или фосфонинозидных взаимодействующих белков по хроматографии Affinity в сочетании с Западной погреловой или масс-спектрометрией
В этой статье
Резюме
Этот протокол фокусируется на выявлении белков, которые связываются с фосфатами инозитол или фосфоинозитами. Он использует сродство хроматографии с биоинтинилатами инозитол фосфатов или фосфоинозитидов, которые обездвижены через стрептавидин агароз или магнитные бусы. Инозитол фосфат или фосфоинозид связывающие белки идентифицируются западной blotting или масс-спектрометрии.
Аннотация
Фосфаты инозитол и фосфоинозиты регулируют несколько клеточных процессов в эукариотах, включая экспрессию генов, торговлю везикулами, трансдукцию сигналов, обмен веществ и развитие. Эти метаболиты выполняют эту регулятивную деятельность путем связывания с белками, тем самым изменяя конформацию белка, каталитическую активность и/или взаимодействия. Метод, описанный здесь, использует сродство хроматографии в сочетании с масс-спектрометрии или западной blotting для выявления белков, которые взаимодействуют с фосфатами инозитол или фосфоинозитидов. Инозитол фосфатов или фосфоинозитидов химически помечены биотин, который затем захватили с помощью стрептавидина сопряжены с агарозили и магнитных бусин. Белки изолированы их сродством связывания с метаболитом, затем eluted и определены масс-спектрометрии или западной blotting. Метод имеет простой рабочий процесс, который является чувствительным, нерадиоактивным, липосомы свободной, и настраиваемый, поддерживая анализ белка и метаболита взаимодействия с точностью. Этот подход может быть использован в без этике или в методах количественной спектрометрии, маркированных аминокислотами, для выявления белково-метаболитных взаимодействий в сложных биологических образцах или с использованием очищенных белков. Этот протокол оптимизирован для анализа белков из trypanosoma brucei,но он может быть адаптирован к родственным простейшие паразиты, дрожжи или млекопитающих клеток.
Введение
Инозитол фосфатов (IPs) и фосфоинозитидов (PIs) играют центральную роль в биологии эукариот через регулирование клеточных процессов, таких как контроль экспрессии генов1,2,3, везикул торговли 4,трансдукция сигнала 5,6,метаболизм7,8,9,и развитие8,10. Регулирующая функция этих метаболитов является результатом их способности взаимодействовать с белками и, таким образом, регулировать функцию белка. При связывании белками, ИС и ИП могут изменять конформацию белка11,каталитической активности12,или взаимодействия13 и, следовательно, влияют на клеточную функцию. ИП и ИП распределены в нескольких субклеточныхотсеках, таких как ядро 2,3,14,15,эндоплазмический ретикулум16,17,плазма мембрана1 и цитозол18, либо связанные с белками3,19 или с РНК20.
Расщепление мембраны, связанных PI (4,5)P2 фосфолипасы C приводит к освобождению Ins (1,4,5)P3, которые могут быть фосфорилированы или дефосфорилированы IP киназы и фосфатазы, соответственно. ИП являются растворимыми молекулами, которые могут связываться с белками и осуществлять регулятивные функции. Например, Ins (1,4,5)P3 в метазоане может выступать в качестве второго посланника, связывая с рецепторами IP3, что вызывает конформанформальные изменения рецепторов и, таким образом, высвобождение Ca2 "из внутриклеточных магазинов11. Ins (1,3,4,5)P4 связывается с комплексом деацетилазы гистона и регулирует сборку белкового комплекса и деятельность13. Другие примеры IPs регулирующая функция включают контроль хроматина организации21, РНК транспорт22,23, РНК редактирования24, и транскрипции1,2,3 . В отличие от этого, ИП часто связаны с набором белков в плазменную мембрану или органеллы мембраны25. Тем не менее, возникающим свойством ИП является способность ассоциироваться с белками в не-мембранной среде3,15,19,26. Это случай ядерного рецептора стероидогенный фактор, который транскрипционной функции управления регулируется PI (3,4,5)P319, и поли-Полимеразы, которая ферментативная деятельность регулируется ядерной PI (4,5)P226. Регулирующая роль для ИС и ИП была показана во многих организмах, включая дрожжи22,27, клетки млекопитающих19,23, Drosophila10 и червей28. Значение имеет роль этих метаболитов в трипаносомы, которые рано расходились от эукариотической линии. Эти метаболиты играют важную роль в Trypanosoma brucei транскрипционного контроля1,3, развитие8, органеллы биогенеза и протеинового движения29,30 , 31 год , 32, а также участвуют в контроле развития и инфекции в патогенных микроорганизмов T. cruzi33,34,35,Токсоплазма36 и Плазмодиум 5 , 37. Таким образом, понимание роли ИС и ИП в трипаносомы может помочь выяснить новую биологическую функцию для этих молекул и определить новые цели наркотиков.
Специфика связывания белка и IP или PI зависит от взаимодействующих доменов белка и состояния фосфорилирования инозитол13,38, хотя взаимодействие с липидной частью ИП также происходит19. Разнообразие ИП и ИП и их изменение киназы и фосфатазы обеспечивает гибкий клеточный механизм для контроля функции белка, который зависит от наличия метаболита и изобилия, состояние фосфорилирования инозитол, и белок сродство взаимодействия1,3,13,38. Хотя некоторые белковые домены хорошо характеризуются39,40,41, например, плекстрин гомологический домен42 и SPX (SYG1/Pho81/XPR1) домены43 ,44,45, некоторые белки взаимодействуют с ИП или ИП механизмами, которые остаются неизвестными. Например, протеин репрессор-активатор 1 (RAP1) T. brucei не имеет канонических PI-связывающих доменов, но взаимодействует с PI (3,4,5)P3 и контролирует транскрипцию генов, участвующих в антигенной вариации3. Хроматография сродства и масс-спектрометрия анализ IP или PI взаимодействующих белков из трипаносомы, дрожжей или млекопитающих клеток определили несколько белков без известных IP- или PI-связывающих доменов8,46, 47. Данные свидетельствуют о дополнительных нехарактерных белковых доменах, которые связываются с этими метаболитами. Таким образом, выявление белков, которые взаимодействуют с ИС или ИП может выявить новые механизмы взаимодействия белково-метаболита и новые клеточные регуляторные функции для этих малых молекул.
Метод, описанный здесь, использует хроматографию сродства в сочетании с западной блоттингом или масс-спектрометрией для выявления белков, которые связываются с ИП или ИП. Он использует биоинтинилатированных ИП или ИП, которые либо кросс-связанные стрептавидин спряжение с агарозными бусинами или же, захваченных через стрептавидин-конъюгированные магнитные бусы (Рисунок 1). Метод обеспечивает простой рабочий процесс, который является чувствительным, нерадиоактивным, липосомы бесплатно и подходит для обнаружения связывания белков из клеточных лисатов или очищенных белков3 (Рисунок 2). Метод может быть использован вбез этикетке 8,46 или в сочетании с аминокислотой маркировки количественной масс-спектрометрии47 для выявления ИС или PI-связывающих белков из сложных биологических образцов. Таким образом, этот метод является альтернативой несколько методов, доступных для изучения взаимодействия ИС или ИП с клеточными белками и поможет в понимании регулирующую функцию этих метаболитов в трипаносомы и, возможно, другие эукариоты.
протокол
1. Анализ IP- или PI-связывающих белков по хроматографии сродства и западной промойки
- Рост клеток, лиза и хроматография сродства
- Выращивайте клетки T. brucei до середины бревенчатого этапа и контролируйте жизнеспособность и плотность клеток. В общей сложности 5,0 х 107 ячеек достаточно для одного связывающего асссе.
- Для форм кровотока, расти клетки в HMI-9 средств дополнены 10% плода крупного рогатого скота сыворотки (FBS) на 37 КС и 5% CO2. Держите плотность клеток между 8,0 х 105 до 1,6 х 106 ячеек/мл.
ПРИМЕЧАНИЕ: Плотность выше, чем 1,8 х 106 6 ячеек/мл может повлиять на жизнеспособность клеток. Удвоение времени T. brucei 427 штамма, выращенного в пробирке составляет от 5,5 до 6,5 ч. - Для проциклических форм, расти клетки в SDM-79 среды дополняется 10% FBS при 27 градусов по Цельсию и сохранить плотность клеток между 1,0 х 107 и 3,0 х 107 клеток / мл.
- Для очищенных белков (например, рекомбинантных белков) принимайте от 0,5 до 1 мкг белка и разбавляйте в 450 мл связывающего буфера (25 мм HEPES, 150 мМ NaCl, 0,2% 4-ниловый фенил-полиэтиленгликоль, рН 7,4). Храните 5% разбавленного белка (ввода) для анализа западной подрезя. Приступай к шагу 1.1.7.
- Для форм кровотока, расти клетки в HMI-9 средств дополнены 10% плода крупного рогатого скота сыворотки (FBS) на 37 КС и 5% CO2. Держите плотность клеток между 8,0 х 105 до 1,6 х 106 ячеек/мл.
- Клетки центрифуги при температуре 1600 х г в течение 10 мин при комнатной температуре (RT). Отбросьте супернатант.
ПРИМЕЧАНИЕ: См. шаг 2.1.2 для дополнительной информации о центрифугации больших объемов культуры. - Аккуратно resuspend гранулы в 10 мл фосфата буферного сольного рН 7,4 дополнены 6 мМ глюкозы (PBS-G) и предварительно нагревается при 37 градусов по Цельсию для мытья клеток. Затем центрифуги ячеек на 1600 х г в течение 5 мин на RT. Повторите процедуру дважды.
- Приостановить гранулы в 1 мл PBS-G. Затем перенесите громкость на трубку 1,5 мл и центрифугу на 1600 х г в течение 5 мин. Отбросьте супернатант.
ПРИМЕЧАНИЕ: Клеточные гранулы могут быть заморожены в жидком азоте и храниться при -80 градусах Цельсия или жидком азоте. - Приостановить гранулы в 0,5 мл лисис буфера (25 мм HEPES, 150 мм NaCl, 1% t-octylphenoxypolyethoxyethanol, рН 7,4) дополнен1,5x протеазы ингибитор коктейль и 1x фосфатазный ингибитор коктейль (Таблица материалов) предварительно охлажденный во льду до лиза клеток. Инкубировать лизат в течение 10 мин вращения при 50 об/мин при 4 градусах Цельсия.
ПРИМЕЧАНИЕ: Это важный шаг, потому что белки могут деградировать, если не обрабатываются, как указано. При необходимости проверьте целостность белка лизата натрием додецил сульфат-полиакриламид гель электрофоресис (SDS/PAGE).
ВНИМАНИЕ: Т-октильфеноксиполиэтитоксиетхетханол является токсичным и может вызвать раздражение кожи и глаз. Используйте перчатки, глазное стекло и защиту лицевого стекла. - Центрифуга лизат на 14000 х г в течение 10 мин при 4 градусах Цельсия. Соберите супернатант в новую трубку 1,5 мл для связывания анализов. Храните 5% от общего объема lysate (ввода) для западного анализа промотирования. Супернатант содержит белки-паразиты, извлеченные из буфера из лисиса.
- Соберите 50 ЗЛ ИП или ИП, спряжение с бусинами агарозы (т.е. 50 л шлама) или 50 зл на бусины агарозы, и центрифуге в течение 1 мин при 1000 х г. Откажитесь от супернатанта и отрепримите в 50 зл связывающего буфера, чтобы уравновесить бусы. Используйте неконъюгированные бусы в качестве элемента управления. Используйте IP/PI-бусы с различной конфигурацией фосфатов, включая нефосфорилированные формы, для контроля для неспецифических взаимодействий.
- Добавьте 50 юрлиц или PI-бусин к клеточному лисату или очищенным белкам (каждый 1 мл бисера содержит 10 нмоль конъюгированных IP-адресов или ИП). Держите объем IP- или PI-бусин в пределах 10% от общего lysate и при необходимости отрегулируйте объем связывающей реакции с связывающим буфером.
- Для анализов конкуренции добавьте к связывающей реакции различные концентрации несъемных IP-адресов или ИП (например, 1-, 10-, 100-кратное избыток молярных по сравнению с IP- или PI-бисером).
- Инкубировать реакцию в течение 1 ч, или на ночь, при 4 градусах Цельсия и вращаясь при 50 об/мин.
ПРИМЕЧАНИЕ: Связывание реакций с очищенными белками может быть сделано на RT в зависимости от стабильности белка. При использовании ИП или ИП, спряжение с биотином, переходит только к шагу 1.1.9.1, в противном случае приступайте к шагу 1.1.10.- Добавьте 50 зЛ стрептавидина-конъюгированного к магнитным бусинкам к связывающей реакции и инкубировать в течение 1 ч при 4 градусах Цельсия, вращающихся при 50 об/мин.
- Центрифуге смесь в течение 1 мин при 1000 х г при 4 градусах Цельсия. Удалите супернатант (проточный) и держите гранулы. Храните 5% от супернатанта для анализа западной подьеки.
ПРИМЕЧАНИЕ: При использовании магнитных бусин, удалить супернатанты и выполнять последующие стирки с помощью магнитной подставки (центрифугации не являются необходимыми). - Добавьте 1 мл стирального буфера (25 мМ HEPES, 300 мМ NaCl, 0,2% 4-нил фенил-полиэтиленгликоль, рН 7,4) и resuspend моли, нажав или закрученного трубки (не используйте пипетку, потому что бисер может прикрепить, чтобы прикрепить к пипетке советы). Centrifuge реакции в течение 1 мин при 1000 х г при 4 кв и отбросить супернатант. Повторите процедуру в общей сложности пять стир.
ВНИМАНИЕ: 4-ненил фенил-полиэтиленгликоль является токсичным и может вызвать раздражение кожи и глаз. Используйте перчатки, глазное стекло и защиту лицевого стекла. - Добавьте 50 юрлиц 2x буфер laemmli, дополненный 710 мМ 2-меркаптоэтанол в бисер и перемешайте, нажав или вихрь, чтобы утилизировать белки. Нагрейте при температуре 95 градусов по Цельсию в течение 5 мин, затем центрифугу в течение 10 000 х г в течение 1 мин и соберите супернатант (содержат элеватенные белки). Кроме того, elute белки с 8 M мочевины/100 мм глицин рН 2,9, чтобы избежать использования SDS. Заморозить eluate при -80 градусах По Цельсию, в противном случае перейти к западному анализу подьение.
ВНИМАНИЕ: 2-меркаптоэтанол является токсичным и может вызвать раздражение кожи, глаз и дыхательных путей. Используйте перчатки и работать в химическом капюшоне.
- Выращивайте клетки T. brucei до середины бревенчатого этапа и контролируйте жизнеспособность и плотность клеток. В общей сложности 5,0 х 107 ячеек достаточно для одного связывающего асссе.
- Западный анализ промотирования
- Смешайте 15 qL входных (от шага 1.1.6) или протекать-через (от шага 1.1.10) образцы с 5 qL 4x буфера Laemmli. Тепловой вход и проточные образцы в течение 5 мин при температуре 95 градусов по Цельсию. Для образцов, выделяемых в 8 М мочевины/100 мм глицина pH 2.9, смешайте 15 л eluate с 5 qL 4x буфера Laemmli, и тепло в течение 5 мин при температуре 95 градусов по Цельсию.
ПРИМЕЧАНИЕ: Этот шаг не является необходимым для образцов eluted в 2x Laemmli буфера. - Загружай скважины 4-20% Гель SDS/PAGE с 2,5 л входных данных, 2,5 л протекаемых, и 20 Зл элетированных образцов, и нагрузка белка лестница в соответствии с рекомендацией производителя.
ПРИМЕЧАНИЕ: Выберите гель% в соответствии с молекулярным весом белка интерес. - Выполнить SDS/PAGE на 150 V в течение 30-45 минут в беговом буфере, или до тех пор, пока синий краситель буфера Laemmli находится в конце геля.
ПРИМЕЧАНИЕ: Время выполнения может варьироваться в зависимости от лабораторного оборудования. - Снимите гель со стеклянных (или пластиковых) пластин и замочите в переносном буфере на 15 мин.
- Перенос белков на мембрану поливилидена дифторид (PVDF) или мембрану нитроцеллюлозы. Замочите мембраны и 3 мм фильтровальной бумаги в переносе буфера. Соберите сэндвич с тремя листами фильтровальной бумаги, нитроцеллюлозы или мембраны PVDF, гель, и дополнительные три листа фильтровальной бумаги. Убедитесь, что не пузырьки воздуха оказались в ловушке в бутерброд. Используйте ролик, чтобы удалить пузырьки, если это необходимо. Установите мембрану на катод и гель на анодной стороне кассеты.
ПРИМЕЧАНИЕ: Проверьте инструкции производителя мембраны для получения информации о активации мембраны или подготовки помот. - Поместите кассету, содержащую сэндвич, в переносной бак с буфером передачи. Поместите бак в ведро со льдом или при 4 градусах По Цельсию (например, в холодной комнате). Передача белков при 100 В на 1 ч (ток колеблется между 200-400 мА). Кроме того, передача на ночь при постоянном токе 15 мА при 4 градусах Цельсия.
- Снимите мембрану с кассеты. Инкубировать мембрану в 6% обезжиренного сухого молока, разбавленного в PBS с 0,05% полисорбата 20 (PBS-T), или совместимым блокирующим раствором, в течение 1 ч на RT, чтобы заблокировать мембрану.
ПРИМЕЧАНИЕ: Перед блокированием мембраны, качество передачи может быть проверено с помощью пятна Понсо S. Инкубировать мембрану в течение 1 мин в 15 мл Понсо S, промыть в воде и визуализировать полосы. - Удалить блокирующий раствор и инкубировать мембрану на 1 ч при РТ с 50 об/мин вращения в первичных антителах, разбавленных 6% обезжиренного сухого молока, разбавленного в PBS-T. Кроме того, инкубировать мембрану на ночь при 4 градусах Цельсия при 50 об/мин вращения.
ПРИМЕЧАНИЕ: Время инкубации может варьироваться в зависимости от качества антител; однако, большинство антител будет работать с инкубациями 1-3 ч на RT. Следуйте рекомендации производителя для концентрации антител или разбавления. - Вымойте пятно путем инкубации мембраны в PBS-T в течение 5 мин с 50 об/мин вращения на RT. Повторите процедуру 3-5 раз. Дополнительные стира могут быть необходимы в зависимости от качества антител.
- Инкубировать мембрану в прероцида пероксидазы (HRP)-конъюгированные вторичные антитела для 1 ч при РТ в 6% обезжиренного сухого молока, разбавленного в PBS-T с 50 об/мин вращения.
ПРИМЕЧАНИЕ: Следуйте рекомендации производителя для концентрации антител или разбавления. - Вымойте подува, как указано в шаге 1.2.9.
- Добавьте chemiluminescent субстрат для покрытия мембраны. Удалите избыток субстрата и инкубировать в течение 5 минут на RT в темноте.
ПРИМЕЧАНИЕ: Проверьте инструкции производителя для рекомендаций по химилюминесценции реагентов. - Захват хемилюминесцентного сигнала с помощью изображения на основе камеры. Кроме того, используйте рентгеновскую пленку для захвата хемилюминесцентного сигнала.
- Смешайте 15 qL входных (от шага 1.1.6) или протекать-через (от шага 1.1.10) образцы с 5 qL 4x буфера Laemmli. Тепловой вход и проточные образцы в течение 5 мин при температуре 95 градусов по Цельсию. Для образцов, выделяемых в 8 М мочевины/100 мм глицина pH 2.9, смешайте 15 л eluate с 5 qL 4x буфера Laemmli, и тепло в течение 5 мин при температуре 95 градусов по Цельсию.
2. Анализ IP/PI-связывающих белков по сродству хроматографии и масс-спектрометрии
- Рост клеток, лиза и хроматография сродства
- Выращивайте клетки T. brucei до середины бревенчатого этапа и контролируйте жизнеспособность и плотность клеток.
ПРИМЕЧАНИЕ: В общей сложности 1,0 х 1010 ячеек достаточно для двух связывающих анализов. Использование меньшего количества клеток, чем указано здесь, может повлиять на обнаружение белков с низким содержанием с помощью масс-спектрометрии.- Для T. brucei формы кровотока, растут клетки в середине журнала фазы (8,0 х 105-1,6 х 106 клеток / мл) в HMI-9 сми дополняется 10% FBS на 37 C и с 5% CO2. Для 427 штамма, 5 L культуры даст 0,5-1,0 х 1010 клеток. Мониторинг роста клеток, чтобы избежать плотности выше, чем 1,8 х 106 ячеек/мл, которые могут повлиять на жизнеспособность клеток. Держите объем культуры клеток до 1/10 объема колбы; в противном случае, темпы роста клеток будут затронуты из-за плохой аэрации.
ПРИМЕЧАНИЕ: Штамм 427 имеет удвоение времени 5,5-6,5 ч. - Для проциклических форм, расти клетки в SDM-79 среды дополняется 10% FBS при 27 градусов по Цельсию и сохранить плотность клеток между 1,0 х 107 и 3,0 х 107 клеток / мл. 500 мл культуры даст 0,5-1,5 х 1010 клеток.
- Для T. brucei формы кровотока, растут клетки в середине журнала фазы (8,0 х 105-1,6 х 106 клеток / мл) в HMI-9 сми дополняется 10% FBS на 37 C и с 5% CO2. Для 427 штамма, 5 L культуры даст 0,5-1,0 х 1010 клеток. Мониторинг роста клеток, чтобы избежать плотности выше, чем 1,8 х 106 ячеек/мл, которые могут повлиять на жизнеспособность клеток. Держите объем культуры клеток до 1/10 объема колбы; в противном случае, темпы роста клеток будут затронуты из-за плохой аэрации.
- Центрифуга клетки на 1600 х г в течение 15 минут на RT. Отбросьте супернатант и resuspend гранулы в 200 мл PBS-G предварительно нагревается при 37 градусов по Цельсию. Используйте круглые нижние центрифуги трубки(Таблицаматериалов), потому что Т. brucei кровотока форме гранулы легко нарушается при использовании фиксированного угла центрифуги роторов. Центрифуги клетки снова на 1600 х г в течение 5 мин на RT.
- Удалите супернатант и resuspend гранулы в 10 мл PBS-G. Центрифуги клетки на 1600 х г в течение 5 мин на RT. Повторите процедуру и после окончательной стирки, отбросить супернатант.
ПРИМЕЧАНИЕ: Пеллеты могут быть заморожены в жидком азоте и храниться при -80 градусах Цельсия или жидком азоте. - Приостановите действие клеточной гранулы в 5 мл буфера лисиса, предварительно охлажденного во льду и дополненного 1,5-кратным ингибитором протеазы и 1x ингибитором фосфатазы(ТаблицаМатериалов). Инкубировать лизат в течение 10 минут при 4 КС, вращаясь при 50 об/мин.
- Центрифуге лизат на 10000 х г в течение 10 мин при 4 градусах Цельсия. Соберите супернатант (растворимые белки) и разбавьте его в 20 мл связующего буфера.
- Соберите 400 ЗЛ ИП или ИП, спряжение с бусинами агарозы (т.е. 400 л суспензии) или 400 юл контрольных бусин, и центрифуги в течение 1 мин при 1000 х г на RT. Отбросьте супернатант и откажитесь в 400 qL буфера для привязки к оцепенению. Используйте агарозные бусы в качестве отрицательного контроля для определения конкретного обогащения белково-метаболитных взаимодействий по сравнению с неспецифическими взаимодействиями (например, белки, которые не связываются с бисером). Используйте ИС или ИП с различными конфигурациями фосфатов, включая нефосфорилированные формы, для контроля неспецифических взаимодействий из-за фосфатных зарядов или связывания с биотином.
- Добавьте 400 л IP/PI-бусин или контрольные бусы к 10 мл лизата и инкубируют сяробизируют в течение 1 ч, или на ночь, при 4 градусах По цельсии, вращаясь при 50 об/мин. При использовании ИП или ИП, спряженых только с биотином (без бисера), приступайте к шагу 2.1.7.1, в противном случае приступайте к шагу 2.1.8.
- Добавьте 100 л стрептавидина-спряжение к магнитным бусинкам и инкубировать по 1 ч при 4 градусах Позвонив при 50 об/мин.
- Центрифуги связывающая реакция в течение 1 мин при 1000 х г при 4 градусах Цельсия. Удалите супернатант (проточный) и держите гранулы. Храните 5% от супернатанта для анализа западной подьеки.
- Добавьте 5 мл стирального буфера к грануле, аккуратно перемешайте, закрученную трубку, а затем центрифугу в течение 1 мин при 1000 х г при 4 градусах Цельсия. Отбросьте супернатант. Повторите мыть пять раз. При использовании магнитных бусин, собирать супернационты и выполнять стирки с помощью магнитной подставки (центрифугации не являются необходимыми).
- Добавить 50 qL 2x Laemmli буфера (или 8 М мочевины / 100 мм глицина рН 2,9, чтобы избежать использования SDS) в бисер и перемешать, нажав или вихрь (избегайте трубача, потому что бисер может прикрепляться к пипетки советы), а затем тепло при температуре 95 градусов по Цельсию в течение 5 мин. и собирать супернатант (элютированные белки). Повторите процедуру дважды, чтобы собрать в общей сложности три фракции.
- Заморозить eluate при -80 градусов по Цельсию, в противном случае отдельные белки в SDS / PAGE или держать в растворе для трипсинациизации и анализа масс-спектрометрии.
- Выращивайте клетки T. brucei до середины бревенчатого этапа и контролируйте жизнеспособность и плотность клеток.
- Трипсин переваривание белков для массовой спектрометрии
ПРИМЕЧАНИЕ: Два варианта этой процедуры показаны для раздела 2.2.1 (в геле) или раздела 2.2.2 (в растворе) переваривания белков. Белок низкой связывания трубки рекомендуется для предотвращения потери образца. Проконсультируйтесь с аналитическим химиком на объекте протеомики пригодность протокола для образцов и средств массового спектрометра.- В гель трипсиизации белков
- После разделения белка в SDS/PAGE, кратко промыть гель в воде высокой чистоты. Перенесите гель на чистую стеклянную тарелку. Акцизные белковые полосы с чистым лезвием и избегайте резки дополнительного геля вне полос. Разрежьте кусочки геля на мелкие кусочки (т.е. примерно 1 мм квадрат) и перенесите их в трубку площадью 1 мл. Используйте наконечник пипетки, если это необходимо, но убедитесь, что кончик пипетки промыть в этанол перед использованием.
ПРИМЕЧАНИЕ: Используйте перчатки, чтобы избежать заражения гелем. Части геля можно хранить при -20 градусов по Цельсию. - Добавьте 100 кЛ высокой чистоты или высокопроизводительной жидкой хроматографии класса воды в трубки для полоски геля штук. Отбросьте воду.
- Для Coomassie или рутения основе флуоресцентных окрашенных геля штук, инкубировать геля куски в растворе destaining (25 мм NH4HCO3 в 50% ацетонитрила) в течение 1 ч, а затем отказаться от раствора. Повторите процедуру, пока окрашивание не будет видно.
ПРИМЕЧАНИЕ: Подготовьте решения, содержащие NH4HCO3 путем разбавления из бульонного раствора на 100 мМ NH4HCO3, pH 7.8.
ВНИМАНИЕ: Ацетонитрил является летучим растворителем, легковоспламеняющимся и токсичным. NH4HCO3 может вызвать раздражение кожи или глаз. Используйте перчатки и работать под химическим капотом. - Для серебра окрашенных геля штук, инкубировать геля штук в 50 л раствора дестабилизации для серебра пятно (15 мм К3"Fe (CN)6, 50 мм Na2S2O3) в воде в течение 30 мин. Отбросьте раствор и мыть геля штук с 200 л воды. Повторите мыть пять раз или пока гель желтого цвета не видно.
ВНИМАНИЕ: K3"Fe (CN)6" может вызвать раздражение кожи или глаз. Используйте перчатки.
- Для Coomassie или рутения основе флуоресцентных окрашенных геля штук, инкубировать геля куски в растворе destaining (25 мм NH4HCO3 в 50% ацетонитрила) в течение 1 ч, а затем отказаться от раствора. Повторите процедуру, пока окрашивание не будет видно.
- Обезвоживать кусочки геля, используя 200 л ацетонитрила в течение 10 мин на RT. Затем отбросьте раствор.
ПРИМЕЧАНИЕ: Обезвоженные части геля меньше по объему, непрозрачные и липкие. Если несколько кусочков геля объединены в одну трубку, повторите процедуру эффективного обезвоживания кусочков геля. - Добавьте 50 л (или достаточный объем, чтобы покрыть кусочки геля) уменьшая раствор (10 мМ дитиотрийтол »DTT» в 100 мм NH4HCO3) и инкубировать при 56 градусах По Цельсию в течение 1 ч. Затем охладите трубки для RT и отбросьте избыток уменьшая раствора.
- Добавьте 50 кЛ (или достаточного объема, чтобы покрыть кусочки геля) раствора алкилирования (50 мм йодоацетамида в 100 мм NH4HCO3)и инкубировать в течение 30 мин на RT в темноте. После этого отбросьте избыток раствора алкилирования.
- Обезвоживать кусочки геля с 200 зл ацетонитрила в течение 10 мин на RT. Удалите ацетонитрил и увлажните кусочки геля 100 мм NH4HCO3 в течение 10 мин на RT.
- Обезвождение геля части снова с 200 Зл ацетонитрила в течение 10 минут на RT и отказаться от избытка раствора.
- Добавьте 15 зЛ масс-спектрометрии класса трипсина, разбавленного в 50 мМ NH4HCO3 буфера, или достаточно объема, чтобы покрыть гидратированные части геля и инкубировать в течение 4 ч, или на ночь, при 37 градусов по Цельсию. Держите общее количество трипсина от 100 до 500 нг (или 20 нг трипсин / мкг белка).
- Охладите образец на RT и центрифугу в течение 1 мин при 2000 х г в микроцентрифуге. Добавьте 10-20 л 5% для модной кислоты, разбавленной в воде, и инкубировать в течение 10 мин на РТ.
ПРЕДЕСЛЯТИЕ: Квиновая кислота легковоспламеняющаяся, коррозионная и токсичная. Используйте перчатки и работать под химическим капотом. - Центрифуга, как указано в шаге 2.2.1.9, затем собрать супернатант (содержат извлеченные пептиды) в другую трубку. Добавьте 20 кл/ с 5% 5% formic acid, разбавленной 50-60% ацетонитрила в трубку и инкубировать в течение 10 мин на RT. Соберите извлеченные пептидные фракции в той же трубке.
- Высушите образец в вакуумном концентраторе и восстановите в 10 зл от 0,5% уксусной кислоты и 2% ацетонитрила для анализа масс-спектрометрии. Центрифуга и собирать раствор в нижней части трубки; хранить раствор при -20 градусах или -80 градусов по Цельсию.
- После разделения белка в SDS/PAGE, кратко промыть гель в воде высокой чистоты. Перенесите гель на чистую стеклянную тарелку. Акцизные белковые полосы с чистым лезвием и избегайте резки дополнительного геля вне полос. Разрежьте кусочки геля на мелкие кусочки (т.е. примерно 1 мм квадрат) и перенесите их в трубку площадью 1 мл. Используйте наконечник пипетки, если это необходимо, но убедитесь, что кончик пипетки промыть в этанол перед использованием.
- В растворе трипсинизация белков
- Осадочные белки для уменьшения объема образцов, опреснения и буферного обмена. Добавьте в образец шесть объемов охлажденный (-20 градусов по Цельсию) ацетона, например, 600 л ацетона до 100 л образца. Вихрь и инкубировать при -20 градусах по Цельсию в течение 15 мин до 1 ч. Решение станет облачным или образует осадок.
ВНИМАНИЕ: Ацетон токсичен и легковоспламеняется. Используйте перчатки и работать под химическим капотом. - Образцы центрифуги при 4 градусах по Цельсию в течение 30 мин. Декант ацетон и воздушно-сухие гранулы в течение 15 мин.
- Добавьте 10 qL 6-8 M мочевины или 1% SDS в 50 mM NH4HCO3, чтобы растворить гранулы и вихрь для смешивания. Для большего количества белков (10 мкг) используйте буфер растворения до 20 qL.
- Добавьте 5 злитровых растворов и вихря. Скручивайте громкость вниз с помощью микроцентрифуга. Если образцы разбавляют в мочевину, то инкубировать в течение 1 ч на RT. Если образцы разбавляют в SDS, затем инкубируются в течение 1 ч при 56 градусах Цельсия.
- Скручивайте громкость вниз с помощью микроцентрифуга. Добавьте 3 Зл раствора алкилирования и вихря. Затем, спина громкости вниз и инкубировать в темноте в течение 30 минут на RT.
- Добавьте 3 злителк уменьшая разрешения для того чтобы нейтрализовать реакцию. Медленно разбавить образец до 1 M мочевины или 0,05% SDS с помощью 50 мМ NH4HCO3.
ПРИМЕЧАНИЕ: Буфер пищеварения трипсина должен иметь моющее средство или денатурант. Предельные концентрации для денатурантов: 0,05% SDS; 0,1% октил B-D-глюкопиранодисид; 0,1% 4-нилфенил-полиэтиленгликоль; 0,1% т-октилфеноксиполицотелетокситанол; 0,1% полисорбат 20; 0,1% 3-з (3-холамидопропил)диметилламмонио-1-пропанесульфонат; Злт; 1 м мочевины или тиуреа. - Добавьте 5 зЛ масс-спектрометрии класса трипсина, разбавленного в 50 мМ NH4HCO3 буфера и инкубировать в течение 4 ч, или на ночь, при 37 градусах Цельсия. Держите общее количество трипсина между 100 и 500 нг (или 20 нг трипсин / мкг белка).
- Охладите образец для RT, и спина объем вниз с помощью микроцентрифуга. Добавить 5% уксусной кислоты (или 5% для модной кислоты в 50% ацетонитрила), чтобы утолить реакцию.
- Высушите образцы в вакуумном концентраторе, как указано в шаге 2.2.1.11. Храните образцы при -80 градусах по Цельсию. Десолт и концентрат пептиды с помощью обратной фазы столбца, такие как C18 zip-tip, а затем анализировать с помощью масс-спектрометрии.
- Осадочные белки для уменьшения объема образцов, опреснения и буферного обмена. Добавьте в образец шесть объемов охлажденный (-20 градусов по Цельсию) ацетона, например, 600 л ацетона до 100 л образца. Вихрь и инкубировать при -20 градусах по Цельсию в течение 15 мин до 1 ч. Решение станет облачным или образует осадок.
- В гель трипсиизации белков
Результаты
Анализ RAP1 и PI (3,4,5)P3 взаимодействия сродства хроматографии и западной blotting
Этот пример иллюстрирует применение этого метода для анализа связывания ИП RAP1 от T. brucei lysate или рекомбинантным белком T. brucei RAP1. В связывающих анализах использовались личицы форм крови T. brucei, которые выражают гемагглютинин (HA) по метки RAP1. RAP1 является белок, участвующих в транскрипционном контроле варианта поверхности гликопротеина (VSG) генов3,48, которые кодируют для поверхностных белков, участвующих в паразита иммунной уклонения антигенной вариации49. RAP1 взаимодействует в комплексе белка теломерик и фосфатидидинозинол 5-фосфатаза (PIP5Pase) фермент3, который также функционирует в контроле транскрипции гена VSG1,3. RAP1 имеет N-терминальный рак молочной железы 1 carboxyl-терминал (BRCT) домен, который сопровождается миелобластоз (myb) ДНК-связывающей домен и C-терминал myb-как домен3,48. Тем не менее, ему не хватает канонических PI связывания доменов. Связывание анализы были выполнены с ИП, которые не фосфорилированных или фосфорилированной в различных положениях иноситол кольцо, и с неконъюгированных бусин агарозы. Западный анализ показывает, что RAP1 преимущественно связывается с PI (3,4,5)P3-бусы(рисунок 3A), но он также связывает в меньшей степени к PI (4,5)P2-бусы. Тем не менее, он не привязывался к каким-либо другим ИП или бусинам агарозы. Поскольку RAP1 является частьюмногобелкового комплекса 3, его взаимодействие с некоторыми ИП не может быть прямым и, таким образом, результатом rap1-HA взаимодействия с другими клеточными белками, которые связываются с ИП.
Таким образом, чтобы проверить, является ли RAP1 связывает непосредственно иП, C-терминально помечены 6x-его рекомбинантный RAP1 (rRAP1) белок был выражен и очищены к однородности от кишечной палочки3. Белок использовался в связывающих анализах с PI (3,4,5)P3-бусы в присутствии конкурирующих концентраций PI (3,4,5)P3 или PI (4,5)P2. Западный blotting показывает, что увеличение концентрации PI (3,4,5)P3, но не PI (4,5)P2 препятствует взаимодействию rRAP1 с PI (3,4,5)P3 (Рисунок 3B). Кроме того, добавление фермента T. brucei очищенного PIP5Pase к реакции восстановленного PI (3,4,5)P3-связывание rRAP1, что связано с дефосфорилением PIP5Pase свободного PI (3,4,5)P33 и, таким образом, указывает на то, что фосфорилирование шаблон этого метаболит необходим для связывания rRAP1. Таким образом, rRAP1 взаимодействует с PI (3,4,5)P3, как это делает RAP1-HA от T. brucei lysates. Кроме того, данные показывают, что привязка RAP1-HA от лисата к PI (4,5)P2, вероятно, является результатом взаимодействия RAP1 с другими белками в комплексе (например, PIP5Pase)3. Данные иллюстрируют взаимодополняемость связывающих анализов с клеточными лисатами и рекомбинантными белками. Он также показывает полезность конкурентных связывающих анализов для определения специфики взаимодействий между белками и ИП.
Идентификация Ins (1,4,5)P3 связывающих белков по хроматографии сродства и масс-спектрометрии
В этом примере хроматография сродства с последующей масс-спектрометрией была использована для выявления белков T. brucei, которые связываются с Ins (1,4,5)P3; Поэтому в эксперименте исследуются потенциальные инсины (1,4,5)P3 связывающие белки из форм крови T. brucei. T. brucei lysate инкубировался ins (1,4,5)P3, спряченными с бусинами агарозы или с неконъюгированными бусинами (используемыми в качестве контроля), а связанные белки были ускользали от буфера образца Laemmli. Анализ SDS/PAGE показывает обогащение в белках, выеханных из Ins (1,4,5)P3-бусы по сравнению с белками, выдавленными из контрольных бусин агарозы(рисунок 4А). Масс-спектрометрия анализа элетированных белков выявили более 250 белков, из которых 84 были обогащены Ins (1,4,5)P3 шарики по сравнению с контрольными бусинами (Рисунок 4B, раз изменения »FC» 2, стр. 0,05). Обогащение белков, привязанных к Ins (1,4,5)P3 по сравнению с контрольными бусинами коррелирует с белковым сигналом, обнаруженным SDS/PAGE. Данные включают белки, которые были проверены, чтобы связать Ins (1,4,5)P3 и белки, механизмы связывания с Ins (1,4,5)P3 неизвестны8. Кроме того, Ins (1,4,5)P3 связывающий протеом значительно отличался от Ins (1,3,4,5)P4 и других ИП8, что позволяет предположить, что некоторые из этих белков признают специфическую конфигурацию фосфатов Ins (1,4,5)P3. Таким образом, биотин-тегами Ins (1,4,5)P3 может быть использован для сродства хроматографии в сочетании с масс-спектрометрии для выявления белков, которые связываются с Ins (1,4,5)P3. Подход может быть изучен для выявления белков, которыесвязываются с другими ИП или ИП 3,8,46,47.

Рисунок 1 : Сродни реагенты для связывания анализов. (A) PI (3,4,5)P3 (вверху) и Ins (1,4,5)P3 (внизу) спрягнулся с биотином на sn1 позиции иноситол. В PI (3,4,5)P3, биотин спрягается в липидной цепи в sn1 позиции инозитол, в то время как в Ins (1,4,5)P3 биотин спрягается в фосфат в положении sn1. (B) Ins (1,4,5)P3 спрягается с биотином и захватывается через связывание стрептавидина, спряченного к бисеру (например, агароз или магнитные бусинки). Вариации этих реагентов с использованием пользовательских синтезированных связующих, которые заменяют биотин также возможны46. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
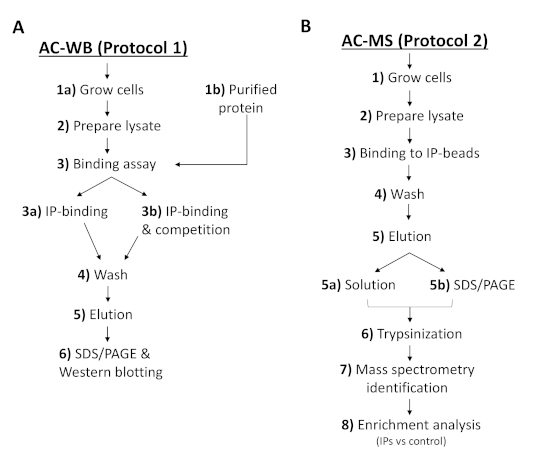
Рисунок 2 : Рабочий процесс протоколов описывает шаги для анализа взаимодействия сродства IP или PI с белками T. brucei и обнаружения (A) Западной blotting или (B) масс-спектрометрии. AC-WB, хроматография сродства и западная поброс; AC-MS, хроматография сродства и масс-спектрометрия. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 3 : Связывание T. brucei RAP1 к фосфоинозитидам. (A) Лысаты T. brucei (5.0 x 107 паразитов), которые выражают HA-тегами RAP1, были инкубированы в течение 2 ч при 4 КС с 50 зЛ ИП (каждый 1 мл буса агарозы, содержащего 10 нмоль спряженных PIs) или агароз (Ag) бусы. Связывающая реакция была вымыта и eluted с 2 х Laemmli образец буфера и нагревается при 95 кв КС в течение 5 мин. Белки были разделены в 4-20% SDS / PAGE, переданы в мембрану PVDF, и зондируется с моноклональными антителами анти-HA (1:5,000, разбавленные в 6% PBS-молоко) следуют анти-мышонком IgG-HRP (1:5,000, разбавленный в 6% PBS-молоко), и обнаружены хемилюминесценции. (B) Один мкг rRAP1 был инкубирован в течение 1 ч на RT с 50 зЛ PI (3,4,5)P3-агарозные бусы в присутствии или отсутствии от 5 до 50 мкм диоктаномилглицерола (diC8) PI (3,4,5)P3, от 20 до 50 мкм diC8 PI (4,5)P2, или 50 мкм diC8 PI (3,4,5)P3 и 250 ng PIP5Pase очищенный от T. brucei формы кровотока3. Связывание было проанализировано западным испугом с помощью моноклональных антител HRP (1:2,000, разбавленных в 6% PBS-молоко) и разработано хемилюминесценцией. Эта цифра была изменена от Cestari и др.3. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 4 : Хроматография аффинити и анализ масс-спектрометрии белков T. brucei, которые связываются с Ins (1,4,5)P3. (A) 10% SDS/PAGE анализ T. brucei белков, которые связываются с Ins (1,4,5)P3-бусы или бусы агарозы. Лисаты 5,0 х 109 паразитов были инкубированы при 4 кс на 2 ч с 400 л Ins (1,4,5)P3 спряженный с агарозным бусинами или с бусинами агаррозы без Ins (1,4,5)P3 1 мл шариков содержат 10 nmol конъюгированных ins (1,4)5.3.3. Связывающая реакция была вымыта, eluted в 2 х Laemmli образец буфера и вареные в течение 5 мин при 95 градусов по Цельсию. Белки были разделены в 10% SDS/PAGE и окрашены Coomassie окрашивания (Таблица материалов). Стрелы показывают белки, которые обогащаются ins (1,4,5)P3-бусы по сравнению с бусинами агарозы; круги показывают белки, присутствующие в обоих Ins (1,4,5)P3-бусы и бусы агарозы, и кронштейн указывает на белки, которые присутствуют в обоих, но обогащены в Ins (1,4,5)P3-бусы по сравнению с агарозными бусинками. (B) Dot-сюжет показывает белки, идентифицированные масс-спектрометрией, которые обогащаются в Ins (1,4,5)P3-бусы по сравнению с бусинами агарозы. Обогащение определяется ФК no gt; 2 и р-значениезлт;0.05. Четыре биологические репликации были использованы для агароз-буса AC-MS, и три биологических репликации для IP3-буса AC-MS. Складные изменения белков, выявленных в IP3-бусинки против агароза-бусы был рассчитан с использованием пептидной интенсивности спектра с помощью MSstat50. Подробные результаты и список пептидов доступны8. Масс-спектрометрии необработанные данные также доступны с идентификатором PXD005907 через консорциум ProteomeXchange через репозиторий партнеров PRIDE. Эта цифра была изменена от Cestari и др.8. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
Обсуждение
Идентификация белков, которые связываются с ИС или ИП имеет решающее значение для понимания клеточной функции этих метаболитов. Хроматография сродства в сочетании с западной помоткой или масс-спектрометрией дает возможность определить взаимодействующие белки ИС или ИП и, следовательно, получить представление об их регулятивной функции. ИП или ИП химически помечены (например, Ins(1,4,5)P3 химически связаны с биотином" и перекрестно к бусинкам агарозы через стрептавидин или захваченных стрептавидина магнитные бусы позволяет изоляции взаимодействующих белков, которые затем могут быть определены массой спектрометрия или западная поместье. Описанные здесь протоколы использовались для идентификации белков из T. brucei3,8 и клеток млекопитающих47, которые связываются с этими метаболитами. Вариации подхода, используюго индивидуальные теги (кроме биотина), также использовались в дрожжах46. Важным фактором, учитываемым в этом подходе, является использование средств контроля для дискриминации конкретных элементов неспецифических взаимодействий. Неконъюгированные бусы являются важным элементом контроля, но дополнительные средства контроля могут включать нефосфорилированные ИП или иноситол, спрягированный с бисером3. ИП или ИП с различными комбинациями фосфатов3,8 также могут быть использованы, потому что связывание белка к этим метаболитам может включать домены, которые дискриминируют конфигурацию фосфатов инозитол38, 39,40,41. Кроме того, сложность выборки может повлиять на чувствительность подхода, и, следовательно, снижение сложности образца путем фракционирования образцов может помочь обнаружению низкообильного белка в клетке. Существуют устоявшиеся протоколы фракционирования клеток и изоляции митохондриона51,ядра52,гликозомы53и flagellum54,55 от трипаносом. Обратите внимание, что буферы и реагенты, используемые в субклеточных фракционированиях, возможно, потребуется скорректировать на совместимость с буферами и реагентами, используемыми в этом протоколе. Примечательно, что идентификация белков, которые связываются с ИС или ИП по сродству хроматографии, как показано здесь, зависит от белка и метаболита сродства взаимодействия, и, таким образом, белки, которые имеют слабое сродство к ИС или ИП, не могут быть легко обнаружены.
Анализ взаимодействия IP или PI с белками из клеточного лизата может также привести к выявлению белков, которые не связываются непосредственно с этими метаболитами, но которые взаимодействия являются результатом белковой ассоциации в комплексе с другими белками, которые связываются с IP-адресами или ИП. Эта функция является примером на рисунке 3A, в котором RAP1-HA от T. brucei lysate, как представляется, связываются с PI (3,4,5)P3-бусы и PI (4,5)P2-бусы. Тем не менее, обязательные анализы с его помечены rRAP1 показывают, что этот белок связывается с PI (3,4,5)P3, а не PI (4,5)P23. Это иллюстрируется на рисунке 3B, в котором конкурентные анализы показывают, что бесплатный PI (3,4,5)P3, но не бесплатно PI (4,5)P2 конкурирует за rRAP1-его взаимодействие с PI (3,4,5)P3-бусы. RAP1 кажущейся взаимодействия с PI (4,5)P2-бусы связано с RAP1 ассоциации в комплексе с белками, которые связывают PI (4,5)P2 (например, PIP5Pase)3. Таким образом, связывающие анализы из клеточных лисатов могут выявлять белки, которые прямо или косвенно связываются с ИП или ИП. Примечательно, что косвенные взаимодействия отличаются от неспецифических взаимодействий, так как первое может иметь биологическую функцию (в контексте белкового комплекса), которая влияет или зависит от связывания метаболита. Например, Ins (1,4,5,6)P4 связывается с комплексом мульти-субъюниров ногой диацетилазы и управляет сложной сборкой и деятельностью13. Следовательно, важно проверить IP/ PI взаимодействия с белками. Проверка взаимодействия может включать в себя конкурсные анализы с превышением ИП или ИП (как на рисунке 3B)3,8, мутации потенциальных белковых доменов56, или использование очищенных белков определить прямые взаимодействия(рисунок 3A,B)3.
Другие методы изучения белков и IP или IP взаимодействий включают привязку белков к радиомаркированным IP-адресам или ИП, использование IP-адресов или ИП, привязанных к гидрофобным мембранам в качестве матриц для улавливания белка, или связывание белков с ИП, включенных в липосомы 42 г. , 57 , 58. Важно, если взаимодействие белка с ИП требует мембранных структур38, липосомы на основе анализов могут быть использованы в качестве дополнительного подхода. Ограничения этих подходов включают низкую пропускную стоимость, низкую чувствительность, неизвестную химическую ориентацию ИП или ассоциацию ИП к матрицам58,или использование радиоактивных материалов42. Описанный здесь метод является чувствительным, без липосомы, нерадиоактивным и IP/PI-бисером коммерчески доступны, и поэтому они не требуют индивидуального синтеза химических веществ. Кроме того, положение биотина, связанного с ИП или ИП, четко определено, и оно также может быть изменено46,58, что позволяет точно анализировать взаимодействие белка и метаболита. Описанный здесь метод также может быть объединен с количественными подходами масс-спектрометрии, такими как стабильная изотопная маркировка аминокислот в клеточной культуре (SILAC)47, которые могут быть использованы для определения динамических взаимодействий под различными клеточными лечения или условия. Хроматография сродства в сочетании с западной помоткой или масс-спектрометрией помогла выявить многочисленные IP- или PI-связывающие белки из T. brucei, клеток млекопитающих и дрожжей3,8,46, 47, в том числе белки, которые не характеризуют IP- или PI-обязательных доменов, и это также помогло выявлению новых связывающих доменов, например, PI (3,4,5)P3 связывающий домен47.
В целом, описанные здесь протоколы могут быть использованы для обследования потенциальных IP или PI взаимодействующих белков от T. brucei,а также для изучения молекулярного взаимодействия белков с этими метаболитами. Протокол может быть легко адаптирован для идентификации IP- или PI-связывающих белков от других одноклеточных паразитов или от других организмов, таких как клетки млекопитающих47 и дрожжи46, и это поможет еще больше понять биологическую функцию IP-адресов и ИП в эукариотах.
Раскрытие информации
Автору нечего раскрывать.
Благодарности
Эта работа была поддержана Советом по естественным наукам и инженерным исследованиям Канады (NSERC, RGPIN-2019-04658); NSERC Discovery Launch Supplement для исследователей ранней карьеры (DGECR-2019-00081) и Университета Макгилла.
Материалы
| Name | Company | Catalog Number | Comments |
| Acetone | Sigma-Aldrich | 650501 | Ketone |
| Acetonitrile | Sigma-Aldrich | 271004 | Solvent |
| Ammonium bicarbonate | Sigma-Aldrich | A6141 | Inorganic salt |
| Centrifuge Avanti J6-MI | Beckman Coulter | Avanti J6-MI | Centrifuge for large volumes (e.g., 1L) |
| Centrifuge botles | Sigma-Aldrich | B1408 | Bottles for centrifugation of 1L of culture |
| Control Beads | Echelon | P-B000-1ml | Affinity chromatography reagent - control |
| D-(+)-Glucose | Sigma-Aldrich | G8270 | Sugar, Added in PBS to keep cells viable |
| Dithiothreitol (DTT) | Bio-Rad | 1610610 | Reducing agent |
| Dynabeads M-270 Streptavidin | ThermoFisher Scientific | 65305 | Streptavidin beads for binding to biotin ligands |
| EDTA-free Protease Inhibitor Cocktail | Roche | 11836170001 | Protease inhibitors |
| Electrophoresis running buffer | Bio-Rad | 1610732 | 25 mM Tris, 192 mM glycine, 0.1% SDS, pH 8.3 |
| Falcon 15 mL Conical Centrifuge Tubes | Corning Life Sciences | 430052 | To centrifuge 10 mL cultures |
| Formic acid | Sigma-Aldrich | 106526 | Acid |
| Glycine | Sigma-Aldrich | G7126 | Amino acid |
| HMI-9 cell culture medium | ThermoFisher Scientific | ME110145P1 | Cell culture medium for T. brucei bloodstream forms |
| Imperial Protein Stain | ThermoFisher Scientific | 24615 | Coomassie staining for protein detection in SDS/PAGE |
| Ins(1,4,5)P3 Beads | Echelon | Q-B0145-1ml | Affinity chromatography reagent |
| Instant Nonfat Dry Milk | Thomas Scientific | C837M64 | Blocking reagent for Western blotting |
| Iodoacetamide | Sigma-Aldrich | I6125 | Alkylating reagent for cysteine proteins or peptides |
| Lab Rotator | Thomas Scientific | 1159Z92 | For binding assays |
| LoBind Microcentrifuge Tubes | ThermoFisher Scientific | 13-698-793 | Low protein binding tubes for mass spectrometry |
| Nonidet P-40 (Igepal CA-630) | Sigma-Aldrich | 21-3277 | Detergent |
| PBS, pH 7.4 | ThermoFisher Scientific | 10010031 | Physiological buffer |
| Peroxidase substrate for chemiluminescence | ThermoFisher Scientific | 32106 | Substrate for Western bloting detection of proteins |
| PhosSTOP Phosphatase Inhibitor Cocktail Tablets | Roche | 4906845001 | Phosphatase inhibitors |
| PI(3)P PIP Beads | Echelon | P-B003a-1ml | Affinity chromatography reagent |
| PI(3,4)P2 PIP Beads | Echelon | P-B034a-1ml | Affinity chromatography reagent |
| PI(3,4,5)P3 diC8 | Echelon | P-3908-1mg | Affinity chromatography reagent |
| PI(3,4,5)P3 PIP Beads | Echelon | P-B345a-1ml | Affinity chromatography reagent |
| PI(3,5)P2 PIP Beads | Echelon | P-B035a-1ml | Affinity chromatography reagent |
| PI(4)P PIP Beads | Echelon | P-B004a-1ml | Affinity chromatography reagent |
| PI(4,5)P2 diC8 | Echelon | P-4508-1mg | Affinity chromatography reagent |
| PI(4,5)P2 PIP Beads | Echelon | P-B045a-1ml | Affinity chromatography reagent |
| PI(5)P PIP Beads | Echelon | P-B005a-1ml | Affinity chromatography reagent |
| Ponceau S solution | Sigma-Aldrich | P7170 | Protein staining (0.1% [w/v] in 5% acetic acid) |
| Potassium hexacyanoferrate(III) | Sigma-Aldrich | 702587 | Potassium salt |
| PtdIns PIP Beads | Echelon | P-B001-1ml | Affinity chromatography reagent |
| PVDF Membrane | Bio-Rad | 1620177 | For Western blotting |
| Refrigerated centrifuge | Eppendorf | 5910 R | Microcentrifuge for small volumes (e.g., 1.5 mL) |
| Sodium dodecyl sulfate | Sigma-Aldrich | 862010 | Detergent |
| Sodium thiosulfate | Sigma-Aldrich | 72049 | Chemical |
| SpeedVac Vacuum Concentrators | ThermoFisher Scientific | SPD120-115 | Sample concentration (e.g., for mass spectrometry) |
| T175 flasks for cell culture | ThermoFisher Scientific | 159910 | To grow 50 mL T. brucei culture |
| Trypsin, Mass Spectrometry Grade | Promega | V5280 | Trypsin for protein digestion |
| Urea | Sigma-Aldrich | U5128 | Denaturing reagent |
| Vortex | Fisher Scientific | 02-215-418 | For mixing reactions |
| Western blotting transfer buffer | Bio-Rad | 1610734 | 25 mM Tris, 192 mM glycine, pH 8.3 with 20% methanol |
| Whatman 3 mm paper | Sigma-Aldrich | WHA3030861 | Paper for Wester transfer |
| 2-mercaptoethanol (14.2 M) | Bio-Rad | 1610710 | Reducing agent |
| 2x Laemmli Sample Buffer | Bio-Rad | 161-0737 | Protein loading buffer |
| 4–20% Mini-PROTEAN TGX Precast Protein Gels | Bio-Rad | 4561094 | Gel for protein electrophoresis |
| 4x Laemmli Sample Buffer | Bio-Rad | 161-0747 | Protein loading buffer |
Ссылки
- Cestari, I., Stuart, K. Inositol phosphate pathway controls transcription of telomeric expression sites in trypanosomes. Proceedings of the National Academy of Sciences of the United States of America. 112 (21), 2803-2812 (2015).
- Odom, A. R., Stahlberg, A., Wente, S. R., York, J. D. A role for nuclear inositol 1,4,5-trisphosphate kinase in transcriptional control. Science. 287 (5460), 2026-2029 (2000).
- Cestari, I., McLeland-Wieser, H., Stuart, K. Nuclear Phosphatidylinositol 5-Phosphatase Is Essential for Allelic Exclusion of Variant Surface Glycoprotein Genes in Trypanosomes. Molecular and Cellular Biology. 39 (3), (2019).
- Billcliff, P. G., et al. OCRL1 engages with the F-BAR protein pacsin 2 to promote biogenesis of membrane-trafficking intermediates. Molecular Biology of the Cell. 27 (1), 90-107 (2016).
- Brochet, M., et al. Phosphoinositide metabolism links cGMP-dependent protein kinase G to essential Ca(2)(+) signals at key decision points in the life cycle of malaria parasites. PLoS Biology. 12 (3), 1001806(2014).
- Azevedo, C., Szijgyarto, Z., Saiardi, A. The signaling role of inositol hexakisphosphate kinases (IP6Ks). Advances in Enzyme Regulation. 51 (1), 74-82 (2011).
- Szijgyarto, Z., Garedew, A., Azevedo, C., Saiardi, A. Influence of inositol pyrophosphates on cellular energy dynamics. Science. 334 (6057), 802-805 (2011).
- Cestari, I., Anupama, A., Stuart, K. Inositol polyphosphate multikinase regulation of Trypanosoma brucei life stage development. Molecular Biology of the Cell. 29 (9), 1137-1152 (2018).
- Bang, S., et al. AMP-activated protein kinase is physiologically regulated by inositol polyphosphate multikinase. Proceedings of the National Academy of Sciences of the United States of America. 109 (2), 616-620 (2012).
- Seeds, A. M., Tsui, M. M., Sunu, C., Spana, E. P., York, J. D. Inositol phosphate kinase 2 is required for imaginal disc development in Drosophila. Proceedings of the National Academy of Sciences of the United States of America. 112 (51), 15660-15665 (2015).
- Hamada, K., Miyatake, H., Terauchi, A., Mikoshiba, K. IP3-mediated gating mechanism of the IP3 receptor revealed by mutagenesis and X-ray crystallography. Proceedings of the National Academy of Sciences of the United States of America. 114 (18), 4661-4666 (2017).
- Watson, P. J., et al. Insights into the activation mechanism of class I HDAC complexes by inositol phosphates. Nature Communications. 7, 11262(2016).
- Watson, P. J., Fairall, L., Santos, G. M., Schwabe, J. W. Structure of HDAC3 bound to co-repressor and inositol tetraphosphate. Nature. 481 (7381), 335-340 (2012).
- Irvine, R. F. Nuclear lipid signalling. Nature Reviews: Molecular Cell Biology. 4 (5), 349-360 (2003).
- Sobol, M., et al. UBF complexes with phosphatidylinositol 4,5-bisphosphate in nucleolar organizer regions regardless of ongoing RNA polymerase I activity. Nucleus. 4 (6), 478-486 (2013).
- Nascimbeni, A. C., et al. ER-plasma membrane contact sites contribute to autophagosome biogenesis by regulation of local PI3P synthesis. EMBO Journal. 36 (14), 2018-2033 (2017).
- Martin, K. L., Smith, T. K. The myo-inositol-1-phosphate synthase gene is essential in Trypanosoma brucei. Biochemical Society Transactions. 33, Pt 5 983-985 (2005).
- Matsu-ura, T., et al. Cytosolic inositol 1,4,5-trisphosphate dynamics during intracellular calcium oscillations in living cells. Journal of Cell Biology. 173 (5), 755-765 (2006).
- Blind, R. D., et al. The signaling phospholipid PIP3 creates a new interaction surface on the nuclear receptor SF-1. Proceedings of the National Academy of Sciences of the United States of America. 111 (42), 15054-15059 (2014).
- Lin, A., et al. The LINK-A lncRNA interacts with PtdIns(3,4,5)P3 to hyperactivate AKT and confer resistance to AKT inhibitors. Nature Cell Biology. 19 (3), 238-251 (2017).
- Steger, D. J., Haswell, E. S., Miller, A. L., Wente, S. R., O'Shea, E. K. Regulation of chromatin remodeling by inositol polyphosphates. Science. 299 (5603), 114-116 (2003).
- York, J. D., Odom, A. R., Murphy, R., Ives, E. B., Wente, S. R. A phospholipase C-dependent inositol polyphosphate kinase pathway required for efficient messenger RNA export. Science. 285 (5424), 96-100 (1999).
- Adams, R. L., Mason, A. C., Glass, L., Aditi,, Wente, S. R. Nup42 and IP6 coordinate Gle1 stimulation of Dbp5/DDX19B for mRNA export in yeast and human cells. Traffic. 18 (12), 776-790 (2017).
- Macbeth, M. R., et al. Inositol hexakisphosphate is bound in the ADAR2 core and required for RNA editing. Science. 309 (5740), 1534-1539 (2005).
- Dickson, E. J., Hille, B. Understanding phosphoinositides: rare, dynamic, and essential membrane phospholipids. Biochemical Journal. 476 (1), 1-23 (2019).
- Mellman, D. L., et al. A PtdIns4,5P2-regulated nuclear poly(A) polymerase controls expression of select mRNAs. Nature. 451 (7181), 1013-1017 (2008).
- Lee, Y. S., Mulugu, S., York, J. D., O'Shea, E. K. Regulation of a cyclin-CDK-CDK inhibitor complex by inositol pyrophosphates. Science. 316 (5821), 109-112 (2007).
- Nagy, A. I., et al. IP3 signalling regulates exogenous RNAi in Caenorhabditis elegans. EMBO Reports. 16 (3), 341-350 (2015).
- Hall, B. S., et al. TbVps34, the trypanosome orthologue of Vps34, is required for Golgi complex segregation. Journal of Biological Chemistry. 281 (37), 27600-27612 (2006).
- Rodgers, M. J., Albanesi, J. P., Phillips, M. A. Phosphatidylinositol 4-kinase III-beta is required for Golgi maintenance and cytokinesis in Trypanosoma brucei. Eukaryotic Cell. 6 (7), 1108-1118 (2007).
- Gilden, J. K., et al. The role of the PI(3,5)P2 kinase TbFab1 in endo/lysosomal trafficking in Trypanosoma brucei. Molecular and Biochemical Parasitology. 214, 52-61 (2017).
- Demmel, L., et al. The endocytic activity of the flagellar pocket in Trypanosoma brucei is regulated by an adjacent phosphatidylinositol phosphate kinase. Journal of Cell Science. 129 (11), 2285(2016).
- Gimenez, A. M., et al. Phosphatidylinositol kinase activities in Trypanosoma cruzi epimastigotes. Molecular and Biochemical Parasitology. 203 (1-2), 14-24 (2015).
- Hashimoto, M., et al. Inositol 1,4,5-trisphosphate receptor regulates replication, differentiation, infectivity and virulence of the parasitic protist Trypanosoma cruzi. Molecular Microbiology. 87 (6), 1133-1150 (2013).
- Cestari, I., Haas, P., Moretti, N. S., Schenkman, S., Stuart, K. Chemogenetic Characterization of Inositol Phosphate Metabolic Pathway Reveals Druggable Enzymes for Targeting Kinetoplastid Parasites. Cell Chemical Biology. 23 (5), 608-617 (2016).
- Lovett, J. L., Marchesini, N., Moreno, S. N., Sibley, L. D. Toxoplasma gondii microneme secretion involves intracellular Ca(2+) release from inositol 1,4,5-triphosphate (IP(3))/ryanodine-sensitive stores. Journal of Biological Chemistry. 277 (29), 25870-25876 (2002).
- McNamara, C. W., et al. Targeting Plasmodium PI(4)K to eliminate malaria. Nature. 504 (7479), 248-253 (2013).
- Tresaugues, L., et al. Structural basis for phosphoinositide substrate recognition, catalysis, and membrane interactions in human inositol polyphosphate 5-phosphatases. Structure. 22 (5), 744-755 (2014).
- Varnai, P., et al. Quantifying lipid changes in various membrane compartments using lipid binding protein domains. Cell Calcium. 64, 72-82 (2017).
- Lystad, A. H., Simonsen, A. Phosphoinositide-binding proteins in autophagy. FEBS Letters. 590 (15), 2454-2468 (2016).
- Cullen, P. J., Cozier, G. E., Banting, G., Mellor, H. Modular phosphoinositide-binding domains--their role in signalling and membrane trafficking. Current Biology. 11 (21), 882-893 (2001).
- Klarlund, J. K., et al. Signaling by phosphoinositide-3,4,5-trisphosphate through proteins containing pleckstrin and Sec7 homology domains. Science. 275 (5308), 1927-1930 (1997).
- Wild, R., et al. Control of eukaryotic phosphate homeostasis by inositol polyphosphate sensor domains. Science. 352 (6288), 986-990 (2016).
- Gerasimaite, R., et al. Inositol Pyrophosphate Specificity of the SPX-Dependent Polyphosphate Polymerase VTC. ACS Chemical Biology. 12 (3), 648-653 (2017).
- Potapenko, E., et al. 5-Diphosphoinositol pentakisphosphate (5-IP7) regulates phosphate release from acidocalcisomes and yeast vacuoles. Journal of Biological Chemistry. 293 (49), 19101-19112 (2018).
- Wu, M., Chong, L. S., Perlman, D. H., Resnick, A. C., Fiedler, D. Inositol polyphosphates intersect with signaling and metabolic networks via two distinct mechanisms. Proceedings of the National Academy of Sciences of the United States of America. 113 (44), 6757-6765 (2016).
- Jungmichel, S., et al. Specificity and commonality of the phosphoinositide-binding proteome analyzed by quantitative mass spectrometry. Cell Reports. 6 (3), 578-591 (2014).
- Yang, X., Figueiredo, L. M., Espinal, A., Okubo, E., Li, B. RAP1 is essential for silencing telomeric variant surface glycoprotein genes in Trypanosoma brucei. Cell. 137 (1), 99-109 (2009).
- Cestari, I., Stuart, K. Transcriptional Regulation of Telomeric Expression Sites and Antigenic Variation in Trypanosomes. Current Genomics. 19 (2), 119-132 (2018).
- Clough, T., Thaminy, S., Ragg, S., Aebersold, R., Vitek, O. Statistical protein quantification and significance analysis in label-free LC-MS experiments with complex designs. BMC Bioinformatics. 13, Suppl 16 6(2012).
- Schneider, A., Charriere, F., Pusnik, M., Horn, E. K. Isolation of mitochondria from procyclic Trypanosoma brucei. Methods in Molecular Biology. 372, 67-80 (2007).
- DeGrasse, J. A., Chait, B. T., Field, M. C., Rout, M. P. High-yield isolation and subcellular proteomic characterization of nuclear and subnuclear structures from trypanosomes. Methods in Molecular Biology. 463, 77-92 (2008).
- Opperdoes, F. R. A rapid method for the isolation of intact glycosomes from Trypanosoma brucei by Percoll -gradient centrifugation in a vertical rotor. Molecular and Biochemical Parasitology. 3 (3), 181-186 (1981).
- Pereira, N. M., de Souza, W., Machado, R. D., de Castro, F. T. Isolation and properties of flagella of trypanosomatids. The Journal of protozoology. 24 (4), 511-514 (1977).
- Subota, I., et al. Proteomic analysis of intact flagella of procyclic Trypanosoma brucei cells identifies novel flagellar proteins with unique sub-localization and dynamics. Molecular and Cellular Proteomics. 13 (7), 1769-1786 (2014).
- Fukuda, M., Kojima, T., Kabayama, H., Mikoshiba, K. Mutation of the pleckstrin homology domain of Bruton's tyrosine kinase in immunodeficiency impaired inositol 1,3,4,5-tetrakisphosphate binding capacity. Journal of Biological Chemistry. 271 (48), 30303-30306 (1996).
- Knodler, A., Mayinger, P. Analysis of phosphoinositide-binding proteins using liposomes as an affinity matrix. BioTechniques. 38 (6), (2005).
- Best, M. D. Global approaches for the elucidation of phosphoinositide-binding proteins. Chemistry and Physics of Lipids. 182, 19-28 (2014).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены