Method Article
זיהוי של אינוזיטול פוספט או זרחן אינטראקציה חלבונים על-ידי כרומטוגרפיה של אהדה מצמידים לאבן חשופה מערבית או ספקטרומטר המסה
In This Article
Summary
פרוטוקול זה מתמקד בזיהוי של חלבונים התאגד כדי אינוזיטול פוספטים או פוספופנוסיידים. היא משתמשת בכרומטוזיקה באמצעות מלחי הביוטיטול או פוספופנוסידים הנמצאים בדרך streptavidin לחרוזים או חרוזי מגנטים. אינוזיטול פוספט או פוספוליזיסיטייז מחייב חלבונים מזוהים על ידי בלוק מערבי או ספקטרומטריה מאסיבית.
Abstract
מלחי אינוזיטול ופוספוליזידים מווסת מספר תהליכים סלולריים ב-eukaryotes, כולל ביטוי גנטי, סחר בסמים, התמרה של אותות, חילוף חומרים, ופיתוח. מטבוליטים אלה לבצע פעילות תקינה זו על ידי איגוד לחלבונים, ובכך שינוי היווצרות חלבון, פעילות קטליטי, ו/או אינטראקציות. השיטה המתוארת כאן משתמשת בכרומטוגרפיה של זיקה בשילוב עם הספקטרומטר המסה או הכתמים המערביים כדי לזהות חלבונים הפועלים באינטראקציה עם מלחי אינוזיטול או פוספופנוסיידים. הפוספטים inositol או פוספיונוסיידים הם כימית מתויג עם biotin, אשר נלכד אז באמצעות streptavidin מצועם מעלה או חרוזים מגנטיים. חלבונים מבודדים על ידי הזיקה שלהם של קשירה המטולוליט, ולאחר מכן הודללו וזוהו על ידי ספקטרומטר המסה או בלוק המערבי. השיטה יש זרימת עבודה פשוטה רגיש, לא רדיואקטיבי, ליפומי-חינם, להתאמה אישית, תמיכה בניתוח של חלבון ואינטראקציה מטבלייט עם דיוק. גישה זו יכולה לשמש ללא תווית או בחומצה אמינית מתויג כמותית שיטות המסה כדי לזהות אינטראקציות חלבון-מטבוליט בדגימות ביולוגיות מורכבות או באמצעות חלבונים מטוהרים. פרוטוקול זה מותאם במיוחד לניתוח של חלבונים מטריאנוסומה ברוסייבי, אך ניתן להתאים אותו לטפילים פרוטוזוקיים, שמרים או מהיונקים.
Introduction
אינוסיטול פוספטים (IPs) ו פוספהונוסידים (פיס) לשחק תפקיד מרכזי בביולוגיה איקריוטים באמצעות התקנה של תהליכים סלולריים כגון השליטה בביטוי הגנים1,2,3, שלפוחית הסחר 4, שינוי האותות של5,6, מטבוליזם7,8,9, ופיתוח8,10. הפונקציה התקינה של מטבוליטים אלה תוצאות מהיכולת שלהם אינטראקציה עם חלבונים ובכך לווסת את תפקוד החלבון. עם כריכה על ידי חלבונים, IPs ו-פיס עשויים לשנות את היווצרות חלבון11, פעילות קטליטי12, או אינטראקציות13 ומכאן להשפיע על הפונקציה התאית. שב ס ו-פיס מופצים בתאי משנה מרובים, כגון: גרעין2,3,14,15, אנפלזמית ברשת16,17, פלזמה ממברנה1 ו ציטוסול18, המשויכים לחלבונים3,19 או עם rnas20.
המחשוף של הממברנה המשויכת PI (4, 5) P2 ידי פוספוליפדאז C תוצאות בשחרור של Ins (1, 4, 5) P3, אשר יכול להיות זרחנים או deated על ידי הקיסים IP ו פוספאטטיות, בהתאמה. שב ס מולקולות מסיסים שיכולות לאגד חלבונים ולהפעיל פונקציות רגולטוריות. לדוגמה, Ins (1, 4, 5) P3 ב מטזוזה יכול לשמש כשליח השני על ידי מחייב IP3 קולטנים, אשר מעורר שינויים בקולטן ובכך לשחרר של Ca2 + מן חנויות תאיים11. Ins (1, 3, 4, 5) P4 נקשר לקומפלקס הימרחליקלז ומסדיר הרכבה ופעילות של מורכבות חלבון13. דוגמאות אחרות של הפונקציה התקינה של IPs כוללות את השליטה של ארגון כרומטין21, rna תחבורה22,23, RNA עריכה24, ושעתוק1,2,3 . לעומת זאת, הפיס משויך לעתים קרובות לגיוס חלבונים לקרום הפלזמה או לקרומים האורגונל25. עם זאת, המאפיין המתעוררים של פיס הוא היכולת לקשר עם חלבונים בסביבה לא קרומי3,15,19,26. זהו המקרה של הגורם לקולטן גרעינית, אשר פונקציה שליטה ההמרה מוסדר על ידי PI (3, 4, 5) P319, ו-פולי פולימראז אשר פעילות אנזימטית מוסדר על ידי הגרעין PI (4, 5) P226. תפקיד רגולטורי עבור IPs ו-פיס הוצג באורגניזמים רבים כולל שמרים22,27, תאים מוחיים19,23, דרוסוהילה10 ותולעים28. המשמעות היא התפקיד של מטבוליטים אלה בטריאנוזומים, אשר התפצל מוקדם מן השושלת איקריוטית. מטבוליטים אלה לשחק תפקיד חיוני בטריאנוסומה ברוסייס1 בקרת שליטה,3, פיתוח8, ארגונית biogenesis ו חלבון התנועה 29,30 , מיכל בן 31 , 32, והם מעורבים גם פיתוח וזיהום של פתוגנים T. cruzi33,34,35, טוקסופלזמה36 ו פלמודיום מיכל 5 , 37. מכאן, הבנת התפקיד של IPs ו-הפיס בטריאנוזומים עשויים לסייע להבהיר פונקציה ביולוגית חדשה עבור מולקולות אלה ולזהות מטרות של סמים חדשניים.
הספציפיות של חלבון ו-IP או כריכת PI תלוי בתחומים של אינטראקציה חלבונים ואת המצב זירחון של אינוזיטול13,38, למרות אינטראקציות עם החלק השומנים של פיס גם מתרחשת19. מגוון של כתובות ה-Ip ו-פיס ושינוי שלהם מספק מנגנון הסלולר גמיש לשליטה בתפקוד החלבון אשר מושפע על ידי זמינות מטבוליזם ושפע, המצב של זירחון של inositol, וחלבון אהדה של אינטראקציה1,3,13,38. למרות כמה תחומים חלבונים מאופיינים היטב39,40,41, למשל, pleckstrin הומולוגיה תחום42 ו SPX (SYG1/Pho81/XPR1) תחומים43 ,44,45, כמה חלבונים אינטראקציה עם IPs או הפיס על ידי מנגנונים שאינם ידועים. לדוגמה, חלבון activator 1 (RAP1) של T. brucei חסר הקאנוני התחומים מחייב pi אבל אינטראקציה עם pi (3, 4, 5) P3 ושליטה שעתוק של גנים המעורבים וריאציה אנטי הגניים3. כרומטוגרפיה וניתוח הספקטרומטר ההמוני של החלבונים בעלי אינטראקציה של ip או pi מתוך טריאנומין, שמרים או תאי מיונקים זיהו מספר חלבונים ללא מחשבים מבוססי IP או pi-כריכה מסוג8,46, 47. הנתונים מציעים מחשבים נוספים שאינם מאופיינים בחלבון שתאגד לאותם מטבוליטים. מכאן, הזיהוי של חלבונים האינטראקציה עם IPs או הפיס עשוי לחשוף מנגנונים חדשניים של האינטראקציה חלבון-מטבוליט ופונקציות חדשות הרגולציה הסלולר עבור אלה מולקולות קטנות.
השיטה המתוארת כאן מעסיקה כרומטוגרפיה של אהדה בשילוב עם הדגמים המערביים או ספקטרומטר המסה כדי לזהות חלבונים הקושרים ל-IPs או לפיס. הוא משתמש ב-IPs biotinylated או ב-"פיס" המקושרים לstreptavidin בעלי מבטים לחרוזים או לחילופין, שנתפסו באמצעות חרוזים מגנטיים streptavidin-מצוייביים (איור 1). השיטה מספקת זרימת עבודה פשוטה רגישה, לא רדיואקטיבית, ליפומי-חינם, והיא מתאימה לזיהוי הכריכה של חלבונים מתאי ליטים או חלבונים מטוהרים3 (איור 2). ניתן להשתמש בשיטה ללא תווית8,46 או מצמידים לחומצות אמינו ממותגים בעלי שמות מספרים מבוססי חומצה אמימטריה47 כדי לזהות חלבונים של IP או PI-מחייב מדגימות ביולוגיות מורכבות. מכאן, שיטה זו היא חלופה לכמה שיטות זמין ללמוד את האינטראקציה של IPs או הפיס עם חלבונים סלולריים יסייע להבין את התפקוד הרגולטורי של מטבוליטים אלה בטריאנוזומים ואולי eukaryotes אחרים.
Protocol
1. ניתוח החלבונים של IP או PI-מחייב על ידי כרומטוגרפיה של אהדה ובלוק מערבי
- צמיחת תאים, לליזה וכרומטוגרפיה של זיקה
- הגדל תאים T. brucei לשלב באמצע היומן ולפקח על הכדאיות וצפיפות התא. סך של 5.0 x 107 תאים מספיק עבור שיטת מחייב אחת.
- עבור טפסים במחזור הדם, לגדול תאים בתקשורת HMI-9 שיושלם עם 10% סרום שור עוברי (FBS) ב 37 ° צ' ו 5% CO2. שמור על צפיפות תאים בין 8.0 x 105 כדי 1.6 x 106 תאים/mL.
הערה: צפיפות גבוהה יותר מ-1.8 x 106 תאים/mL עלולה להשפיע על הכדאיות בתאים. זמן ההכפלה של T. brucei 427 הזנים גדל בתוך מבחנה הוא בין 5.5 ו 6.5 h. - עבור צורות procyclic, לגדול תאים ב SDM-79 בינוני בתוספת 10% FBS ב 27 ° צ' ולשמור על צפיפות התא בין 1.0 x 107 ו 3.0 x 107 תאים/mL.
- עבור חלבונים מטוהרים (למשל, רקומביננטי חלבונים), לקחת 0.5 עד 1 μg של חלבון ולדלל ב 450 μL של מאגר מחייב (25 מ"מ HEPES, 150 mM הנאקל, 0.2% 4-לאיל פניאיל-פוליאתילן גליקול, pH 7.4). לשמור 5% חלבון מדולל (קלט) עבור ניתוח כתמי אבן מערבית. . המשך לשלב 1.1.7
- עבור טפסים במחזור הדם, לגדול תאים בתקשורת HMI-9 שיושלם עם 10% סרום שור עוברי (FBS) ב 37 ° צ' ו 5% CO2. שמור על צפיפות תאים בין 8.0 x 105 כדי 1.6 x 106 תאים/mL.
- בתאי צנטריפוגה ב 1,600 x g עבור 10 דקות בטמפרטורת החדר (RT). . מחק את הסופרנטאנט
הערה: ראה step 2.1.2 לקבלת מידע נוסף על צנטריפוגה של כמויות גדולות של תרבות. - השעיית מחדש בעדינות את הגלולה ב 10 מ ל של פוספט מלוחים באגירה pH 7.4 שיושלם עם 6 מ"מ גלוקוז (PBS-G) ו מחומם מראש ב 37 ° צ' כדי לשטוף את התאים. לאחר מכן, צנטריפוגה את התאים ב 1,600 x g עבור 5 דקות ב RT. חזור על ההליך פעמיים.
- השהה את הגלולה ב-1 מ ל של PBS-G. ואז, להעביר את עוצמת הקול לצינור 1.5 mL ו צנטריפוגה ב 1,600 x g עבור 5 דקות. להיפטר supernatant.
הערה: כדורי תא יכול להיות פלאש קפוא בחנקן נוזלי ומאוחסן ב-80 ° c או חנקן נוזלי. - השהה מחדש את הגלולה ב 0.5 mL של מאגר הליזה (25 מ"מ HEPES, 150 mM הנאקל, 1% t-octylphenoxypolyethoxyethanol, pH 7.4) שיושלם עם מעכב 1.5 x המעכבי הקוקטייל ו-1x פוספאטאז מעכבי הקוקטייל (טבלת חומרים) טרום מקורר בקרח כדי . לסדר את התאים דגירה ליפוסט עבור 10 דקות מסתובבת ב 50 rpm ב 4 ° c.
הערה: זהו שלב קריטי מכיוון שחלבונים עלולים להיפגם אם לא טופלו כמצוין. בדיקת שלמות חלבון ליפוסט על ידי נתרן dodecyl סולפט-פוליאקרילמיד ג'ל אלקטרופורזה (SDS/PAGE) במידת הצורך.
התראה: T-octylphenoxypolyethoxyethanol הוא רעיל יכול לגרום גירוי בעור ובעיניים. שימוש בכפפות, eyeshield והגנה faceshield. - צנטריפוגה את הליפוסט ב 14,000 x g עבור 10 דקות ב 4 ° c. לאסוף את supernatant לתוך שפופרת חדש 1.5 mL לכריכה assays. שמור 5% מכלל הליפוסט הכולל (קלט) עבור ניתוח הכתמים המערביים. Supernatant מכיל חלבונים טפיל שחולצו עם מאגר לפירוק.
- לאסוף 50 μL של שב ס או הפיס מעלה מעלה חרוזים agarose (כלומר, 50 μL של שאיפה) או 50 μL של חרוזים של agarose, ו צנטריפוגה עבור 1 דקות ב 1,000 x g. למחוק את supernatant ולהשעות מחדש ב 50 μL של מאגר מחייב כדי לבטג את החרוזים. השתמש בחרוזים שאינם מצובית כפקד. השתמש ב-IP/PI חרוזים עם תצורת פוספט שונים כולל צורות שאינן זרחמות כדי לשלוט על אינטראקציות לא ספציפיות.
- הוסף 50 μL של IP-או PI חרוזים ל-ליפוסט תא או חלבונים מטוהרים (כל 1 מ ל של חרוזים מכיל 10 nmol של מעלה שב ס או פיס). שמור על עוצמת הקול של מחרוזות IP או PI בתוך 10% מכלל הליפוסט הכולל ובמידת הצורך, כוונן את עוצמת התגובה של האיגוד עם מאגר האיגוד.
- לגבי התחרות, הוסיפו לתגובת האיגוד ריכוזים שונים של כתובות IPs או פיס (לדוגמה, 1-, 10-, 100-העודפים מתקפל לעומת ה-IP או PI-חרוזים).
- דגירה את התגובה עבור 1 h, או לילה, ב 4 ° c ו מסתובבת ב 50 rpm.
הערה: כריכת תגובות עם חלבונים מטוהרים ניתן לעשות ב-RT בהתאם ליציבות החלבון. אם השימוש ב-IPs או ב-הפיס מעלה לביוטין להמשיך לשלב 1.1.9.1, אחרת המשך לשלב 1.1.10.- הוסף 50 μL של streptavidin-מעלה מעלה חרוזים מגנטיים לתגובת איגוד ו דגירה עבור 1 h ב 4 ° c מסתובבת ב 50 סל ד.
- צנטריפוגה את התערובת עבור 1 דקות ב 1,000 x g ב 4 ° c. הסר את הסופרנטנט (זרימה) ושמור את הגלולה. שמרו 5% מתוך הסופרנטאנט לניתוח כתמי אבן מערבית.
הערה: אם אתה משתמש בחרוזים מגנטיים, הסר את הסופרנטנים ובצע שוטף באמצעות מעמד מגנטי (centrifugations אינם נחוצים). - הוסף 1 מ ל של מאגר כביסה (25 מ"מ HEPES, 300 מ"מ היאl, 0.2% 4-nonyl פניאיל-פוליאתילן גליקול, pH 7.4) ו להשעות את שרף על ידי הקשה או מתערבל את הצינור (לא להשתמש בפיפטה כי חרוזים יכולים לצרף לטיפים פיפטה). צנטריפוגה את התגובה עבור 1 דקות ב 1,000 x g ב 4 ° c ולהיפטר supernatant. חזור על ההליך עבור סך של חמש שטיפות.
התראה: 4-nonyl פניאיל-פוליאתילן גליקול רעיל והוא יכול לגרום גירוי בעור ובעיניים. שימוש בכפפות, eyeshield והגנה faceshield. - הוסף 50 μL של מאגר 2x Laemmli בתוספת עם 710 mM 2-mercaptoethanol לחרוזים ומערבבים על ידי הקשה או מערבולת כדי elute את החלבונים. חום ב 95 ° צ' עבור 5 דקות, לאחר מכן צנטריפוגה עבור 10,000 x g עבור 1 דקות ולאסוף את supernatant (מכיל חלבונים מתכווצים). לחילופין, חלבון elute חלבונים עם 8 M שתנן/100 מילימטר גליצין pH 2.9 כדי להימנע משימוש SDS. הקפא את ההקפאה ב-80 ° c, אחרת המשיכו לניתוח כתמי האבן המערביים.
התראה: 2-mercaptoethanol הוא רעיל ועלול לגרום עור, עיניים וגירויים בדרכי הנשימה. השתמש בכפפות ועבוד בשכונה הכימית.
- הגדל תאים T. brucei לשלב באמצע היומן ולפקח על הכדאיות וצפיפות התא. סך של 5.0 x 107 תאים מספיק עבור שיטת מחייב אחת.
- אנליזה בלופית מערבית
- מערבבים 15 μL של קלט (משלב 1.1.6) או זרימה-דרך (משלב 1.1.10) דגימות עם 5 μL של מאגר 4x Laemmli. כניסת חום ודגימות זרימה במשך 5 דקות ב 95 ° c. עבור דגימות משתמט 8 מ ' אוריאה/100 מ"מ גליצין pH 2.9, מערבבים 15 μL של הללויה עם 5 μL של מאגר 4x Laemmli, וחום עבור 5 דקות ב 95 ° c.
הערה: שלב זה אינו הכרחי עבור דגימות המודערות במאגר 2x Laemmli. - טעינת בארות של 4-20% SDS/דף ג ' ל עם 2.5 μL של קלט, 2.5 μL זרימה-through, ו 20 μL של דגימות משחרלי, ולטעון את סולם החלבון לפי המלצת היצרן.
הערה: בחר ג'ל% בהתאם למשקל המולקולרי של חלבון הריבית. - הפעל SDS/PAGE ב 150 V עבור 30-45 דקות במאגר פועל, או עד הצבע הכחול של מאגר Laemmli הוא בסוף ג'ל.
הערה: זמן ההפעלה עשוי להשתנות בהתאם לציוד המעבדה. - הסירו את הג מלוחות הזכוכית (או הפלסטיק) והשתזפו במאגר העברה למשך 15 דקות.
- העבר את החלבונים כדי polyvinylidene difluoride (PVDF) קרום או ניטרוצלולוזה קרום. השתזפו בקרומים ובנייר סינון 3 מ"מ במאגר ההעברות. להרכיב סנדוויץ ' עם שלושה גיליונות של נייר סינון, ניטרוצלולוזה קרום PVDF, ג'ל, ו שלושה גיליונות נוספים של נייר סינון. ודא שאין בועות אוויר לכודים בכריך. השתמש רולר כדי להסיר בועות במידת הצורך. הגדר את הקרום על הקתודה ועל הג בצד האנודה של הקלטת.
הערה: בדוק את הוראות יצרן הממברנה לקבלת מידע על הפעלת קרום או הכנה לכתם. - הצב את הקלטת המכילה את הכריך במיכל ההעברות עם מאגר העברה. מניחים את המיכל בדלי קרח או ב -4 ° צ' (למשל, בחדר הקריר). העברת חלבונים ב 100 V עבור 1 h (הנוכחי משתנה בין 200-400 mA). לחלופין, העבירו לילה בזרם קבוע של 15 מא ' בשעה 4 ° c.
- הסר את הקרום מתוך הקלטת. מודלת את הקרום ב 6% חלב יבש ללא שומן מדולל PBS עם 0.05% של polysorbate 20 (PBS-T), או פתרון חסימה תואמת, עבור 1 h ב RT כדי לחסום את הקרום.
הערה: לפני חסימת הקרום, ניתן לבדוק את איכות ההעברה באמצעות הכתם של פוננסו. הרפידת את הקרום במשך 1 דקות ב-15 מ ל של פוננסו S, שטפו במים ודמיינו להקות. - להסיר את הפתרון חסימה מודלת את הקרום עבור 1 h ב RT עם 50 rpm סיבוב בנוגדנים העיקרי מדולל ב 6% חלב יבש שומן מדולל ב-PBS-T. לחילופין, ממברנה דגירה לילה ב 4 ° צ' עם סיבוב 50 rpm.
הערה: זמן הדגירה עשוי להשתנות בהתאם לאיכות הנוגדנים; עם זאת, רוב הנוגדנים יעבדו עם 1-3 incubations h ב-RT. בצע את ההמלצה של היצרן על הריכוז נוגדנים או דילול. - לשטוף את האבן על ידי דגירה את הקרום ב-PBS-T עבור 5 דקות עם 50 rpm סיבוב ב RT. חזור על ההליך 3-5 פעמים. ניתן לקבל עוד שוטפים בהתאם לאיכות הנוגדנים.
- הממברנה הקרום בחזרת peroxidase (HRP)-מצועם נוגדנים משנית עבור 1 h ב RT ב 6% חלב יבש ללא שומן מדולל PBS-T עם 50 rpm סיבוב.
הערה: עקוב אחר המלצת היצרן לגבי הריכוז או הדילול של נוגדנים. - שטוף את האבן החשופה כפי שמצוין בשלב 1.2.9.
- הוסיפו את המצע הכימי. כדי לכסות את הקרום הסר את עודפי המצע ואת הדגירה עבור 5 דקות ב-RT בחושך.
הערה: בדוק את הוראות היצרן להמלצות על הריאגנטים הכימי. - לכוד את אות הכמימיננטאנאת. בעזרת האימגר המבוסס על מצלמה לחילופין, השתמש בסרט רנטגן כדי ללכוד את האות הכימי.
- מערבבים 15 μL של קלט (משלב 1.1.6) או זרימה-דרך (משלב 1.1.10) דגימות עם 5 μL של מאגר 4x Laemmli. כניסת חום ודגימות זרימה במשך 5 דקות ב 95 ° c. עבור דגימות משתמט 8 מ ' אוריאה/100 מ"מ גליצין pH 2.9, מערבבים 15 μL של הללויה עם 5 μL של מאגר 4x Laemmli, וחום עבור 5 דקות ב 95 ° c.
2. ניתוח מחייב החלבונים באמצעות כרומטוגרפיה של אהדה וספקטרומטר מסה
- צמיחת תאים, לליזה וכרומטוגרפיה של זיקה
- הגדל תאים T. brucei לשלב באמצע היומן ולפקח על הכדאיות וצפיפות התא.
הערה: סך של 1.0 x 10 תאים מספיק עבור שני מחייב כריכה. שימוש בפחות תאים מאשר המצוין כאן עלול להשפיע על איתור חלבונים שפע נמוך על ידי ספקטרומטר מסה.- עבור הטפסים במחזור הדם של T. brucei , לגדול תאים בשלב באמצע יומן (8.0 x 105-1.6 x 106 תאים/mL) ב hmi-9 מדיה בתוספת 10% fbs ב 37 ° צ' ו עם 5% CO2. עבור 427 זן, 5 L של התרבות תניב 0.5-1.0 x 1010 תאים. נטר את צמיחת התאים כדי למנוע צפיפות גבוהה יותר מ-1.8 x 106 תאים/mL אשר עשויים להשפיע על הכדאיות של התא. שמור את נפח התרבות הסלולרית ל-1/10 של נפח הבקבוקון; אחרת, שיעור הצמיחה של התאים יושפעו עקב האנטנה המסכנה.
הערה: למתח 427 יש זמן הכפלה של 5.5-6.5 h. - עבור צורות procyclic, לגדול תאים ב SDM-79 בינוני בתוספת 10% FBS ב 27 ° צ' ולשמור על צפיפות התא בין 1.0 x 107 ו 3.0 x 107 תאים/mL. 500 מ ל של התרבות תניב 0.5-1.5 x 1010 תאים.
- עבור הטפסים במחזור הדם של T. brucei , לגדול תאים בשלב באמצע יומן (8.0 x 105-1.6 x 106 תאים/mL) ב hmi-9 מדיה בתוספת 10% fbs ב 37 ° צ' ו עם 5% CO2. עבור 427 זן, 5 L של התרבות תניב 0.5-1.0 x 1010 תאים. נטר את צמיחת התאים כדי למנוע צפיפות גבוהה יותר מ-1.8 x 106 תאים/mL אשר עשויים להשפיע על הכדאיות של התא. שמור את נפח התרבות הסלולרית ל-1/10 של נפח הבקבוקון; אחרת, שיעור הצמיחה של התאים יושפעו עקב האנטנה המסכנה.
- צנטריפוגה את התאים ב 1,600 x g עבור 15 דקות ב RT. להשליך את supernatant ולהשעות את הגלולה ב 200 ML של PBS-g מחומם מראש ב 37 ° c. השימוש עגול התחתון צינורות צנטריפוגה (טבלה של חומרים) כי T. brucei מחזור הדם טופס כדורי מופרע בקלות כאשר משתמשים ברוטור צנטריפוגה בזוית קבועה. צנטריפוגה את התאים שוב ב 1,600 x g עבור 5 דקות ב RT.
- והשהה מחדש את הגלולה. ב -10 מ ל של PBS-ג'י צנטריפוגה את התאים ב 1,600 x g עבור 5 דקות ב RT. חזור על ההליך ולאחר השטיפה הסופית, מחק את הסופרנטאנט.
הערה: כדורי עשוי להיות פלאש קפוא בחנקן נוזלי ומאוחסן ב-80 ° c או חנקן נוזלי. - השהה מחדש את הגלולה בתא 5 מ ל של מאגר הליזה לפני מקורר בקרח ושיושלם עם מעכב 1.5 x הפרוטאז מעכבי ו-1x פוספאטאז מעכבי קוקטייל (טבלת חומרים). מודטה הליפוסט עבור 10 דקות ב 4 ° c מסתובבת ב 50 סל ד.
- צנטריפוגה את הליפוסט ב 10,000 x g עבור 10 דקות ב 4 ° c. לאסוף את supernatant (חלבונים מסיסות) ולדלל אותו 20 מ ל של מאגר מחייב.
- לאסוף 400 μL של שב ס או מעלה באוב חרוזים agarose (כלומר, 400 μL של שאיפה) או 400 μL של חרוזי שליטה, צנטריפוגה עבור 1 דקות בשעה 1,000 x g ב RT. להיפטר supernatant ולהשעות מחדש בתוך 400 μl של מאגר מחייב כדי לequiאת החרוזים. השתמש חרוזים agarose כפקד שלילי כדי לקבוע העשרה ספציפיים של החלבון מטבוליזם אינטראקציות לעומת אינטראקציות לא ספציפיות (למשל, חלבונים כי לאגד לא במיוחד את החרוזים). השתמש ב-IPs או ב-"פיס" עם תצורות פוספט שונות, כולל צורות לא-זרחמות לשליטה על אינטראקציות לא ספציפיות עקב מטעני פוספט או קשירה לביוטין.
- הוסף 400 μL של IP/PI חרוזים או חרוזי בקרה ל 10 מ ל של ליפוסט ו-דגירה עבור 1 h, או לילה, ב 4 ° c מסתובבת ב 50 סל ד. אם השימוש ב-IPs או ב-הפיס מצועם עם ביוטין בלבד (ללא חרוזים) המשך לשלב 2.1.7.1, אחרת המשך לשלב 2.1.8.
- הוסף 100 μL של streptavidin-מעלה מעלה על חרוזים מגנטיים והדגירה עבור 1 h ב 4 ° c מסתובבת ב 50 סל ד.
- צנטריפוגה את תגובת האיגוד במשך 1 דקות ב 1,000 x g ב -4 ° c. הסר את הסופרנטנט (זרימה) ושמור את הגלולה. שמרו 5% מתוך הסופרנטאנט לניתוח כתמי אבן מערבית.
- הוסף 5 מ ל של מאגר כביסה לתוך הגלולה, לערבב בעדינות על ידי התערבל הצינור, ולאחר מכן צנטריפוגה עבור 1 דקות ב 1,000 x g ב 4 ° c. . מחק את הסופרנטאנט . חזור על הכביסה חמש פעמים אם שימוש בחרוזים מגנטיים, לאסוף supernatants ולבצע שוטף באמצעות עמדה מגנטית (centrifugations אינם נחוצים).
- הוסף 50 μL של מאגר 2x Laemmli (או 8 M שתנן/100 מ"מ גליצין pH 2.9, כדי למנוע שימוש ב-SDS) על חרוזים ולערבב על ידי הקשה או מערבולת (להימנע ללטף כי חרוזים יכולים לצרף לטיפים הפיפטה), ולאחר מכן חום ב 95 ° צ' עבור 5 10,000 דקות ולאסוף את ה-סופרנטנט (חלבונים מאלגנים). חזור על ההליך פעמיים כדי לאסוף סך של שלושה שברים.
- הקפא את המנוע ב-80 ° c, אחרת הפרידו חלבונים ב-SDS/PAGE או המשיכו בפתרון לטריסינזציה ולניתוח ספקטרומטר המסה.
- הגדל תאים T. brucei לשלב באמצע היומן ולפקח על הכדאיות וצפיפות התא.
- טריפסין העיכול של חלבונים לספקטרומטר מסה
הערה: שתי וריאציות של הליך זה מוצגות עבור סעיף 2.2.1 (ב ג'ל) או סעיף 2.2.2 (בפתרון) העיכול של חלבונים. מומלץ למנוע הפסדים לדוגמה. התייעץ עם כימאי אנליטי במתקן פרוטקומקס את ההתאמה של פרוטוקול עבור דגימות ומכשירי ספקטרומטר מסה זמין.- טריסינטזציה של חלבונים בתוך-ג'ל
- לאחר הפרדת החלבון ב-SDS/PAGE, שטוף בקצרה את הג במים בעלי טוהר גבוה. להעביר את הג על צלחת זכוכית נקייה. להקות חלבון בלו עם להב נקי ולהימנע מקיצוץ ג'ל נוסף מחוץ ללהקות. חותכים את חתיכות ג'ל לחתיכות קטנות (כלומר, כ 1 מ"מ מרובע) ולהעביר אותם לתוך צינור 1 מ ל. השתמשו בעצת פיפטה במידת הצורך, אך ודאו שטיפ הפיפטה שוטפים באתנול לפני השימוש.
הערה: השתמש בכפפות כדי למנוע זיהום ג'ל. חתיכות ג'ל ניתן לאחסן ב-20 ° c. - הוסף 100 μL של מים בעלי טוהר גבוהה או ביצועים גבוהים כרומטוגרפיה נוזלית צינורות לשטוף חתיכות ג'ל. . להשליך את המים
- עבור Coomassie או רותניום מבוססי פלורסנט בחתיכות ג'ל ויטראז ', מודות את חתיכות ג'ל בפתרון destaining (25 מ"מ NH4hco3 ב 50% acetonitrile) עבור 1 h, ואז למחוק את הפתרון. חזור על ההליך עד שהצביעת לא תהיה גלויה.
הערה: הכנת פתרונות המכילים NH4hco3 על ידי דילול מתוך פתרון מניות ב 100 mM NH4hco3, pH 7.8.
התראה: Acetonitrile הוא ממיס נדיפים, דליק רעיל. NH4hco3 יכול לגרום גירוי בעור או בעין. להשתמש בכפפות ולעבוד תחת כיסוי כימי. - עבור חתיכות ג'ל ויטראז ', חתיכות ג'ל דגירה ב 50 μL של מחיקת הפתרון לכתם כסף (15 מ"מ K3[FE (CN)6], 50 mM Na2S2O3) במים עבור 30 דקות. למחוק את הפתרון ולשטוף חתיכות ג'ל עם 200 μl של מים. חזור על השטיפה חמש פעמים או עד שהצבע הצהוב של ג'ל לא ייראה.
התראה: K3[FE (CN)6] עלול לגרום לגירוי בעור או בעיניים. . תשתמש בכפפות
- עבור Coomassie או רותניום מבוססי פלורסנט בחתיכות ג'ל ויטראז ', מודות את חתיכות ג'ל בפתרון destaining (25 מ"מ NH4hco3 ב 50% acetonitrile) עבור 1 h, ואז למחוק את הפתרון. חזור על ההליך עד שהצביעת לא תהיה גלויה.
- מייבשים את חתיכות ג'ל באמצעות 200 μL של acetonitrile עבור 10 דקות ב RT. לאחר מכן, בטל את הפתרון.
הערה: פריטי ג'ל יבשים קטנים יותר בנפח, אטום ודביק. אם כמה חתיכות ג'ל משולבים בצינור אחד, לחזור על ההליך להתייבשות יעילה של חתיכות ג'ל. - הוסף 50 μL (או נפח מספיק כדי לכסות את חתיכות ג'ל) של הפחתת פתרון (10 מ"מ dithio, [DTT] ב 100 mM NH4hco3) ו דגירה ב 56 ° צ' עבור 1 h. לאחר מכן, קריר את הצינורות כדי RT ולמחוק את העודף של פתרון הפחתת.
- הוסף 50 μL (או נפח מספיק כדי לכסות את חתיכות ג'ל) של פתרון האלקיללציה (50 mM iodoamide ב 100 mM NH4hco3) ו דגירה עבור 30 דקות ב RT בחושך. לאחר מכן, השמט את. פתרון האלקיללציה
- מייבשים את חתיכות ג'ל עם 200 μL של acetonitrile עבור 10 דקות ב RT. הסר את הצ ומימה את חתיכות ג'ל עם 100 mM NH4hco3 עבור 10 דקות ב rt.
- מייבשים את חתיכות ג'ל שוב עם 200 μL של acetonitrile עבור 10 דקות ב RT ולמחוק את העודף של הפתרון.
- הוסף 15 μL של המסה ספקטרומטר כיתה טרימטריה מדולל בשנת 50 mM NH4hco3 מאגר, או נפח מספיק כדי לכסות חתיכות ג'ל ומודלת עבור 4 h, או לילה, ב 37 ° c. שמרו על טריפסין כמויות מוחלטת בין 100 ל-500 ng (או 20 מלטריפסין/μg של חלבון).
- מגניב את הדגימה ל RT, ואת צנטריפוגה עבור 1 דקות ב 2,000 x g ב מיקרוצנטריפוגה. הוסף 10-20 μl של 5% החומצה פורמית מדולל במים ו דגירה עבור 10 דקות ב RT.
התראה: חומצה פורמית היא דליק, מאכל ורעיל. להשתמש בכפפות ולעבוד תחת כיסוי כימי. - צנטריפוגה כפי שצוין בשלב 2.2.1.9, ולאחר מכן לאסוף את supernatant (מכילים פפטידים מחולץ) לצינור אחר. הוסף 20 μl של 5% חומצה פורמית מדולל ב 50-60% acetonitrile לצינור ו דגירה עבור 10 דקות ב RT. לאסוף שברים פפטיד שחולצו באותה צינורית.
- יבש את המדגם בתוך מרכז ואקום ומהווים מחדש ב 10 μL של 0.5% חומצה אצטית 2% acetonitrile עבור ניתוח הספקטרומטר ההמוני. צנטריפוגה ולאסוף את הפתרון בתחתית הצינור; פתרון החנות ב-20 ° צ' או-80 ° c.
- לאחר הפרדת החלבון ב-SDS/PAGE, שטוף בקצרה את הג במים בעלי טוהר גבוה. להעביר את הג על צלחת זכוכית נקייה. להקות חלבון בלו עם להב נקי ולהימנע מקיצוץ ג'ל נוסף מחוץ ללהקות. חותכים את חתיכות ג'ל לחתיכות קטנות (כלומר, כ 1 מ"מ מרובע) ולהעביר אותם לתוך צינור 1 מ ל. השתמשו בעצת פיפטה במידת הצורך, אך ודאו שטיפ הפיפטה שוטפים באתנול לפני השימוש.
- בפתרון טריזיזציה של חלבונים
- מזרז חלבונים כדי להפחית את הנפח, התפלה, וחילופי מאגר. הוסף שישה כרכים של מקורר (-20 ° c) אצטון למדגם, למשל, 600 μL של אצטון כדי 100 μL של דגימה. מערבולת ומודקון ב-20 ° c עבור 15 דקות עד 1 h. הפתרון יהפוך להיות מעורפל או ליצור מזרז.
זהירות: אצטון רעיל ודליק. להשתמש בכפפות ולעבוד תחת כיסוי כימי. - דגימות צנטריפוגה ב 4 ° c עבור 30 דקות. Decant אצטון ואוויר יבש את הגלולה עבור 15 דקות.
- הוסף 10 μL של 6-8 M אוריאה או 1% SDS ב 50 mM NH4hco3 לפזר את הגלולה ואת המערבולת לערבב. עבור כמויות גדולות יותר של חלבונים (> 10 μg), להשתמש עד 20 μL של מאגר הפירוק.
- הוסף 5 μL של הפחתת פתרון ומערבולת. תוריד את הווליום. בעזרת מיקרוצנטריפוגה אם הדגימות מדוללת באוריאה, אז הדגירה עבור 1 h ב RT. אם הדגימות מדולדלים ב-SDS, לאחר מכן מודלת עבור 1 h ב 56 ° c.
- תוריד את הווליום. בעזרת מיקרוצנטריפוגה הוסף 3 μL של פתרון אלקיללציה ומערבולת. לאחר מכן, לסובב את עוצמת הקול למטה הדגירה בחושך עבור 30 דקות ב RT.
- הוסף 3 μL של הפחתת פתרון כדי לנטרל את התגובה. לאט לדלל את המדגם 1 M אוריאה או 0.05% SDS באמצעות 50 mM NH4hco3.
הערה: מאגר העיכול של טריפסין חייב להיות כביסה או ניקוי. מגבלות הריכוז של הדאצורנים הן: 0.05% SDS; 0.1% אוקטיל ב-D-גלוקופיסוסייד; 0.1% 4-ללא שאילפניקסיל-פוליאתילן גליקול; 0.1% t-octylphenoxypolyethoxyethanol; 0.1% פוליפbate 20; 0.1% 3-[(3-cholamidopropyl) dimethlammonio] -1-propane,; . < 1 מ אוריאה או טאוראה - הוסף 5 μL של טרימטריה כיתה מאסיבית המוניים מדולל ב50 mM NH4hco3 מאגר ו מודונט עבור 4 h, או לילה, ב 37 ° c. שמרו על מספר טריפסין כמויות בין 100 ו-500 ng (או 20 מנג טריפסין/μg של חלבון).
- לצנן את המדגם כדי RT, ולסובב את עוצמת הקול באמצעות מיקרוצנטריפוגה. הוסף 5% חומצה אצטית (או חומצה פורמית 5% ב 50% acetonitrile) כדי להרוות את התגובה.
- נגב את הדגימות בתוך מרכז ואקום כפי שמצוין בשלב 2.2.1.11. דגימות מהחנות ב-80 ° c. Desalt ו פפטידים להתרכז באמצעות עמודה הפוכה השלב כמו סי18 zip-עצה ולאחר מכן לנתח על ידי ספקטרומטר מסה.
- מזרז חלבונים כדי להפחית את הנפח, התפלה, וחילופי מאגר. הוסף שישה כרכים של מקורר (-20 ° c) אצטון למדגם, למשל, 600 μL של אצטון כדי 100 μL של דגימה. מערבולת ומודקון ב-20 ° c עבור 15 דקות עד 1 h. הפתרון יהפוך להיות מעורפל או ליצור מזרז.
- טריסינטזציה של חלבונים בתוך-ג'ל
תוצאות
אנליזה של RAP1 ו-PI (3, 4, 5) P3 אינטראקציה באמצעות כרומטוגרפיה של אהדה ובלוק מערבי
דוגמה זו ממחישה את היישום של שיטה זו כדי לנתח את הכריכה של RAP1 מ t. brucei ליפוסט או על ידי רקומביננטי t. brucei RAP1 חלבון. ליזוטים של T. brucei מחזור הדם צורות לבטא hemagglutinin (HA)-מתויגים RAP1 שימשו בכריכה assays. RAP1 הוא חלבון מעורב השליטה transcript של פני השטח של שונות גליקופרוטאין (vsg) גנים3,48, אשר קידוד עבור חלבונים פני השטח מעורב התחמקות החיסונית טפיל על ידי וריאציה העברה אנטיגנית49. RAP1 אינטראקציה בתוך קומפלקס החלבון telomeric עם פוספולידיליליניום 5-פוספטאז (PIP5Pase) אנזים3, אשר גם פונקציות בשליטה של שעתוק vsg גנים1,3. RAP1 יש סרטן השד N-מסוף 1 carboxyl-טרמינל (brct) התחום אשר ואחריו מיאלואובלסטוזיס (myb) התחום המחייב ה-DNA ו-C-טרמינל myb-תחום כמו3,48. עם זאת, אין לו קבוצות מחשבים כריכה קאנונית. כריכה מספרת הוצעו עם הפיס כי הם לא זרחונים או הם זרחונים בתנוחות שונות של הטבעת אינוזיטול, עם חרוזים שאינם מצובטים מעלה. הניתוח המערבי מראה כי RAP1 נקשר המועדפת ביותר PI (3, 4, 5) P3-חרוזים (איור 3A), אבל זה גם נקשר במידה פחותה יותר PI (4, 5)-חרוזים P2. עם זאת, זה לא לאגד לחרוזים אחרים הפיס או agarose. בגלל RAP1 הוא חלק מורכבת מרובת חלבון3, האינטראקציה שלה עם כמה מהפיס לא יכול להיות ישיר ולכן התוצאות של RAP1-HA אינטראקציה עם חלבונים סלולריים אחרים הכרוך ל-פיס.
מכאן, כדי לבדוק אם RAP1 נקשר ישירות ל-פיס, C-סופני מתויג 6x-שלו רקומביננטי RAP1 (rRAP1) חלבון ביטא וטוהר הומוגניות של E. coli3. החלבון שימש בכריכת הכריכה עם PI (3, 4, 5) P3-חרוזים בנוכחות של ריכוזים מתחרים של PI (3, 4, 5) P3 או PI (4, 5) P2. בלוק מערבי מראה כי ריכוזים גוברת של PI (3, 4, 5) P3, אבל לא PI (4, 5) P2 מעכב את האינטראקציה של rRAP1 עם PI (3, 4, 5) P3 (איור 3ב). יתר על כן, התוספת של T. brucei מטוהרים PIP5Pase האנזים לתגובה שוחזר PI (3, 4, 5) P3-מחייב על ידי rRAP1, אשר בשל PIP5Pase dephosphorylation של PI חינם (3, 4, 5) P33 ולכן מציין כי תבנית זירחון של זה מטבוליט חיוני עבור איגוד rRAP1. מכאן, rRAP1 אינטראקציה עם PI (3, 4, 5) P3 כפי שהוא עושה RAP1-HA מ T. brucei ליסטט. יתר על כן, הנתונים מראים כי האיגוד של RAP1-HA מ lysate כדי PI (4, 5) P2 כנראה תוצאה של אינטראקציה RAP1 עם חלבונים אחרים במתחם (למשל, PIP5Pase)3. הנתונים מדגימים את השלמת הכריכה של מחייב עם תאי ליטים וחלבונים רקומביננטי. זה גם מראה את השירות של מחייב תחרותי בחני לקבוע את הספציפיות של אינטראקציות בין חלבונים ו-פיס.
זיהוי של Ins (1, 4, 5) P3 מאגד חלבונים באמצעות כרומטוגרפיה של זיקה וספקטרומטר מסה
בדוגמה זו, נעשה שימוש בכרומטוגרפיה של אהדה לאחר השימוש בספקטרומטר המסה כדי לזהות חלבונים של T. brucei התאגד ל-Ins (1, 4, 5) P3; לפיכך, הניסוי סוקר את היכולות הפוטנציאליות (1, 4, 5) P3 מחייב חלבונים מפני טפסי הדם של T. brucei . T. brucei ליפוסט היה מודרט עם Ins (1, 4, 5) P3 מצופחת חרוזים או עם חרוזים לא מצובית (משמש שליטה), וחלבונים מאוגדים היו שרוט עם מאגר לדוגמה Laemmli. SDS/עמוד ניתוח מראה העשרה בחלבונים שמודלים מ-Ins (1, 4, 5) P3-חרוזים לעומת חלבונים שמודלים מן הבקרה agarose חרוזים (איור 4א). ניתוח ספקטרומטר מסה של חלבונים שזוהו מעל 250 חלבונים, אשר 84 העשירו עם Ins (1, 4, 5) P3 חרוזים לעומת חרוזי בקרה (איור 4B, שינוי מקפלים [FC] ≥ 2, p < 0.05). העשרת החלבונים המאוגדים ל-Ins (1, 4, 5) P3 בהשוואה לחרוזי בקרה עם אות החלבון שזוהה על ידי SDS/PAGE. הנתונים כוללים חלבונים שאומתו לאגד (1, 4, 5) P3 וחלבונים אשר מנגנונים של איגוד ל-Ins (1, 4, 5) P3 אינם ידועים8. יתר על כן, ה-Ins (1, 4, 5) P3 כריכה פרוטאום שונה במידה רבה מתוך זה של Ins (1, 3, 4, 5) P4 ואחרים פיס8, אשר מרמז כי חלק מהחלבונים הללו מכירים את תצורת פוספט מסוים של Ins (1, 4, 5) P3. לפיכך, biotin-מתויג Ins (1, 4, 5) P3 יכול לשמש עבור כרומטוגרפיה זיקה בשילוב עם ספקטרומטר המסה כדי לזהות חלבונים התאגד ל-Ins (1, 4, 5) P3. ניתן לחקור את הגישה כדי לזהות חלבונים התאגד לשב ס אחרים או לפיס3,8,46,47.

איור 1 : בעלי אהדה לכריכה מחייבת. (א) PI (3, 4, 5) P3 (למעלה) ו-Ins (1, 4, 5) P3 (למטה) מצומנת לביוטין במיקום sn1 של האינוסיטול. ב PI (3, 4, 5) P3, ביוטין מצומדת לשרשרת השומנים במיקום sn1 של inositol, ואילו בתוך Ins (1, 4, 5) P3 הביוטין מצושלת הפוספט במיקום sn1. (ב) תוספות (1, 4, 5) P3 מצומנת בביוטין ונלכדה באמצעות קשירה לstreptavidin מצומנת לחרוזים (לדוגמה, מחרוזות או חרוזים מגנטיים). וריאציות של ריאגנטים אלה באמצעות משתמשים מסונתז מותאם אישית המחליף את ביוטין הם גם אפשריים46. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
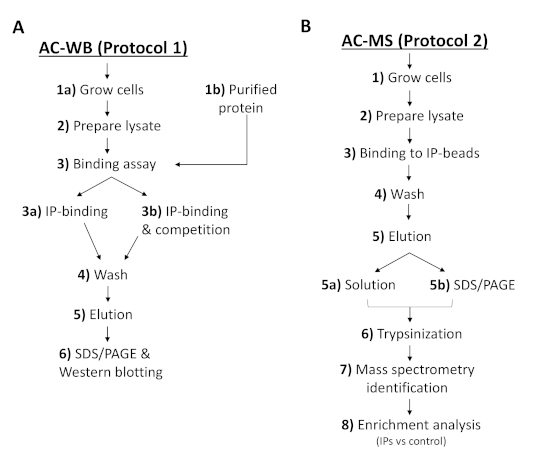
איור 2 : זרימת העבודה של פרוטוקולים מתארת את השלבים לניתוח של אינטראקציה IP או PI של זיקה עם חלבונים של T. brucei וזיהוי על ידי (א) מערבי הספקטרוקטימטריה או (ב) ספקטרומטר מסה. AC-WB, כרומטוגרפיה של אהדה ובלוק מערבי; AC-MS, כרומטוגרפיה של אהדה וספקטרומטר מסה. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 3 : הכריכה של T. brucei RAP1 לפוספיונוסיידים. (א) lysates של T. brucei (5.0 x 107 טפילים) כי לבטא HA-tagged RAP1 היו מודבטים עבור 2 h ב 4 ° c עם 50 μl של פיס (כל 1 מ ג של חרוזים של agarose המכיל 10 nmol של מעלה מצוח) או agarose (Ag) חרוזים. תגובת הקשירה נשטפה והופרדה עם 2 x Laemmli לדוגמה מאגר מחומם ב 95 ° צ' עבור 5 דקות. חלבונים הופרדו ב 4-20% SDS/עמוד, הועברו קרום PVDF, ובדק עם נוגדנים חד שבטיים anti-HA (1:5000, מדולל ב 6%-חלב PBS) ואחריו על ידי אנטי עכבר IgG-HRP (1:5000, מדולל ב 6%-החלב PBS), וזוהה על ידי כימויומימיננציה. (ב) אחד μg של rRAP1 היה מודבטים עבור 1 h ב RT עם 50 μl של PI (3, 4, 5) P3-agarose חרוזים בנוכחות או היעדרות של 5 כדי 50 μm dioctanoylglycerol (DIC8) PI (3, 4, 5) P3, 20 עד 50 Μm diC8 pi (4, 5) P2, או 50 Μm diC8 pi (3, 4, 5) P3 ו 250 PIP5Pase מטוהרים ממחזור הדם של T. brucei טפסים3. הכריכה נותחה על ידי הכתמים המערביים עם העכבר נגד הנוגדנים האנטי-שבטיים (1:2000, מדולל ב-6% מחלב PBS) ופותח על ידי כימוצ. דמות זו שונתה מ-Cestari et al.3. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 4 : כרומטוגרפיה של אהדה וניתוח הספקטרומטר מסה של חלבונים T. brucei התאגד ל-Ins (1, 4, 5) P3. (א) 10% sds/ניתוח דף של חלבונים T. brucei התאגד ל-Ins (1, 4, 5) P3 חרוזים או חרוזים. Lysates של 5.0 x 109 טפילים היו מודבטים ב 4 ° c עבור 2 h עם 400 Μl של Ins (1, 4, 5) P3 מצופחת חרוזים או עם חרוזים מכיל ללא תוספות (1, 4, 5) P3 [1 מ ל של חרוזים מכילים 10 nmol של מצופני מעלה (1, 4, 5) P3]. התגובה הכבילה נשטפה, הרקיעה ב 2 x Laemmli לדוגמה מאגר מבושל 5 דקות ב 95 ° c. חלבונים הופרדו ב-10% SDS/PAGE והוכתם בצביעת Coomassie (טבלת חומרים). ראשי חץ מראים חלבונים המועשר ב-Ins (1, 4, 5) P3-חרוזים בהשוואה לחרוזי agarose; עיגולים מצביעים על חלבונים הקיימים בשני הצדדים (1, 4, 5) P3 חרוזים וחרוזים, והסוגר מציין חלבונים המצויים בשניהם אך מועשרים ב-Ins (1, 4, 5) P3 חרוזים בהשוואה לחרוזי agarose. (ב) נקודה-עלילה מראה חלבונים המזוהים על ידי ספקטרומטר המסה המועשרת ב-Ins (1, 4, 5) P3-חרוזים בהשוואה לחרוזי agarose. העשרה המוגדרים על ידי FC > 2 ו -p-value < 0.05. ארבעה משכפל ביולוגי שימשו לאגקם-חרוזים AC-MS, ושלושה משכפל ביולוגי עבור IP3-מחרוזות AC-MS. מקפלים-שינוי של חלבונים שזוהו IP3-חרוזים vs agarose-חרוזים חושבה באמצעות האינטנסיביות ספקטרום של פפטיד באמצעות MSstat50. תוצאות מפורטות ורשימה של פפטידים זמינים8. נתונים בעלי ספקטרומטר מסה מופרומטריה זמינים גם עם מזהה PXD005907 דרך ה-פרוטאוצ'יינג Consortium דרך מאגר השותפים של גאוות. דמות זו שונתה מ-Cestari et al.8. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
Discussion
הזיהוי של חלבונים התאגד ל-IPs או לפיס הוא קריטי להבנת התפקוד התאי של מטבוליטים אלה. כרומטוגרפיה של אהדה מצמידים לאבן החשופה המערבית או לספקטרומטר מסה מציעה הזדמנות לזהות את החלבונים באינטראקציה של IP או PI ומכאן לקבל תובנות על התפקוד הרגולטורי שלהם. שב ס או פיס כימית מתויג [למשל, Ins (1, 4, 5) P3 כימית מקושרים biotin] ו מקושרות לחרוזי agarose דרך streptavidin או נתפס על ידי חרוזים streptavidin מגנטיים מאפשר את הבידוד של אינטראקציה חלבונים אשר יכול להיות מזוהה על ידי המוני ספקטרומטריה או אבן חשופה מערבית. הפרוטוקולים המתוארים כאן שימשו לזיהוי חלבונים מ -T. brucei3,8 ו תאים מאמליות47 כי לאגד אלה מטבוליטים. וריאציות של הגישה המשתמשת תגים מותאמים אישית (מלבד biotin) היו גם בשימוש שמרים46. שיקול חשוב בגישה זו הוא השימוש בפקדים כדי להפלות מסוימות מאינטראקציות שאינן ספציפיות. חרוזים לא מצובטים הם שליטה חיונית, אבל פקדים נוספים עשויים לכלול בלתי זרחה1 ו-האינוזיטול מעלה מבטים חרוזים3. שב ס או פיס עם שילובי פוספט שונים3,8 יכול לשמש גם כי כריכת חלבונים אלה מטבוליטים עשויים לכלול תחומים להפלות את תצורת פוספט של אינוזיטול38, 39,40,41. בנוסף, מורכבות לדוגמה עלולה להשפיע על רגישות הגישה, ולכן ירידה במורכבות המדגם באמצעות שבירה לדוגמה עשויה לסייע לגילוי חלבונים שופע נמוך בתא. ישנם פרוטוקולים מבוססים היטב עבור משבר התאים ובידוד של המיטו,51, גרעין52, גלילחלק53, ו פלגסטאללום54,55 מטריאנוזומים. שימו לב כי מאגרים וריאגנטים המשמשים בהתפרצות תת-תאית עשויים להתאים לתאימות עם מאגרים וריאגנטים המשמשים בפרוטוקול זה. בעיקר, הזיהוי של חלבונים התאגד ל-IPs או לפיס על-ידי כרומטוגרפיה של אהדה כפי שמצוין כאן תלוי החלבון והזיקה המטלילייט של אינטראקציה, ולכן חלבונים אשר יש זיקה חלשה עבור IPs או הפיס לא ניתן לזהות בקלות.
ניתוח של האינטראקציה IP או PI עם חלבונים מתוך תא ליפוסט עלול גם לגרום לזיהוי של חלבונים שאינם לאגד ישירות אלה מטבוליטים, אבל אילו אינטראקציה התוצאות של האגודה חלבונים במתחם עם חלבונים אחרים לאגד IPs או הפיס. תכונה זו היא לדוגמה באיור 3A, שבו RAP1-HA מ T. brucei ליפוסט נראה לאגד pi (3, 4, 5) P3-חרוזים ו PI (4, 5)-חרוזים P2. עם זאת, כריכת בחני עם שלו-מתויג rRAP1 להראות כי חלבון זה נקשר pi (3, 4, 5) P3 ולא PI (4, 5) P23. זה מומחש באיור 3B, שבו תחרותי בחני להראות כי בחינם pi (3, 4, 5) P3 אבל לא חינם pi (4, 5) P2 מתחרה עבור rRAP1-האינטראקציה שלו עם pi (3, 4, 5) P3-חרוזים. RAP1 לכאורה אינטראקציה עם PI (4, 5) P2-חרוזים הוא בשל האגודה RAP1 בתוך קומפלקס עם חלבונים לאגד PI (4, 5) P2 (למשל, PIP5Pase)3. מכאן, כריכה מחייבת מפני lysates עשוי לזהות חלבונים הקושרים ישירות או בעקיפין ל-IPs או לפיס. בעיקר, אינטראקציות עקיפות הן ברורות מאינטראקציות לא ספציפיות מאחר שהראשון עשוי להיות בעל פונקציה ביולוגית (בהקשר של מתחם החלבון) המשפיע או מושפע על ידי כריכת מטבוליט. לדוגמה, Ins (1, 4, 5, 6) P4 נקשר לקומפלקס מרובה-משנה של שיתוף-הפעולה, ומפקח על ההרכבה המורכבת ופעילות13. מכאן, חיוני לאמת אינטראקציות IP/PI עם חלבונים. האימות של האינטראקציה עשוי לכלול התחרות בחני עם עודף של IPs או הפיס (כמו באיור 3ב)3,8, מוטציות של מחשבים חלבון פוטנציאליים56, או השימוש של חלבונים מטוהרים כדי ל קבוע אינטראקציות ישירות (איור 3א, ב)3.
שיטות אחרות לחקר חלבונים ואינטראקציות IP או PI כוללות את הכריכה של חלבונים כדי radiolabeled או הפיס, השימוש ב-IPs או בפיס לקרומים הידרופובי כבטריצות של לכידת חלבונים, או כריכת חלבונים ל-"פיס" המשולבת בתוך ליפוזומים 42 , 57 , 58. הדבר החשוב ביותר, אם האינטראקציה עם החלבון עם הפיס דורשת מבני ממברנה38, ניתן להשתמש בתוספות מבוססות-ליפומין כגישה משלימה. מגבלות גישות אלה כוללות תפוקה נמוכה, רגישות נמוכה, האוריינטציה הכימית הבלתי ידועה של IPs אוהאגודה ל58 מטריצות, או שימוש בחומרים רדיואקטיביים42. השיטה המתוארת כאן רגישה, ליפופי-חינם, לא רדיואקטיבית, ו-IP/PI חרוזים הם זמינים מסחרית, ולכן הם אינם דורשים סינתזה כימית אישית. יתר על כן, המיקום של ביוטין מקושר IPs או פיס הוא מוגדר היטב, והוא יכול גם להיות שונה46,58, אשר מאפשר ניתוח מדויק של חלבונים ואינטראקציה מטבלייט. השיטה המתוארת כאן יכולה להיות גם בשילוב עם גישות כמותית של ספקטרומטר מסה כגון: תוויות איזוטופ יציבות של חומצות אמינו בתרבית תאים (SILAC)47, שניתן להשתמש בה כדי לזהות אינטראקציות דינמיות בסלולר שונות טיפולים או תנאים. כרומטוגרפיה של אהדה מצמידים לאבן החשופה המערבית או לספקטרומטר המסה סייעה לזהות חלבונים רבים של IP או PI-מחייב מ -T. brucei, תאים מיונקים ושמרים3,8,46, 47, כולל חלבונים שאינם מאופיינים בתחומים מסוימים של איגוד IP או PI, והיא סייעה גם לזהות תחומים של איגוד הרומן, למשל, PI (3, 4, 5) P3 תחום מחייב47.
בסך הכל, הפרוטוקולים המתוארים כאן ניתן להשתמש כדי לסקור את החלבונים הפוטנציאליים אינטראקציה IP או PI מ -T. brucei, וללמוד את האינטראקציה המולקולרית של חלבונים עם אלה מטבוליטים. ניתן להתאים בקלות את הפרוטוקול כדי לזהות חלבונים של IP או PI-binding מטפילים חד-תאיים אחרים או מאורגניזמים אחרים כגון תאים מיונקים47 ושמרים46, וזה יעזור להבין עוד יותר את הפונקציה הביולוגית של IPs ו . בסדר.
Disclosures
. לסופר אין מה לגלות
Acknowledgements
עבודה זו נתמכה על ידי מדעי הטבע והמועצה לחקר ההנדסה של קנדה (NSERC, RGPIN-2019-04658); השקת NSERC גילוי תוספת עבור חוקרים קריירה מוקדמת (DGECR-2019-00081) ועל ידי אוניברסיטת מקגיל.
Materials
| Name | Company | Catalog Number | Comments |
| Acetone | Sigma-Aldrich | 650501 | Ketone |
| Acetonitrile | Sigma-Aldrich | 271004 | Solvent |
| Ammonium bicarbonate | Sigma-Aldrich | A6141 | Inorganic salt |
| Centrifuge Avanti J6-MI | Beckman Coulter | Avanti J6-MI | Centrifuge for large volumes (e.g., 1L) |
| Centrifuge botles | Sigma-Aldrich | B1408 | Bottles for centrifugation of 1L of culture |
| Control Beads | Echelon | P-B000-1ml | Affinity chromatography reagent - control |
| D-(+)-Glucose | Sigma-Aldrich | G8270 | Sugar, Added in PBS to keep cells viable |
| Dithiothreitol (DTT) | Bio-Rad | 1610610 | Reducing agent |
| Dynabeads M-270 Streptavidin | ThermoFisher Scientific | 65305 | Streptavidin beads for binding to biotin ligands |
| EDTA-free Protease Inhibitor Cocktail | Roche | 11836170001 | Protease inhibitors |
| Electrophoresis running buffer | Bio-Rad | 1610732 | 25 mM Tris, 192 mM glycine, 0.1% SDS, pH 8.3 |
| Falcon 15 mL Conical Centrifuge Tubes | Corning Life Sciences | 430052 | To centrifuge 10 mL cultures |
| Formic acid | Sigma-Aldrich | 106526 | Acid |
| Glycine | Sigma-Aldrich | G7126 | Amino acid |
| HMI-9 cell culture medium | ThermoFisher Scientific | ME110145P1 | Cell culture medium for T. brucei bloodstream forms |
| Imperial Protein Stain | ThermoFisher Scientific | 24615 | Coomassie staining for protein detection in SDS/PAGE |
| Ins(1,4,5)P3 Beads | Echelon | Q-B0145-1ml | Affinity chromatography reagent |
| Instant Nonfat Dry Milk | Thomas Scientific | C837M64 | Blocking reagent for Western blotting |
| Iodoacetamide | Sigma-Aldrich | I6125 | Alkylating reagent for cysteine proteins or peptides |
| Lab Rotator | Thomas Scientific | 1159Z92 | For binding assays |
| LoBind Microcentrifuge Tubes | ThermoFisher Scientific | 13-698-793 | Low protein binding tubes for mass spectrometry |
| Nonidet P-40 (Igepal CA-630) | Sigma-Aldrich | 21-3277 | Detergent |
| PBS, pH 7.4 | ThermoFisher Scientific | 10010031 | Physiological buffer |
| Peroxidase substrate for chemiluminescence | ThermoFisher Scientific | 32106 | Substrate for Western bloting detection of proteins |
| PhosSTOP Phosphatase Inhibitor Cocktail Tablets | Roche | 4906845001 | Phosphatase inhibitors |
| PI(3)P PIP Beads | Echelon | P-B003a-1ml | Affinity chromatography reagent |
| PI(3,4)P2 PIP Beads | Echelon | P-B034a-1ml | Affinity chromatography reagent |
| PI(3,4,5)P3 diC8 | Echelon | P-3908-1mg | Affinity chromatography reagent |
| PI(3,4,5)P3 PIP Beads | Echelon | P-B345a-1ml | Affinity chromatography reagent |
| PI(3,5)P2 PIP Beads | Echelon | P-B035a-1ml | Affinity chromatography reagent |
| PI(4)P PIP Beads | Echelon | P-B004a-1ml | Affinity chromatography reagent |
| PI(4,5)P2 diC8 | Echelon | P-4508-1mg | Affinity chromatography reagent |
| PI(4,5)P2 PIP Beads | Echelon | P-B045a-1ml | Affinity chromatography reagent |
| PI(5)P PIP Beads | Echelon | P-B005a-1ml | Affinity chromatography reagent |
| Ponceau S solution | Sigma-Aldrich | P7170 | Protein staining (0.1% [w/v] in 5% acetic acid) |
| Potassium hexacyanoferrate(III) | Sigma-Aldrich | 702587 | Potassium salt |
| PtdIns PIP Beads | Echelon | P-B001-1ml | Affinity chromatography reagent |
| PVDF Membrane | Bio-Rad | 1620177 | For Western blotting |
| Refrigerated centrifuge | Eppendorf | 5910 R | Microcentrifuge for small volumes (e.g., 1.5 mL) |
| Sodium dodecyl sulfate | Sigma-Aldrich | 862010 | Detergent |
| Sodium thiosulfate | Sigma-Aldrich | 72049 | Chemical |
| SpeedVac Vacuum Concentrators | ThermoFisher Scientific | SPD120-115 | Sample concentration (e.g., for mass spectrometry) |
| T175 flasks for cell culture | ThermoFisher Scientific | 159910 | To grow 50 mL T. brucei culture |
| Trypsin, Mass Spectrometry Grade | Promega | V5280 | Trypsin for protein digestion |
| Urea | Sigma-Aldrich | U5128 | Denaturing reagent |
| Vortex | Fisher Scientific | 02-215-418 | For mixing reactions |
| Western blotting transfer buffer | Bio-Rad | 1610734 | 25 mM Tris, 192 mM glycine, pH 8.3 with 20% methanol |
| Whatman 3 mm paper | Sigma-Aldrich | WHA3030861 | Paper for Wester transfer |
| 2-mercaptoethanol (14.2 M) | Bio-Rad | 1610710 | Reducing agent |
| 2x Laemmli Sample Buffer | Bio-Rad | 161-0737 | Protein loading buffer |
| 4–20% Mini-PROTEAN TGX Precast Protein Gels | Bio-Rad | 4561094 | Gel for protein electrophoresis |
| 4x Laemmli Sample Buffer | Bio-Rad | 161-0747 | Protein loading buffer |
References
- Cestari, I., Stuart, K. Inositol phosphate pathway controls transcription of telomeric expression sites in trypanosomes. Proceedings of the National Academy of Sciences of the United States of America. 112 (21), 2803-2812 (2015).
- Odom, A. R., Stahlberg, A., Wente, S. R., York, J. D. A role for nuclear inositol 1,4,5-trisphosphate kinase in transcriptional control. Science. 287 (5460), 2026-2029 (2000).
- Cestari, I., McLeland-Wieser, H., Stuart, K. Nuclear Phosphatidylinositol 5-Phosphatase Is Essential for Allelic Exclusion of Variant Surface Glycoprotein Genes in Trypanosomes. Molecular and Cellular Biology. 39 (3), (2019).
- Billcliff, P. G., et al. OCRL1 engages with the F-BAR protein pacsin 2 to promote biogenesis of membrane-trafficking intermediates. Molecular Biology of the Cell. 27 (1), 90-107 (2016).
- Brochet, M., et al. Phosphoinositide metabolism links cGMP-dependent protein kinase G to essential Ca(2)(+) signals at key decision points in the life cycle of malaria parasites. PLoS Biology. 12 (3), 1001806(2014).
- Azevedo, C., Szijgyarto, Z., Saiardi, A. The signaling role of inositol hexakisphosphate kinases (IP6Ks). Advances in Enzyme Regulation. 51 (1), 74-82 (2011).
- Szijgyarto, Z., Garedew, A., Azevedo, C., Saiardi, A. Influence of inositol pyrophosphates on cellular energy dynamics. Science. 334 (6057), 802-805 (2011).
- Cestari, I., Anupama, A., Stuart, K. Inositol polyphosphate multikinase regulation of Trypanosoma brucei life stage development. Molecular Biology of the Cell. 29 (9), 1137-1152 (2018).
- Bang, S., et al. AMP-activated protein kinase is physiologically regulated by inositol polyphosphate multikinase. Proceedings of the National Academy of Sciences of the United States of America. 109 (2), 616-620 (2012).
- Seeds, A. M., Tsui, M. M., Sunu, C., Spana, E. P., York, J. D. Inositol phosphate kinase 2 is required for imaginal disc development in Drosophila. Proceedings of the National Academy of Sciences of the United States of America. 112 (51), 15660-15665 (2015).
- Hamada, K., Miyatake, H., Terauchi, A., Mikoshiba, K. IP3-mediated gating mechanism of the IP3 receptor revealed by mutagenesis and X-ray crystallography. Proceedings of the National Academy of Sciences of the United States of America. 114 (18), 4661-4666 (2017).
- Watson, P. J., et al. Insights into the activation mechanism of class I HDAC complexes by inositol phosphates. Nature Communications. 7, 11262(2016).
- Watson, P. J., Fairall, L., Santos, G. M., Schwabe, J. W. Structure of HDAC3 bound to co-repressor and inositol tetraphosphate. Nature. 481 (7381), 335-340 (2012).
- Irvine, R. F. Nuclear lipid signalling. Nature Reviews: Molecular Cell Biology. 4 (5), 349-360 (2003).
- Sobol, M., et al. UBF complexes with phosphatidylinositol 4,5-bisphosphate in nucleolar organizer regions regardless of ongoing RNA polymerase I activity. Nucleus. 4 (6), 478-486 (2013).
- Nascimbeni, A. C., et al. ER-plasma membrane contact sites contribute to autophagosome biogenesis by regulation of local PI3P synthesis. EMBO Journal. 36 (14), 2018-2033 (2017).
- Martin, K. L., Smith, T. K. The myo-inositol-1-phosphate synthase gene is essential in Trypanosoma brucei. Biochemical Society Transactions. 33, Pt 5 983-985 (2005).
- Matsu-ura, T., et al. Cytosolic inositol 1,4,5-trisphosphate dynamics during intracellular calcium oscillations in living cells. Journal of Cell Biology. 173 (5), 755-765 (2006).
- Blind, R. D., et al. The signaling phospholipid PIP3 creates a new interaction surface on the nuclear receptor SF-1. Proceedings of the National Academy of Sciences of the United States of America. 111 (42), 15054-15059 (2014).
- Lin, A., et al. The LINK-A lncRNA interacts with PtdIns(3,4,5)P3 to hyperactivate AKT and confer resistance to AKT inhibitors. Nature Cell Biology. 19 (3), 238-251 (2017).
- Steger, D. J., Haswell, E. S., Miller, A. L., Wente, S. R., O'Shea, E. K. Regulation of chromatin remodeling by inositol polyphosphates. Science. 299 (5603), 114-116 (2003).
- York, J. D., Odom, A. R., Murphy, R., Ives, E. B., Wente, S. R. A phospholipase C-dependent inositol polyphosphate kinase pathway required for efficient messenger RNA export. Science. 285 (5424), 96-100 (1999).
- Adams, R. L., Mason, A. C., Glass, L., Aditi,, Wente, S. R. Nup42 and IP6 coordinate Gle1 stimulation of Dbp5/DDX19B for mRNA export in yeast and human cells. Traffic. 18 (12), 776-790 (2017).
- Macbeth, M. R., et al. Inositol hexakisphosphate is bound in the ADAR2 core and required for RNA editing. Science. 309 (5740), 1534-1539 (2005).
- Dickson, E. J., Hille, B. Understanding phosphoinositides: rare, dynamic, and essential membrane phospholipids. Biochemical Journal. 476 (1), 1-23 (2019).
- Mellman, D. L., et al. A PtdIns4,5P2-regulated nuclear poly(A) polymerase controls expression of select mRNAs. Nature. 451 (7181), 1013-1017 (2008).
- Lee, Y. S., Mulugu, S., York, J. D., O'Shea, E. K. Regulation of a cyclin-CDK-CDK inhibitor complex by inositol pyrophosphates. Science. 316 (5821), 109-112 (2007).
- Nagy, A. I., et al. IP3 signalling regulates exogenous RNAi in Caenorhabditis elegans. EMBO Reports. 16 (3), 341-350 (2015).
- Hall, B. S., et al. TbVps34, the trypanosome orthologue of Vps34, is required for Golgi complex segregation. Journal of Biological Chemistry. 281 (37), 27600-27612 (2006).
- Rodgers, M. J., Albanesi, J. P., Phillips, M. A. Phosphatidylinositol 4-kinase III-beta is required for Golgi maintenance and cytokinesis in Trypanosoma brucei. Eukaryotic Cell. 6 (7), 1108-1118 (2007).
- Gilden, J. K., et al. The role of the PI(3,5)P2 kinase TbFab1 in endo/lysosomal trafficking in Trypanosoma brucei. Molecular and Biochemical Parasitology. 214, 52-61 (2017).
- Demmel, L., et al. The endocytic activity of the flagellar pocket in Trypanosoma brucei is regulated by an adjacent phosphatidylinositol phosphate kinase. Journal of Cell Science. 129 (11), 2285(2016).
- Gimenez, A. M., et al. Phosphatidylinositol kinase activities in Trypanosoma cruzi epimastigotes. Molecular and Biochemical Parasitology. 203 (1-2), 14-24 (2015).
- Hashimoto, M., et al. Inositol 1,4,5-trisphosphate receptor regulates replication, differentiation, infectivity and virulence of the parasitic protist Trypanosoma cruzi. Molecular Microbiology. 87 (6), 1133-1150 (2013).
- Cestari, I., Haas, P., Moretti, N. S., Schenkman, S., Stuart, K. Chemogenetic Characterization of Inositol Phosphate Metabolic Pathway Reveals Druggable Enzymes for Targeting Kinetoplastid Parasites. Cell Chemical Biology. 23 (5), 608-617 (2016).
- Lovett, J. L., Marchesini, N., Moreno, S. N., Sibley, L. D. Toxoplasma gondii microneme secretion involves intracellular Ca(2+) release from inositol 1,4,5-triphosphate (IP(3))/ryanodine-sensitive stores. Journal of Biological Chemistry. 277 (29), 25870-25876 (2002).
- McNamara, C. W., et al. Targeting Plasmodium PI(4)K to eliminate malaria. Nature. 504 (7479), 248-253 (2013).
- Tresaugues, L., et al. Structural basis for phosphoinositide substrate recognition, catalysis, and membrane interactions in human inositol polyphosphate 5-phosphatases. Structure. 22 (5), 744-755 (2014).
- Varnai, P., et al. Quantifying lipid changes in various membrane compartments using lipid binding protein domains. Cell Calcium. 64, 72-82 (2017).
- Lystad, A. H., Simonsen, A. Phosphoinositide-binding proteins in autophagy. FEBS Letters. 590 (15), 2454-2468 (2016).
- Cullen, P. J., Cozier, G. E., Banting, G., Mellor, H. Modular phosphoinositide-binding domains--their role in signalling and membrane trafficking. Current Biology. 11 (21), 882-893 (2001).
- Klarlund, J. K., et al. Signaling by phosphoinositide-3,4,5-trisphosphate through proteins containing pleckstrin and Sec7 homology domains. Science. 275 (5308), 1927-1930 (1997).
- Wild, R., et al. Control of eukaryotic phosphate homeostasis by inositol polyphosphate sensor domains. Science. 352 (6288), 986-990 (2016).
- Gerasimaite, R., et al. Inositol Pyrophosphate Specificity of the SPX-Dependent Polyphosphate Polymerase VTC. ACS Chemical Biology. 12 (3), 648-653 (2017).
- Potapenko, E., et al. 5-Diphosphoinositol pentakisphosphate (5-IP7) regulates phosphate release from acidocalcisomes and yeast vacuoles. Journal of Biological Chemistry. 293 (49), 19101-19112 (2018).
- Wu, M., Chong, L. S., Perlman, D. H., Resnick, A. C., Fiedler, D. Inositol polyphosphates intersect with signaling and metabolic networks via two distinct mechanisms. Proceedings of the National Academy of Sciences of the United States of America. 113 (44), 6757-6765 (2016).
- Jungmichel, S., et al. Specificity and commonality of the phosphoinositide-binding proteome analyzed by quantitative mass spectrometry. Cell Reports. 6 (3), 578-591 (2014).
- Yang, X., Figueiredo, L. M., Espinal, A., Okubo, E., Li, B. RAP1 is essential for silencing telomeric variant surface glycoprotein genes in Trypanosoma brucei. Cell. 137 (1), 99-109 (2009).
- Cestari, I., Stuart, K. Transcriptional Regulation of Telomeric Expression Sites and Antigenic Variation in Trypanosomes. Current Genomics. 19 (2), 119-132 (2018).
- Clough, T., Thaminy, S., Ragg, S., Aebersold, R., Vitek, O. Statistical protein quantification and significance analysis in label-free LC-MS experiments with complex designs. BMC Bioinformatics. 13, Suppl 16 6(2012).
- Schneider, A., Charriere, F., Pusnik, M., Horn, E. K. Isolation of mitochondria from procyclic Trypanosoma brucei. Methods in Molecular Biology. 372, 67-80 (2007).
- DeGrasse, J. A., Chait, B. T., Field, M. C., Rout, M. P. High-yield isolation and subcellular proteomic characterization of nuclear and subnuclear structures from trypanosomes. Methods in Molecular Biology. 463, 77-92 (2008).
- Opperdoes, F. R. A rapid method for the isolation of intact glycosomes from Trypanosoma brucei by Percoll -gradient centrifugation in a vertical rotor. Molecular and Biochemical Parasitology. 3 (3), 181-186 (1981).
- Pereira, N. M., de Souza, W., Machado, R. D., de Castro, F. T. Isolation and properties of flagella of trypanosomatids. The Journal of protozoology. 24 (4), 511-514 (1977).
- Subota, I., et al. Proteomic analysis of intact flagella of procyclic Trypanosoma brucei cells identifies novel flagellar proteins with unique sub-localization and dynamics. Molecular and Cellular Proteomics. 13 (7), 1769-1786 (2014).
- Fukuda, M., Kojima, T., Kabayama, H., Mikoshiba, K. Mutation of the pleckstrin homology domain of Bruton's tyrosine kinase in immunodeficiency impaired inositol 1,3,4,5-tetrakisphosphate binding capacity. Journal of Biological Chemistry. 271 (48), 30303-30306 (1996).
- Knodler, A., Mayinger, P. Analysis of phosphoinositide-binding proteins using liposomes as an affinity matrix. BioTechniques. 38 (6), (2005).
- Best, M. D. Global approaches for the elucidation of phosphoinositide-binding proteins. Chemistry and Physics of Lipids. 182, 19-28 (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved