Method Article
Быстрое поколение первичных культур Мурин Меланоцит и Фибробласт
В этой статье
Резюме
Этот протокол излагает быстрый метод одновременного генерации меланоцитов и фибробластных культур из кожи 0-4 дневных мышей. Эти первичные культуры могут быть сохранены и манипулировать в пробирке для изучения различных физиологически значимых процессов, в том числе биологии клеток кожи, пигментации, заживления ран и меланомы.
Аннотация
Дефекты функции фибробласта или меланоцита связаны с заболеваниями кожи, включая плохую барьерную функцию, дефектное заживление ран, дефекты пигментации и рак. Важнейшими для понимания и улучшения этих заболеваний являются эксперименты в первичных фибробластных и меланоцитных культурах. Тем не менее, текущие протоколы для изоляции меланоцитов требуют, чтобы эпидермальные и кожные слои кожи пробифицировались и вручную отмежевались. Этот процесс занимает много времени, технически сложной и способствует несовместимым урожаям. Кроме того, невсегдаен доступ к методам одновременного генерации чистых фибробластных культур из одного образца тканей. Здесь мы описываем улучшенный протокол для изоляции меланоцитов и фибробластов из кожи мышей в послеродовые дни 0-4. В этом протоколе, вся кожа механически гомогенизированы с помощью вертолета ткани, а затем кратко усваивается с коллагеназой и трипсином. Популяции клеток затем изолированы через селективное покрытие, за которым следует лечение G418. Эта процедура приводит к последовательной меланоцитов и фибробластов дает от одной мыши менее чем за 90 минут. Этот протокол также легко масштабируется, что позволяет исследователям обрабатывать большие когорты животных без значительного увеличения времени. Мы показываем через поток цитометрических оценок, что культуры, созданные с помощью этого протокола, высоко обогащены меланоцитами или фибробластами.
Введение
Кожа млекопитающих является многослойным органом, который защищает организм от инородных патогенов и ультрафиолетового облучения (УВР). Кожа также играет важную роль в гомеостатических процессов, таких как заживление ран, регулирование температуры и витамина D производства1,2,3. Кожа млекопитающих состоит из трех основных типов клеток: меланоцитов, фибробластов и кератиноцитов. Эти типы клеток населяют различные слои кожи, с кератиноцитами, составляющими эпидермиса, фибробластов, проживающих в дерме и меланоцитах, локализованных в эпидермально-дермальных соединения хищных и волосяных фолликулов4. Здесь мы подробно простую процедуру, которая позволяет одновременное поколение первичных меланоцитов и фибробластных культур из кожи мурин.
Меланоциты пигментных клеток, найденных во многих местах по всему человеческому телу, в том числе базальных эпидермис, радужная оболочка, улитка, мозг и волосяные фолликулы5. Основная функция меланоцитов заключается в генерации и выделении меланиносодержащих пузырьков, называемых меланосомами5,6. Меланосомы содержат два основных класса меланина: коричневый/черный эумеланин ижелтый/красный феомеланин 6,7. Биохимические процессы в меланоцитах регулируют относительное изобилие каждого вида меланинаи помогают определить цвет волос, кожи и глаз 8,9. Меланин также служит для поглощения UVR и защиты солнечных тканей от мутагенеза10.
Меланоцит дисфункции может вызвать пигментные дефекты и увеличить восприимчивость рака кожи. Например, гиперпигментированные участки кожи, характерные для меланомы, являются результатом перепроизводства фокусного меланина, в то время как зародышевые генетические мутации, которые компрометируют гены, участвующие в синтезе меланина, приводят к альбинизму11,12 . Интимное знание биологии меланоцитов требуется для разработки стратегий, которые позволят исправить такие пигментные дефекты и в конечном итоге улучшить психосоциальное благополучие людей, страдающих этими заболеваниями. Дефицит в производстве меланина и / или преференциальный синтез феомеланина также связаны с повышенным риском рака кожи10. Этот риск, как полагают, в результате снижения защиты UVR6,13. Таким образом, методы повышения или восстановления производства эумеланина в меланоцитах могут снизить заболеваемость раком кожи в этих популяциях.
Мезенхимальные фибробласты устанавливают соединительную ткань и структурную поддержку для всех органов тела, включая кожный слой кожи14. Выделение белков, таких как коллаген, эластин, ламинин и фибронектин позволяют фибробластам формировать внеклеточную матрицу (ECM), которая необходима для целостности тканей1,14. Фибробласты также играют важную роль в таких процессах, как заживление ран, воспаление, ангиогенез и образование рака/прогрессирование1,15,16.
Как и меланоциты, дефекты в фибробластной активации и функции могут способствовать опухолевому и заболеванию. Например, неуместная активация фибробластов обычно приводит к образованию фиброза, в результате повышенного осаждения избыточных компонентов ECM в окружающие ткани. Как фибробласты поддерживать большую часть структурной целостности организма, фиброз способствует заболеваний, которые влияют на многочисленные ткани и органы, в том числе идиопатический легочный фиброз, системный склероз, цирроз печени и сердечный фиброз15. Фибробласты также играют важную роль в раке16. Связанные с раком фибробласты (ЦАФ) являются наиболее распространенными незлокачественными клетками в микроокружении многих опухолей. Было показано, что ЦАФы способствуют пролиферации опухоли, прогрессированию и терапевтической резистентности путем модулирования жесткости тканей, местного производства цитокинов и иммунной функции16.
Первичные клеточные культуры предоставляют исследователям генетически убираемые модели для выявления и смягчения дефектов меланоцитов и фибробластов, которые приводят к болезням. Тем не менее, современные методы создания меланоцитов культур ы отнимают много времени и технически сложной задачей. Потребность в трипсинизации и деликатное разделение эпидермиса и дермы способствует изменчивости экспериментальной урожайности и затрудняет проведение крупномасштабных экспериментов. Кроме того, протоколы для одновременного изолировать меланоциты и фибробласты от всей кожи в настоящее время не хватает в поле.
Мы разработали метод снижения этапов обработки, изменчивости и времени, необходимого для создания меланоцитов и фибробластных культур из одного и того же образца всей кожи. Используя метод механической гомогенизации с последующим кратким пищеварением, наша стратегия значительно уменьшает количество практического времени, необходимого для изоляции первичных меланоцитов, позволяя одновременной изоляции фибробластов. Повышенная скорость, эффективность и согласованность этого протокола, в сочетании с возможностью изолировать меланоциты от 0-4-дневных мышей, предоставляет исследователям гибкость для выполнения более широкого спектра экспериментов, чем это было ранее возможно.
протокол
Получить одобрение от вашего институционального комитета по этике животных, прежде чем причавать это или любое другое исследование с участием животных. Эксперименты, проведенные в этом протоколе, были одобрены Институциональным комитетом по уходу и использованию животных Университета штата Огайо (IACUC, протокол #2012A00000134).
1. Подготовка протокола
ПРИМЕЧАНИЕ: Следующие инструкции по подготовке реагента подходят для генерации 9 см2 меланоцитов и фибробластных культур из одной мыши. Обратитесь к руководству по подготовке реагентов в таблице 1 для более масштабных изоляций.
- Приготовьте 1,5 мл коллагенового раствора, содержащего 50 мкг/мл коллагена в 0,1 м ледниковой уксусной кислоты.
- В ламинарном шкафу потока, пальто один из 6-хорошо ячейки культуры блюдо с 8 мкг /см2 (1,44 мл) Коллаген решение. Убедитесь, что скважина полностью покрыта коллагеновым раствором. Инкубировать блюдо при 37 градусах по Цельсию в течение 3 ч или при 4 градусах на ночь. Перед использованием, мыть коллагена покрытием хорошо дважды с 1,35 мл стерильного фосфата буферного солей (PBS) (150 мл ПБС на 1 см2).
- Соберите траулера ткани в шкаф потока ламинарпуте путем тщательно устанавливать отрубать диск на платформе вертолета ткани и обеспечивать стерильное лезвие к подвижной рукоятке.
- Приготовьте 3 мл 1x антибиотик/антимикотический раствор, разбавив 100x антибиотик/антимикотический бульонный раствор в стерильных PBS.
- Подготовка 3 мл свежей кожи пищеварения буфера, содержащего 10% плода крупного рогатого скота сыворотки, 1% пенициллина / стрептомицина раствор, 1% L-глютамина, 10 мг/мл коллагена типа I, 0,25% свина трипсина и 0,02 мг/mL deoxyribonuclease I в 1640.
- Подготовка 6 мл свежих меланоцитов Media, содержащая 10% сыворотки крупного рогатого скота плода, 7% сыворотки лошади, 1% пенициллина/стрептомицина, 1% L-глутамина, 0,5 мМ ди-бутирила цикли amp (dbcAMP), 20 nM тетрейданолторбол 13-ace (TPA) и 20m tte Питательный микс F-12 Ветчина сми.
ПРИМЕЧАНИЕ: Концентрированные dbcAMP, TPA и CT фондовые решения могут быть сделаны, aliquoted и хранится в течение 1 года при -80 градусов по Цельсию. Базовые носители, не имеющие этих компонентов, могут храниться до 1 месяца при 4 градусах Цельсия. - Подготовка 4 мл Fibroblast Media, содержащей 10% сыворотки крупного рогатого скота плода, 1% пенициллина / стрептомицина и 1% L-глютамина в Dulbecco в модифицированных Eagle Medium. Этот носители могут храниться при 4 градусах По Цельсию в течение 1 месяца.
- Приготовьте 40 мл 4% раствора параформальдегида, разбавив 16% параформальдегида в PBS. Храните любое превышение при 4 градусах по Цельсию в течение 1 месяца или -20 градусов по Цельсию в течение 1 года.
- Приготовьте 1% сапонина, перемешивая 0,5 г сапонина в 50 мл PBS при 37 градусах По Цельсия до полного растворения сапонина. Стерилизовать раствор для долгосрочного хранения с помощью 50 мл шприца оснащены 0,2 мкм PES фильтр. Полученный сапонин бульонный раствор может храниться при 4 градусах по Цельсию в течение 1 месяца.
- Приготовьте 200 л 0,1% Сапонина Раствор на мышь, разбавляя 1% сапонина стокового раствора в PBS, содержащий 3% бычьего сыворотоки альбумина (BSA).
- Приготовьте 1 мл решения жизнеспособности, разбавив 1 л поправляемого красителя жизнеспособности в 1 мл PBS.
2. Меланоцит и изоляция фибробластов
- Эвтаназия от 0 до 4 дневных мужчин и / или женщин C57Bl/6J щенков путем обезглавливания и удалить конечности из эвтанированных мышей с помощью хирургических ножниц.
- В ламинарном шкафу, кратко рулон ствол каждой мыши в стерильной чашке Петри, содержащий 70% этанола. Снимите ствол с этанола и поместите его в пустую, стерильную чашку Петри.
- Используя хирургические ножницы, стерилизованные в 70% этанола, делают разрез в коже на брюшной стороне туловища, начиная от шеи до хвоста. Очистите кожу от ствола мыши с помощью стерильных щиптов.
- Поместите кожу дермы стороной вниз в 6-хорошо блюдо, содержащее 3 мл 1x антибиотик / антимикотический раствор и инкубировать при комнатной температуре в течение 2-3 мин.
- Включите тканевой измельчитель со следующими настройками на месте: Толщина фрагмента: 1 мкм; Сила лезвия: 60% от максимума; Скорость: 50% от максимума.
- Перенесите кожу, дерму стороной вниз, на стерильный диск измельчителя ткани и передать кожу полностью через активированный измельчитель ткани 3 раза.
- Перенесите гомогенизированную кожу в стерильную коническую трубку 15 мл, содержащую 3 мл буфера пищеварения кожи. Смешайте полученную подвеску, повышая и остывая 10-15 раз с микропипеттом P1000.
- Cap конической трубки и инкубировать образец в 37 градусов по Цельсию водяной бане в течение 15 минут, инвертирование трубки каждые 3-5 минут.
- Пеллетклетки кожи гоменатируют путем центрифугирования конической трубки в размахивая ротор ведро на 750 х г в течение 5 минут при комнатной температуре.
- Использование p1000 micropipette, медленно и полностью удалить пищеварительной буфера пищеварения быть осторожным, чтобы не беспокоить гранулы.
ПРИМЕЧАНИЕ: Часть всей кожи может быть сохранена на данном этапе и используется в качестве контроля для шага 3: Подтверждение клеточной чистоты. Процедите эти клетки через 70 мкм ячейки ситечко, а затем начать на шаг 3,5 для дальнейшей обработки. - Тщательно resuspend клеточной гранулы в 1 мл меланоцитов СМИ путем pipetting вверх и вниз 15-20 раз с p1000 микропайпет. Добавьте результирующее клеточное раствор в непокрытом колодце из 6-ну хорошо блюда, содержащего 1 мл меланоцитов Media.
- Поместите покрытую кожу гомегенатом в инкубатор культуры тканей, установленный при 37 градусах по Цельсию и 5% CO2. Разрешить культур инкубировать в течение 40 минут.
ПРИМЕЧАНИЕ: В течение этого времени, некоторые фибробласты в коже гоменат будет придерживаться непокрытого блюда в то время как меланоциты и кератиноциты остаются в подвеске. - Перенесите культурный супернатант из непокрытого блюда в один колодец предварительно промытого, покрытого коллагеном 6-ну хорошо блюдо. Добавьте G418 в СМИ так, что конечная концентрация 100 нг/мл.
- Добавьте 2 мл Fibroblast Media в один колодец непокрытого блюда, теперь содержащего адепт фибробластов.
- Инкубировать обе культуры на ночь в инкубаторе культуры тканей, установленном на уровне 37 градусов по Цельсию и 5% CO2.
- Отдельно аспирируйте средства массовой информации и любые обломки от каждой культуры, 16-24 ч после покрытия. Вымойте каждое блюдо дважды с 1 мл стерильных PBS, а затем добавить 2 мл свежих меланоцитов СМИ плюс 100 нг /мл G418 в меланоцитов культуры и 2 мл свежих Фибробласт СМИ в фибробласткультурной культуры.
- После меланоцитов культуры были обработаны G418 для 48 ч, мыть клетки дважды с 1 мл стерильных PBS и добавить 2 мл свежих меланоцитов СМИ без G418 в культуру.
ПРИМЕЧАНИЕ: Как фибробласты в меланоцитов культуры продолжают отмирать после лечения G418, мыть блюдо с стерильными PBS удалить мертвые клетки и добавить свежие меланоцитов СМИ. Меланоциты и фибробластные культуры должны быть проложены, когда они достигают 70-80% confluency.
3. Подтверждение клеточной чистоты
- Аспирируйте средства массовой информации от каждой культуры и тщательно мыть каждое блюдо с 1 мл стерильных PBS.
- Добавьте 0,7 мл 0,25% трипсина к каждой культуре и инкубировать культуры в трипсин при 37 градусах Цельсия и 5% CO2 в течение 1 мин.
- Выбить клетки путем pipetting трипсина против нижней части блюда с помощью p1000 micropipette.
- Добавьте 0,7 мл соответствующего носителя к каждой трипсинизированной культуре и перенесите клеточный раствор в микроцентрифугную трубку мощностью 1,5 мл.
- Пелле клетки центрифугации при 750 х г в течение 2 мин при комнатной температуре. Тщательно удалить и отбросить супернатант с помощью микропайпета P1000.
ПРИМЕЧАНИЕ: Шаги 3.1-3.5 могут быть использованы для прохождения меланоцитов и фибробластных культур. Полученные гранулы следует переопустить в соответствующие носители и поместить в новое, непокрытое (фибробласты) или предварительно промытые, коллагеновы (меланоциты) блюдо. - Приостановите действие клеточной гранулы в 0,5 мл ледяного PBS.
- Перечислите и перенесите 0,5 миллиона клеток в предварительно охлажденную микроцентрифугную трубку мощностью 1,5 мл.
- Повторите шаг 3.5, а затем повторно приостановите клетки в 100 злимости решения. Инкубировать клеточную подвеску в течение 30 минут при 4 градусах По Цельсию в темноте.
- Повторите шаги 3,5-3,6 дважды.
- Повторите шаг 3.5, затем исправить клетки, повторно приостановив гранулы в 100 л ледяного холода 4% Параформальдегид ареш. Инкубировать подвеску в течение 15 минут при комнатной температуре в темноте.
- Повторите шаг 3,5 дважды, каждый раз, когда повторное приостановление гранулы в 0,5 мл 3% BSA в 1x PBS.
- Повторите шаг 3.5, затем приостановите клеточные гранулы в 100 Л Л 0,1% Сапонина Раствор. Инкубировать подвеску в течение 15 минут при комнатной температуре в темноте.
- Повторите шаг 3.5, затем resuspend клеточной гранулы в 100 л 0,1% Сапонин Раствор, содержащий 0,5 мкг анти-gp100 кролика антитела, 0,5 мкг кролика антифибробласт-специфического белка 1 (FSP1) антитела и 0,025 мкг мыши анти-Цитокератин 14 (K14) антитела. Инкубировать подвеску на 1 ч при комнатной температуре в темноте.
ПРИМЕЧАНИЕ: В то время как антитела K14 были приобретены предварительно конъюгированные Alexa Fluor 647, антитела gp100 и FSP1 были спряжено к CF 555 и CF 488, соответственно. На этом этапе следует также начать окрашивание контрольных популяций. Популяции контрольно-клеточных элементов должны быть изолированы от культуры и обработаны, как описано в шагах 3.5-3.12. - Повторите шаг 3.11 дважды, чтобы удалить любые несвязанные антитела.
- Повторите шаг 3.5, затем resuspend клеточной гранулы в 200-400 л 3% BSA в 1x PBS.
- Передайте клеточный раствор через 40 мкм ячейки ситечко в 5 мл полистирола круглого дна трубки и анализировать напряженные клетки по потоку цитометрии.
Результаты
Мужчины и женщины C57Bl/6J мышей были усыплены в послеродовые дни 0-4 и усеченной кожи был подвергнут механической диссоциации, как описано выше. После измельчения, кожа формируется вязкой суспензии не хватает каких-либо признаков структурных тканей. Центругирование этой суспензии привело к образованию большой клеточной гранулы в нижней части конической трубки и слоя жировой, плавающей поверх супернатанта. Этот жировой слой был отброшен с супернатантом, в то время как остальные клеточные гранулы были перекрашены и перенесены в непокрытую колодец из 6-колодца. Высокая плотность клеток вызвала облачность в носителях. Однако, после 40 минут инкубации, большие клетки и ткани конгломераты наблюдались в средствах массовой информации и приверженец фибробластов можно было увидеть с перевернутым световым микроскопом (Рисунок 1).
Неадекторные клетки из фибробластной культуры были перенесены в один колодец 6-хорошего блюда с коллагеном, чтобы изолировать меланоциты. Добавление G418 убил всех оставшихся фибробластов в гоменат, в результате чего многочисленные мертвые клетки плавающей в средствах массовой информации в течение следующих 5 дней(Рисунок2-C). После 4-5 дней роста, покрытые меланоциты начали принимать на стереотипных дендритный фенотип с меланоцитарными гранулами(рисунок 2C). Этот фенотип сохраняется после прохождения культуры(Рисунок 2D). В то время как кластеры загрязняющих кератиноцитов первоначально наблюдались в меланоцитных культурах(рисунок 2А),эти популяции были потеряны при последующем прохождении.
Цитометрические анализы потока были использованы для подтверждения чистоты в результате первичного меланоцита и фибробластных культур. Кератиноциты мыши C5N17, день 10 первичных культур меланоцитов и день 6 первичных культур фибробластов были окрашены: анти-gp100 (дифференцированные меланоциты), анти-цитокератин 14 (K14; кератиноциты) и антифибробластно-специфический белок 1 ( FSP1; фибробласты)(Рисунок 3). В этих клетках, gp100 окрашивания был специфичен для первичных меланоцитов, в то время как FSP1 положительность наблюдалась только в фибробластов(Рисунок 3A,B). Выражение K14 ограничивалось кератиноцитами C5N(рисунок 3C). Дополнительные анализы были проведены для определения чистоты наших меланоцитов культур 1, 2, 3, 4 и 10 дней после изоляции(рисунок 4). Комбинированное загрязнение фибробластом и кератиноцитами никогда не превышало 25% от общего количества клеток в культуре(рисунок 4B, C). Тем не менее, резкое увеличение gp100 не наблюдалось до четвертого дня в культуре(рисунок 4A). Мы приписываем это наблюдение уменьшенному выражению gp100 в меланоцитах-предшественниках (т.е. меланобластах), многие из которых появляются полностью дифференцированными к 10-му дню в культуре(рисунок 4А). Таким образом, эти данные свидетельствуют о том, что наш протокол быстрой изоляции одновременно производит культуры, обогащенные меланоцитами и фибробластами.
| Шаг # | Реагента | 1 щенка | 5 щенков |
| 1.1 | Коллагенное решение | 1,5 мл | 4,5 мл л. |
| 1,2 | Размер плиты | 6-ну хорошо | 10 см |
| 1.4 | Антибиотик / Антимикотический раствор | 3 мл | 15 мл |
| 1,5 | Буфер пищеварения кожи | 3 мл | 15 мл |
| 1,6 | Меланоцит Медиа | 6 мл | 30 мл |
| 1,7 | Фибробласт Медиа | 4 мл | 20 мл |
Таблица 1: Руководство по подготовке реагентов для различных размеров когорты.

Рисунок 1 : Репрезентативные изображения первичных культур фибробластов мурина. Показаны 20x изображения фибробластов сразу же после изоляции (A), а также 24 (B) и 48 (C) h после изоляции. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 2 : Репрезентативные изображения первичных меланоцитов культур. Показаны 20x изображения меланоцитов культур 1 (A), 2 (B) и 4 дней (C ) после изоляции. Загрязняющие кератиноциты указываются стрелой в 'A'. (D) Представитель изображение первичных культур меланоцитов после прохождения. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 3 : Поток цитометрических оценок чистоты культуры. Представитель гистограммы, показывающие gp100 (A; дифференцированные меланоциты), FSP1 (B; фибробласты) и K14 (C; кератиноциты) положительность в первичных меланоцитов (день 10), первичных фибробластов (день 6) и C5N кератиноцитов. После gating на живых клетках, 10000 событий были проанализированы от каждой популяции. Для компенсации использовались элементы управления одним цветом, а полученные данные были визуализированы с помощью программного обеспечения FlowJo. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
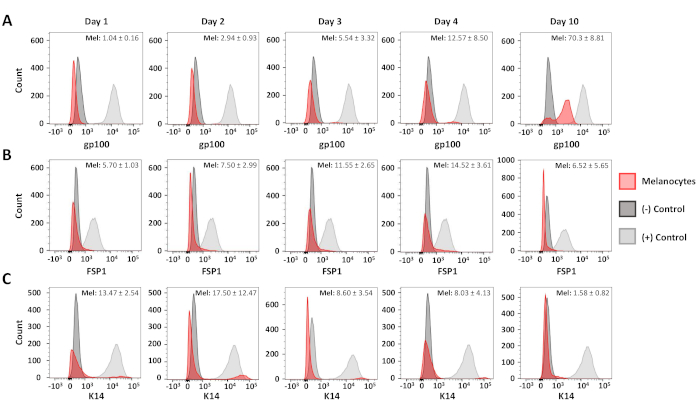
Рисунок 4 : Анализ курса времени чистоты меланоцита. Представитель гистограммы, показывающие чистоту меланоцита 1-10 дней после первоначальной изоляции. Образцы были окрашены, проанализированы и на графике, как описано на рисунке 3. Положительные и отрицательные группы контроля были следующими: gp100--человеческие меланоциты (я), первичные фибробласты мурина (-); FSP1 --первичные фибробласты морин (яп. ) человека, меланоциты человека (-); Клетки K14--C5N (я), меланоциты человека (-). Средняя позитивность и стандартное отклонение по крайней мере для трех различных меланоцитов культур показано в правом верхнем углу каждого графика. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
Обсуждение
Культура in vitro первичных меланоцитов и фибробластов привела к значительным достижениям в нашем понимании биологии кожи и болезней. Этот протокол улучшает предыдущие методы изоляции меланоцитов за счет сокращения времени и технической смекалки, необходимой для создания последовательных меланоцитов культур, позволяя при одновременной изоляции фибробластов кожи. Новый, экономяный время элемент этой процедуры заключается в том, что дермы и эпидермис не должны быть разделены. Вместо этого, клетки кожи изолированы с использованием последовательной силы измельчения и детализации механической ткани измельчитель наряду с селективными средствами и покрытие методов. Снижая сложность обработки и практическое время, эта процедура также позволяет исследователям эффективно проводить крупномасштабные эксперименты.
Мы рекомендуем несколько шагов для повышения урожайности и согласованности с помощью этого протокола. Во-первых, до шага 2.4, мы советуем использовать изогнутые щипчинки, чтобы очистить от любой жировой ткани из кожной стороны кожи. Этот процесс позволит уменьшить жир торт формируется после центрифугации. Далее, надлежащая механическая диссоциация кожи имеет решающее значение для успеха этого протокола и может быть усилена путем вращения диска гомогенизатора после каждого прохода лезвия. Другим ключевым шагом является обеспечение того, чтобы все skin Digest Buffer удаляется в шаге 2.10. Невыполнение этого требования будет препятствовать клеточной сливке к блюду и значительно снизить урожайность. Поскольку гранулы не прочно прикреплены к нижней части конической трубки 15 мл в шаге 2.10, клетки могут быть легко аспирированы, если супернатант не удаляется медленно. Если тщательное удаление пищеварительного буфера является проблемой, мы предлагаем промыть гранулы в 2-3 мл меланоцитов СМИ, а затем повторять шаги 2.9-2.10 до покрытия. Наконец, при повторной приостановке клеточной гранулы в шаге 2.11, важно, чтобы пипетка энергично для того, чтобы разбить любые сгустки и обеспечить, чтобы клетки равномерно распределены на поверхности тарелки культуры клеток. Мусор и мертвые клетки будут наблюдаться в культуре в течение первых нескольких дней после изоляции. Эти мертвые клетки могут препятствовать росту культуры и должны быть удалены путем мытья блюда с PBS, а затем добавить свежие средства массовой информации.
Этот протокол излагает метод генерации первичных меланоцитов и фибробластных культур из одной мыши. Тем не менее, процедура может быть эффективно скорректирована для размещения больших когорт мышей (см. таблицу 1). Для больших когорт, сочетание кожи гомогенат от 4-5 щенков приводит к 30-40% слияние 10 см блюдо меланоцитов в течение 4-5 дней изоляции. Несколько методов могут быть использованы для повышения эффективности этого протокола при работе с несколькими животными. Во-первых, мы обычно усыпаем животных в наборах по четыре человека, перерабатывая по два животных одновременно. Мы обнаружили, что гомогенизированная кожа от двух щенков может быть объединена на шагах 2,7-2,8 за счет увеличения объема skin Digest Buffer до 6 мл. Чтобы сэкономить время, мы начинаем изолировать кожу от следующей пары щенков, в то время как первый набор проходит гомогенизацию и пищеварение. Такой подход гарантирует, что популяции клеток изолированы вскоре после эвтаназии и сокращает время обработки, необходимое для нескольких животных. При работе со взрослыми мышами (т.е. послеродовыми днями 2-4) мы обнаружили, что прохождение кожи в четвертый раз через активный тканевой измельчитель (шаг 2.6) повышает гомогенизацию кожи и клеточную урожайность. Используя этот метод, мы не видим возрастной разницы в урожайности меланоцитов или фибробластов.
В этом протоколе подробно описывается, как одновременно генерировать фибробласты и меланоциты культур из одного образца кожи. Мы заметили, что кератиноциты в начальной меланоцитовой культуре остаются прилипаемыми к блюду, когда краткосрочная трипсиизация проводится вместе с силовым вытеснением меланоцитов (см. шаги 3.2-3.3). Хотя мы не оптимизировали методы распространения этих оставшихся клеток, мы предполагаем, что продолжение культуры таких популяций приверженцев в кератиноцитов средств довольствуется 100 нг /мл G418 может привести к обогащению популяции клеток.
Раскрытие информации
Авторы не имеют конфликта интересов раскрыть.
Благодарности
Авторы благодарят Фонд Дэймона Руньона (Премия за инновации #38-16 C.E.B.) и Pelotonia (B.M.M.) за финансовую поддержку. Мы признательны К. Хейнсу и К. Вормсбачеру, которые предоставили комментарии для улучшения текста рукописи. Эта работа выиграла от штата Огайо Всеобъемлющий онкологический центр аналитической цитометрии Общий ресурс, который поддерживается NIH P30 CA016058.
Материалы
| Name | Company | Catalog Number | Comments |
| 0.2 µm PES sterile syringe filter | VWR | 28145-501 | |
| 10 cm cell culture dish | Corning | 430167 | |
| 40 µm cell strainer | Fisher Scientific | 22363547 | |
| 5 mL polystyrene round-bottom tubes | Fisher Scientific | 352008 | |
| 6-well cell culture dish | Sigma-Aldrich | SIAL0516 | |
| 70 µm cell strainer | Fisher Scientific | 22363548 | |
| Antibiotic Antimycotic Solution (100x) | Sigma-Aldrich | A5955 | |
| Bovine Serum Albumin | Fisher Scientific | BP9706-100 | |
| CF 488A Mix-n-Stain Antibody Labeling Kit | Biotium | 92273 | |
| CF 555 Mix-n-Stain Antibody Labeling Kit | Biotium | 92274 | |
| Cholera Toxin | Sigma-Aldrich | C8052 | |
| Collagen from rat tail | Sigma-Aldrich | C7661 | |
| Collagenase Type I | Worthington Biochemicals | LS004156 | |
| Corning Penicillin/Streptomycin Solution | Fisher Scientific | 30-002-CL | |
| Cytokeratin 14 Antibody Alexa Fluor 647 | Novus Biologicals | NBP2-34403AF647 | |
| Deoxyribonuclease I | Worthington Biochemicals | LS002058 | |
| Di-butyryl cyclic AMP | Sigma-Aldrich | D0627 | |
| Dulbecco's Modified Eagle Medium | Gibco | 12800-082 | |
| Dulbecco's Phosphate Buffered Saline | Sigma-Aldrich | D8537 | |
| eBioscience Fixable Viability Dye eFluor 780 | Thermo Fisher | 65-0865-14 | |
| Ethanol, 200 proof | Fisher Scientific | 22032601 | |
| Fetal Bovine Serum | Sigma-Aldrich | 12306C | |
| FSP1/S100A4 antibody | Millipore Sigma | 07-2274 | |
| G418 Disulfide | P212121 | LGB-418-1 | |
| Glacial Acetic Acid | VWR | VWRV0714 | |
| Horse Serum | Fisher Scientific | 26050088 | |
| HyClone L-Glutamine | Fisher Scientific | SH3003402 | |
| McIlwain Tissue Chopper | Ted Pella | 10180 | |
| Melanoma gp100 antibody | Abcam | ab137078 | |
| Nutrient Mix F-12 Ham's Media | Sigma-Aldrich | N6760 | |
| Phorbol 12-Myristate 13-acetate | Sigma-Aldrich | P8139 | |
| Pierce 16% Formaldehyde | Thermo Fisher | 28908 | |
| Porcine Trypsin | Sigma-Aldrich | 85450C | |
| RPMI 1640 media | Sigma-Aldrich | R8758 | |
| Saponin | Sigma-Aldrich | S-7900 | |
| Tissue Chopper Blade | Ted Pella | 121-6 | |
| Tissue Chopper Plastic Disk | Ted Pella | 10180-01 | |
| Trypsin | VWR | VWRL0154-0100 |
Ссылки
- Rittie, L. Cellular mechanisms of skin repair in humans and other mammals. Journal of Cell Communucation and Signal. 10 (2), 103-120 (2016).
- Romanovsky, A. A. Skin temperature: its role in thermoregulation. Acta Physiologica (Oxf). 210 (3), 498-507 (2014).
- Holick, M. F., Smith, E., Pincus, S. Skin as the site of vitamin D synthesis and target tissue for 1,25-dihydroxyvitamin D3. Use of calcitriol (1,25-dihydroxyvitamin D3) for treatment of psoriasis. Archives of Dermatology. 123 (12), 1677-1683 (1987).
- Yamaguchi, Y., Hearing, V. J. Physiological factors that regulate skin pigmentation. Biofactors. 35 (2), 193-199 (2009).
- Yamaguchi, Y., Hearing, V. J. Melanocytes and their diseases. Cold Spring Harbor Perspectives in Medicine. 4 (5), (2014).
- Brenner, M., Hearing, V. J. The protective role of melanin against UV damage in human skin. Photochemistry and Photobiology. 84 (3), 539-549 (2008).
- Thody, A. J., et al. Pheomelanin as well as eumelanin is present in human epidermis. The Journal of Investigative Dermatology. 97 (2), 340-344 (1991).
- Swope, V. B., Abdel-Malek, Z. A. MC1R: Front and Center in the Bright Side of Dark Eumelanin and DNA Repair. International Journal of Molecular Science. 19 (9), (2018).
- Barsh, G. S. What controls variation in human skin color. PLoS biology. 1 (1), 27 (2003).
- Abdel-Malek, Z., et al. The melanocortin-1 receptor is a key regulator of human cutaneous pigmentation. Pigment Cell Research. 13, 156-162 (2000).
- Gronskov, K., Ek, J., Brondum-Nielsen, K. Oculocutaneous albinism. Orphanet Journal of Rare Diseases. 2, 43 (2007).
- Kwon, S. H., Hwang, Y. J., Lee, S. K., Park, K. C. Heterogeneous Pathology of Melasma and Its Clinical Implications. International Journal of Molecular Sciences. 17 (6), (2016).
- D'Orazio, J., Jarrett, S., Amaro-Ortiz, A., Scott, T. UV radiation and the skin. International Journal of Molecular Science. 14 (6), 12222-12248 (2013).
- Bonnans, C., Chou, J., Werb, Z. Remodelling the extracellular matrix in development and disease. Nature Reviews Molecular Cell Biology. 15 (12), 786-801 (2014).
- Kendall, R. T., Feghali-Bostwick, C. A. Fibroblasts in fibrosis: novel roles and mediators. Frontiers in Pharmacology. 5, 123 (2014).
- Kalluri, R. The biology and function of fibroblasts in cancer. Nature Reviews Cancer. 16 (9), 582-598 (2016).
- Dickson, M. A., et al. Human keratinocytes that express hTERT and also bypass a p16(INK4a)-enforced mechanism that limits life span become immortal yet retain normal growth and differentiation characteristics. Molecular and Cellular Biology. 20 (4), 1436-1447 (2000).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены