Method Article
原発性マウスメラノサイトと線維芽細胞培養の急速な生成
要約
このプロトコルは、0〜4日前マウスの皮膚からメラノサイトおよび線維芽細胞培養物を同時に生成する迅速な方法を概説する。これらの一次培養は、皮膚細胞生物学、色素沈着、創傷治癒および黒色腫を含む様々な生理学的に関連するプロセスを研究するために、インビトロで維持および操作することができる。
要約
線維芽細胞またはメラノサイト機能の欠陥は、バリア機能の低下、創傷治癒の欠陥、色素沈着欠陥および癌を含む皮膚疾患に関連している。これらの疾患の理解と改善に不可欠なのは、一次線維芽細胞およびメラノサイト培養における実験である。それにもかかわらず、メラノサイト単離のための現在のプロトコルは、皮膚の表皮層および真皮層がトリプシン化され、手動で関連付け解除される必要があります。このプロセスは時間がかかり、技術的に困難であり、一貫性のない収率に寄与します。さらに、同じ組織試料から純粋な線維芽細胞培養物を同時に生成する方法は容易に入手できない。ここでは、出生後0-4日目にマウスの皮膚からメラノサイトおよび線維芽細胞を分離するための改善されたプロトコルについて説明する。このプロトコルでは、皮膚全体が組織チョッパーを使用して機械的に均質化され、その後、コラゲナーゼとトリプシンで簡単に消化される。細胞集団は、その後、G418処理に続いて選択的めっきを通して単離される。この手順は、90分未満で単一のマウスから一貫したメラノサイトと線維芽細胞の収量をもたらす。このプロトコルはスケーラブルでもあり、研究者は実践的な時間を大幅に増やすことなく、動物の大きなコホートを処理することができます。我々は、このプロトコルを使用して確立された培養物がメラノサイトまたは線維芽細胞に対して非常に濃縮されていることをフローサイトメトリック評価を通して示す。
概要
哺乳類の皮膚は、外来病原体や紫外線照射(UVR)から体を保護する多層器官です。皮膚はまた、創傷治癒、温度調節およびビタミンD産生1、2、3などの恒待プロセスにおいて重要な役割を果たしている。哺乳類の皮膚は、メラノサイト、線維芽細胞およびケラチノサイトの3つの主要な細胞タイプからなる。これらの細胞型は皮膚の異なる層に入り込み、表皮を構成するケラチノサイト、真皮およびメラノサイトに存在する線維芽細胞が表皮真皮接合部および毛包4に局在する。ここでは、マウスの皮膚から一次メラノサイトと線維芽細胞培養物の同時生成を可能にする簡単な手順を詳しく説明します。
メラノサイトは、基礎表皮、虹彩、簡膜、脳および毛包5を含む人体全体の多くの場所で見つかった色素産生細胞である。メラノサイトの主な機能は、メラノソーム5、6と呼ばれるメラニン含有小胞を生成し、分泌することです。メラノソームは、メラニンの2つの主要なクラスが含まれています: 茶色/黒ユーメラニンと黄色/赤フェオメラニン6,7.メラノサイト内の生化学的プロセスは、各メラニン種の相対的な存在量を調節し、髪、皮膚および目の色8、9を決定するのに役立ちます。メラニンはまた、UVRを吸収し、変異発生から太陽にさらされた組織を保護するのに役立ちます10.
メラノサイト機能不全は、色素欠損を引き起こし、皮膚癌の感受性を高めることができます。例えば、メラスマの超色素性皮膚パッチは、焦点メラニン過剰産生の結果であるのに対し、メラニン合成に関与する遺伝子を損なう生殖細胞系遺伝子変異はアルビニズム11、12につながる.メラノサイト生物学の深い知識は、このような色素不全を修正し、最終的にこれらの疾患に苦しむ個人の心理社会的幸福を改善する戦略を開発するために必要とされます。メラニン産生および/またはフェオメラニンの優遇合成の欠損はまた、増加した皮膚癌リスク10に関連している。このリスクは、UVR保護6、13の減少に起因すると考えられている。したがって、メラノサイトにおけるユーメラニン産生を増強または回復させる方法は、これらの集団における皮膚癌の発生率を減少させることができる。
間葉線維芽細胞は、皮膚14の真皮層を含む身体のすべての器官の結合組織および構造支持体を確立する。コラーゲン、エラスチン、ラミニン、フィブロネクチンなどのタンパク質の排泄により、線維芽細胞が組織の完全性1、14に不可欠な細胞外マトリックス(ECM)を形成することができます。線維芽細胞はまた、創傷治癒、炎症、血管新生および癌形成/進行1、15、16などのプロセスにおいて重要な役割を果たす。
メラノサイトと同様に、線維芽細胞活性化および機能の欠陥は、腫瘍形成および疾患を促進することができる。例えば、不適切な線維芽細胞活性化は、一般的に線維化の形成につながり、周囲の組織への過剰なECM成分の増強堆積に起因する。線維芽細胞は身体の構造的完全性の多くを維持するにつれて、線維症は特発性肺線維症、全身性硬化症、肝硬変および心臓線維症を含む多数の組織および器官に影響を与える疾患を促進する15。線維芽細胞はまた、癌16で重要な役割を果たしています.癌関連線維芽細胞(CAF)は、多くの腫瘍の微小環境において最も豊富な非悪性細胞である。CAFは、組織の剛性、局所的なサイトカイン産生および免疫機能16を調節することにより腫瘍増殖、進行および治療抵抗を促進することが示されている。
一次細胞培養は、疾患につながるメラノサイトおよび線維芽細胞欠損を同定し、軽減するための遺伝的に扱いやすいモデルを研究者に提供します。しかし、メラノサイト培養を確立する現在の方法は、時間がかかり、技術的に困難です。表皮と真皮のトリプシン化と繊細な分離の必要性は、実験収率の変動に寄与し、大規模な実験を行うことを困難にする。さらに、皮膚全体からメラノサイトと線維芽細胞を同時に分離するプロトコルは、現在、この分野に欠けている。
我々は、同じ皮膚サンプルからメラノサイトおよび線維芽細胞培養物を確立するために必要な処理ステップ、変動性および時間を低減する方法を開発した。機械的均質化法と短い消化を使用して、我々の戦略は、同時線維芽細胞分離を可能にしながら、一次メラノサイトを分離するために必要な実践的な時間の量を大幅に減少させる。このプロトコルの速度、効率および一貫性の増加は、0〜4日前のマウスからメラノサイトを単離する能力と組み合わせることで、研究者に以前よりも広い配列の実験を行う柔軟性を提供する。
プロトコル
動物に関する研究を開始する前に、組織動物倫理委員会の承認を得る。このプロトコルで行われた実験は、オハイオ州立大学の施設動物管理および使用委員会(IACUC、プロトコル#2012A00000134)によって承認されました。
1. プロトコルの準備
注:以下の試薬調製指示は、単一のマウスからの9cm2メラノサイトおよび線維芽細胞培養物の生成に適している。大規模な単離については、表1の試薬調製ガイドを参照してください。
- 0.1 Mの氷河酢酸で50 μg/mLコラーゲンを含むコラーゲン溶液の1.5 mLを調出します。
- 層流キャビネットで、8 μg/cm 2(1.44 mL)コラーゲン溶液で6ウェル細胞培養皿の1ウェルをコーティングします。井戸がコラーゲン溶液で完全に覆われていることを確認します。37 °Cで3時間または一晩4 °Cで皿をインキュベートします。使用前に、1.35 mLの無菌リン酸緩衝生理食生(PBS)(1cm2当たり150μLのPBS)でコラーゲンコーティングをよく洗います。
- ティッシュチョッパープラットフォームにチョッピングディスクを慎重に配置し、可動アームに滅菌ブレードを固定することにより、層流キャビネットにティッシュチョッパーを組み立てます。
- 無菌PBSで100倍の抗生物質/抗菌ストック溶液を希釈することにより、1x抗生物質/抗マイコティック溶液の3mLを調剤する。
- 10%の胎児ウシ血清、1%ペニシリン/ストレプトマイシン溶液、1%L-グルタミン、10mg/mLコラゲナーゼ型I型、0.25%ブタトリプシンおよび0.02mg/mLデオキシリボヌクレスIを含む新鮮な皮膚消化バッファーを準備する。
- 10%の胎児ウシ血清を含む新鮮なメラノサイト培地の6 mLを調作し、 7% 馬血清, 1% ペニシリン/ストレプトマイシン溶液, 1% L-グルタミン, 0.5 mMジブシリル環状AMP(dbcAMP), 20 nMテトレトカノイルフィルボル13-アセテート(TPA)および200 pMコレラ毒素(CT)栄養ミックスF-12ハムのメディア。
注:濃縮dbcAMP、TPAおよびCTストックソリューションは、-80°Cで>1年間、アリクォートおよび保存することができます。これらの部品を欠いている基盤媒体は4 °Cで1ヶ月まで貯えることができる。 - 10%の胎児ウシ血清、1%ペニシリン/ストレプトマイシン、1%L-グルタミンを含む線維芽細胞培地の4mLをダルベッコの改変イーグル培地に調製する。この媒体は1ヶ月まで4°Cで貯えることができる。
- PBSで16%パラホルムアルデヒドを希釈することにより、4%パラホルムアルデヒド溶液の40 mLを調作する。1ヶ月間、または-20°Cで1年まで4°Cまたは-20°Cで過剰を保存します。
- サポニンが完全に溶解するまで37°CでPBSの50 mLでサポニン0.5gを混合して1%サポニンストック溶液を調出します。0.2 μm PESフィルターを装着した50 mLシリンジを使用して、長期保存用の溶液を殺菌します。得られたサポニンストック溶液は、1ヶ月間4°Cに保つことができる。
- 3%ウシ血清アルブミン(BSA)を含むPBSで1%サポニンストック溶液を希釈することにより、マウス当たり0.1%サポニン溶液の200μLを調剤する。
- PBSの1 mLで固定可能な生存性色素の1 μLを希釈することにより、1 mLの生存率溶液を調作する。
2. メラノサイトと線維芽細胞分離
- 0~4歳の雄および/または雌のC57Bl/6Jの子犬を首切りで安楽死させ、外科的はさみを用いて安楽死マウスから四肢を取り除く。
- 層流キャビネットで、70%のエタノールを含む無菌ペトリ皿で各マウスのトランクを簡単に転がします。エタノールからトランクを取り出し、空の無菌ペトリ皿に入れます。
- 外科的はさみを使用して、70%のエタノールで殺菌し、首から尾に始まる幹の腹部側の皮膚に切開を行う。無菌鉗子を使用して、マウスの幹から皮膚を剥がします。
- 皮膚真皮を1x抗生物質/抗菌溶液の3mLを含む6ウェル皿に置き、室温で2〜3分間インキュベートします。
- 次の設定でティッシュチョッパーをオンにします: スライスの厚さ: 1 μm;ブレード力:最大の約60%。速度:最大の約50%。
- 皮膚、真皮側を下に移し、滅菌組織チョッパーディスクに移し、活性化された組織チョッパーを3回完全に通す。
- 均質化された皮膚を無菌、皮膚消化バッファーの3 mLを含む15 mL円錐管に移す。P1000マイクロピペットで10~15回ピペットを上下に混ぜてサスペンションを混ぜます。
- 円錐形のチューブをキャップし、37 °Cの水浴で15分間サンプルをインキュベートし、チューブを3〜5分ごとに反転させます。
- 円錐管をスイングバケツロータに遠心分離して皮膚内の細胞を均質化し、室温で5分間750xgにする。
- P1000マイクロピペットを使用して、ペレットを邪魔しないように注意して皮膚消化バッファーをゆっくりと完全に取り除きます。
注:皮膚全体の一部は、この段階で保存することができ、ステップ3:細胞純度の確認のためのコントロールとして使用することができます。70 μmセルストレーナーを介してこれらの細胞をひずみ、さらに処理するためにステップ3.5から開始します。 - P1000マイクロピペットで15~20回上下にピペッティングすることにより、メラノサイトメディアの1mLでセルペレットを徹底的に再ステーペンします。メラノサイト培地の1mLを含む6ウェル皿のコーティングされていない井戸に、得られた細胞溶液を滴下して追加します。
- 37°Cおよび5%CO2に設定された組織培養インキュベーターにめっきされた皮膚を均質に置きます。培養物を40分間インキュベートできるようにします。
注:この間、皮膚の一部の線維芽細胞は、メラノサイトとケラチノサイトが懸濁液中に残っている間、コーティングされていない皿に付着します。 - コーティングされていない皿から、コラーゲンコーティングされた6ウェル皿の1ウェルに培養上清を移します。最終的な濃度が 100 ng/mL であることをメディアに G418 を追加します。
- 付着した線維芽細胞を含む未塗装の1つの井戸に線維芽細胞培体の2 mLを追加します。
- 37°Cおよび5%CO2に設定された組織培養インキュベーターで一晩両方の培養物をインキュベートする。
- 別に各培養からメディアや任意の破片を吸引, メッキ後16〜24時間.各皿を1mLの滅菌PBSで2回洗い、次に新鮮なメラノサイトメディアプラス100 ng/mL G418をメラノサイト培養に加え、2mLの新鮮な線維芽細胞培養物を線維芽細胞培養に加えます。
- メラノサイト培養物を48時間G418で処理した後、無菌PBSの1 mLで細胞を2回洗浄し、G418なしで新鮮なメラノサイト培地を2mL加えて培養する。
注:メラノサイト培養中の線維芽細胞がG418後の治療で死に続くように、死んだ細胞を除去し、新鮮なメラノサイトメディアを追加するために無菌PBSで皿を洗います。メラノサイトおよび線維芽細胞培養物は、70-80%の合流性に達したときに通過する必要があります。
3. 細胞純度の確認
- 各培養物から培った培養物を吸引し、各皿を1mLの無菌PBSで丁寧に洗います。
- 各培養物に0.25%トリプシンの0.7mLを加え、トリプシンで培養し37°C、CO2を1分間インキュベートします。
- P1000マイクロピペットを使用して皿の底にトリプシンをピペで取り除きます。
- トリプシン化培養液に適切な培膜の0.7 mLを加え、細胞溶液を1.5mLマイクロ遠心管に移します。
- 室温で2分間750xgの遠心分離による細胞のペレット。P1000マイクロピペットを使用して上清を慎重に取り外し、廃棄します。
注:ステップ3.1-3.5は、メラノサイトおよび線維芽細胞培養物を通過するために使用することができる。得られたペレットは、適切な培地に再懸濁し、新しい、コーティングされていない(線維芽細胞)または前洗浄されたコラーゲンコーティング(メラノサイト)皿に置かれるべきである。 - セルペレットを0.5mLの氷冷PBSで再ステーペントします。
- 050万個の細胞を、あらかじめ冷やされた1.5mLマイクロ遠心分離管に列挙し、移します。
- ステップ 3.5 を繰り返し、100 μL の生存率溶液で細胞を再中断します。暗闇の中で4°Cで30分間セル懸濁液をインキュベートする。
- 手順 3.5~3.6 を 2 回繰り返します。
- ステップ3.5を繰り返し、100μLの氷冷4%パラホルムアルデヒド溶液でペレットを再度サスペンドして細胞を固定する。暗闇の中で室温で15分間懸濁液をインキュベートする。
- ステップ3.5を2回繰り返し、毎回ペレットを0.5mLの3%BSAで1x PBSで再中断する。
- ステップ3.5を繰り返し、0.1%サポニン溶液の100μLで細胞ペレットを再中断する。暗闇の中で室温で15分間懸濁液をインキュベートする。
- ステップ3.5を繰り返し、次いで0.5 μgのウサギ抗gp100抗体を含む0.5μgのサポニン溶液を含む0.1%サポニン溶液の100 μLで細胞ペレットを再中断し、0.5 μgのウサギ抗線維芽細胞特異的タンパク質1(FSP1)抗体および0.025 μgのマウス抗サイトカーチン14(K14)抗体を再び中断する。暗闇の中で室温で1時間の懸濁液をインキュベートする。
注:K14抗体はAlexa Fluor 647にあらかじめ共役して購入されたが、gp100およびFSP1抗体はそれぞれCF 555およびCF 488に結合した。コントロール集団の染色もこのステップで開始する必要があります。制御細胞集団は培養から分離し、ステップ3.5-3.12で説明されているように処理されるべきである。 - ステップ3.11を2回繰り返し、任意の非結合抗体を除去する。
- ステップ3.5を繰り返し、次いで1x PBSで3%BSAの200〜400 μLで細胞ペレットを再ステーペンする。
- 40 μmセルストレーナーを介して5 mLポリスチレン丸底チューブに細胞溶液を渡し、フローサイトメトリーによって歪んだ細胞を分析します。
結果
雄及び雌のC57Bl/6Jマウスを0〜4日目に安楽死させ、トランカル皮膚を上述したように機械的解離を行った。切り刻んだ後、皮膚は構造組織の兆候を欠く粘性スラリーを形成した。このスラリーの遠心分離は、円錐管の底部に大きな細胞ペレットを形成し、上清の上に浮かぶ脂肪の層をもたらした。この脂肪層は、残りの細胞ペレットが再懸濁され、6ウェル皿のコーティングされていない井戸に移された間、上清で廃棄された。細胞の密度が高いので、メディアが曇って見える。しかし、インキュベーションの40分後に、より大きな細胞および組織結合物が培地中で観察され、付着性線維芽細胞は反転光顕微鏡で見ることができた(図1)。
線維芽細胞培養からの非付着細胞を、メラノサイトを単離するためにコラーゲンコーティングされた6ウェル皿の1ウェルに移した。G418の添加は、同質体中の残りの線維芽細胞を死亡させ、その後5日間、多数の死細胞を培養したままにした(図2A-C)。成長の4〜5日後、めっきされたメラノサイトは、メラノサイト顆粒を有するステレオタイプの樹状表現型を服用し始めた(図2C)。この表現型は、培養の通過後に持続した(図2D)。汚染ケラチノサイトのクラスターは、当初メラノサイト培養(図2A)で観察されたが、これらの集団は、その後の通過時に失われた。
フローサイトメトリック分析を用いて、得られた一次メラノサイトおよび線維芽細胞培養物の純度を確認した。C5Nマウスケラチノサイト17、10日目の一次メラノサイト培養および6日目の一次線維芽細胞培養物を染色した:抗gp100(分化メラノサイト)、抗サイトケラチン14(K14;ケラチノサイト)および抗線維芽細胞特異的タンパク質(1)FSP1;線維芽細胞) (図3)これらの細胞では、gp100染色は原発性メラノサイトに特異的であったが、FSP1陽性は線維芽細胞でのみ観察された(図3A,B)。K14の発現はC5Nケラチノサイトに限られた(図3C)。 さらなる分析を行い、単離後1、2、3、4、および10日後のメラノサイト培養物の純度を決定した(図4)。結合線維芽細胞およびケラチノサイト汚染は、培養中の全細胞の25%を超えたことはない(図4B,C)。それにもかかわらず、gp100の劇的な増加は、文化の4日目まで観察されなかった(図4A)。この観察は、メラノサイト前駆体(すなわち、メラノブラスト)におけるgp100の発現の減少に起因し、その多くは培養中の10日目までに完全に区別するように見える(図4A)。要約すると、これらのデータは、当社の急速な単離プロトコルが同時にメラノサイトと線維芽細胞に富む培養物を生成することを示しています。
| ステップ# | 試薬 | 1子犬 | 5子犬 |
| 1.1年 | コラーゲン溶液 | 1.5メートル | 4.5 mL |
| 1.2年 | プレートサイズ | 6ウェル | 10センチメートル |
| 1.4年 | 抗生物質/抗菌性溶液 | 3 mL | 15 mL |
| 1.5年 | 皮膚消化バッファー | 3 mL | 15 mL |
| 1.6年 | メラノサイトメディア | 6 mL | 30 mL |
| 1.7年 | 線維芽細胞メディア | 4 mL | 20 mL |
表 1: 異なるコホートサイズの試薬調製ガイド。

図 1: 一次マウス線維芽細胞培養物の代表的な画像.図示は、単離(A)の直後の線維芽細胞の20倍の画像と、24(B)および48(C)hのポスト分離である。この図のより大きなバージョンを表示するには、ここをクリックしてください。

図 2:一次メラノサイト培養物の代表的な画像。メラノサイト培養物1(A)、2(B)及び4日(C)の20倍の画像を示す。汚染ケラチノサイトは「A」の矢印で示されます。(D) 通過後の一次メラノサイト培養物の代表的な画像。この図のより大きなバージョンを表示するには、ここをクリックしてください。

図 3: 培養純度のフローサイトメトリック評価gp100(A;分化メラノサイト)、FSP1(B;線維芽細胞)およびK14(C;ケラチノサイト)陽性を示す代表的なヒストグラムは、原発性メラノサイト(10日目)、原発線維芽細胞(6日目)およびC5Nケラチノサイトにおける陽性である。生細胞をゲーティングした後、各集団から10,000のイベントを分析した。補正には単一のカラーコントロールが使用され、結果のデータはFlowJoソフトウェアで視覚化されました。この図のより大きなバージョンを表示するには、ここをクリックしてください。
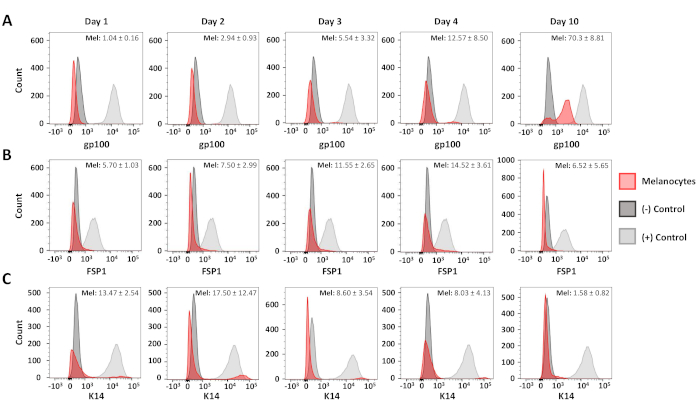
図 4:メラノサイト純度の時間コース分析。メラノサイト純度を示す代表的なヒストグラムは、最初の単離後1〜10日後に示す。サンプルを染色し、分析し、図3に記載されているようにグラフ化した。陽性および陰性対照集団は、gp100--ヒトメラノサイト(+)、原発性マウス線維芽細胞(-)と同様であった。FSP1--原発性マウス線維芽細胞(+)、ヒトメラノサイト(-);K14--C5N細胞(+)、ヒトメラノサイト(-)。少なくとも3つの異なるメラノサイト培養物の平均陽性と標準偏差は、各グラフの右上隅に示されています。この図のより大きなバージョンを表示するには、ここをクリックしてください。
ディスカッション
一次メラノサイトと線維芽細胞のインインビトロ培養は、皮膚生物学と疾患に関する我々の理解において大きな進歩をもたらした。このプロトコルは、皮膚線維芽細胞の同時単離を可能にしながら、一貫したメラノサイト培養物を生成するために必要な時間と技術的な精通を減らすことによって、以前のメラノサイト単離方法を改善します。この手順の新しい、時間を節約する要素は、真皮と表皮を分離する必要がないです。代わりに、皮膚細胞は、選択的培養剤およびめっき技術と共に機械組織チョッパーの一貫したチョッピング力および粒度を使用して単離される。また、処理の複雑さと実践的な時間を減らすことで、研究者が効率的に大規模な実験を行うことができます。
このプロトコルを使用して歩留まりと一貫性を高めるには、いくつかの手順をお勧めします。まず、ステップ2.4の前に、皮膚の真皮側から脂肪組織を掻き取るために湾曲した鉗子を使用することをお勧めます。このプロセスは、遠心分離後に形成された脂肪ケーキを減らします。次に、皮膚の適切な機械的解離は、このプロトコルの成功に不可欠であり、ブレードの各パスの後にホモジナイザーディスク〜60°を回転させることによって増強することができる。もう 1 つの重要な手順は、ステップ 2.10 ですべてのスキン ダイジェスト バッファが削除されるようにすることです。そうしないと、皿への細胞の接着を妨げ、収率を大幅に低下させる。ペレットはステップ2.10で15mL円錐管の底部にしっかりと貼付されていないため、上清がゆっくりと除去されなければ細胞を吸引しやすい。皮膚消化バッファーの完全な除去が困難である場合は、メラノサイト培地の2-3 mLでペレットを洗浄し、めっき前に2.9-2.10の手順を繰り返すことをお勧めします。最後に、ステップ2.11で細胞ペレットを再中断する場合、任意の塊を分解し、細胞培養皿の表面に細胞が均等に分布していることを確認するために、激しくピプテットすることが重要です。破片や死んだ細胞は、分離後の最初の数日間に培養中に観察されます。これらの死んだ細胞は、培養の成長を妨げる可能性があり、PBSで皿を洗浄し、新鮮なメディアを追加することによって除去する必要があります。
このプロトコルは、単一のマウスから一次メラノサイトおよび線維芽細胞培養物を生成する方法を概説する。しかし、この手順は、マウスのより大きなコホートに対応するように効果的に調整することができる(表1参照)。より大きなコホートの場合、4-5の子犬から均質化された皮膚を組み合わせると、単離後4〜5日以内にメラノサイトの30〜40%のコンフルエント10cm皿が生じます。複数の動物を操作する場合、このプロトコルの効率を向上させるためにいくつかの技術を使用できます。まず、我々は通常、一度に2匹の動物を処理し、4組の動物を安楽死させます。2匹の子犬から均質化された皮膚を、スキンダイジェストバッファーの体積を6mLに増やすことで、ステップ2.7~2.8で組み合わせることができることがわかった。時間を節約するために、最初のセットが均質化と消化を受けている間、私たちは次のペアの子犬から皮膚を分離し始めます。このアプローチは、細胞集団が安楽死後すぐに単離されることを保証し、複数の動物に必要な処理時間を短縮します。古いマウス(すなわち、出生後2-4日)で作業する場合、活性組織チョッパー(ステップ2.6)を介して4回目に皮膚を通過させることは、皮膚の均質化および細胞収率を高めることを見出した。この技術を用いて、メラノサイトまたは線維芽細胞収率に年齢依存的な差は見られなかった。
このプロトコルは、同じ皮膚サンプルから線維芽細胞およびメラノサイト培養物を同時に生成する方法を詳述する。我々は、メラノサイトの強制的な脱落と共に短期トリプシン化が行われるとき、初期メラノサイト培養中のケラチノサイトが皿に付着したままであることを観察した(手順3.2-3.3参照)。我々はこれらの残りの細胞の伝播方法を最適化していないが、我々は100 ng/mL G418を補充したケラチノサイト培養におけるそのような付着集団の培養を継続すると、細胞集団を豊かにする可能性があると仮定する。
開示事項
著者は、開示する利益相反を持っていません。
謝辞
著者らは、デーモン・ルニヨン財団(イノベーション賞#38-16~C.E.B.)とペロトニア(B.M.M.)の財政支援に感謝しています。原稿文を改善するためのコメントを提供してくれたC・ヘインズとC.ワームスバエッチャーに感謝しています。この研究は、NIH P30 CA016058によってサポートされているオハイオ州総合癌センターの分析サイトメトリー共有リソースの恩恵を受けました。
資料
| Name | Company | Catalog Number | Comments |
| 0.2 µm PES sterile syringe filter | VWR | 28145-501 | |
| 10 cm cell culture dish | Corning | 430167 | |
| 40 µm cell strainer | Fisher Scientific | 22363547 | |
| 5 mL polystyrene round-bottom tubes | Fisher Scientific | 352008 | |
| 6-well cell culture dish | Sigma-Aldrich | SIAL0516 | |
| 70 µm cell strainer | Fisher Scientific | 22363548 | |
| Antibiotic Antimycotic Solution (100x) | Sigma-Aldrich | A5955 | |
| Bovine Serum Albumin | Fisher Scientific | BP9706-100 | |
| CF 488A Mix-n-Stain Antibody Labeling Kit | Biotium | 92273 | |
| CF 555 Mix-n-Stain Antibody Labeling Kit | Biotium | 92274 | |
| Cholera Toxin | Sigma-Aldrich | C8052 | |
| Collagen from rat tail | Sigma-Aldrich | C7661 | |
| Collagenase Type I | Worthington Biochemicals | LS004156 | |
| Corning Penicillin/Streptomycin Solution | Fisher Scientific | 30-002-CL | |
| Cytokeratin 14 Antibody Alexa Fluor 647 | Novus Biologicals | NBP2-34403AF647 | |
| Deoxyribonuclease I | Worthington Biochemicals | LS002058 | |
| Di-butyryl cyclic AMP | Sigma-Aldrich | D0627 | |
| Dulbecco's Modified Eagle Medium | Gibco | 12800-082 | |
| Dulbecco's Phosphate Buffered Saline | Sigma-Aldrich | D8537 | |
| eBioscience Fixable Viability Dye eFluor 780 | Thermo Fisher | 65-0865-14 | |
| Ethanol, 200 proof | Fisher Scientific | 22032601 | |
| Fetal Bovine Serum | Sigma-Aldrich | 12306C | |
| FSP1/S100A4 antibody | Millipore Sigma | 07-2274 | |
| G418 Disulfide | P212121 | LGB-418-1 | |
| Glacial Acetic Acid | VWR | VWRV0714 | |
| Horse Serum | Fisher Scientific | 26050088 | |
| HyClone L-Glutamine | Fisher Scientific | SH3003402 | |
| McIlwain Tissue Chopper | Ted Pella | 10180 | |
| Melanoma gp100 antibody | Abcam | ab137078 | |
| Nutrient Mix F-12 Ham's Media | Sigma-Aldrich | N6760 | |
| Phorbol 12-Myristate 13-acetate | Sigma-Aldrich | P8139 | |
| Pierce 16% Formaldehyde | Thermo Fisher | 28908 | |
| Porcine Trypsin | Sigma-Aldrich | 85450C | |
| RPMI 1640 media | Sigma-Aldrich | R8758 | |
| Saponin | Sigma-Aldrich | S-7900 | |
| Tissue Chopper Blade | Ted Pella | 121-6 | |
| Tissue Chopper Plastic Disk | Ted Pella | 10180-01 | |
| Trypsin | VWR | VWRL0154-0100 |
参考文献
- Rittie, L. Cellular mechanisms of skin repair in humans and other mammals. Journal of Cell Communucation and Signal. 10 (2), 103-120 (2016).
- Romanovsky, A. A. Skin temperature: its role in thermoregulation. Acta Physiologica (Oxf). 210 (3), 498-507 (2014).
- Holick, M. F., Smith, E., Pincus, S. Skin as the site of vitamin D synthesis and target tissue for 1,25-dihydroxyvitamin D3. Use of calcitriol (1,25-dihydroxyvitamin D3) for treatment of psoriasis. Archives of Dermatology. 123 (12), 1677-1683 (1987).
- Yamaguchi, Y., Hearing, V. J. Physiological factors that regulate skin pigmentation. Biofactors. 35 (2), 193-199 (2009).
- Yamaguchi, Y., Hearing, V. J. Melanocytes and their diseases. Cold Spring Harbor Perspectives in Medicine. 4 (5), (2014).
- Brenner, M., Hearing, V. J. The protective role of melanin against UV damage in human skin. Photochemistry and Photobiology. 84 (3), 539-549 (2008).
- Thody, A. J., et al. Pheomelanin as well as eumelanin is present in human epidermis. The Journal of Investigative Dermatology. 97 (2), 340-344 (1991).
- Swope, V. B., Abdel-Malek, Z. A. MC1R: Front and Center in the Bright Side of Dark Eumelanin and DNA Repair. International Journal of Molecular Science. 19 (9), (2018).
- Barsh, G. S. What controls variation in human skin color. PLoS biology. 1 (1), 27 (2003).
- Abdel-Malek, Z., et al. The melanocortin-1 receptor is a key regulator of human cutaneous pigmentation. Pigment Cell Research. 13, 156-162 (2000).
- Gronskov, K., Ek, J., Brondum-Nielsen, K. Oculocutaneous albinism. Orphanet Journal of Rare Diseases. 2, 43 (2007).
- Kwon, S. H., Hwang, Y. J., Lee, S. K., Park, K. C. Heterogeneous Pathology of Melasma and Its Clinical Implications. International Journal of Molecular Sciences. 17 (6), (2016).
- D'Orazio, J., Jarrett, S., Amaro-Ortiz, A., Scott, T. UV radiation and the skin. International Journal of Molecular Science. 14 (6), 12222-12248 (2013).
- Bonnans, C., Chou, J., Werb, Z. Remodelling the extracellular matrix in development and disease. Nature Reviews Molecular Cell Biology. 15 (12), 786-801 (2014).
- Kendall, R. T., Feghali-Bostwick, C. A. Fibroblasts in fibrosis: novel roles and mediators. Frontiers in Pharmacology. 5, 123 (2014).
- Kalluri, R. The biology and function of fibroblasts in cancer. Nature Reviews Cancer. 16 (9), 582-598 (2016).
- Dickson, M. A., et al. Human keratinocytes that express hTERT and also bypass a p16(INK4a)-enforced mechanism that limits life span become immortal yet retain normal growth and differentiation characteristics. Molecular and Cellular Biology. 20 (4), 1436-1447 (2000).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved