Method Article
1 차적인 뮤린 멜라닌세포 및 섬유아세포 배양물의 급속한 생성
요약
이 프로토콜은 0-4일 된 마우스의 피부로부터 멜라닌세포 및 섬유아세포 배양을 동시에 생성하는 신속한 방법을 간략하게 설명한다. 이러한 1차 배양은 피부 세포 생물학, 색소 침착, 상처 치유 및 흑색종을 포함한 다양한 생리학적 관련 과정을 연구하기 위해 시험관 내에서 유지 및 조작될 수 있다.
초록
섬유아세포 또는 멜라닌세포 기능의 결함은 열악한 장벽 기능, 결함있는 상처 치유, 색소 침착 결함 및 암을 포함한 피부 질환과 관련이 있습니다. 이러한 질병의 이해와 개량에 필수적인 것은 1 차적인 섬유아세포 및 멜라닌세포 배양에서의 실험이다. 그럼에도 불구하고, 멜라닌세포 격리를 위한 현재 프로토콜은 피부의 표피 및 진피 층이 트립시니화되고 수동으로 분리되도록 요구한다. 이 프로세스는 시간이 많이 걸리고 기술적으로 어렵고 일관성없는 수율에 기여합니다. 더욱이, 동일한 조직 샘플로부터 순수한 섬유아세포 배양을 동시에 생성하는 방법은 용이하게 사용할 수 없다. 여기서, 우리는 출생 후 일 0-4에 마우스의 피부에서 멜라닌 세포와 섬유 아세포를 분리하기위한 개선 된 프로토콜을 설명합니다. 이 프로토콜에서 전체 피부는 조직 헬기를 사용하여 기계적으로 균질화된 다음 콜라게나아제와 트립신으로 간략하게 소화됩니다. 세포 집단은 G418 처리에 선행된 선택적인 도금을 통해 그 때 단리됩니다. 이 절차는 90 분 이내에 단일 마우스에서 일관된 멜라닌 세포 및 섬유 아세포 수율을 초래한다. 이 프로토콜은 또한 쉽게 확장 할 수 있으므로 연구원은 실습 시간의 상당한 증가없이 동물의 큰 집단을 처리 할 수 있습니다. 우리는 이 프로토콜을 사용하여 확립된 배양이 멜라닌세포 또는 섬유아세포에 대해 매우 풍부하다는 것을 유동 세포 측정 평가를 통해 보여줍니다.
서문
포유류 피부는 이물질과 자외선 조사 (UVR)로부터 신체를 보호하는 다층 기관입니다. 피부는 또한 상처 치유, 온도 조절 및 비타민 D 생산 1,2,3과같은 항상성 과정에 중요한 역할을합니다. 포유류 피부는 멜라닌 세포, 섬유아세포 및 각질 세포의 세 가지 주요 세포 유형으로 구성됩니다. 이러한 세포 유형은 표피를 구성하는 각질 세포, 진피및 멜라닌 세포에 거주하는 섬유아세포가 표피-진피 접합부 및 모낭에 국한되는 등피부의 상이한 층을 채웁니다 4. 여기에서, 우리는 뮤린 피부에서 1 차적인 melanocyte 및 섬유아세포 배양물의 동시 생성을 가능하게 하는 간단한 절차를 자세히 설명합니다.
멜라닌세포는 기저표피, 홍채, 달팽이관, 뇌 및 모낭을 포함한 인체 전역의 많은 위치에서 발견되는 안료 생성 세포5. 멜라닌세포의 주요 기능은 멜라닌 함유 소포를 5,6. 멜라노솜은 멜라닌의 두 가지 주요 클래스를 포함: 갈색/블랙 유멜라닌과 노란색/레드 페오멜라닌6,7. 멜라닌세포 내의 생화학적 과정은 각 멜라닌 종의 상대적 풍부를 조절하고 모발, 피부 및 눈 색깔을 결정하는 데 도움을 줍니다8,9. 멜라닌은 또한 UVR을 흡수하고 돌연변이 발생10에서태양 에 노출된 조직을 보호하는 역할을합니다.
Melanocyte 기능 장애는 색소 결함을 일으키는 원인이 되고 피부암 감수성을 증가할 수 있습니다. 예를 들어, 멜라스마의 특징인 과색색 피부 패치는 국소 멜라닌 과잉 생산의 결과인 반면, 멜라닌 합성에 관여하는 유전자를 손상시키는 생식선 유전 적 돌연변이는 백색증11,12로 이어진다. . melanocyte 생물학의 친밀한 지식은 그 같은 색소 결함을 정정하고 궁극적으로 이 질병으로 고통받는 개별의 심리사회적 복지를 향상할 전략을 개발하기 위하여 요구됩니다. 멜라닌 생산 및/또는 페오멜라닌의 우대 합성에 있는 적자는 또한 증가한 피부암 리스크10와연관됩니다. 이 위험은 감소 된 UVR 보호6,13에서발생하는 것으로 추정된다. 따라서, 멜라닌 세포에서 유멜라닌 생산을 강화 하거나 복원 하는 방법은 이러한 인구에 피부 암의 발생률을 줄일 수 있습니다.
중간 엽 섬유 아세포는 피부(14)의진피 층을 포함하여 신체의 모든 장기에 대한 결합 조직 및 구조적 지지를 확립한다. 콜라겐, 엘라스틴, 라미닌 및 섬유넥틴과 같은 단백질의 배설은 섬유아세포가 조직 무결성에 필수적인 세포외 매트릭스(ECM)를 형성할 수 있게 한다 1,14. 섬유아세포는 또한 상처 치유, 염증, 혈관신생 및 암 형성/진행과 같은 과정에 필수적인 역할을 한다1,15,16.
멜라닌 세포와 유사하게, 섬유아세포 활성화 및 기능의 결함은 종양 발생 및 질병을 촉진할 수 있다. 예를 들어, 부적절한 섬유아세포 활성화는 일반적으로 섬유증의 형성으로 이어지며, 이는 과잉 ECM 성분을 주변 조직으로 증착한 결과로 생긴다. 섬유아세포는 신체의 구조적 무결성의 대부분을 유지함에 따라, 섬유증은 특발성 폐 섬유증, 전신 경화증, 간 경화증 및 심장 섬유증을 포함하여 수많은 조직 및 장기에 영향을 미치는 질병을 촉진합니다15. 섬유아세포는 또한 암16에있는 중요한 역할을 합니다. 암 관련 섬유아세포 (CAFs)는 많은 종양의 미세 환경에서 가장 풍부한 비 악성 세포입니다. CAFs는 조직 강성, 국소 사이토카인 생산 및 면역 기능(16)을조절함으로써 종양 증식, 진행 및 치료 내성을 촉진하는 것으로 나타났다.
1 차적인 세포 배양은 질병으로 이끌어 내는 melanocyte 및 섬유아세포 결점을 확인하고 완화하기 위하여 유전으로 견인할 수 있는 모형을 연구원을 제공합니다. 그러나, melanocyte 문화를 설치하는 현재 방법은 시간이 많이 걸리고 기술적으로 도전적입니다. 표피와 진피의 트립시네이드화와 섬세한 분리의 필요성은 실험 수율의 가변성에 기여하고 대규모 실험을 수행하기 어렵게 만듭니다. 더욱이, 전체 피부에서 멜라닌 세포와 섬유아세포를 동시에 분리하는 프로토콜은 현재 현장에서 부족합니다.
우리는 동일한 전체 피부 샘플에서 멜라닌 세포 및 섬유 아세포 배양을 확립하는 데 필요한 처리 단계, 가변성 및 시간을 줄이는 방법을 개발했습니다. 기계적 균질화 방법을 사용하여 간략한 소화를 통해 당사의 전략은 동시 섬유아세포 분리를 가능하게 하면서 1차 멜라닌 을 분리하는 데 필요한 실습 시간을 크게 줄입니다. 이 프로토콜의 증가된 속도, 효율성 및 일관성은 0-4일 된 쥐로부터 멜라닌을 분리하는 능력과 결합하여 연구원들에게 이전에 가능했던 것보다 더 광범위한 실험을 수행할 수 있는 유연성을 제공합니다.
프로토콜
동물과 관련된 다른 연구를 시작하기 전에 기관 동물 윤리 위원회의 승인을 얻으십시오. 이 프로토콜에서 수행 된 실험은 오하이오 주립 대학의 기관 동물 관리 및 사용위원회 (IACUC, 프로토콜 #2012A00000134)에 의해 승인되었습니다.
1. 프로토콜 준비
참고: 다음 시약 제제 지침은 단일 마우스로부터 9 cm2 멜라닌세포 및 섬유아세포의 배양생성에 적합하다. 더 큰 스케일 절연은 표 1의 시약 준비 가이드를 참조하십시오.
- 0.1 m 빙하 아세트산에 50 μg/mL 콜라겐을 함유한 콜라겐 용액 1.5 mL을 준비합니다.
- 라미나 유량 캐비닛에 8 μg/cm2 (1.44 mL) 콜라겐 용액으로 6 웰 세포 배양 접시 중 하나를 코팅하십시오. 웰이 콜라겐 용액으로 완전히 덮여 있는지 확인하십시오. 접시를 37°C에서 3시간 동안 또는 4°C에서 밤새 배양합니다. 사용하기 전에, 1.35 mL의 멸균 인산완충식염수(PBS)로 콜라겐 코팅을 2회 잘 세척하였다(1 cm당PBS 150 μL).
- 조직 헬기 플랫폼에 잘게 자른 디스크를 조심스럽게 배치하고 멸균 블레이드를 이동식 암에 고정하여 층류 캐비닛에 조직 다기를 조립합니다.
- 멸균 된 PBS에서 100 x 항생제 / 항 균증 스톡 용액을 희석하여 1 x 항생제 / 항 균제 용액 3 mL을 준비하십시오.
- 10% 태아 소 혈청, 1% 페니실린/스트렙토미신 용액, 1% L-글루타민, 10 mg/mL 콜라주나아제 타입 I, 0.25% 포르신 트립신 및 0.02 mg/mL 디옥시리보뉴클레스 I를 함유한 신선한 피부 소화 완충제 3 mL을 준비합니다.
- 10% 태아 소 혈청을 함유한 신선한 멜라닌세포 미디어 6 mL를 준비하고, 7% 말 혈청, 1% 페니실린/스트렙토마이신 용액, 1% L-글루타민, 0.5 mM 디-부티릴 사이클앰프(dbcAMP), 20 nM 테트레이드카노일포어볼 13-아세테이트(TPA) 및 200 pM 콜레라 독소(CT) 영양 믹스 F-12 햄의 미디어.
참고: 농축 된 dbcAMP, TPA 및 CT 재고 솔루션을 만들어 - 80 °C에서 >1 년 동안 aliquoted 및 보관 할 수 있습니다. 이러한 성분이 결여된 염저 매질은 4°C에서 최대 1개월 동안 보관할 수 있다. - Dulbecco의 수정 된 독수리 매체에 10 % 태아 소 혈청, 1 % 페니실린 / 스트렙토 마이신 및 1 % L-글루타민을 함유 한 섬유 아세포 배지 4 mL을 준비하십시오. 이 매체는 최대 1개월 동안 4°C에서 보관할 수 있다.
- PBS에서 16% 파라포름알데히드를 희석하여 4% 파라포름알데히드 용액의 40 mL를 준비합니다. 1개월 동안 4°C, 최대 1년 동안 -20°C에서 본인의 본분을 보관하십시오.
- 사포닌이 완전히 용해될 때까지 37°C에서 PBS 50 mL에 0.5 g의 사포닌을 혼합하여 1% 사포닌 스톡 용액을 준비한다. 0.2 μm PES 필터가 장착된 50 mL 주사기를 사용하여 장기 보관용 용액을 살균합니다. 생성된 사포닌 스톡 용액은 1개월 동안 4°C에서 유지될 수 있다.
- 3% 소 혈청 알부민(BSA)을 함유하는 PBS에서 1% 사포닌 스톡 용액을 희석하여 마우스당 0.1% 사포닌 용액 의 200 μL을 준비한다.
- PBS 1 mL에서 1 μL의 고정 가능한 생존 용염을 희석하여 생존 용액 1 mL을 준비하십시오.
2. 멜라닌 세포 와 섬유 아세포 격리
- 0-4일 된 수컷 및/또는 암컷 C57Bl/6J 새끼를 참수하여 안락사시키고 수술용 가위를 사용하여 안락사된 마우스에서 사지를 제거합니다.
- 층류 캐비닛에서, 70% 에탄올을 함유한 멸균 페트리 접시에 각 마우스의 트렁크를 짧게 굴린다. 에탄올에서 트렁크를 제거하고 빈 멸균 페트리 접시에 넣습니다.
- 70 % 에탄올로 멸균 된 수술 용 가위를 사용하여 목에서 꼬리까지 트렁크의 복부 쪽의 피부를 절개합니다. 멸균 집게를 사용하여 마우스 트렁크에서 피부를 벗깁니다.
- 피부 진피 면을 항생제/항균액 3mL가 함유된 6웰 접시에 놓고 실온에서 2-3분 동안 배양합니다.
- 장소에 다음과 같은 설정으로 조직 헬기를 켜십시오 : 슬라이스 두께 : 1 μm; 블레이드 힘 : ~ 60 % 최대; 속도 : ~ 최대의 50 %.
- 피부를 아래로, 멸균 조직 헬기 디스크로 옮기고 활성화 된 조직 헬기를 통해 피부를 완전히 3 회 전달합니다.
- 균질화된 피부를 3 mL의 피부 소화 완충제 함유 멸균, 15 mL 원엽 관으로 옮김. P1000 마이크로파이펫으로 10-15회 위아래로 파이펫팅하여 생성된 현탁액을 혼합합니다.
- 원추형 튜브를 캡하고 샘플을 37°C 수조에서 15분 동안 인큐베이션하고 튜브를 3-5분마다 반전시다.
- 펠렛 은 750 x g에서 스윙 버킷 로터에서 원원관을 원심분리하여 실온에서 5 분 동안 피부의 세포를 균질화한다.
- P1000 마이크로파이펫을 사용하여 펠릿을 방해하지 않도록 주의하면서 피부 소화 버퍼를 천천히 완전히 제거합니다.
참고: 전체 피부의 일부를 이 단계에서 저장하고 3단계: 세포 순도 확인을 위한 대조군으로 사용할 수 있습니다. 70 μm 세포 여과기를 통해 이 세포를 변형시키고 추가 처리를 위한 단계 3.5에서 시작합니다. - P1000 마이크로파이펫으로 15-20회 위아래로 파이펫팅하여 멜라노시테 미디어 1mL에서 세포 펠릿을 완전히 재중단시면 됩니다. 생성된 세포 용액을 멜라노시테 1mL를 함유한 6웰 접시의 코팅되지 않은 우물에 떨어뜨립니다.
- 도금된 피부를 37°C 및 5% CO2로 설정된 조직 배양 인큐베이터에 균질화한다. 배양이 40분 동안 배양되도록 합니다.
참고: 이 시간 동안 피부 균질화의 일부 섬유 아세포는 코팅되지 않은 접시에 부착되며 멜라닌 세포와 각질 세포는 현탁액에 남아 있습니다. - 코팅되지 않은 접시에서 미리 세척된 콜라겐 코팅 6웰 접시에 배양을 옮김을 옮김을 옮김을 옮김을 옮김을 옮김을 옮김을 옮김을 옮김으로 옮김을 옮김을 옮김으로 옮김을 옮김을 담아낸다. 최종 농도가 100 ng/mL이 되도록 미디어에 G418을 추가합니다.
- 섬유아세포 미디어 2 mL를 코팅되지 않은 접시 의 한 우물에 넣고, 이제 부착 된 섬유 아세포가 들어 있습니다.
- 37°C 및 5% CO2로 설정된 조직 배양 인큐베이터에서 하룻밤 동안 두 배양체를 배양한다.
- 별도로 도금 후, 각 배양에서 미디어 및 파편을 흡인, 16-24 시간. 멸균 PBS 1 mL로 각 접시를 두 번 씻은 다음 신선한 멜라노시테 미디어 2 mL과 멜라닌 세포 배양에 100 ng/mL G418을 추가하고 섬유아세포 배양에 신선한 섬유아세포 배지 2 mL를 추가합니다.
- 멜라닌세포 배양액을 48시간 동안 G418로 처리한 후, 세포를 멸균 PBS 1 mL로 2회 세척하고 G418 없이 신선한 멜라노세포 배지 2 mL를 배양한다.
참고: 멜라닌세포 배양액의 섬유아세포가 G418 후 처리에서 계속 죽어가면서, 멸균 된 PBS로 접시를 씻어 죽은 세포를 제거하고 신선한 멜라닌 세포 매체를 추가하십시오. 멜라닌 세포와 섬유아세포 배양은 70-80 % 동률에 도달 할 때 통과되어야합니다.
3. 세포 순도 확인
- 각 배양물에서 미디어를 흡인하고 각 접시를 멸균 PBS 1 mL로 조심스럽게 씻습니다.
- 각 배양에 0.25% 트립신의 0.7 mL를 추가하고 1분 동안 37°C 및 5% CO2에서 트립신에서 배양한다.
- P1000 마이크로파이펫을 사용하여 트립신을 접시 바닥에 파이펫팅하여 세포를 빼내십시오.
- 각 트립시네이션 배양액에 0.7 mL의 적절한 배지를 첨가하고 세포 용액을 1.5 mL 미세원원지 튜브로 옮김을 전달한다.
- 실온에서 2 분 동안 750 x g에서 원심 분리에 의해 세포를 펠렛. P1000 마이크로파이펫을 사용하여 상급체를 조심스럽게 제거하고 폐기하십시오.
참고: 단계 3.1-3.5는 멜라닌 세포 및 섬유아세포 배양을 통과하는 데 사용될 수 있다. 생성된 펠릿은 적절한 매체에 다시 부유하고 코팅되지 않은 새로운(섬유아세포) 또는 미리 세척된 콜라겐 코팅(melanocytes) 접시에 놓아야 합니다. - 얼음 차가운 PBS의 0.5 mL에 세포 펠릿을 다시 중단.
- 0.5백만 개의 세포를 미리 냉각된 1.5 mL 미세원원지 튜브로 열거하고 이송합니다.
- 3.5단계를 반복한 다음 100 μL의 생존 용액으로 세포를 다시 중단합니다. 암흑에서 4°C에서 30분 동안 세포 현탁액을 배양한다.
- 3.5-3.6단계를 두 번 반복합니다.
- 3.5단계를 반복한 다음, 100 μL의 얼음 차가운 4% 파라포름알데히드 용액으로 펠릿을 재중단시킴으로써 세포를 고정시켰다. 어둠 속에서 실온에서 15 분 동안 현탁액을 배양하십시오.
- 반복 단계 3.5 두 번, 때마다 1 x PBS에서 3% BSA의 0.5 mL에서 펠릿을 다시 중단.
- 3.5단계를 반복한 다음, 0.1% 사포닌 용액의 100 μL에서 세포 펠릿을 다시 중단시켰다. 어둠 속에서 실온에서 15 분 동안 현탁액을 배양하십시오.
- 반복 단계 3.5, 토끼 항 gp100 항체의 0.5 μg를 포함하는 0.1% 사포닌 용액의 100 μL에서 세포 펠릿을 재중단한 다음, 토끼 항섬유아세포 특이적 단백질 1(FSP1) 항체 및 0.025 μg의 마우스 항-시토케라틴 14(K1body)를 함유한다. 어둠 속에서 실온에서 1 시간 동안 현탁액을 배양하십시오.
참고: K14 항체는 알렉사 플루어 647에 미리 접합된 구입되었지만, gp100 및 FSP1 항체는 각각 CF 555 및 CF 488로 공액화되었다. 제어 인구의 얼룩도이 단계에서 시작해야합니다. 제어 세포 집단은 3.5-3.12 단계에서 기재된 바와 같이 배양으로부터 분리되고 처리되어야 한다. - 3.11 단계를 두 번 반복하여 언바운드 항체를 제거합니다.
- 3.5단계를 반복한 다음, 1x PBS에서 3% BSA의 200-400 μL에서 세포 펠릿을 재중단시켰다.
- 40 μm 세포 스트레이너를 통해 세포 용액을 5 mL 폴리스티렌 라운드 바닥 튜브에 전달하고 유세포 분석에 의해 변형 된 세포를 분석합니다.
결과
수컷 및 암컷 C57Bl/6J 마우스는 0-4일 후에 안락사되었고, 트렁크 피부는 전술한 바와 같이 기계적 해리를 행하였다. 잘라낸 후, 피부는 구조 조직의 흔적이없는 점성 슬러리를 형성했다. 이 슬러리의 원심 분리는 원유관의 바닥에 큰 세포 펠릿의 형성과 상층의 상단에 떠있는 지방층의 형성을 초래했다. 이 지방층은 상층부로 폐기되었고, 나머지 세포 펠릿은 재중단되어 6웰 접시의 코팅되지 않은 우물로 옮겨졌다. 셀의 밀도가 높음으로 인해 미디어가 흐린 것처럼 보입니다. 그러나, 배양 40분 후, 더 큰 세포 및 조직 재벌은 매체에서 관찰되었고 부착섬유아세포는 거꾸로된 광현미경으로 볼 수 있었다(도 1).
섬유아세포 배양으로부터 의 부착되지 않은 세포를 멜라닌세포를 분리시키기 위해 콜라겐 코팅된 6웰 접시 중 하나의 웰로 옮겼다. G418의 추가는 균질체에 있는 어떤 남아 있는 섬유아세포든지 죽였고, 다음 5일 동안 수많은 죽은 세포가 미디어에 떠 있는 떠나 (그림2A-C). 성장 4-5 일 후, 도금 된 멜라닌 세포는 멜라닌 과립과 고정 관념 적인 수지상 표현형을 취하기 시작했습니다 (그림2C). 이러한 표현형은 배양물의 통과 후에도 지속되었다(도2D). 오염 각질 세포의 클러스터는 처음에 멜라닌 세포 배양에서 관찰된 동안 (그림2A),이 인구는 후속 통과시 손실되었다.
유세포분석은 생성된 1차 멜라닌세포 및 섬유아세포 배양물의 순도를 확인하기 위해 사용되었다. C5N 마우스 각질 세포17,10 일 10 일 1 차 적인 섬유아세포 배양및 6 일 1 차 적인 섬유아세포 배양물로 염색되었습니다: 반대로 gp100 (분화한 melanocytes), 반대로 Cytokeratin 14 (K14; 각질 세포질) 및 항 섬유아세포 특이적 단백질 1( FSP1; 섬유 아세포)(그림 3). 이들 세포에서, gp100 염색은 1차 멜라닌세포에 특이적이었고, FSP1 양성은 섬유아세포에서만 관찰되었다(도3A,B). K14의 발현은 C5N 각질세포로 제한되었다(도3C). 추가 분석은 격리 후 1, 2, 3, 4 및 10일 후 우리의 멜라닌세포 배양물의 순도를 결정하기 위해 수행되었다(도 4). 결합된 섬유아세포 및 각질세포 오염은 배양내 총 세포의 25%를 초과하지 않았다(도4B,C). 그럼에도 불구하고, gp100의 극적인 증가는 배양에서 4일째까지 관찰되지 않았다(도4A). 우리는 멜라닌 세포 전구체 (즉, 멜라노 블라스트)에서 gp100의 감소 된 발현에 이러한 관찰을 기인하며, 그 중 많은 것이 배양10일째까지 완전히 분화되는 것으로 나타났다(도4A). 요약하면, 이러한 데이터는 우리의 급속한 격리 프로토콜이 동시에 멜라닌 세포와 섬유아세포에 대해 풍부한 배양을 생성한다는 것을 보여줍니다.
| 단계 # | 시약 | 강아지 1개 | 새끼 5개 |
| 1.1 | 콜라겐 용액 | 1.5 mL | 4.5 mL |
| 1.2 | 플레이트 크기 | 6-웰 | 10cm |
| 1.4 | 항생제 / 항균제 용액 | 3 mL | 15 mL |
| 1.5 | 피부 소화 버퍼 | 3 mL | 15 mL |
| 1.6 | 멜라닌시테 미디어 | 6 mL | 30 mL |
| 1.7 | 섬유아세포 미디어 | 4 mL | 20 mL |
표 1: 다양한 코호트 크기에 대한 시약 제제 가이드.

그림 1 : 1차 뮤린 섬유아세포 배양물의 대표적인이미지. 도시된 섬유아세포의 20x 이미지는 분리직후(A), 뿐만 아니라 24(B) 및 48(C) h 사후 격리이다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2 : 1차 멜라닌세포 배양물의 대표적인 이미지. 도시된 멜라닌세포 배양물 1(A),2(B) 및 4일(C)의 20x 상심이다. 오염 각질 세포는 'A'의 화살표로 표시됩니다. (D) 1차 멜라닌세포 배양후의 대표적인 이미지. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3 : 배양 순도의 유동 세포 측정 평가. gp100 (A; 분화 된 멜라닌 세포), FSP1 (B ; 섬유 아세포) 및 K14 (C; 각질 세포) 1 차 멜라닌 세포 (일째 10), 1 차 섬유 아세포 (6 일째) 및 C5N 각질 세포체를 나타내는 대표적인 이스토그램. 살아있는 세포에 게이팅 후에, 각 인구에서 10,000개의 사건이 분석되었습니다. 단일 색상 컨트롤은 보정에 사용되었고 결과 데이터는 FlowJo 소프트웨어로 시각화되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
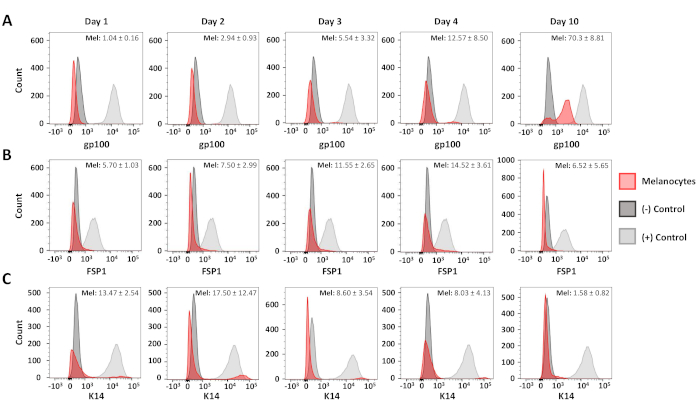
그림 4 : 멜라닌세포 순도의 시간 과정 분석. 멜라닌세포 순도를 나타내는 대표적인 히스토그램은 초기 분리 후 1-10일. 도 3에 기재된 바와 같이 샘플을 염색, 분석 및 그래프화하였다. 양성 및 음성 대조군 집단은 다음과 같이 되었다: gp100-인간 멜라닌세포 (+), 1차 뮤린 섬유아세포(-); FSP1-원발성 뮤린 섬유아세포 (+), 인간 멜라닌세포(-); K14--C5N 세포 (+), 인간 멜라닌 세포 (-). 적어도 3개의 뚜렷한 멜라닌세포 배양에 대한 평균 양성 및 표준 편차는 각 그래프의 오른쪽 상단 모서리에 도시되어 있다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
1 차적인 melanocytes및 섬유아세포의 체외 문화는 피부 생물학 및 질병의 우리의 이해에 있는 중요한 전진으로 이끌어 냈습니다. 이 프로토콜은 피부 섬유아세포의 동시 분리를 허용하면서 일관된 멜라닌세포 배양을 생성하는 데 필요한 시간과 기술적 숙련도를 감소시킴으로써 이전의 멜라닌세포 분리 방법을 향상시킵니다. 이 절차의 새로운 시간 절약 요소는 진피와 표피를 분리 할 필요가 없다는 것입니다. 대신, 피부 세포는 선택적 매체 및 도금 기술과 더불어 기계 조직 헬기의 일관된 도마력 및 세분성을 사용하여 단리됩니다. 이 절차를 통해 처리 복잡성과 실습 시간을 단축함으로써 연구원들이 대규모 실험을 효율적으로 수행할 수 있습니다.
이 프로토콜을 사용하여 수율과 일관성을 향상시키기 위해 몇 가지 단계를 권장합니다. 첫째, 2.4 단계 이전에 는 곡선 집게를 사용하여 피부의 진피 측에서 지방 조직을 긁어 내는 것이 좋습니다. 이 과정은 원심 분리 후 형성 된 지방 케이크를 줄일 수 있습니다. 다음으로, 피부의 적절한 기계적 해리는 이 프로토콜의 성공에 매우 중요하며 블레이드의 각 통과 후 균질화 디스크 ~60°를 회전시킴으로써 향상될 수 있다. 또 다른 중요한 단계는 2.10단계에서 모든 스킨 다이제스트 버퍼를 제거하는 것입니다. 그렇게하지 않으면 접시에 세포 접착을 방해하고 수율을 크게 감소시게됩니다. 펠릿은 2.10단계에서 15 mL 원엽 관의 바닥에 단단히 부착되지 않기 때문에 상열제가 천천히 제거되지 않으면 세포가 쉽게 흡인될 수 있습니다. 피부 소화 완충제의 철저한 제거가 어려운 경우, 우리는 멜라노 세포 미디어의 2-3 mL에서 펠릿을 세척한 다음 도금 전에 2.9-2.10 단계를 반복하는 것이 좋습니다. 마지막으로, 2.11 단계에서 세포 펠릿을 재중단 할 때, 어떤 덩어리를 분해하고 세포가 세포 배양 접시의 표면에 고르게 분포되도록하기 위해 적극적으로 피펫하는 것이 중요합니다. 파편과 죽은 세포는 격리 후 처음 며칠 동안 배양에서 관찰될 것이다. 이 죽은 세포는 배양의 성장을 방해할 수 있고 PBS로 접시를 세척하고 신선한 매체를 추가하여 제거되어야 합니다.
이 프로토콜은 단일 마우스로부터 1차 멜라닌세포 및 섬유아세포 배양체를 생성하는 방법을 간략하게 설명한다. 그러나, 절차는 효과적으로 마우스의 더 큰 집단을 수용하기 위하여 조정될 수 있다 (표 1참조). 더 큰 코호트의 경우, 4-5 개의 새끼에서 피부 균류를 결합하면 격리 4-5 일 이내에 멜라닌 세포의 30-40 % 동시 10cm 접시가 생성됩니다. 여러 동물과 함께 작업할 때 이 프로토콜의 효율성을 향상시키기 위해 여러 가지 기술을 사용할 수 있습니다. 첫째, 우리는 일반적으로 한 번에 두 마리의 동물을 처리, 네 세트의 동물을 안락사. 우리는 두 새끼에서 균질화 된 피부가 6 mL로 피부 다이제스트 버퍼의 볼륨을 증가시켜 단계 2.7-2.8에서 결합 될 수 있음을 발견했다. 시간을 절약하기 위해, 우리는 첫 번째 세트가 균질화와 소화를 겪고있는 동안 강아지의 다음 쌍에서 피부를 분리하기 시작합니다. 이 접근은 세포 인구가 안락사 후에 곧 고립되고 다중 동물을 위해 요구되는 처리 시간을 감소시킨다는 것을 확인합니다. 더 오래된 마우스(즉, 출생 후 일 2-4)와 함께 작업할 때, 우리는 활성 조직 헬기(step 2.6)를 통해 피부를 네 번째로 통과하면 피부 균질화 및 세포 수율이 향상된다는 것을 발견했습니다. 이 기술을 사용하여, 우리는 melanocyte 또는 섬유아세포 수율에 있는 나이 의존적인 다름을 봅을 봅을 봅니까.
이 프로토콜은 동일한 피부 샘플로부터 섬유아세포 및 멜라닌세포 배양을 동시에 생성하는 방법을 자세히 다. 우리는 멜라닌 세포의 강제 적인 이탈과 함께 단기 trypsinization가 수행 될 때 초기 멜라닌 세포 배양에서 각질 세포가 접시에 부착 남아 있음을 관찰했다 (단계 참조 3.2-3.3). 우리는 이 남아 있는 세포를 위한 전파 방법을 최적화하지 않은 동안, 우리는 100 ng/mL G418로 보충된 각질 세포 매체에 있는 그 같은 부착인구의 지속적인 배양이 풍부하게 한 세포 인구 귀착될 수 있었다는 것을 가설을 세워.
공개
저자는 공개할 이해상충이 없습니다.
감사의 말
저자는 데이먼 러니온 재단 (혁신 상 #38-16 에 C.E.B.) 및 펠로토니아 (B.M.M.) 재정 지원을 감사드립니다. 원고 텍스트를 개선하기 위해 의견을 제공한 C. 헤인즈와 C. 웜스배처에게 감사드립니다. 이 작품은 NIH P30 CA016058에 의해 지원되는 오하이오 주 포괄적인 암 센터의 분석 세포 분석 공유 자원에서 유익했습니다.
자료
| Name | Company | Catalog Number | Comments |
| 0.2 µm PES sterile syringe filter | VWR | 28145-501 | |
| 10 cm cell culture dish | Corning | 430167 | |
| 40 µm cell strainer | Fisher Scientific | 22363547 | |
| 5 mL polystyrene round-bottom tubes | Fisher Scientific | 352008 | |
| 6-well cell culture dish | Sigma-Aldrich | SIAL0516 | |
| 70 µm cell strainer | Fisher Scientific | 22363548 | |
| Antibiotic Antimycotic Solution (100x) | Sigma-Aldrich | A5955 | |
| Bovine Serum Albumin | Fisher Scientific | BP9706-100 | |
| CF 488A Mix-n-Stain Antibody Labeling Kit | Biotium | 92273 | |
| CF 555 Mix-n-Stain Antibody Labeling Kit | Biotium | 92274 | |
| Cholera Toxin | Sigma-Aldrich | C8052 | |
| Collagen from rat tail | Sigma-Aldrich | C7661 | |
| Collagenase Type I | Worthington Biochemicals | LS004156 | |
| Corning Penicillin/Streptomycin Solution | Fisher Scientific | 30-002-CL | |
| Cytokeratin 14 Antibody Alexa Fluor 647 | Novus Biologicals | NBP2-34403AF647 | |
| Deoxyribonuclease I | Worthington Biochemicals | LS002058 | |
| Di-butyryl cyclic AMP | Sigma-Aldrich | D0627 | |
| Dulbecco's Modified Eagle Medium | Gibco | 12800-082 | |
| Dulbecco's Phosphate Buffered Saline | Sigma-Aldrich | D8537 | |
| eBioscience Fixable Viability Dye eFluor 780 | Thermo Fisher | 65-0865-14 | |
| Ethanol, 200 proof | Fisher Scientific | 22032601 | |
| Fetal Bovine Serum | Sigma-Aldrich | 12306C | |
| FSP1/S100A4 antibody | Millipore Sigma | 07-2274 | |
| G418 Disulfide | P212121 | LGB-418-1 | |
| Glacial Acetic Acid | VWR | VWRV0714 | |
| Horse Serum | Fisher Scientific | 26050088 | |
| HyClone L-Glutamine | Fisher Scientific | SH3003402 | |
| McIlwain Tissue Chopper | Ted Pella | 10180 | |
| Melanoma gp100 antibody | Abcam | ab137078 | |
| Nutrient Mix F-12 Ham's Media | Sigma-Aldrich | N6760 | |
| Phorbol 12-Myristate 13-acetate | Sigma-Aldrich | P8139 | |
| Pierce 16% Formaldehyde | Thermo Fisher | 28908 | |
| Porcine Trypsin | Sigma-Aldrich | 85450C | |
| RPMI 1640 media | Sigma-Aldrich | R8758 | |
| Saponin | Sigma-Aldrich | S-7900 | |
| Tissue Chopper Blade | Ted Pella | 121-6 | |
| Tissue Chopper Plastic Disk | Ted Pella | 10180-01 | |
| Trypsin | VWR | VWRL0154-0100 |
참고문헌
- Rittie, L. Cellular mechanisms of skin repair in humans and other mammals. Journal of Cell Communucation and Signal. 10 (2), 103-120 (2016).
- Romanovsky, A. A. Skin temperature: its role in thermoregulation. Acta Physiologica (Oxf). 210 (3), 498-507 (2014).
- Holick, M. F., Smith, E., Pincus, S. Skin as the site of vitamin D synthesis and target tissue for 1,25-dihydroxyvitamin D3. Use of calcitriol (1,25-dihydroxyvitamin D3) for treatment of psoriasis. Archives of Dermatology. 123 (12), 1677-1683 (1987).
- Yamaguchi, Y., Hearing, V. J. Physiological factors that regulate skin pigmentation. Biofactors. 35 (2), 193-199 (2009).
- Yamaguchi, Y., Hearing, V. J. Melanocytes and their diseases. Cold Spring Harbor Perspectives in Medicine. 4 (5), (2014).
- Brenner, M., Hearing, V. J. The protective role of melanin against UV damage in human skin. Photochemistry and Photobiology. 84 (3), 539-549 (2008).
- Thody, A. J., et al. Pheomelanin as well as eumelanin is present in human epidermis. The Journal of Investigative Dermatology. 97 (2), 340-344 (1991).
- Swope, V. B., Abdel-Malek, Z. A. MC1R: Front and Center in the Bright Side of Dark Eumelanin and DNA Repair. International Journal of Molecular Science. 19 (9), (2018).
- Barsh, G. S. What controls variation in human skin color. PLoS biology. 1 (1), 27 (2003).
- Abdel-Malek, Z., et al. The melanocortin-1 receptor is a key regulator of human cutaneous pigmentation. Pigment Cell Research. 13, 156-162 (2000).
- Gronskov, K., Ek, J., Brondum-Nielsen, K. Oculocutaneous albinism. Orphanet Journal of Rare Diseases. 2, 43 (2007).
- Kwon, S. H., Hwang, Y. J., Lee, S. K., Park, K. C. Heterogeneous Pathology of Melasma and Its Clinical Implications. International Journal of Molecular Sciences. 17 (6), (2016).
- D'Orazio, J., Jarrett, S., Amaro-Ortiz, A., Scott, T. UV radiation and the skin. International Journal of Molecular Science. 14 (6), 12222-12248 (2013).
- Bonnans, C., Chou, J., Werb, Z. Remodelling the extracellular matrix in development and disease. Nature Reviews Molecular Cell Biology. 15 (12), 786-801 (2014).
- Kendall, R. T., Feghali-Bostwick, C. A. Fibroblasts in fibrosis: novel roles and mediators. Frontiers in Pharmacology. 5, 123 (2014).
- Kalluri, R. The biology and function of fibroblasts in cancer. Nature Reviews Cancer. 16 (9), 582-598 (2016).
- Dickson, M. A., et al. Human keratinocytes that express hTERT and also bypass a p16(INK4a)-enforced mechanism that limits life span become immortal yet retain normal growth and differentiation characteristics. Molecular and Cellular Biology. 20 (4), 1436-1447 (2000).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유