Method Article
Generación rápida de cultivos primarios de melanocitos muritonos y fibroblastos
En este artículo
Resumen
Este protocolo describe un método rápido para generar simultáneamente cultivos de melanocitos y fibroblastos a partir de la piel de ratones de 0-4 días de edad. Estos cultivos primarios pueden ser mantenidos y manipulados in vitro para estudiar una variedad de procesos fisiológicamente relevantes, incluyendo biología celular de la piel, pigmentación, cicatrización de heridas y melanoma.
Resumen
Los defectos en la función de fibroblastos o melanocitos se asocian con enfermedades de la piel, incluyendo la función de barrera deficiente, cicatrización de heridas defectuosas, defectos de pigmentación y cáncer. Vital para la comprensión y la mejora de estas enfermedades son experimentos en cultivos primarios de fibroblastos y melanocitos. Sin embargo, los protocolos actuales para el aislamiento de melanocitos requieren que las capas epidérmicas y dérmicas de la piel se trippsinizan y se desvinculen manualmente. Este proceso consume mucho tiempo, técnicamente desafiante y contribuye a rendimientos inconsistentes. Además, los métodos para generar simultáneamente cultivos de fibroblastos puros a partir de la misma muestra de tejido no están fácilmente disponibles. Aquí, describimos un protocolo mejorado para aislar melanocitos y fibroblastos de la piel de los ratones en los días postnatales 0-4. En este protocolo, toda la piel se homogeneiza mecánicamente usando un helicóptero de tejido y luego se digiere brevemente con colagenasa y trippsina. Las poblaciones celulares se aíslan a través de un revestimiento selectivo seguido del tratamiento con G418. Este procedimiento da como resultado rendimientos constantes de melanocitos y fibroblastos de un solo ratón en menos de 90 minutos. Este protocolo también es fácilmente escalable, lo que permite a los investigadores procesar grandes cohortes de animales sin un aumento significativo en el tiempo de práctica. Mostramos a través de evaluaciones citométricas de flujo que los cultivos establecidos con este protocolo están altamente enriquecidos para melanocitos o fibroblastos.
Introducción
La piel de mamífero es un órgano multicapa que protege el cuerpo de patógenos extraños e irradiación ultravioleta (UVR). La piel también juega un papel crítico en los procesos homeostáticos como la cicatrización de heridas, la regulación de la temperatura y la producción de vitamina D1,2,3. La piel de mamífero consta de tres tipos principales de células: melanocitos, fibroblastos y queratinocitos. Estos tipos celulares pueblan diferentes capas de la piel, con queratinocitos que componen la epidermis, fibroblastos que residen en la dermis ymelanocitos localizando a la unión epidérmica-dérmica y folículos pilosos 4. Aquí, detallamos un procedimiento simple que permite la generación simultánea de cultivos primarios de melanocitos y fibroblastos a partir de la piel murina.
Los melanocitos son células productoras de pigmentos que se encuentran en muchos lugares del cuerpo humano,incluyendo la epidermis basal, iris, cócleara, cerebro y folículos pilosos 5. La función principal de los melanocitos es generar y secretar vesículas que contienen melanina llamadas melanosomas5,6. Los melanosomas contienen dos clases principales de melanina: eumelanina marrón/negra y feomelanina amarilla/roja6,7. Los procesos bioquímicos dentro del melancito regulan la abundancia relativa de cadaespecie de melanina y ayudan a determinar el cabello, la piel y los ojos de color 8,9. La melanina también sirve para absorber la UVR y proteger los tejidos expuestos al sol de la mutagénesis10.
La disfunción del melanocitos puede causar defectos pigmentarios y aumentar la susceptibilidad al cáncer de piel. Por ejemplo, los parches de piel hiperpigmentados característicos del melasma son el resultado de la sobreproducción focal de melanina, mientras que las mutaciones genéticas germinales que comprometen los genes implicados en la síntesis de melanina conducen al albinismo11,12 . Se requiere un conocimiento íntimo de la biología de los melanocitos para desarrollar estrategias que corrijan tales defectos pigmentarios y, en última instancia, mejoren el bienestar psicosocial de las personas afectadas por estas enfermedades. Déficits en la producción de melanina y / o la síntesis preferencial de feomelanina también se asocian con el aumento del riesgo de cáncer de piel10. Se cree que este riesgo es el resultado de una reducción de la protección UVR6,13. Por lo tanto, métodos para mejorar o restaurar la producción de eumelanina en melanocitos pueden reducir la incidencia de cáncer de piel en estas poblaciones.
Los fibroblastos mesenquimales establecen el tejido conectivo y el soporte estructural para todos los órganos del cuerpo, incluida la capa dérmica de la piel14. La excreción de proteínas como el colágeno, la elastina, laminina y fibronectina permiten que losfibroblastos formen la matriz extracelular (ECM) que es esencial para la integridad del tejido 1,14. Los fibroblastos también desempeñan un papel esencial en procesos como la cicatrización de heridas, inflamación, angiogénesis y formación/progresión del cáncer1,15,16.
Al igual que los melanocitos, los defectos en la activación y función de los fibroblastos pueden promover la tumorigenesis y la enfermedad. Por ejemplo, la activación inadecuada de fibroblastos comúnmente conduce a la formación de fibrosis, como resultado de la mayor deposición de componentes de ECM en exceso en el tejido circundante. Como los fibroblastos mantienen gran parte de la integridad estructural del cuerpo, la fibrosis promueve enfermedades que afectan a numerosos tejidos y órganos, incluyendo fibrosis pulmonar idiopática, esclerosis sistémica, cirrosis hepática y fibrosis cardíaca15. Los fibroblastos también desempeñan un papel crítico en el cáncer16. Los fibroblastos asociados al cáncer (CAC) son las células no malignas más abundantes en el microambiente de muchos tumores. Se ha demostrado que los CAF promueven la proliferación tumoral, la progresión y la resistencia terapéutica mediante la modulación de la rigidez tisular, la producción local de citoquinas y la función inmune16.
Los cultivos celulares primarios proporcionan a los investigadores modelos genéticamente manejables para identificar y mitigar los defectos de melanocitos y fibroblastos que conducen a la enfermedad. Sin embargo, los métodos actuales para establecer cultivos de melanocitos consumen mucho tiempo y son técnicamente desafiantes. La necesidad de tripinización y separación delicada de la epidermis y la dermis contribuye a la variabilidad en el rendimiento experimental y dificulta la realización de experimentos a gran escala. Además, actualmente faltan protocolos para aislar simultáneamente melanocitos y fibroblastos de toda la piel en el campo.
Hemos desarrollado un método para reducir los pasos de procesamiento, la variabilidad y el tiempo necesario para establecer cultivos de melanocitos y fibroblastos a partir de la misma muestra de piel entera. Utilizando un método de homogeneización mecánica seguido de una breve digestión, nuestra estrategia disminuye significativamente la cantidad de tiempo práctico necesario para aislar los melanocitos primarios al tiempo que permite el aislamiento simultáneo de fibroblastos. El aumento de la velocidad, eficiencia y consistencia de este protocolo, en combinación con la capacidad de aislar melanocitos de ratones de 0-4 días de edad, proporciona a los investigadores la flexibilidad para realizar una gama más amplia de experimentos de lo que antes era posible.
Protocolo
Obtenga la aprobación de su comité institucional de ética animal antes de empezar este o cualquier otro estudio que involucre animales. Los experimentos realizados en este protocolo fueron aprobados por el Comité Institucional de Cuidado y Uso de Animales (IACUC, por sus #2012A00000134).
1. Preparación del protocolo
NOTA: Las siguientes instrucciones de preparación de reactivos son adecuadas para la generación de cultivos de 9 cm2 de melanocitos y fibroblastos a partir de un solo ratón. Consulte la guía de preparación de reactivos de la Tabla 1 para obtener aislamientos a mayor escala.
- Preparar 1,5 ml de solución de colágeno que contenga colágeno de 50 g/ml en ácido acético glacial de 0,1 M.
- En un armario de flujo laminar, cubra un pozo de un plato de cultivo celular de 6 pozos con solución de colágeno de 8 g/cm2 (1,44 ml). Asegúrese de que el pozo esté completamente cubierto por la solución de colágeno. Incubar el plato a 37oC durante 3 h o a 4oC durante la noche. Antes de su uso, lave bien el colágeno recubierto dos veces con 1,35 ml de solución salinatamponada con fosfato estéril (PBS) (150 ol de PBS por 1 cm 2).
- Montar el helicóptero de tejido en un gabinete de flujo laminar colocando cuidadosamente un disco de corte en la plataforma del helicóptero de tejido y asegurando una hoja estéril al brazo móvil.
- Preparar 3 ml de 1 x solución antibiótica/antimicótica diluyendo 100x solución de stock antibiótico/antimicótico en PBS estéril.
- Preparar 3 ml de tampón fresco de digestión de la piel que contenga 10% de suero bovino fetal, 1% solución de penicilina/estreptomicina, 1% de L-glutamina, 10 mg/ml de colagenasa tipo I, 0,25% de trippsina porcina y 0,02 mg/ml desoxirribonucleasa I en RPMI 1640.
- Preparar 6 ml de medios frescos de melanocitos que contengan 10% de suero bovino fetal, 7% de suero de caballo, 1% solución de penicilina/estreptomicina, 1% de L-glutamina, 0,5 mM de toxina cíclica de 0,5 mM (dbcAMP), 20 nM de tetradecanoylphorbol 13-acetato (TPA) y 200 pM de toxina de cólera (CT) Nutrient Mix F-12 Ham's media.
NOTA: Las soluciones concentradas de dbcAMP, TPA y CT se pueden hacer, alícset y almacenar durante >1 año a -80 oC. Los medios base que carezcan de estos componentes se pueden almacenar durante un máximo de 1 mes a 4 oC. - Preparar 4 ml de medios fibroblastos que contengan 10% de suero bovino fetal, 1% penicilina/estreptomicina y 1% L-glutamina en el medio de águila modificado de Dulbecco. Este soporte se puede almacenar a 4 oC durante un máximo de 1 mes.
- Preparar 40 ml de 4% de solución de paraformaldehyde diluyendo 16% paraformaldehyde en PBS. Almacene cualquier exceso a 4 oC durante 1 mes o -20 oC durante un máximo de 1 año.
- Preparar una solución de stock de saponina al 1% mezclando 0,5 g de saponina en 50 ml de PBS a 37oC hasta que la saponina se haya disuelto por completo. Esterilice la solución para su almacenamiento a largo plazo utilizando una jeringa de 50 ml equipada con un filtro PES de 0,2 m. La solución de stock de saponina resultante se puede mantener a 4 oC durante 1 mes.
- Preparar 200 ml de solución de saponina al 0,1% por ratón diluyendo un 1% de solución de saponina en PBS que contiene 3% de albúmina sérica bovina (BSA).
- Preparar 1 ml de solución de viabilidad diluyendo 1 l de tinte de viabilidad fijable en 1 ml de PBS.
2. Aislamiento de melanocitos y fibroblastos
- Eutanasia cachorros C57Bl/6J de 0 a 4 días de edad por decapitación y elimina las extremidades de los ratones eutanasiados usando tijeras quirúrgicas.
- En un armario de flujo laminar, enrolle brevemente el tronco de cada ratón en una placa estéril de Petri que contenga 70% de etanol. Retire el tronco del etanol y colóquelo en un plato de Petri vacío y estéril.
- Usando tijeras quirúrgicas, esterilizadas en 70% etanol, hacer una incisión en la piel en el lado ventral del tronco comenzando desde el cuello hasta la cola. Pelar la piel del tronco del ratón usando fórceps estériles.
- Coloque la dermis de la piel hacia abajo en un plato de 6 pozos que contenga 3 ml de 1 x solución antibiótica/antimicótica e incubar a temperatura ambiente durante 2-3 min.
- Encienda el helicóptero de tejido con los siguientes ajustes en su lugar: Grosor de la rebanada: 1 m; Fuerza de la hoja: 60% del máximo; Velocidad: 50% del máximo.
- Transfiera la piel, la dermis hacia abajo, a un disco de helicóptero de tejido estéril y pase la piel completamente a través del helicóptero de tejido activado 3 veces.
- Transfiera la piel homogeneizada a un tubo cónico estéril de 15 ml que contenga 3 ml de tampón de digestión de la piel. Mezcle la suspensión resultante pipeteando hacia arriba y hacia abajo 10-15 veces con un micropipeta P1000.
- Tapar el tubo cónico e incubar la muestra en un baño de agua de 37 oC durante 15 minutos, invirtiendo el tubo cada 3-5 min.
- Reventar las células de la piel homogeneizar centrifugando el tubo cónico en un rotor de cubo oscilante a 750 x g durante 5 min a temperatura ambiente.
- Usando una micropipeta P1000, retire lenta y completamente el búfer de digestión de la piel teniendo cuidado de no molestar el pellet.
NOTA: Una porción de piel entera se puede guardar en esta etapa y se utiliza como un control para Paso 3: Confirmación de pureza celular. Colar estas células a través de un colador de células de 70 m y luego comenzar en el paso 3.5 para su posterior procesamiento. - Resuspenda completamente el pellet celular en 1 ml de melanocitos Media pipeteando 15-20 veces con una micropipeta P1000. Agregue la solución celular resultante en forma de gota a un pozo sin recubrimiento de un plato de 6 pozos que contenga 1 ml de medios de melanocitos.
- Colocar el homogeneato de la piel chapada en una incubadora de cultivodeta tisular a 37oC y 5% deCO2. Permita que las culturas incuban durante 40 min.
NOTA: Durante este tiempo, algunos fibroblastos en el homogeneizado de la piel se adhieren al plato sin recubrimiento, mientras que los melanocitos y queratinocitos permanecen en suspensión. - Transfiera el sobrenadante de cultivo del plato sin recubrimiento a un pozo de un plato de 6 pozos prelavado y recubierto de colágeno. Añadir G418 a los medios de comunicación de tal forma que la concentración final sea de 100 ng/ml.
- Agregue 2 ml de medios de fibroblastos a un pozo del plato sin recubrimiento, que ahora contiene fibroblastos adherentes.
- Incubar ambos cultivos durante la noche en una incubadora decultivos tisulares situada a 37oC y 5% de CO2.
- Aspirar por separado los medios y los restos de cada cultivo, 16-24 h después del enchapado. Lave cada plato dos veces con 1 ml de PBS estéril, y luego agregue 2 ml de medios de melanocitos frescos más 100 ng/ml G418 al cultivo de melanocitos y 2 ml de medios de fibroblastos frescos al cultivo de fibroblastos.
- Después de que los cultivos de melanocitos hayan sido tratados con G418 durante 48 h, lave las células dos veces con 1 ml de PBS estéril y agregue 2 ml de medios de melanocitos frescos sin G418 al cultivo.
NOTA: A medida que los fibroblastos en el cultivo de melanocitos continúen muriendo en el tratamiento post-G418, lave el plato con PBS estéril para eliminar las células muertas y agregue medios de melanocitos frescos. Los cultivos de melanocitos y fibroblastos deben ser repasos cuando alcanzan una confluencia del 70-80%.
3. Confirmación de pureza celular
- Aspirar los medios de cada cultivo y lavar cuidadosamente cada plato con 1 ml de PBS estéril.
- Añadir 0,7 ml de 0,25% de trippsina a cada cultivo e incubar las culturas en trippsina a 37oC y 5% de CO2 durante 1 min.
- Desaloje las células pipeteando la trippsina contra la parte inferior del plato usando un micropipeta P1000.
- Añadir 0,7 ml del medio adecuado a cada cultivo trippsinizado y transferir la solución celular a un tubo de microcentrífuga de 1,5 ml.
- Reventar las células por centrifugación a 750 x g durante 2 min a temperatura ambiente. Retire y deseche cuidadosamente el sobrenadante con un micropita P1000.
NOTA: Los pasos 3.1-3.5 se pueden utilizar para el paso de cultivos de melanocitos y fibroblastos. El pellet resultante debe ser resuspendido en el medio apropiado y colocado en un plato nuevo, sin recubrimiento (fibroblastos) o prelavado, recubierto de colágeno (melanocitos). - Resuspenda el pellet celular en 0,5 ml de PBS helado.
- Enumere y transfiera 0,5 millones de células a un tubo de microcentrífuga de 1,5 ml preenfriado.
- Repita el paso 3.5 y luego resuspenda las celdas en 100 s de solución de viabilidad. Incubar la suspensión celular durante 30 min a 4oC en la oscuridad.
- Repita los pasos 3.5-3.6 dos veces.
- Repita el paso 3.5, luego fije las células resuponiendo el pellet en 100 sL de hielo frío 4% Paraformaldehído Solución. Incubar la suspensión durante 15 min a temperatura ambiente en la oscuridad.
- Repita el paso 3.5 dos veces, cada vez que vuelva a depender del pellet en 0,5 ml de 3% de BSA en 1x PBS.
- Repita el paso 3.5 y, a continuación, vuelva a suspender el gránulo celular en 100 ml de solución de saponina al 0,1%. Incubar la suspensión durante 15 min a temperatura ambiente en la oscuridad.
- Repita el paso 3.5, luego resuspenda el pellet celular en 100 éL de Solución de Saponina al 0,1% que contenga 0,5 g de anticuerpo anti-gp100 de conejo, 0,5 g de anticuerpo de proteína específica de fibroblasto de conejo 1 (FSP1) y 0,025 g de anticuerpo anti-cytoqueratina de ratón 14 (K14). Incubar la suspensión durante 1 h a temperatura ambiente en la oscuridad.
NOTA: Mientras que el anticuerpo K14 fue comprado pre-conjugado a Alexa Fluor 647, los anticuerpos gp100 y FSP1 fueron conjugados a CF 555 y CF 488, respectivamente. La tinción de las poblaciones de control también debe comenzar en este paso. Las poblaciones de células de control deben aislarse del cultivo y procesarse como se describe en los pasos 3.5-3.12. - Repita el paso 3.11 dos veces para eliminar cualquier anticuerpo no unido.
- Repita el paso 3.5, luego resuspenda el pellet celular en 200-400 l de 3% de BSA en 1x PBS.
- Pase la solución celular a través de un colador de células de 40 m en un tubo de fondo redondo de poliestireno de 5 ml y analice las células tensadas por citometría de flujo.
Resultados
Los ratones C57Bl/6J machos y hembras fueron eutanasiados en los días postnatales 0-4 y la piel truncal fue sometida a disociación mecánica como se describió anteriormente. Después de cortar, la piel formó una suspensión viscosa carente de cualquier signo de tejido estructural. La centrifugación de esta suspensión dio lugar a la formación de un gran pellet celular en la parte inferior del tubo cónico y una capa de adiposo flotando en la parte superior del sobrenadante. Esta capa adiposa se desectó con el sobrenadante, mientras que el pellet celular restante fue resuspendido y transferido a un pozo sin recubrimiento de un plato de 6 polos. La alta densidad de células hizo que el medio apareciera turbio. Sin embargo, después de 40 minutos de incubación, se observaron conglomerados celulares y tisulares más grandes en los medios y se pudieron observar fibroblastos adherentes con un microscopio de luz invertida (Figura1).
Las células no adherentes del cultivo de fibroblastos se transfirieron a un pozo de un plato recubierto de colágeno de 6 pozos con el fin de aislar los melanocitos. La adición de G418 mató los fibroblastos restantes en el homogeneato, dejando numerosas células muertas flotando en los medios de comunicación durante los próximos 5 días (Figura2A-C). Después de 4-5 días de crecimiento, los melanocitos chapados comenzaron a tomar un fenotipo dendrítico estereotipado con gránulos melanocíticos (Figura2C). Este fenotipo persistió después del paso de la referencia cultural (Figura2D). Mientras que los cúmulos de queratinocitos contaminantes se observaron inicialmente en los cultivos de melanocitos (Figura2A),estas poblaciones se perdieron tras el posterior paso.
Se utilizaron análisis citométricos de flujo para confirmar la pureza de los cultivos de melanocitos primarios y fibroblastos resultantes. C5N queratinocitos de ratón17, día 10 cultivos de melanocitos primarios y día 6 cultivos primarios de fibroblastos se teñiron con: anti-gp100 (melanocitos diferenciados), anti-citoqueratina 14 (K14; queratinocitos) y proteína específica antifibroblasto 1 ( FSP1; fibroblastos) (Figura3). En estas células, la tinción gp100 era específica de los melanocitos primarios, mientras que la positividad FSP1 sólo se observó en fibroblastos (Figura3A,B). La expresión de K14 se limitó a los queratinocitos C5N (Figura3C). Se realizaron análisis adicionales para determinar la pureza de nuestros cultivos de melanocitos 1, 2, 3, 4 y 10 días después del aislamiento (Figura4). La contaminación combinada por fibroblastos y queratinocitos nunca superó el 25% del total de células en cultivo (Figura4B,C). Sin embargo, no se observaron aumentos dramáticos en gp100 hasta el cuarto día en cultivo (Figura4A). Atribuimos esta observación a la reducción de la expresión de gp100 en precursores de melanocitos (es decir, melanoblastos), muchos de los cuales parecen diferenciarse completamente por el día 10 en el cultivo (Figura4A). En resumen, estos datos demuestran que nuestro protocolo de aislamiento rápido produce simultáneamente cultivos enriquecidos para melanocitos y fibroblastos.
| Paso # | Reactivo | 1 cachorro | 5 cachorros |
| 1.1 | Solución de colágeno | 1,5 ml | 4,5 ml |
| 1.2 | Tamaño de la placa | 6-bien | 10 cm |
| 1.4 | Solución antibiótica / antimicótica | 3 ml | 15 ml |
| 1.5 | Búfer de digestión de la piel | 3 ml | 15 ml |
| 1.6 | Medios de melanocitos | 6 mL | 30 mL |
| 1.7 | Medios de fibroblastos | 4 ml | 20 mL |
Tabla 1: Guía de preparación de reactivos para diferentes tamaños de cohortes.

Figura 1 : Imágenes representativas de los cultivos primarios de fibroblastos murinos. Se muestran imágenes 20x de fibroblastos inmediatamente después del aislamiento (A), así como 24 (B) y 48 (C ) h postaislamiento. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2 : Imágenes representativas de los cultivos primarios de melanocitos. Se muestran imágenes 20x de cultivos de melanocitos 1 (A), 2 (B) y 4 días (C) post-aislamiento. Los queratinocitos contaminantes se indican mediante la flecha en 'A'. (D) Imagen representativa de los cultivos primarios de melanocitos después del paso. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3 : Evaluaciones citométricas de flujo de pureza cultural. Histogramas representativos que muestran gp100(A; melanocitos diferenciados), FSP1 (B; fibroblastos) y K14 (C; queratinocitos) positividad en melanocitos primarios (día 10), fibroblastos primarios (día 6) y queratinocitos C5N. Después de hacer un seguimiento de las células vivas, se analizaron 10.000 eventos de cada población. Se utilizaron controles de un solo color para la compensación y los datos resultantes se visualizaron con el software FlowJo. Haga clic aquí para ver una versión más grande de esta figura.
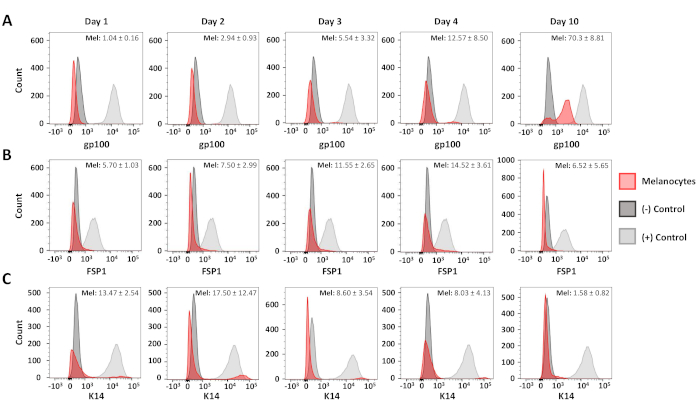
Figura 4 : Análisis del curso de tiempo de pureza de melanocitos. histogramas representativos que muestran la pureza del melanocitos 1-10 días después del aislamiento inicial. Las muestras se han manchado, analizado y graficado como se describe en la Figura3. Las poblaciones de control positivo y negativo fueron las siguientes: gp100--melanocitos humanos (+), fibroblastos murinoprimarios primarios (-); FSP1--fibroblastos murinos primarios (+), melanocitos humanos (-); K14--Células C5N (+), melanocitos humanos (-). La positividad media y la desviación estándar para al menos tres cultivos de melanocitos distintos se muestran en la esquina superior derecha de cada gráfico. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
El cultivo in vitro de melanocitos primarios y fibroblastos ha llevado a avances significativos en nuestra comprensión de la biología y la enfermedad de la piel. Este protocolo mejora los métodos previos de aislamiento de melanocitos al reducir el tiempo y los conocimientos técnicos necesarios para generar cultivos de melanocitos consistentes, al tiempo que permite el aislamiento simultáneo de fibroblastos cutáneos. Un elemento novedoso que ahorra tiempo de este procedimiento es que la dermis y la epidermis no necesitan separarse. En su lugar, las células de la piel se aíslan utilizando la fuerza de corte constante y la granularidad de un helicóptero de tejido mecánico junto con medios selectivos y técnicas de chapado. Al reducir la complejidad del procesamiento y el tiempo práctico, este procedimiento también permite a los investigadores llevar a cabo experimentos a gran escala de manera eficiente.
Recomendamos varios pasos para mejorar el rendimiento y la coherencia mediante este protocolo. En primer lugar, antes del paso 2.4, aconsejamos el uso de fórceps curvos para raspar cualquier tejido adiposo del lado dérmico de la piel. Este proceso reducirá la torta de grasa formada después de la centrifugación. A continuación, la disociación mecánica adecuada de la piel es fundamental para el éxito de este protocolo y se puede mejorar girando el disco homogeneizador a 60o después de cada pasada de la hoja. Otro paso clave es asegurarse de que todo el búfer de resumen de piel se elimina en el paso 2.10. Si no lo hace, se obstaculizará la adhesión celular al plato y disminuirá significativamente el rendimiento. Debido a que el pellet no se fija firmemente a la parte inferior del tubo cónico de 15 ml en el paso 2.10, las células se pueden aspirar fácilmente si el sobrenadante no se retira lentamente. Si la eliminación a fondo del búfer de digestión de la piel es un desafío, sugerimos lavar el pellet en 2-3 ml de medios de melanocitos y luego repetir los pasos 2.9-2.10 antes del enchapado. Finalmente, al resucitar el pellet celular en el paso 2.11, es importante pipetear vigorosamente con el fin de romper cualquier grumos y asegurarse de que las células se distribuyen uniformemente en la superficie del plato de cultivo celular. Los escombros y las células muertas se observarán en el cultivo durante los primeros días después del aislamiento. Estas células muertas pueden obstaculizar el crecimiento del cultivo y deben eliminarse lavando el plato con PBS y luego agregando medios frescos.
Este protocolo describe un método para generar cultivos primarios de melanocitos y fibroblastos a partir de un solo ratón. Sin embargo, el procedimiento se puede ajustar eficazmente para dar cabida a cohortes de ratones más grandes (ver Tabla 1). Para cohortes más grandes, la combinación de homogeneato de piel de 4-5 cachorros da como resultado un plato de 10 cm de melanocitos de 10 cm de confluente de 30-40% dentro de 4-5 días de aislamiento. Se pueden utilizar varias técnicas para mejorar la eficiencia de este protocolo cuando se trabaja con varios animales. En primer lugar, normalmente eutanasiamos a los animales en conjuntos de cuatro, procesando dos animales a la vez. Hemos encontrado que la piel homogeneizada de dos cachorros se puede combinar en los pasos 2.7-2.8 aumentando el volumen de Skin Digest Buffer a 6 mL. Para ahorrar tiempo, comenzamos a aislar la piel del siguiente par de cachorros mientras el primer conjunto está en proceso de homogeneización y digestión. Este enfoque garantiza que las poblaciones celulares se aíslen poco después de la eutanasia y reduce el tiempo de procesamiento requerido para varios animales. Cuando se trabaja con ratones mayores (es decir, los días postnatales 2-4), hemos encontrado que pasar la piel por cuarta vez a través del helicóptero de tejido activo (paso 2.6) mejora la homogeneización de la piel y el rendimiento celular. Usando esta técnica, no vemos ninguna diferencia dependiente de la edad en el rendimiento de melanocitos o fibroblastos.
Este protocolo detalla cómo generar simultáneamente cultivos de fibroblastos y melanocitos a partir de la misma muestra de piel. Hemos observado que los queratinocitos en el cultivo inicial de melanocitos permanecen adheridos al plato cuando la tripinización a corto plazo se realiza junto con el desalojo forzoso de los melanocitos (ver pasos 3.2-3.3). Si bien no hemos optimizado los métodos de propagación para estas células restantes, hipotetizar que el cultivo continuo de tales poblaciones adherentes en medios de queratinocitos complementado con 100 ng/ml G418 podría resultar en una población celular enriquecida.
Divulgaciones
Los autores no tienen conflictos de intereses que revelar.
Agradecimientos
Los autores agradecen el apoyo financiero a la Fundación Damon Runyon (Premio a la Innovación #38-16 a C.E.B.) y a Pelotonia (B.M.M.). Agradecemos a C. Haines y C. Wormsbaecher que proporcionaron comentarios para mejorar el texto del manuscrito. Este trabajo se benefició del Recurso Compartido de Citometría Analítica del Centro Integral del Cáncer de Ohio, que es apoyado por NIH P30 CA016058.
Materiales
| Name | Company | Catalog Number | Comments |
| 0.2 µm PES sterile syringe filter | VWR | 28145-501 | |
| 10 cm cell culture dish | Corning | 430167 | |
| 40 µm cell strainer | Fisher Scientific | 22363547 | |
| 5 mL polystyrene round-bottom tubes | Fisher Scientific | 352008 | |
| 6-well cell culture dish | Sigma-Aldrich | SIAL0516 | |
| 70 µm cell strainer | Fisher Scientific | 22363548 | |
| Antibiotic Antimycotic Solution (100x) | Sigma-Aldrich | A5955 | |
| Bovine Serum Albumin | Fisher Scientific | BP9706-100 | |
| CF 488A Mix-n-Stain Antibody Labeling Kit | Biotium | 92273 | |
| CF 555 Mix-n-Stain Antibody Labeling Kit | Biotium | 92274 | |
| Cholera Toxin | Sigma-Aldrich | C8052 | |
| Collagen from rat tail | Sigma-Aldrich | C7661 | |
| Collagenase Type I | Worthington Biochemicals | LS004156 | |
| Corning Penicillin/Streptomycin Solution | Fisher Scientific | 30-002-CL | |
| Cytokeratin 14 Antibody Alexa Fluor 647 | Novus Biologicals | NBP2-34403AF647 | |
| Deoxyribonuclease I | Worthington Biochemicals | LS002058 | |
| Di-butyryl cyclic AMP | Sigma-Aldrich | D0627 | |
| Dulbecco's Modified Eagle Medium | Gibco | 12800-082 | |
| Dulbecco's Phosphate Buffered Saline | Sigma-Aldrich | D8537 | |
| eBioscience Fixable Viability Dye eFluor 780 | Thermo Fisher | 65-0865-14 | |
| Ethanol, 200 proof | Fisher Scientific | 22032601 | |
| Fetal Bovine Serum | Sigma-Aldrich | 12306C | |
| FSP1/S100A4 antibody | Millipore Sigma | 07-2274 | |
| G418 Disulfide | P212121 | LGB-418-1 | |
| Glacial Acetic Acid | VWR | VWRV0714 | |
| Horse Serum | Fisher Scientific | 26050088 | |
| HyClone L-Glutamine | Fisher Scientific | SH3003402 | |
| McIlwain Tissue Chopper | Ted Pella | 10180 | |
| Melanoma gp100 antibody | Abcam | ab137078 | |
| Nutrient Mix F-12 Ham's Media | Sigma-Aldrich | N6760 | |
| Phorbol 12-Myristate 13-acetate | Sigma-Aldrich | P8139 | |
| Pierce 16% Formaldehyde | Thermo Fisher | 28908 | |
| Porcine Trypsin | Sigma-Aldrich | 85450C | |
| RPMI 1640 media | Sigma-Aldrich | R8758 | |
| Saponin | Sigma-Aldrich | S-7900 | |
| Tissue Chopper Blade | Ted Pella | 121-6 | |
| Tissue Chopper Plastic Disk | Ted Pella | 10180-01 | |
| Trypsin | VWR | VWRL0154-0100 |
Referencias
- Rittie, L. Cellular mechanisms of skin repair in humans and other mammals. Journal of Cell Communucation and Signal. 10 (2), 103-120 (2016).
- Romanovsky, A. A. Skin temperature: its role in thermoregulation. Acta Physiologica (Oxf). 210 (3), 498-507 (2014).
- Holick, M. F., Smith, E., Pincus, S. Skin as the site of vitamin D synthesis and target tissue for 1,25-dihydroxyvitamin D3. Use of calcitriol (1,25-dihydroxyvitamin D3) for treatment of psoriasis. Archives of Dermatology. 123 (12), 1677-1683 (1987).
- Yamaguchi, Y., Hearing, V. J. Physiological factors that regulate skin pigmentation. Biofactors. 35 (2), 193-199 (2009).
- Yamaguchi, Y., Hearing, V. J. Melanocytes and their diseases. Cold Spring Harbor Perspectives in Medicine. 4 (5), (2014).
- Brenner, M., Hearing, V. J. The protective role of melanin against UV damage in human skin. Photochemistry and Photobiology. 84 (3), 539-549 (2008).
- Thody, A. J., et al. Pheomelanin as well as eumelanin is present in human epidermis. The Journal of Investigative Dermatology. 97 (2), 340-344 (1991).
- Swope, V. B., Abdel-Malek, Z. A. MC1R: Front and Center in the Bright Side of Dark Eumelanin and DNA Repair. International Journal of Molecular Science. 19 (9), (2018).
- Barsh, G. S. What controls variation in human skin color. PLoS biology. 1 (1), 27 (2003).
- Abdel-Malek, Z., et al. The melanocortin-1 receptor is a key regulator of human cutaneous pigmentation. Pigment Cell Research. 13, 156-162 (2000).
- Gronskov, K., Ek, J., Brondum-Nielsen, K. Oculocutaneous albinism. Orphanet Journal of Rare Diseases. 2, 43 (2007).
- Kwon, S. H., Hwang, Y. J., Lee, S. K., Park, K. C. Heterogeneous Pathology of Melasma and Its Clinical Implications. International Journal of Molecular Sciences. 17 (6), (2016).
- D'Orazio, J., Jarrett, S., Amaro-Ortiz, A., Scott, T. UV radiation and the skin. International Journal of Molecular Science. 14 (6), 12222-12248 (2013).
- Bonnans, C., Chou, J., Werb, Z. Remodelling the extracellular matrix in development and disease. Nature Reviews Molecular Cell Biology. 15 (12), 786-801 (2014).
- Kendall, R. T., Feghali-Bostwick, C. A. Fibroblasts in fibrosis: novel roles and mediators. Frontiers in Pharmacology. 5, 123 (2014).
- Kalluri, R. The biology and function of fibroblasts in cancer. Nature Reviews Cancer. 16 (9), 582-598 (2016).
- Dickson, M. A., et al. Human keratinocytes that express hTERT and also bypass a p16(INK4a)-enforced mechanism that limits life span become immortal yet retain normal growth and differentiation characteristics. Molecular and Cellular Biology. 20 (4), 1436-1447 (2000).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados