Method Article
初级毛质素黑色素细胞和纤维细胞培养的快速生成
摘要
该协议概述了一种快速方法,从0-4天大小鼠的皮肤中同时产生黑色素细胞和成纤维细胞培养物。这些主要培养物可以在体外维护和操作,以研究各种生理相关过程,包括皮肤细胞生物学、色素沉着、伤口愈合和黑色素瘤。
摘要
成纤维细胞或黑色素细胞功能的缺陷与皮肤病有关,包括屏障功能差、伤口愈合缺陷、色素沉着缺陷和癌症。理解和改善这些疾病的关键是在原发性成纤维细胞和黑色素细胞培养物中的实验。然而,目前的黑色素细胞分离协议要求皮肤的表皮和皮肤层被试穿和手动解除关联。这个过程非常耗时,技术上具有挑战性,并且会导致产量不一致。此外,从同一组织样本同时生成纯成纤维细胞培养的方法也不容易获得。在这里,我们描述了在产后0-4日从小鼠皮肤上分离黑色素细胞和成纤维细胞的改进方案。在此协议中,使用组织切碎器对整个皮肤进行机械均质化,然后用胶原酶和胰蛋白酶短暂消化。然后通过选择性电镀分离细胞群,然后进行G418治疗。此过程在不到 90 分钟内从单个小鼠获得一致的黑色细胞和成纤维细胞。该协议也易于扩展,使研究人员能够处理大量动物,而无需显著增加动手时间。我们通过流式细胞测量表明,使用该协议建立的培养物对黑色素细胞或成纤维细胞具有很高的丰富性。
引言
哺乳动物皮肤是一种多层器官,保护身体免受外来病原体和紫外线照射(UVR)。皮肤在伤口愈合、温度调节和维生素D生产等静温过程中也起着关键作用。1,2,3。哺乳动物皮肤由三种主要细胞类型组成:黑色素细胞、成纤维细胞和角蛋白细胞。这些细胞类型填充皮肤的不同层,角蛋白细胞组成表皮,成纤维细胞驻留在真皮和黑色素细胞局部到表皮-皮肤结和毛囊4。在这里,我们详细介绍了一个简单的过程,使主素黑色素细胞和成纤维细胞培养物从鼠皮并发生成。
黑色素细胞是色素生成细胞,存在于人体的许多地方,包括基底表皮、虹膜、耳蜗、大脑和毛囊5。黑色素细胞的主要功能是生成和分泌含黑色素的囊泡,称为黑色素体5,6。黑色素包含黑色素的两大类:棕色/黑色欧美兰素和黄色/红色五甲素6,7。黑色素细胞内的生化过程调节每个黑色素物种的相对丰度,并帮助确定头发、皮肤和眼睛的颜色8,9。梅拉宁也用于吸收UVR和保护阳光暴露组织免受诱变10。
黑色素细胞功能障碍可引起色素缺陷,增加皮肤癌易感性。例如,黑色素的超色素皮肤斑块是焦点黑色素过度生产的结果,而影响黑色素合成基因的生殖系基因突变导致白化病11,12.黑素细胞生物学的深入了解需要制定策略,以纠正这些色素缺陷,并最终改善患有这些疾病的个人的心理社会福祉。黑色素生产和/或优均合成的蛋素也与皮肤癌风险增加10相关。这种风险被认为是由于减少的UVR保护6,13。因此,提高或恢复黑色素细胞中欧美兰素生产的方法可以减少这些人群皮肤癌的发病率。
中成纤维细胞建立结缔组织和结构支持的所有身体器官,包括皮肤的皮肤层14。蛋白质的排泄,如胶原蛋白,艾氏氨酸,拉米宁和纤维蛋白使成纤维细胞形成细胞外基质(ECM),这是组织完整性1,14。成纤维细胞在伤口愈合、炎症、血管生成和癌症形成/进展1、15、16等过程中也起着至关重要的作用。
与黑色素细胞类似,成纤维细胞活化和功能的缺陷可以促进肿瘤的产生和疾病。例如,不适当的成纤维细胞活化通常会导致纤维化的形成,因为多余的ECM成分沉积到周围组织。由于成纤维细胞保持身体的许多结构完整性,纤维化促进影响许多组织和器官的疾病,包括特发性肺纤维化,全身硬化症,肝硬化和心脏纤维化15。成纤维细胞在癌症16中也起着关键作用。癌症相关成纤维细胞(CAFs)是许多肿瘤微环境中最丰富的非恶性细胞。CAF已被证明通过调节组织刚度、局部细胞因子产生和免疫功能16来促进肿瘤增殖、进展和治疗阻力。
初级细胞培养为研究人员提供遗传可处理的模型,以识别和缓解导致疾病的黑色素细胞和成纤维细胞缺陷。然而,目前建立黑色素细胞培养的方法既费时又在技术上具有挑战性。表皮和真皮的试穿和精细分离的需要导致实验产量的变异性,使进行大规模实验变得困难。此外,目前该领域还缺乏同时从整个皮肤分离黑色素细胞和成纤维细胞的协议。
我们已经开发出一种方法,以减少处理步骤,变异性和时间,建立黑色素细胞和成纤维细胞培养从相同的整个皮肤样本。使用机械均质方法,然后进行短暂的消化,我们的策略可显著减少分离原发性黑色素细胞所需的动手时间,同时实现并发成纤维细胞分离。该协议的速度、效率和一致性的提高,加上从0-4天大小鼠中分离黑色素细胞的能力,为研究人员提供了灵活性,可以进行比以前更广泛的实验。
研究方案
在开始本研究或任何其他涉及动物的研究之前,请获得您的机构动物伦理委员会的批准。俄亥俄州立大学机构动物护理和使用委员会(IACUC,协议#2012A00000134)批准了在该协议中进行的实验。
1. 议定书的编写
注:以下试剂制备说明适用于从单个小鼠生成 9 厘米2黑色素细胞和成纤维细胞培养物。有关更大规模隔离,请参阅表1中的试剂制备指南。
- 在0.1M冰川醋酸中制备含有50微克/mL胶原蛋白的1.5 mL胶原蛋白溶液。
- 在层流柜中,用 8 μg/cm2 (1.44 mL) 胶原蛋白溶液涂覆 6 孔细胞培养皿的一口井。确保油井完全被胶原蛋白溶液覆盖。在37°C下孵育菜肴3小时或4°C过夜。使用前,用1.35 mL的无菌磷酸盐缓冲盐水(PBS)(每1cm2150 μL的PBS)清洗胶原蛋白涂层两次。
- 在层流柜中组装组织切碎器,在组织切碎器平台上小心地放置一个切碎盘,并将无菌刀片固定到可移动臂上。
- 通过在无菌PBS中稀释100x抗生素/抗菌药液,制备3 mL的1x抗生素/抗菌药溶液。
- 在 RPMI 1640 中制备 3 mL 新鲜皮肤消化缓冲液,含有 10% 胎儿牛血清、1% 青霉素/链霉素溶液、1% L-谷氨酰胺、10 mg/mL 胶原酶 I 型、0.25% 猪胰蛋白酶和 0.02 mg/mL 脱氧核糖酸 I。
- 准备6 mL的新鲜黑色素细胞培养基,含有10%胎儿牛血清、7%马血清、1%青霉素/链霉素溶液、1%L-谷氨酰胺、0.5 mM二丁基环AMP(dbcAMP)、20 nM tetradecanphorbol 13-醋酸酯(TPA)和200 pM霍乱毒素(CT)营养混合F-12火腿的介质。
注:浓缩的dbcAMP、TPA和CT库存解决方案可以制成,并加报价,并在-80°C下储存1年。缺少这些组件的基本介质可在 4°C 下存储长达 1 个月。 - 在Dulbeco的改性鹰培养中制备4mL的纤维细胞介质,含有10%的胎儿牛血清、1%青霉素/链霉素和1%L-谷氨酰胺。此介质可在 4°C 下存储长达 1 个月。
- 通过在PBS中稀释16%的甲醛,制备40mL的4%甲醛溶液。将多余的任何时间储存在 4°C 下 1 个月或 -20°C 长达 1 年。
- 在37°C下将0.5克皂苷混合在50 mL的PBS中,直到皂苷完全溶解,制备1%皂苷溶液。使用装有 0.2 μm PES 过滤器的 50 mL 注射器对溶液进行长期灭菌。由此产生的皂素库存溶液可保持4°C1个月。
- 通过稀释含有3%牛血清白蛋白(BSA)的PBS中1%皂苷溶液,每只小鼠制备200μL0.1%的皂素溶液。
- 通过在 PBS 的 1 mL 中稀释 1 μL 的可修复活力染料,制备 1 mL 的可存活性溶液。
2. 黑色素细胞和纤维细胞隔离
- 通过斩首和用手术剪刀从安乐死小鼠中取出四肢,对0至4天大的雄性和/或雌性C57Bl/6J幼崽进行安乐死。
- 在层流柜中,在含有 70% 乙醇的无菌培养皿中短暂滚动每只小鼠的躯干。从乙醇中取出树干,放入空的无菌培养皿中。
- 使用手术剪刀,用70%乙醇消毒,从颈部到尾巴,在躯干腹侧的皮肤进行切口。使用无菌钳子从鼠标躯干上剥下皮肤。
- 将皮肤真皮侧放在含有3 mL的1x抗生素/抗肌溶液的6井盘中,在室温下孵育2-3分钟。
- 打开组织切碎器,并设置如下:切片厚度:1 μm;刀片力:最大±60%;速度:最大值的 ±50%。
- 将皮肤,真皮侧向下,到无菌组织切碎盘,并通过激活的组织切碎器完全通过皮肤3次。
- 将均质皮肤转移到含有3 mL皮肤消化缓冲液的无菌15 mL锥形管中。将产生的悬架与 P1000 微移液器上下移液 10-15 次混合。
- 将锥形管盖住,在 37°C 水浴中孵育样品 15 分钟,每 3-5 分钟反转管一次。
- 在室温下,将锥形管在摆动桶转子中以 750 x g离心 5 分钟,使皮肤中的细胞均匀化。
- 使用 P1000 微移液器,缓慢且完全去除皮肤消化缓冲液小心不要干扰颗粒。
注:整个皮肤的一部分可以保存在此阶段,并用作控制步骤3:细胞纯度确认。通过70μm细胞滤网对这些细胞进行应变,然后从步骤3.5开始进行进一步处理。 - 使用 P1000 微移液器上下移液 15-20 次,彻底重新悬浮在 1 mL 的 Melanocell 介质中的细胞颗粒。将生成的细胞溶液滴至含有1 mL的Melanocell介质的6孔培养皿的无涂层孔中。
- 将镀值皮肤均匀化置于组织培养培养箱中,设定在37°C和5%CO2。允许培养物孵育40分钟。
注:在此期间,皮肤均质物中的一些成纤维细胞会粘附在未涂布的菜上,而黑色素细胞和角蛋白细胞则保持悬浮状态。 - 将培养上清液从未涂布的菜转移到预洗、胶原蛋白涂层的 6 口菜的一口井。将 G418 添加到介质中,使最终浓度为 100 纳克/mL。
- 将 2 mL 的纤维细胞介质添加到未涂布的一口盘中,现在含有粘附成纤维细胞。
- 在37°C和5%CO2设置的组织培养箱中孵育两种培养物过夜。
- 电镀后16-24小时,分别吸气介质和每种培养物的任何碎屑。用1 mL的无菌PBS洗两次每道菜,然后将2mL的新鲜黑色素细胞介质加上100纳克/mL G418添加到黑色素细胞培养物和2 mL的新鲜纤维细胞培养物中。
- 黑色素细胞培养物使用G418治疗48小时后,用1mL无菌PBS洗涤细胞两次,并在培养物中加入2mL的新鲜黑色素细胞培养物,而不加G418。
注:当黑色素细胞培养中的成纤维细胞在G418治疗后继续死亡时,用无菌PBS洗碗,去除死细胞,并添加新鲜的黑色素细胞介质。当黑色素细胞和成纤维细胞培养达到70-80%的汇合时,应经过。
3. 确认细胞纯度
- 从每种培养皿中吸出介质,用 1 mL 无菌 PBS 仔细清洗每道菜。
- 在每个培养物中加入0.7 mL 0.25%的胰蛋白酶,并在37°C和5%CO2的培养物中孵育1分钟。
- 使用P1000微移液器将胰蛋白酶移至碟底,将胰蛋白酶移出细胞。
- 将0.7 mL的合适介质添加到每个胰蛋白酶培养基中,并将细胞溶液转移到1.5 mL微离心管中。
- 在室温下,在750 x g下通过离心将细胞进行2分钟的离心。使用 P1000 微移液器小心地取出并丢弃上清液。
注:步骤3.1-3.5可用于传递黑色素细胞和成纤维细胞培养物。产生的颗粒应重新悬浮在适当的介质中,并放置在新的,未涂层(纤维细胞)或预洗,胶原蛋白涂层(黑色素细胞)盘中。 - 在0.5 mL的冰冷的PBS中重新悬浮细胞颗粒。
- 枚举50万个细胞,并将其转移到预冷冻的1.5 mL微离管中。
- 重复步骤3.5,然后在100μL的可活力溶液中重新悬浮细胞。在黑暗中4°C下孵育细胞悬浮液30分钟。
- 重复步骤 3.5-3.6 两次。
- 重复步骤3.5,然后通过在100 μL的冰冷4%甲醛溶液中重新悬浮颗粒来修复细胞。在黑暗中室温下孵育悬浮液15分钟。
- 重复步骤 3.5 两次,每次在 0.5 mL 中重新悬浮在 0.5 mL 的 3% BSA 中,在 1x PBS 中。
- 重复步骤3.5,然后在100μL的0.1%皂素溶液中重新悬浮细胞颗粒。在黑暗中室温下孵育悬浮液15分钟。
- 重复步骤3.5,然后重新悬浮细胞颗粒在100μL的0.1%皂素溶液中,含有0.5μg的兔子抗gp100抗体,0.5μg兔抗纤维细胞特异性蛋白1(FSP1)抗体和0.025μg小鼠抗细胞素14(K14)抗体。在黑暗中室温下孵育悬浮液1小时。
注:当K14抗体在预联与Alexa Fluor 647时,gp100和FSP1抗体分别与CF 555和CF 488结合。控制人群的染色也应从这一步骤开始。控制细胞群应与培养体隔离并进行处理,如步骤 3.5-3.12 所述。 - 重复步骤3.11两次,取出任何未结合的抗体。
- 重复步骤3.5,然后在1xPBS中重新悬浮200-400μL的3%BSA中的细胞颗粒。
- 将细胞溶液通过40μm细胞滤网放入5mL聚苯乙烯圆底管中,并通过流动细胞测定法分析紧张的细胞。
结果
雄性和雌性C57Bl/6J小鼠在产后0-4日安乐死,如上文所述,肌肤受到机械分离。切碎后,皮肤形成粘性浆料,缺乏任何结构组织的迹象。这种泥浆的离心导致在锥形管底部形成一个大细胞颗粒,并在上清液顶部漂浮一层脂肪。此脂肪层与上清液一起被丢弃,而剩余的细胞颗粒被重新悬浮并转移到 6 孔盘的未涂层孔中。细胞的高密度导致介质出现多云。然而,在孵育40分钟后,在介质中观察到较大的细胞和组织群,用倒置的光显微镜可以看到粘附成纤维细胞(图1)。
从成纤维细胞培养的非粘附细胞被转移到胶原蛋白涂层6井盘的一个井,以分离黑色素细胞。加入G418杀死了同质中任何剩余的成纤维细胞,使得许多死细胞在接下来的5天里漂浮在介质中(图2A-C)。经过4-5天的生长,镀金黑色素细胞开始采取与黑色素细胞颗粒的定型树突表型(图2C)。此表型在传递区域性后仍然存在 (图 2D)。虽然最初在黑色素细胞培养中观察到污染角蛋白细胞簇(图2A),但这些种群在随后的传递后就消失了。
流细胞学分析用于确认产生的原发性黑色素细胞和成纤维细胞培养物的纯度。C5N小鼠角蛋白细胞17,第10天原发性黑色素细胞培养物和第6天原丝纤维细胞培养物被染色:抗gp100(分化黑色素细胞)、抗细胞角蛋白14(K14;角蛋白细胞)和抗纤维细胞特异性蛋白1((FSP1;成纤维细胞) (图 3)在这些细胞中,gp100染色对原发性黑色素细胞是特有,而FSP1正性仅在成纤维细胞中观察到(图3A,B)。K14的表达仅限于C5N角蛋白细胞(图3C)。 在隔离后1、2、3、4和10天进行其他分析以确定我们黑色素细胞培养物的纯度(图4)。成纤维细胞和角蛋白细胞污染的组合从未超过培养细胞总数的25%(图4B,C)。然而,gp100的急剧增加直到文化的第四天才观察到(图4A)。我们将此观察归因于在黑色素细胞前体(即黑色素细胞前体)中gp100的表达减少,其中许多在文化中第10天出现完全分化(图4A)。总之,这些数据表明,我们的快速隔离方案同时产生丰富的黑色素细胞和成纤维细胞的培养物。
| 步# | 试剂 | 1 小狗 | 5 个小狗 |
| 1.1 | 胶原蛋白溶液 | 1.5 mL | 4.5 mL |
| 1.2 | 板尺寸 | 6-井 | 10 厘米 |
| 1.4 | 抗生素/抗菌溶液 | 3 mL | 15 mL |
| 1.5 | 皮肤消化缓冲液 | 3 mL | 15 mL |
| 1.6 | 黑色素细胞媒体 | 6 mL | 30 mL |
| 1.7 | 成纤维细胞介质 | 4 mL | 20 mL |
表1:不同队列大小的试剂制备指南。

图 1:原鼠成纤维细胞培养的代表性图像。图中所示是隔离后立即的20x成纤维细胞图像(A ),以及隔离后的 24 (B) 和 48 (C) h.请点击此处查看此图的较大版本。

图 2:主要黑色素细胞培养物的代表性图像。图中所示为20x黑色素细胞培养物1 (A), 2 (B) 和4天 (C) 隔离后的图像.污染角蛋白细胞由"A"中的箭头指示。(D) 传递后主要黑色素细胞培养物的代表形象.请点击此处查看此图的较大版本。

图 3:对培养纯度的流动细胞学评估。代表直方图显示gp100(A;分化黑色素细胞)、FSP1(B;成纤维细胞)和K14(C;角蛋白细胞)在原发性黑色素细胞(第10天)、原发性成纤维细胞(第6天)和C5N角蛋白细胞中的积极性。在活细胞上浇注后,从每个总体中分析10,000个事件。使用单色控件进行补偿,并使用 FlowJo 软件对结果数据进行可视化。请点击此处查看此图的较大版本。
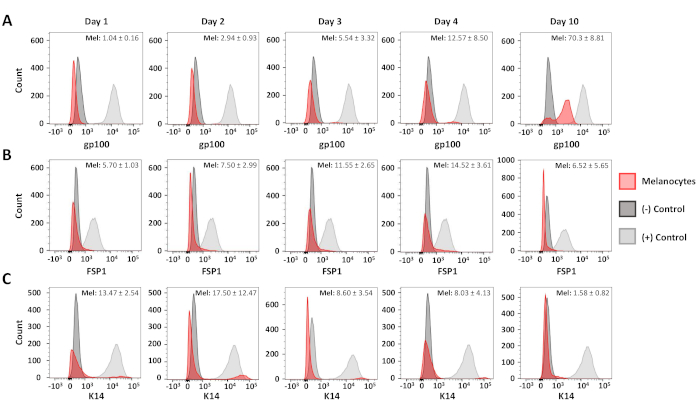
图 4:黑色素细胞纯度的时间过程分析。首次分离后10天显示黑色素细胞纯度的代表性直方图。样品被染色、分析和绘制,如图3所示。 正对照组和负对照组如下:gp100-人黑色素细胞(+),原色肌细胞(-);FSP1-原原鼠成纤维细胞(+),人类黑色素细胞(-);K14-C5N细胞(+),人类黑色素细胞(-)。每个图形的右上角显示了至少三种不同黑色素细胞培养物的平均积极性和标准偏差。请点击此处查看此图的较大版本。
讨论
原发性黑色素细胞和成纤维细胞的体外培养使我们对皮肤生物学和疾病的理解有了重大进步。该协议通过减少生成一致的黑色细胞培养物所需的时间和技术知识,同时允许同时分离皮肤成纤维细胞,改进了先前的黑色素细胞分离方法。这个过程的一个新颖的、节省时间的要素是真皮和表皮不需要分离。相反,使用机械组织切碎器的一致斩力和粒度以及选择性介质和电镀技术来分离皮肤细胞。通过降低处理复杂性和动手时间,此过程还使研究人员能够有效地进行大规模实验。
我们建议使用此协议执行几个步骤来提高产量和一致性。首先,在步骤2.4之前,我们建议使用弯曲的钳子刮去皮肤皮肤皮侧的任何脂肪组织。这个过程将减少离心后形成的脂肪蛋糕。其次,皮肤适当的机械解散对该协议的成功至关重要,并且可以通过在刀片每次通过后旋转均质器盘 [60]来增强。另一个关键步骤是确保在步骤 2.10 中删除所有皮肤消化缓冲液。否则会阻碍细胞粘附在菜上,并显著降低产量。由于颗粒未牢固地贴在步骤 2.10 中 15 mL 锥形管的底部,因此,如果未缓慢去除上清液,细胞很容易吸气。如果彻底去除皮肤消化缓冲液是一个挑战,我们建议在2-3 mL的Melanocy细胞介质中洗涤颗粒,然后在电镀前重复步骤2.9-2.10。最后,在步骤 2.11 中重新悬浮细胞颗粒时,必须大力移液,以分解任何团块并确保细胞均匀分布在细胞培养皿的表面。在隔离后的最初几天内,将在培养物中观察到碎片和死细胞。这些死细胞可能会阻碍培养物的生长,应该用PBS洗碗,然后加入新鲜的培养物来去除。
该协议概述了一种从单个小鼠生成原发性黑色素细胞和成纤维细胞培养物的方法。然而,这个程序可以有效地调整,以适应更多的小鼠群(见表1)。对于较大的群体,结合4-5个幼崽的皮肤均质性,在隔离后的4-5天内,产生30-40%的10厘米黑色素细胞。当处理多种动物时,可以使用多种技术来提高该协议的效率。首先,我们通常将动物安乐死四组,一次处理两只动物。我们发现,通过增加皮肤消化缓冲液的体积到6 mL,两只小狗的同质化皮肤可以在步骤2.7-2.8中结合。为了节省时间,我们开始将皮肤与下一对小狗隔离,而第一组则进行同质化和消化。这种方法可确保在安乐死后很快分离细胞群,并减少多只动物所需的处理时间。当对年龄较大的小鼠(即产后2-4天)进行工作时,我们发现第四次通过活性组织切碎器(步骤2.6)通过皮肤可增强皮肤均质化和细胞产量。使用这种技术,我们没有看到黑色素细胞或成纤维细胞产量与年龄相关的差异。
此协议详细介绍了如何同时从相同的皮肤样本生成成纤维细胞和黑色素细胞培养物。我们观察到,当短期胰蛋白酶化与强脱黑色素细胞一起进行时,初始黑色素细胞培养中的角蛋白细胞仍然粘附在盘子里(参见步骤3.2-3.3)。虽然我们还没有针对这些剩余的细胞优化繁殖方法,但我们假设,在角蛋白细胞介质中继续培养这种粘附性人群,辅以100纳克/mL G418,可能导致细胞群丰富。
披露声明
提交人没有利益冲突可披露。
致谢
作者感谢达蒙·鲁尼恩基金会(创新奖#38-16授予C.E.B.)和佩洛托尼亚(B.M.M.)的财政支持。我们感谢C.海恩斯和C.沃姆巴彻,他们提出了改进稿件的评论。这项工作得益于俄亥俄州综合癌症中心的分析细胞学共享资源,该资源由NIH P30 CA016058支持。
材料
| Name | Company | Catalog Number | Comments |
| 0.2 µm PES sterile syringe filter | VWR | 28145-501 | |
| 10 cm cell culture dish | Corning | 430167 | |
| 40 µm cell strainer | Fisher Scientific | 22363547 | |
| 5 mL polystyrene round-bottom tubes | Fisher Scientific | 352008 | |
| 6-well cell culture dish | Sigma-Aldrich | SIAL0516 | |
| 70 µm cell strainer | Fisher Scientific | 22363548 | |
| Antibiotic Antimycotic Solution (100x) | Sigma-Aldrich | A5955 | |
| Bovine Serum Albumin | Fisher Scientific | BP9706-100 | |
| CF 488A Mix-n-Stain Antibody Labeling Kit | Biotium | 92273 | |
| CF 555 Mix-n-Stain Antibody Labeling Kit | Biotium | 92274 | |
| Cholera Toxin | Sigma-Aldrich | C8052 | |
| Collagen from rat tail | Sigma-Aldrich | C7661 | |
| Collagenase Type I | Worthington Biochemicals | LS004156 | |
| Corning Penicillin/Streptomycin Solution | Fisher Scientific | 30-002-CL | |
| Cytokeratin 14 Antibody Alexa Fluor 647 | Novus Biologicals | NBP2-34403AF647 | |
| Deoxyribonuclease I | Worthington Biochemicals | LS002058 | |
| Di-butyryl cyclic AMP | Sigma-Aldrich | D0627 | |
| Dulbecco's Modified Eagle Medium | Gibco | 12800-082 | |
| Dulbecco's Phosphate Buffered Saline | Sigma-Aldrich | D8537 | |
| eBioscience Fixable Viability Dye eFluor 780 | Thermo Fisher | 65-0865-14 | |
| Ethanol, 200 proof | Fisher Scientific | 22032601 | |
| Fetal Bovine Serum | Sigma-Aldrich | 12306C | |
| FSP1/S100A4 antibody | Millipore Sigma | 07-2274 | |
| G418 Disulfide | P212121 | LGB-418-1 | |
| Glacial Acetic Acid | VWR | VWRV0714 | |
| Horse Serum | Fisher Scientific | 26050088 | |
| HyClone L-Glutamine | Fisher Scientific | SH3003402 | |
| McIlwain Tissue Chopper | Ted Pella | 10180 | |
| Melanoma gp100 antibody | Abcam | ab137078 | |
| Nutrient Mix F-12 Ham's Media | Sigma-Aldrich | N6760 | |
| Phorbol 12-Myristate 13-acetate | Sigma-Aldrich | P8139 | |
| Pierce 16% Formaldehyde | Thermo Fisher | 28908 | |
| Porcine Trypsin | Sigma-Aldrich | 85450C | |
| RPMI 1640 media | Sigma-Aldrich | R8758 | |
| Saponin | Sigma-Aldrich | S-7900 | |
| Tissue Chopper Blade | Ted Pella | 121-6 | |
| Tissue Chopper Plastic Disk | Ted Pella | 10180-01 | |
| Trypsin | VWR | VWRL0154-0100 |
参考文献
- Rittie, L. Cellular mechanisms of skin repair in humans and other mammals. Journal of Cell Communucation and Signal. 10 (2), 103-120 (2016).
- Romanovsky, A. A. Skin temperature: its role in thermoregulation. Acta Physiologica (Oxf). 210 (3), 498-507 (2014).
- Holick, M. F., Smith, E., Pincus, S. Skin as the site of vitamin D synthesis and target tissue for 1,25-dihydroxyvitamin D3. Use of calcitriol (1,25-dihydroxyvitamin D3) for treatment of psoriasis. Archives of Dermatology. 123 (12), 1677-1683 (1987).
- Yamaguchi, Y., Hearing, V. J. Physiological factors that regulate skin pigmentation. Biofactors. 35 (2), 193-199 (2009).
- Yamaguchi, Y., Hearing, V. J. Melanocytes and their diseases. Cold Spring Harbor Perspectives in Medicine. 4 (5), (2014).
- Brenner, M., Hearing, V. J. The protective role of melanin against UV damage in human skin. Photochemistry and Photobiology. 84 (3), 539-549 (2008).
- Thody, A. J., et al. Pheomelanin as well as eumelanin is present in human epidermis. The Journal of Investigative Dermatology. 97 (2), 340-344 (1991).
- Swope, V. B., Abdel-Malek, Z. A. MC1R: Front and Center in the Bright Side of Dark Eumelanin and DNA Repair. International Journal of Molecular Science. 19 (9), (2018).
- Barsh, G. S. What controls variation in human skin color. PLoS biology. 1 (1), 27 (2003).
- Abdel-Malek, Z., et al. The melanocortin-1 receptor is a key regulator of human cutaneous pigmentation. Pigment Cell Research. 13, 156-162 (2000).
- Gronskov, K., Ek, J., Brondum-Nielsen, K. Oculocutaneous albinism. Orphanet Journal of Rare Diseases. 2, 43 (2007).
- Kwon, S. H., Hwang, Y. J., Lee, S. K., Park, K. C. Heterogeneous Pathology of Melasma and Its Clinical Implications. International Journal of Molecular Sciences. 17 (6), (2016).
- D'Orazio, J., Jarrett, S., Amaro-Ortiz, A., Scott, T. UV radiation and the skin. International Journal of Molecular Science. 14 (6), 12222-12248 (2013).
- Bonnans, C., Chou, J., Werb, Z. Remodelling the extracellular matrix in development and disease. Nature Reviews Molecular Cell Biology. 15 (12), 786-801 (2014).
- Kendall, R. T., Feghali-Bostwick, C. A. Fibroblasts in fibrosis: novel roles and mediators. Frontiers in Pharmacology. 5, 123 (2014).
- Kalluri, R. The biology and function of fibroblasts in cancer. Nature Reviews Cancer. 16 (9), 582-598 (2016).
- Dickson, M. A., et al. Human keratinocytes that express hTERT and also bypass a p16(INK4a)-enforced mechanism that limits life span become immortal yet retain normal growth and differentiation characteristics. Molecular and Cellular Biology. 20 (4), 1436-1447 (2000).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。