Method Article
Управление кластером первоначальный 3D клеток в гибрид геля куб устройство для повторяющихся шаблон образований
В этой статье
Резюме
Мы представляем процедуру для контроля первоначальная клеточная кластера фигуру в 3D внеклеточного матрикса получить воспроизводимые модели формирования. Кубических устройство, содержащее два разных гидрогели, используемых для достижения многоцелевые изображения для формирования узор ткани.
Аннотация
В пробирке 3D культур значительно подчеркнуто в культуре ткани клеток. Однако отсутствие экспериментальных повторяемость является одним из его ограничений. Несколько повторяемые результаты формирования шаблона ухудшается анализ механизмов, лежащих в основе самоорганизации. Сокращение различий в условиях первоначальной культуры, таких как плотность клеток и распределения в внеклеточного матрикса (ECM), имеет решающее значение для улучшения повторяемости 3D культуры. В этой статье мы демонстрируем простые, но надежные процедуры для контроля первоначальная клеточная кластера фигуру в 3D внеклеточной матрицы для получения высокой повторяемости шаблон образований. Micromold с желаемой формы производилась с помощью фотолитографии или процесс обработки, и он сформировал 3D карман в ECM, содержащихся в Кубе гибрид геля (КГЧ). Высококонцентрированных клетки затем вводили в кармане, так что форма ячеек кластер соответствует сфабрикованные плесень формы. Занятых КГЧ допускается многоцелевые сканирование его вращения, которая позволила изображений с высоким разрешением и захват структуры всей ткани, хотя низкий увеличение объектива была использована. Нормальные человеческие бронхиальной эпителиальные клетки были использованы для демонстрации методологии.
Введение
Значение 3D культуры, который лучше имитирует биологических сред, чем 2D культуры, значительно подчеркнул в ткани клеток культуры1,2,3. Взаимодействие между клетками и внеклеточного матрикса (ECM) предоставляет важные подсказки относительно морфогенеза4,5. Многие ткани образований может возникнуть только в 3D средах, таких как складной процесса6,7, invagination8и трубчатых формирования9,10. Однако многочисленные трудности предотвратить исследователей от перехода к 3D эксперименты 2D экспериментов на блюдо. Одна из основных трудностей в 3D экспериментов является вопрос о визуализации 3D образцов. По сравнению с плоской эксперименты, приобретения соответствующей 3D изображения по-прежнему сложным во многих случаях. В частности получение соответствующей 3D изображения является трудной задачей, когда размер выборки достигает миллиметрового диапазона из-за большой глубины очага низкой увеличение линз. К примеру глубины очага достигает более чем 50 мкм, когда 10 x увеличение объектива используется в то время как размер одной ячейки составляет обычно менее 10 мкм. Для повышения качества изображения, в настоящее время разрабатываются высокими технологиями микроскопии систем (например, два Фотон микроскопии11 и свет лист микроскопии системы12), но их доступность ограничена ввиду их дорогой ценой. В качестве альтернативы мы разработали ранее гибрид геля устройства куб (КГЧ)13. Устройство состоит из двух видов гидрогели: как гель поддержки и ECM как коллаген или Matrigel как культура гель агарозы. HGC позволяет нам собирать образца при культивировании и вращать куб для достижения многоцелевые изображений, который устраняет проблему глубины очага14.
Еще одна трудность в 3D экспериментов является их низкая воспроизводимость вследствие плохой управляемости 3D средах. В отличие от плоской культуры на пластиковые блюдо вариации в условиях первоначальной культуры легко произойти в трехмерном пространстве, окруженный мягким материалом. Значительные различия в результатах экспериментальной ухудшается после анализа и маски основных механизмов. Многие инженерные технологии были разработаны пространственно выровнять единичных клеток, таких как подложке15,16, волокна, ткачество17и18леса, но они требуют сложной предварительной обработки или специально Дизайн оборудования. В отличие от этого мы разработали методологию для достижения 3D клеток выравнивания в КГЧ19.
В этом протоколе мы иллюстрируется простая процедура с часто используемым оборудованием для контроля 3D первоначальная клеточная форма кластера в КГЧ. Во-первых был продемонстрирован процесс изготовления КГЧ. Затем micromolds сфабрикованы фотолитографии или процесс обработки были помещены в КГЧ производить карман с произвольной формы в ECM. Впоследствии весьма плотной клетки после центрифугирования вводили в карман, чтобы контролировать форму первоначальная клеточная кластера в КГЧ. Точно контролируемой клеток кластера может образы из многих направлений благодаря КГЧ. Нормальные человеческие бронхиальной эпителиальных клеток (NHBE) были использованы для демонстрации элемента управления формы кластера первоначальная клеточная и изображений ветвей с нескольких направлений повышения качества изображений.
протокол
1. Изготовление гибрид геля куб устройства
- Подготовьте кубических кадр поликарбонат (PC), либо с помощью обработки или 3D-принтер. Размер кадра ПК зависит от размера выборки. В этом исследовании мы использовали кадр 5 мм на каждой стороне, так что ветви было достаточно пространства для удлиненное во время культивирования.
- Место Рамка ПК на предварительно охлажденным стеклянное скольжение или другой гладкой поверхности в коробке льда (< 0 ° C) (рис. 1A).
- Мкл 12 подогретую агарозы 1,5% (w/v) из верхней грани кубический кадра к нижней поверхности с пипеткой. Инсульта пипетки, так что агарозы спреды для создания плоской поверхности (рис. 1B).
- В течение нескольких минут будет вылечить агарозы. Выберите вверх PC кадра, сдвинув его к краю стекла слайда с помощью пинцета. Обратите внимание, что вертикально поднимая кадр из стекла слайд может привести к отсоединение от агарозы из кубической кадра из-за силы сцепления между агарозы и стеклянное скольжение (рис. 1 c).
- Вращайте куб кадра, чтобы сделать открытым лицом вниз, а затем поместить на слайде стекло снова (рис. 1 d).
- Повторите шаги 1.3-1.5 до тех пор, пока три поверхности заполнены с агарозы (Рисунок 1E).
- Сформировать агарозы стены на четвертом и пятом лица, падение агарозы с открытым лицом (Рисунок 1F). После того как стена агарозы формируется на пятой лицо, завершена подготовка КГЧ.
2. Изготовление micromolds фотолитографии или процесс обработки
- Изготовление по фотолитографии
- Очистить пластины кремния (Si) через ультразвуковой очистки с помощью ацетона, изопропиловый спирт (IPA), затем дистиллированной воды (DI) за 5 мин. После азота дует Si пластин с азотом обезвоживанию в духовке при 140 ° C в течение 20 мин (Рисунок 2а(i)).
- Спин пальто жертвенного слоя как ЛОР и Az сопротивляется на Si пластины (2000 об/мин, 30 s) с помощью спин coater под желтым светом. Сразу же после отжима покрытие тепло пластин на горячей плите на 90 ° C на 3 мин (Рисунок 2а(ii)). Желаемую толщину жертвенного слоя является более 1 мкм, так что подъема процесс может осуществляться легко, но точной толщины не является необходимым.
- Поместите пластины на горячей плите при 70 ° C, а затем прокатанный лист толщиной негативного фоторезиста с требуемой толщины на жертвенный слой с помощью рук ролика (рис. 2а(iii))
- Через пять минут после ламинирования, поместите пластины на маска выравниватель для УФ-облучения. Photomask с желаемый узор на лист сопротивляться и разоблачить с ультрафиолетовым светом для соответствующего срока. Время воздействия определяется толщина фоторезиста и интенсивность УФ-излучения. Впоследствии Поместите пластины на горячей плите для постконтактная выпекать при температуре 60 ° C за 5 мин, после чего выпечки на 90 ° C в течение 10 минут (рис. 2A(iv))
- Разработка негативного фоторезиста, погружая вафельные в пропиленгликоля монометиловый эфир ацетат (PGMEA), до тех пор, пока неэкспонированные области полностью не растворится (около 20 мин) (рисунок 2A(v)).
- Растворите жертвенного слоя с помощью АПИ для ультразвуковой очистки для подъема микроструктуры. Как только микроструктуры отрывании от пластины, промойте водой ди ультразвуковой очистки 10 мин (рисунок 2A(vi)).
- Погружайте плесень в 30 мкл MPC полимера для 30 мин при комнатной температуре (примерно 20 ° C), чтобы полностью высохнуть. Рисунок 2B показывает сфабрикованные Призма плесень.
- Изготовление цилиндров плесень
- Изготовить стальной цилиндр плесень с нужного размера, процесс обработки. Кроме того использование коммерчески доступных из нержавеющей стали. (В этом исследовании используется φ цилиндра 600 мкм.)
- Погружайте стальной цилиндр в 30 мкл MPC полимера для 30 мин при комнатной температуре (примерно 20 ° C), чтобы полностью высохнуть.
- Подготовка жидких полидиметилсилоксан (PDMS) путем смешивания базы смолы и ее катализатора (см. Таблицу материалы) в соотношении 10:1, следуют дегазация с вакуумной дегазации системы за 20 мин. Затем налейте PDMS 12-хорошо пластины.
- Установите стальной цилиндр перпендикулярно поверхности датум и фиксированной линейной z-сцену так, что он может быть перпендикулярно вставлен в неотвержденных поверхности PDMS в 12-хорошо плита размещены на одной и той же поверхности datum, перемещая z этап. Инкубируйте PDMS с стальной цилиндр в духовке 20 минут при 90 ° C для лечения. Вырежьте PDMS для формирования боковой поверхности, так что накапайте могут быть вставлены в процессе следующих (рис. 2 c).
3. Управление первоначальная клеточная форма кластера в Гидрогель
- Внедрить соответствующие ECM для нужной ячейки культуры, таких как коллаген и искусственных базальной мембраны, в КГЧ для заполнения пространства в культуре (рис. 3A).
- Комплект готовых micromold на КГЧ прямо или косвенно соответствующий держатель, как показано на рисунке 3B. Впоследствии место КГЧ в CO2 инкубатора для 25 мин при 37 ° C для лечить его.
- Осторожно выньте micromold, так что ECM не ухудшится (рис. 3 c). Карман, как форму желаемой формы, будут изготовлены в ECM.
- Урожай клетки культивировали блюдо трипсина ЭДТА или его эквивалент в зависимости от типов клеток. Впоследствии, центрифуга клетки для получения высококонцентрированных клеток (для NHBE культуры, применить трипсин 0.25%-ЭДТА и инкубации клеток на 3 мин, а затем нейтрализовать с FBS-содержащих среднего и центрифугирование в 300 x g 4 мин).
- После центрифугирования, удалить супернатант средне-и уплотнить клетки и придать высококонцентрированных клетки (3.0 × 104 клеток/мкл для NHBE клеток) в карман в ECM (рис. 3D).
- Инкубируйте КГЧ с ячейками в CO2 инкубатора для 20 минут при 37 ° C, так что клетки попадают в карман ECM для заполнения пространства, созданный micromolds. Если чрезмерное среднего или клетки присутствуют на верхней поверхности, тщательно удалите с помощью пипетки.
- КГЧ состоится 24-хорошо пластины и 100 мкл соответствующего среднего (Рисунок 3E). Для NHBE клеток используйте 1:1 смесь коммерчески доступных специализированных средних для NHBE и эндотелиальных клеток (см. Таблицу материалы).
- Внедрить дополнительные ECM закрыть кармана в ECM, и затем инкубации при 37 ° C 25 мин.
- Охладить разогретой агарозы 1,5% до комнатной температуры (примерно 20 ° C). Падение приблизительно 10 мкл агарозы на верхней поверхности КГЧ закрыть поверхности и предотвратить выпадение КГЧ во время культивирования и обработки изображений (Рисунок 3F) ECM. Затем Инкубируйте КГЧ для еще 20 минут при 37 ° C вылечить агарозы.
- Добавление средних для покрытия всего КГЧ так что осмотическое давление может помочь в обеспечении питания для клетки внутри КГЧ.
4. Многоцелевые изображения
- Неинвазивная 3D формы признания многоцелевые наблюдения
- Место культуры блюдо или хорошо пластины, содержащие КГЧ на микроскопе и ориентировать КГЧ в кадре. Затем получите пример изображения, яркий контраст поле или фазы.
- Возьмите и повернуть КГЧ разместить различные поверхности вниз.
- Повторите шаги 4.1.1 и 4.1.2 получаются изображения со всех шести сторон.
- Иммуно люминесцентные изображения с разнонаправленными наблюдения
- Для фиксации применяются параформальдегида 4% к образцу над КГЧ при комнатной температуре (примерно 20 ° C) для 20 минут, следуют два полоскания PBS на 10 мин.
- Разрушения КГЧ с PBS содержащих 0,5% Тритон X-100 10 мин при температуре 4 ° C, затем смывают 3 x 10 мин с PBS.
- Инкубировать КГЧ с 10% козьего сыворотки в IF-буфера (0,2% Тритон X-100, 0.1% бычьего сывороточного альбумина и 0,05% Tween-20 в PBS) 60 мин при комнатной температуре для первичного блокировки шага.
- Для окрашивания конкретных молекулы, используйте соответствующие антитела. Соблюдать коллективные клетки геометрии, Alexa Fluor 488 Фаллоидин может использоваться для пятно актина.
- Место КГЧ на блюдо дно стекла под микроскопом лазер или люминесцентных и выполнять сканирование с шести сторон для получения изображения весь пример.
Результаты
Нормальные человеческие бронхиальной эпителиальных клеток (NHBE) были использованы для демонстрации иллюстрируется методологии и контроля геометрии первоначального коллективного клеток для достижения цилиндрической формы и формы Призма, соответственно в среде ECM. Многоцелевые изображения результаты, полученные фазового контраста, а также Фаллоидин пятнать призму формы (рис. 4 cD) и цилиндрической формы (рис. 4AB) представлены. Клетки подходяще выравниванные, чтобы принести желаемого 3D формы в среде ECM. Впоследствии клетки были культивировали в течение четырех дней, чтобы сформировать конкретную форму и затем были проанализированы многоцелевые изображения. Большие выборки размер делает его довольно трудно захватить изображение всей ткани в одном направлении; Однако КГЧ позволили изображений до шести сторон, раскрывая весь ткани форму. Рисунок 5 показывает результаты иммуноокрашивания бронхиального дерева, из NHBE клеток. NHBE клетки были первоначально контролируется на цилиндрическую форму в КГЧ. Затем большинство филиалов были направлены перпендикулярно оси цилиндрические.

Рисунок 1: процесс изготовления гибрид геля куб устройства. (A) поликарбоната кубический рама устанавливается на окно помощи льда. (B) агарозы (1,5%) вводится для покрытия нижней поверхности. (C) куб скользнул должны быть собраны. (D) куб вращается сделать другой поверхностью вниз. (E) агарозы (1,5%) вводят сформировать другой агарозы стены. (F) после того, как стена агарозы производится три лица, агарозы впрыскивается через открытым лицом. Линейки: 5 mm. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
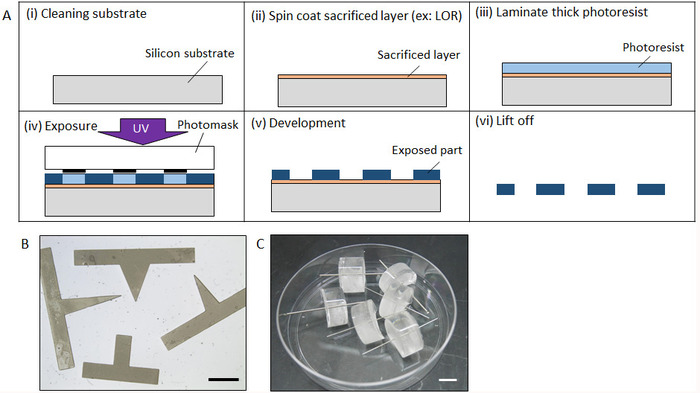
Рисунок 2: процесс изготовления micromolds. (A) изготовление процесс micromold, фотолитографии. (B) полная форма форма micromold сфабрикованы Призма, фотолитографии. (C) сфабрикованы micromold с стальной цилиндр. Линейки: (B) (C), 2 мм 10 мм. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 3: процесс изготовления первоначальная клеточная кластер управления. (A) ECM (например, коллаген и Matrigel) впрыскивается в КГЧ. (B) micromold устанавливается на кубический раме с или без владельца. (C) после ECM лечится, micromold удаляется. (D) после центрифугирования, весьма плотной клетки вводят и инкубировали. (E) среднего применяется. Для покрытия поверхности КГЧ вводят дополнительные ECM (F) следуют агарозы. Линейки: 5 mm. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
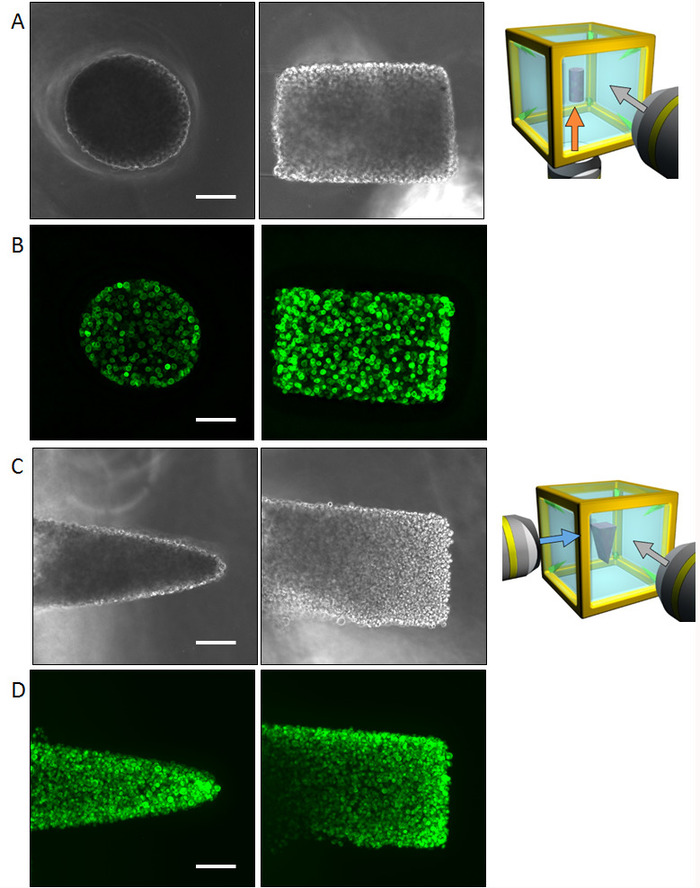
Рисунок 4: результаты первоначальных ячейки управления с NHBE клетками. (A) фазово контрастной изображения цилиндрически контролируемых NHBE клетки, взятые для нижней и боковой поверхности. Целиком может быть признаны многоцелевые наблюдения не требуя флуоресцентных изображений. (B) изображения флуоресценции цилиндрически контролируемых NHBE клеток, окрашивание F-миозина. (C) фазово контрастной изображения NHBE клетки, контролируемых в форме треугольной призмы, захватили из нижней и боковой поверхностей. (D) изображения флуоресценции клеток NHBE, контролируемых в форме треугольной призмы. Линейки: 100 µm. 10 x увеличение объектива (0,3 числовая апертура) был использован. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
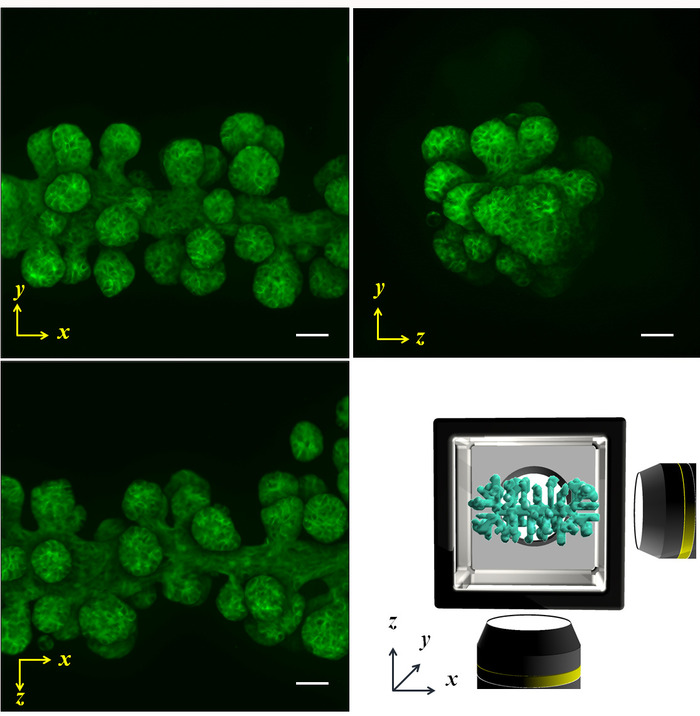
Рисунок 5: прогнозируемые флуоресцентного изображения захвачен многоцелевые сканирование. NHBE клетки были первоначально контролируемых производить цилиндрическую форму и культивировали в КГЧ на 4 дня. Впоследствии актина была запятнана Фаллоидин. Ветви были удлиненные от начальной цилиндра по оси x, и длину, размер и угол от оси были также разработаны. Нижнего правого изображения показана схема образца формы и x-y-z оси. Линейки: 100 мкм. 10 x увеличение объектива (0,3 числовая апертура) был использован. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Обсуждение
Метод, представленный в настоящем документе проста и может выполняться без высокотехнологичного оборудования. Одновременно можно получить точное ячейки кластера форму управления результат в 3D пространстве гидрогеля. После первоначального контроля клетки могут расти в КГЧ как они культивированный на блюдо. Многоцелевые изображений производится вращением образца с HGC, используя любой системы микроскопии, и это значительно повышает качество изображения. Выбор материалов для HGC рамы и micromold является гибким, пока они являются биосовместимыми. 3D-принтер может использоваться для производства HGC кадр или micromold если точность 3D принтер является достаточным для их приложений. Предложенный метод совместим с много изображений, расширение технологии, такие как прозрачность реагентов20,21 и свет лист микроскопии систем. Применяя эти технологии, можно улучшить качество изображения.
Объем агарозы, ECM и весьма плотной клетки для инъекций зависит от размера HGC и плесени. Тщательно ручной работы, которая не вводите пузырьки воздуха не требуется, иначе пузыри сформировали ухудшится точность управления, роста клеток и качества изображения.
Процесс изготовления micromolds будет определяться желаемую форму управления. Фотолитография позволяет изготовление точных 2D фигур с определенной глубины, как Призма фигуры по приказу мкм; Однако это не эффективно с 3D-фигур, таких как цилиндр. Процесс обработки позволяет нам изготовить 3D форму, но в целом, точность размеров меньше фотолитографии. После изготовления micromolds покрытие полимера фосфорилхолин (ПДК) 2-methacryloyloxyethyl на формы требуется для предотвращения прилипания на ECM.
Воспользовавшись HGC, микроскопических изображений с или без лазерного облучения могут выполняться в нескольких направлениях. 3D образца фигуры могут быть примерно признаны многоцелевые наблюдения без люминесцентные маркировки; Этот метод не вызывает любой ячейки инвазивность во время наблюдения. В отличие от флуоресцентных изображений не требуется для получения более точных 3D образца формы и молекулярные выражения.
Ограничения метода представленных для начальной ячейки является, что он не может применяться к плесени с сложной 3D формы. Форма должна быть удалена, подбирая без ухудшения ECM. Таким образом плесень ограничивается простой прямой или конической формы. Чтобы получить более сложные формы управления, необходима дальнейшая разработка протокола.
Предлагаемая методология имеет широкие и легко может проводиться в большинстве лабораторных сред. Эта простая процедура может преодолеть ограничения 3D культуры, визуализации и повторяемость и внести вклад в дальнейшее развитие необходимых для 3D культуры.
Раскрытие информации
Авторы и университета префектуры Осака и Кюсю технологический институт подали заявку на патент для гибрид геля куб устройство и Nippon медицинской и химической инструментов Co. Ltd, Япония недавно продажным куб. Компания не затрагивает любого дизайна, процесса и методов, описанных.
Благодарности
Эта работа была финансово поддержана JSP-страницы KAKENHI (18H 04765) и программу для распространения системы землевладения трек, МПКСНТ, Япония.
Материалы
| Name | Company | Catalog Number | Comments |
| 12-well-plate | Corning Inc. | 3513 | |
| 2-Methoxy-1-methylethyl Acetate | FUJIFILM Wako Pure Chemical Co. | 130-10505 | PGMEA, CAS: 108-65-6 |
| 4% paraformaldehyde | FUJIFILM Wako Pure Chemical Co. | 161-20141 | CAS: 30525-89-4 |
| Agarose, low gelling temperature BioReagent | Sigma-Aldrich | A9414 | |
| Alexa fluor 488 phalloidin | Thermo Fisher Scientific | A12379 | |
| AZ1512 | Merck | ||
| BEGM bullet kit | Lonza | CC-3170 | Specialized medium for NHBE cells |
| Bovine Serum Albumin solution (10 %) | Sigma-Aldrich | A1595 | |
| EGM-2 bullet kit | Lonza | CC-3162 | Specialized medium for endothelial cells |
| Lipidure | NOF co. | MPC polymer | |
| Matrigel growth factor reduced basement membrane matrix | Corning Inc. | 354230 | |
| Normal Goat Serum (10%) | Thermo Fisher Scientific | 50197Z | |
| Normal human bronchial epithelial cells | Lonza | CC-2541 | |
| SILPOT 184 W/C | Dow Corning Co. | 3255981 | Base resin and catalyst for PDMS |
| SUEX D300 | DJ MicroLaminates, Inc | Thick negative photoresist (thichness: 300 mm) | |
| Triton X-100 (1%) | Thermo Fisher Scientific | HFH10 | |
| Trypsin-EDTA (0.25%) | Thermo Fisher Scientific | 25200056 | |
| TWEEN 20 | Sigma-Aldrich | P9416 |
Ссылки
- Baker, B. M., Chen, C. S. Deconstructing the third dimension - how 3D culture microenvironments alter cellular cues. Journal of Cell Science. 125 (13), 3015-3024 (2012).
- Sasai, Y. Cytosystems dynamics in self-organization of tissue architecture. Nature. 493 (7432), 318-326 (2013).
- Shamir, E. R., Ewald, A. J. Three-dimensional organotypic culture: Experimental models of mammalian biology and disease. Nature Reviews Molecular Cell Biology. 15 (10), 647-664 (2014).
- Frantz, C., Stewart, K. M., Weaver, V. M. The extracellular matrix at a glance. Journal of Cell Science. 123 (24), 4195-4200 (2010).
- Choquet, D., Felsenfeld, D. P., Sheetz, M. P. Extracellular matrix rigidity causes strengthening of integrin- cytoskeleton linkages. Cell. 88 (1), 39-48 (1997).
- Hannezo, E., Prost, J., Joanny, J. -F. Theory of epithelial sheet morphology in three dimensions. Proceedings of the National Academy of Sciences of the United States of America. 111 (1), 27-32 (2014).
- Tawk, M., et al. A mirror-symmetric cell division that orchestrates neuroepithelial morphogenesis. Nature. 446 (7137), 797-800 (2007).
- Eiraku, M., et al. Self-organizing optic-cup morphogenesis in three-dimensional culture. Nature. 472 (7341), 51-58 (2011).
- Zegers, M. M. P., O’Brien, L. E., Yu, W., Datta, A., Mostov, K. E. Epithelial polarity and tubulogenesis in vitro. Trends in Cell Biology. 13 (4), 169-176 (2003).
- Affolter, M., Bellusci, S., Itoh, N., Shilo, B., Thiery, J. P., Werb, Z. Tube or not tube: Remodeling epithelial tissues by branching morphogenesis. Developmental Cell. 4 (1), 11-18 (2003).
- Denk, W., Strickler, J., Webb, W. Two-photon laser scanning fluorescence microscopy. Science. 248 (4951), 73-76 (1990).
- Huisken, J., et al. Optical Sectioning Deep Inside Live Embryos by Selective Plane Illumination Microscopy. Science. , 1007-1009 (2004).
- Hagiwara, M., Kawahara, T., Nobata, R. Tissue in Cube: In Vitro 3D Culturing Platform with Hybrid Gel Cubes for Multidirectional Observations. Advanced Healthcare Materials. 5 (13), 1566-1571 (2016).
- Hagiwara, M., Nobata, R., Kawahara, T. Large Scale Imaging by Fine Spatial Alignment of Multi-Scanning Data with Gel Cube Device. Applied Sciences. 8 (235), (2018).
- Kolesky, D. B., Homan, K. A., Skylar-Scott, M. A., Lewis, J. A. Three-dimensional bioprinting of thick vascularized tissues. Proceedings of the National Academy of Sciences of the United States of America. 113 (12), 3179-3184 (2016).
- Mironov, V., Visconti, R. P., Kasyanov, V., Forgacs, G., Drake, C. J., Markwald, R. R. Organ printing: Tissue spheroids as building blocks. Biomaterials. 30 (12), 2164-2174 (2009).
- Onoe, H., et al. Metre-long cell-laden microfibres exhibit tissue morphologies and functions. Nature Materials. 12 (6), 584-590 (2013).
- Miller, J. S., et al. Rapid casting of patterned vascular networks for perfusable engineered three-dimensional tissues. Nature Materials. 11 (9), 768-774 (2012).
- Hagiwara, M., Nobata, R., Kawahara, T. High repeatability from 3D experimental platform for quantitative analysis of cellular branch pattern formations. Integrative Biology. 10, 306-312 (2018).
- Tainaka, K., et al. Whole-body imaging with single-cell resolution by tissue decolorization. Cell. 159 (4), 911-924 (2014).
- Murray, E., et al. Scalable Proteomic Imaging for High-Dimensional Profiling of Intact Systems. Cell. 163 (6), 1500-1514 (2015).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
ISSN 2578-2614
Авторские права © 2025 MyJoVE Corporation. Все права защищены
Мы используем файлы cookie для улучшения качества работы на нашем веб-сайте.
Продолжая пользоваться нашим веб-сайтом или нажимая кнопку «Продолжить», вы соглашаетесь принять наши файлы cookie.