Method Article
Controllo del Cluster iniziale delle cellule 3D in un ibrido Gel cubo dispositivo per reticolo ripetibile formazioni
In questo articolo
Riepilogo
Presentiamo una procedura per controllare la forma di cluster iniziale delle cellule in una matrice extracellulare 3D per ottenere una formazione di reticolo ripetibile. Un dispositivo cubico contenente due diversi idrogeli è impiegato per realizzare multi-direzionale imaging per la formazione del reticolo di tessuto.
Abstract
L'importanza delle colture in vitro di 3D notevolmente è sottolineata nella coltura del tessuto e delle cellule. Tuttavia, la mancanza di ripetibilità sperimentale è una delle sue restrizioni. Producendo pochi risultati ripetibili di formazione di pattern si deteriora l'analisi dei meccanismi di auto-organizzazione. Ridurre la variazione in condizioni di coltura iniziale, come ad esempio la densità delle cellule e la distribuzione nella matrice extracellulare (ECM), è fondamentale per migliorare la ripetibilità di una cultura 3D. In questo articolo, dimostriamo una procedura semplice ma robusta per controllare la forma di cluster iniziale delle cellule in una matrice extracellulare 3D per ottenere formazioni reticolo altamente ripetibile. Un micromold con una forma desiderata è stato fabbricato utilizzando fotolitografia o un processo di lavorazione, e formava una tasca 3D in ECM contenuta in un cubo di gel ibrido (HGC). Le cellule altamente concentrate quindi sono state iniettate nella tasca affinché la forma di cluster di cellule abbinato con la forma di stampo fabbricato. Il lavoratore HGC ammessi multi-direzionale scansione dalla sua rotazione, che permetteva a imaging ad alta risoluzione e la cattura di struttura del tessuto intero anche se è stato utilizzato un basso ingrandimento lente. Cellule epiteliali bronchiali umane normali sono state usate per illustrare la metodologia.
Introduzione
Notevolmente è sottolineata l'importanza di una cultura 3D, che imita meglio ambienti biologici rispetto a una cultura 2D, in cellule/tessuti cultura1,2,3. L'interazione tra cellule e matrice extracellulare (ECM) fornisce importanti indicazioni riguardanti la morfogenesi4,5. Molti tessuti formazioni possono emergere solo in ambienti 3D, quali la piegatura processo6,7, invaginazione8e formazione tubolare9,10. Tuttavia, numerose difficoltà impediscono i ricercatori di spostamento agli esperimenti 3D da esperimenti 2D su un piatto. Una delle difficoltà principali in esperimenti di 3D è la questione dei campioni 3D imaging. Confrontati con gli esperimenti planari, acquisizione di immagini 3D appropriate è ancora difficile in molti casi. In particolare, ottenendo un'immagine 3D appropriata è un compito difficile quando la dimensione del campione raggiunge l'intervallo di millimetro a causa della grande profondità focale di lenti a basso ingrandimento. Ad esempio, la profondità focale raggiunge più di 50 µm quando una lente di ingrandimento di 10x è usato mentre la dimensione della cella singola è normalmente inferiore a 10 µm. Per migliorare la qualità delle immagini, sistemi di microscopia ad alta tecnologia sono in fase di sviluppo (per esempio, microscopia del due-fotone11 e microscopia luce-foglio sistema12), ma la loro disponibilità è limitata a causa del loro prezzo costoso. In alternativa, in precedenza abbiamo sviluppato un ibrido gel cubo (HGC) dispositivo13. Il dispositivo è costituito da due tipi di idrogeli: agarosio come un gel di supporto e un ECM come il collagene o Matrigel come un gel di cultura. La HGC permette di raccogliere il campione durante la messa in coltura e ruotare il cubo per ottenere immagini multi-direzionale, che affronta il problema di profondità focale14.
Un'altra difficoltà in esperimenti di 3D è loro ripetibilità bassa a causa della scarsa controllabilità degli ambienti 3D. A differenza di una coltura planare su un piatto di plastica, variazioni delle condizioni di coltura iniziale si verificano facilmente in uno spazio 3D, circondato da un materiale morbido. Una variazione significativa nei risultati sperimentali si deteriora la seguente analisi e maschera i meccanismi di fondo. Molte tecnologie di ingegneria sono stati sviluppati per allineare spazialmente cellule singole, ad esempio multimateriali15,16, fibra tessitura17e ponteggi18, ma richiedono pre-elaborazione complessa o specificamente apparecchiature progettate. Al contrario, abbiamo sviluppato una metodologia per realizzare l'allineamento di cella 3D in un HGC19.
In questo protocollo, abbiamo illustrato una procedura semplice con attrezzature comunemente usate per controllare la forma di cluster iniziale 3D delle cellule in un HGC. In primo luogo, il processo di fabbricazione dell'HGC è stato dimostrato. Quindi, micromolds fabbricato di fotolitografia o un processo di lavorazione sono stati collocati in HGC per produrre una tasca con una forma arbitraria a un ECM. Successivamente, cellule altamente dense dopo centrifugazione sono state iniettate nella tasca per controllare la forma di cluster iniziale delle cellule nel HGC. Il cluster precisamente controllata delle cellule potrebbe essere imaged da molte direzioni a causa della HGC. Cellule (NHBE) di epiteliali bronchiali umane normali sono state usate per dimostrare il controllo della forma di cluster iniziale delle cellule e la formazione immagine dei rami da più direzioni per migliorare la qualità delle immagini.
Protocollo
1. fabbricazione di dispositivo ibrido gel cubo
- Preparare un telaio cubico di policarbonato (PC) tramite un processo di lavorazione o una stampante 3D. La dimensione del telaio PC dipende la dimensione del campione. In questo studio, abbiamo utilizzato un telaio di 5 mm su ciascun lato affinché i rami avevano spazio sufficiente per allungare durante la coltura.
- Posizionare il telaio del PC su una lastra di vetro pre-raffreddata o un'altra superficie liscia in una scatola di ghiaccio (< 0 ° C) (Figura 1A).
- Aggiungere 12 µ l di pre-riscaldata agarosio al 1.5% (p/v) dalla faccia superiore del telaio cubico alla superficie inferiore con una pipetta. Corsa la pipetta affinché l'agarosio si diffonde per creare una superficie piana (Figura 1B).
- In pochi minuti, l'agarosio sarà guarito. Ritirare il telaio PC facendolo scorrere al bordo del vetrino con una pinzetta. Si noti che verticalmente, raccogliendo il telaio dal vetrino può provocare lo scollegamento di agarosio dal telaio cubico a causa della forza di attrazione tra l'agarosio e il vetrino (Figura 1).
- Ruotare la cornice di cubica per rendere il viso aperto verso il basso e poi posto su nuovamente la lastra di vetro (Figura 1).
- Ripetere i passaggi 1,3 – 1,5 tre superfici sono pieni di agarosio (Figura 1E).
- Per formare un muro di agarosio sui volti di quarto e quinto, cada l'agarosio da un viso aperto (Figura 1F). Una volta che una parete dell'agarosi è formata sulla Quinta faccia, la preparazione dell'HGC è completata.
2. fabbricazione di micromolds di fotolitografia o un processo di lavorazione
- Fabbricazione di fotolitografia
- Pulire un wafer di silicio (Si) tramite lavaggio ad ultrasuoni con acetone, alcool isopropilico (IPA), poi distillata (DI) di acqua per 5 minuti ciascuno. Dopo azoto che soffia la cialda Si con azoto, disidratare in forno a 140 ° C per 20 min (Figura 2A(i)).
- Spin-cappotto uno strato sacrificale come LOR e Az resiste sul wafer Si (2.000 giri/min, 30 s) utilizzando un spin-coater sotto luce gialla. Immediatamente dopo il rivestimento per rotazione, riscaldare la cialda su un piatto caldo a 90 ° C per 3 min (Figura 2A(ii)). Lo spessore desiderato dello strato sacrificale è più di 1 µm, affinché l'ascensore fuori processo possa essere eseguito facilmente, ma non è necessario uno spessore preciso.
- Posizionare la cialda su un piatto caldo a 70 ° C e quindi un foglio di spessore photoresist negativo di laminato con lo spessore desiderato sullo strato sacrificale con rullo a mano (Figura 2A(iii))
- Cinque minuti dopo la laminazione, posizionare la cialda su un aligner maschera per esposizione ai raggi UV. Impostare un photomask con il modello desiderato il fotoresist foglio ed esporre con luce UV per una durata di tempo appropriato. Il tempo di esposizione è determinato dallo spessore di photoresist e l'intensità della luce UV. Successivamente, inserire la cialda su un piatto caldo per una post-esposizione di cuocere in forno a 60 ° C per 5 minuti, seguito da cottura a 90 ° C per 10 min (Figura 2A(iv))
- Sviluppare un photoresist negativo immergendo la cialda in propilene glicole monometil etere acetato (PGMEA) fino a quando l'area non esposta è completamente sciolto (circa 20 min) (Figura 2A(v)).
- Sciogliere lo strato sacrificale utilizzando IPA per la pulizia ad ultrasuoni per sollevare la microstruttura. Una volta che la microstruttura è sbucciata fuori da wafer, sciacquare con acqua DI pulizia ad ultrasuoni per 10 min (Figura 2A(vi)).
- Immergere lo stampo in 30 µ l del polimero MPC per 30 min a temperatura ambiente (circa 20 ° C) per asciugarlo completamente. Figura 2B Mostra lo stampo fabbricato prisma.
- Fabbricazione di uno stampo cilindro
- Realizzare uno stampo cilindro d'acciaio con dimensione desiderata da un processo di lavorazione. In alternativa, utilizzare commercialmente disponibili in acciaio inox. (In questo studio, un cilindro di 600 µm φ è usato.)
- Immergere l'acciaio cilindro in 30 µ l del polimero MPC per 30 min a temperatura ambiente (circa 20 ° C) per asciugarlo completamente.
- Preparare il liquido polidimetilsilossano (PDMS) mescolando base resina e il catalizzatore (Vedi Tabella materiali) in un rapporto di 10:1 seguito da degasaggio con un vuoto degasaggio sistema per 20 min. Poi versare il PDMS in una piastra a 12 pozzetti.
- Impostare il cilindro d'acciaio perpendicolare alla superficie di riferimento e fissa su una z-fase lineare così che può essere inserito perpendicolarmente sulla superficie di PDMS non polimerizzato in un 12-pozzo-targhetta posizionata sulla stessa superficie datum spostando il z-stage. Incubare il PDMS con l'acciaio del cilindro in un forno per 20 min a 90 ° C per la polimerizzazione. Tagliare il PDMS per formare una superficie di fianco, in modo che la pipetta può essere inserita nel seguente processo (Figura 2).
3. controllo della forma di cluster iniziale delle cellule in un idrogel
- Iniettare un ECM appropriato per la cultura di cella desiderata, come il collagene e artificiale della membrana dello scantinato, il HGC per riempire lo spazio di cultura (Figura 3A).
- Impostare il micromold fabbricato sull'HGC direttamente o indirettamente con un supporto adeguato, come mostrato nella Figura 3B. Successivamente, posizionare il HGC in incubatore a CO2 per 25 min a 37 ° C per curarlo.
- Sollevare delicatamente il micromold modo che l'ECM non si deteriora (Figura 3). La tasca, come la forma di stampo desiderato, sarà fabbricata in ECM.
- Raccogliere le cellule dal piatto colta di tripsina-EDTA o il suo equivalente a seconda dei tipi di cella. Successivamente, centrifugare le cellule per ottenere cellule altamente concentrate (per cultura NHBE, applicare 0,25% tripsina-EDTA e incubare le cellule per 3 min, quindi neutralizzare con FBS-contenente medio e centrifugazione a 300 x g per 4 minuti).
- Dopo centrifugazione, rimuovere il surnatante medium per condensare le cellule e iniettare le cellule altamente concentrate (3,0 × 104 cellule / µ l per le cellule NHBE) nella tasca in ECM (Figura 3D).
- Incubare il HGC con cellule in incubatore a CO2 per 20 min a 37 ° C affinché le cellule cadono nella tasca ECM per riempire lo spazio creato dal micromolds. Se sono presenti sulla superficie superiore medio eccessivo o cellule, rimuovere con cautela usando una pipetta.
- Posizionare il HGC su una piastra a 24 pozzetti e aggiungere 100 µ l di terreno appropriato (Figura 3E). Per le celle NHBE, utilizzare una miscela di 1:1 di mezzo disponibile nel commercio specializzato per NHBE e cellule endoteliali (Vedi Tabella materiali).
- Iniettare ulteriori ECM per chiudere la tasca in ECM e poi incubare a 37 ° C per 25 min.
- Raffreddare preriscaldato agarosio al 1.5% a temperatura ambiente (circa 20 ° C). Goccia circa 10 µ l di agarosio sulla superficie superiore dell'HGC per chiudere la superficie e impedire la caduta fuori il HGC durante imaging (Figura 3F) e coltura di ECM. Quindi, incubare la HGC per un altro 20 min a 37 ° C per curare l'agarosio.
- Aggiungere il terreno per coprire l'intero HGC in modo che la pressione osmotica può contribuire a fornire la nutrizione per le cellule dentro il HGC.
4. multi-direzionale imaging
- Riconoscimento di forme 3D non invasiva tramite osservazione multi-direzionale
- Posizionare la piastra di coltura o ben piastra contenente il HGC su un microscopio e orientare il HGC al telaio della macchina fotografica. Quindi, ottenere un'immagine di esempio di contrasto di fase o campo luminoso.
- Pick up e ruotare il HGC per posare una superficie diversa.
- Ripetere i passaggi 4.1.1 e 4.1.2 immagini da tutti i sei lati sono ottenuti.
- Formazione immagine di immuno-fluorescenza di osservazione multi-direzionale
- Per il fissaggio, applicare paraformaldeide al 4% al campione sopra HGC a temperatura ambiente (circa 20 ° C) per 20 min, seguito da due risciacqui di PBS per 10 minuti ciascuno.
- Permeabilize le HGC con PBS contenente 0.5% Triton X-100 per 10 min a 4 ° C, poi lavare 3x per 10 min con PBS.
- Incubare il HGC con 10% siero di capra nel tampone IF (0,2% Triton X-100, 0,1% di albumina di siero bovino e 0.05% Tween-20 in PBS) per 60 min a temperatura ambiente per un passaggio di blocco primario.
- Per la colorazione di una molecola specifica, utilizzare l'anticorpo appropriato. Per osservare la geometria della cella collettiva, Alexa Fluor 488 falloidina può essere utilizzato per colorare l'actina.
- Posizionare il HGC su un piatto fondo di vetro sotto un microscopio laser o fluorescenti ed eseguire la scansione da sei lati per ottenere l'immagine dell'intero campione.
Risultati
Cellule (NHBE) di epiteliali bronchiali umane normali sono state utilizzate per dimostrare la metodologia illustrata e controllare la geometria iniziale delle cellule collettiva per ottenere la forma di un cilindro e una forma di prisma, rispettivamente in un ambiente di ECM. Vengono presentati i risultati di imaging multi-direzionali ottenuti dal contrasto di fase, nonché falloidina macchiatura della forma di un cilindro (fig. 4AB) e la forma di prisma (Figura 4D). Le cellule sono allineate in modo adeguato per ottenere la forma desiderata 3D in ambito ECM. Successivamente, le cellule sono state coltivate per quattro giorni formare una forma specifica e quindi sono state analizzate da imaging multi-direzionale. La dimensione del grande campione lo rende abbastanza difficile da catturare l'immagine di intero tessuto da una direzione; Tuttavia, l'HGC permesso la formazione immagine fino a sei lati, rivelando la forma di intero tessuto. La figura 5 Mostra i risultati di immunostaining dell'albero bronchiale sviluppata dalle cellule del NHBE. Le cellule NHBE inizialmente sono state controllate a forma cilindrica nel HGC. Quindi, la maggior parte dei rami erano diretto perpendicolarmente all'asse cilindrico.

Figura 1: processo di fabbricazione del dispositivo ibrido gel cubo. (A) la struttura cubica in policarbonato è impostata su un contenitore di ghiaccio preraffreddato. (B) agarosio (1,5%) viene iniettato per coprire la superficie inferiore. (C), il cubo è scivolata per essere raccolti. (D), il cubo viene ruotata per rendere un'altra superficie verso il basso. (E) agarosio (1,5%) viene iniettato per formare un altro muro di agarosio. (F) dopo un muro dell'agarosi è prodotto per tre facce, agarosio viene iniettato attraverso un viso aperto. Barra della scala: 5 mm. per favore clicca qui per visualizzare una versione più grande di questa figura.
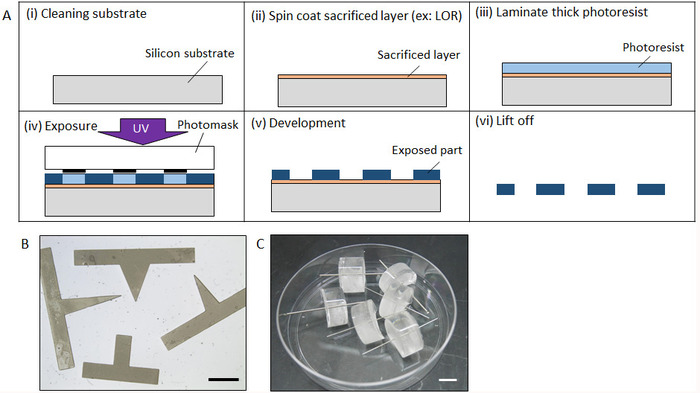
Figura 2: processo di fabbricazione di micromolds. (A) fabbricazione processo di un micromold di fotolitografia. (B) compilare il modulo di un prisma fabbricato forma micromold di fotolitografia. (C) fabbricato micromold con acciaio cilindro. Barra della scala: (B), 2 mm, (C) mm. 10 fare clic qui per visualizzare una versione più grande di questa figura.

Figura 3: processo di fabbricazione di controllo cluster iniziale delle cellule. (A) ECM (ad es., collagene e Matrigel) viene iniettato il HGC. (B) la micromold è impostata sul telaio cubico con o senza un supporto. (C) dopo l'ECM è guarito, il micromold è stato rimosso. (D) dopo centrifugazione, altamente dense cellule iniettate e incubate. Medium (E) viene applicato. (F) ulteriori ECM seguita da agarosio sono iniettati per coprire la superficie superiore dell'HGC. Barra della scala: 5 mm. per favore clicca qui per visualizzare una versione più grande di questa figura.
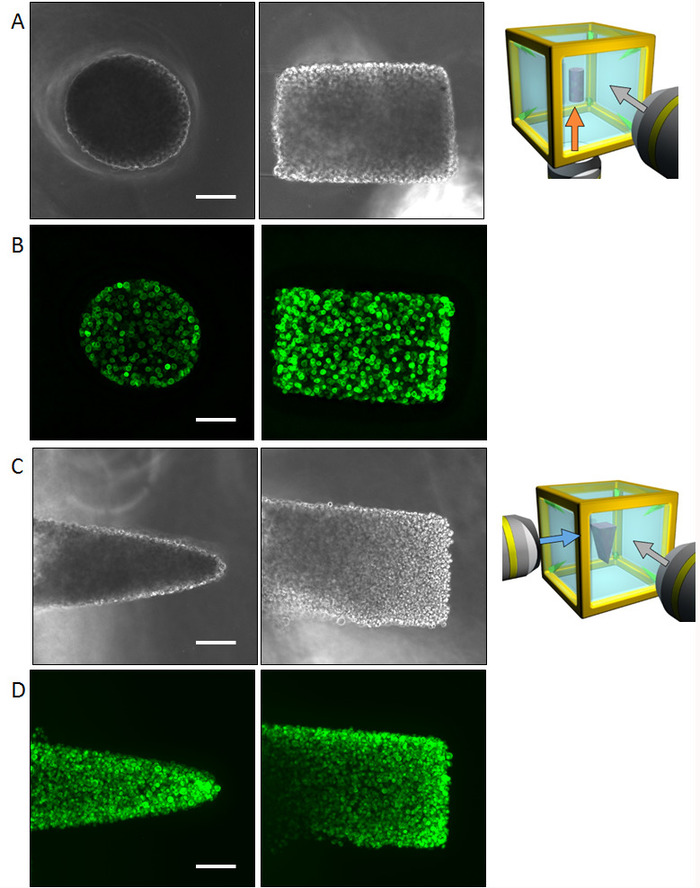
Figura 4: risultati di cellula iniziale di controllo con le cellule NHBE. (A) immagini di contrasto di fase delle cellule NHBE cilindricamente controllate prese per la superficie inferiore e laterale. L'intera forma potrebbe essere riconosciuta tramite l'osservazione multi-direzionale senza la necessità di formazione immagine di fluorescenza. (B) immagini di fluorescenza delle cellule NHBE cilindricamente controllate macchiatura F-actina. (C) immagini di contrasto di fase della NHBE cellule sottoposte a forma di prisma triangolare catturata dalle superfici inferiore e laterale. (D) immagini di fluorescenza delle cellule NHBE controllate a forma di prisma triangolare. Barra della scala: 100 µm. 10 x lente di ingrandimento (apertura numerica 0,3) è stato utilizzato. Clicca qui per visualizzare una versione più grande di questa figura.
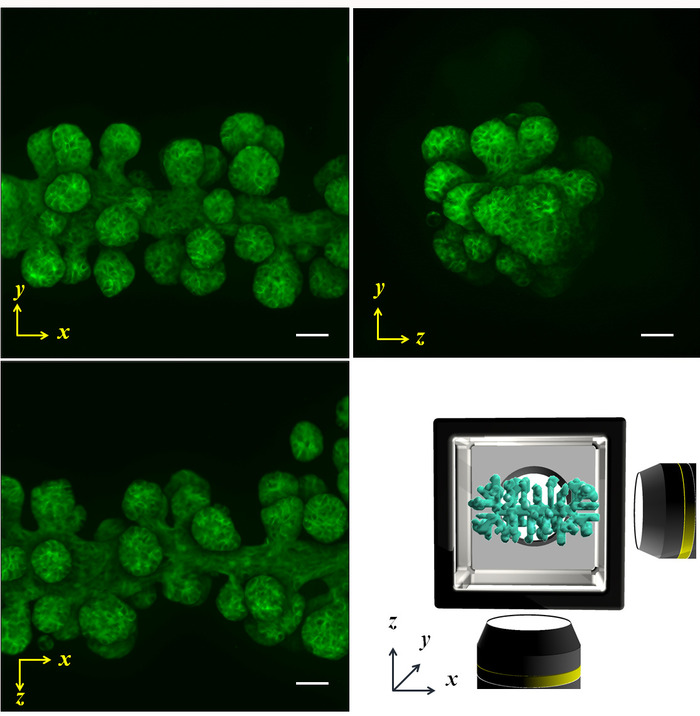
Figura 5: proiettato fluorescente immagini catturate dalla scansione multi-direzionale. Le cellule NHBE erano inizialmente controllate per produrre una forma cilindrica e coltivate nel HGC per 4 giorni. Successivamente, l'actina era macchiata di falloidina. I rami sono stati allungati dal cilindro iniziale lungo l'asse x, e la lunghezza, dimensione e l'angolo dall'asse ugualmente sono stati sviluppati. Immagine di destra inferiore mostra lo schema dell'asse x-y-z e la forma del campione. Barra della scala: 100 µm. È stato utilizzato un 10x lente di ingrandimento (0,3 apertura numerica). Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
Il metodo presentato in questa carta è semplice e può essere eseguito senza attrezzature ad alta tecnologia. Contemporaneamente, un risultato di controllo cella precisa forma cluster nello spazio 3D di idrogel è ottenibile. Dopo il controllo iniziale, le cellule possono crescere nel HGC tanto quanto sono coltivate su un piatto. L'imaging multi-direzionale viene eseguita ruotando il campione con l'HGC utilizzando qualsiasi sistema di microscopia, e migliora significativamente la qualità delle immagini. La scelta dei materiali per il telaio HGC e micromold è flessibile, purché essi siano biocompatibili. Una stampante 3D può essere usata per produrre il HGC frame o micromold se la precisione della stampante 3D è sufficiente per le loro applicazioni. Il metodo proposto è compatibile con molti immagine tecnologie quali i sistemi trasparenza reagenti20,21 e luce-foglio microscopia di rafforzamento. Utilizzando queste tecnologie, può essere migliorata la qualità dell'immagine.
Il volume del agarosio, ECM e cellule molto dense da iniettare dipende dalla dimensione HGC e muffa. È necessaria un'attenta operazione manuale che non iniettare bolle d'aria, altrimenti le bolle formate si deteriorano la precisione del controllo, la crescita delle cellule e la qualità delle immagini.
Il processo di fabbricazione della micromolds sarà determinato dalla forma desiderata al controllo. Fotolitografia consente la fabbricazione di forme precise 2D con una certa profondità, ad esempio una forma di prisma dell'ordine di micrometri; Tuttavia, non è efficace con forme 3D, ad esempio un cilindro. Il processo di lavorazione permette di fabbricare la forma 3D, ma in generale, la precisione dimensionale è inferiore di fotolitografia. Dopo la realizzazione della micromolds, rivestimento del polimero fosforilcolina (MPC) 2-methacryloyloxyethyl sugli stampi per impedire l'adesione su ECM è necessaria.
Approfittando di un HGC, formazione immagine microscopica con o senza esposizione laser può essere eseguita in più direzioni. Una forma 3D campione può essere riconosciuta circa di osservazione multi-direzionale senza contrassegno fluorescente; Questo metodo non causa alcuna invasività delle cellule durante l'osservazione. Al contrario, formazione immagine fluorescente è richiesta per ottenere una più accurata campione 3D forma ed espressione molecolare.
Il vincolo del metodo presentato per controllo cella iniziale è che non può essere applicato a uno stampo con una forma 3D complessa. Lo stampo deve essere rimossa sollevando senza deteriorarsi ECM. Così, lo stampo è limitato a una semplice forma diritta o conica. Per ottenere più complesso controllo shape, ulteriore sviluppo del protocollo è necessaria.
La metodologia proposta è larghissimo e può essere condotta facilmente nella maggior parte degli ambienti di laboratorio. Questa procedura semplice può superare i limiti della cultura 3D, imaging e ripetibilità e contribuire all'ulteriore sviluppo richiesto per cultura 3D.
Divulgazioni
Gli autori e l'Università di Osaka Prefecture e Kyushu Institute of Technology hanno presentato una domanda di brevetto per un dispositivo ibrido gel cubo e Nippon medica e chimica Instruments Co. Ltd, Giappone ha recentemente commercializzato il cubo. L'azienda non ha colpito uno di progettazione, processo e metodi descritti.
Riconoscimenti
Quest'opera è stata sostenuta finanziariamente dalla JSPS KAKENHI (18h 04765) e il programma per diffondere Tenure Track System, MEXT, Giappone.
Materiali
| Name | Company | Catalog Number | Comments |
| 12-well-plate | Corning Inc. | 3513 | |
| 2-Methoxy-1-methylethyl Acetate | FUJIFILM Wako Pure Chemical Co. | 130-10505 | PGMEA, CAS: 108-65-6 |
| 4% paraformaldehyde | FUJIFILM Wako Pure Chemical Co. | 161-20141 | CAS: 30525-89-4 |
| Agarose, low gelling temperature BioReagent | Sigma-Aldrich | A9414 | |
| Alexa fluor 488 phalloidin | Thermo Fisher Scientific | A12379 | |
| AZ1512 | Merck | ||
| BEGM bullet kit | Lonza | CC-3170 | Specialized medium for NHBE cells |
| Bovine Serum Albumin solution (10 %) | Sigma-Aldrich | A1595 | |
| EGM-2 bullet kit | Lonza | CC-3162 | Specialized medium for endothelial cells |
| Lipidure | NOF co. | MPC polymer | |
| Matrigel growth factor reduced basement membrane matrix | Corning Inc. | 354230 | |
| Normal Goat Serum (10%) | Thermo Fisher Scientific | 50197Z | |
| Normal human bronchial epithelial cells | Lonza | CC-2541 | |
| SILPOT 184 W/C | Dow Corning Co. | 3255981 | Base resin and catalyst for PDMS |
| SUEX D300 | DJ MicroLaminates, Inc | Thick negative photoresist (thichness: 300 mm) | |
| Triton X-100 (1%) | Thermo Fisher Scientific | HFH10 | |
| Trypsin-EDTA (0.25%) | Thermo Fisher Scientific | 25200056 | |
| TWEEN 20 | Sigma-Aldrich | P9416 |
Riferimenti
- Baker, B. M., Chen, C. S. Deconstructing the third dimension - how 3D culture microenvironments alter cellular cues. Journal of Cell Science. 125 (13), 3015-3024 (2012).
- Sasai, Y. Cytosystems dynamics in self-organization of tissue architecture. Nature. 493 (7432), 318-326 (2013).
- Shamir, E. R., Ewald, A. J. Three-dimensional organotypic culture: Experimental models of mammalian biology and disease. Nature Reviews Molecular Cell Biology. 15 (10), 647-664 (2014).
- Frantz, C., Stewart, K. M., Weaver, V. M. The extracellular matrix at a glance. Journal of Cell Science. 123 (24), 4195-4200 (2010).
- Choquet, D., Felsenfeld, D. P., Sheetz, M. P. Extracellular matrix rigidity causes strengthening of integrin- cytoskeleton linkages. Cell. 88 (1), 39-48 (1997).
- Hannezo, E., Prost, J., Joanny, J. -. F. Theory of epithelial sheet morphology in three dimensions. Proceedings of the National Academy of Sciences of the United States of America. 111 (1), 27-32 (2014).
- Tawk, M., et al. A mirror-symmetric cell division that orchestrates neuroepithelial morphogenesis. Nature. 446 (7137), 797-800 (2007).
- Eiraku, M., et al. Self-organizing optic-cup morphogenesis in three-dimensional culture. Nature. 472 (7341), 51-58 (2011).
- Zegers, M. M. P., O’Brien, L. E., Yu, W., Datta, A., Mostov, K. E. Epithelial polarity and tubulogenesis in vitro. Trends in Cell Biology. 13 (4), 169-176 (2003).
- Affolter, M., Bellusci, S., Itoh, N., Shilo, B., Thiery, J. P., Werb, Z. Tube or not tube: Remodeling epithelial tissues by branching morphogenesis. Developmental Cell. 4 (1), 11-18 (2003).
- Denk, W., Strickler, J., Webb, W. Two-photon laser scanning fluorescence microscopy. Science. 248 (4951), 73-76 (1990).
- Huisken, J., et al. Optical Sectioning Deep Inside Live Embryos by Selective Plane Illumination Microscopy. Science. , 1007-1009 (2004).
- Hagiwara, M., Kawahara, T., Nobata, R. Tissue in Cube: In Vitro 3D Culturing Platform with Hybrid Gel Cubes for Multidirectional Observations. Advanced Healthcare Materials. 5 (13), 1566-1571 (2016).
- Hagiwara, M., Nobata, R., Kawahara, T. Large Scale Imaging by Fine Spatial Alignment of Multi-Scanning Data with Gel Cube Device. Applied Sciences. 8 (235), (2018).
- Kolesky, D. B., Homan, K. A., Skylar-Scott, M. A., Lewis, J. A. Three-dimensional bioprinting of thick vascularized tissues. Proceedings of the National Academy of Sciences of the United States of America. 113 (12), 3179-3184 (2016).
- Mironov, V., Visconti, R. P., Kasyanov, V., Forgacs, G., Drake, C. J., Markwald, R. R. Organ printing: Tissue spheroids as building blocks. Biomaterials. 30 (12), 2164-2174 (2009).
- Onoe, H., et al. Metre-long cell-laden microfibres exhibit tissue morphologies and functions. Nature Materials. 12 (6), 584-590 (2013).
- Miller, J. S., et al. Rapid casting of patterned vascular networks for perfusable engineered three-dimensional tissues. Nature Materials. 11 (9), 768-774 (2012).
- Hagiwara, M., Nobata, R., Kawahara, T. High repeatability from 3D experimental platform for quantitative analysis of cellular branch pattern formations. Integrative Biology. 10, 306-312 (2018).
- Tainaka, K., et al. Whole-body imaging with single-cell resolution by tissue decolorization. Cell. 159 (4), 911-924 (2014).
- Murray, E., et al. Scalable Proteomic Imaging for High-Dimensional Profiling of Intact Systems. Cell. 163 (6), 1500-1514 (2015).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon