Method Article
用于可重复模式形成的混合凝胶立方体器件中的初始三维单元群集控制
摘要
我们提出了一个控制三维细胞外基质中初始细胞簇形状的过程, 以获得可重复的模式形成。采用含有两种不同水凝胶的立方装置, 实现组织形态形成的多向成像。
摘要
体外3D 培养在细胞组织培养中的重要性得到了很大的强调。然而, 缺乏实验重复性是其限制之一。产生少量可重复的模式形成结果会破坏对自组织机制的分析。减少初始培养条件的变化, 如细胞密度和细胞外基质 (ECM) 中的分布, 对于提高3D 培养的可重复性至关重要。在本文中, 我们演示了一个简单而可靠的过程, 用于控制三维细胞外基质中的初始细胞簇形状, 以获得高度可重复的模式形成。利用光刻技术或加工工艺制备了一种具有所需形状的微极本, 并在混合凝胶立方体 (HGC) 中的 Ecm 中形成了三维口袋。然后将高浓度的细胞注入口袋, 使细胞簇形状与制造的模具形状相匹配。所使用的 HGC 通过旋转实现了多方向扫描, 即使使用了低放大透镜, 也实现了高分辨率成像和整个组织结构的捕获。采用正常人支气管上皮细胞对该方法进行了验证。
引言
3d 培养比2d 培养更能模仿生物环境, 在细胞组织培养1,2,3中得到了很大的强调。细胞与细胞外基质 (ecm) 之间的相互作用为形态发生 4、5 提供了重要线索。许多组织形成只能在三维环境下出现, 如折叠过程6,7, 侵入 8, 和管状形成 9,10。然而, 许多困难使研究人员无法从盘子上的2D 实验转向三维实验。3D 实验的主要困难之一是3D 样品的成像问题。与平面实验相比, 在许多情况下, 获取合适的3D 图像仍然具有挑战性。特别是, 当样品尺寸达到毫米范围时, 由于低放大倍率镜头的焦距较大, 获得合适的3D 图像是一项艰巨的任务。例如, 当使用10倍放大镜时, 焦距超过 50μm, 而单个单元的大小通常小于10μm。为了提高成像质量, 正在开发高技术显微镜系统 (例如双光子显微镜11和光片显微镜系统12), 但由于价格昂贵, 这些系统的供应有限。作为替代方案, 我们以前开发过混合凝胶立方体 (HGC) 设备13。该装置由两种类型的水凝胶组成: 琼脂糖作为支撑凝胶和 ECM, 如胶原蛋白或 Matrigel 作为培养凝胶。HGC 允许我们在培养和旋转立方体的过程中收集样本, 以实现多向成像, 从而解决焦距问题14。
3D 实验的另一个困难是由于3D 环境的可控性较差, 因此其可重复性较低。与塑料盘上的平面培养不同, 初始培养条件的变化很容易发生在被软材料包围的3D 空间中。实验结果的一个显著变化会恶化以下分析, 并掩盖潜在的机制。许多工程技术已经开发出来, 空间对齐单个细胞, 如生物印迹15,16,纤维编织17, 脚手架 18, 但它们需要复杂的预处理或专门设计的设备。相反, 我们开发了一种方法来实现 HGC19中的3d 细胞对齐。
在该协议中, 我们用常用的设备说明了一个简单的过程, 用于控制 HGC 中的三维初始细胞簇形状。首先, 对 HGC 的制造工艺进行了论证。然后, 在 HGC 中放置用光刻或加工工艺制作的微型光片, 以生产 ECM 中任意形状的口袋。随后, 离心后将高密度细胞注入口袋, 以控制 HGC 中的初始细胞簇形状。由于 HGC 的存在, 精确控制的细胞群可以从多个方向进行成像。正常的人支气管上皮细胞 (NHBE) 被用来证明控制最初的细胞簇形状和从多个方向的分支成像, 以提高成像质量。
研究方案
1. 混合凝胶立方体装置的制作
- 通过使用加工工艺或3D 打印机准备聚碳酸酯 (PC) 立方帧。PC 机架的大小取决于样本大小。在这项研究中, 我们在每一侧使用了一个5毫米的框架, 以便树枝在培养过程中有足够的空间拉长。
- 将 PC 机架放置在预冷玻璃滑块或另一个光滑表面的冰盒 (和 lt;0 °c) 中 (图 1a)。
- 用移液器将预热的1.5% 琼脂糖 (w v) 从立方框架的顶面添加到底部表面。抚摸移液器, 使琼脂糖扩散以形成一个平坦的表面 (图 1b)。
- 几分钟内, 琼脂糖就会痊愈。用推拿器将 PC 机架滑到玻璃滑梯边缘, 将其拾取。请注意, 由于琼脂糖与玻璃滑块之间的粘结力, 从玻璃滑块垂直拾取框架可能会导致琼脂糖从立方框架中分离 (图 1C)。
- 旋转立方框架, 使打开的脸朝下, 然后再次放置在玻璃滑梯上 (图 1d)。
- 重复步骤 1.3–1.5, 直到三个表面充满琼脂糖 (图 1e)。
- 要在第四和第五面形成琼脂糖墙, 就把琼脂糖从一个开放的脸上掉了下来 (图 1f)。一旦在第五面形成了琼脂糖墙, HGC 的准备工作就完成了。
2. 通过光刻或加工工艺制备微光
- 光刻技术制作
- 用丙酮、异丙醇 (IPA) 超声波清洗硅 (Si) 晶片, 然后每瓶蒸馏 5分钟 (DI) 水。氮气用氮气吹过硅晶片后, 在140°c 的烤箱中脱水 20分钟 (图 2a (i))。
- 自旋涂层, 如 LOR 和 Az, 在黄灯下使用自旋涂布器, 可抵抗硅晶片 (2, 000 转/分、30秒)。自旋涂层后, 立即在90°c 下加热热板上的晶圆 3分钟 (图 2a (ii))。所需的牺牲层厚度大于1微米, 因此可以轻松进行提升过程, 但不需要精确的厚度。
- 将晶片放在70°c 的热板上, 然后使用手辊在牺牲层上层压厚度为所需厚度的厚负光刻板 (图 2a (iii))
- 层压5分钟后, 将晶片放在面罩上, 进行紫外线照射。在板材上设置具有所需图案的光掩模, 以抵抗并暴露在适当的时间内使用紫外光。曝光时间由光刻胶的厚度和紫外光的强度决定。随后, 将晶圆放在热盘中, 以便在60°c 下进行曝光后烘烤 5分钟, 然后在90°c 下烘烤 10分钟 (图 2a (iv))
- 通过将晶圆浸入丙二醇单甲基醋酸酯 (PGMEA) 中, 直到未暴露的区域完全溶解 (约 20分钟), 开发负光刻胶 (图2a (v))。
- 使用 IPA 进行超声波清洗, 以解除牺牲层的微观结构, 从而溶解牺牲层。一旦微观结构从晶片上剥落, 用超声波清洗 di 水冲洗 10分钟 (图 2a (vi))。
- 将模具浸入30Μl 的 MPC 聚合物中, 在室温 (约 20°c) 下浸泡 30分钟, 使其完全干燥。图 2b显示了制造的棱镜模具。
- 圆筒模具的制造
- 通过加工工艺制造尺寸所需的钢瓶模具。或者, 使用市售不锈钢。(在本研究中, 使用了一个600μm 的圆柱体。
- 将气缸钢浸入30Μl 的 MPC 聚合物中, 在室温 (约 20°c) 下浸泡 30分钟, 使其完全干燥。
- 通过混合基础树脂及其催化剂 (见材料表) 以10x:1 的比例制备液体聚二甲基硅氧烷 (PDMS), 然后用真空脱气系统脱气20分钟。然后把 PDMS 倒在一个12井的盘子里。
- 将垂直于基准表面并固定到线性 z 级的钢瓶设置, 以便通过移动 z 级将其垂直插入未固化的 PDMS 表面中, 并将其放置在位于同一基准表面上的12孔板中。在90°c 条件下, 用圆筒钢在烤箱中加氢20分钟即可固化。剪切 PDMS 以形成侧面, 以便在以下过程中插入管道 (图 2c)。
3. 控制水凝胶中的初始细胞簇形状
- 为所需的细胞培养 (如胶原蛋白和人工基底膜) 注入适当的 ECM, 以填充培养空间 (图 3 a)。
- 使用适当的支架直接或间接地在 HGC 上设置制造的微数据, 如图3B 所示。随后, 将 HGC 放置在二氧化碳孵化器中 25分钟, 在37°c 下进行固化。
- 小心地提起微块, 使 ECM 不会恶化 (图 3C)。口袋, 作为所需的模具形状, 将在 ECM 中制造。
- 根据细胞类型, 通过胰蛋白酶-EDTA 或其等效的方法从培养的菜品中提取细胞。随后, 离心细胞以获得高浓度细胞 (对于 NHBE 培养, 应用0.25% 的胰蛋白酶 edta 和孵育细胞 3分钟, 然后用含有 fbs 的培养基中和, 以 300 x g 离心 4分钟).
- 离心后, 取出上清液培养基使细胞凝结, 并将高浓度细胞 (用于 NHBE 细胞的 3.0X10 4 细胞) 注入 ECM (图 3d) 的口袋.
- 在37°c 条件下, 用细胞在 co2孵化器中孵育 hgc 20分钟, 使细胞落入 ecm 口袋, 以填补微光产生的空间。如果顶部表面有过多的介质或细胞, 请使用移液器小心取出。
- 将 HGC 放在24孔板上, 并添加100μl 的适当介质 (图 3e)。对于 NHBE 细胞, 使用1:1 混合的商用专用培养基, 用于 NHBE 和内皮细胞 (见材料表)。
- 注入额外的 ECM 来关闭 ECM 中的口袋, 然后在37°c 下孵育25分钟。
- 将预热的1.5% 琼脂糖冷却至室温 (约 20°C)。将琼脂糖的约10μl 滴至 HGC 的顶部表面, 以关闭表面, 并防止 ECM 在培养和成像过程中从 HGC 中掉落 (图 3F)。然后, 在37°c 下再孵育 HGC 20分钟, 以治愈琼脂糖。
- 添加培养基覆盖整个 HGC, 以便渗透压力有助于为 HGC 内的细胞提供营养。
4. 多向成像
- 多方向观察的无创三维形状识别
- 将含有 HGC 的培养盘或井板放在显微镜上, 并将 HGC 定向到相机框架。然后, 通过明亮的场或相位对比度获得样本图像。
- 拾取并旋转 HGC, 以向下放置不同的表面。
- 重复步骤4.1.1 和 4.1.2, 直到获得来自所有六个侧面的图像。
- 多方向观测免疫荧光成像
- 对于固定, 在室温 (约 20°c) 下, 将4% 的甲醛涂在 HGC 上的样品上 20分钟, 然后用两洗 PBS 10分钟。
- 用含有 0.5% Triton X-100 的 PBS 对 HGC 进行渗透, 在4°c 下 10分钟, 然后用 PBS 清洗 3x 10分钟。
- 在室温下, 用10% 山羊血清在 If-bacin 中 (0.2% triton X-100、0.1% 的牛血清白蛋白和0.05% 的 Tween-20) 在室温下培养 HGC, 进行一次主要的阻滞步骤。
- 对于特定分子的染色, 请使用适当的抗体。为了观察集体细胞的几何形状, 亚历克莎·福陆488法洛伊丁可以用来染色肌动蛋白。
- 将 HGC 放在激光或荧光显微镜下的玻璃底盘上, 并从六面进行扫描以获得整个样品图像。
结果
利用正常的人支气管上皮细胞, 分别在 ECM 环境中, 演示了所说明的方法, 并控制了初始集体细胞的几何形状, 以实现圆柱形和棱镜形状。给出了圆筒形状 (图 4 a, b) 和棱镜形状 (图 4A, d) 的相位对比和 phalloidin 染色所获得的多方向成像结果。在 ECM 环境中, 这些单元格经过适当的对齐, 以生成所需的3D 形状。随后, 对细胞进行了四天的培养, 形成了特定的形状, 然后通过多向成像进行了分析。大样本量使得从一个方向捕获整个组织图像变得相当困难;然而, HGC 允许从六个侧面的成像, 揭示整个组织的形状。图 5显示了从 NHBE 细胞中发育出来的支气管树的免疫染色结果。NHBE 细胞最初在 HGC 中被控制为圆柱形。然后, 大部分的分支被定向垂直于圆柱形轴。

图 1: 混合凝胶立方体装置的制备工艺.(a) 聚碳酸酯立方框架设置在预冷冰盒上。(b) 琼脂糖 (1.5%)被注入到覆盖底部表面。(c) 将多维数据集滑动收集。(d) 立方体旋转, 使另一个表面向下。(e) 琼脂糖 (1.5%)被注射形成另一个琼脂糖墙。(f) 在为三个面生成琼脂糖墙之后, 琼脂糖通过一个开放的面注射。刻度栏: 5 毫米. 请点击这里查看此图的较大版本.
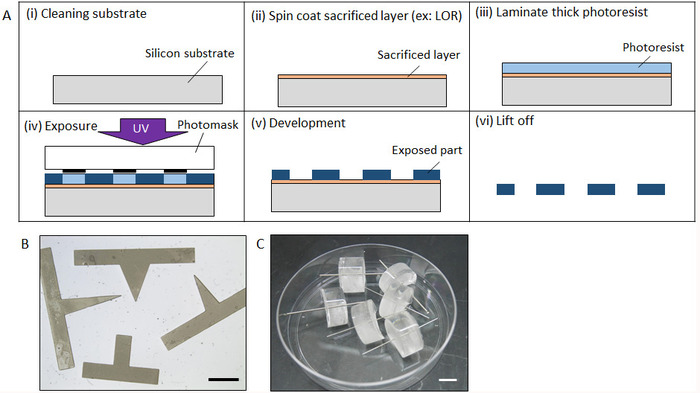
图 2: 微分的制备过程.(a) 光刻制备微极本的工艺。(b) 通过光刻制作的棱镜形状的完整形式。(c) 用圆柱钢制造的微型。刻度栏: (b) 2 毫米, (c) 10 毫米. 请点击这里查看这个数字的更大版本.

图 3: 初始细胞集群控制的制造过程.(a) ecm (例如, 胶原蛋白和 matrigel) 被注射到 hgc 中。(b) 微块设置在有或没有支架的立方框架上。(c) ecm 固化后, 将去除微块。(d) 离心后, 注入和培养高度致密的细胞。(e) 采用中等。(f) 额外的 ecm, 然后是琼脂糖, 被注射到覆盖 hgc 的顶部表面。刻度栏: 5 毫米. 请点击这里查看此图的较大版本.
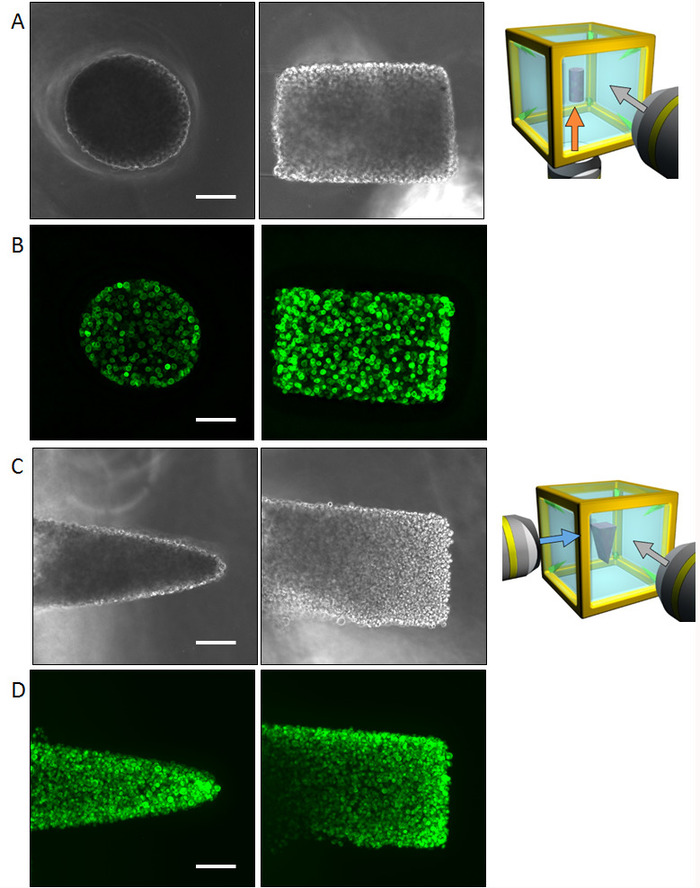
图 4: NHBE 细胞初始细胞控制的结果.(a) 为底部和侧面表面拍摄的圆柱形控制 nbe 细胞的相对比图像。通过多方向观察可以识别整个形状, 而不需要荧光成像。(b) 圆筒对照 NHBE 细胞的荧光图像染色 f-肌动蛋白。(c) 从底部和侧面拍摄的 NHBE 细胞的相对比图像, 控制在三角形棱镜形状中。(d) 以三角形棱镜形状控制的 NHBE 细胞的荧光图像。刻度杆: 100μm. 10倍放大镜 (0.3个数字光圈)。请点击这里查看此图的较大版本.
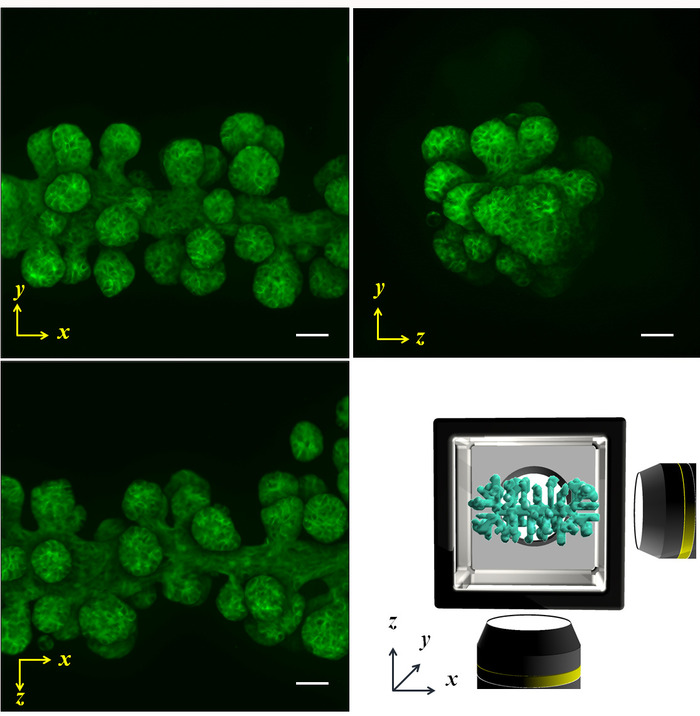
图 5: 通过多向扫描捕获的投影荧光图像.NHBE 细胞最初被控制产生一个圆柱形, 并在 HGC 培养4天。随后, 肌动蛋白被法洛伊丁染色。分枝沿 x 轴从初始圆筒拉长, 长度、大小和从轴的角度相等。右下角的图像显示 x-y- z轴和样品形状的示意图。刻度杆: 100μm。使用了10倍放大镜 (0.3个数字光圈)。请点击这里查看此图的较大版本.
讨论
本文提出的方法简单, 无需高科技设备即可实现。同时, 在水凝胶的三维空间中, 可以得到精确的细胞簇形状控制结果。在最初的控制之后, 细胞可以在 HGC 中生长, 就像它们在盘子上培养一样多。多向成像是通过使用任何显微镜系统将样品与 HGC 旋转来完成的, 它显著提高了成像质量。HGC 框架和微工具的材料选择是灵活的, 只要它们是生物相容性的。如果3D 打印机的精度足以满足其应用要求, 则可使用3D 打印机生成 HGC 帧或微型打印机。该方法与许多图像增强技术兼容, 如透明试剂20、21和光片显微镜系统。通过采用这些技术, 可以提高图像质量。
琼脂糖、ECM 和高密度细胞的注入量取决于 HGC 和模具尺寸。需要谨慎的手动操作, 不注入气泡, 否则形成的气泡会恶化控制的准确性, 细胞生长, 和成像质量。
微光的制造过程将由所需的形状来决定。光刻技术可以制造具有一定深度的精确二维形状, 例如按微米顺序的棱镜形状;但是, 它是无效的3D 形状, 如圆柱体。加工过程使我们能够制造3D 形状, 但一般来说, 尺寸精度低于光刻。在制备微光后, 需要在模具上涂覆 2-甲基丙烯酸甲氧基磷酰胆碱 (MPC) 聚合物, 以防止粘附在 ECM 上。
通过利用 HGC, 可以在多个方向上进行有或没有激光照射的显微成像。通过多方向观察可以近似识别三维样品形状, 而不需要荧光标记;这种方法在观察过程中不会导致任何细胞侵入。相反, 荧光成像是必要的, 以获得更准确的3D 样品形状和分子表达。
所提出的初始单元控制方法的约束是不能应用于具有复杂三维形状的模具。必须通过拾取而不恶化 ECM 来去除霉菌。因此, 模具仅限于一个简单的直或锥形。为了获得更复杂的形状控制, 需要进一步发展协议。
拟议的方法具有广泛的实用性, 可以很容易地在大多数实验室环境中进行。这个简单的过程可以克服3D 文化、成像和可重复性的限制, 并有助于3D 文化所需的进一步开发。
披露声明
作者与大阪府立大学和九州理工学院提交了混合凝胶立方装置的专利申请, 日本医药化工仪器有限公司最近将该立方体商业化。该公司没有影响所描述的任何设计、过程和方法。
致谢
这项工作得到了日本 JPS KAKENHI (18H04765) 和日本 MEXT 的传播保有权跟踪系统方案的财政支持。
材料
| Name | Company | Catalog Number | Comments |
| 12-well-plate | Corning Inc. | 3513 | |
| 2-Methoxy-1-methylethyl Acetate | FUJIFILM Wako Pure Chemical Co. | 130-10505 | PGMEA, CAS: 108-65-6 |
| 4% paraformaldehyde | FUJIFILM Wako Pure Chemical Co. | 161-20141 | CAS: 30525-89-4 |
| Agarose, low gelling temperature BioReagent | Sigma-Aldrich | A9414 | |
| Alexa fluor 488 phalloidin | Thermo Fisher Scientific | A12379 | |
| AZ1512 | Merck | ||
| BEGM bullet kit | Lonza | CC-3170 | Specialized medium for NHBE cells |
| Bovine Serum Albumin solution (10 %) | Sigma-Aldrich | A1595 | |
| EGM-2 bullet kit | Lonza | CC-3162 | Specialized medium for endothelial cells |
| Lipidure | NOF co. | MPC polymer | |
| Matrigel growth factor reduced basement membrane matrix | Corning Inc. | 354230 | |
| Normal Goat Serum (10%) | Thermo Fisher Scientific | 50197Z | |
| Normal human bronchial epithelial cells | Lonza | CC-2541 | |
| SILPOT 184 W/C | Dow Corning Co. | 3255981 | Base resin and catalyst for PDMS |
| SUEX D300 | DJ MicroLaminates, Inc | Thick negative photoresist (thichness: 300 mm) | |
| Triton X-100 (1%) | Thermo Fisher Scientific | HFH10 | |
| Trypsin-EDTA (0.25%) | Thermo Fisher Scientific | 25200056 | |
| TWEEN 20 | Sigma-Aldrich | P9416 |
参考文献
- Baker, B. M., Chen, C. S. Deconstructing the third dimension - how 3D culture microenvironments alter cellular cues. Journal of Cell Science. 125 (13), 3015-3024 (2012).
- Sasai, Y. Cytosystems dynamics in self-organization of tissue architecture. Nature. 493 (7432), 318-326 (2013).
- Shamir, E. R., Ewald, A. J. Three-dimensional organotypic culture: Experimental models of mammalian biology and disease. Nature Reviews Molecular Cell Biology. 15 (10), 647-664 (2014).
- Frantz, C., Stewart, K. M., Weaver, V. M. The extracellular matrix at a glance. Journal of Cell Science. 123 (24), 4195-4200 (2010).
- Choquet, D., Felsenfeld, D. P., Sheetz, M. P. Extracellular matrix rigidity causes strengthening of integrin- cytoskeleton linkages. Cell. 88 (1), 39-48 (1997).
- Hannezo, E., Prost, J., Joanny, J. -F. Theory of epithelial sheet morphology in three dimensions. Proceedings of the National Academy of Sciences of the United States of America. 111 (1), 27-32 (2014).
- Tawk, M., et al. A mirror-symmetric cell division that orchestrates neuroepithelial morphogenesis. Nature. 446 (7137), 797-800 (2007).
- Eiraku, M., et al. Self-organizing optic-cup morphogenesis in three-dimensional culture. Nature. 472 (7341), 51-58 (2011).
- Zegers, M. M. P., O’Brien, L. E., Yu, W., Datta, A., Mostov, K. E. Epithelial polarity and tubulogenesis in vitro. Trends in Cell Biology. 13 (4), 169-176 (2003).
- Affolter, M., Bellusci, S., Itoh, N., Shilo, B., Thiery, J. P., Werb, Z. Tube or not tube: Remodeling epithelial tissues by branching morphogenesis. Developmental Cell. 4 (1), 11-18 (2003).
- Denk, W., Strickler, J., Webb, W. Two-photon laser scanning fluorescence microscopy. Science. 248 (4951), 73-76 (1990).
- Huisken, J., et al. Optical Sectioning Deep Inside Live Embryos by Selective Plane Illumination Microscopy. Science. , 1007-1009 (2004).
- Hagiwara, M., Kawahara, T., Nobata, R. Tissue in Cube: In Vitro 3D Culturing Platform with Hybrid Gel Cubes for Multidirectional Observations. Advanced Healthcare Materials. 5 (13), 1566-1571 (2016).
- Hagiwara, M., Nobata, R., Kawahara, T. Large Scale Imaging by Fine Spatial Alignment of Multi-Scanning Data with Gel Cube Device. Applied Sciences. 8 (235), (2018).
- Kolesky, D. B., Homan, K. A., Skylar-Scott, M. A., Lewis, J. A. Three-dimensional bioprinting of thick vascularized tissues. Proceedings of the National Academy of Sciences of the United States of America. 113 (12), 3179-3184 (2016).
- Mironov, V., Visconti, R. P., Kasyanov, V., Forgacs, G., Drake, C. J., Markwald, R. R. Organ printing: Tissue spheroids as building blocks. Biomaterials. 30 (12), 2164-2174 (2009).
- Onoe, H., et al. Metre-long cell-laden microfibres exhibit tissue morphologies and functions. Nature Materials. 12 (6), 584-590 (2013).
- Miller, J. S., et al. Rapid casting of patterned vascular networks for perfusable engineered three-dimensional tissues. Nature Materials. 11 (9), 768-774 (2012).
- Hagiwara, M., Nobata, R., Kawahara, T. High repeatability from 3D experimental platform for quantitative analysis of cellular branch pattern formations. Integrative Biology. 10, 306-312 (2018).
- Tainaka, K., et al. Whole-body imaging with single-cell resolution by tissue decolorization. Cell. 159 (4), 911-924 (2014).
- Murray, E., et al. Scalable Proteomic Imaging for High-Dimensional Profiling of Intact Systems. Cell. 163 (6), 1500-1514 (2015).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。