Method Article
Celular 3D inicial grupo Control en un dispositivo híbrido Gel cubo para formaciones de patrón repetible
En este artículo
Resumen
Presentamos un procedimiento para el control de la forma de racimo de célula inicial en una matriz extracelular 3D para obtener una formación de patrón repetible. Un dispositivo cúbico que contiene dos diferentes hidrogeles se emplea para lograr la proyección de imagen multi-direccional para la formación de patrones de tejido.
Resumen
La importancia de cultivos in vitro de 3D se acentúa considerablemente en cultura de célula y tejidos. Sin embargo, la falta de repetibilidad experimental es una de las restricciones. Produciendo pocos resultados repetibles de formación, deteriora el análisis de los mecanismos subyacentes a la propia organización. Reducción de la variación en las condiciones de cultivo inicial, como la densidad de la célula y la distribución en la matriz extracelular (ECM), es crucial para mejorar la repetibilidad de una cultura 3D. En este artículo, se demuestra un procedimiento sencillo pero robusto para el control de la forma de racimo de célula inicial en una matriz extracelular 3D para obtener las formaciones patrón altamente repetible. Micromold con forma deseada fue fabricado utilizando Fotolitografía o un proceso de mecanizado, y formó un bolsillo 3D en el ECM contenido en un cubo de gel híbrido (HGC). Células altamente concentradas entonces se inyectaron en el bolsillo de manera que la forma de racimo de células con la forma del molde fabricado. La HGC empleada permitió multidireccional de su rotación, lo que permitió la proyección de imagen de alta resolución y la captura de la estructura de tejido entero aunque se utilizó una lente de baja magnificación. Células epiteliales bronquiales humanas normales fueron utilizadas para demostrar la metodología.
Introducción
La importancia de una cultura 3D, que mejor simula entornos biológicos que hace una cultura 2D, se acentúa considerablemente en el tejido de la célula cultura1,2,3. La interacción entre las células y matriz extracelular (ECM) proporciona pistas importantes sobre morfogénesis4,5. Muchas formaciones de tejido pueden surgir sólo en entornos 3D, como el plegamiento proceso6,7, invaginación8formación tubular9,10. Sin embargo, numerosas dificultades que los investigadores pasando a 3D experimentos de experimentos 2D en un plato. Una de las mayores dificultades en experimentos 3D es el tema de la proyección de imagen 3D muestras. Comparado con experimentos planares, adquisición de imágenes 3D adecuados es aún un desafío en muchos casos. En particular, obtener una imagen 3D adecuada es una tarea difícil cuando el tamaño de la muestra alcanza el rango de milímetros debido a la gran profundidad focal de lentes de bajo aumento. Por ejemplo, la profundidad focal alcanza más de 50 μm cuando 10 x lente de aumento se utiliza mientras que el tamaño de la célula es normalmente menos de 10 μm. Para mejorar la calidad de imagen, se están desarrollando sistemas de microscopía de alta tecnología (por ejemplo, microscopía de dos fotones11 y microscopía de luz hoja sistema12), pero su disponibilidad es limitada debido a su costoso precio. Como alternativa, previamente hemos desarrollado un híbrido gel cubo (HGC) dispositivo13. El dispositivo consta de dos tipos de hidrogeles: agarosa como un gel de soporte y un ECM como colágeno o Matrigel como un gel de cultura. La HGC nos permite recoger la muestra durante el cultivo y girar el cubo para lograr la proyección de imagen multi-direccional, que aborda el problema de profundidad focal14.
Otra dificultad en experimentos 3D es su repetibilidad baja debido a la pobre controlabilidad de los entornos 3D. A diferencia de una cultura planar en un plato de plástico, las variaciones en las condiciones de cultivo inicial se producen fácilmente en un espacio 3D rodeado por un material suave. Una variación significativa en los resultados experimentales deteriora el siguiente análisis y enmascara los mecanismos subyacentes. Se han desarrollado muchas tecnologías de ingeniería espacial alinear celdas individuales, tales como bioprinting15,16, fibra tejido17y18de andamios, pero requieren de procesamiento complejo o específicamente equipo de diseño. En cambio, hemos desarrollado una metodología para lograr un alineamiento celular 3D en una HGC19.
En este protocolo, ilustra un procedimiento simple con equipos utilizados para el control de la forma de racimo 3D de la célula inicial en un HGC. En primer lugar, se demostró el proceso de fabricación de la HGC. Micromolds fabricados por Fotolitografía o un proceso de mecanizado se colocan en la HGC para producir un bolsillo con una forma arbitraria en una ECM. Posteriormente, fueron inyectadas células altamente densas después de la centrifugación en el bolsillo para controlar la forma de racimo de células iniciales en el HGC. El cúmulo celular precisamente controlada podría ser reflejado desde todas las direcciones debido a la HGC. Células epiteliales bronquiales humanas normales (NHBE) fueron utilizadas para demostrar el control de la forma de racimo de células inicial y la proyección de imagen de las ramas de direcciones múltiples para mejorar la calidad de imagen.
Protocolo
1. fabricación de híbrido gel cubo dispositivo
- Preparar una estructura cúbica de policarbonato (PC) mediante un proceso de mecanizado o una impresora 3D. El tamaño de la estructura de PC depende del tamaño de la muestra. En este estudio, utilizamos un marco de 5 mm a cada lado para que las ramas tenían suficiente espacio para estirarse durante el cultivo.
- Coloque el marco de la PC en un portaobjeto previamente enfriado u otra superficie lisa en una caja de hielo (< 0 ° C) (figura 1A).
- Añadir 12 μl de agarosa 1.5% precalentado (w/v) de la cara superior de la estructura cúbica en la superficie inferior con una pipeta. Movimiento de la pipeta para que la agarosa se extiende para crear una superficie plana (figura 1B).
- Dentro de minutos, se curará la agarosa. Recoger el marco de la PC deslizando al borde de la diapositiva de cristal con unas pinzas. Tenga en cuenta que recoger verticalmente el marco de la diapositiva de cristal puede provocar desprendimiento de la agarosa de la estructura cúbica debido a la fuerza adhesiva entre la agarosa y el portaobjetos de cristal (figura 1).
- Gire el marco cúbico para hacer la cara hacia abajo y luego colocar sobre el portaobjetos de cristal otra vez (figura 1).
- Repita los pasos 1.3 – 1.5 hasta que las tres superficies se llenan de agarosa (Figura 1E).
- Para formar una pared de agarosa en las caras cuarta y quinta, de la gota la agarosa de una cara (Figura 1F). Una vez que se forma una pared de agarosa en la quinta cara, la preparación de la HGC completa.
2. fabricación de micromolds por Fotolitografía o un proceso de mecanizado
- Fabricación por Fotolitografía
- Limpiar una oblea de silicio (Si) por medio de limpieza por ultrasonidos con acetona, alcohol isopropílico (IPA), entonces (DI) agua destilada por 5 minutos cada uno. Después de soplar la oblea de Si con nitrógeno el nitrógeno, se deshidratan en un horno a 140 ° C durante 20 min (figura 2A(i)).
- Spin-capa una capa sacrificial como LOR y Az resiste en la oblea de Si (2.000 rpm, 30 s) mediante el uso de un recubridor spin bajo luz amarilla. Inmediatamente después de spin-coating, calentar la oblea en un plato caliente a 90 ° C durante 3 minutos (figura 2A(ii)). El espesor deseado de la capa sacrificial es más de 1 μm para que el proceso de Levante puede llevarse a cabo fácilmente, pero un grosor exacto no es necesario.
- Colocar la oblea en un plato caliente a 70 ° C y luego laminado una hoja gruesa photoresist negativo con el espesor deseado de la capa de sacrificio utilizando un rodillo de mano (figura 2A(iii))
- Cinco minutos después de la laminación, colocar la oblea en un alineador de máscara para la exposición Ultravioleta. Un photomask con el patrón deseado en la resistencia de la hoja y exponer con la luz UV durante un período de tiempo apropiado. El tiempo de exposición es determinado por el grueso del photoresist y la intensidad de la luz UV. Posteriormente, colocar la oblea en una placa para un post-exposición cuece al horno a 60 ° C por 5 min, seguido de horneado a 90 ° C durante 10 minutos (figura 2A(iv))
- Desarrollar una fotoresistencia negativa sumergiendo la oblea en acetato de Propilenglicol Monometil Éter (PGMEA) hasta que la zona no expuesta se haya disuelto completamente (aproximadamente 20 min) (figura 2A(v)).
- Disolver la capa de sacrificio usando IPA para la limpieza ultrasónica para levantar la microestructura. Una vez que la microestructura es pelada de la oblea, enjuague con agua desionizada por limpieza ultrasónica durante 10 minutos (figura 2A(vi)).
- Sumerja el molde en 30 μL del polímero MPC durante 30 min a temperatura ambiente (aproximadamente 20 ° C) para secar completamente hacia fuera. Figura 2B muestra el molde fabricado prisma.
- Fabricación de un molde de cilindro
- Fabricar un molde de cilindro de acero con tamaño deseado mediante un proceso de mecanizado. Alternativamente, use acero inoxidable disponible comercialmente. (En este estudio, un cilindro de 600 μm φ se utiliza).
- Sumerja el cilindro de acero en 30 μL del polímero MPC durante 30 min a temperatura ambiente (aproximadamente 20 ° C) para secar completamente hacia fuera.
- Preparar líquido polydimethylsiloxane (PDMS) mezclando la base resina y su catalizador (véase Tabla de materiales) en una proporción 10:1 seguida por desgasificación con un sistema de 20 min de desgasificación al vacío. Luego Vierta el PDMS en una placa de 12 pozos.
- Fijar el cilindro de acero fija y perpendicular a la superficie de referencia a una etapa lineal de z para que puedan insertarse perpendicular en la superficie PDMS no curada en una placa de 12 pozos colocada en la misma superficie de referencia moviendo la etapa z. Incubar el PDMS con el cilindro de acero en un horno por 20 min a 90 ° C para el curado. Corte el PDMS para formar una superficie de flanco para que la pipeta se puede insertar en el siguiente proceso (figura 2).
3. controlar la forma de racimo de células iniciales en un hidrogel
- Inyectar un ECM apropiado para el cultivo de células deseada, como el colágeno y la membrana del sótano artificial, en el HGC para llenar el espacio de cultura (Figura 3A).
- Conjunto micromold fabricado en el HGC directa o indirectamente con un soporte apropiado, como se muestra en la figura 3B. Posteriormente, coloque la HGC en un incubador de CO2 durante 25 minutos a 37 ° C para curarlo.
- Cuidadosamente levante el micromold para que el ECM no degrada (figura 3). El bolsillo, como la forma del molde deseado, a ser fabricado en el ECM.
- Recoger las células de la fuente culta por tripsina-EDTA o su equivalente en función del tipo de célula. Posteriormente, centrifugar las células para obtener células altamente concentradas (para la cultura NHBE, aplicar 0.25% tripsina-EDTA e incubar células durante 3 min., luego neutralizar con medio que contiene FBS y centrifugación a 300 x g durante 4 minutos).
- Después de centrifugar, quitar el medio sobrenadante para condensar las células e inyectar células altamente concentradas (3,0 × 104 células/μl para las células NHBE) en el bolsillo en el ECM (figura 3D).
- Incubar la HGC con células en una incubadora de CO2 por 20 min a 37 ° C para que las células caigan en el bolsillo de ECM para llenar el espacio creado por la micromolds. Si medio excesivo o las células están presentes en la superficie, retire con cuidado con ayuda de una pipeta.
- Coloque la HGC en una placa de 24 pozos y añadir 100 μl de medio apropiado (figura 3E). Para las células NHBE, use una mezcla de 1:1 de medio especializado disponible en el mercado de NHBE y las células endoteliales (véase Tabla de materiales).
- Inyectar el ECM adicional para cerrar el bolsillo en el ECM y luego incubar a 37 ° C durante 25 minutos.
- Enfriar precalentado agarosa 1.5% a temperatura ambiente (aproximadamente 20 ° C). Caída de aproximadamente 10 μl de la agarosa sobre la superficie superior de la HGC a cerca de la superficie y evitar que el ECM caiga de la HGC durante el cultivo y proyección de imagen (figura 3F). Luego, incubar la HGC por otro 20 min a 37 ° C para curar la agarosa.
- Añadir el medio para cubrir la HGC completa para que la presión osmótica puede ayudar en proveer nutrición a las células dentro de la HGC.
4. proyección de imagen de multidireccional
- Reconocimiento de formas 3D no invasiva mediante la observación y multidireccional
- Coloque la placa de cultivo o bien placa que contiene la HGC en un microscopio y Oriente la HGC al marco de la cámara. A continuación, obtener una imagen de muestra por contraste de fase o campo luminoso.
- Levante y gire la HGC para colocar una superficie diferente hacia abajo.
- Repita los pasos del 4.1.1 y 4.1.2 hasta que se obtienen las imágenes de los seis lados.
- Proyección de imagen de inmuno-fluorescente por la observación y multidireccional
- Para la fijación, aplique paraformaldehído al 4% para la muestra sobre la HGC a temperatura ambiente (aproximadamente 20 ° C) por 20 min, seguido de dos aclarados de PBS durante 10 minutos.
- Permeabilizar la HGC con PBS que contenga 0,5% Tritón X-100 durante 10 min a 4 ° C, luego lavar 3 x 10 minutos con PBS.
- Incubar la HGC con 10% de suero de cabra en tampón IF (0,2% Tritón X-100, seroalbúmina bovina al 0.1% y 0.05% Tween-20 en PBS) durante 60 min a temperatura ambiente durante un paso de bloqueo primaria.
- Para la tinción de una molécula específica, utilice el anticuerpo apropiado. Para observar la geometría de la celda colectiva, Alexa Fluor 488 Phalloidin puede utilizarse para la actinia de la mancha.
- Coloque la HGC en un plato de fondo de cristal con un microscopio láser o fluorescente y realizar análisis de seis lados para obtener la imagen completa muestra.
Resultados
Células epiteliales bronquiales humanas normales (NHBE) fueron utilizadas para demostrar la metodología ilustrada y control de la geometría de la celda colectiva inicial para lograr una forma de cilindro y una forma de prisma, respectivamente, en un ambiente de ECM. Se presentan los resultados imagenológicos multidireccionales por contraste de fases, así como phalloidin tinción de una forma del cilindro (Figura 4AB) y la forma de prisma (figura 4D). Las células se alinean convenientemente para obtener la forma deseada de 3D en el entorno de ECM. Posteriormente, las células fueron cultivadas durante cuatro días formar una forma específica y luego fueron analizadas por la proyección de imagen multi-direccional. El tamaño de muestra grande, es muy difícil de capturar la imagen de tejido entero de una sola dirección; sin embargo, la HGC permitió la proyección de imagen de hasta seis lados, revelando la forma entera del tejido. La figura 5 muestra los resultados de immunostaining del árbol bronquial desarrollado a partir de las células NHBE. Las células NHBE fueron controladas inicialmente a una forma cilíndrica en el HGC. Entonces, la mayoría de las ramas fueron dirigido perpendicular al eje cilíndrico.

Figura 1: proceso de fabricación del dispositivo de híbrido gel cubo. (A) la estructura cúbica de policarbonato se encuentra en una caja de hielo preenfriada. (B) agarosa (1.5%) se inyecta para cubrir la superficie inferior. (C) el cubo se ha deslizado para su cobro. (D) el cubo se rota para hacer otra superficie hacia abajo. (E) agarosa (1.5%) se inyecta para formar otra pared de agarosa. (F) después de una pared de agarosa es producida por tres caras, agarosa se inyecta a través de una cara. Barra de escala: 5 mm. haga clic aquí para ver una versión más grande de esta figura.
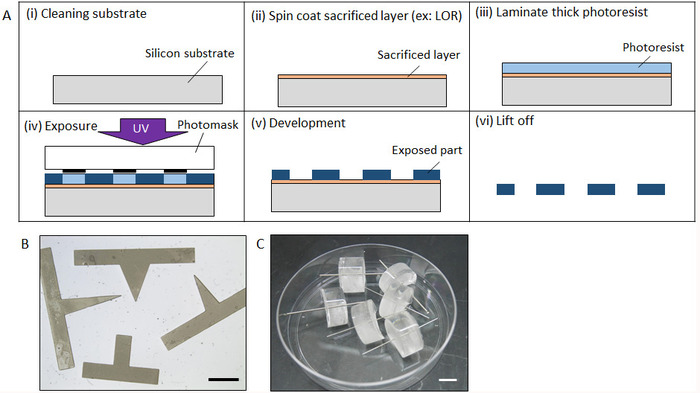
Figura 2: proceso de fabricación de micromolds. (A) fabricación proceso de micromold por Fotolitografía. (B) forma completa de un prisma fabricado forma micromold por Fotolitografía. (C) fabricado micromold con cilindro acero. Barra de escala: (B) (C) de 2 mm, 10 mm. haga clic aquí para ver una versión más grande de esta figura.

Figura 3: proceso de fabricación de control de clúster inicial celular. (A) ECM (por ejemplo, colágeno y Matrigel) se inyecta en el HGC. (B) la micromold ocupa en la estructura cúbica con o sin un soporte. (C) después de la ECM se cura, se quita el micromold. (D) después de células centrifugación, altamente densas se inyecta y se incubó. Medio (E) se aplica. (F) ECM adicional seguido de agarosa se inyectan para cubrir la superficie superior de la HGC. Barra de escala: 5 mm. haga clic aquí para ver una versión más grande de esta figura.
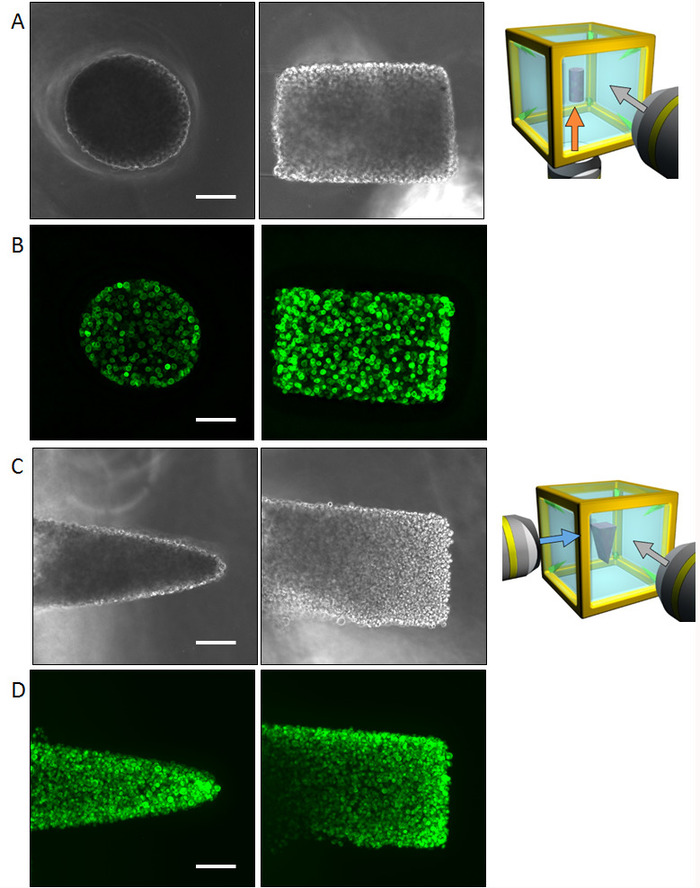
Figura 4: resultados de la célula inicial de control con las células NHBE. (A) imágenes de contraste de fase de las células NHBE cilíndrico controladas de la superficie inferior y lateral. La forma entera podría ser reconocida por la observación multidireccional sin necesidad de imágenes fluorescentes. (B) imágenes de fluorescencia de las células NHBE cilíndrico controladas coloración F-actina. (C) imágenes de contraste de fase de la NHBE las células en forma de prisma triangular de las superficies inferior y lateral. (D) imágenes de fluorescencia de las células NHBE en forma de prisma triangular. Barra de escala: 100 μm. 10 x lente de aumento (apertura numérica 0.3) fue utilizado. Haga clic aquí para ver una versión más grande de esta figura.
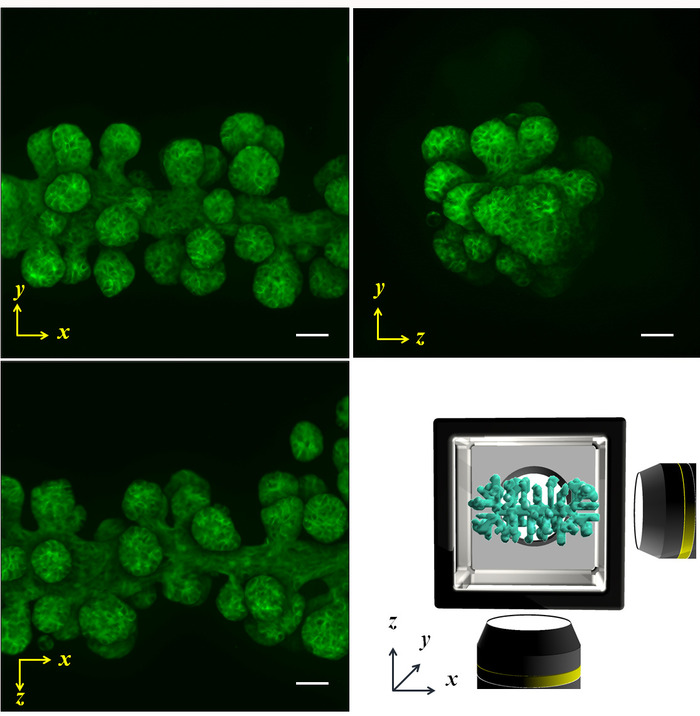
Figura 5: proyecta imágenes fluorescentes análisis multidireccional. Las células NHBE fueron inicialmente controladas para producir una forma cilíndrica y cultivadas en el HGC durante 4 días. Posteriormente, la actinia fue manchada por phalloidin. Las ramas eran alargadas desde el cilindro inicial a lo largo del eje x, y la longitud, el tamaño y el ángulo del eje se desarrollaron igualmente. Imagen inferior derecha muestra el esquema de los ejes x-y-z y la forma de la muestra. Barra de escala: 100 μm. Se utilizó un 10 x lente de aumento (0.3 apertura numérica). Haga clic aquí para ver una versión más grande de esta figura.
Discusión
El método presentado en este trabajo es simple y puede realizarse sin equipos de alta tecnología. Al mismo tiempo, puede obtenerse un resultado del control preciso de la célula cluster forma en el espacio 3D de hidrogel. Después del control inicial, las células pueden crecer en el HGC, tanto como se cultivan en un plato. La proyección de imagen multi-direccional se realiza girando la muestra con la HGC utilizando cualquier sistema de microscopía, y mejora significativamente la calidad de imagen. La elección de los materiales para el marco de la HGC y micromold es flexible como son biocompatibles. Una impresora 3D puede utilizarse para producir el marco de la HGC o micromold si la precisión de la impresora 3D es suficiente para sus aplicaciones. El método propuesto es compatible con muchos imagen mejorar tecnologías tales como sistemas transparencia de reactivos20,21 y la hoja de luz microscopia. Mediante el empleo de estas tecnologías, se puede mejorar la calidad de imagen.
El volumen de la agarosa, ECM y células muy densas que se inyecta depende del tamaño HGC y molde. Es necesaria una cuidadosa operación manual que no inyectan burbujas de aire, de lo contrario las burbujas formadas deterioran la precisión del control, crecimiento celular y calidad de imagen.
El proceso de fabricación de la micromolds será determinado por la forma deseada al control. Fotolitografía permite la fabricación de formas 2D precisas con cierta profundidad, como una forma de prisma del orden de micrómetros; sin embargo, no es eficaz con formas 3D, como un cilindro. Los procesos nos permiten fabricar la forma 3D, pero en general, la precisión dimensional es menor que la fotolitografía. Después de la fabricación de la micromolds, capa del polímero de Fosforilcolina (MPC) 2-methacryloyloxyethyl en los moldes es necesaria para prevenir la adhesión en el ECM.
Aprovechando una HGC, la proyección de imagen microscópica con o sin exposición del laser puede realizarse en múltiples direcciones. Una forma 3D de la muestra se puede reconocer aproximadamente por observación multidireccional sin etiquetado fluorescente; Este método no causa ninguna invasividad celular durante la observación. En cambio, la proyección de imagen fluorescente es requerida para la obtención de una forma más precisa de 3D muestra y expresión molecular.
La restricción del método actual para el control de la célula inicial es que no se puede aplicar a un molde con una forma 3D complejo. El molde tiene que ser eliminado al recoger sin deterioro del ECM. Así, el molde se limita a una simple forma recta o cónica. Para obtener el control de forma más compleja, más desarrollo del protocolo es necesario.
La metodología propuesta tiene gran utilidad y puede realizarse fácilmente en la mayoría de los entornos de laboratorio. Este procedimiento simple puede superar las limitaciones de la cultura 3D, proyección de imagen y capacidad de repetición y contribuir al desarrollo necesario para cultura 3D.
Divulgaciones
Los autores y la Universidad de la Prefectura de Osaka y el Instituto de tecnología de Kyushu han presentado una solicitud de patente para un híbrido gel cubo y Nippon médica y química Instruments Co. Ltd, Japón ha comercializado recientemente el cubo. La empresa no afectó a ninguno de los métodos descritos, diseño y proceso.
Agradecimientos
Este trabajo fue apoyado por KAKENHI JSPS (18H 04765) y el programa para difundir vía sistema, MEXT, Japón.
Materiales
| Name | Company | Catalog Number | Comments |
| 12-well-plate | Corning Inc. | 3513 | |
| 2-Methoxy-1-methylethyl Acetate | FUJIFILM Wako Pure Chemical Co. | 130-10505 | PGMEA, CAS: 108-65-6 |
| 4% paraformaldehyde | FUJIFILM Wako Pure Chemical Co. | 161-20141 | CAS: 30525-89-4 |
| Agarose, low gelling temperature BioReagent | Sigma-Aldrich | A9414 | |
| Alexa fluor 488 phalloidin | Thermo Fisher Scientific | A12379 | |
| AZ1512 | Merck | ||
| BEGM bullet kit | Lonza | CC-3170 | Specialized medium for NHBE cells |
| Bovine Serum Albumin solution (10 %) | Sigma-Aldrich | A1595 | |
| EGM-2 bullet kit | Lonza | CC-3162 | Specialized medium for endothelial cells |
| Lipidure | NOF co. | MPC polymer | |
| Matrigel growth factor reduced basement membrane matrix | Corning Inc. | 354230 | |
| Normal Goat Serum (10%) | Thermo Fisher Scientific | 50197Z | |
| Normal human bronchial epithelial cells | Lonza | CC-2541 | |
| SILPOT 184 W/C | Dow Corning Co. | 3255981 | Base resin and catalyst for PDMS |
| SUEX D300 | DJ MicroLaminates, Inc | Thick negative photoresist (thichness: 300 mm) | |
| Triton X-100 (1%) | Thermo Fisher Scientific | HFH10 | |
| Trypsin-EDTA (0.25%) | Thermo Fisher Scientific | 25200056 | |
| TWEEN 20 | Sigma-Aldrich | P9416 |
Referencias
- Baker, B. M., Chen, C. S. Deconstructing the third dimension - how 3D culture microenvironments alter cellular cues. Journal of Cell Science. 125 (13), 3015-3024 (2012).
- Sasai, Y. Cytosystems dynamics in self-organization of tissue architecture. Nature. 493 (7432), 318-326 (2013).
- Shamir, E. R., Ewald, A. J. Three-dimensional organotypic culture: Experimental models of mammalian biology and disease. Nature Reviews Molecular Cell Biology. 15 (10), 647-664 (2014).
- Frantz, C., Stewart, K. M., Weaver, V. M. The extracellular matrix at a glance. Journal of Cell Science. 123 (24), 4195-4200 (2010).
- Choquet, D., Felsenfeld, D. P., Sheetz, M. P. Extracellular matrix rigidity causes strengthening of integrin- cytoskeleton linkages. Cell. 88 (1), 39-48 (1997).
- Hannezo, E., Prost, J., Joanny, J. -. F. Theory of epithelial sheet morphology in three dimensions. Proceedings of the National Academy of Sciences of the United States of America. 111 (1), 27-32 (2014).
- Tawk, M., et al. A mirror-symmetric cell division that orchestrates neuroepithelial morphogenesis. Nature. 446 (7137), 797-800 (2007).
- Eiraku, M., et al. Self-organizing optic-cup morphogenesis in three-dimensional culture. Nature. 472 (7341), 51-58 (2011).
- Zegers, M. M. P., O’Brien, L. E., Yu, W., Datta, A., Mostov, K. E. Epithelial polarity and tubulogenesis in vitro. Trends in Cell Biology. 13 (4), 169-176 (2003).
- Affolter, M., Bellusci, S., Itoh, N., Shilo, B., Thiery, J. P., Werb, Z. Tube or not tube: Remodeling epithelial tissues by branching morphogenesis. Developmental Cell. 4 (1), 11-18 (2003).
- Denk, W., Strickler, J., Webb, W. Two-photon laser scanning fluorescence microscopy. Science. 248 (4951), 73-76 (1990).
- Huisken, J., et al. Optical Sectioning Deep Inside Live Embryos by Selective Plane Illumination Microscopy. Science. , 1007-1009 (2004).
- Hagiwara, M., Kawahara, T., Nobata, R. Tissue in Cube: In Vitro 3D Culturing Platform with Hybrid Gel Cubes for Multidirectional Observations. Advanced Healthcare Materials. 5 (13), 1566-1571 (2016).
- Hagiwara, M., Nobata, R., Kawahara, T. Large Scale Imaging by Fine Spatial Alignment of Multi-Scanning Data with Gel Cube Device. Applied Sciences. 8 (235), (2018).
- Kolesky, D. B., Homan, K. A., Skylar-Scott, M. A., Lewis, J. A. Three-dimensional bioprinting of thick vascularized tissues. Proceedings of the National Academy of Sciences of the United States of America. 113 (12), 3179-3184 (2016).
- Mironov, V., Visconti, R. P., Kasyanov, V., Forgacs, G., Drake, C. J., Markwald, R. R. Organ printing: Tissue spheroids as building blocks. Biomaterials. 30 (12), 2164-2174 (2009).
- Onoe, H., et al. Metre-long cell-laden microfibres exhibit tissue morphologies and functions. Nature Materials. 12 (6), 584-590 (2013).
- Miller, J. S., et al. Rapid casting of patterned vascular networks for perfusable engineered three-dimensional tissues. Nature Materials. 11 (9), 768-774 (2012).
- Hagiwara, M., Nobata, R., Kawahara, T. High repeatability from 3D experimental platform for quantitative analysis of cellular branch pattern formations. Integrative Biology. 10, 306-312 (2018).
- Tainaka, K., et al. Whole-body imaging with single-cell resolution by tissue decolorization. Cell. 159 (4), 911-924 (2014).
- Murray, E., et al. Scalable Proteomic Imaging for High-Dimensional Profiling of Intact Systems. Cell. 163 (6), 1500-1514 (2015).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados