Method Article
Erste 3D Cluster Zellkontrolle in einem Hybrid Gel Cube Gerät für wiederholbare Muster Formationen
In diesem Artikel
Zusammenfassung
Wir präsentieren Ihnen ein Verfahren zur Steuerung der erste Zellform der Cluster in einer 3D extrazelluläre Matrix, eine wiederholbare Musterbildung zu erhalten. Eine kubische Gerät mit zwei verschiedenen Hydrogele wird eingesetzt, um Multi-direktionalen Imaging für Gewebebildung Muster zu erreichen.
Zusammenfassung
Die Bedeutung der in-vitro-3D Kulturen wird deutlich im Zellgewebe/Kultur betont. Jedoch ist der Mangel an experimentellen Wiederholbarkeit eines seine Einschränkungen. Einige wiederholbare Resultate der Musterbildung, verschlechtert sich die Analyse der Mechanismen, die die Selbstorganisation. Reduzierung Variation im ersten Kulturbedingungen, wie z. B. die Zelldichte und Verteilung in der extrazellulären Matrix (ECM), ist entscheidend für die Wiederholbarkeit von 3D Culture zu verbessern. In diesem Artikel zeigen wir eine einfache, aber robuste Verfahren zur Steuerung der erste Zellform der Cluster in einer 3D extrazelluläre Matrix sehr wiederholbare Muster Formationen zu erhalten. Micromold mit einer gewünschten Form mittels Photolithographie oder einer Bearbeitung hergestellt wurde, und bildete eine 3D Tasche in das ECM in einem Hybrid-Gel-Cube (HGC) enthalten. Hochkonzentrierte Zellen wurden dann in der Tasche injiziert, so dass die Zellform-Cluster mit den vorgefertigten Form aufeinander abgestimmt. Die eingesetzten HGC erlaubt Multi-direktionalen Abtastung durch seine Drehung, die hochauflösende Bildgebung und die Erfassung der gesamten Gewebestruktur ermöglicht, obwohl eine niedrige Vergrößerungslinse verwendet wurde. Normalen menschlichen bronchiale Epithelzellen wurden verwendet, um die Methodik zu demonstrieren.
Einleitung
Die Bedeutung von einem 3D Culture, die biologische Umgebungen besser imitiert als eine 2D Kultur tut, ist deutlich im Zellgewebe/Kultur1,2,3betont. Die Interaktion zwischen den Zellen und der extrazellulären Matrix (ECM) bietet wichtige Hinweise bezüglich Morphogenese4,5. Viele Gewebe Formationen können nur unter 3D Umgebungen, z. B. die klappbare Prozess6,7, Einstülpen8und röhrenförmigen Bildung9,10entstehen. Jedoch verhindern, dass zahlreiche Schwierigkeiten Forscher Verlagerung auf 3D Experimente von 2D Experimente auf einen Teller geben. Eine der Hauptschwierigkeiten in 3D Experimenten ist die Frage der bildgebenden 3D Proben. Verglichen mit planaren Experimente, ist Erwerb der entsprechenden 3D-Bilder in vielen Fällen immer noch herausfordernd. Insbesondere ist die Erlangung einer entsprechenden 3D Bild eine schwierige Aufgabe, wenn die Stichprobengröße Millimeterbereich aufgrund großer Fokustiefe Low-Vergrößerung Objektive erreicht. Beispielsweise erreicht die Schärfentiefe mehr als 50 µm bei einer 10-fach Vergrößerung Objektiv verwendet wird, während die Größe der einzelnen Zelle normalerweise weniger als 10 µm beträgt. Um die Bildqualität zu verbessern, werden High-Tech-Mikroskopiesysteme entwickelt (z. B. zwei-Photonen-Mikroskopie11 und Licht-Blatt Mikroskopie System12), aber ihre Verfügbarkeit ist begrenzt aufgrund ihrer teuren Preis. Als Alternative haben wir zuvor ein Hybrid Gel Cube (HGC) Gerät13entwickelt. Das Gerät besteht aus zwei Arten von Hydrogele: Agarose als eine Unterstützung Gel und einem ECM wie Kollagen oder Matrigel als Kultur Gel. Die HGC ermöglicht es uns, sammeln der Probenmaterials während der Kultivierung und drehen Sie den Würfel um Multi-direktionalen Bildgebung zu erreichen, richtet sich die Fokustiefe Problem14.
Eine weitere Schwierigkeit in 3D Experimenten ist ihre geringe Reproduzierbarkeit aufgrund der schlechten Steuerbarkeit der 3D Umgebungen. Im Gegensatz zu einer planaren Kultur auf einer Plastikschale treten Abweichungen in der anfänglichen Kulturbedingungen leicht in einem 3D Raum, umgeben von einem weichen Material. Eine signifikante Variation in den experimentellen Ergebnissen verschlechtert sich die folgende Analyse und Masken die zugrunde liegenden Mechanismen. Viele Technologien wurden entwickelt, um räumlich ausrichten einzelne Zellen, z. B. Bioprinting15,16, Faser weben17und Gerüste18, aber sie erfordern komplexe Vorverarbeitung oder speziell konstruierte Geräte. Im Gegensatz dazu haben wir eine Methodik zur Erreichung 3D Zellausrichtung in eine HGC19entwickelt.
In diesem Protokoll dargestellt wir ein einfaches Verfahren mit häufig verwendeten Ausrüstung zur Steuerung der 3D ursprünglichen Cluster Zellform in eine HGC. Zunächst zeigte sich der Fertigungsprozess von der HGC. Dann wurden Micromolds hergestellt von Photolithographie oder Bearbeitungsvorgang in der HGC, eine Tasche mit einer beliebigen Form in einem ECM zu produzieren gelegt. Hoher Dichte Zellen nach Zentrifugation wurden anschließend in die Tasche zu steuern, die erste Zellform der Cluster in der HGC injiziert. Die präzise gesteuerte Zelle Cluster könnte aus vielen Richtungen wegen der HGC abgebildet werden. Normalen menschlichen Bronchien (NHBE) Epithelzellen wurden verwendet, um die Kontrolle über die ursprünglichen Cluster Zellform und Bildgebung der Zweige aus mehreren Richtungen zur Verbesserung der Bildqualität zu demonstrieren.
Protokoll
1. Herstellung von Gel Cube Hybridgerät
- Bereiten Sie einem Polycarbonat (PC) kubischen Rahmen entweder mithilfe einer Bearbeitung oder einem 3D-Drucker. Die Größe des Rahmens PC hängt die Größe der Stichprobe. In dieser Studie verwendet wir einen Rahmen von 5 mm auf jeder Seite, so dass die Zweige genügend Raum hatten, um während der Kultivierung zu verlängern.
- Legen Sie die PC-Rahmen auf eine vorgekühlte Glas-Folie oder einer anderen glatten Oberfläche in eine Eisbox (< 0 ° C) (Abbildung 1A).
- Der Bodenfläche mit einer Pipette 12 µL vorgewärmten 1,5 % Agarose (w/V) aus der oberen Fläche der kubischen Rahmen hinzufügen. Streicheln Sie die Pipette, so dass die Agarose breitet sich um eine flache Oberfläche (Abb. 1 b) zu erstellen.
- Innerhalb von Minuten wird die Agarose geheilt werden. Heben Sie die PC-Rahmen schieben sie an den Rand der Objektträger mit einer Pinzette. Beachten Sie, dass vertikal Abholung des Rahmens aus der Glas-Folie lösen der Agarose aus dem kubischen Rahmen durch die Haftkraft zwischen der Agarose und Objektträger (Abbildung 1) führen kann.
- Drehen Sie den kubischen Rahmen um das offene Gesicht nach unten, und legen Sie dann auf den Objektträger wieder (Abbildung 1).
- Wiederholen Sie die Schritte 1,3 – 1,5 bis drei Oberflächen mit Agarose (Abbildung 1E) gefüllt sind.
- Eine Agarose-Wand auf den vierten und fünften Flächen bilden, lassen fallen Sie die Agarose in aus einer offenen Fläche (Abb. 1F). Sobald eine Agarose-Wand auf dem fünften Gesicht gebildet wird, ist die Vorbereitung der HGC abgeschlossen.
(2) Herstellung von Micromolds durch Photolithographie oder einer Bearbeitung
- Herstellung von Photolithographie
- Saubere destilliert ein Siliziumwafer (Si) per Ultraschall-Reinigung mit Aceton, Isopropylalkohol (IPA), dann (DI) Wasser für 5 Minuten. Nach Stickstoff bläst des Si-Wafers mit Stickstoff Entwässern Sie in einem Ofen bei 140 ° C für 20 min (Abbildung 2A(i)).
- Spin-Mantel eine Opferschicht wie LOR und Az auf dem Si-Wafer widersteht (2.000 u/min, 30 s) mit einem Spin Coater unter Gelblicht. Sofort nach dem Spin-Coating erhitzen Sie die Wafer auf einer heißen Platte bei 90 ° C für 3 min (Abbildung 2A(Ii)). Die gewünschte Dicke der Opferschicht ist mehr als 1 µm, so dass das Abheben der Prozess leicht durchgeführt werden kann, aber eine genaue Dicke nicht notwendig ist.
- Legen Sie die Wafer auf einer heißen Platte bei 70 ° C und dann Laminat ein dicker negativer Photoresist Blatt mit der gewünschten Stärke auf die Opferschicht mit einem Handroller (Abbildung 2A(Iii))
- Legen Sie fünf Minuten nach dem Laminieren, die Wafer auf eine Mask Aligner für UV-Exposition. Festlegen einer Fotomaske mit dem gewünschten Muster auf das Blatt zu widerstehen und für eine angemessene Zeitdauer mit UV-Licht aussetzen. Die Belichtungszeit wird durch die Stärke des Photoresist und die Intensität des UV-Lichts bestimmt. Anschließend legen Sie die Wafer auf einer heißen Platte für eine Post-Exposition Backen bei 60 ° C für 5 min, gefolgt von Backen bei 90 ° C für 10 min. (Abbildung 2A(iv))
- Entwickeln Sie ein negativer Photoresist durch Eintauchen des Wafers in Propylenglykol Monomethyl Äther Acetat (PGMEA), bis die unbelichtete Bereich (ca. 20 min) vollständig gelöst ist (Abbildung 2A(V)).
- Lösen Sie die Opferschicht mithilfe von IPA für Ultraschall-Reinigung der Mikrostruktur abheben. Sobald die Mikrostruktur aus dem Wafer abgeschält ist, spülen Sie mit VE-Wasser durch Ultraschallreinigung für 10 min (Abbildung 2A(vi)).
- Tauchen Sie den Schimmel in 30 µL des MPC Polymers für 30 min bei Raumtemperatur (ca. 20 ° C) vollständig es trocknen. Abbildung 2 b zeigt die fabrizierten Prisma Form.
- Herstellung von Zylinder-Schimmel
- Eine Stahl-Zylinder Form mit der gewünschten Größe durch einen Bearbeitungsprozess zu fabrizieren. Alternativ können Sie im Handel erhältlichen Edelstahl. (In dieser Studie wird ein Zylinder φ 600 µm verwendet.)
- Tauchen Sie den Zylinder Stahl 30 µL des MPC Polymers für 30 min bei Raumtemperatur (ca. 20 ° C) vollständig es trocknen.
- Bereiten Sie flüssige Polydimethylsiloxan (PDMS) durch Mischen Basis Harz und seine Katalysator (siehe Tabelle der Materialien) im Verhältnis 10:1 gefolgt von Entgasung mit einem Vakuum-Entgasung System für 20 Minuten. Dann gießen Sie die PDMS in einem 12-Well-Platte.
- Die Stahlflasche senkrecht auf die Bezugsfläche und festen zu einer linearen Z-Stufe so eingerichtet dass es senkrecht in die ausgehärtete PDMS Oberfläche in einer 12-Brunnen-Platte platziert auf dieselbe Bezugsfläche durch Verschieben der Z-Phase eingesetzt werden kann. Inkubieren Sie die PDMS mit dem Zylinder Stahl in einem Ofen für 20 min bei 90 ° C für die Heilung. Schneiden Sie die PDMS um eine Flankenoberfläche zu bilden, so dass das Pipettieren im folgenden Prozess (Abbildung 2) eingefügt werden kann.
3. Kontrolle der erste Zellform Cluster in einem hydrogel
- Injizieren Sie eine entsprechende ECM für die gewünschte Zellkultur wie Kollagen und künstliche Basalmembran in der HGC Kultur Raum (Abbildung 3A) füllen.
- Legen Sie fabrizierten Micromold auf die HGC direkt oder indirekt mit einem geeigneten Halter, wie in Abbildung 3 bdargestellt. Anschließend legen Sie die HGC in eine CO2 Inkubator für 25 min bei 37 ° C für die Heilung von es.
- Sorgfältig herausheben der Micromold, so dass das ECM nicht (Abbildung 3 verschlechtert). Die Tasche wird als die gewünschte Form in das ECM hergestellt werden.
- Zellen aus der kultivierten Schale von Trypsin-EDTA oder eines gleichwertigen Dokuments, je nach der Zelltypen zu ernten. Anschließend Zentrifugieren der Zellen um hochkonzentrierte Zellen zu erhalten (für NHBE Kultur gelten 0,25 % Trypsin-EDTA und Zellen für 3 min inkubieren, dann neutralisieren mit FBS-haltigen Medium und Zentrifugieren bei 300 X g für 4 min).
- Entfernen Sie nach Zentrifugieren das überstehende Medium, um die Zellen zu verdichten und injizieren Sie hochkonzentrierte Zellen (3,0 × 104 Zellen/µL für NHBE Zellen) in der Tasche in die ECM (Abbildung 3D).
- Inkubieren Sie HGC mit Zellen in einem CO-2 -Inkubator für 20 min bei 37 ° C, so dass die Zellen in die ECM-Tasche fallen füllen den Raum durch die Micromolds erstellt. Wenn übermäßige Mittel "oder" Zellen auf der Oberfläche vorhanden sind, entfernen Sie vorsichtig mit einer Pipette.
- Die HGC auf einer 24-Well-Platte geben Sie und 100 µL in anderer geeigneter Form (Abbildung 3E). Verwenden Sie für NHBE Zellen eine 1:1 Mischung aus handelsüblichen spezialisierte Medium für NHBE und Endothelzellen (siehe Tabelle der Materialien).
- Injizieren Sie zusätzliche ECM zum Schließen der Tasche in die ECM, und dann bei 37 ° C für 25 min inkubieren.
- Vorgeheizten 1,5 % Agarose auf Raumtemperatur (ca. 20 ° C) abkühlen. Fallen Sie ca. 10 µL der Agarose auf der oberen Fläche des HGC in der Nähe der Oberfläche zu verhindern, dass das ECM ein Herausfallen der HGC während der Kultivierung und imaging (Abbildung 3F). Dann, brüten Sie die HGC für weitere 20 Minuten bei 37 ° C um die Agarose zu heilen.
- Fügen Sie Medium, um die gesamte HGC zu decken, so dass der osmotische Druck helfen kann bei der Bereitstellung von Nahrung auf die Zellen im Inneren der HGC hinzu.
4. Multi-direktionalen Bildgebung
- Nicht-invasive 3D-Form Anerkennung durch Multi-direktionalen Beobachtung
- Platzieren Sie die Kulturschale oder well-Platte mit der HGC am Mikroskop und orientieren Sie der HGC um den Bildausschnitt zu. Dann verschaffen Sie ein Beispielbild von hellen Feld oder Phase Kontrast.
- Abholen und den HGC um Platz auf eine andere Oberfläche nach unten drehen.
- Wiederholen Sie die Schritte 4.1.1 und 4.1.2 bis Bilder von allen sechs Seiten abgerufen werden.
- Immuno-fluoreszierende Bildgebung durch Multi-direktionalen Beobachtung
- Gelten Sie für Fixierung 4 % Paraformaldehyd zum Beispiel über die HGC bei Raumtemperatur (ca. 20 ° C) für 20 min, gefolgt von zwei Spülungen der PBS für 10 min.
- Permeabilize der HGC mit PBS mit 0,5 % Triton x-100 für 10 min bei 4 ° C, dann 3 X 10 min. mit PBS waschen.
- Inkubieren Sie die HGC mit 10 % Ziegenserum in IF-Puffer (0,2 % Triton x-100, 0,1 % Rinderserumalbumin und 0,05 % Tween 20 in PBS) für 60 min bei Raumtemperatur für eine primäre Blockierungsschritt.
- Verwenden Sie für die Färbung eines bestimmten Moleküls, die entsprechenden Antikörper. Um die kollektive Zellengeometrie zu beobachten, kann Alexa Fluor 488 Phalloidin, Aktin zu beflecken verwendet werden.
- Die HGC auf einer Glasschale unten unter dem Mikroskop Laser- oder Leuchtstofflampen und Scannen von sechs Seiten, das gesamte Sample Bild zu erhalten.
Ergebnisse
Normalen menschlichen Bronchien (NHBE) Epithelzellen dienten demonstrieren die illustrierte Methodik und steuern die erste kollektive Zellengeometrie um eine Zylinderform und Prisma geformt, bzw. in einem ECM-Umfeld zu erreichen. Die Multi-direktionalen bildgebenden Ergebnisse durch Phasenkontrast sowie Phalloidin Färbung, der Form eines Zylinders (Abbildung 4AB) und die Prisma-Form (Abbildung 4D) werden vorgestellt. Die Zellen sind entsprechend ausgerichtet, um die gewünschte 3D-Form in der ECM-Umgebung ergeben. Anschließend die Zellen waren für vier Tage zu einer bestimmten Gestalt kultivierten und Multi-direktionalen Bildgebung analysiert wurden. Die große Stichprobe-Größe macht es ziemlich schwierig, das gesamte Gewebe-Bild aus einer Richtung zu erfassen; jedoch erlaubt die HGC Bildgebung von bis zu sechs Seiten offenbart die ganze Gewebe Form. Abbildung 5 zeigt die Immunostaining Ergebnisse des Bronchialbaumes entwickelt aus den NHBE Zellen. Die NHBE Zellen wurden zunächst in eine zylindrische Form in der HGC gesteuert. Dann waren die meisten der Zweige gerichtete senkrecht zur zylindrischen Achse.

Abbildung 1: Herstellung von Gel Cube Hybridgerät. (A) der Polycarbonat kubischen Rahmen befindet sich eine vorgekühlte Kühlbox. (B) Agarose (1,5 %) wird eingespritzt, um die Bodenfläche bedecken. (C) der Würfel geschoben wird, gesammelt werden. (D) der Würfel wird gedreht, um eine andere Fläche nach unten zu machen. (E) Agarose (1,5 %) wird eingespritzt, um eine andere Agarose Wand bilden. (F) nach eine Agarose-Wand für drei Gesichter entsteht, wird Agarose durch ein offenes Gesicht gespritzt. Maßstab: 5 mm. Bitte klicken Sie hier für eine größere Version dieser Figur.
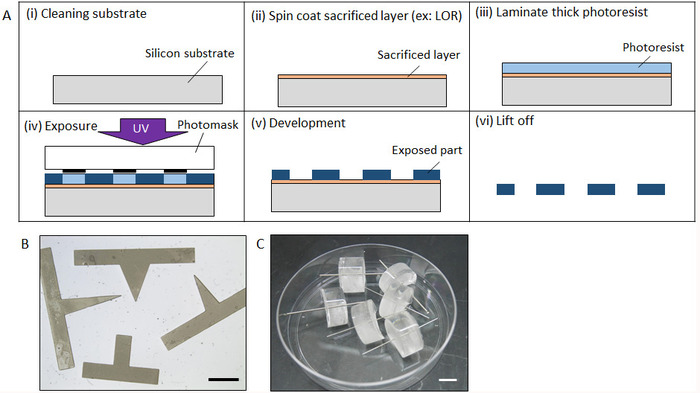
Abbildung 2: Herstellung von Micromolds. (A) Herstellung von Micromold durch Photolithographie. (B) vollständige Form von einer vorgefertigten Prisma Form Micromold durch Photolithographie. (C) Micromold mit Zylinder Stahl hergestellt. Maßstabsleiste: (B) 2 mm, (C) 10 mm. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 3: Herstellung der ersten Cluster Zellkontrolle. (A) ECM (z. B. Kollagen und Matrigel) wird in der HGC injiziert. (B) wird die Micromold auf dem kubischen Rahmen mit oder ohne einen Halter festgelegt. (C) nach der ECM ist geheilt, die Micromold wird entfernt. (D) nach Sandbacken, hoher Dichte Zellen injiziert und inkubiert werden. (E) Medium wird angewendet. (F) zusätzliche ECM gefolgt von Agarose sind eingespritzt, um die Oberseite der HGC abdecken. Maßstab: 5 mm. Bitte klicken Sie hier für eine größere Version dieser Figur.
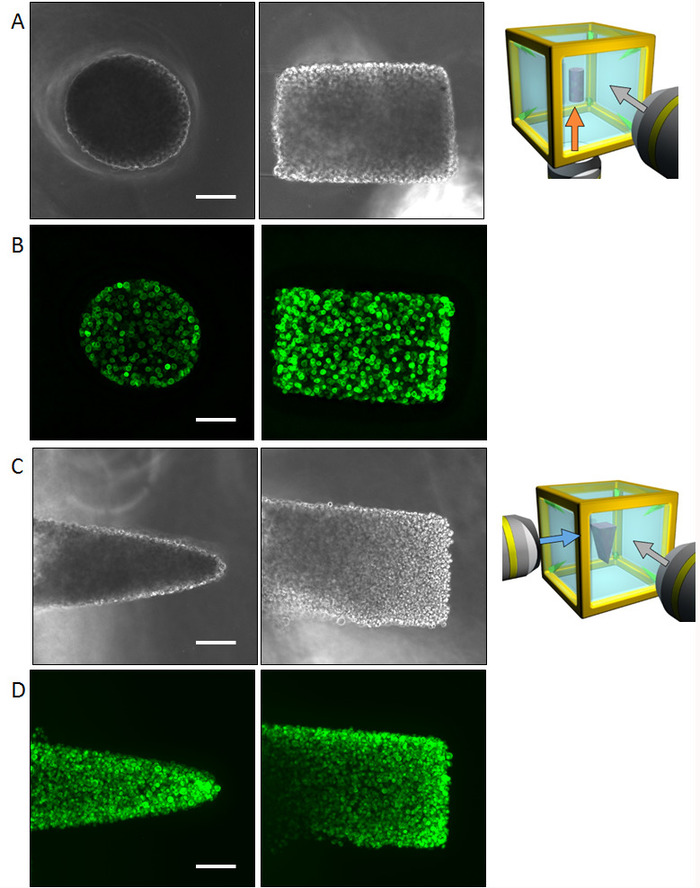
Abbildung 4: Ergebnisse der ersten Zelle mit NHBE Zellen steuern. (A) Phasenkontrast-Bilder der zylindrisch kontrollierten NHBE Zellen für die unteren und seitlichen Oberfläche genommen. Die gesamte Form konnte durch Multi-direktionalen Beobachtung erkannt werden, ohne Fluoreszenz-Bildgebung. (B) Fluoreszenzbilder der zylindrisch kontrollierten NHBE Zellen färben F-Aktin. (C) Phasenkontrast-Bilder von den NHBE Zellen gesteuert in Form eines dreieckigen Prismas aus den unteren und seitlichen Oberflächen erfasst. (D) Fluoreszenzbilder der NHBE Zellen in Form eines dreieckigen Prismas gesteuert. Maßstab: 100 µm. 10 x Vergrößerungslinse (0,3 numerische Apertur) diente. Bitte klicken Sie hier für eine größere Version dieser Figur.
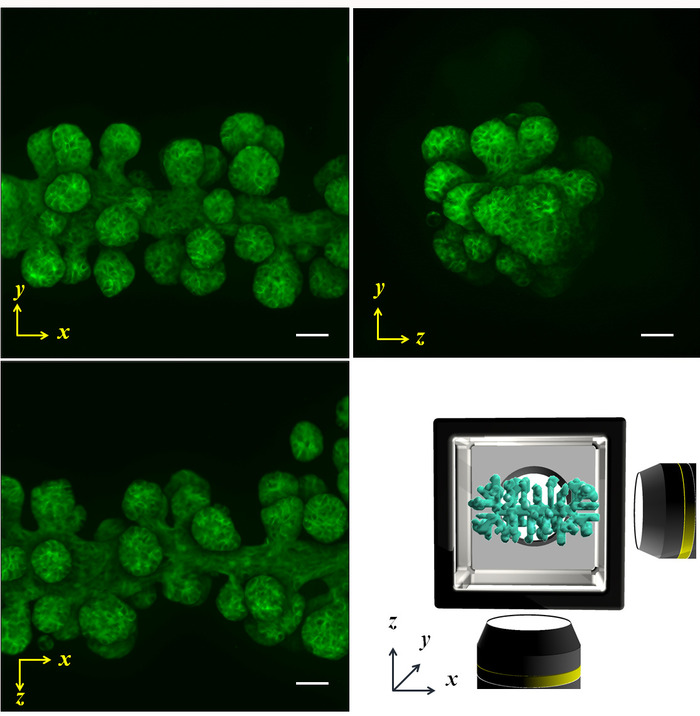
Abbildung 5: fluoreszierende Bilder von Multi-direktionalen Scannen projiziert. Die NHBE Zellen wurden zunächst kontrolliert, um eine zylindrische Form zu produzieren und für 4 Tage in der HGC kultiviert. Anschließend wurde Aktin durch Phalloidin gefärbt. Die Zweige wurden aus dem ersten Zylinder entlang der x-Achse länglich und Länge, Größe und Winkel von der Achse wurden ebenso entwickelt. Untere rechte Bild zeigt die schematische Darstellung der X-y-Z -Achse und der Probenform. Maßstab: 100 µm. Ein 10 x Vergrößerungslinse (0,3 numerische Apertur) diente. Bitte klicken Sie hier für eine größere Version dieser Figur.
Diskussion
In diesem Whitepaper vorgestellte Methode ist einfach und kann ohne High-Tech-Ausrüstung durchgeführt werden. Gleichzeitig erhalten Sie eine präzise Zelle Cluster Form Kontrollergebnis im 3D-Raum Hydrogel. Nach der ersten Kontrolle können die Zellen in der HGC wachsen, wie sie auf einem Teller kultiviert sind. Die Multi-direktionale Bildgebung erfolgt durch Drehen der Probenmaterials mit der HGC mit jedem Mikroskopie-System, und es verbessert erheblich die Bildqualität. Die Wahl der Materialien für die HGC Rahmen und Micromold ist flexibel, solange sie biokompatibel sind. Ein 3D-Drucker kann verwendet werden, um den HGC Rahmen oder Micromold zu produzieren, wenn die Genauigkeit des 3D-Druckers für ihre Anwendungen ausreicht. Die vorgeschlagene Methode ist kompatibel mit vielen Bild Verbesserung Technologien wie Transparenz Reagenzien20,21 und Licht-Blatt Mikroskopiesysteme. Durch den Einsatz dieser Technologies, kann die Bildqualität verbessert werden.
Das Volumen der Agarose, ECM und hoher Dichte Zellen injiziert werden, hängt von der HGC und Schimmel Größe. Eine sorgfältige manuelle Bedienung, die injizieren nicht Luftblasen erforderlich ist, ansonsten die Luftblasen gebildet werden die Genauigkeit der Steuerung, Zellwachstum und Abbildungsqualität verschlechtern.
Der Fertigungsprozess von der Micromolds richtet sich nach der gewünschten Form zu kontrollieren. Photolithographie ermöglicht die Herstellung von präzisen 2D-Konturen mit einer bestimmten Tiefe, wie ein Prisma Form in der Größenordnung von Mikrometern. Es ist jedoch nicht wirksam mit 3D-Formen, z. B. eines Zylinders. Der Bearbeitungsprozess ermöglicht es uns, die 3D-Form zu fabrizieren, aber im Allgemeinen die Maßgenauigkeit ist niedriger als Photolithographie. Nach der Herstellung der Micromolds ist Beschichtung des 2-Methacryloyloxyethyl Phosphorylcholin (MPC) Polymers auf die Formen erforderlich, um die Haftung auf dem ECM zu verhindern.
Unter Ausnutzung der ein HGC kann mikroskopische Bildgebung mit oder ohne Laserbelichtung in mehrere Richtungen durchgeführt werden. Ein 3D Probenform man etwa Multi-direktionalen Beobachtung erkennt an ohne fluoreszierende Kennzeichnung; Diese Methode verursacht keine Zelle Invasivität während der Beobachtung. Im Gegensatz dazu wird Fluoreszenz-Bildgebung Führerscheinausbildung eine genauere 3D Probenform und molekulare Ausdruck.
Die Einschränkung der vorgestellten Methode zur ersten Zellkontrolle ist, dass es auf eine Form mit einer komplexen 3D Form angewendet werden kann. Die Form muss entfernt werden, indem Sie sich ohne Verschlechterung der ECM. Somit ist die Form beschränkt sich auf eine einfache gerade oder konische Form. Um komplexere Form-Steuerelement zu erhalten, bedarf weiterer Entwicklung des Protokolls.
Die vorgeschlagene Methode hat breite nutzen und kann leicht in einem Großteil der Laborumgebungen durchgeführt werden. Dieses einfache Verfahren kann die Begrenzungen von 3D Culture, Bildgebung und Wiederholbarkeit und dazu beitragen, die weitere Entwicklung für 3D Culture erforderlich.
Offenlegungen
Die Autoren und der Osaka Prefecture University und Kyushu Institute of Technology angemeldet haben eine Patentanmeldung für ein Gel Cube Hybridgerät und Nippon medizinischen und chemischen Instruments Co. Ltd, Japan hat vor kurzem den Würfel in den Handel gebracht. Das Unternehmen wurde eines Design, Prozess und beschriebenen Methoden nicht berührt.
Danksagungen
Diese Arbeit wurde von JSPS KAKENHI (18 H 04765) und das Programm zu verbreiten Tenure-Track-System, MEXT, Japan finanziell unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| 12-well-plate | Corning Inc. | 3513 | |
| 2-Methoxy-1-methylethyl Acetate | FUJIFILM Wako Pure Chemical Co. | 130-10505 | PGMEA, CAS: 108-65-6 |
| 4% paraformaldehyde | FUJIFILM Wako Pure Chemical Co. | 161-20141 | CAS: 30525-89-4 |
| Agarose, low gelling temperature BioReagent | Sigma-Aldrich | A9414 | |
| Alexa fluor 488 phalloidin | Thermo Fisher Scientific | A12379 | |
| AZ1512 | Merck | ||
| BEGM bullet kit | Lonza | CC-3170 | Specialized medium for NHBE cells |
| Bovine Serum Albumin solution (10 %) | Sigma-Aldrich | A1595 | |
| EGM-2 bullet kit | Lonza | CC-3162 | Specialized medium for endothelial cells |
| Lipidure | NOF co. | MPC polymer | |
| Matrigel growth factor reduced basement membrane matrix | Corning Inc. | 354230 | |
| Normal Goat Serum (10%) | Thermo Fisher Scientific | 50197Z | |
| Normal human bronchial epithelial cells | Lonza | CC-2541 | |
| SILPOT 184 W/C | Dow Corning Co. | 3255981 | Base resin and catalyst for PDMS |
| SUEX D300 | DJ MicroLaminates, Inc | Thick negative photoresist (thichness: 300 mm) | |
| Triton X-100 (1%) | Thermo Fisher Scientific | HFH10 | |
| Trypsin-EDTA (0.25%) | Thermo Fisher Scientific | 25200056 | |
| TWEEN 20 | Sigma-Aldrich | P9416 |
Referenzen
- Baker, B. M., Chen, C. S. Deconstructing the third dimension - how 3D culture microenvironments alter cellular cues. Journal of Cell Science. 125 (13), 3015-3024 (2012).
- Sasai, Y. Cytosystems dynamics in self-organization of tissue architecture. Nature. 493 (7432), 318-326 (2013).
- Shamir, E. R., Ewald, A. J. Three-dimensional organotypic culture: Experimental models of mammalian biology and disease. Nature Reviews Molecular Cell Biology. 15 (10), 647-664 (2014).
- Frantz, C., Stewart, K. M., Weaver, V. M. The extracellular matrix at a glance. Journal of Cell Science. 123 (24), 4195-4200 (2010).
- Choquet, D., Felsenfeld, D. P., Sheetz, M. P. Extracellular matrix rigidity causes strengthening of integrin- cytoskeleton linkages. Cell. 88 (1), 39-48 (1997).
- Hannezo, E., Prost, J., Joanny, J. -F. Theory of epithelial sheet morphology in three dimensions. Proceedings of the National Academy of Sciences of the United States of America. 111 (1), 27-32 (2014).
- Tawk, M., et al. A mirror-symmetric cell division that orchestrates neuroepithelial morphogenesis. Nature. 446 (7137), 797-800 (2007).
- Eiraku, M., et al. Self-organizing optic-cup morphogenesis in three-dimensional culture. Nature. 472 (7341), 51-58 (2011).
- Zegers, M. M. P., O’Brien, L. E., Yu, W., Datta, A., Mostov, K. E. Epithelial polarity and tubulogenesis in vitro. Trends in Cell Biology. 13 (4), 169-176 (2003).
- Affolter, M., Bellusci, S., Itoh, N., Shilo, B., Thiery, J. P., Werb, Z. Tube or not tube: Remodeling epithelial tissues by branching morphogenesis. Developmental Cell. 4 (1), 11-18 (2003).
- Denk, W., Strickler, J., Webb, W. Two-photon laser scanning fluorescence microscopy. Science. 248 (4951), 73-76 (1990).
- Huisken, J., et al. Optical Sectioning Deep Inside Live Embryos by Selective Plane Illumination Microscopy. Science. , 1007-1009 (2004).
- Hagiwara, M., Kawahara, T., Nobata, R. Tissue in Cube: In Vitro 3D Culturing Platform with Hybrid Gel Cubes for Multidirectional Observations. Advanced Healthcare Materials. 5 (13), 1566-1571 (2016).
- Hagiwara, M., Nobata, R., Kawahara, T. Large Scale Imaging by Fine Spatial Alignment of Multi-Scanning Data with Gel Cube Device. Applied Sciences. 8 (235), (2018).
- Kolesky, D. B., Homan, K. A., Skylar-Scott, M. A., Lewis, J. A. Three-dimensional bioprinting of thick vascularized tissues. Proceedings of the National Academy of Sciences of the United States of America. 113 (12), 3179-3184 (2016).
- Mironov, V., Visconti, R. P., Kasyanov, V., Forgacs, G., Drake, C. J., Markwald, R. R. Organ printing: Tissue spheroids as building blocks. Biomaterials. 30 (12), 2164-2174 (2009).
- Onoe, H., et al. Metre-long cell-laden microfibres exhibit tissue morphologies and functions. Nature Materials. 12 (6), 584-590 (2013).
- Miller, J. S., et al. Rapid casting of patterned vascular networks for perfusable engineered three-dimensional tissues. Nature Materials. 11 (9), 768-774 (2012).
- Hagiwara, M., Nobata, R., Kawahara, T. High repeatability from 3D experimental platform for quantitative analysis of cellular branch pattern formations. Integrative Biology. 10, 306-312 (2018).
- Tainaka, K., et al. Whole-body imaging with single-cell resolution by tissue decolorization. Cell. 159 (4), 911-924 (2014).
- Murray, E., et al. Scalable Proteomic Imaging for High-Dimensional Profiling of Intact Systems. Cell. 163 (6), 1500-1514 (2015).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
ISSN 2578-2614
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten
Wir verwenden Cookies, um Ihre Erfahrung auf unserer Website zu verbessern.
Indem Sie unsere Website weiterhin nutzen oder auf „Weiter“ klicken, stimmen Sie zu, unsere Cookies zu akzeptieren.