Method Article
Обнаружение активности протеаз, флуоресцентный пептид Зимография
В этой статье
Резюме
Здесь мы представляем подробный протокол для модифицированных zymographic техники, в котором флуоресцентные пептиды используются как разложению субстрат вместо родной белков. Электрофорез биологических образцов в флуоресцентные пептидные zymograms позволяет выявлять широкий спектр протеаз, чем предыдущие методы zymographic.
Аннотация
Этот метод предназначен для измерения протеолитической активности сложных биологических образцов. Образцы разделены молекулярный вес с помощью электрофореза через разрешая гель, встроенных с разложению субстрата. Этот метод отличается от традиционных гель Зимография закаленном fluorogenic пептид ковалентно включены в разрешая гель вместо полной длины белков, таких как желатин или казеина. Использование fluorogenic пептидов позволяет прямое обнаружение протеолитической активности без дополнительных шагов окрашивание. Ферменты в биологических образцах расщеплять пептид закаленном fluorogenic, что привело к увеличению в флуоресцировании. Флуоресцентный сигнал в гелях затем образы с сканера стандартные флуоресцентные гель и количественно с помощью денситометрия. Использование пептидов как разложению субстрат существенно расширяет возможных протеаз обнаружению с zymographic методами.
Введение
Гель Зимография — биологические метод, используемый для измерения протеолитической активности в биологических образцах, например жидкости организма или клетки культуры СМИ1,2,3. Образцы разделены их молекулярным весом с электрофорезом через гель полиакриламида, встроенный с разложению субстрата. Общие разложению субстратов включают желатина, казеин, коллагена и эластина, которые были использованы для измерения активности матрицы металлопротеиназ (MMPs) -1, -2, -3, -7, -8, -9 и -11, в дополнение к разнообразным катепсинов1,2 , 4 , 5 , 6 , 7 , 8. после электрофореза, ферменты renatured и деградировать белок в гель. В традиционных гель Зимография гель запачкается с белком красителя, например Кумасси синий, и протеазы деятельность определяется как потери сигнала, т.е. белые полосы (деградации белка) на синем фоне.
Здесь мы описываем протокол для альтернативного метода Зимография геля, в котором разложению субстрата является короткий, fluorogenic пептид ковалентно включены в геле полиакриламида (рис. 1). Замена синтетических пептидов как разложению субстратов позволяет выявлять широкий спектр протеаз по сравнению с традиционными гель Зимография с родной белки9. Ковалентная связь fluorogenic пептид предотвращает пептид диффузии и миграции во время электрофорез с предыдущие методы9,10. Кроме того использование подложке fluorogenic позволяет прямое обнаружение активности протеаз без дополнительных окрашивания и исключения окрашивания шаги. Общая цель этого метода является обнаружение активности протеаз в биологических образцах через ковалентных включение fluorogenic пептидов в зимограммы гели.
протокол
1. Подготовка разрешая слой геля
- Подготовка 10% полиакриламида, решения гелем решения согласно таблице 1. Добавьте Tetramethylethylenediamine (TEMED) и Аммония пероксодисульфат (APS) непосредственно перед заливкой геля, как их дополнение инициирует реакции полимеризации.
- Заполните пустой 1,5 мм мини-гель кассеты половину пути (5 мл) с 10% раствором разрешая гель.
- Добавьте тонкий слой изопропиловый спирт (~ 500 мкл) в верхней части геля полиакриламида производить уровня геля и предотвратить пузыри. Используйте решение оставшихся полиакриламида отслеживать прогресс реакции полимеризации. Когда полностью затвердевшим Полиакриламид в трубе, реакция является полным (~ 40 мин.).
2. Подготовка молекулы компоновщика Azido-PEG3-maleimide
- В то время как первый слой разрешая гель полимеризации, получить комплект azido-PEG3-maleimide из хранения от-20 ° C и позволяют использовать компоненты до комнатной температуры. Есть два компонента в каждом комплекте. 1 флакон содержит Эстер maleimide-NHS, кремовый, серый сплошной. Флакон 2 содержит azido-PEG3-Амин, слегка желтоватый нефти.
Примечание: Авторы предлагают с помощью комплекта azido-PEG3-maleimide 25 мг, как он может храниться только для коротких периодов времени (1-2 часа) при-20 ° C после готовятся, прежде чем он начинает ухудшаться. 25 мг достаточно для производства 10 пептид гели. Использование гелей в течение 3 недель подготовки. - Распустить компоненты 2 флакона в производителя рекомендуется объем диметилсульфоксида (ДМСО) и вихрь 30 s для обеспечения жидкости смешались хорошо.
- Перенесите содержимое 1 флакона в колбу раунд дно чистой, сухой 100 мл, содержащие бар stir.
Примечание: Ополосните колбу с ацетоном и полностью высушите перед использованием, чтобы предотвратить влаги от вмешательства с реакцией. - Сразу вставьте резиновой пробкой перегородки с диафрагмой, которая может прокола со шприцем в горловину колбы. Работайте быстро, чтобы предотвратить проникновение колбу влаги.
- Вставить два 18 калибровочных шприц иглы в диафрагму и подключите один танк инертного газа (например , аргоном). Разрешить инертного газа для заполнения Фляга для 3 мин смесь компонентов флаконы 1 и 2 в атмосфере инертного газа для предотвращения продуктов нежелательные реакции.
Предупреждение: Вторая игла шприца – предоставить отверстие, тем самым позволяя атмосферного воздуха, содержащихся в колбу течь из колбы, как он заполняет с инертным газом. Не забудьте включить отверстие иглы! - Выключить инертного газа и отсоединить его от иглы. С помощью шприца, внедрить полное содержимое флакона 2 в колбу.
- Удаление игл и шприцев и позволяют использовать компоненты смешать 30 мин при комнатной температуре помешивая.
- Снимите резиновую пробку перегородки и передать содержание чистого 5 мл пластиковых пробирок. Azido-PEG3-maleimide раствор необходимо использовать в течение 1 часа при комнатной температуре.
3. Подготовка пептид, урегулировании слой геля
- После того, как первый слой разрешая Гель полимеризуется, слить слой изопропиловый спирт. Промыть в верхней части геля дозирования 1 мл деионизованной воды на вершине гель и затем слейте воду.
- Извлечение тиоловых функционализированных флуоресцентные пептид от-80 ° C для хранения и позволяют разморозить при комнатной температуре.
Примечание: Тиоловых функционализированных пептид может быть подготовлен как описано ранее,11,12. Коммерчески доступные пептиды могут также использоваться, но требуют сложения остатков цистеина терминала для включения maleimide тиоловых нажмите реакции. Распустить пептид запасов концентрацию 10 мм и хранить его на-80 ° C в малых (30 uL) аликвоты ограничить циклов повторных замораживания оттаивания. - Подготовка 10% разрешении гель раствор, содержащий azido-PEG3-maleimide компоновщика молекулы и флуоресцентные пептид согласно таблице 1. Добавьте APS и TEMED непосредственно перед заливкой геля, как их дополнение инициирует реакции полимеризации.
- Заполните половину из оставшейся части гель кассеты (3 мл) с пептида, решении решения гелем.
Примечание: Многослойная разрешая гель подход уменьшает количество пептида и компоновщик, необходимых для каждого геля. Размер слоя разрешая гель пептид может корректироваться чтобы вместить больший диапазон молекулярным весом, при необходимости. - Пипетка тонкий слой изопропиловый спирт (~ 500 мкл) в верхней части геля полиакриламида производить уровня геля и предотвратить пузыри. Используйте решение оставшихся полиакриламида отслеживать прогресс реакции полимеризации. Когда полностью затвердевшим Полиакриламид в трубе, реакция является полным (~ 40 мин.).
Примечание: Флуоресцентные пептида является светочувствительный. Держите гели, покрытые алюминиевой фольги для предотвращения Фотообесцвечивание во время подготовки геля, электрофорез, стирки и развития. - Слить слой изопропанол и промойте в верхней части решения гелем с дейонизированной водой как шаг 3.1 пептида.
- Если использовать гели немедленно, перейдите к шагу 4, иначе, погружайте подготовленный гели в 100 мл 1 x фосфатный буфер (PBS) при 4 ° C в пластиковой коробке, чтобы предотвратить Гели от высыхания. Заверните в алюминиевую фольгу для предотвращения Фотообесцвечивание поле. Гели могут храниться в PBS до 3 недель до использования.
4. Подготовка штабелируя гель
- Приготовляют раствор укладка гель 5% согласно таблице 1. Добавьте APS и TEMED непосредственно перед заливкой геля, как их дополнение инициирует реакции полимеризации.
- Заполните оставшиеся пустую часть кассеты гель (~ 2 мл) с укладки решения гелем.
- Быстро вставить гребень гель 1.5 мм в наложения слоя геля, убедившись, что нет пузырьков остаются ловушке под колодцы. Используйте решение оставшихся полиакриламида отслеживать прогресс реакции полимеризации. Когда полностью затвердевшим Полиакриламид в трубе, реакция является полным (~ 10 мин).
- Аккуратно снимите расческу и ленты из задней части кассеты геля.
5. Подготовка биологических образцов для электрофореза
- Подготовьте кондиционером ячейки СМИ, lysates клетки, ткани гомогенатах и ММП стандартов как описано в других разделах под-сокращение условий2. Не разогревайте образцы.
- К примеру готовят кондиционером ячейки СМИ следующим образом:
- Пластина 40 000 клеток/см2 клетки в 6-ну пластины в культуре средств массовой информации 10% плода бычьим сывороточным (ФБС). Инкубации клеток в камере увлажненные (5% CO2 при 37 ° C) для 24 часов и дать им возможность достичь слияния 70-80%.
Примечание: Если клетки не достигли желаемого confluency после 24 часов, позволяют им расти в культуре средств массовой информации 10% FBS на дополнительные 24 часа. - Вымыть клетки дважды с PBS и добавить 2 мл сыворотки свободной культуры средств массовой информации. Инкубации клеток в камере увлажненные (5% CO2 при 37 ° C) для еще 24 часа.
- С помощью Пипетки серологические, соберите кондиционером СМИ от каждой скважины. Центрифуга для средств массовой информации на 1200 об/мин за 3 минуты, чтобы удалить любой ячейки мусор. Возьмите супернатант и сосредоточиться с использованием 15 мл, 10 кДа молекулярный вес центробежный фильтр отсечки единицы. Центрифуга фильтр единиц на 4000 x g 15 мин в размахивая ротора ведро или 5000 g x 15 мин в фиксированный угол ротора.
Примечание: Этот шаг является необязательным, но может повысить интенсивность протеолитических полос в гелях Зимография пептида. - Передать свежие 1,5 мл пластиковых пробирок концентрированной фильтрата. Алиготе и хранить образцы на-80 ° C до трех циклов замораживания оттаивания.
- Пластина 40 000 клеток/см2 клетки в 6-ну пластины в культуре средств массовой информации 10% плода бычьим сывороточным (ФБС). Инкубации клеток в камере увлажненные (5% CO2 при 37 ° C) для 24 часов и дать им возможность достичь слияния 70-80%.
- Количественно содержание белка, используя assay количественной оценки стандартных протеина (например BCA, Assay Брадфорд, и т.д.).
6. электрофорез биологических образцов в пептидной Зимография гели
- Распустить образцов в буфере выборки обычных Зимография (62,5 мм трис-HCl, pH 6.8, 25% глицерина, 4% SDS, 0,01% бромфеноловый синий). Для образцов клеток и тканей, рекомендуется ~ 30 мкг общего белка в колодец и 50-100 нг белка для СПП стандартов.
- Добавить 400 мл 1 x трис-глицин SDS работает буфер аппарат гель. Нагрузка до 35 мкл пример за хорошо. Выполнение примеров на 120 V на 4 ° C на 1,5 часа или до тех пор, пока молекулярный вес стандартов показывают, что протеаз интерес внутри пептид, урегулировании слой геля (который имеет видимый оранжевого цвета).
Примечание: Большинство равенству и их варианты попадают в диапазон 35-100 кДа. Когда стандартов молекулярный вес указывают, что этих весов находятся в пределах пептид, урегулировании слой геля, электрофореза может быть остановлена. Же принцип может быть применен к другим классам протеаз с известным молекулярным весом. Если есть интерес в обнаружении нескольких протеаз над более широкого круга молекулярным весом, уменьшить размер разрешения слой геля и увеличить размер слоя разрешая гель пептида. - После электрофореза удалите гели из пластиковых кассет и мыть гели три раза за 10 мин при комнатной температуре под нежным агитации в renaturing буфер, содержащий 2,5% Тритон X-100, 1 мкм ZnCl2и 5 мм CaCl2 в 50 мм Трис-HCl, pH 7.5.
- Передача гели для развивающихся буферного раствора, содержащего 1% тритон X-100, 1 мкм ZnCl2 и 5 мм CaCl2 в 50 мм трис-HCl, рН 7,5 на 15 мин заменить с свежие разработки буферного раствора и инкубировать гели при 37 ° C под нежным агитации за 24 часа , убедившись, что гели полностью submersed в решении.
7. изображения пептида Зимография гели
- После 24 часов гели изображения с помощью флуоресцентных гель сканер/формирователь изображений, используя соответствующие фильтры возбуждения и выбросов. К примеру, пептид гели, показано в результатах представительных проспряганное с Fluorescein и были образы с помощью фильтра возбуждения 488 нм и фильтр выбросов 521 Нм. Используя соответствующие фильтры для вашего Флюорофор будет максимально обнаружение протеолитической активности.
Примечание: Изображения также могут быть приняты с гель Тепловизор с УФ transilluminator, часто используется для визуализации гелей ДНК, окрашенных бромидом ethidium. Изображение с помощью transilluminator УФ гели (365 Нм) параметр и фильтр выбросов 590 нм. - Проведение денситометрических оценки группа интенсивности с использованием ImageJ, как описано в других разделах13.
Результаты
Используя метод, описанный здесь, две люминесцентные протеаз разложению пептиды были включены в полиакриламидных гелей: GGPQG↓IWGQK(PEG)2C (сокращенно QGIW на протяжении всего текста и цифр) и GPLA↓CpMeOBzlWARK(PEG)2 C (сокращенно LACW на протяжении всего текста и фигур). ↓ Указывает на сайте расщепления. QGIW является коллаген-я полученные последовательности, предназначен для обнаружения клеточных коллагеназ14. LACW — это последовательность, которая оптимизирована для обнаружения MMP-14 и15MMP-11. Пептиды помечены dabcyl (утоления) и флюоресцеином (Флюорофор) с использованием N-оксисукцинимидного (NHS) - Эстер - Амин химия11. Это может быть трудно развивать новые fluorogenic пептидов, которые имеют достаточное флуоресценции закалки и растворим в стандартные буферы. Таким образом адаптация пептид последовательности из коммерчески доступных флуоресцентные протеазы субстратов включить C терминал хвоща часто является успешная стратегия для разработки новых fluorogenic датчиков. Чтобы продемонстрировать способности пептидной Зимография для разделения смеси комплекс протеаз, кондиционером СМИ была собрана из двух разных рак клеточных линий. HT1080 фибросаркома клетки и клетки аденокарциномы груди MDA-MB-231 были покрытием в СМИ FBS 10% за 24 часа, после чего СМИ был заменен сыворотки свободных СМИ на дополнительные 24 часа. Кондиционерами СМИ образцы были собраны и в основном с помощью 10 кДа молекулярный вес центробежный фильтр отсечки единиц. Содержание белка в СМИ была измерена с помощью стандартного µBCA assay. 30 мкг белка с кондиционером СМИ были electrophoresed. Как позитивные элементы, скважин с типом я бактериальных коллагеназы (100 мкг) или очищенный, активированный MMP-9 (125 нг) также были включены. Гели были инкубировали в течение 24 ч в разработке буфер, чтобы позволить MMP расщепления разложению субстратов в пределах гели (рис. 2) и затем образы. Флуоресцентных изображений показало, что многочисленные группы были видны внутри LACW пептид гели (рисунок 2A14), в то время как только одной группы проявился в пределах QGIW гели (2D рисунок14). По сравнению с желатином Зимография (Рисунок 2 g14) LACW гели смогли обнаружить более протеолитических полос, демонстрируя пептид Зимография способность обнаруживать широкий спектр протеазы присутствует в биологических образцах, чем традиционные методы с использованием родного субстратов.
Чтобы проверить личность визуализированных полосы как равенству, пептид Зимография гели были инкубировали в развитие буфер, содержащий либо 20 мкм GM6001, ингибитор широкого спектра ММП, или 10 мкм E-64, ингибитор общего катепсин. Лечение LACW пептид гели с GM6001 (14Рисунок 2B) уменьшилась интенсивность полос, в то время как лечение с E-64 (рис. 2 c14) имел никакого заметного эффекта. Лечение QGIW пептид гели с GM6001 привели к полной аблации ранее видели полос (2E рисунок14). Как и ожидалось, E-64 не было никакого эффекта (2F рисунок14). В обоих пептид гели GM6001 ингибирует очищенного MMP-9 деятельность, но не влияет на активность бактериальных коллагеназы, далее проверка визуализированного увеличение флуоресценции было результатом протеолитической активности по равенству в рамках испытания биологических образцы.
Для сравнения чувствительности пептид Зимография для текущего золотого стандарта, желатин Зимография, анализ чувствительности был проведен с использованием очищенной, активированные MMP-9. Серийных разведений MMP-9 (1-250 нг) были electrophoresed в LACW, QGIW и желатин Зимография гели (14рис. 3A). После развития и флуоресцентных изображений полоса света были количественно с ImageJ и участки интенсивности нормализованных группы были созданы для вычисления ЕС50 значения концентрация, которая производит 50% от максимального сигнала (рис. 3B 14). LACW пептид гели смогли обнаружить маленьких концентрациях MMP-9, со значением50 EC 17.28 нг, по сравнению с QGIW и желатин zymograms с ценностями 59.50 нг и 31.85 нг, соответственно. Эти данные показывают, что использование пептида Зимография может соответствуют или превышают пределы чувствительности родной субстратов как желатин.
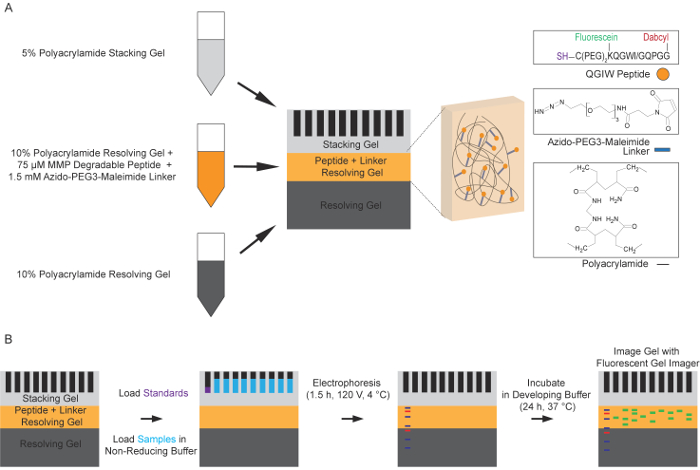
Рисунок 1: схема процесса Зимография флуоресцентные пептид. (A) подготовка многослойных полиакриламида, решения гелем. Стандартная 10% решения гелем решение используется для формирования первый слой геля Зимография пептида. Второе решение 10% гель слой, содержащий закаленных, флуоресцентный пептида и молекула azido-PEG3-maleimide компоновщика затем полимеризуется поверх первого слоя. Последний верхний слой является штабелируя гель 5%. Стандартный электрофореза (B) под-уменьшение условия используется для разделения протеаз содержащих образцы в функционализированных полиакриламидных гелей. Гели промывают удалить SDS и позволить белков на renature. Гели, затем инкубируют в развития буфер для 24 ч при 37 ° C, позволяя протеаз прилепится fluorogenic пептидов, что приводит к увеличению флуоресценции. Этот флуоресценции, соответствует активности протеаз, затем фиксируется с помощью флуоресцентных гель тепловизор возбуждения 488 нм и выбросов 521 Нм (адаптировано с разрешения от биотехнологий и будущее науки14). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 2: обнаружение выделяется ячейка протеаз в человеческих раковых клеток линии. Анализ фермент коллагеназа (100 мкг), ММП-9 (125 нг) и кондиционером СМИ клеток от HT1080 фибросаркома (30 мкг) и MDA-MB-231 аденокарциномы молочной железы рак (30 мкг) клеточные линии в LACW и QGIW пептид гели. Гели были относиться с ДМСО (транспортное средство управления) (A & D), лечение с GM6001 (B и E) или лечение с E-64 (C & F). (G) желатина зимограммы HT1080 и MDA-MB-231 с кондиционером ячейки СМИ (адаптировано с разрешения от биотехнологий и будущее науки14). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
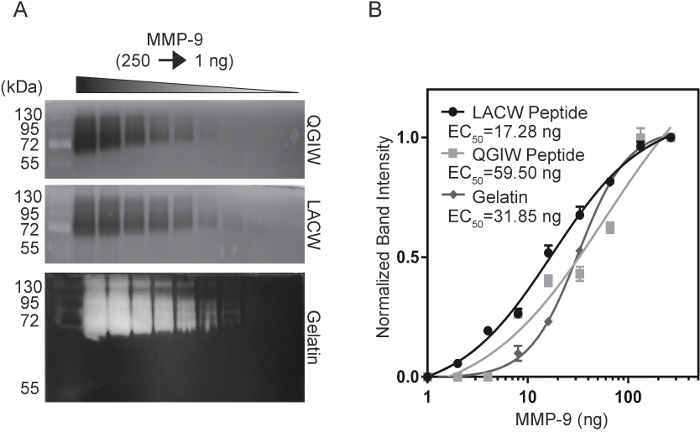
Рисунок 3: сравнение MMP-9 чувствительности пептида и желатин Zymograms. (A) QGIW (вверху), LACW (средний) и желатин (внизу) Зимография гели были подвергнуты серийных разведений MMP-9. (B) нормированный полоса света были заговоре против концентрации ММП-9 и подходят для четыре параметра Переменная наклона кривой. EC50 указывают концентрация на половину максимального сигнала. Результаты представлены как n = 3, означает SD (адаптировано с разрешения от биотехнологий и будущее науки14). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
| Разрешая гель | ||||
| Складе высококонцентрированные | Окончательный высококонцентрированные | 5 гели | 10 гели | |
| Акриламид/Bis акриламида (19:1) | 40% | 10% | 10 мл | 20 мл |
| Трис-HCl рН 8.7 | 1 M | 0,375 М | 15 мл | 30 мл |
| Лаурилсульфат натрия (SDS) | 20% | 0,10% | 200 МКЛ | 400 МКЛ |
| Дейонизированной H2O | -- | -- | 14.4 мл | 28.7 мл |
| TEMED | -- | -- | 40 МКЛ | 80 МКЛ |
| APS | 10% | 0,10% | 400 МКЛ | 800 МКЛ |
| Общий объем | 40 мл | 80 мл | ||
| Разрешая гель пептида | ||||
| Складе высококонцентрированные | Окончательный высококонцентрированные | 5 гели | 10 гели | |
| Акриламид/Bis акриламида (19:1) | 40% | 10% | 5 мл | 10 мл |
| Трис-HCl рН 8.7 | 1 M | 0,375 М | 7,5 мл | 15 мл |
| Лаурилсульфат натрия (SDS) | 20% | 0,10% | 100 МКЛ | 200 МКЛ |
| Дейонизированной H2O | -- | -- | 6,5 МКЛ | 13 мл |
| Флуоресцентный пептида | 10 мм | 75 МКМ | 150 МКЛ | 300 МКЛ |
| Azido-PEG3-Maleimide сшивателя | 75 мм | 1,5 мм | 400 МКЛ | 800 МКЛ |
| TEMED | -- | -- | 20 МКЛ | 40 uL |
| APS | 10 | 0,10% | 200 МКЛ | 400 МКЛ |
| Общий объем | 20 мл | 40 мл | ||
| Штабелируя гель | ||||
| Складе высококонцентрированные | Окончательный высококонцентрированные | 5 гели | 10 гели | |
| Акриламид/Bis акриламида (19:1) | 40% | 5% | 2,5 мл | 5 мл |
| Трис-HCl рН 6.9 | 1 M | 0.125 M | 2,5 мл | 5 мл |
| Лаурилсульфат натрия (SDS) | 20% | 0,10% | 100 МКЛ | 200 МКЛ |
| Дейонизированной H2O | -- | -- | 14.75 мл | 29,5 мл |
| TEMED | -- | -- | 50 МКЛ | 100 МКЛ |
| APS | 10% | 0,10% | 100 МКЛ | 200 МКЛ |
| Общий объем | 20 мл | 40 мл | ||
Таблица 1: Таблица реагентов для приготовления флуоресцентных пептид Зимография гели. Концентрации и томов для приготовления геля Зимография многослойных пептид.
Обсуждение
Современные zymographic методы полагаются на включение родной субстратов в полиакриламидных гелей для обнаружения протеолиза. Хотя эти методы имеют получил широкое применение, они по-прежнему ограничены в количество протеаз, которые они могут обнаружить. Здесь протокол был описан, в которых флуоресцентные, протеаз разложению пептиды включены в разрешении геля полиакриламида. Ковалентного соединения с помощью молекула azido-PEG3-maleimide компоновщика позволяет разделение и обнаружение более широкий спектр протеаз, чем в настоящее время достижим с родной субстратов. Высоко настраиваемый характер флуоресцентные пептиды дает исследователи возможность дизайна субстратов, которые можно ориентировать их протеаз интерес. Широкий спектр протеаз с использованием библиотек пептида были определены многочисленные пептидных субстратов, и существует растущее количество коммерческих источников, производство пользовательских пептидов. Это может быть трудно развивать новые fluorogenic пептидов, которые имеют достаточное флуоресценции закалки и растворим в стандартные буферы. Таким образом адаптация пептид последовательности из коммерчески доступных флуоресцентные протеазы субстратов включить хвоща C-терминал является часто успешную стратегию для разработки новых fluorogenic датчиков.
Завершая этот протокол, следует проявлять осторожность при обработке флуоресцентные пептид гели для предотвращения чрезмерного воздействия света, как это может значительно уменьшить обнаруженных флуоресцентного сигнала. Кроме того текущие концентрация пептида, используемых в каждом гель является 75 мкм. Это может быть изменено для снижения концентрации для сохранения пептид, имея в виду, что раствор azido-PEG3-maleimide необходимо добавить в решение в по крайней мере 20 молярной избыток для пептида. Azido-PEG3-maleimide комплект можно приобрести в 3 размерах (25, 100 и 1000 мг). Авторы рекомендуют покупке комплекта 25 мг как приготовленный раствор может храниться только на короткие периоды времени при температуре-20 ° C. Кроме того набор 25 мг достаточно подготовить 10 пептид гели, которые должны быть использованы в течение 3 недель подготовки.
Одним из ограничений Зимография является трудность в взыскательных точное личность визуализированных протеазы полос из-за значительного дублирования в молекулярной массой. В будущем исследования, он будет иметь решающее значение для проведения дополнительного анализа для определения их идентичности, с использованием таких методов, как масс-спектрометрии16,17. Еще одним ограничением Зимография является, складывая белков для их активной конформации после частичной денатурации SDS и электрофорез. Эти процессы может вызвать изменение в активной конформации протеазы, рендеринга proteolytically неактивных белков, активные. Например, про ММП-2 может быть обнаружен в zymograms желатин, несмотря на то что тормозящий про домен нетронутыми должной к ее выемка для промежуточных активную форму. Дополнительные методы, как энзим соединенный assay иммуносорбента (ELISA) или западных помарок могут использоваться для установления личности и общее наличие протеазы интерес.
Эта статья демонстрирует использование флуоресцентных пептидных субстратов для повышения чувствительности методов текущего zymographic. Использование очищенной MMP-9, был проведен анализ градиент концентрации, сравнивая гели Зимография LACW, QGIW и желатин. В настоящее время, желатин Зимография методика золотой стандарт, который gelatinases в биологических образцах обнаружены (ММП-2 и 9). Сравнение значения50 EC трех субстратов, LACW пептид гели были низкие значения, указывающее высокая чувствительность. Используя последовательности разных пептидных предназначен для обнаружения конкретных протеаз потенциально может улучшить эти чувства еще больше. Лечение гели с ММП активирующего агента например 4-aminophenylmercuric ацетат (APMA) или гепарином может также использоваться для повышения сигнал слишком слабый как описано18.
Помимо измерения активности протеаз биологических исследований протеаз разложению пептиды также часто используются для сшивания синтетических гидрогели для ткани инженерии и наркотиков доставки приложений. Контролируемые деградация имеет решающее значение для этих приложений. В настоящее время кинетика деградации этих пептидов характеризуются с помощью единого, очищенные ферменты. Однако определяя какие ферменты, клетки фактически производят и отвечает за расщепление этих пептидов было трудно определить. Использование пептида Зимография квантифицировать клеток и тканей конкретного фермента релиз значительно поможет в рациональный дизайн этих последовательностей сшивки пептид.
Раскрытие информации
Авторы не имеют ничего сообщать.
Благодарности
Финансирование предоставлено Огайо государственного университета инженерного колледжа, биомедицинская инженерия и всеобъемлющем онкологический центр - Артур G. Джеймс рака больницы и Ричард J. Solove научно-исследовательский институт.
Материалы
| Name | Company | Catalog Number | Comments |
| 1.5 mm Empty Gel Cassettes | ThermoFisher Scientific | NC2015 | |
| 1.5 mm, 10 well Empty Gel Cassette Combs | ThermoFisher Scientific | NC3510 | |
| 1x Phosphate Buffered Saline | Fisher Scientific | 10-010-049 | |
| 20% SDS Solution | Ambion | AM9820 | |
| 3x Zymography Sample Buffer | Bio-Rad | 1610764 | |
| 40% (w/v) Acrylamide/Bis (19:1) | Ambion | AM9022 | |
| 6 Well Tissue Culture Plates | ThermoFisher Scientific | 087721B | |
| Amicon Ultra-2 Centrifugal Filter Unit (10 kDa MWCO) | Sigma-Aldrich | UFC201024 | |
| Ammounium Persulfate | Sigma-Aldrich | A3678 | |
| Azido-PEG3-Maleimide Kit | Click Chemistry Tools | AZ107 | |
| Calcium Chloride | ThermoFisher Scientific | BP510100 | |
| Dimethyl Sulfoxide | Fisher Scientific | BP231 | |
| Isopropanol | Fisher Scientific | A416P | |
| Micro BCA Protein Assay Kit | ThermoFisher Scientific | 23235 | |
| N N N' N'-Tetramethylethylenediamine (TEMED) | Sigma-Aldrich | T9281 | |
| PowerPac Basic Power Supply | Bio-Rad | 1645050 | |
| Precision Plus Protein Dual Color Standard | Bio-Rad | 161-0374 | |
| PrecisionGlide Hypodermic Needles | Fisher Scientific | 14-826 | |
| Round Bottom Flask (100 mL) | Fisher Scientific | 50-873-144 | |
| Septum Rubber Stopper | Fisher Scientific | 50-872-546 | |
| Sterile Slip Tip Syringe (1 mL) | Fisher Scientific | 14-823-434 | |
| Triton X-100 | Sigma-Aldrich | X100 | |
| Trizma hydrochlroide | Sigma-Aldrich | T5941 | |
| Typhoon 9410 Molecular Imager | GE Amersham | 8149-30-9410 | |
| Zinc Chloride | Sigma-Aldrich | 208086 |
Ссылки
- Vandooren, J., Geurts, N., Martens, E., Vanden Steen, P. E., Opdenakker, G. Zymography methods for visualizing hydrolytic enzymes. Nature Methods. 10 (3), 211-220 (2013).
- Toth, M., Fridman, R. Assessment of Gelatinases (MMP-2 and MMP-9) by Gelatin Zymography. Methods in Molecular Medicine. 57, (2001).
- Heussen, C., Dowdle, E. B. Electrophoretic analysis of plasminogen activators in polyacrylamide gels containing sodium dodecyl sulfate and copolymerized substrates. Analytical Biochemistry. 102 (1), 196-202 (1980).
- Gogly, B., Groult, N., Hornebeck, W., Godeau, G., Pellat, B. Collagen zymography as a sensitive and specific technique for the determination of subpicogram levels of interstitial collagenase. Analytical Biochemistry. 255 (2), 211-216 (1998).
- Inanc, S., Keles, D., Oktay, G. An improved collagen zymography approach for evaluating the collagenases MMP-1, MMP-8, and MMP-13. BioTechniques. 63 (4), 174-180 (2017).
- Perera, H. K. I. Detection of Aspartic Proteinase Activities Using Gel Zymography. Zymography. , 43-52 (2017).
- van Beurden, P. A. M. S. noek-, Vonden Hoff, J. W. Zymographic techniques for the analysis of matrix metalloproteinases and their inhibitors. BioTechniques. 38 (1), 73-83 (2005).
- Oliver, G. W., Stetler-Stevenson, W. G., Kleiner, D. E., Zymography, Zymography, Casein Zymography, and Reverse Zymography: Activity Assays for Proteases and their Inhibitors. Proteolytic Enzymes. Springer Lab Manual. , Springer. Berlin, Heidelberg. 63-76 (1999).
- Deshmukh, A. A., Weist, J. L., Leight, J. L. Detection of proteolytic activity by covalent tethering of fluorogenic substrates in zymogram gels. BioTechniques. 64 (5), 203-210 (2018).
- Yasothornsrikul, S., Hook, V. Y. Detection of proteolytic activity by fluorescent zymogram in-gel assays. BioTechniques. 28 (6), 1172-1173 (2000).
- Leight, J. L., Alge, D. L., Maier, A. J., Anseth, K. S. Direct measurement of matrix metalloproteinase activity in 3D cellular microenvironments using a fluorogenic peptide substrate. Biomaterials. 34 (30), 7344-7352 (2013).
- Leight, J. L., Tokuda, E. Y., Jones, C. E., Lin, A. J., Anseth, K. S. Multifunctional bioscaffolds for 3D culture of melanoma cells reveal increased MMP activity and migration with BRAF kinase inhibition. Proceedings of the National Academy of Sciences of the United States of America. 112 (17), 5366-5371 (2015).
- Ren, Z., Chen, J., Khalil, R. A. Zymography as a Research Tool in the Study of Matrix Metalloproteinase Inhibitors. Methods in Molecular Biology. 1626, Clifton, N.J. 79-102 (2017).
- Nagase, H., Fields, G. B. Human matrix metalloproteinase specificity studies using collagen sequence-based synthetic peptide. Biopolymers. 40 (4), 399-416 (1996).
- Mucha, A., et al. Membrane Type-1 Matrix Metalloprotease and Stromelysin-3 Cleave More Efficiently Synthetic Substrates Containing Unusual Amino Acids in Their P1′ Positions. Journal of Biological Chemistry. 273 (5), 2763-2768 (1998).
- Thimon, V., Belghazi, M., Labas, V., Dacheux, J. -L., Gatti, J. -L. One- and two-dimensional SDS-PAGE zymography with quenched fluorogenic substrates provides identification of biological fluid proteases by direct mass spectrometry. Analytical Biochemistry. 375 (2), 382-384 (2008).
- Sun, X., Salih, E., Oppenheim, F. G., Helmerhorst, E. J. Activity-based mass spectrometric characterization of proteases and inhibitors in human saliva. Proteomics. Clinical Applications. 3 (7), 810-820 (2009).
- Yu, W., Woessner, J. F. Heparin-Enhanced Zymographic Detection of Matrilysin and Collagenases. Analytical Biochemistry. 293 (1), 38-42 (2001).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены