Method Article
Rilevazione di attività di proteasi dallo Zymography Peptide fluorescente
In questo articolo
Riepilogo
Qui, presentiamo un protocollo dettagliato per una tecnica di zymographic modificate in cui peptidi fluorescenti vengono utilizzati come substrato degradabile al posto di proteine native. L'elettroforesi dei campioni biologici in zymograms peptide fluorescente consente il rilevamento di una vasta gamma delle proteasi che tecniche zymographic precedenti.
Abstract
Lo scopo di questo metodo è quello di misurare l'attività proteolitica dei campioni biologici complessi. I campioni sono separati dal peso molecolare tramite l'elettroforesi attraverso un gel di risoluzione incorporato con un substrato degradabile. Questo metodo si differenzia dal tradizionale gel zymography in quanto un peptide fluorogenico estiguuto covalentemente incorporò il gel di risoluzione invece di proteine integrale, come gelatina o caseina. Uso dei peptidi fluorogenici consente il rilevamento diretto di attività proteolitica senza ulteriori passaggi di colorazione. Gli enzimi all'interno i campioni biologici fendono il peptide fluorogenico estiguuto, conseguente a un aumento di fluorescenza. Il segnale fluorescente nel gel è allora imaged con uno scanner standard del gel fluorescente e quantificati tramite densitometria. L'uso di peptidi come il substrato degradabile espande notevolmente le possibili proteasi rilevabile con le tecniche di zymographic.
Introduzione
Zymography gel è una tecnica biologica utilizzata per misurare l'attività proteolitica all'interno di campioni biologici, quali fluidi corporei o delle cellule di coltura1,2,3. I campioni sono separati dai loro pesi molecolari con l'elettroforesi attraverso un gel di poliacrilammide incorporato con un substrato degradabile. I substrati degradabili comuni includono gelatina, caseina, collagene ed elastina, che sono stati utilizzati per misurare l'attività delle metalloproteinasi di matrice (MMP) -1, -2, -3, -7, -8, -9 e -11, oltre ad una varietà di catepsine1,2 , 4 , 5 , 6 , 7 , 8. dopo elettroforesi, gli enzimi sono rinaturalizzato e permesso di degradare le proteine all'interno del gel. In zymography tradizionale gel, il gel è colorato con un colorante di proteine, come blu di Coomassie, e l'attività della proteasi è rilevato come una perdita di segnale, cioè, bianco bande (degradazione della proteina) su uno sfondo blu scuro.
Qui, descriviamo un protocollo per un metodo alternativo di gel zymography, in cui il substrato degradabile è un breve, peptide fluorogenico covalentemente incorporato in gel di poliacrilammide (Figura 1). La sostituzione di peptidi sintetici come i substrati degradabile consente il rilevamento di una gamma più ampia di proteasi rispetto al tradizionale gel zymography con proteine native9. Covalente del peptide fluorogenico impedisce la diffusione del peptide e la migrazione durante l'elettroforesi del gel, osservato con precedenti metodi9,10. Inoltre, l'uso di un substrato fluorogenico consente rilevazione diretta delle attività della proteasi senza ulteriori macchiatura e passi de-colorazione. L'obiettivo generale di questo metodo è la rilevazione di attività di proteasi in campioni biologici tramite l'incorporazione covalente di peptidi fluorogenici in gel di zymogram.
Protocollo
1. preparazione di strato di Gel di risoluzione
- Preparare un poliacrilammide 10% Risoluzione soluzione di gel come da tabella 1. Aggiungere il tetrametiletilendiammina (TEMED) e l'ammonio persolfato (APS) immediatamente prima di versare il gel come loro aggiunta avvia la reazione di polimerizzazione.
- Riempire un vassoio del mini-gel vuoto 1,5 mm a metà strada (5 mL) con la soluzione di gel di risoluzione 10%.
- Aggiungere uno strato sottile di isopropanolo (~ 500 µ l) nella parte superiore del gel di poliacrilammide per produrre un livello gel e prevenire bolle. Utilizzare la soluzione di poliacrilammide avanzi per tenere traccia dell'avanzamento della reazione di polimerizzazione. Quando il poliacrilammide nel tubo è completamente solidificato, la reazione è completa (~ 40 min).
2. preparazione della molecola del Linker Azido-PEG3-maleimide
- Mentre il primo strato di gel di risoluzione è polimerizzando, recuperare il kit azido-PEG3-maleimide dallo stoccaggio-20 ° C e lasciare i componenti a temperatura ambiente. Ci sono due componenti in ogni kit. 1 flaconcino contiene un estere di maleimide-NHS, un bianco sporco al grigio solido. Flacone 2 contiene azido-PEG3-ammina, un olio leggermente giallo.
Nota: Gli autori suggeriscono utilizzando il kit di azido-PEG3-maleimide 25 mg come può essere conservato solo per brevi periodi di tempo (1-2 ore) a-20 ° C dopo essere preparati prima che inizia a degradare. 25 mg è sufficiente a produrre 10 peptide gel. Utilizzare gel entro 3 settimane di preparazione. - Sciogliere i componenti del flaconcino 2 nel produttore consigliato volume di solfossido dimetilico (DMSO) e vortex per 30 s per garantire i liquidi sono stati mescolati bene.
- Trasferire il contenuto di 1 fiala in un pallone asciutto 100 mL contenente un'ancoretta.
Nota: Risciacquare il matraccio con acetone e asciugare completamente prima dell'uso per evitare che l'umidità da interferire con la reazione. - Immediatamente inserire un tappo di setto di gomma con un diaframma che può essere perforato con una siringa nella bocca del pallone. Lavorare rapidamente per impedire all'umidità di entrare il pallone.
- Inserisci due 18 gauge siringa aghi nel diaframma e collegare uno ad un serbatoio di gas inerte (ad es. gas argon). Lasciare il gas inerte per riempire il pallone per 3 min Mix i componenti di fiale 1 e 2 sotto gas inerte per evitare che i prodotti di reazione indesiderabile.
Attenzione: Il secondo ago di siringa è quello di fornire uno sfogo, consentendo in tal modo l'aria atmosferica contenuta all'interno della muffola a fluire fuori il pallone come si riempie con gas inerte. Non dimenticate di includere un ago di sfiato! - Chiudere il gas inerte e staccarlo dall'ago. Utilizzando una siringa, iniettare l'intero contenuto del flaconcino 2 nel pallone.
- Rimuovere la siringa e aghi e consentire ai componenti di mescolare per 30 min a temperatura ambiente mescolando.
- Rimuovere il tappo di gomma del setto e trasferire il contenuto in una provetta da centrifuga pulita 5 mL. La soluzione di azido-PEG3-maleimide deve essere utilizzata entro 1 ora a temperatura ambiente.
3. preparazione del Peptide risoluzione strato di Gel
- Una volta che il primo strato di gel di risoluzione ha polimerizzato, versare lo strato di isopropanolo. Sciacquare la parte superiore del gel di pipettaggio 1 mL di acqua deionizzata sulla parte superiore del gel e quindi versare l'acqua.
- Recuperare il peptide fluorescente del tiolo-funzionalizzati da-80 ° C stoccaggio e lasciarlo scongelare a temperatura ambiente.
Nota: Il peptide del tiolo-funzionalizzate possa essere preparato come descritto in precedenza11,12. Commercialmente disponibile peptidi possono anche essere usati ma richiedono l'aggiunta di un residuo di cisteina terminale per abilitare il maleimide-tiolo clicca reazione. Sciogliere il peptide ad una concentrazione stock di 10 mM e conservare a-80 ° C in piccole aliquote (30 uL) per limitare i cicli ripetuti di congelamento-scongelamento. - Preparare un 10% risoluzione dei gel di soluzione contenente la molecola azido-PEG3-maleimide del linker e il peptide fluorescente come da tabella 1. Aggiungere il TEMED e APS immediatamente prima di versare il gel come loro aggiunta avvia la reazione di polimerizzazione.
- Riempire a metà della parte restante del vassoio del gel (3 mL) con il peptide soluzione gel di risoluzione.
Nota: Un approccio di gel di risoluzione multistrato riduce la quantità di peptide e del linker necessario per ogni gel. La dimensione dello strato di gel di risoluzione del peptide può essere regolata per soddisfare un'ampia gamma di pesi molecolari come necessario. - Pipettare un sottile strato di isopropanolo (~ 500 µ l) alla parte superiore del gel di poliacrilammide per produrre un livello gel e prevenire bolle. Utilizzare la soluzione di poliacrilammide avanzi per tenere traccia dell'avanzamento della reazione di polimerizzazione. Quando il poliacrilammide nel tubo è completamente solidificato, la reazione è completa (~ 40 min).
Nota: Il peptide fluorescente è sensibile alla luce. Mantenere i gel coperti con carta stagnola per evitare che photobleaching durante lo sviluppo, l'elettroforesi, lavaggio e preparazione del gel. - Versare lo strato di isopropanolo e sciacquare la parte superiore del peptide risoluzione dei gel con acqua deionizzata come descritto al punto 3.1.
- Se si utilizza il gel immediatamente, procedere al passaggio 4, in caso contrario, immergere i gel preparati in 100 mL di tampone fosfato salino (PBS) a 4 ° C in una scatola di plastica per evitare che il gel secchi: 1x. Avvolgere la scatola in carta stagnola per evitare che photobleaching. Gel possono essere memorizzati in PBS per fino a 3 settimane prima dell'uso.
4. preparazione del Gel d'impilamento
- Preparare una soluzione di gel d'impilamento 5% secondo la tabella 1. Aggiungere il TEMED e APS immediatamente prima di versare il gel come loro aggiunta avvia la reazione di polimerizzazione.
- Riempire la parte vuota rimanente del vassoio del gel (~ 2 mL) con la soluzione di gel di impilamento.
- Inserire rapidamente un pettine di gel di 1,5 mm in strato di gel d'impilamento, assicurandosi che non ci sono bolle rimangono intrappolate sotto i pozzi. Utilizzare la soluzione di poliacrilammide avanzi per tenere traccia dell'avanzamento della reazione di polimerizzazione. Quando il poliacrilammide nel tubo è completamente solidificato, la reazione è completa (~ 10 min).
- Rimuovere delicatamente il pettine e il nastro dal retro del vassoio del gel.
5. preparazione dei campioni biologici per elettroforesi
- Preparare la media condizionato delle cellule, lisati cellulari, omogenati e MMP standard come descritto altrove sotto non riducenti condizioni2. Non riscaldare i campioni.
- Ad esempio, preparare media condizionato delle cellule come segue:
- Cellule a piastra 40.000 cellule/cm2 in una piastra a 6 pozzetti in terreni di coltura di 10% siero bovino fetale (FBS). Incubare le cellule in una camera umidificata (5% CO2 a 37 ° C) per 24 ore e consentire loro di raggiungere la confluenza di 70-80%.
Nota: Se le cellule non hanno raggiunto la confluenza desiderato dopo 24 ore, consentire loro di crescere in terreni di coltura di 10% FBS per altre 24 ore. - Lavare le cellule due volte con PBS e aggiungere 2 mL di terreno di coltura privo di siero. Incubare le cellule in una camera umidificata (5% CO2 a 37 ° C) per altre 24 ore.
- Utilizzando una pipetta sierologica, raccogliere i media condizionati da ciascun pozzetto. Centrifugare i media a 1200 rpm per 3 minuti per rimuovere eventuali detriti cellulari. Prendere il surnatante e concentrarsi utilizzando un 15 mL, filtro centrifugo cutoff peso molecolare 10 kDa. Centrifugare le unità filtro a 4.000 x g per 15 min in un rotore oscillante o 5.000 x g per 15 min in un rotore ad angolo fisso.
Nota: Questo passaggio è facoltativo, ma può migliorare l'intensità delle bande proteolitici nei gel di zymography del peptide. - Trasferire il filtrato concentrato in una provetta da centrifuga fresca 1,5 mL. Aliquotare e conservare i campioni a-80 ° C per fino a tre cicli di gelo-disgelo.
- Cellule a piastra 40.000 cellule/cm2 in una piastra a 6 pozzetti in terreni di coltura di 10% siero bovino fetale (FBS). Incubare le cellule in una camera umidificata (5% CO2 a 37 ° C) per 24 ore e consentire loro di raggiungere la confluenza di 70-80%.
- Quantificare il contenuto di proteine usando un'analisi di quantificazione della proteina standard (ad es. BCA, analisi di Bradford, ecc.).
6. elettroforesi del biologico campioni in Peptide Zymography gel
- Sciogliere i campioni nel buffer del campione convenzionale zymography (62,5 mM Tris-HCl, pH 6.8, 25% glicerolo, 4% SDS, 0,01% bromofenolo). Per i campioni di cellule e tessuti, ~ 30 µ g di proteina totale per pozzetto è raccomandato e 50-100 ng di proteina per gli standard di MMP.
- Aggiungere 400 mL di 1 x Tris-glicina SDS Running Buffer all'apparato di gel. Caricare fino a 35 µ l di campione per pozzetto. Eseguire gli esempi a 120 V a 4 ° C per 1,5 ore o fino a quando gli standard di peso molecolare indicano che le proteasi di interesse sono all'interno del peptide risoluzione strato di gel (che ha un colore arancio visibile).
Nota: La maggior parte delle MMPs e loro varianti cadono all'interno della gamma di 35-100 kDa. Quando gli standard di peso molecolare indicano che quei pesi sono all'interno del peptide risoluzione strato di gel, elettroforesi può essere fermato. Lo stesso principio può essere applicato ad altre classi di proteasi con pesi molecolari noti. Se c'è un interesse nella rilevazione della proteasi più sopra una più vasta gamma di pesi molecolari, ridurre le dimensioni della risoluzione strato di gel e aumentare le dimensioni dello strato di gel di risoluzione del peptide. - A seguito di elettroforesi, rimuovere il gel dalla cassetta plastica e lavare gel tre volte per 10 minuti ciascuno, a temperatura ambiente sotto agitazione delicata in tampone di rinaturazione con 2,5% Triton X-100, 1 µM ZnCl2e 5 mM CaCl2 a 50 mM Tris-HCl, pH 7.5.
- Trasferimento gel per una sviluppo soluzione tampone contenente 1% Triton X-100, 1 µM ZnCl2 e 5 mM CaCl2 a 50 mM Tris-HCl, pH 7.5 per 15 min. Sostituisci con sviluppo fresco soluzione tampone e incubare gel a 37 ° C sotto agitazione delicata per 24 ore , assicurandosi che i gel sono completamente immerso nella soluzione.
7. formazione immagine del Peptide Zymography gel
- Dopo 24 ore, gel di immagine utilizzando un fluorescente gel scanner/imager utilizzando i filtri di eccitazione e di emissione appropriati. Ad esempio, i gel di peptide indicati nei risultati rappresentativi sono coniugati con fluoresceina ed erano imaged utilizzando un filtro di eccitazione di 488 nm e un filtro di emissione di 521 nm. Utilizzando i filtri appropriati per il fluoroforo ci permetterà di ottimizzare il rilevamento di attività proteolitica.
Nota: Immagini possono anche essere preso con un imager di gel con un transilluminatore UV, spesso utilizzato per l'imaging del DNA gel colorato con bromuro di etidio. Immagine del gel utilizzando il transilluminatore UV (365 nm) impostazione e un filtro di emissione di 590 nm. - Condurre la valutazione densitometrica delle intensità di banda usando ImageJ come descritto altrove13.
Risultati
Utilizzando il metodo descritto qui, due peptidi di proteasi-degradabile fluorescenti sono state incorporate in gel di poliacrilammide: GGPQG↓IWGQK(PEG)2C (abbreviato come QGIW in tutto il testo e le figure) e GPLA↓CpMeOBzlWARK(PEG)2 C (abbreviato come LACW in tutto il testo e le figure). ↓ indica il sito di clivaggio. QGIW è un collagene-I derivati sequenza progettato per rilevare le collagenasi cellulare14. LACW è una sequenza che è stata ottimizzata per il rilevamento di MMP-14 e MMP-1115. I peptidi sono etichettati con dabcyl (quencher) e della fluorescina (fluoroforo) utilizzando N-Idrossisuccinimide (NHS) - ester - ammina chimica11. Può essere difficile sviluppare nuovi peptidi fluorogenici che hanno fluorescenza adeguata tempra e sono solubili nei buffer standard. Di conseguenza, adattare sequenze peptidiche da substrati di proteasi fluorescente commercialmente disponibile per includere una cisteina terminale C è spesso una strategia di successo per sviluppare nuovi fluorogenic sensori. Per dimostrare la capacità di zymography del peptide per separare miscele complesse di proteasi, media condizionati è stato raccolto da due linee cellulari tumorali differenti. Cellule di fibrosarcoma HT1080 e cellule dell'adenocarcinoma del seno di MDA-MB-231 erano placcate in media di 10% FBS per 24 ore, dopo di che i media è stato sostituito con terreni privi di siero per altre 24 ore. Media condizionati campioni sono stati raccolti e concentrano con 10 unità di taglio filtro centrifugo peso molecolare kDa. Il contenuto proteico dei media è stato misurato usando un'analisi standard µBCA. 30 µ g di proteina da media condizionati sono stati electrophoresed. Come controlli positivi, wells con tipo I collagenasi batterica (100 µ g) o purificata, attivato MMP-9 (125 ng) inoltre sono stati inclusi. I gel sono stati incubati per 24 h nello sviluppo di buffer per consentire fenditura MMP dei substrati biodegradabili entro i gel (Figura 2) e poi ripreso. Formazione immagine fluorescente ha rivelato che numerose band erano visibili all'interno del gel di peptide LACW (Figura 2A14), mentre solo una singola banda era apparente all'interno gel QGIW (Figura 2D14). In confronto a zymography della gelatina (Figura 2,14), erano in grado di rilevare più bande proteolitici, dimostrando la capacità di rilevare una gamma più ampia di proteasi presenti all'interno di campioni biologici di peptide zymography LACW gel metodi tradizionali utilizzando substrati nativi.
Per verificare l'identità dei gruppi visualizzati come MMPs, gel zymography del peptide sono stati incubati in tampone di sviluppo contenente entrambi 20 µM GM6001, un inibitore MMP ad ampio spettro, o 10 µM E-64, un inibitore della catepsina generale. Trattamento del peptide LACW gel con GM6001 (Figura 2B14) diminuito l'intensità delle bande, mentre il trattamento con E-64 (Figura 214) ha avuto nessun effetto percepibile. Trattamento dei gel del peptide QGIW con GM6001 è provocato da ablazione completa delle bande precedentemente viste (Figura 2E14). Come previsto, è possibile che E-64 non ha avuto alcun effetto (Figura 2F14). In entrambi gel peptide, GM6001 inibita purificato attività di MMP-9 ma non ha influenzato l'attività batterica della collagenosi, ulteriore verifica che l'aumento visualizzato in fluorescenza era un risultato di attività proteolitica di MMPs presenti all'interno della testata biologica campioni.
Per confrontare la sensibilità del peptide zymography all'attuale standard di oro, zymography della gelatina, un'analisi di sensibilità è stata condotta utilizzando purificata, attivato MMP-9. Diluizioni seriali di MMP-9 (1-250 ng) erano electrophoresed in LACW, QGIW e gelatina zymography gel (Figura 3A14). In seguito lo sviluppo e la formazione immagine fluorescente, intensità di banda sono stati quantificati con ImageJ e appezzamenti di intensità normalizzata band sono stati generati per calcolare CE50 valori, la concentrazione che produce il 50% del segnale massimo (Figura 3B 14). LACW peptide gel sono stati in grado di rilevare le più piccole concentrazioni di MMP-9, con un valore di50 CE di 17,28 ng, rispetto ai zymograms QGIW e gelatina con valori di 59.50 ng e 31,85 ng, rispettivamente. Questi dati indicano che l'uso del peptide zymography può eguagliare o superare i limiti di sensibilità del nativi substrati come gelatina.
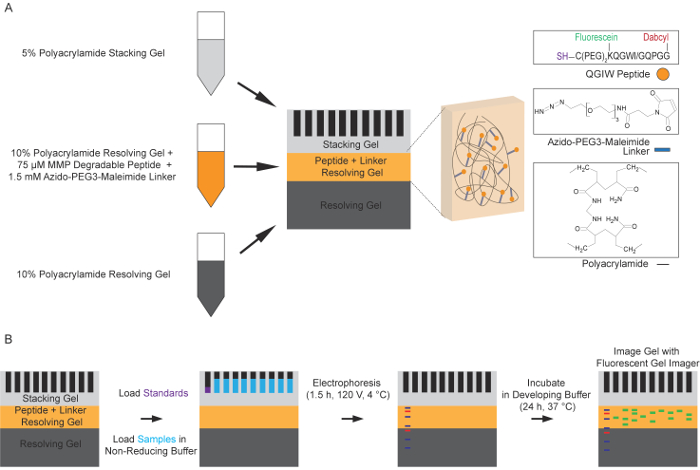
Figura 1: schematica del processo di zymography del peptide fluorescente. (A) preparazione del multistrato poliacrilammide gel di risoluzione. Uno standard 10% soluzione di gel di risoluzione è utilizzato per formare il primo strato del gel di zymography del peptide. Una seconda risoluzione 10% gel livello contenente un peptide bonificato, fluorescente e una molecola del linker azido-PEG3-maleimide quindi viene polimerizzata sopra il primo strato. Lo strato superiore finale è un gel d'impilamento del 5%. (B) elettroforesi Standard sotto non riducenti condizioni viene utilizzato per separare i campioni contenenti proteasi nei gel di poliacrilammide funzionalizzati. I gel sono lavati per rimuovere SDS e consentire le proteine di rinaturazione. I gel sono poi incubati in un buffer di sviluppo per 24 h a 37 ° C, permettendo le proteasi fendere i peptidi fluorogenici, con conseguente aumento della fluorescenza. Questa fluorescenza, corrispondente con l'attività della proteasi, viene catturata utilizzando un gel fluorescente imager a un'eccitazione di 488 nm e l'emissione di 521 nm (adattato con il permesso di Biotechniques e scienza futura14). Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2: rilevazione delle proteasi secrete cellulare nelle linee cellulari tumorali umane. Analisi dell'enzima collagenasi (100 µ g), MMP-9 (125 ng) e condizionata media delle cellule HT1080 fibrosarcoma (30 µ g) e linee cellulari di MDA-MB-231 dell'adenocarcinoma del seno cancro (30 µ g) in gel di peptide LACW e QGIW. Gel sono stati trattati con DMSO (controllo del veicolo) (A & D), trattati con GM6001 (furto con scasso) o trattati con E-64 (C & F). (G) zymogram di gelatina HT1080 e MDA-MB-231 condizionata media delle cellule (adattato con il permesso di Biotechniques e scienza futura14). Clicca qui per visualizzare una versione più grande di questa figura.
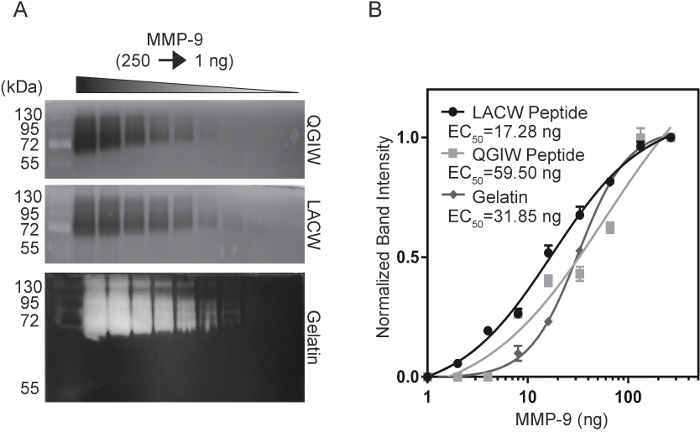
Figura 3: confronto della sensibilità di MMP-9 del Peptide e gelatina Zymograms. (A) QGIW (in alto), LACW (medio) e gel di zymography di gelatina (in basso) sono stati sottoposti a diluizioni seriali di MMP-9. (B) normalizzato banda intensità erano complottato contro concentrazione di MMP-9 e adatta ad una curva di pendenza variabile parametro quattro. CE50 valori indicano la concentrazione a metà il segnale massimo. Risultati sono rappresentati come n = 3, media DS (adattato con il permesso di Biotechniques e scienza futura14). Clicca qui per visualizzare una versione più grande di questa figura.
| Gel di risoluzione | ||||
| Stock conc. | Finale conc. | 5 gel | 10 gel | |
| Acrilammide/Bis-acrilammide (19:1) | 40% | 10% | 10 mL | 20 mL |
| Tris-HCl pH 8.7 | 2. | 0,375 M | 15 mL | 30 mL |
| Sodio dodecil solfato (SDS) | 20% | 0,10% | 200 Μ l | 400 Μ l |
| Deionizzata H2O | -- | -- | 14,4 mL | 28,7 mL |
| TEMED | -- | -- | 40 Μ l | 80 Μ l |
| APS | 10% | 0,10% | 400 Μ l | 800 Μ l |
| Volume totale | 40 mL | 80 mL | ||
| Gel di risoluzione del peptide | ||||
| Stock conc. | Finale conc. | 5 gel | 10 gel | |
| Acrilammide/Bis-acrilammide (19:1) | 40% | 10% | 5 mL | 10 mL |
| Tris-HCl pH 8.7 | 2. | 0,375 M | 7,5 mL | 15 mL |
| Sodio dodecil solfato (SDS) | 20% | 0,10% | 100 Μ l | 200 Μ l |
| Deionizzata H2O | -- | -- | Μ l 6,5 | 13 mL |
| Peptide fluorescente | 10 mM | 75 ΜM | 150 Μ l | 300 Μ l |
| Azido-PEG3-Maleimide reticolante | 75 mM | 1,5 mM | 400 Μ l | 800 Μ l |
| TEMED | -- | -- | 20 Μ l | uL 40 |
| APS | 10 | 0,10% | 200 Μ l | 400 Μ l |
| Volume totale | 20 mL | 40 mL | ||
| Gel d'impilamento | ||||
| Stock conc. | Finale conc. | 5 gel | 10 gel | |
| Acrilammide/Bis-acrilammide (19:1) | 40% | 5% | 2,5 mL | 5 mL |
| Tris-HCl pH 6,9 | 2. | 0,125 M | 2,5 mL | 5 mL |
| Sodio dodecil solfato (SDS) | 20% | 0,10% | 100 Μ l | 200 Μ l |
| Deionizzata H2O | -- | -- | 14,75 mL | 29,5 mL |
| TEMED | -- | -- | 50 Μ l | 100 Μ l |
| APS | 10% | 0,10% | 100 Μ l | 200 Μ l |
| Volume totale | 20 mL | 40 mL | ||
Tabella 1: tabella di reagente per la preparazione del peptide fluorescente gel zymography. Concentrazioni e volumi per la preparazione del gel di zymography del peptide di multi-strato.
Discussione
Le attuali tecniche di zymographic si affidano l'incorporazione di substrati nativi in gel di poliacrilammide per la rilevazione di proteolisi. Mentre queste tecniche hanno raccolto l'uso molto diffuso, sono ancora limitati nel numero di proteasi che sono in grado di rilevare. Qui, un protocollo è stato descritto in quali peptidi fluorescenti, proteasi-degradabile sono incorporate la risoluzione di gel di poliacrilammide. Covalente accoppiamento usando una molecola del linker azido-PEG3-maleimide consente la separazione e l'individuazione di una più ampia varietà di proteasi che è attualmente raggiungibile con substrati nativi. La natura altamente sintonizzabile di peptidi fluorescenti offre ai ricercatori la capacità di progettare substrati che possono essere destinati loro proteasi di interesse. Per un'ampia varietà di proteasi utilizzando librerie peptidiche sono stati individuati numerosi substrati del peptide, e ci sono un numero crescente di fonti commerciali personalizzate peptidi di fabbricazione. Può essere difficile sviluppare nuovi peptidi fluorogenici che hanno fluorescenza adeguata tempra e sono solubili nei buffer standard. Pertanto, adattando commercialmente sequenze peptidiche da substrati di proteasi fluorescente disponibile per includere una cisteina C-terminale è spesso una strategia di successo per sviluppare nuovi fluorogenic sensori.
Durante il completamento di questo protocollo, deve prestare attenzione durante la manipolazione di gel fluorescente del peptide per evitare un'eccessiva esposizione alla luce, come questo può ridurre significativamente il segnale fluorescente rilevato. Inoltre, l'attuale concentrazione del peptide utilizzato in ogni gel è 75 µM. Questo può essere regolato per abbassare le concentrazioni di conservare del peptide, tenendo presente che la soluzione di azido-PEG3-maleimide deve essere aggiunto alla soluzione in almeno un molare 20 in eccesso al peptide. Il kit di azido-PEG3-maleimide possa essere acquistato in 3 dimensioni (25, 100 e 1000 mg). Gli autori raccomandano l'acquisto del kit di 25 mg come soluzione preparata possa essere conservata solo a brevi periodi di tempo a-20 ° C. Inoltre, un kit di 25 mg è sufficiente per preparare 10 gel del peptide, che deve essere utilizzato entro 3 settimane di preparazione.
Uno dei limiti di zymography è la difficoltà nel discernere l'identità esatta di bande di proteasi visualizzati a causa di sovrapposizione significativa in pesi molecolari. In futuro gli studi, sarà fondamentale per condurre analisi secondaria per determinare la propria identità utilizzando tecniche quali la spettrometria di massa16,17. Un'altra limitazione di zymography è il ripiegamento delle proteine alla loro conformazione attiva dopo denaturazione parziale di SDS e l'elettroforesi. Questi processi possono causare un cambiamento nella conformazione attiva della proteasi, rendering di proteine proteolytically inattivi, attivo. Ad esempio, pro-MMP-2 può essere rilevato in zymograms di gelatina pur avendo l'inibitorio Pro-dominio intatto dovuto alla sua rinaturazione di forma intermedia attiva. Metodi supplementari come analisi enzima-collegata dell'immunosorbente (ELISA) o macchie occidentali può essere utilizzate per determinare l'identità e la presenza totale di una proteasi di interesse.
In questo articolo viene illustrato l'utilizzo di substrati del peptide fluorescente per migliorare la sensibilità delle attuali tecniche di zymographic. Utilizzando purificata MMP-9, stata condotta un'analisi di gradiente di concentrazione confrontando LACW, QGIW e gelatina Gel zymography. Zymography della gelatina è attualmente la tecnica gold standard mediante il quale la gelatinasi (MMP-2 e -9) vengono rilevate in campioni biologici. Confrontando i valori di50 CE dei tre substrati, LACW peptide gel aveva i valori più bassi, che indica la sensibilità più alta. Utilizzando sequenze peptidiche differenti progettati per il rilevamento di specifiche proteasi può potenzialmente migliorare ulteriormente queste sensibilità. Trattamento dei gel con un agente d'attivazione di MMP come acetato di 4-aminophenylmercuric (APMA) o eparina può essere utilizzato anche per amplificare un segnale debole come descritto in precedenza18.
Oltre alla misura di attività della proteasi per gli studi biologici, proteasi-degradabile peptidi sono anche spesso utilizzati per reticolazione idrogel sintetico per applicazioni di consegna di droga e ingegneria del tessuto. Degradazione controllata è fondamentale per queste applicazioni. Attualmente, la cinetica di degradazione di questi peptidi sono caratterizzati usando gli enzimi di singoli, purificati. Tuttavia, determinare quali enzimi le cellule in realtà producono e sono responsabili per la scissione di questi peptidi è stato difficile da determinare. L'uso del peptide zymography quantificare delle cellule e rilascio degli enzimi tessuto-specifici aiuterà notevolmente nella progettazione razionale di queste sequenze di reticolazione del peptide.
Divulgazioni
Gli autori non hanno nulla a rivelare.
Riconoscimenti
Finanziamento fornito da The Ohio State University College of Engineering, dipartimento di ingegneria biomedica e il Comprehensive Cancer Center - Arthur G. James Cancer Hospital e Richard J. Solove Research Institute.
Materiali
| Name | Company | Catalog Number | Comments |
| 1.5 mm Empty Gel Cassettes | ThermoFisher Scientific | NC2015 | |
| 1.5 mm, 10 well Empty Gel Cassette Combs | ThermoFisher Scientific | NC3510 | |
| 1x Phosphate Buffered Saline | Fisher Scientific | 10-010-049 | |
| 20% SDS Solution | Ambion | AM9820 | |
| 3x Zymography Sample Buffer | Bio-Rad | 1610764 | |
| 40% (w/v) Acrylamide/Bis (19:1) | Ambion | AM9022 | |
| 6 Well Tissue Culture Plates | ThermoFisher Scientific | 087721B | |
| Amicon Ultra-2 Centrifugal Filter Unit (10 kDa MWCO) | Sigma-Aldrich | UFC201024 | |
| Ammounium Persulfate | Sigma-Aldrich | A3678 | |
| Azido-PEG3-Maleimide Kit | Click Chemistry Tools | AZ107 | |
| Calcium Chloride | ThermoFisher Scientific | BP510100 | |
| Dimethyl Sulfoxide | Fisher Scientific | BP231 | |
| Isopropanol | Fisher Scientific | A416P | |
| Micro BCA Protein Assay Kit | ThermoFisher Scientific | 23235 | |
| N N N' N'-Tetramethylethylenediamine (TEMED) | Sigma-Aldrich | T9281 | |
| PowerPac Basic Power Supply | Bio-Rad | 1645050 | |
| Precision Plus Protein Dual Color Standard | Bio-Rad | 161-0374 | |
| PrecisionGlide Hypodermic Needles | Fisher Scientific | 14-826 | |
| Round Bottom Flask (100 mL) | Fisher Scientific | 50-873-144 | |
| Septum Rubber Stopper | Fisher Scientific | 50-872-546 | |
| Sterile Slip Tip Syringe (1 mL) | Fisher Scientific | 14-823-434 | |
| Triton X-100 | Sigma-Aldrich | X100 | |
| Trizma hydrochlroide | Sigma-Aldrich | T5941 | |
| Typhoon 9410 Molecular Imager | GE Amersham | 8149-30-9410 | |
| Zinc Chloride | Sigma-Aldrich | 208086 |
Riferimenti
- Vandooren, J., Geurts, N., Martens, E., Vanden Steen, P. E., Opdenakker, G. Zymography methods for visualizing hydrolytic enzymes. Nature Methods. 10 (3), 211-220 (2013).
- Toth, M., Fridman, R. Assessment of Gelatinases (MMP-2 and MMP-9) by Gelatin Zymography. Methods in Molecular Medicine. 57, (2001).
- Heussen, C., Dowdle, E. B. Electrophoretic analysis of plasminogen activators in polyacrylamide gels containing sodium dodecyl sulfate and copolymerized substrates. Analytical Biochemistry. 102 (1), 196-202 (1980).
- Gogly, B., Groult, N., Hornebeck, W., Godeau, G., Pellat, B. Collagen zymography as a sensitive and specific technique for the determination of subpicogram levels of interstitial collagenase. Analytical Biochemistry. 255 (2), 211-216 (1998).
- Inanc, S., Keles, D., Oktay, G. An improved collagen zymography approach for evaluating the collagenases MMP-1, MMP-8, and MMP-13. BioTechniques. 63 (4), 174-180 (2017).
- Perera, H. K. I. Detection of Aspartic Proteinase Activities Using Gel Zymography. Zymography. , 43-52 (2017).
- van Beurden, P. A. M. S. noek-, Vonden Hoff, J. W. Zymographic techniques for the analysis of matrix metalloproteinases and their inhibitors. BioTechniques. 38 (1), 73-83 (2005).
- Oliver, G. W., Stetler-Stevenson, W. G., Kleiner, D. E., Zymography, Zymography, Casein Zymography, and Reverse Zymography: Activity Assays for Proteases and their Inhibitors. Proteolytic Enzymes. Springer Lab Manual. , Springer. Berlin, Heidelberg. 63-76 (1999).
- Deshmukh, A. A., Weist, J. L., Leight, J. L. Detection of proteolytic activity by covalent tethering of fluorogenic substrates in zymogram gels. BioTechniques. 64 (5), 203-210 (2018).
- Yasothornsrikul, S., Hook, V. Y. Detection of proteolytic activity by fluorescent zymogram in-gel assays. BioTechniques. 28 (6), 1172-1173 (2000).
- Leight, J. L., Alge, D. L., Maier, A. J., Anseth, K. S. Direct measurement of matrix metalloproteinase activity in 3D cellular microenvironments using a fluorogenic peptide substrate. Biomaterials. 34 (30), 7344-7352 (2013).
- Leight, J. L., Tokuda, E. Y., Jones, C. E., Lin, A. J., Anseth, K. S. Multifunctional bioscaffolds for 3D culture of melanoma cells reveal increased MMP activity and migration with BRAF kinase inhibition. Proceedings of the National Academy of Sciences of the United States of America. 112 (17), 5366-5371 (2015).
- Ren, Z., Chen, J., Khalil, R. A. Zymography as a Research Tool in the Study of Matrix Metalloproteinase Inhibitors. Methods in Molecular Biology. 1626, Clifton, N.J. 79-102 (2017).
- Nagase, H., Fields, G. B. Human matrix metalloproteinase specificity studies using collagen sequence-based synthetic peptide. Biopolymers. 40 (4), 399-416 (1996).
- Mucha, A., et al. Membrane Type-1 Matrix Metalloprotease and Stromelysin-3 Cleave More Efficiently Synthetic Substrates Containing Unusual Amino Acids in Their P1′ Positions. Journal of Biological Chemistry. 273 (5), 2763-2768 (1998).
- Thimon, V., Belghazi, M., Labas, V., Dacheux, J. -L., Gatti, J. -L. One- and two-dimensional SDS-PAGE zymography with quenched fluorogenic substrates provides identification of biological fluid proteases by direct mass spectrometry. Analytical Biochemistry. 375 (2), 382-384 (2008).
- Sun, X., Salih, E., Oppenheim, F. G., Helmerhorst, E. J. Activity-based mass spectrometric characterization of proteases and inhibitors in human saliva. Proteomics. Clinical Applications. 3 (7), 810-820 (2009).
- Yu, W., Woessner, J. F. Heparin-Enhanced Zymographic Detection of Matrilysin and Collagenases. Analytical Biochemistry. 293 (1), 38-42 (2001).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon