Method Article
Erkennung von Protease-Aktivität durch fluoreszierende Peptid Zymography
In diesem Artikel
Zusammenfassung
Hier präsentieren wir Ihnen ein detailliertes Protokoll für eine modifizierte Zymographic-Technik in der fluoreszierenden Peptide als abbaubare Substrat anstelle von native Proteine verwendet werden. Elektrophorese von biologischen Proben in fluoreszierenden Peptid-Zymogramme ermöglicht die Detektion eines breiteren Spektrums von Proteasen als frühere Zymographic Techniken.
Zusammenfassung
Der Zweck dieser Methode ist es, die proteolytische Aktivität von komplexen biologischen Proben zu messen. Die Proben werden durch Molekulargewicht mit Elektrophorese durch eine Lösung von Gel eingebettet mit einem abbaubarem Substrat getrennt. Diese Methode unterscheidet sich von traditionellen Gel Zymography, dass eine abgeschreckt Fluorogenic Peptid in der Lösung von Gel statt voller Länge Proteine, wie Gelatine oder Kasein kovalent eingearbeitet ist. Verwendung der Fluorogenic Peptide ermöglicht direkte Nachweis der proteolytischen Aktivität ohne zusätzliche Färbung Schritte. Enzyme in den biologischen Proben cleave das abgeschreckt Fluorogenic Peptid, was zu einem Anstieg in Fluoreszenz. Das Fluoreszenzsignal in die Gele ist dann mit einem standard Leuchtstofflampen Gel Scanner abgebildet und quantifiziert mit Densitometrie. Die Verwendung von Peptiden als abbaubare Substrat erweitert erheblich die möglichen Proteasen nachweisbar mit Zymographic Techniken.
Einleitung
Gel Zymography ist ein biologischer Verfahren zur Messung der proteolytischen Aktivität in biologischen Proben, z. B. Körperflüssigkeiten oder Zelle Nährmedien1,2,3. Die Proben werden durch ihre Molmassen mit Elektrophorese durch ein Polyacrylamid-Gel eingebettet mit einem abbaubarem Substrat getrennt. Gemeinsamen abbaubaren Substrate enthalten Gelatine, Kasein, Kollagen und Elastin, die verwendet wurden, um die Aktivität von Matrix-Metalloproteinasen (MMPs) -1,-2-3, -7,-8,-9 und-11, neben einer Vielzahl von Cathepsins1,2 messen , 4 , 5 , 6 , 7 , 8. nach Elektrophorese, die Enzyme sind renaturierte und durfte um das Protein innerhalb des Gels zu degradieren. In traditionellen Gel Zymography das Gel wird mit einem Protein-Farbstoff, z. B. Coomassie Blau gefärbt und Protease-Aktivität wird als Verlust des Signals, d. h. weiße Bänder (Abbau von Protein) auf einem dunkelblauen Hintergrund erkannt.
Hier beschreiben wir ein Protokoll für eine alternative Methode der Gel Zymography, in dem das abbaubare Substrat kurzer Fluorogenic Peptid kovalent in das Polyacrylamid-Gel (Abbildung 1) integriert ist. Die Substitution von synthetische Peptide als abbaubare Substrate ermöglicht eine Erfassung von einer breiteren Palette von Proteasen im Vergleich zu traditionellen Gel Zymography mit native Proteine9. Kovalente Bindung des Peptids Fluorogenic verhindert Peptid Verbreitung und Migration während der Gelelektrophorese mit bisherigen Methoden9,10beobachtet. Darüber hinaus ermöglicht die Verwendung eines Substrates Fluorogenic direkte Nachweis der Protease-Aktivität ohne zusätzliche Färbung und de-Färbung Schritte. Das übergeordnete Ziel dieser Methode ist die Erkennung von Protease-Aktivität in biologischen Proben über die kovalente Einbeziehung Fluorogenic Peptide in Zymogram Gele.
Protokoll
1. Vorbereitung der Lösung von Gelschicht
- Bereiten Sie eine 10 %-Polyacrylamid-Gel-Lösung gemäß Tabelle 1zu lösen. Fügen Sie die Tetramethylethylenediamine (TEMED) und Ammonium Bleichen (APS) unmittelbar vor dem Gießen des Gels wie ihre Ergänzung die Polymerisationsreaktion initiiert.
- Füllen Sie eine leere 1,5 mm Mini-Gel Kassette auf halbem Weg (5 mL) mit 10 % ige Lösung von Gel-Lösung.
- Fügen Sie eine dünne Schicht von Isopropanol (~ 500 µL) an die Spitze der Polyacrylamid-Gel zu produzieren eine Ebene Gel und Luftblasen zu verhindern. Verwenden Sie die übrig gebliebenen Polyacrylamid-Lösung, um die Polymerisationsreaktion verfolgen. Wenn das Polyacrylamid in das Rohr vollständig erstarrt ist, ist die Reaktion abgeschlossen (~ 40 min).
2. Vorbereitung des Moleküls Azido-PEG3-Maleimide-Linker
- Während die erste Lösung von Gelschicht dadurch ist, rufen Sie das Azido-PEG3-Maleimide-Kit von-20 ° C Speicher ab und lassen Sie die Komponenten auf Zimmertemperatur kommen. Es gibt zwei Komponenten in jedem Kit. 1 Durchstechflasche enthält eine Maleimide-NHS Ester, eine Weiß-gelbliche grau solide. 2 Fläschchen enthält Azido-PEG3-Amin, ein leicht gelbes Öl.
Hinweis: Die Autoren schlagen mit dem 25 mg-Azido-PEG3-Maleimide-Kit, da es nur für kurze Zeit (1-2 Stunden) gespeichert und kann bei-20 ° C nach vorbereitet, bevor es beginnt zu erniedrigen. 25 mg reicht um 10 Peptid Gele zu produzieren. Verwenden Sie Gele innerhalb von 3 Wochen der Vorbereitung. - Lösen sich die Komponenten der Ampulle 2 in der vom Hersteller empfohlenen Menge Dimethyl Sulfoxid (DMSO) und Vortex für 30 s, um die Flüssigkeiten zu gewährleisten haben gut gemischt worden.
- Übertragen Sie den Inhalt des Fläschchens 1 in einem sauberen, trockenen 100 mL Rundboden Kolben mit Stir Bar.
Hinweis: Spülen Sie die Flasche mit Aceton und lassen Sie vollständig trocknen, vor dem Gebrauch zu verhindern, dass Feuchtigkeit stören die Reaktion. - Legen Sie sofort einen Gummistopfen Septum mit einer Membran, die mit einer Spritze in den Mund des Kolbens punktiert werden kann. Arbeit schnell zu verhindern, dass Feuchtigkeit in die Flasche.
- Legen Sie zwei 18 Gauge Nadeln in die Membrane Spritze und verbinden zu einem inerten Gastank (z.B. Argon-Gas). Lassen Sie dem Edelgas füllen die Flasche für 3 min. Mix Komponenten Fläschchen 1 und 2 unter Schutzgas, unerwünschte Reaktionsprodukte zu verhindern.
Achtung: Die zweite Spritzennadel ist ein Ventil, wodurch der atmosphärischen Luft in die Flasche, aus der Flasche zu fließen, wie es mit Inertgas füllt enthalten. Vergessen Sie nicht, eine Nadel Vent gehören! - Das Inertgas ausschalten und von der Nadel lösen. Mit einer Spritze, den vollständigen Inhalt des Fläschchens 2 Spritzen Sie in den Kolben.
- Entfernen Sie Nadeln und Spritzen zu und lassen Sie die Komponenten für 30 min bei Raumtemperatur unter Rühren mischen.
- Entfernen Sie den Gummistopfen Septum und übertragen Sie den Inhalt auf eine saubere 5 mL Zentrifugenröhrchen. Die Azido-PEG3-Maleimide-Lösung muss innerhalb von 1 Stunde bei Raumtemperatur verwendet werden.
3. Vorbereitung des Peptids Gelschicht zu lösen
- Sobald die erste Lösung von Gelschicht polymerisiert ist, Gießen Sie die Isopropanol-Schicht. Spülen Sie die Spitze des Gels durch Pipettieren 1 mL deionisiertes Wasser oben auf das Gel und dann abgießen.
- Rufen Sie die Thiol-funktionalisiert fluoreszierende Peptid von-80 ° C Speicher ab und lassen Sie es bei Raumtemperatur auftauen.
Hinweis: Die Thiol-funktionalisiert Peptid kann vorbereitet werden, wie oben beschrieben11,12. Kommerziell verfügbare Peptide können auch verwendet werden, sondern erfordern der Zusatz eines terminal Cystein-Rückstands zu ermöglichen, die Maleimide-Thiol klicken Reaktion. Lösen Sie das Peptid Lager Konzentration von 10 mM zu, und bewahren sie bei-80 ° C im kleinen (30 uL) Aliquote, wiederholte Frost-Tau-Wechseln zu begrenzen. - Bereiten Sie eine 10 % Lösung von Gel-Lösung mit dem Azido-PEG3-Maleimide-Linker-Molekül und das fluoreszierende Peptid gemäß Tabelle 1. Fügen Sie die TEMED und APS unmittelbar vor dem Gießen des Gels wie ihre Ergänzung die Polymerisationsreaktion initiiert.
- Füllen Sie die Hälfte des verbleibenden Teils der Gel-Kassette (3 mL) mit das Peptid Gel Lösung zu lösen.
Hinweis: Ein mehrschichtige Lösung von Gel Ansatz reduziert die Menge von Peptid und Linker für jedes Gel erforderlich. Die Größe der die Peptid-Lösung von Gelschicht kann angepasst werden einen größeren Bereich von Molekulargewichten nach Bedarf. - Pipette eine dünne Schicht von Isopropanol (~ 500 µL) an die Spitze der Polyacrylamid-Gel zu produzieren eine Ebene Gel und Luftblasen zu verhindern. Verwenden Sie die übrig gebliebenen Polyacrylamid-Lösung, um die Polymerisationsreaktion verfolgen. Wenn das Polyacrylamid in das Rohr vollständig erstarrt ist, ist die Reaktion abgeschlossen (~ 40 min).
Hinweis: Das fluoreszierende Peptid ist lichtempfindlich. Halten Sie die Gele, abgedeckt mit Alufolie, Immunofluoreszenz während Gel Vorbereitung, Elektrophorese, Wasch- und Entwicklung zu verhindern. - Gießen Sie die Isopropanol-Schicht und spülen Sie die Spitze des Peptids Gel mit entionisiertem Wasser wie in Schritt 3.1 zu lösen.
- Wenn mit der Gele sofort, fahren Sie mit Schritt 4, ansonsten Tauchen Sie die vorbereiteten Gele in 100 mL 1 x Phosphat gepufferte Kochsalzlösung (PBS) bei 4 ° C in einer Plastikbox, die Gele Austrocknen verhindert wird. Wickeln Sie die Box in Alufolie, Immunofluoreszenz zu verhindern. Gele können mit PBS-Puffer für bis zu 3 Wochen vor dem Gebrauch gespeichert werden.
4. Vorbereitung des stapelnden Gels
- Bereiten Sie eine 5 % Stapeln Gel Lösung gemäß Tabelle 1. Fügen Sie die TEMED und APS unmittelbar vor dem Gießen des Gels wie ihre Ergänzung die Polymerisationsreaktion initiiert.
- Füllen Sie den verbleibenden leeren Teil des Gel-Kassette (~ 2 mL) mit Stapeln Gel-Lösung.
- Legen Sie schnell einen 1,5 mm Gel Kamm in Stapeln Gelschicht, sicherstellen, dass keine Luftblasen unter dem Brunnen gefangen bleiben. Verwenden Sie die übrig gebliebenen Polyacrylamid-Lösung, um die Polymerisationsreaktion verfolgen. Wenn das Polyacrylamid in das Rohr vollständig erstarrt ist, ist die Reaktion abgeschlossen (~ 10 min).
- Entfernen Sie vorsichtig den Kamm und das Klebeband von der Rückseite der Kassette Gel.
5. Vorbereitung des biologischen Proben für Elektrophorese
- Bereiten Sie konditionierten Zelle Medien, Zelle Lysates, Gewebe Homogenates und MMP-Standards, wie an anderer Stelle unter nicht-reduzierenden Bedingungen2beschrieben. Erwärmen Sie Proben nicht.
- Zum Beispiel bereiten Sie konditioniert Zelle Medien wie folgt:
- Platte 40.000 Zellen/cm2 Zellen in einem 6-Well-Platte in Kulturmedien 10 % fetalen bovine Serum (FBS). Inkubieren Sie Zellen in eine feuchte Kammer (5 % CO2 bei 37 ° C) für 24 Stunden und es ermöglichen Sie ihnen, Zusammenfluss von 70-80 % zu erreichen.
Hinweis: Wenn die Zellen nicht die gewünschte Konfluenz nach 24 Stunden erreicht haben, können sie für weitere 24 Stunden in 10 % FBS Nährmedien wachsen. - Waschen Sie die Zellen zweimal mit PBS und 2 mL Serum-freie Kultur Medien. Inkubieren Sie die Zellen in eine feuchte Kammer (5 % CO2 bei 37 ° C) für weitere 24 Stunden.
- Mit einer serologischen Pipette, sammeln Sie die konditionierten Medien aus jedem Brunnen. Zentrifugieren Sie die Medien bei 1200 u/min für 3 Minuten, jede Zelle Ablagerungen zu entfernen. Den Überstand und mit einem 15 mL, 10 kDa Molekulargewicht cutoff zentrifugale Filtereinheit. Zentrifugieren Sie die Filtereinheiten an 4.000 x g für 15 min in eine schwingende Eimer Rotor oder 5.000 x g für 15 min in einem festen Winkel Rotor.
Hinweis: Diese Schritt ist optional, jedoch kann die Intensität der proteolytischen Bands die Peptid-Zymography-Gele erhöhen. - Übertragen Sie das konzentrierte Filtrat auf eine frische 1,5 mL Zentrifugenröhrchen. Aliquoten und Store Proben bei-80 ° C für bis zu drei Gefrier-Tau-Zyklen.
- Platte 40.000 Zellen/cm2 Zellen in einem 6-Well-Platte in Kulturmedien 10 % fetalen bovine Serum (FBS). Inkubieren Sie Zellen in eine feuchte Kammer (5 % CO2 bei 37 ° C) für 24 Stunden und es ermöglichen Sie ihnen, Zusammenfluss von 70-80 % zu erreichen.
- Protein-Inhalt mit einem standard Protein Quantifizierung Assay zu quantifizieren (z. B. BCA, Bradford-Test, etc.).
6. Elektrophorese von biologischen Proben in Peptid Zymography Gele
- Proben in konventionellen Zymography Probenpuffer auflösen (62,5 mM Tris-HCl, pH 6,8, 25 % Glycerin, 4 % SDS, 0,01 % Bromophenol blue). Für Zellen und Gewebe Proben, ~ 30 µg des Gesamt-Protein pro Bohrloch wird empfohlen, und 50-100 ng Protein für MMP-Standards.
- Fügen Sie 400 mL 1 x Tris-Glycin SDS laufen Puffer auf den Gel-Apparat. Laden Sie bis zu 35 µL Probe pro Bohrloch. Laufen Sie die Proben bei 120 V bei 4 ° C, 1,5 Stunden oder bis die Molekulargewicht Normen zeigen, dass die Proteasen von Interesse in das Peptid Gelschicht sind (hat eine sichtbare orange Farbe) zu lösen.
Hinweis: Die meisten MMPs und deren Varianten liegen im Bereich von 35-100 kDa. Wenn die Molekulargewicht Standards zeigen, dass diese Gewichte in das Peptid Gelschicht zu lösen sind, kann die Elektrophorese gestoppt werden. Das gleiche Prinzip kann auf andere Klassen von Proteasen mit bekannten Molekulargewichten angewendet werden. Wenn es ein Interesse bei der Aufdeckung von mehreren Proteasen über einen größeren Bereich der Molekulargewichte, reduzieren Sie die Größe der Lösung von Gelschicht und vergrößern Sie die Peptid-Lösung von Gelschicht. - Entfernen Sie nach Elektrophorese die Gele aus Kunststoff Kassette und waschen Sie Gele dreimal für 10 min bei Raumtemperatur unter schonenden rühren in Renaturierungen Puffer mit 2,5 % Triton x-100, 1 µM ZnCl2und 5 mM CaCl2 in 50 mM Tris-HCl, pH 7,5.
- Transfer Gele zu entwickelnden Pufferlösung mit 1 % Triton x-100, 1 µM ZnCl2 und 5 mM CaCl2 in 50 mM Tris-HCl, pH 7,5 für 15 min. ersetzen mit der Entwicklung von frischen Lösung zu puffern und inkubieren Sie Gele bei 37 ° C unter sanften Agitation für 24 Stunden , dafür sorgen die Gele sind vollständig in die Lösung eingetaucht.
7. Darstellung der Peptid-Zymography Gele
- Nach 24 Stunden gel Bild Gele mit einer fluoreszierenden Scanner/Imager entsprechende Anregung und Emission Filter verwenden. Beispielsweise die Peptid-Gele in die repräsentativen Ergebnisse gezeigt werden konjugiert mit Fluorescein und wurden abgebildet mit einem Filter Anregung von 488 nm und eine Emission Filter von 521 nm. Mit den entsprechenden Filtern für Ihre Fluorophor wird der Nachweis der proteolytischen Aktivität maximieren.
Hinweis: Bilder können auch mit einer Gel-Imager, ausgestattet mit einem UV-Transilluminator, oft verwendet für die Darstellung der DNA-Gele mit Interkalation Bromid befleckt getroffen werden. Die Gele mit dem UV-Transilluminator Bild (365 nm) Einstellung und eine Emission Filter von 590 nm. - Führen Sie densitometrischen Auswertung der Band Intensitäten mit ImageJ wie an anderer Stelle13beschrieben.
Ergebnisse
Mit der beschriebenen Methode hier, zwei fluoreszierende Protease-abbaubar Peptide flossen in Polyacrylamid-Gele: GGPQG↓IWGQK(PEG)2C (abgekürzt als QGIW in den Text und Zahlen) und GPLA↓CpMeOBzlWARK(PEG)2 C (abgekürzt als LACW im gesamten Text und Zahlen). ↓ gibt die Site der Spaltung. QGIW ist ein Kollagen-ich abgeleitet Sequenz entwickelt, um zelluläre Collagenases14erkennen. LACW ist eine Sequenz, die für die Erkennung von MMP-14 und MMP-1115optimiert wurde. Die Peptide sind gekennzeichnet mit Dabcyl (Löscher) und Fluorescein (Fluorophor) mit N-Hydroxysuccinimide (NHS) - Ester - Amin Chemie11. Es kann schwierig sein, neue Fluorogenic Peptide zu entwickeln, die haben ausreichende Fluoreszenzlöschung und sind in standard-Puffer löslich. Daher ist die Anpassung der Peptid-Sequenzen aus handelsüblichen Leuchtstoffröhren Protease Substraten eine C-terminal-Cystein enthalten oft eine erfolgreiche Strategie, neue Fluorogenic Sensoren zu entwickeln. Um die Fähigkeit der Peptid-Zymography, komplexen Protease Mischungen zu trennen zu demonstrieren, wurde konditionierte Medien aus zwei verschiedenen Krebszelllinien gesammelt. HT1080 Fibrosarkom und MDA-MB-231 Brust Adenokarzinom Zellen wurden in 10 % FBS Medien für 24 Stunden, vergoldete danach die Medien mit serumfreie Medien für weitere 24 Stunden ersetzt wurde. Konditionierte Medien Proben wurden gesammelt und konzentriert mit 10 kDa Molekulargewicht cutoff-zentrifugale Filtereinheiten. Der Proteingehalt der Medien wurde mit einem standard µBCA-Assay gemessen. 30 µg Protein von konditionierten Medien waren electrophoresed. Als Positivkontrollen, Brunnen mit Typ ich bakterielle Kollagenase (100 µg) oder gereinigt, aktiviert MMP-9 (125 ng) wurden ebenfalls enthalten. Die Gele wurden für 24 h bei der Entwicklung von Puffer erlauben MMP Spaltung der abbaubaren Substrate innerhalb der Gele (Abbildung 2) inkubiert und dann ein Image erstellt. Fluoreszenz-Bildgebung ergab, dass zahlreiche Bands innerhalb der LACW Peptid Gele (Abbildung 2A14), sichtbar waren, während nur ein einzelnes Band innerhalb QGIW Gele (Abb. 2D14) erkennbar war. Im Vergleich zu Gelatine Zymography (Abbildung 2-14) konnten LACW Gele mehr proteolytischen Bands, demonstriert die Fähigkeit der Peptid-Zymography, ein breiteres Spektrum von Proteasen in biologischen Proben als erkennen erkennen traditionelle Methoden mit nativen Substraten.
Um die Identität des visualisierten Bands wie MMPs Peptid Zymography Gele in Entwicklung-Puffer mit entweder 20 µM inkubiert wurden GM6001, ein Ausgedehntspektrum MMP-Hemmer oder 10 µM E-64, eine allgemeine Cathepsin-Inhibitor. Behandlung des Peptids LACW Gele mit GM6001 (Abb. 2 b14) verringert die Intensität der Banden, während der Behandlung mit E-64 (Abbildung 2-14) keine erkennbare Wirkung hatte. Behandlung der QGIW Peptid Gele mit GM6001 führte zu kompletten Ablation der zuvor gesehene Bands (2E Abbildung14). Wie erwartet, E-64 (Abbildung 2F14) wirken sich nicht. In den beiden Peptid-Gelen GM6001 gehemmt gereinigt MMP-9 Aktivität aber nicht auf bakterielle Kollagenase-Aktivität, weiter zu überprüfen, dass die visualisierte Zunahme der Fluoreszenz ein Resultat der proteolytischen Aktivität von MMPs in die geprüfte biologische Proben.
Um die Empfindlichkeit des Peptid-Zymography zum aktuellen Goldstandard, Gelatine Zymography vergleichen wurde eine Sensitivitätsanalyse durchgeführt mit gereinigtem, aktivierte MMP-9. Verdünnungsreihen von MMP-9 (1-250 ng) wurden in den LACW, QGIW und Gelatine Zymography Gelen (Abbildung 3A14) electrophoresed. Nach Entwicklung und Fluoreszenz-Bildgebung Band Intensitäten wurden mit ImageJ quantifiziert und Grundstücke normalisierte Band Intensität wurden erzeugt, um EG50 Werte der Konzentration zu berechnen, die 50 % der maximalen Signal (Abb. 3 b produziert 14). LACW Peptid Gele waren in der Lage zu erkennen, die kleinste Konzentrationen von MMP-9 EG50 Wert von 17,28 ng, im Vergleich zu QGIW und Gelatine Zymogramme mit Werten von 59.50 ng und 31,85 ng, beziehungsweise. Diese Daten deuten darauf hin, dass die Verwendung von Peptid-Zymography kann entsprechen oder die Sensitivitätslimite von nativen Substraten wie Gelatine übertreffen.
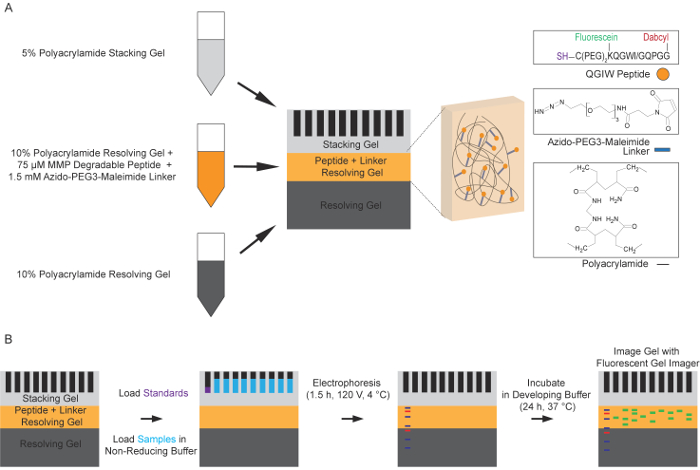
Abbildung 1: Schematische des fluoreszierenden Peptid-Zymography-Prozesses. (A) Vorbereitung der Multi-Layer Polyacrylamid-Gel zu lösen. Standard 10 % Lösung von Gel-Lösung wird verwendet, um die erste Schicht der Peptid-Zymography-Gel zu bilden. Eine zweite Lösung 10 % gel-Layer mit einem abgeschreckt, fluoreszierende Peptid und ein Linker Azido-PEG3-Maleimide-Molekül wird dann auf die erste Schicht polymerisiert. Die endgültige Deckschicht ist ein 5 % Stapeln Gel. (B) Standard Elektrophorese unter nicht-reduzierenden Bedingungen dient zum Trennen von Protease-haltigen Proben in die funktionalisierten Polyacrylamid-Gele. Die Gele sind SDS zu entfernen und damit die Proteine zur Renaturierung gewaschen. Die Gele werden dann in einem Entwicklung-Puffer für 24 h bei 37 ° C, so dass die Proteasen, die Fluorogenic Peptide, wodurch erhöhte Fluoreszenz Spalten inkubiert. Diese Fluoreszenz, Korrespondenz mit Protease-Aktivität ist dann eingefangen mit einer fluoreszierenden Gel-Imager auf eine Anregung von 488 nm und Emission von 521 nm (Adapted mit freundlicher Genehmigung von Biotechniques und Zukunft der Wissenschaft14). Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 2: Erkennung der Zelle sezerniert Proteasen in menschlichen Krebszelllinien. Analyse der Kollagenase Enzym (100 µg), MMP-9 (125 ng) und konditioniert Zelle Medien von HT1080 Fibrosarkom (30 µg) und MDA-MB-231 Adenokarzinom (30 µg) Brustkrebszelllinien in LACW und QGIW-Peptid-Gele. Gele wurden behandelt mit DMSO (Fahrzeugkontrolle) (A & D), mit GM6001 (B & E) behandelt oder mit E-64 (C & F)behandelt. (G) Gelatine Zymogram HT1080 und MDA-MB-231 bedingt Zelle Medien (Adapted mit freundlicher Genehmigung von Biotechniques und Zukunft der Wissenschaft14). Bitte klicken Sie hier für eine größere Version dieser Figur.
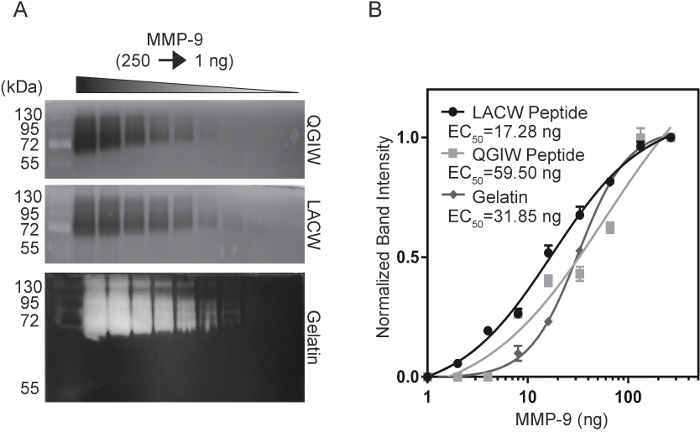
Abbildung 3: Vergleich der MMP-9 Empfindlichkeit des Peptid und Gelatine Zymogramme. (A) QGIW (oben), LACW (Mitte) und Gelatine (unten) Zymography Gele wurden serielle Verdünnungen von MMP-9 unterzogen. (B) normalisierte Band Intensitäten wurden aufgetragen gegen MMP-9 Konzentration und passen zu einer vier Parameter-Variable Steigung-Kurve. EG50 Werte zeigen eine Konzentration auf die Hälfte der maximalen Signal. Ergebnisse werden dargestellt als n = 3, meine SD (Adapted mit freundlicher Genehmigung von Biotechniques und Zukunft der Wissenschaft14). Bitte klicken Sie hier für eine größere Version dieser Figur.
| Gel zu lösen | ||||
| Lager Konz. | Endgültige Konz. | 5 Gele | 10 Gele | |
| Acrylamid/Bis-Acrylamid (19:1) | 40 % | 10 % | 10 mL | 20 mL |
| Tris-HCl pH 8,7 | 1 M | 0,375 M | 15 mL | 30 mL |
| Sodium Dodecyl Sulfat (SDS) | 20 % | 0,10 % | 200 ΜL | 400 ΜL |
| Entionisiertem H2O | -- | -- | 14,4 mL | 28,7 mL |
| TEMED | -- | -- | 40 ΜL | 80 ΜL |
| APS | 10 % | 0,10 % | 400 ΜL | 800 ΜL |
| Gesamtvolumen | 40 mL | 80 mL | ||
| Peptid-Lösung von Gel | ||||
| Lager Konz. | Endgültige Konz. | 5 Gele | 10 Gele | |
| Acrylamid/Bis-Acrylamid (19:1) | 40 % | 10 % | 5 mL | 10 mL |
| Tris-HCl pH 8,7 | 1 M | 0,375 M | 7,5 mL | 15 mL |
| Sodium Dodecyl Sulfat (SDS) | 20 % | 0,10 % | 100 ΜL | 200 ΜL |
| Entionisiertem H2O | -- | -- | 6.5 ΜL | 13 mL |
| Fluoreszierende Peptid | 10 mM | 75 ΜM | 150 ΜL | 300 ΜL |
| Azido-PEG3-Maleimide-Vernetzer | 75 mM | 1,5 mM | 400 ΜL | 800 ΜL |
| TEMED | -- | -- | 20 ΜL | 40 uL |
| APS | 10 | 0,10 % | 200 ΜL | 400 ΜL |
| Gesamtvolumen | 20 mL | 40 mL | ||
| Stapeln von Gel | ||||
| Lager Konz. | Endgültige Konz. | 5 Gele | 10 Gele | |
| Acrylamid/Bis-Acrylamid (19:1) | 40 % | 5 % | 2,5 mL | 5 mL |
| Tris-HCl pH 6,9 | 1 M | 0,125 M | 2,5 mL | 5 mL |
| Sodium Dodecyl Sulfat (SDS) | 20 % | 0,10 % | 100 ΜL | 200 ΜL |
| Entionisiertem H2O | -- | -- | 14,75 mL | 29,5 mL |
| TEMED | -- | -- | 50 ΜL | 100 ΜL |
| APS | 10 % | 0,10 % | 100 ΜL | 200 ΜL |
| Gesamtvolumen | 20 mL | 40 mL | ||
Tabelle 1: Reagenz-Tabelle für die Zubereitung von fluoreszierenden Peptid Zymography Gele. Konzentrationen und Mengen für die Herstellung von mehrschichtigen Peptid Zymography Gel.
Diskussion
Aktuelle Zymographic Techniken beruhen auf dem Einbau von nativen Substraten in Polyacrylamid-Gele für den Nachweis der Proteolyse. Während diese Techniken weit verbreiteten Einsatz angesammelt haben, werden sie noch in der Anzahl der Proteasen beschränkt, die Sie erkennen können. Hier wurde ein Protokoll beschrieben, in welche Leuchtstofflampen, Protease-abbaubar Peptide in der Polyacrylamid-Gel zu lösen integriert sind. Kovalente Kupplung mit ermöglicht ein Linker Azido-PEG3-Maleimide-Molekül die Trennung und Nachweis von einer größeren Vielfalt von Proteasen als derzeit mit nativen Substraten erreichbar ist. Hoch abstimmbaren Artder fluoreszierende Peptide bietet Forscher die Möglichkeit, Substrate zu entwerfen, die ihre Proteasen Interesse ausrichten können. Zahlreiche Peptid Substrate wurden für eine Vielzahl von Proteasen Peptid Bibliotheken verwenden, und es gibt eine wachsende Anzahl von kommerziellen Quellen, die Herstellung von kundenspezifischen Peptide. Es kann schwierig sein, neue Fluorogenic Peptide zu entwickeln, die haben ausreichende Fluoreszenzlöschung und sind in standard-Puffer löslich. Anpassung Peptid Sequenzen aus kommerziell verfügbare fluoreszierende Protease Substrate zu einer C-terminalen Cystein enthalten deshalb oft eine erfolgreiche Strategie, neue Fluorogenic Sensoren zu entwickeln.
Beim Ausfüllen dieses Protokolls, sollte darauf geachtet werden beim Umgang mit fluoreszierenden Peptid Gele, übermäßiger Lichteinwirkung zu verhindern, da dies erkannten Fluoreszenzsignal deutlich reduzieren kann. Darüber hinaus ist die aktuelle Konzentration von Peptid in jedes Gel verwendet 75 µM. Dies kann eingestellt werden, um niedrigere Konzentrationen, Peptid, unter Berücksichtigung, dass die Azido-PEG3-Maleimide-Lösung in mindestens 20 molaren Lösung hinzugefügt werden muss überschüssiges den Peptid zu sparen. Das Azido-PEG3-Maleimide-Kit erhältlich in 3 Größen (25, 100 und 1000 mg). Die Autoren empfehlen die 25 mg-Kit kaufen, da die fertige Lösung nur bei kurzen Zeiträume bei-20 ° c gelagert werden können Darüber hinaus genügt eine Kit 25 mg 10 Peptid Gele vorzubereiten, die innerhalb von 3 Wochen der Vorbereitung verwendet werden muss.
Eine Einschränkung des Zymography ist die Schwierigkeit die genaue Identität der visualisierten Protease Bands durch erhebliche Überschneidungen in Molekulargewichte zu erkennen. In Zukunft werden es Studien, wichtige sekundäre Analysen um ihre Identität mit Techniken wie Massenspektrometrie16,17zu bestimmen. Eine weitere Einschränkung der Zymography ist die Umfaltung von Proteinen zu ihren aktiven Konformation nach teilweisen Denaturierung von SDS und Elektrophorese. Diese Prozesse können eine Änderung in der aktiven Konformation der Protease, Rendern proteolytisch inaktive Proteine, aktive verursachen. Z. B. Pro-MMP-2 in Gelatine-Zymogramme trotz des Habens der hemmenden pro-Domänen intakten Due nachweisbar zu seiner Renaturierung, eine Zwischenform aktiv. Ergänzende Methoden wie Enzym-linked Immunosorbentprobe Assay (ELISA) oder Western Blots kann verwendet werden, um die Identität und die totale Präsenz eine Protease von Interesse zu bestimmen.
Dieser Artikel beschreibt die Verwendung von fluoreszierenden Peptid Substrate für die Verbesserung der Empfindlichkeit des aktuellen Zymographic Techniken. Mit gereinigten MMP-9, wurde ein Konzentrationsgradient durchgeführt LACW, QGIW und Gelatine Zymography Gele zu vergleichen. Derzeit ist Gelatine Zymography Gold-Standard-Technik, die Gelatinases (MMP-2 und-9) in biologischen Proben erkannt werden. Vergleicht man die EG-50 -Werte der drei Substrate, hatte LACW Peptid Gele die niedrigsten Werte angibt die höchste Empfindlichkeit. Unter Verwendung verschiedener Peptid-Sequenzen zur Erkennung von spezifischen Proteasen kann möglicherweise diese Empfindlichkeiten noch weiter verbessern. Behandlung der Gele mit MMP aktivierende Vermittler wie 4-Aminophenylmercuric-Acetat (APMA) oder Heparin kann auch verwendet werden, um ein schwaches Signal als zuvor beschriebenen18zu steigern.
Neben der Messung der Protease-Aktivität für biologische Studien dienen Protease-abbaubar Peptide auch oft Vernetzung synthetischen Hydrogelen für Gewebe-Engineering und Arzneimittel-Lieferung-Applikationen. Kontrollierten Abbau ist von entscheidender Bedeutung für diese Anwendungen. Derzeit die Abbau-Kinetik dieser Peptide zeichnen sich mit einzelnen, gereinigten Enzyme. Bestimmen, welche Enzyme Zellen tatsächlich produzieren und sind verantwortlich für die Spaltung dieser Peptide ist jedoch schwierig zu bestimmen gewesen. Die Verwendung von Peptid-Zymography, Zelle und Gewebe-spezifische Enzymfreisetzung quantifizieren wird stark in die rationale Gestaltung dieser Peptid-Vernetzung-Sequenzen unterstützen.
Offenlegungen
Die Autoren haben nichts preisgeben.
Danksagungen
Gefördert von der Ohio State University College of Engineering, Biomedical Engineering-Abteilung und dem Comprehensive Cancer Center - Arthur G. James Cancer Hospital und Richard J. Solove Research Institute.
Materialien
| Name | Company | Catalog Number | Comments |
| 1.5 mm Empty Gel Cassettes | ThermoFisher Scientific | NC2015 | |
| 1.5 mm, 10 well Empty Gel Cassette Combs | ThermoFisher Scientific | NC3510 | |
| 1x Phosphate Buffered Saline | Fisher Scientific | 10-010-049 | |
| 20% SDS Solution | Ambion | AM9820 | |
| 3x Zymography Sample Buffer | Bio-Rad | 1610764 | |
| 40% (w/v) Acrylamide/Bis (19:1) | Ambion | AM9022 | |
| 6 Well Tissue Culture Plates | ThermoFisher Scientific | 087721B | |
| Amicon Ultra-2 Centrifugal Filter Unit (10 kDa MWCO) | Sigma-Aldrich | UFC201024 | |
| Ammounium Persulfate | Sigma-Aldrich | A3678 | |
| Azido-PEG3-Maleimide Kit | Click Chemistry Tools | AZ107 | |
| Calcium Chloride | ThermoFisher Scientific | BP510100 | |
| Dimethyl Sulfoxide | Fisher Scientific | BP231 | |
| Isopropanol | Fisher Scientific | A416P | |
| Micro BCA Protein Assay Kit | ThermoFisher Scientific | 23235 | |
| N N N' N'-Tetramethylethylenediamine (TEMED) | Sigma-Aldrich | T9281 | |
| PowerPac Basic Power Supply | Bio-Rad | 1645050 | |
| Precision Plus Protein Dual Color Standard | Bio-Rad | 161-0374 | |
| PrecisionGlide Hypodermic Needles | Fisher Scientific | 14-826 | |
| Round Bottom Flask (100 mL) | Fisher Scientific | 50-873-144 | |
| Septum Rubber Stopper | Fisher Scientific | 50-872-546 | |
| Sterile Slip Tip Syringe (1 mL) | Fisher Scientific | 14-823-434 | |
| Triton X-100 | Sigma-Aldrich | X100 | |
| Trizma hydrochlroide | Sigma-Aldrich | T5941 | |
| Typhoon 9410 Molecular Imager | GE Amersham | 8149-30-9410 | |
| Zinc Chloride | Sigma-Aldrich | 208086 |
Referenzen
- Vandooren, J., Geurts, N., Martens, E., Vanden Steen, P. E., Opdenakker, G. Zymography methods for visualizing hydrolytic enzymes. Nature Methods. 10 (3), 211-220 (2013).
- Toth, M., Fridman, R. Assessment of Gelatinases (MMP-2 and MMP-9) by Gelatin Zymography. Methods in Molecular Medicine. 57, (2001).
- Heussen, C., Dowdle, E. B. Electrophoretic analysis of plasminogen activators in polyacrylamide gels containing sodium dodecyl sulfate and copolymerized substrates. Analytical Biochemistry. 102 (1), 196-202 (1980).
- Gogly, B., Groult, N., Hornebeck, W., Godeau, G., Pellat, B. Collagen zymography as a sensitive and specific technique for the determination of subpicogram levels of interstitial collagenase. Analytical Biochemistry. 255 (2), 211-216 (1998).
- Inanc, S., Keles, D., Oktay, G. An improved collagen zymography approach for evaluating the collagenases MMP-1, MMP-8, and MMP-13. BioTechniques. 63 (4), 174-180 (2017).
- Perera, H. K. I. Detection of Aspartic Proteinase Activities Using Gel Zymography. Zymography. , 43-52 (2017).
- van Beurden, P. A. M. S. noek-, Vonden Hoff, J. W. Zymographic techniques for the analysis of matrix metalloproteinases and their inhibitors. BioTechniques. 38 (1), 73-83 (2005).
- Oliver, G. W., Stetler-Stevenson, W. G., Kleiner, D. E., Zymography, Zymography, Casein Zymography, and Reverse Zymography: Activity Assays for Proteases and their Inhibitors. Proteolytic Enzymes. Springer Lab Manual. , Springer. Berlin, Heidelberg. 63-76 (1999).
- Deshmukh, A. A., Weist, J. L., Leight, J. L. Detection of proteolytic activity by covalent tethering of fluorogenic substrates in zymogram gels. BioTechniques. 64 (5), 203-210 (2018).
- Yasothornsrikul, S., Hook, V. Y. Detection of proteolytic activity by fluorescent zymogram in-gel assays. BioTechniques. 28 (6), 1172-1173 (2000).
- Leight, J. L., Alge, D. L., Maier, A. J., Anseth, K. S. Direct measurement of matrix metalloproteinase activity in 3D cellular microenvironments using a fluorogenic peptide substrate. Biomaterials. 34 (30), 7344-7352 (2013).
- Leight, J. L., Tokuda, E. Y., Jones, C. E., Lin, A. J., Anseth, K. S. Multifunctional bioscaffolds for 3D culture of melanoma cells reveal increased MMP activity and migration with BRAF kinase inhibition. Proceedings of the National Academy of Sciences of the United States of America. 112 (17), 5366-5371 (2015).
- Ren, Z., Chen, J., Khalil, R. A. Zymography as a Research Tool in the Study of Matrix Metalloproteinase Inhibitors. Methods in Molecular Biology. 1626, Clifton, N.J. 79-102 (2017).
- Nagase, H., Fields, G. B. Human matrix metalloproteinase specificity studies using collagen sequence-based synthetic peptide. Biopolymers. 40 (4), 399-416 (1996).
- Mucha, A., et al. Membrane Type-1 Matrix Metalloprotease and Stromelysin-3 Cleave More Efficiently Synthetic Substrates Containing Unusual Amino Acids in Their P1′ Positions. Journal of Biological Chemistry. 273 (5), 2763-2768 (1998).
- Thimon, V., Belghazi, M., Labas, V., Dacheux, J. -L., Gatti, J. -L. One- and two-dimensional SDS-PAGE zymography with quenched fluorogenic substrates provides identification of biological fluid proteases by direct mass spectrometry. Analytical Biochemistry. 375 (2), 382-384 (2008).
- Sun, X., Salih, E., Oppenheim, F. G., Helmerhorst, E. J. Activity-based mass spectrometric characterization of proteases and inhibitors in human saliva. Proteomics. Clinical Applications. 3 (7), 810-820 (2009).
- Yu, W., Woessner, J. F. Heparin-Enhanced Zymographic Detection of Matrilysin and Collagenases. Analytical Biochemistry. 293 (1), 38-42 (2001).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten