Method Article
זיהוי של פרוטאז פעילות על-ידי ניאון פפטידים Zymography
In This Article
Summary
כאן, אנו מציגים פרוטוקול מפורט עבור טכניקה שונה zymographic שבו ניאון פפטידים משמשים את המצע מתכלה במקום חלבונים מקורית. אלקטרופורזה של דגימות ביולוגיות בפפטיד פלורסנט zymograms מאפשר זיהוי של מגוון רחב יותר של פרוטאזות מאשר טכניקות zymographic הקודם.
Abstract
מטרת שיטה זו היא למדוד את הפעילות הפרוטאוליטי של דגימות ביולוגיות מורכבות. הדגימות מופרדים באמצעות משקל מולקולרי באמצעות אלקטרופורזה באמצעות ג'ל פתרון מוטבע עם מצע מתכלה. שיטה זו שונה zymography ג'ל מסורתיות בכך fluorogenic מתרצה פפטיד הוא שולב covalently הג'ל פתרון במקום חלבונים באורך מלא, כגון ג'לטין או קזאין. השימוש פפטידים fluorogenic מאפשרת זיהוי ישיר של פעילות הפרוטאוליטי ללא שלבים נוספים מוכתמים. אנזימים בתוך דגימות ביולוגיות קליב פפטיד fluorogenic מתרצה, וכתוצאה מכך עלייה בזריחה. האות פלורסנט, ג'לים ולאחר מכן עם תמונה עם סורק ג'ל פלורסנט רגיל, לכמת באמצעות densitometry. השימוש של פפטידים המצע מתכלה מאוד מרחיבה של פרוטאזות אפשרי לזיהוי בטכניקות zymographic.
Introduction
ג'ל zymography היא טכניקה ביולוגי למדידת פעילות הפרוטאוליטי בתוך דגימות ביולוגיות, כגון נוזלי הגוף או תא תרבות המדיה1,2,3. הדגימות מופרדים באמצעות משקולות מולקולרית שלהם עם אלקטרופורזה באמצעות ג'ל לזיהוי מוטבע עם מצע מתכלה. מצעים מתכלה נפוצים כוללים ג'לטין, קזאין, קולגן ואלסטין, אשר שימשו כדי למדוד את הפעילות של מטריקס metalloproteinases (MMPs)-1,-2,-3,-7, -8,-9 ו-11, בנוסף למגוון cathepsins1,2 , 4 , 5 , 6 , 7 , 8. לאחר אלקטרופורזה, האנזימים renatured הינם מותרות כדי להשפיל את החלבון בתוך הג'ל. Zymography ג'ל מסורתיים, הג'ל הוא מוכתם צבע חלבון, כגון כחול Coomassie, ולאחר פעילות פרוטאז מתגלה כמו איבוד אות, קרי, לבנים להקות (השפלה של חלבון) על רקע כחול כהה.
כאן, אנו מתארים את פרוטוקול עבור שיטה חלופית zymography ג'ל, שבו המצע מתכלה הוא קצר, פפטיד fluorogenic covalently שולבו הג'ל לזיהוי (איור 1). ההחלפה של peptides סינתטי בשם דיאלקטריים מתכלה מאפשר זיהוי של מגוון רחב יותר של פרוטאזות לעומת zymography ג'ל מסורתי עם חלבונים מקורית9. להצמדת קוולנטיות פפטיד fluorogenic מונע פעפוע פפטיד והעברה במהלך בג'ל נצפתה עם שיטות קודמות9,10. יתר על כן, השימוש של מצע fluorogenic מאפשרת זיהוי ישיר של פעילות פרוטאז מבלי להכתים נוספים וצעדים מבטל את ההגדלה. המטרה הכוללת של שיטה זו היא הגילוי של פעילות פרוטאז דגימות ביולוגיות באמצעות שיתוף קוולנטיות פפטידים fluorogenic zymogram ג'ל.
Protocol
1. הכנת שכבת ג'ל פתרון
- להכין לזיהוי של 10% פתרון פתרון ג'ל לפי טבלה 1. הוסף את Tetramethylethylenediamine (TEMED) ואת אמוניום Persulfate (APS) מייד לפני לשפוך את הג'ל כמו תוספת שלהם יוזם התגובה הפילמור.
- למלא קלטת מיני ג'ל של ריק 1.5 מ מ בחצי הדרך (5 מ"ל) הפתרון ג'ל פתרון 10%.
- הוסף שכבה דקה של אלכוהול איזופרופיל (~ 500 µL) לחלק העליון של הג'ל לזיהוי לייצר ג'ל ברמה, למנוע בועות. השתמש הפתרון לזיהוי שאריות כדי לעקוב אחר ההתקדמות של התגובה הפילמור. כאשר לזיהוי בצינור לחלוטין התחזק, התגובה היא מלאה (~ 40 דקות).
2. הכנת המולקולה מקשר Azido-PEG3-maleimide
- ואילו השכבה ג'ל פתרון הראשונה היא polymerizing, לאחזר את ערכת azido-PEG3-maleimide אחסון-20 ° C ולאפשר המרכיבים לטמפרטורת החדר. ישנם שני מרכיבים כל ערכה. מבחנה 1 מכיל של אסתר maleimide-NHS, בצבע אופ-וייט גריי מוצק. בקבוקון 2 מכיל azido-PEG3-אמין, שמן מעט צהבהב.
שים לב: המחברים מציע באמצעות ערכת azido-PEG3-maleimide 25 מ ג כפי ניתן לאחסן רק לפרקי זמן קצרים של זמן (1-2 שעות) ב-20 ° C אחרי הכנה לפני שזה מתחיל להתפורר. 25 מ ג מספיקה לייצר 10 פפטיד ג'לים. השתמש ג'לים בתוך 3 שבועות של הכנה. - להמיס את הרכיבים של מבחנה 2 היצרן מומלצת כמות דימתיל סולפוקסיד (דימתיל סולפוקסיד) ואת מערבולת ב-30 s כדי להבטיח לו נוזלים יש מספר טוב.
- העברת תכולת הבקבוקון 1 לתוך בקבוקון סיבוב למטה נקי, יבש 100 מל המכילה בר מערבבים.
הערה: יש לשטוף את הבקבוק עם אצטון, להתייבש לחלוטין לפני השימוש כדי למנוע לחות מתנגש עם התגובה. - מיד להוסיף פקק מחצה גומי עם הדיאפרגמה זה יכול להיות ניקב בעזרת מזרק לתוך הפה של הבקבוק. לעבוד מהר כדי למנוע לחות להזין את הבקבוקון.
- הוספת שני 18 מד מזרק מחטים לתוך הסרעפת וחבר אחד מיכל גז אינרטי (למשל גז ארגון). לאפשר גז אינרטי כדי למלא את הבקבוק במשך 3 דקות לערבב את הרכיבים של בקבוקונים 1 ו- 2 תחת גז אינרטי כדי למנוע תגובה לא רצויה מוצרים.
התראה: מחט מזרק השני נועד לספק אוורור, ובכך לאפשר את האוויר האטמוספרי הכלול בתוך הבקבוק לזרום מתוך הבקבוק כפי הוא ממלא גז אינרטי. אל תשכח לכלול מחט פתח! - מכבים את הגז אינרטי תוך הפרדתה של המחט. באמצעות מזרק, להזריק את התוכן המלא של מבחנה 2 לתוך הבקבוק.
- הסר מחטים והן מזרק ולאפשר את הרכיבים לערבב למשך 30 דקות בטמפרטורת החדר תוך כדי ערבוב.
- הסר את פקק הגומי מחצה ולהעביר את התוכן שפופרת צנטרפוגה נקיים מ. הפתרון azido-PEG3-maleimide יש להשתמש בתוך שעה בטמפרטורת החדר.
3. הכנת פפטיד לפתרון שכבת ג'ל
- לאחר השכבה הראשונה ג'ל פתרון כולל polymerized, יוצקים את השכבה אלכוהול איזופרופיל. לשטוף את החלק העליון של הג'ל על ידי pipetting 1 מ"ל של מים יונים על גג הג'ל, ואז לשפוך את המים.
- לאחזר את פפטיד פלורסנט תיול-functionalized-80 ° C אחסון ולאפשר להפשיר בטמפרטורת החדר.
הערה: פפטיד תיול-functionalized ניתן להכין כפי שתואר לעיל11,12. פפטידים זמינים מסחרית יכול לשמש גם אבל דורשים התוספת של משקע ציסטאין מסוף כדי לאפשר את maleimide-תיול לחץ על התגובה. להמיס את פפטיד כדי ריכוז מניות של 10 מ מ ואחסן אותו ב-80 מעלות צלזיוס ב aliquots קטן (30 uL) להגבלת מחזורים ההקפאה חוזרות ונשנות-הפשרה. - הכינו 10% פתרון פתרון ג'ל המכיל את המולקולה azido-PEG3-maleimide מקשר את פפטיד פלורסנט לפי טבלה 1. הוסף את TEMED ואת APS מייד לפני לשפוך את הג'ל כמו תוספת שלהם יוזם התגובה הפילמור.
- ממלאים חצי החלק הנותר של קלטת ג'ל (3 מ ל) פפטיד פתרון פתרון ג'ל.
הערה: בגישה ג'ל פתרון רב-שכבתית מפחיתה את כמות פפטיד, מקשר הכרחי עבור כל ג'ל. יכול להיות מותאם לגודל השכבה ג'ל פפטיד פתרון כדי להתאים מגוון גדול יותר של משקולות מולקולרית כנדרש. - Pipette שכבה דקה של אלכוהול איזופרופיל (~ 500 µL) לחלק העליון של הג'ל לזיהוי לייצר ג'ל ברמה, למנוע בועות. השתמש הפתרון לזיהוי שאריות כדי לעקוב אחר ההתקדמות של התגובה הפילמור. כאשר לזיהוי בצינור לחלוטין התחזק, התגובה היא מלאה (~ 40 דקות).
הערה: פפטיד פלורסנט הוא רגיש אור. שמור את ג'לים מכוסה ברדיד אלומיניום, כדי למנוע photobleaching במהלך הכנת ג'ל אלקטרופורזה, כביסה, פיתוח. - יוצקים את השכבה אלכוהול איזופרופיל ולשטוף העליון של פפטיד פתרון ג'ל עם מים יונים כמו שלב 3.1.
- אם משתמש את ג'ל באופן מיידי, להמשיך לשלב 4, אחרת, לטבול את ג'לים מוכן ב- 100 מ של 1 x buffered פוספט תמיסת מלח (PBS) ב 4 ° C בתוך קופסת פלסטיק כדי למנוע את ג'לים ממנו להתייבש. לעטוף את תיבת בנייר אלומיניום כדי למנוע photobleaching. ג'לים ניתן לאחסן PBS עד 3 שבועות לפני השימוש.
4. הכנה של הג'ל הערימה
- להכין פתרון ג'ל הערימה 5% לפי טבלה 1. הוסף את TEMED ואת APS מייד לפני לשפוך את הג'ל כמו תוספת שלהם יוזם התגובה הפילמור.
- למלא את החלק הריק הנותר של קלטת ג'ל (~ 2 מ"ל) הפתרון ג'ל הערימה.
- להוסיף במהירות מסרק ג'ל 1.5 מ מ אל שכבת ג'ל הערמה, מוודא שאין בועות נשארים לכודים תחת הבארות. השתמש הפתרון לזיהוי שאריות כדי לעקוב אחר ההתקדמות של התגובה הפילמור. כאשר לזיהוי בצינור לחלוטין התחזק, התגובה היא מלאה (~ 10 דקות).
- הסר בעדינות את המסרק, והקלטת מהחלק האחורי של קלטת ג'ל.
5. הכנה של דגימות ביולוגיות אלקטרופורזה
- להכין מדיה תאים ממוזגים, lysates תא, רקמה homogenates ותקני MMP כמתואר תחת תנאים שאינם בהפחתת2. לא לא מחממים את הדגימות.
- לדוגמה, להכין מדיה תאים ממוזגים כמפורט להלן:
- צלחת 40,000 תאים/cm2 תאים צלחת 6-ובכן בתקשורת תרבות סרום שור עוברית (FBS) 10%. דגירה תאים בתוך תא humidified (5% CO2 ב 37 מעלות צלזיוס) למשך 24 שעות, לאפשר להם להגיע למפגש 70-80%.
הערה: אם התאים לא הגיעו את confluency הרצוי לאחר 24 שעות, לאפשר להם לגדול ב- 10% FBS תרבות המדיה 24 שעות נוספות. - לשטוף את התאים פעמיים עם PBS ולהוסיף 2 מ"ל של סרום ללא תרבות המדיה. דגירה התאים בתוך תא humidified (5% CO2 ב 37 מעלות צלזיוס) 24 שעות נוספות.
- באמצעות פיפטה סרולוגית, לאסוף את המדיה ממוזגים מכל קידוח. Centrifuge התקשורת-1200 סל ד במשך 3 דקות להסיר את כל שאריות תאים. קח את תגובת שיקוע, להתרכז באמצעות a 15 מ"ל, יחידת מסנן צנטריפוגלי סף משקל מולקולרי 10 kDa. Centrifuge היחידות מסנן ב 4000 x g למשך 15 דקות רוטור דלי מתנדנדים או g x 5,000 למשך 15 דקות רוטור זווית קבועה.
הערה: שלב זה הוא אופציונלי, אך ניתן לשפר את עוצמת הלהקות הפרוטאוליטי של ג'לים zymography פפטיד. - להעביר את פילטרט מרוכז של שפופרת צנטרפוגה mL 1.5 טריים. Aliquot מאגר דגימות ב-80 מעלות צלזיוס עד שלושה מחזורים ההקפאה-הפשרה.
- צלחת 40,000 תאים/cm2 תאים צלחת 6-ובכן בתקשורת תרבות סרום שור עוברית (FBS) 10%. דגירה תאים בתוך תא humidified (5% CO2 ב 37 מעלות צלזיוס) למשך 24 שעות, לאפשר להם להגיע למפגש 70-80%.
- לכמת את תכולת החלבון שימוש assay כימות של חלבון סטנדרטית (למשל BCA, ברדפורד Assay, וכדומה).
6. אלקטרופורזה של הביולוגיה דוגמאות בפפטיד Zymography ג'ל
- להמיס הדגימות במאגר מדגם zymography קונבנציונלי (62.5 מ"מ טריס-HCl, pH 6.8, bromophenol 0.01% 25% גליצרול, 4% מרחביות, כחול). עבור דגימות תאים ורקמות, מומלץ ~ 30 µg של חלבון סה כ ליום טוב, ו- 50-100 ננוגרם של חלבון עבור MMP סטנדרטים.
- להוסיף 400 מ של 1 x טריס-גליצין מרחביות הפעלת מאגר למכשירים ג'ל. לטעון µL עד 35 מדגם לכל טוב. הפעל את הדגימות-120 V ב 4 ° C 1.5 שעות או עד המידה משקל מולקולרי מציינים כי פרוטאזות עניין נמצאים במרחק פפטיד לפתרון שכבת ג'ל (בעל צבע כתום גלוי).
הערה: רוב MMPs ואת גירסאותיהם ליפול בטווח של 35-100 kDa. כאשר הסטנדרטים משקל מולקולרי לציין כי משקולות אלה נמצאים במרחק פפטיד לפתרון שכבת ג'ל, ניתן לעצור אלקטרופורזה. ניתן להחיל את אותו עיקרון מעמדות אחרים של פרוטאזות עם משקולות מולקולרית ידוע. אם יש אינטרס גילוי פרוטאזות מרובים על טווח גדול יותר של משקולות מולקולרית, להקטין את הגודל של שכבת ג'ל פתרון ולהגדיל את הגודל של השכבה ג'ל פפטיד פתרון. - בעקבות אלקטרופורזה, להסיר את ג'לים בקלטת פלסטיק ולשטוף ג'לים שלוש פעמים במשך 10 דקות בטמפרטורת החדר תחת עדין עצבנות במאגר renaturing המכילים 2.5% טריטון X-100, 1 מיקרומטר ZnCl2ו- 5 מ מ CaCl2 ב- 50 מ מ טריס-HCl, pH 7.5.
- העברת ג ' לים כדי לפתח פתרון מאגר המכיל 1% טריטון X-100, ZnCl 1 מיקרומטר2 ו CaCl 5 מ מ2 ב- 50 מ"מ טריס-HCl, pH 7.5 15 דקות להחליף עם פיתוח טריים מאגר פתרון דגירה ג'לים ב 37 ° C תחת עצבנות עדין למשך 24 שעות , מוודא ג'לים הם submersed באופן מלא בפתרון.
7. הדמיה של פפטיד Zymography ג ' לים
- לאחר 24 שעות, ג'לים התמונה באמצעות פלורסנט ג'ל סורק/imager באמצעות את המסננים המתאימים עירור, פליטה. לדוגמה, ג'לים פפטיד המוצג בתוצאות נציג הם מצומדת עם Fluorescein ' היו עם תמונה באמצעות מסנן עירור של 488 ננומטר, מסנן פליטה של 521 ננומטר. שימוש את המסננים המתאימים עבור fluorophore שלך יהיה למקסם את הגילוי של פעילות הפרוטאוליטי.
הערה: תמונות יכולות להילקח גם עם imager ג'ל מצוידים transilluminator UV, המשמשת לעתים קרובות ההדמיה של ה-DNA ג'ל מוכתם אתידיום ברומיד. תמונה של ג'לים באמצעות את transilluminator UV (365 ננומטר) הגדרת ואת מסנן פליטה של 590 ננומטר. - לבצע הערכה densitometric של הלהקה עוצמות באמצעות ImageJ כמתואר13.
תוצאות
באמצעות השיטה המתוארת כאן, שני ניאון פפטידים פרוטאז-מתכלים אוחדו ג'לים לזיהוי: GGPQG↓IWGQK(PEG)2C (באופן מקוצר כ- QGIW לאורך הטקסט ואת המספרים) ו GPLA↓CpMeOBzlWARK(PEG)2 C (באופן מקוצר כ- LACW לאורך הטקסט ואת המספרים). ↓ מציין האתר של המחשוף. QGIW הוא קולגן-אני נגזר רצף תוכננה לאתר collagenases הסלולר14. LACW הוא רצף מוטבה איתור MMP-14 ו- MMP-1115. פפטידים מסומנות עם dabcyl (כ'חטיף), fluorescein (fluorophore) באמצעות N-hydroxysuccinimide (NHS) - אסתר - הודיה עמר כימיה11. זה יכול להיות קשה לפתח פפטידים fluorogenic החדש יש קרינה פלואורסצנטית נאותה שכבתה והם מסיסים במאגרי סטנדרטי. לכן, התאמת פפטיד רצפים של סובסטרטים פרוטאז פלורסנט זמינים מסחרית כדי לכלול ציסטאין מסוף של C מהווה לעיתים קרובות כאסטרטגיה מוצלחת לפתח חיישנים fluorogenic חדש. להפגין את היכולת של פפטיד zymography להפרדת תערובות מורכבים פרוטאז, מדיה ממוזגים נאסף מתוך שתי שורות תאים סרטן שונים. HT1080 fibrosarcoma תאים ותאים אדנוקרצינומה של השד מד א-MB-231 מצופים בתקשורת FBS 10% במשך 24 שעות, לאחר מכן הוחלף התקשורת עם מדיה ללא סרום 24 שעות נוספות. מדיה ממוזגים דגימות נאספו, מרוכז באמצעות 10 יחידות סינון צנטריפוגלי הקיצוץ של משקל מולקולרי kDa. תכולת החלבון של המדיה נמדדה שימוש assay µBCA רגיל. 30 µg של חלבון ממדיה ממוזגים היו electrophoresed. כפקדי חיובית, בארות עם סוג אני collagenase חיידקי (100 µg) או מטוהרים, מופעל MMP-9 (125 ng) בנוסף נכללו. ג'לים הדגירה במשך 24 שעות ביממה בפיתוח מאגר כדי לאפשר MMP המחשוף סובסטרטים מתכלה בתוך ג'ל (איור 2), ואז עם תמונה. הדמיה פלורסנט חשף שלהקות רבות היו גלוי בתוך ג'ל פפטיד LACW (איור 2 א14), בעוד רק להקה אחת היה ברור בתוך QGIW ג'ל (2D איור14). בהשוואה zymography ג'לטין (איור 2G14), ג'לים LACW היו מסוגלים לזהות עוד להקות הפרוטאוליטי, הוכחת היכולת של פפטיד zymography לאתר מגוון רחב יותר של פרוטאזות מתנה בתוך דגימות ביולוגיות יותר שיטות מסורתיות באמצעות סובסטרטים מקורית.
כדי לוודא את הזהות של הלהקות מטמיעים כמו MMPs, ג'לים zymography פפטיד היו מודגרות פיתוח מאגר המכיל גם 20 מיקרומטר GM6001, מעכב MMP ותתנו לו, או 10 מיקרומטר E-64, מעכב cathepsin כללי. טיפול של פפטיד LACW ג ' לים עם GM6001 (2B איור14) ירד האינטנסיביות של הלהקות, בזמן הטיפול עם E-64 (2C איור14) הייתה השפעה ניכרת. טיפול של ג'לים פפטיד QGIW עם GM6001 הביא אבלציה מלאה הלהקות בעבר ראינו (2E איור14). כצפוי, E-64 לא הייתה כל השפעה (2F איור14). ב שני ג'לים פפטיד, GM6001 עכבות מטוהר. הפעילות MMP-9 אך לא השפיע על פעילות collagenase חיידקי, עוד יותר מאמת כי העלייה מטמיעים פלורסצנטיות היה תוצאה של פעילות הפרוטאוליטי על-ידי MMPs מתנה בתוך התחום הביולוגי שנבדקו דוגמאות.
כדי להשוות את רמת הרגישות של פפטיד zymography כדי תקן הזהב הנוכחי, zymography ג'לטין, ניתוח רגישות נערך באמצעות מטוהרים, מופעל MMP-9. דילולים טורי של MMP-9 (1-250 ng) היו electrophoresed ב ג'לים zymography LACW, QGIW, ג'לטין (איור 3 א14). בעקבות פיתוח והדמיה פלורסנט, עוצמות הלהקה היו לכמתו ImageJ, חלקות בעוצמה הלהקה מנורמל נוצרו כדי לחשב EC50 ריכוז ערכים-המייצרת 50% של האות המרבי (איור 3B 14). LACW פפטיד ג'לים הצליחו לזהות את הקטן ריכוזי MMP-9, שערכו50 EC 17.28 ng, לעומת zymograms QGIW ואת הג'לטין עם ערכים של 59.50 ng ו 31.85 ng, בהתאמה. נתונים אלה מציינים כי השימוש של פפטיד zymography יכול להתאים או לחרוג ממגבלות רגישות יליד סובסטרטים כמו ג'לטין.
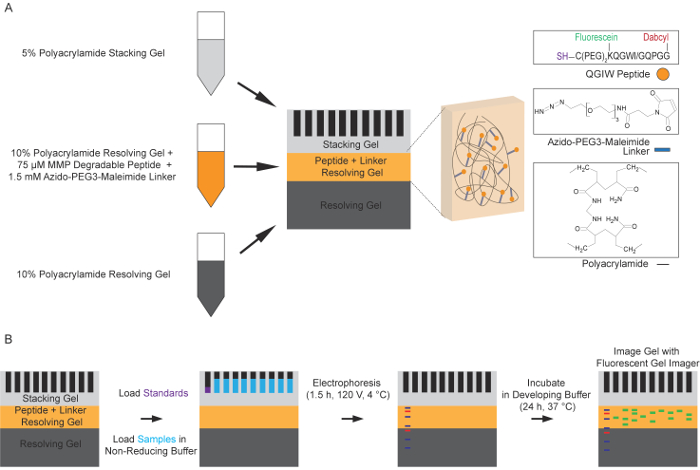
איור 1: סכמטי של תהליך zymography ניאון פפטידים. (א) הכנת לזיהוי שכבתיים לפתרון ג'ל. תקן 10% פתרון פתרון ג'ל משמש כדי ליצור את השכבה הראשונה של הג'ל zymography פפטיד. לפתרון השני 10% ג'ל בשכבה הכוללת פפטיד מתרצה, פלורסנט, מולקולה מקשר azido-PEG3-maleimide הוא polymerized אז על גבי השכבה הראשונה. השכבה העליונה הסופי הוא 5% ג'ל הערימה. אלקטרופורזה סטנדרטי (B) מתחת ללא הפחתת התנאים משמש כדי להפריד פרוטאז המכילים דוגמאות ג'לים לזיהוי functionalized. ג'לים נשטפים להסיר מרחביות ולאפשר את החלבונים כדי renature. ג'לים מודגרת ואז במאגר פיתוח במשך 24 שעות ביממה ב 37 מעלות צלזיוס, ומאפשר פרוטאזות לבקע את פפטידים fluorogenic, וכתוצאה מכך פלורסצנטיות מוגברת. זו קרינה פלואורסצנטית, המתאים עם פעילות פרוטאז, ואז נתפס באמצעות imager ג'ל פלורסנט של עירור של 488 ננומטר, פליטה של 521 nm (Adapted באישור Biotechniques ומדע העתיד14). אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.

איור 2: זיהוי של פרוטאזות מופרש תא בשורות תאים סרטניים אנושיים. ניתוח של אנזים collagenase (100 µg), MMP-9 (125 ng) ושמת תא מדיה HT1080 fibrosarcoma (30 µg), מד א-MB-231 אדנוקרצינומה השד סרטן (30 µg) שורות תאים בג'לים פפטיד LACW ו- QGIW. ג'לים היו שטופלו דימתיל סולפוקסיד (בקרת הרכב) (A & D), מטופלים עם GM6001 (B & E) או מטופלים עם E-64 (C & F). (גרם) ג'לטין zymogram של HT1080, מד א-MB-231 ממוזגים תא מדיה (Adapted באישור Biotechniques ומדע העתיד14). אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
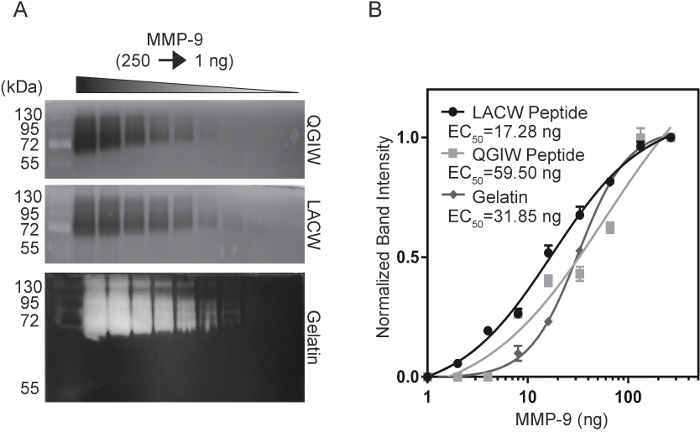
איור 3: השוואה של MMP-9 רגישות של פפטיד, ג'לטין Zymograms. (א) QGIW (למעלה), LACW (באמצע), ג'לטין (למטה) zymography ג'לים היו נענשים דילולים טורי של MMP-9. (B) Normalized הלהקה עוצמות היו לעומת ריכוז MMP-9 ובכושר לעקומה שיפוע משתנה של פרמטר ארבע. EC50 ערכים עולה ריכוז-חצי האות המרבי. תוצאות מיוצגים בתור n = 3, כלומר SD (Adapted באישור Biotechniques ומדע העתיד14). אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
| פתרון ג'ל | ||||
| מניות conc. | סופי conc. | 5 ג'לים | ג'לים 10 | |
| אקרילאמיד/Bis-אקרילאמיד (19:1) | 40% | 10% | 10 מ | 20 מ |
| טריס-HCl pH 8.7 | 1 מ' | ז 0.375 | 15 מ | 30 מ |
| Dodecyl נתרן גופרתי (מרחביות) | 20% | 0.10% | 200 ΜL | 400 ΜL |
| H יונים2O | -- | -- | 14.4 מ | 28.7 mL |
| TEMED | -- | -- | 40 ΜL | 80 ΜL |
| APS | 10% | 0.10% | 400 ΜL | 800 ΜL |
| הנפח הכולל | 40 מ | 80 מ | ||
| ג'ל פתרון פפטיד | ||||
| מניות conc. | סופי conc. | 5 ג'לים | ג'לים 10 | |
| אקרילאמיד/Bis-אקרילאמיד (19:1) | 40% | 10% | 5 מ | 10 מ |
| טריס-HCl pH 8.7 | 1 מ' | ז 0.375 | 7.5 mL | 15 מ |
| Dodecyl נתרן גופרתי (מרחביות) | 20% | 0.10% | 100 ΜL | 200 ΜL |
| H יונים2O | -- | -- | 6.5 ΜL | 13 mL |
| פפטיד פלורסנט | 10 מ מ | מיקרומטר 75 | 150 ΜL | 300 ΜL |
| Azido-PEG3-Maleimide CrossLinker | 75 מ מ | 1.5 מ מ | 400 ΜL | 800 ΜL |
| TEMED | -- | -- | 20 ΜL | 40 uL |
| APS | 10 | 0.10% | 200 ΜL | 400 ΜL |
| הנפח הכולל | 20 מ | 40 מ | ||
| ג'ל הערימה | ||||
| מניות conc. | סופי conc. | 5 ג'לים | ג'לים 10 | |
| אקרילאמיד/Bis-אקרילאמיד (19:1) | 40% | 5% | 2.5 מ | 5 מ |
| טריס-HCl pH 6.9 | 1 מ' | 0.125 מ' | 2.5 מ | 5 מ |
| Dodecyl נתרן גופרתי (מרחביות) | 20% | 0.10% | 100 ΜL | 200 ΜL |
| H יונים2O | -- | -- | 14.75 mL | 29.5 מ |
| TEMED | -- | -- | 50 ΜL | 100 ΜL |
| APS | 10% | 0.10% | 100 ΜL | 200 ΜL |
| הנפח הכולל | 20 מ | 40 מ | ||
טבלה 1: ריאגנט טבלה עבור הכנת ניאון פפטידים ג'לים zymography. ריכוזי ואמצעי אחסון עבור הכנת הג'ל zymography פפטיד רב-שכבתית.
Discussion
טכניקות zymographic הנוכחיים מסתמכים על שילוב של סובסטרטים יליד לתוך לזיהוי ג'לים איתור proteolysis. ואילו טכניקות אלה משכו השימוש הנרחב, הם עדיין מוגבלים במספר של פרוטאזות שהם יכולים לזהות. . הנה, פרוטוקול תוארה בפפטידים פלורסנט, פרוטאז-מתכלים אשר משולבים של לזיהוי פתרון ג'ל. קוולנטיות צימוד באמצעות מולקולה מקשר azido-PEG3-maleimide מאפשר את הפרדה וזיהוי של מגוון רחב יותר של פרוטאזות יותר הוא כיום השגה עם מצעים מקורית. הטבע מאוד tunable של ניאון פפטידים מעניק חוקרים את היכולת לעצב סובסטרטים שיכולות היעד שלהם פרוטאזות עניין. מצעים פפטיד רבים זוהו עבור מגוון רחב של פרוטאזות באמצעות מעבדות, יש מספר גדל והולך של מקורות מסחריים לייצור פפטידים מותאם אישית. זה יכול להיות קשה לפתח פפטידים fluorogenic החדש יש קרינה פלואורסצנטית נאותה שכבתה והם מסיסים במאגרי סטנדרטי. לכן, התאמת פפטיד רצפים של מסחרית זמינים פרוטאז פלורסנט סובסטרטים לכלול של ציסטאין C-מסוף מהווה לעיתים קרובות כאסטרטגיה מוצלחת לפתח חיישנים fluorogenic חדש.
במהלך השלמת פרוטוקול זה, צריך לקחת טיפול לטיפול ניאון פפטידים ג'לים כדי למנוע חשיפה מוגזמת לשמש אור כמו זה יכול להפחית באופן משמעותי את האות פלורסנט שזוהו. בנוסף, הריכוז הנוכחי של פפטיד בשימוש כל ג'ל הוא 75 מיקרומטר. זה יכול להיות מותאם להורדת ריכוזי לשמר פפטיד, במחשבה כי הפתרון azido-PEG3-maleimide יש להוסיף את הפתרון ב פחות שן טוחנת 20 עודף פפטיד. ניתן לרכוש ערכת azido-PEG3-maleimide בשלושה גדלים שונים (25, 100, 1000 מ ג). המחברים ממליצים בחום על רכישת ערכת 25 מ ג כמו הפתרון מוכן רק ניתן לאחסן על תקופות קצרות של זמן ב-20 ° C. יתר על כן, ערכה 25 מ ג מספיקה להכין 10 ג'ל פפטיד, אשר חייב לשמש בתוך 3 שבועות של הכנה.
אחת המגבלות של zymography היא הקושי אניני טעם את זהותו המדויק של להקות פרוטאז מטמיעים בשל חפיפה משמעותי במולקולרית משקולות. בעתיד מחקרים, זה יהיה קריטי לערוך ניתוח משני כדי לקבוע את זהותם באמצעות טכניקות כגון ספקטרומטר מסה16,17. מגבלה נוספת של zymography הוא refolding של חלבונים כדי שלהם קונפורמציה פעיל בעקבות denaturing חלקית על ידי מרחביות ו אלקטרופורזה. תהליכים אלו יכולים לגרום לשינוי קונפורמציה פעיל הפרוטאז, עיבוד חלבונים proteolytically אינו פעיל, פעיל. לדוגמה, ניתן לזהות pro-MMP-2 ג'לטין zymograms למרות שיש יעד שלמים מעכבות את הפרו-התחום כדי renaturation שלו אל הטופס הפעיל בינוני. שיטות משלימים כמו מקושרים-אנזים immunosorbent assay (אליסה) או ווסטרן שמחק יכול לשמש כדי לקבוע את זהותו ואת נוכחות הכולל של פרוטאז עניין.
מאמר זה מדגים את השימוש ניאון פפטידים סובסטרטים לשיפור הרגישות של טכניקות zymographic הנוכחית. באמצעות מטוהרים MMP-9, ניתוח ריכוז הדרגתי נערכה השוואת ג'לים zymography LACW, QGIW, ג'לטין. כיום, zymography ג'לטין הוא הטכניקה תקן הזהב שבו gelatinases (MMP-2 ו-9) מזוהים בדגימות ביולוגיות. השוואת הערכים50 EC של סובסטרטים שלושה, ג'לים פפטיד LACW היו הערכים הנמוכים ביותר, המציין את הרגישות הגבוהה ביותר. ניצול רצפי פפטיד שונים המיועדים גילוי של פרוטאזות ספציפי יכול לשפר באופן פוטנציאלי רגישויות אלה עוד יותר. טיפול היחסי של ג'ל עם סוכן הפעלת MMP כגון אצטט 4-aminophenylmercuric (APMA) או הפארין יכול לשמש גם כדי להגביר את האות חלש כפי שתואר לעיל18.
בנוסף המדד של פרוטאז פעילות עבור מחקרים ביולוגיים, פפטידים פרוטאז-מתכלים משמשים גם לעתים קרובות crosslinking hydrogels סינתטי עבור הנדסת רקמות ויישומי משלוח סמים. השפלה מבוקר הוא קריטי עבור יישומים אלה. נכון לעכשיו, ההשפלה קינטיקה של פפטידים אלה מאופיינים באמצעות אנזימים יחיד, מטוהרים. עם זאת, קביעה אילו אנזימים תאים למעשה לייצר והם אחראים על המחשוף של פפטידים אלה כבר קשה לקבוע. השימוש zymography פפטיד לכמת התא ואת שחרור רקמות ספציפיות אנזים יסייעו במידה רבה בעיצוב רציונלית של רצפי crosslinking אלה פפטיד.
Disclosures
המחברים אין לחשוף.
Acknowledgements
מימון מסופקים על ידי אוהיו סטייט אוניברסיטת להנדסה, המחלקה להנדסה ביו-רפואית של מקיף במרכז לחקר הסרטן - ארתור ג ג'יימס סרטן החולים ו ריצ'רד ג' Solove מכון מחקר.
Materials
| Name | Company | Catalog Number | Comments |
| 1.5 mm Empty Gel Cassettes | ThermoFisher Scientific | NC2015 | |
| 1.5 mm, 10 well Empty Gel Cassette Combs | ThermoFisher Scientific | NC3510 | |
| 1x Phosphate Buffered Saline | Fisher Scientific | 10-010-049 | |
| 20% SDS Solution | Ambion | AM9820 | |
| 3x Zymography Sample Buffer | Bio-Rad | 1610764 | |
| 40% (w/v) Acrylamide/Bis (19:1) | Ambion | AM9022 | |
| 6 Well Tissue Culture Plates | ThermoFisher Scientific | 087721B | |
| Amicon Ultra-2 Centrifugal Filter Unit (10 kDa MWCO) | Sigma-Aldrich | UFC201024 | |
| Ammounium Persulfate | Sigma-Aldrich | A3678 | |
| Azido-PEG3-Maleimide Kit | Click Chemistry Tools | AZ107 | |
| Calcium Chloride | ThermoFisher Scientific | BP510100 | |
| Dimethyl Sulfoxide | Fisher Scientific | BP231 | |
| Isopropanol | Fisher Scientific | A416P | |
| Micro BCA Protein Assay Kit | ThermoFisher Scientific | 23235 | |
| N N N' N'-Tetramethylethylenediamine (TEMED) | Sigma-Aldrich | T9281 | |
| PowerPac Basic Power Supply | Bio-Rad | 1645050 | |
| Precision Plus Protein Dual Color Standard | Bio-Rad | 161-0374 | |
| PrecisionGlide Hypodermic Needles | Fisher Scientific | 14-826 | |
| Round Bottom Flask (100 mL) | Fisher Scientific | 50-873-144 | |
| Septum Rubber Stopper | Fisher Scientific | 50-872-546 | |
| Sterile Slip Tip Syringe (1 mL) | Fisher Scientific | 14-823-434 | |
| Triton X-100 | Sigma-Aldrich | X100 | |
| Trizma hydrochlroide | Sigma-Aldrich | T5941 | |
| Typhoon 9410 Molecular Imager | GE Amersham | 8149-30-9410 | |
| Zinc Chloride | Sigma-Aldrich | 208086 |
References
- Vandooren, J., Geurts, N., Martens, E., Vanden Steen, P. E., Opdenakker, G. Zymography methods for visualizing hydrolytic enzymes. Nature Methods. 10 (3), 211-220 (2013).
- Toth, M., Fridman, R. Assessment of Gelatinases (MMP-2 and MMP-9) by Gelatin Zymography. Methods in Molecular Medicine. 57, (2001).
- Heussen, C., Dowdle, E. B. Electrophoretic analysis of plasminogen activators in polyacrylamide gels containing sodium dodecyl sulfate and copolymerized substrates. Analytical Biochemistry. 102 (1), 196-202 (1980).
- Gogly, B., Groult, N., Hornebeck, W., Godeau, G., Pellat, B. Collagen zymography as a sensitive and specific technique for the determination of subpicogram levels of interstitial collagenase. Analytical Biochemistry. 255 (2), 211-216 (1998).
- Inanc, S., Keles, D., Oktay, G. An improved collagen zymography approach for evaluating the collagenases MMP-1, MMP-8, and MMP-13. BioTechniques. 63 (4), 174-180 (2017).
- Perera, H. K. I. Detection of Aspartic Proteinase Activities Using Gel Zymography. Zymography. , 43-52 (2017).
- van Beurden, P. A. M. S. noek-, Vonden Hoff, J. W. Zymographic techniques for the analysis of matrix metalloproteinases and their inhibitors. BioTechniques. 38 (1), 73-83 (2005).
- Oliver, G. W., Stetler-Stevenson, W. G., Kleiner, D. E., Zymography, Zymography, Casein Zymography, and Reverse Zymography: Activity Assays for Proteases and their Inhibitors. Proteolytic Enzymes. Springer Lab Manual. , Springer. Berlin, Heidelberg. 63-76 (1999).
- Deshmukh, A. A., Weist, J. L., Leight, J. L. Detection of proteolytic activity by covalent tethering of fluorogenic substrates in zymogram gels. BioTechniques. 64 (5), 203-210 (2018).
- Yasothornsrikul, S., Hook, V. Y. Detection of proteolytic activity by fluorescent zymogram in-gel assays. BioTechniques. 28 (6), 1172-1173 (2000).
- Leight, J. L., Alge, D. L., Maier, A. J., Anseth, K. S. Direct measurement of matrix metalloproteinase activity in 3D cellular microenvironments using a fluorogenic peptide substrate. Biomaterials. 34 (30), 7344-7352 (2013).
- Leight, J. L., Tokuda, E. Y., Jones, C. E., Lin, A. J., Anseth, K. S. Multifunctional bioscaffolds for 3D culture of melanoma cells reveal increased MMP activity and migration with BRAF kinase inhibition. Proceedings of the National Academy of Sciences of the United States of America. 112 (17), 5366-5371 (2015).
- Ren, Z., Chen, J., Khalil, R. A. Zymography as a Research Tool in the Study of Matrix Metalloproteinase Inhibitors. Methods in Molecular Biology. 1626, Clifton, N.J. 79-102 (2017).
- Nagase, H., Fields, G. B. Human matrix metalloproteinase specificity studies using collagen sequence-based synthetic peptide. Biopolymers. 40 (4), 399-416 (1996).
- Mucha, A., et al. Membrane Type-1 Matrix Metalloprotease and Stromelysin-3 Cleave More Efficiently Synthetic Substrates Containing Unusual Amino Acids in Their P1′ Positions. Journal of Biological Chemistry. 273 (5), 2763-2768 (1998).
- Thimon, V., Belghazi, M., Labas, V., Dacheux, J. -L., Gatti, J. -L. One- and two-dimensional SDS-PAGE zymography with quenched fluorogenic substrates provides identification of biological fluid proteases by direct mass spectrometry. Analytical Biochemistry. 375 (2), 382-384 (2008).
- Sun, X., Salih, E., Oppenheim, F. G., Helmerhorst, E. J. Activity-based mass spectrometric characterization of proteases and inhibitors in human saliva. Proteomics. Clinical Applications. 3 (7), 810-820 (2009).
- Yu, W., Woessner, J. F. Heparin-Enhanced Zymographic Detection of Matrilysin and Collagenases. Analytical Biochemistry. 293 (1), 38-42 (2001).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved