Method Article
蛍光ペプチド ザイモグラフィーによってプロテアーゼ活性の検出
要約
ここでは、代わりにネイティブ蛋白質分解性基質として蛍光ペプチドを使用する変更におけるザイモグラムの技術のための詳しいプロトコルを提案する.蛍光ペプチド手技で生体試料の電気泳動におけるザイモグラムの前の技術よりも幅広いプロテアーゼの検出が有効にします。
要約
このメソッドの目的は、複雑な生物学的サンプルのタンパク質分解活性を測定することです。サンプルは、分解性基板が埋め込まれた解決のゲルを通した電気泳動を用いた分子量で区切られます。このメソッドは、伝統的なゲル ザイモグラフィーと異なり、焼入れ蛍光ペプチド、ゼラチン、カゼインなどの完全な長さの蛋白質ではなく解決のゲルに組み込まれて共有ができます。蛍光ペプチド追加染色手順なしのプロテアーゼ活性の直接検出を使用します。生体試料中の酵素はクリーブ蛍光性の増加の結果、焼入れ蛍光ペプチドです。ゲルの蛍光信号が標準的な蛍光スキャナーで画像化し、デンシトメトリーを用いて定量化します。分解性基質ペプチドの使用におけるザイモグラムを用いて検出可能なプロテアーゼを大きく広げます。
概要
ゲル ザイモグラフィーは、体液や細胞培養媒体1,2,3などの生体サンプル中のプロテアーゼ活性を測定する使用生物学的手法です。サンプルは分解性基板が埋め込まれたポリアクリルアミドのゲルを通した電気泳動とその分子量によって区切られます。ゼラチン、カゼイン、コラーゲン、エラスチン、マトリックスメタロプロテアーゼ (Mmp)-1、-2、-3、-7、-8、-9、-11、カテプシン1,2のさまざまなの活動を測定するために使用されている一般的な分解性基板が含まれます,4,5,6,7,8. 電気泳動後、酵素 renatured、ゲル内の蛋白質を低下させて。伝統的なゲル ザイモグラフィーでゲルはブルーなどのタンパク質染料で染色、暗い青色の背景にすなわち、白いバンド (タンパク質の分解)、信号の損失としてプロテアーゼ活性を検出します。
ここでは、分解性基質、短い、共有組み込まれて電気泳動法 (図 1) 蛍光ペプチド ゲル ザイモグラフィー法が代替のプロトコルについて述べる。合成ペプチドの分解性基質としての置換伝統的なゲル ザイモグラフィー ネイティブ蛋白質9と比較してプロテアーゼの広い範囲の検出が有効に。蛍光ペプチドの共有結合連鎖ペプチド拡散とゲル電気泳動前メソッド9,10で観察中に移行を防止します。さらに、蛍光基板を使用する追加染色および染色解除手順なしプロテアーゼ活性の直接検出できます。このメソッドの全体的な目標は、共有のザイモグラムおよびゲルの蛍光ペプチド定款による生体試料中のプロテアーゼ活性の検出です。
プロトコル
1. 解決のゲル層の作製
- 10% ポリアクリルアミド ゲル溶液の表 1に従って解決を準備します。彼らの付加重合反応を開始すると、ゲルを注ぐ直前テトラメチルエチレンジアミン (TEMED) とアンモニウムの過硫酸塩 (APS) を追加します。
- 10% の解決のゲル溶液で空の 1.5 mm ミニ ゲル カセット (5 mL) の半分の方法を満たします。
- レベルのゲルを生成し、気泡を防ぐためポリアクリルアミドゲルの上部にイソプロパノール (〜 500 μ L) の薄層を追加します。残ったポリアクリルアミド ソリューションを使用すると、重合反応の進行状況を追跡します。チューブにポリアクリルアミドが完全に固化反応は、完全な (~ 40 分) です。
2. アジドフェニル PEG3 マレイミド リンカー分子の作製
- 一方、最初の解決のゲル層を重合すると、-20 ° C のストレージからアジドフェニル PEG3 マレイミド キットを取得と部屋の温度に到達するコンポーネント。各キットには 2 つのコンポーネントがあります。1 バイアルには、マレイミド NHS エステル、灰色の固体にオフホワイトが含まれています。バイアル 2 アジドフェニル PEG3 アミン、若干黄色の油が含まれています。
注: 著者使用してお勧め 25 mg アジドフェニル PEG3 マレイミド キット (1-2 時間) の短い期間のみ格納できます-20 ° C でそれが低下し始めた前に準備されている後。25 mg は 10 ペプチド ゲルを生成するのに十分です。準備の 3 週間以内のジェルを使用します。 - ジメチルスルホキシド (DMSO) と 30 の渦の量を推奨メーカーのバイアル 2 のコンポーネントを溶かす液体をように s はよく混合されています。
- 攪拌棒を含む清潔で乾燥した 100 mL の丸底フラスコに 1 バイアルの内容を転送します。
注: はアセトンでフラスコをすすいで水分の反作用と干渉することを防ぐために使用する前に完全に乾燥します。 - すぐにフラスコの口の中に注射器で穿刺できるダイヤフラムのゴム中隔ストッパーを挿入します。水分がフラスコ内に入るを防ぐためにすぐに動作します。
- 挿入 2 18 ゲージは横隔膜に針を注射器、不活性ガスのタンク (例えばアルゴン ガス) に 1 つを接続します。3 分ミックスのフラスコを埋めるため不活性ガスのバイアル 1 と不活性ガス下で 2 望ましくない反応生成物を防ぐためにコンポーネントを許可します。
注意: 2 番目の注射針により、不活性ガスがフラスコの流れに、フラスコ内に含まれる大気、通気孔を提供することです。口針を含めることを忘れないでください! - 不活性ガスを止めるし、針からデタッチします。バイアル 2 の完全な内容をフラスコに注入する注射器を使用して。
- 針と注射器を削除し、攪拌しながら室温で 30 分間混合するコンポーネント。
- ゴム中隔ストッパーを削除し、内容をきれいな 5 mL 遠心管に転送します。室温で 1 時間以内、アジドフェニル PEG3 マレイミド ソリューションを使用する必要があります。
3. ゲル層を解決するペプチドの作製
- 最初の解決のゲル層が重合したイソプロパノール層を注ぎなさい。ゲルのトップをゲルの上に脱イオン水のピペット 1 mL でリンスし、水を注ぐ。
- -80 ° C のストレージからチオール官能基化蛍光ペプチドを取得でき室温で自然解凍。
注: 前述11,12チオール修飾ペプチドを用意できます。市販ペプチドも使用できますが、マレイミド チオールを有効にターミナルのシステイン残基の付加反応のクリックを必要とします。10 mM のストック濃度ペプチドを溶解し、凍結融解の繰り返しを制限するための小さい (30 uL) 因数で-80 ° C で保存します。 - 解決するアジドフェニル PEG3 マレイミド リンカー分子との表 1に従って蛍光ペプチドを含むゲル溶液 10% を準備します。彼らの付加重合反応を開始すると、ゲルを注ぐ直前 TEMED と AP を追加します。
- ゲル溶液を解決するペプチドでゲル カセット (3 mL) の残りの部分の半分を埋めます。
注: 多層解決ゲル アプローチのペプチドでリンカー各ゲルに必要な量が減ります。ペプチド分解ゲル層のサイズは、必要に応じて、分子量の大きい範囲に合わせて調整できます。 - イソプロパノール (〜 500 μ L) の薄層のレベルのゲルを生成し、気泡を防ぐためポリアクリルアミド ゲルの上にピペットします。残ったポリアクリルアミド ソリューションを使用すると、重合反応の進行状況を追跡します。チューブにポリアクリルアミドが完全に固化反応は、完全な (~ 40 分) です。
注: 蛍光ペプチドは光に敏感です。開発、洗濯の電気泳動のゲルの準備の間に退色を防ぐためにアルミ箔で覆われているゲルを維持します。 - イソプロパノール層を離れて注ぎ、ステップ 3.1 のように脱イオン水でゲルを解決するペプチドの上部をすすいでください。
- 場合は、すぐにゲルを使用して手順 4 に進みます、それ以外の場合、ゲルが乾くを防ぐためにプラスチック製のボックスで 4 ° C、リン酸緩衝生理食塩水 (PBS) x 1 の 100 mL で準備ができてゲルを浸します。退色を防止するアルミ箔でボックスをラップします。ジェルは、使用する前に 3 週間の PBS に格納できます。
4. スタッキングのゲルの調製
- 表 1に従って 5% スタッキング ゲル溶液を準備します。彼らの付加重合反応を開始すると、ゲルを注ぐ直前 TEMED と AP を追加します。
- スタッキングのゲル溶液でゲル カセット (~ 2 mL) の残りの空の部分を塗りつぶします。
- すぐにスタッキングのゲルの層、井戸の下で閉じ込められた気泡が残っていないかどうかを確かめるに 1.5 mm のゲル櫛を挿入します。残ったポリアクリルアミド ソリューションを使用すると、重合反応の進行状況を追跡します。チューブにポリアクリルアミドが完全に固化反応は、完全な (~ 10 分) です。
- ゲル カセットの背面から櫛とテープを慎重に取り外します。
5. 電気泳動用試料の準備
- 非還元条件2の下で前述の他の場所で MMP 等組織ホモジネートのセル lysates エアコン携帯メディアを準備します。サンプルを加熱しないでください。
- たとえば、とおりエアコン携帯メディアを準備します。
- 10% ウシ胎児血清 (FBS) 培地で 6 ウェル プレートのプレート 40,000 セル/cm2セル。24 時間インキュベート加湿チャンバー (37 ° C 5% CO2 ) 細胞と 70-80% の合流点に達することができます。
注: セルが 24 時間後希望の confluency に達しない場合付加的な 24 時間の 10 %fbs 文化メディアに育つためにそれらを許可します。 - PBS で 2 回細胞を洗浄し、無血清培地 2 mL を加えます。追加 24 時間加湿チャンバー (5% CO2 37 ° c) のセルを孵化させなさい。
- 血清ピペットを使用して、各ウェルからエアコンのメディアを収集します。任意の細胞の残骸を削除する 3 分の 1200 rpm でメディアを遠心します。上清をとり、15 mL、10 kDa の分子量カットオフ遠心ろ過ユニットを使っても集中。4,000 x g スイング バケツ ローターで 15 分間または固定角ロータで 15 分間 5,000 × g フィルター ユニットを遠心します。
注: この手順はオプションですが、ペプチド ザイモグラフィー ゲル内の蛋白質分解バンドの強度を高めることができます。 - 新鮮な 1.5 mL 遠心管に集中して濾液を転送します。-80 ° c まで 3 つの凍結融解の因数とストアのサンプル。
- 10% ウシ胎児血清 (FBS) 培地で 6 ウェル プレートのプレート 40,000 セル/cm2セル。24 時間インキュベート加湿チャンバー (37 ° C 5% CO2 ) 細胞と 70-80% の合流点に達することができます。
- 標準蛋白質定量アッセイを用いたタンパク質含量を定量化 (例えばBCA は、ブラッドフォードの試金、等)。
6 生物の電気泳動のペプチド ザイモグラフィー ゲルのサンプルします。
- 従来のザイモグラフィー サンプル バッファーのサンプルを溶解 (62.5 mM トリス-HCl、pH 6.8, 4 %sds、グリセリン 25% 0.01% ブロモフェノール ブルー)。細胞・組織のサンプルもあたり総蛋白質の ~ 30 μ g をお勧めしますと MMP の標準のための蛋白質の 50-100 ng。
- 1 の 400 mL を追加 x ゲル装置にトリス-グリシンの SDS を実行するバッファー。最大 35 μ L/ウェル サンプルをロードします。1.5 時間または分子量の基準を示す関心のプロテアーゼが (目に見えるオレンジ色のある) ゲル層を解決するペプチド内にあるまで 4 ° C で 120 V でサンプルを実行します。
注: ほとんどの MMPs とその亜種 35 100 kDa の範囲内で落ちる。分子量の基準を示す、これらの重みがゲル層を解決するペプチド、電気泳動を停止できます。同じ原理は、知られている分子量プロテアーゼの他のクラスに適用できます。分子量の大きい範囲にわたって複数のプロテアーゼを検出するに興味がある場合、解決のゲル層のサイズを小さくし、ペプチド分解ゲル層のサイズを増やします。 - 次の電気泳動、プラスチック カセットからゲルを削除し、2.5% トリトン X-100、1 μ M ZnCl2、50 mM で 5 mM CaCl2を含む renaturing バッファーの穏やかな撹拌下で室温で 10 分ずつ 3 回ジェルを洗うトリス-HCl、pH 7.5。
- 転送ゲル 1% を含む開発緩衝液に 1 μ M ZnCl2トリトン X-100 と 5 mM CaCl2 50 ミリメートル pH 7.5 15 分置換新鮮な開発とトリス塩酸バッファー溶液と 24 時間のために穏やかな攪拌下の 37 ° C でゲルを孵化させなさい、ゲルがソリューションで完全に沈水生であることを確かめます。
7. イメージング ペプチド ザイモグラフィーをゲルします。
- 24 時間後、蛍光画像ゲル ゲルのスキャナー/撮像素子の励起と放射の適切なフィルターを使用しています。たとえば、代表的な結果に示すようにペプチド ゲルのフルオレセインを用いた共役し、488 の励起フィルターを使用してイメージを作成した nm と 521 の排出フィルター nm。適切なフィルターを使用してあなたの fluorophore のプロテアーゼ活性の検出を最大化します。
注: 画像は、エチジウム ブロマイドで染色 DNA ゲルのイメージングのために頻繁に使用される UV transilluminator 装備ゲル固体撮像素子でも撮影することができます。UV transilluminator を使用してゲルの画像 (365 nm) 設定と 590 の排出フィルター nm。 - 13を他の場所で説明されているように ImageJ を用いたバンド強度のデンシトメトリーの評価を実施します。
結果
ここで説明した方法を使用して、2 つの蛍光プロテアーゼ分解性ペプチドは、ポリアクリルアミドゲルに組み込まれている: GGPQG↓IWGQK(PEG)2C (テキストと数値で QGIW と略す) と GPLA↓CpMeOBzlWARK(PEG)2C (テキストと数値で LACW と略す)。↓ は、胸の谷間のサイトを示します。QGIW は、コラーゲンの細胞のコラゲナーゼ14を検出するために設計されたシーケンスを派生しました。LACW は、MMP 14 と MMP 1115の検出用に最適化されているシーケンスです。Dabcyl (クェンチャー) とフルオレセイン (fluorophore) N ヒドロキシスクシンイミド (NHS) - エステル - を使用してペプチッドが付きますアミン化学11。それは適切な蛍光消光を持ち、標準的なバッファーに溶け合うことは新しい蛍光ペプチドを開発することは困難することができます。したがって、C ターミナル システインを含むように市販の蛍光プロテアーゼの基質からペプチド配列の適応は、しばしば新しい蛍光センサーの開発に成功した戦略では。ペプチド ザイモグラフィー複雑なプロテアーゼ混合物を分離する能力を示すためには、調節されたメディアは、2 つの異なった癌細胞ラインから採取しました。HT1080 線維肉腫細胞と MDA MB 231 乳房腺癌細胞 10 %fbs メディアでメッキされた 24 時間、その後メディアを付加的な 24 時間の血清無料メディアで交換しました。エアコン メディア サンプル採取し、10 kDa の分子量カットオフ遠心フィルター ユニットを使用して集中しています。メディアのタンパク質含有量は、標準的な µBCA のアッセイを用いて測定しました。調節されたメディアからの蛋白質の 30 μ g を electrophoresed いた。ポジティブ コントロールとして井戸型私細菌コラゲナーゼ (100 μ g) または精製、アクティブに MMP 9 (125 ng) も含まれていた。ゲルはゲル (図 2) 内分解性基板の MMP 胸の谷間を許可するバッファーを開発で 24 時間培養され、イメージを作成し。蛍光イメージングでは、シングル バンドのみが QGIW ゲル (図 2 D14) 以内に明らかな間、多数のバンドいた LACW ペプチド ゲル (図 2 a14) 内で表示を明らかにしました。ゼラチン ザイモグラフィー (図 214) と比較して LACW ゲル プロテアーゼより試料中に存在のより広い範囲を検出するペプチド ザイモグラフィーの能力を示すより多くの蛋白バンドを検出することができたネイティブの基板を用いた従来の方法。
いずれかの 20 μ M を含む開発バッファー Mmp として可視化されたバンドの id を確認するペプチド ザイモグラフィー ゲル培養 GM6001、広域スペクトルの MMP 阻害剤または 10 μ M 一般的なカテプシン阻害剤 E-64。GM6001 のゲルの LACW ペプチドの治療 (図 2 b14) に、バンドの強度が低下し E-64 (図 214) による治療には影響を与えなかったがなかった。GM6001 と QGIW のペプチド ゲルの治療は、以前見たバンド (図 2 e14) の完全なアブレーションで起因しました。予想通り、E-64 (図 2F14) の任意の効果を持っていなかった。両方ペプチド ゲル抑制 GM6001 精製 MMP 9 活動が影響を及ぼさない細菌コラゲナーゼの活性、さらに蛍光で可視化の増加された Mmp テスト生物中に存在によってプロテアーゼ活性の結果を確認します。サンプル。
現在のゴールド スタンダード、ゼラチン ザイモグラフィーをペプチド ザイモグラフィーの感度を比較するには、感度分析を精製、活性 MMP 9 を使用して行った。MMP-9 (1-250 ng) のシリアル希薄は、LACW、QGIW、ゼラチン ザイモグラフィー ゲル (図 3 a14) で electrophoresed いた。次の開発と蛍光イメージング、ImageJ で定量化されたバンド強度と正規化されたバンド強度のプロットは、最大信号 (図 3 bの 50% を作り出す EC50値の濃度を計算する生成されました。14). LACW ペプチド ゲル 17.28 EC50値を持つ MMP-9 の最小濃度を検出することができた 59.50 の値を持つ QGIW とゼラチンの手技と比較して ng ng と 31.85 ng、それぞれ。これらのデータを示すペプチド ザイモグラフィーの使用が一致したり、ゼラチンのようなネイティブの基板の感度の限界を超えます。
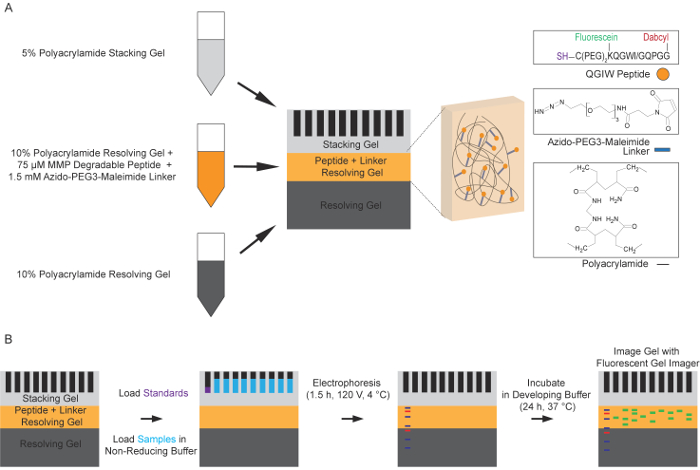
図 1: 蛍光ペプチド ザイモグラフィー プロセスの概略図です。(A)解決のゲル層ポリアクリルアミドゲルの調製。ペプチド ザイモグラフィー ゲルの最初の層を形成するため、ゲル溶液を解決する標準的な 10% が使用されます。焼入れ、蛍光ペプチドを含むレイヤーのゲルの 2 番目の 10% の解決と最初の層の上にアジドフェニル PEG3 マレイミド リンカー分子を重合し。最後の最上位のレイヤーは、5% のスタッキングのゲルです。(B)非還元の下で標準的な電気泳動条件を使用して機能性のポリアクリルアミドのゲルにサンプルをプロテアーゼを含みます。ゲルは、SDS を削除し、renature に蛋白質を洗っています。ゲル、開発バッファー増加蛍光、蛍光ペプチドを分解するプロテアーゼを許可する 37 ° C で 24 時間で孵化します。488 nm の励起と 521 の放出で蛍光イメージャを用いたプロテアーゼ活性に対応する、この蛍光をしながら nm (Biotechniques と未来科学14の許可を得て適合)。この図の拡大版を表示するのにはここをクリックしてください。

図 2: ひと癌細胞株細胞分泌されるプロテアーゼの検出。コラゲナーゼ酵素 (100 μ g)、MMP 9 の解析 (125 ng) 線維肉腫 HT1080 (30 μ g) から MDA MB 231 腺癌乳がん (30 μ g) 細胞株 LACW および QGIW のペプチド ゲルの携帯メディアを完備し、。ゲルは、DMSO (車両管理) (A & D)と扱われる、GM6001 (B & E)と扱われるまたは E-64 (C & F)と扱われます。(G) HT1080 と MDA MB 231 のゼラチンのザイモグラムおよび携帯メディア (Biotechniques と未来科学14の許可を得て適合) を完備しました。この図の拡大版を表示するのにはここをクリックしてください。
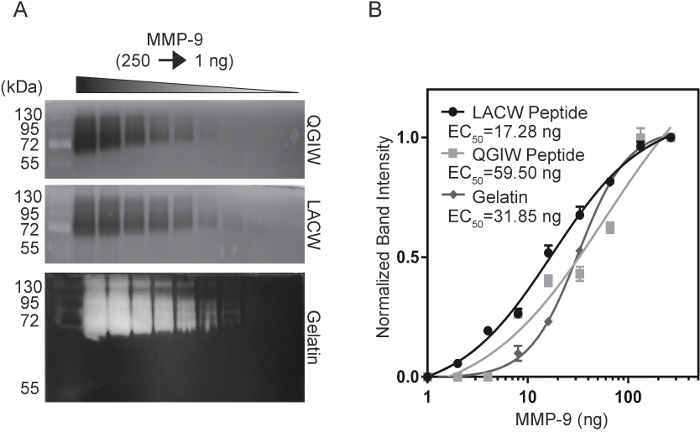
図 3: ペプチド、ゼラチン パーオキシターゼの MMP 9 感受性の比較。(A) QGIW (トップ)、LACW (中央)、ゼラチン (下) ザイモグラフィー ゲルは MMP 9 のシリアル希薄を受けた。(B)正規化バンド強度に MMP 9 濃度に対してプロットされ 4 つパラメーター可変勾配曲線にフィットさせます。EC50値は半分の最大信号で濃度を示します。結果は n で表されます = 3、SD (Biotechniques と未来科学14の許可を得て適合) を意味します。この図の拡大版を表示するのにはここをクリックしてください。
| 解決のゲル | ||||
| ストック濃度 | 最終濃度 | 5 ゲル | 10 ゲル | |
| アクリルアミド/ビス-アクリルアミド (19:1) | 40% | 10% | 10 mL | 20 mL |
| トリス塩酸 pH 8.7 | 1 M | 0.375 M | 15 mL | 30 mL |
| ドデシル硫酸ナトリウム (SDS) | 20% | 0.10% | 200 Μ L | 400 Μ L |
| 脱イオン H2O | -- | -- | 14.4 ミリリットル | 28.7 mL |
| TEMED | -- | -- | 40 Μ L | 80 Μ L |
| APS | 10% | 0.10% | 400 Μ L | 800 Μ L |
| 総容積 | 40 mL | 80 mL | ||
| ペプチッド解決のゲル | ||||
| ストック濃度 | 最終濃度 | 5 ゲル | 10 ゲル | |
| アクリルアミド/ビス-アクリルアミド (19:1) | 40% | 10% | 5 mL | 10 mL |
| トリス塩酸 pH 8.7 | 1 M | 0.375 M | 7.5 mL | 15 mL |
| ドデシル硫酸ナトリウム (SDS) | 20% | 0.10% | 100 Μ L | 200 Μ L |
| 脱イオン H2O | -- | -- | 6.5 Μ L | 13 mL |
| 蛍光ペプチド | 10 mM | 75 Μ M | 150 Μ L | 300 Μ L |
| アジドフェニル PEG3 マレイミド架橋剤 | 75 mM | 1.5 mM | 400 Μ L | 800 Μ L |
| TEMED | -- | -- | 20 Μ L | 40 uL |
| APS | 10 | 0.10% | 200 Μ L | 400 Μ L |
| 総容積 | 20 mL | 40 mL | ||
| スタッキングのゲル | ||||
| ストック濃度 | 最終濃度 | 5 ゲル | 10 ゲル | |
| アクリルアミド/ビス-アクリルアミド (19:1) | 40% | 5% | 2.5 mL | 5 mL |
| トリス塩酸 pH 6.9 | 1 M | 0.125 M | 2.5 mL | 5 mL |
| ドデシル硫酸ナトリウム (SDS) | 20% | 0.10% | 100 Μ L | 200 Μ L |
| 脱イオン H2O | -- | -- | 14.75 mL | 29.5 mL |
| TEMED | -- | -- | 50 Μ L | 100 Μ L |
| APS | 10% | 0.10% | 100 Μ L | 200 Μ L |
| 総容積 | 20 mL | 40 mL | ||
表 1:蛍光ペプチド ザイモグラフィー ゲルを準備するための試薬テーブル。濃度と多層膜ペプチド ザイモグラフィー ゲルの準備のためのボリューム。
ディスカッション
におけるザイモグラムの現在の技術は、ネイティブ基板の蛋白の検出のためのポリアクリルアミドのゲルへの取り込みに依存します。これらの技術は広く使用いただいて中は、プロテアーゼを検出できる数でまだ限られました。ここでは、プロトコルは、どの蛍光灯、プロテアーゼ分解性ペプチドのポリアクリルアミド ゲルの解決に組み込まれている記述されていた。使用して結合共有結合アジドフェニル PEG3 マレイミド リンカー分子により分離・検出幅広いプロテアーゼのネイティブ基板現在達成可能であるよりも。高度可変蛍光ペプチド性研究者興味の彼らのプロテアーゼを対象とする基板を設計する能力を与えます。さまざまなペプチド ライブラリーを用いたプロテアーゼの識別された多数のペプチド基質とカスタム ペプチド製造商業のソースの数が高まっています。それは適切な蛍光消光を持ち、標準的なバッファーに溶け合うことは新しい蛍光ペプチドを開発することは困難することができます。したがって、ペプチド配列からの商業適応 C 末端のシステインを含むように使用可能な蛍光プロテアーゼの基質はしばしば新しい蛍光センサーの開発に成功した戦略。
このプロトコルを完了している間、注意は、検出された蛍光信号を減らすことができます大幅これ光に過度の露出を防ぐために蛍光ペプチド ゲルを処理しながらすべき。また、現在各ゲルで使用されるペプチド濃度は 75 μ M であります。これは、ペプチド ・ ペプチド過剰のアジドフェニル PEG3 マレイミド ソリューション必要があります少なくとも 20 モルのソリューションに追加することを念頭に置いて維持を節約するために濃度を低下させる調整できます。3 サイズ アジドフェニル PEG3 マレイミド キットを購入することができます (25、100 および 1000 mg)。著者に調製した溶液は-20 ° C で時間の短い期間にのみ格納できます、25 mg キットの購入をお勧めします。さらに、25 mg キットは 10 のペプチド ゲルを 3 週間の準備で使用する必要がありますを準備するのに十分です。
ザイモグラフィーの制限の 1 つは分子量のかなりの重複による可視化プロテアーゼ バンドの正確な id の検知の難易度です。今後の研究、それ重要になります質量16,17などの技術を使用してユーザー id を決定する二次分析を実施します。ザイモグラフィーのもう一つの制限は、次の SDS 電気泳動によって部分的な変化をアクティブな構造タンパク質のリフォールディングです。これらのプロセスは、生アクティブでない蛋白質をアクティブなレンダリング、プロテアーゼの活性コンフォメーション変化を可能性があります。抑制の親ドメインそのまま期限を持っていることにもかかわらずゼラチン手技でプロ MMP 2 を検出できますたとえば、中間のアクティブなフォームへの下に。酵素結合抗体法 (ELISA) のような補助的な手段または西部のしみはアイデンティティおよび興味のプロテアーゼの全存在を決定する使用できます。
この資料では、現在におけるザイモグラム技術の感度向上のため蛍光ペプチド基質の使用を示します。精製 MMP 9、濃度勾配解析を実施した LACW、QGIW、ゼラチンのザイモグラフィー ゲルを比較します。現在、ゼラチン ザイモグラフィーは、金本位法、gelatinases (MMP 2 と-9) は生体試料で検出されました。LACW ペプチド ゲル 3 つの基板の EC50値を比較すると、最高の感度を示す値の小さい方を持っていた。特定プロテアーゼの検出用に設計された別のペプチド配列を利用した可能性がありますさらにこれらの視感度を強化できます。4-aminophenylmercuric 酢酸 (APMA) やヘパリンなど MMP 活性剤とゲルの治療は、前述18として弱い信号をブーストするも使用できます。
生物学研究のプロテアーゼ活性の測定に加えてプロテアーゼ分解性ペプチドも架橋合成ゲル組織工学と薬配信アプリケーションのために使用されます。制御の低下はこれらのアプリケーションにとって重要です。現在、単一、精製された酵素を使用してこれらのペプチドの分解速度が特徴です。しかし、細胞が実際に生産し、これらのペプチドの胸の谷間は、どの酵素を決定を決定することは困難されています。細胞と組織特異的酵素の放出を定量化するペプチド ザイモグラフィーの使用を非常に架橋するこれらペプチドの配列の合理的な設計の援助します。
開示事項
著者が明らかに何もありません。
謝辞
オハイオ州大学大学工学、医用生体工学科、包括的がんセンター - アーサー g. ジェームス キャンサー ホスピタルとリチャード ・ j ・ ソロブ研究所によって提供される資金。
資料
| Name | Company | Catalog Number | Comments |
| 1.5 mm Empty Gel Cassettes | ThermoFisher Scientific | NC2015 | |
| 1.5 mm, 10 well Empty Gel Cassette Combs | ThermoFisher Scientific | NC3510 | |
| 1x Phosphate Buffered Saline | Fisher Scientific | 10-010-049 | |
| 20% SDS Solution | Ambion | AM9820 | |
| 3x Zymography Sample Buffer | Bio-Rad | 1610764 | |
| 40% (w/v) Acrylamide/Bis (19:1) | Ambion | AM9022 | |
| 6 Well Tissue Culture Plates | ThermoFisher Scientific | 087721B | |
| Amicon Ultra-2 Centrifugal Filter Unit (10 kDa MWCO) | Sigma-Aldrich | UFC201024 | |
| Ammounium Persulfate | Sigma-Aldrich | A3678 | |
| Azido-PEG3-Maleimide Kit | Click Chemistry Tools | AZ107 | |
| Calcium Chloride | ThermoFisher Scientific | BP510100 | |
| Dimethyl Sulfoxide | Fisher Scientific | BP231 | |
| Isopropanol | Fisher Scientific | A416P | |
| Micro BCA Protein Assay Kit | ThermoFisher Scientific | 23235 | |
| N N N' N'-Tetramethylethylenediamine (TEMED) | Sigma-Aldrich | T9281 | |
| PowerPac Basic Power Supply | Bio-Rad | 1645050 | |
| Precision Plus Protein Dual Color Standard | Bio-Rad | 161-0374 | |
| PrecisionGlide Hypodermic Needles | Fisher Scientific | 14-826 | |
| Round Bottom Flask (100 mL) | Fisher Scientific | 50-873-144 | |
| Septum Rubber Stopper | Fisher Scientific | 50-872-546 | |
| Sterile Slip Tip Syringe (1 mL) | Fisher Scientific | 14-823-434 | |
| Triton X-100 | Sigma-Aldrich | X100 | |
| Trizma hydrochlroide | Sigma-Aldrich | T5941 | |
| Typhoon 9410 Molecular Imager | GE Amersham | 8149-30-9410 | |
| Zinc Chloride | Sigma-Aldrich | 208086 |
参考文献
- Vandooren, J., Geurts, N., Martens, E., Vanden Steen, P. E., Opdenakker, G. Zymography methods for visualizing hydrolytic enzymes. Nature Methods. 10 (3), 211-220 (2013).
- Toth, M., Fridman, R. Assessment of Gelatinases (MMP-2 and MMP-9) by Gelatin Zymography. Methods in Molecular Medicine. 57, (2001).
- Heussen, C., Dowdle, E. B. Electrophoretic analysis of plasminogen activators in polyacrylamide gels containing sodium dodecyl sulfate and copolymerized substrates. Analytical Biochemistry. 102 (1), 196-202 (1980).
- Gogly, B., Groult, N., Hornebeck, W., Godeau, G., Pellat, B. Collagen zymography as a sensitive and specific technique for the determination of subpicogram levels of interstitial collagenase. Analytical Biochemistry. 255 (2), 211-216 (1998).
- Inanc, S., Keles, D., Oktay, G. An improved collagen zymography approach for evaluating the collagenases MMP-1, MMP-8, and MMP-13. BioTechniques. 63 (4), 174-180 (2017).
- Perera, H. K. I. Detection of Aspartic Proteinase Activities Using Gel Zymography. Zymography. , 43-52 (2017).
- van Beurden, P. A. M. S. noek-, Vonden Hoff, J. W. Zymographic techniques for the analysis of matrix metalloproteinases and their inhibitors. BioTechniques. 38 (1), 73-83 (2005).
- Oliver, G. W., Stetler-Stevenson, W. G., Kleiner, D. E., Zymography, Zymography, Casein Zymography, and Reverse Zymography: Activity Assays for Proteases and their Inhibitors. Proteolytic Enzymes. Springer Lab Manual. , Springer. Berlin, Heidelberg. 63-76 (1999).
- Deshmukh, A. A., Weist, J. L., Leight, J. L. Detection of proteolytic activity by covalent tethering of fluorogenic substrates in zymogram gels. BioTechniques. 64 (5), 203-210 (2018).
- Yasothornsrikul, S., Hook, V. Y. Detection of proteolytic activity by fluorescent zymogram in-gel assays. BioTechniques. 28 (6), 1172-1173 (2000).
- Leight, J. L., Alge, D. L., Maier, A. J., Anseth, K. S. Direct measurement of matrix metalloproteinase activity in 3D cellular microenvironments using a fluorogenic peptide substrate. Biomaterials. 34 (30), 7344-7352 (2013).
- Leight, J. L., Tokuda, E. Y., Jones, C. E., Lin, A. J., Anseth, K. S. Multifunctional bioscaffolds for 3D culture of melanoma cells reveal increased MMP activity and migration with BRAF kinase inhibition. Proceedings of the National Academy of Sciences of the United States of America. 112 (17), 5366-5371 (2015).
- Ren, Z., Chen, J., Khalil, R. A. Zymography as a Research Tool in the Study of Matrix Metalloproteinase Inhibitors. Methods in Molecular Biology. 1626, Clifton, N.J. 79-102 (2017).
- Nagase, H., Fields, G. B. Human matrix metalloproteinase specificity studies using collagen sequence-based synthetic peptide. Biopolymers. 40 (4), 399-416 (1996).
- Mucha, A., et al. Membrane Type-1 Matrix Metalloprotease and Stromelysin-3 Cleave More Efficiently Synthetic Substrates Containing Unusual Amino Acids in Their P1′ Positions. Journal of Biological Chemistry. 273 (5), 2763-2768 (1998).
- Thimon, V., Belghazi, M., Labas, V., Dacheux, J. -L., Gatti, J. -L. One- and two-dimensional SDS-PAGE zymography with quenched fluorogenic substrates provides identification of biological fluid proteases by direct mass spectrometry. Analytical Biochemistry. 375 (2), 382-384 (2008).
- Sun, X., Salih, E., Oppenheim, F. G., Helmerhorst, E. J. Activity-based mass spectrometric characterization of proteases and inhibitors in human saliva. Proteomics. Clinical Applications. 3 (7), 810-820 (2009).
- Yu, W., Woessner, J. F. Heparin-Enhanced Zymographic Detection of Matrilysin and Collagenases. Analytical Biochemistry. 293 (1), 38-42 (2001).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved