Method Article
Ex Vivo Визуализации ячейки конкретных кальция сигнализации на трехсторонней синапса диафрагмы мыши
В этой статье
Резюме
Здесь мы представляем протокол к изображение кальция сигнализации в популяциях типов индивидуальных клеток на перекрестке мышиных нервно.
Аннотация
Электрической активности клеток в тканях может контролироваться электрофизиологические методы, но они обычно ограничены к анализу отдельных клеток. Поскольку увеличение внутриклеточного кальция (Ca2 +) в цитозоле часто возникает из-за электрической активности, или в ответ на множество других раздражителей, этот процесс может контролироваться изображений клеток загружен с флуоресцентные кальция чувствительных красители. Однако трудно изображение этот ответ в типе отдельной ячейки в пределах всей ткани, потому что эти красители, принимаются все типы клеток в тканях. Напротив показатели генетически закодированный кальция (GECIs) может быть выражена типа отдельной ячейки и флуоресцировать в ответ на увеличение числа внутриклеточных Ca2 +, позволяя изображений Ca2 + сигнализации в всей популяции типы отдельных клеток. Здесь мы применяем использование GECIs GCaMP3/6 к мыши нервно-Джанкшн, трехсторонний синапса между двигательных нейронов, скелетных мышц и терминал/perisynaptic Шванновские клетки. Мы продемонстрировать полезность этой техники в классическом ex vivo ткани препаратов. С помощью оптического сплиттера, мы выполняем двойной длины волны изображений Ca2 + сигналов динамической и статической метки нервно-Джанкшн (NMJ) в рамках подхода, который может быть легко адаптирована для мониторинга двух клеток конкретных ГЕЧИ или генетически закодированный напряжения показатели (GEVI) одновременно. Наконец мы обсуждаем процедуры, используемые для захвата пространственных карты интенсивности флуоресценции. Вместе эти оптические, трансгенных и аналитические методы могут быть использованы для изучения биологической активности отдельных клеток субпопуляций в NMJ в самых разнообразных контекстах.
Введение
NMJ, как все синапсы, состоит из трех элементов: Пресинаптический терминал производным от нейрона, постсинаптических нейронов/эффекторных клеток, и perisynaptic глиальных клеток в1,2. Хотя основные аспекты синаптической передачи были впервые представлены на этом синапса3, многие аспекты этого процесса остается неизвестным, отчасти из-за выражение же молекул путем различных клеточных элементов этой синапса. Например рецепторы для пуриновых нуклеотидов аденина СПС и ацетилхолин (АКП), которые совместно выпущенная двигательных нейронов в позвоночных NMJ, выраженные мышцы, Шванновские клетки и двигательных нейронов, что затрудняет интерпретации любого функциональное действие, оказываемое этими веществами (например, передатчик выпуска или ответ, мышечной силы поколения)4. Кроме того хотя трехсторонний компоненты NMJ просты по сравнению с, например, нейронов в центральной нервной системе, которые часто exhibit несколько синаптических входов, ли двигательных нейронов, мышечных клеток или Шванновские клетки изменяться в ответ на стимулы на основе на их внутреннюю неоднородность (например, эмбриональных дифференцирование, волокна подтип, морфология) остается неясным. Для того, чтобы рассмотреть каждый из этих вопросов, было бы целесообразно одновременно отслеживать реакцию многих клеток в пределах одной синаптических элемента, а также трек, в то же время, такой ответ в любом из отдельных элементов. Обычные стратегии, используя химические красители для измерения сигналов кальция не могут достичь этих двух целей, потому что краска ванна прикладной занимает несколько типов клеток после применения к ткани, и внутриклеточно загружен краситель может использоваться только для визуализации отдельных лиц или небольших групп клеток. Здесь, используя трансгенных мышей, выражая GECIs предназначен для измерения кальция клеток конкретных сигнализации, вместе с конкретных изображений и программного обеспечения инструменты5, мы продемонстрировать первый из этих двух общих целей и обсудить как добавление новых Трансгенные инструменты поможет достижению второй. Эта техника будет полезно для тех, кто заинтересован в отслеживания динамики кальция или других сотовых сигнализации наблюдаемых событий через ген закодированы оптических датчиков в несколько клеточных популяций в то же время.
протокол
Животноводство и эксперименты были проведены в соответствии с национальными институтами здравоохранения руководство для ухода и использования лабораторных животных и IACUC при университете Невады.
1. Подготовка диафрагмы и диафрагмального нервов от трансгенных мышей
- Покупка трансгенных мышей и праймеры олигонуклеотида с генотипом этих мышей.
Примечание: Праймеры, перечислены на странице «Информация» для каждого из этих мышей.- Порода 3-6-месячного мыши, выражая одну копию соответствующего аллеля трансгенных/запрессовка Cre водитель и нулевой копии условного аллеля GCaMP3/6 с второй мыши того же возраста, выражая одну или две копии условного GCaMP3 / 6 аллели и нулевой копии аллеля Cre водитель.
- Генотип детенышей и Марк те, которые имеют КРР и условного аллели GCaMP3/6 — это будет отныне называться двойной трансгенных мышей (например, Myf5-Cre, условного GCaMP3)6.
Примечание: Таким образом, все данные будут наследовать от мышей, выражая одну копию КРР и условного аллели GCaMP3/6. Это особенно важно при добавлении в других мутантных мышей (например, нокауты) эти кресты.
- При двойной трансгенных мышей соответствующего возраста (например, послеродовой день 0 или 5 [Р0 или P5] или взрослый), усыпить мышей путем обезглавливания их с ножницами (для мышей моложе P10) или путем размещения их в камеру ингаляции изофлюрановая — когда они являются больше не реагировать щипать хвост с парой щипцов, они готовы к самопожертвованию.
- Жертву животное, обезглавливание с ножницами.
- Поперек секции через весь животное чуть ниже печени и чуть выше сердца и легких иридэктомия ножницами.
- Вскрыть прочь, печени, сердца и легких, стараясь сохранить длину диафрагмальный нерв, который достаточно долго, чтобы быть втянутым в всасывания электрода (т.е., 1-2 см).
Примечание: Левый диафрагмальный нерв могут быть определены как кусок белой ткани, которая входит в медиальной части влево диафрагмы. Это не должны быть обрезаны, когда удаление легких. Право диафрагмальный нерв проходит внутри кусок фасции, который также содержит верхней полой вены и тоньше и белее, чем верхней полой вены. Вместе они оба проникают прямо медиальной диафрагмы. - Далее удалите грудной клетки и позвоночника, за исключением тонкий хребта вокруг диафрагмы.
- Место диафрагмы и образец диафрагмального нерва в трубу отцентрифугировать Кребса-звонарь раствором с 1 мкг/мл 594-αBTX 10 мин в темноте.
Примечание: Эта концентрация 594-αBTX этикетки ACh рецепторы (AChRs) без блокирования их функции (личное наблюдение).
2. стимуляция и запись действий потенциалов мышц
- С помощью minutien Пен, иммобилизации диафрагмы, закрепляя его на 6 см блюдо с диэлектрической силиконовый гель покрытием и заполнены с ~ 8 мл раствора кислородом Кребса-звонарь и поместить его на этап микроскопа. Perfuse диафрагма с более Кребса-Рингера раствор (8 мл/мин) за 30 мин.
Примечание: Это произведет промывку несвязанных 594-αBTX, а также уравновешивает ткани после вскрытия. - Сделайте всасывания электрода согласно установленных методов7.
- При 4-кратном, используя микроманипулятор наведите левый диафрагмальный нерв всасывания электрода и применять всасывания, потянув ствола 5-мл шприц, подключенных к трубки, которая прилагается к всасывания электрода.
Примечание: Когда успешно втянуты всасывания электрода, диафрагмальный нерв тугой. Включите стимулятор и стимулировать диафрагмальный нерв, щелкая ручной переключатель 1 x. - Убедитесь, что диафрагма контрактов в ответ на стимуляцию 1 Гц, визуально изучив его с brightfield освещения. Если нет, то отрегулировать напряжение, повернув регулятор напряжения постепенно добиться supramaximal импульсов, которые могут быть проверены путем визуального осмотра мышц. Если до сих пор не видно, задуть нерва с шприц и пытаются нарисовать его снова, применяя всасывания.
- При 4-кратном, используя микроманипулятор наведите левый диафрагмальный нерв всасывания электрода и применять всасывания, потянув ствола 5-мл шприц, подключенных к трубки, которая прилагается к всасывания электрода.
- Выключить перфузии и добавьте мышц конкретных миозин ингибитор БХК6 или закрытом напряжения натрия канал антагонист µ-conotoxin8 до конечной концентрации 100 мкм.
- Чтобы сделать 100 мкм БХК, Пипетка 4 мкл акций 200 мм в ДМСО и predilute в 1 мл раствора Кребса-звонаря.
- 1 мл раствора Кребса-звонарь снять блюдо.
- Добавьте prediluted БХК, блюдо.
Примечание: Этот predilution помогает предотвратить индукции в неразбавленном ДМСО непереходными флуоресцентные ответ в GCaMP3-выражая клеток. - Подождите 30 минут, а затем, включите перфузии свежих Кребса-звонарь решение для еще 20-30 мин.
- Подготовка записи электрода.
- Перчатках, уложите микропипеткой съемник боросиликатного стекла filamented с внешнего диаметра (OD) 1 мм и внутренним диаметром 0,4 мм (ID) и затяните циферблатов зажать его в положение. Закройте дверцу съемник.
- С помощью съемника P-97, программа следующий параметр: тепло в 900, тянуть на 120, скорость на 75, время на 250, давление в 500 и без дополнительных петель.
Примечание: Resistance (R) измеряется с помощью программного обеспечения управления усилителя: программное обеспечение получения данных подтверждает сопротивление путем решения по формуле V = IR. Программное обеспечение контроллера проходит известный ток (I) (обычно 1 НС) через электрод и измеряет изменение напряжения (V), что позволит нам решить для р. - Для эмбриональных диафрагмы что обеспечивает сопротивление около 60 MΩ и для старых диафрагмы, 10-20 MΩ. Загрузите запись электрод с 3 M KCl.
- При 10-кратном опустите электрода в мышцы, используя второй микроманипулятор на противоположной стороне сцены как стимулирующий электрода.
- С помощью электрофизиологических данных приобретения программного обеспечения, подождать, пока мембранный потенциал покоя изменяется от 0 до -65 mV или ниже.
- Стимулирование на 1 Гц и проверить наличие потенциал действия мышц путем проверки для большой потенциал, что экспонаты скромный выброс (потенциал, который поднимается выше 0 mV, когда она начинается -65 mV или ниже). Не путайте стимуляции артефакт с потенциал действия.
Примечание: Потенциал значительно больше в продолжительности (~ 5 мс) чем стимуляции артефактов.
3. томография флуоресценции образца
- При 20-кратном, найдите концевую полоса в центре мышцы, ищет 594-αBTX-меченых NMJs под желто зеленый свет возбуждения (550 Нм). Переключиться на синий свет возбуждения (470 Нм) для изображения Ca2 + ответы в мышцы, мотонейрона или Шванновские клетки.
- При желании настройте изображение разделителя с полосовых фильтров и дихроичный фильтр краевыми для отображения двойной длины волны.
- Чтобы вычислить максимальное флюоресценция (Fmax) выставлены GCaMP3/6-выражая ткани, мкл 12 3 M хлорида калия (KCl) Диафрагма препаратов6.
- Проводить эксперименты с панель яркости на панели таблицы подстановки, установите 110% от уровня, на котором GCaMP3/6-выражая ткани экспонатов насыщения при 20-кратном, без биннинга в ответ KCl.
- Запись при 20 кадрах в секунду, чтобы не пропустить никаких быстрых событий.
- Стимулировать с 1-45 s 20-40 Гц нерва стимуляции, обеспечивая поезд импульсов с помощью всасывания электрода или добавить фармакологических агонисты Ванна приложением или перфузии и собирать динамических флуоресцентные Ca2 + ответы в одной ячейке подтип Вместе с сигналом NMJ статические 594-αBTX.
Примечание: Если ткани конкретных красного или far-red ГЕЧИ или GEVI мышей становятся доступными для использования в NMJ, они могут использоваться для сбора двух динамических сигналов, отражающие двух отдельных клеточных элементов в NMJ. - Когда изображения или электрофизиологических эксперименты закончены потому, что были достигнуты желаемые результаты, perfuse воды через линии перфузии и сосать воду 2 x - 3 x через всасывания электрод для обеспечения что соли не строить.
4. экспорт и анализ данных по стандартное отклонение люминесцентная интенсивности карта (SDiu16)
- Запись последовательности изображений, как 16-битных TIFF стеки и загрузить их в нужный визуализации система анализа данных для анализа.
- В меню файл 8d программного обеспечения выберите Стек изображений интерес и нажмите кнопку Загрузить.
- После того, как видео загрузится, сканировать через время, чтобы определить раздел, который имеет не клеточную активность флуоресцентные.
Примечание: Этот регион будет использоваться для создания фона образца. - Удерживайте клавишу Shift и нажмите, чтобы рисовать региона интерес (ROI) поле в области определены как области образец фона.
- После создания поле, нажмите клавишу пробел для создания участок изменения фоновой активности.
- Щелкните правой кнопкой мыши трассировку и выберите параметр ассорти представить вариант Дамп ROI как текст чтобы трассировки xy координаты текстового файла.
- После того, как видео загрузится, сканировать через время, чтобы определить раздел, который имеет не клеточную активность флуоресцентные.
- Переход обратно к видео интерес, сканирования снова определить время регион, где происходит действие интерес.
- С помощью средней кнопки мыши, выберите этот регион время в поле время желтый.
- Щелкните правой кнопкой мыши на видео и выберите Стек УОП и стат карта вариант 5.
Примечание: Это будет генерировать стандартное отклонение (SD карта) в левом окне. - Нажмите на карту SD и затем нажмите [ ] 19 x применять тепла карта соответствующего цвета.
- Щелкните правой кнопкой мыши на карте SD и выберите STM загрузки и сохранения, которая представит параметр сохранить stm как tiff , чтобы сохранить SD карту.
- Затем, нажмите [ ключ 19 x вернуться к карте серого цвета.
- Нажмите C и D воспитывать средства сопоставления плотности. Используя левую кнопку мыши и кнопкой мыши центр, отрегулируйте порог включить все флуоресцентные деятельность, показано на SD карте.
- Нажмите C , чтобы закрыть плотность инструменты при сохранении настройки порога.
- Щелкните правой кнопкой мыши на карте SD и выберите STM частицы , а затем Найти PTCLS.
Примечание: Это будет идентифицировать отдельные клетки, выражая флуоресцентные активности. - Еще раз щелкните правой кнопкой мыши на карте SD и выберите Создать частиц ROIs.
Примечание: Это будет накладывать выбранные ячейки на оригинальное видео интерес. - Удерживая клавишу Shift, щелкните правой кнопкой мыши на любой из теперь выявленных частицы ROIs на оригинальное видео.
- Выберите маркер ROI и мера Int в ROI.
Примечание: Это будет генерировать отдельных флуоресцентные активности участков для каждого выявленных ROI в видео интерес. Эти можно сохранить, щелкнув правой кнопкой любой из этих и выбор ассорти, следуют Дамп ROI как текст.
- Для детальной логики, лежащих в основе этих операций пожалуйста, смотрите файл исходного кода9.
Результаты
Несколько примеров изменения интенсивности флуоресценции, посредничестве увеличивает внутриклеточную Ca2 + в пределах определенных клеток типы NMJ, показать полезности такого подхода. Эти результаты представлены в виде пространственной флуоресценции интенсивности карты, которые предоставляют расположение ответивших клеток, а также интенсивность их ответов, таким образом позволяя для оценки как многие клетки реагируют и сколько каждая клетка реагирует к конкретному стимул. Например как показано на рисунке 1, мы взяли видео Ca2 + ответы в популяции терминала/perisynaptic Шванновские клетки (TPSCs) на NMJs диафрагмы P7 Wnt1-Cre; Условные GCaMP3-выражая мыши в ответ на стимуляцию диафрагмального нерва и определены субпопуляции клеток ответивших пространственной флуоресценции интенсивности карты. Эти карты интенсивности флуоресценции представлены как тепловой карты и цветом согласно таблицы подстановки цвет Fire (огонь CLUT). Мы записали эти видео с и без разделения изображения одновременно просматривать кластеры α-BTX-меченых AChRs в середине диафрагмы (видео 1 и 2), подход, который может быть легко адаптирована для захвата динамический ГЕЧИ или GEVI ответы от двух разных клеток типов, при том условии, что каждый из них экспонаты non перекроя возбуждения и выбросов спектров.
На рисунке 2, мы провели же эксперимент стимуляции нерва на диафрагму P4 Myf5-Cre; условное GCaMP3-выражая мыши и образы Ca2 + ответы в мышечных клетках. Интересно, что когда мы использовали миозин блокатор БХК или скелетных мышц конкретные закрытый напряжения натрия канал (Nav1.4) блокатор µ-conotoxin (рис. 2A и 3 видео или Рисунок 2B и видео 4, соответственно) , мы визуализирована Ca2 + переходные процессы которые путешествуют по всей длине волокна мышцы, действие потенциал и опосредованным путем выпуска Ca2 + от саркоплазматический ретикулум, или просто длина концевую группы, т.е. концевую потенциал и опосредованный внеклеточного Ca2 + приток через AChR.In дополнение к выявления субпопуляции ответивших клеток с пространственной флуоресценции интенсивности карты (SD), как показано на рисунке 1, мы также измеряется изменения в флуоресцировании со временем в популяции этих клеток мышцы с пространственно-временных (ST) карты. Каждый из этих экспериментов представляет тип различных клеток, разного возраста, другое лечение (стимуляция против нерва стимуляция нерва при наличии разных препаратов) и различных видов анализа (пространственных против пространственно-временных интенсивность флуоресценции карты). Эти цифры также иллюстрируют один из наиболее полезных особенностей трансгенных мышей, выражая GCaMP, а именно способность постоянно стимулировать образ того же образца и, таким образом, проверить действие условий различных лечения.

Рисунок 1: Измерение деятельности индуцированной Шванновские клетки Ca2 + ответов в Диафрагма и диафрагмальный нерв P7 Wnt1-Cre; мышей условного GCaMP3 . (A) (слева) средняя флуоресценции интенсивности изображения, показывая фоновые уровни флюоресценции в Шванновские клетки вдоль ветвей диафрагмальный нерв и нервно на перекрестке (NMJ), был захвачен до стимуляции нерва (Prestim). Значения этого фон флуоресценции были вычитается из флуоресценции значений, полученных после стимуляции нерва. (Справа) Пространственные карта стандартного отклонения единиц интенсивности флуоресценции 16-битный (16SDiu) Ca2 + ответов, созданных после 30 s 40 Гц диафрагмального нерва стимуляции (Stim карта или карта SD) показывает надежный ответ в терминал/perisynaptic Шванн клетки (TPSCs) в NMJ. Heatmap CLUT огонь в SDiu16 и линейки шкалы в мкм. Все изображения в панели B - E являются же увеличение как те в группе А. (B) (слева) с 594-конъюгированных α-bungarotoxin (α-BTX), которая связывает и этикетки ацетилхолину рецепторы (AChRs) и возбужденных с желто зеленый свет для идентификации NMJ был назван же диафрагмы. (Справа) Эта панель показывает образ brightfield же диафрагмы, показаны кончик внутриклеточных записи электрода (стрелка), которые могут руководствоваться NMJ, основана на α-BTX маркировки. (C) Ca2 + переходных функций (например, интенсивность, начала после стимуляции, продолжительность) отдельные ячейки или группы ячеек могут быть оценены демаркации отдельных регионов на карте пространственные интенсивности как частицы (слева), регионов их как цветные интерес (ROI) и (D) построения их интенсивности во времени. (E) Эта группа показывает изображения двойной длины волны GCaMP3-опосредованной флуоресцентные Ca2 + ответы и 594-α-меченых NMJs же диафрагмы, используя изображение разделителя Близнецы после стимуляции нерва. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Видео 1: кино без изображения расщепления деятельности индуцированной Шванновские клетки Ca 2 + ответы на P7, как подробно описано в Рисунок 1 легенда. Пожалуйста нажмите здесь, чтобы посмотреть это видео. (Правой кнопкой мыши для загрузки.)
Видео 2: фильм с изображения расщепления деятельности индуцированной Шванновские клетки Ca 2 + ответы и 594- Α-BTX-меченых AChRs на P7, как подробно описано в Рисунок 1 легенда. Пожалуйста нажмите здесь, чтобы посмотреть это видео. (Правой кнопкой мыши для загрузки.)
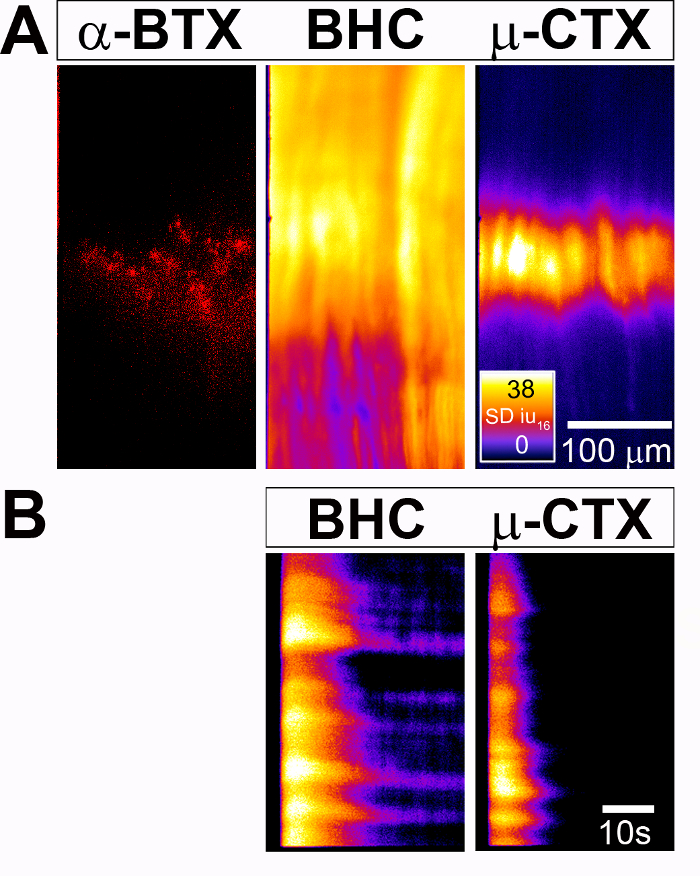
Рисунок 2: Измерение деятельности индуцированной мышечных клеток Ca2 + ответов в Диафрагма P4 Myf5-Cre; мышей условного GCaMP3 . (A) (слева) никотиновой АКПЧ кластеры расположен концевую группы диафрагмы помечены 594-α-BTX. (Средний) Пространственные карта Ca2 + переходных интенсивностей (SD карта), сформированное после 30 s 40 Гц диафрагмального нерва стимуляции присутствии миозин ингибитор БХК, показывает ответ во всем регионе всех клеток мышцы диафрагмы. (Справа) В противоположность этому, SD карта, созданные из же диафрагмы, после же стимуляции, но в присутствии Nav1.4 антагонист µ-conotoxin (μ-CTX), экспонаты пространственно ограниченных ответ в регионе медиальной всех мышц диафрагмы клетки, соответствует группе кластера обогащенный концевую АКПЧ. Heatmap CLUT огонь в SDiu16 и линейки шкалы в мкм. (B) Эта группа показывает пространственно-временных карты Ca2 + переходных интенсивности с течением времени (ST карт) в популяции мышечных клеток (y-ось) затем со временем (x-оси). В баре масштаба — в секундах. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Видео 3: фильм о деятельности индуцированной мышечных клеток Ca 2 + ответы присутствии миозин блокатор БХК в P4, как подробно описано в Рисунок 2A легенда. Пожалуйста нажмите здесь, чтобы посмотреть это видео. (Правой кнопкой мыши для загрузки.)

Видео 4: фильм о деятельности индуцированной мышечных клеток Ca 2 + ответы в присутствии НС v 1.4 антагонист µ-conotoxin в P4, как подробно описано в Рисунок 2B легенда. Пожалуйста нажмите здесь, чтобы посмотреть это видео. (Правой кнопкой мыши для загрузки.)
Обсуждение
Здесь мы предлагаем некоторые примеры измерения Ca2 + ответы в определенных ячейках нетронутыми нервно-мышечной ткани, с помощью выражения ГЕЧИ мышей. Для того, чтобы успешно выполнить эти эксперименты, крайне важно, чтобы не травмировать диафрагмального нерва во время вскрытия. Чтобы изображение Ca2 + ответы в Шванновские клетки на низкой или высокой мощности (т.е., 20 X или 60 X), необходимо использовать БХК или µ-conotoxin блок движения. Для маломощных изображений Ca2 + ответов в мышечных клетках, это можно измерить их в отсутствие этих препаратов, позволяя Одновременное приобретение мышц Ca2 + переходных интенсивности и мышечные изменения длины во время ВЧ-нерва стимуляции6. При выполнении нескольких экспериментов на того же образца, необходимо отделить каждый из них, по крайней мере 15 минут, во время которого может быть увлажненную образца. Эти шаги позволяют для повторных изображений стимуляции индуцированного Ca2 + ответы от той же поле зрения в том же образце для по крайней мере 3-5 часов. Важно также к predilute препаратам, растворенных в ДМСО, как описано для БХК, ДМСО, применяется непосредственно на GCaMP выражая ткани вызывает необратимые, стимул независимые флуоресценции ответы.
Мы обнаружили, что по причинам, которые остаются неясными, Wnt1-Cre; conditionalGCaMP3/6 мышей не выставлять стимуляции нерва или агонист индуцированной Ca2 + ответы в Шванновские клетки после P15 - P20. Однако, Sox10-Cre; Условные GCaMP3/6 мышей по-прежнему выставлять эти ответы по крайней мере, как в конце P56, самый возраст, который мы изучили. В отличие от Myf5-условный GCaMP3/6 мышей экспонат ответы так же стара, как один год, самый возраст изучены.
Выражая ГЕЧИ мышей предоставляют уникальные возможности для визуализации Ca2 + ответы в всей популяции клеток конкретных подтипа, существуют некоторые ограничения, такие как неспособность выполнить ratiometric изображений и, таким образом, извлечь количественных Ca 2 + измерения. Существуют также ограничения на количество глубины ткани, из которой эти ответы можно образы с помощью микроскопии флуоресцирования widefield (то есть, в отличие от использования multiphoton или конфокальная микроскопия). Таким образом, в то время как тонкость диафрагмы поддается для применения методов, представленные здесь, захватив клеток конкретных Ca2 + ответы в типах клеток NMJ в других мышц, которые толще может потребовать суб рассечение или других видов из микроскопии флуоресцирования.
Эти генетические и оптические инструменты представляют собой значительное улучшение над предыдущим Ca2 + методы, которыми быть imaged только несколько типов клеток или несколько отдельных ячеек в одной ячейке тип визуализации. Дополнительным преимуществом является, что Ca2 + ответы могут быть repeatably образы для длительных периодов времени от тех же ячейках с помощью ГЕЧИ мышей, тогда как это не легко можно с помощью традиционных химических Ca2 +-привязка флуоресцентных красителей. Наконец с помощью изображения разделителя, мы выполнить двойной длины волны изображений динамического сигнала в пределах одной ячейки типа (Шванновские клетки) и фиксированные метки в секунду (мышечных клеток) и, таким образом, показать как несколько клеток конкретных кальция или напряжения, что ответы могут быть оценены) например, клеток Шванн Cre вождения мыши, перешли к условной Cre зависимой GCaMP мыши как сообщили здесь, перешли к трансгенные мыши Cre независимые, выражая мышечных клеток конкретных ГЕЧИ или GEVI с non перекроя возбуждения флуоресценции / спектры выбросов10, позволило бы одновременное отслеживание динамических Ca2 + и/или напряжения изменений в Шванн и мышечных клеток). Такие инструменты могли бы помочь оценить ли ответ одной ячейки типа на конкретные стимулы, например пуриновых АТФ или ее разбивка продукта аденозина, прямо или косвенно опосредованной, прямое воздействие на другой тип ячейки в NMJ.
Основная цель этих исследований заключалась в оценке пространственно-временных Ca2 + ответ шаблон ячейки подтипы для стимуляции нерва, но методы, используемые для достижения этой цели может быть развернут на другие цели. Например, они могут использоваться для анализа Ca2 + ответы при наличии определенных антагонисты или в некоторых мутантных стола, такие как в конкретных моделях животных, болезни двигательного нейрона, мышечная дистрофия или болезнь Шарко-Мари зуб, для анализа CA2 + ответ на конкретные агонисты для оценки экспрессии рецепторов, оценить неоднородность Ca2 + ответ функций внутри клетки подтип на раздражитель, или для сравнения Ca2 + ответы в субклассе клетки других функциональных ответы в пределах этого типа (electrophysiologically записанные мышцы концевую или действий потенциалов, оптически фотосъемка мышечные сокращения, силы датчика Записанная мышечное напряжение, и т.д.) или другие параметры (например, должность Специального Оценка морфология Шванновские клетки нерва/мышцы или молекулярные выражения через иммуногистохимия). Вместе эти исследования показывают как клеток конкретных ГЕЧИ или GEVI мышей может использоваться для освещения широкий спектр физиологических процессов в СИНАПС состоит из генетически идентифицировать, клетки конкретных материалов.
Раскрытие информации
Авторы не имеют ничего сообщать.
Благодарности
Эта работа было поддержано средств от национальных институтов здравоохранения (НИЗ) GM103554 и GM110767 (T.W.G.) и национального центра по 5P20RR018751 научно-исследовательских ресурсов и национального института Генеральной медицинских наук 8P 20 GM103513 (для G.W.H.).
Материалы
| Name | Company | Catalog Number | Comments |
| Myf5-Cre mice | Jax | #007893 | Drives muscle cell expression as early as E136 |
| Wnt1-Cre mice | Jax | #003829 | Drives expression into all Schwann cells at E13 but not P209 |
| Sox10-Cre mice | Jax | #025807 | Drives Schwann cell expression at older ages |
| Conditional GCaMP3 mice | Jax | #029043 | Expresses GCaMP3 in cell-specific fashion |
| Conditional GCaMP6f mice | Jax | #024105 | Expresses GCaMP6f in cell-specific fashion |
| BHC (3-(N-butylethanimidoyl)-4-hydroxy-2H-chromen-2-one) | Hit2Lead | #5102862 | Blocks skeletal muscle myosin but not neurotransmission6 |
| CF594-α-BTX | Biotium | #00007 | Labels acetylcholine receptor clusters at NMJ |
| µ-conotoxin GIIIb | Peptides Int'l | #CONO20-01000 | Blocks Nav1.4 voltage-dependent sodium channel8 |
| Silicone Dielectric Gel; aka Sylgard | Ellswoth Adhesives | # Sil Dielec Gel .9KG | Allows for the immobilization of the diaphragm by minutien pins |
| Minutien pins (0.1mm diameter) | Fine Science Tools | 26002-10 | Immobilizes diaphragm onto silicone dielectric gel |
| Eclipse FN1 upright microscope | Nikon | MBA74100 | Allows staging and observation of specimen |
| Basic Fixed Microscope Platform with Manual XY Microscope Translator | Autom8 | MXMScr | Allows movement of specimen |
| Manual micromanipulator | Narishige | M-152 | Holds recording and stimulating electrodes |
| Microelectrode amplifier | Molecular Devices | Axoclamp 900A | Allows sharp electrode intracellular electrophysiological recording |
| Microelectrode low-noise data acquisition system | Molecular Devices | Digidata 1550 | Allows electrophysiological data acquisition |
| Microelectrode data analysis system | Molecular Devices | PCLAMP 10 Standard | Performs electrophysiological data analysis |
| Square wave stimulator | Grass | S48 | Stimulates nerve to excite muscle |
| Stimulus Isolation Unit | Grass | PSIU6 | Reduces stimulation artifacts |
| Borosilicate filaments, 1.0 mm outer diameter, 0.5mm internal diameter | Sutter | FG-GBF100-50-15 | Impales and records nerve-evoked muscle potentials |
| Borosilicate filaments, 1.5 mm outer diameter, 1.17mm internal diameter | Sutter | BF150-117-15 | Lengthened and used for suction electrode |
| Micropipette Puller | Sutter | P-97 | Pulls and prepares recording electrodes |
| 1200x1200 pixel, back-illuminated cMOS camera | Photometrics | Prime 95b | Sensitive camera that allows high-resolution, high-speed imaging |
| Light Source | Lumencor | Spectra X | Provides illumination from LEDs for fluorescence obsevation |
| Infinity-corrected fluorescent water immersion objectives, W.D. 2mm | Nikon | CFI60 | Provide long working distances for visualization of specimen |
| Fiber Optic Illuminator with Halogen lamp | Sumita | LS-DWL-N | Provides illumination for brightfield observation |
| W-View Gemini Image Splitter | Hamamatsu | A12801-01 | Projects 1 pair of dual wavelength images separated by a dichroic to single camera |
| Single-band Bandpass Filters (512/25-25 and 630/92-25) | SemRock | FF01-512/25-25; FF01-630/92-25 | Permits dual band imaging |
| 560 nm Single-Edge Dichroic Beamsplitter | Sem Rock | FF560-FDi01-25x36 | Dichroic mirror which separates beams of light to allow dual-wavelength imaging |
| Imaging data acquisition system | Nikon | NIS Elements - MQS31000 | Allows imaging data acquisition |
| Wavelength control module | Nikon | MQS41220 | Module for imaging data acqusiition |
| Emission splitter hardware module | Nikon | MQS41410 | Module for imaging data acqusiition |
| Imaging data analysis system | NA | Volumetry 8D5, Fiji | Allows analysis of fluorescence intensity and other imaging data |
Ссылки
- Sanes, J. R., Lichtman, J. W. Development of the vertebrate neuromuscular junction. Annual Review of Neuroscience. 22, 389-442 (1999).
- Darabid, H., Perez-Gonzalez, A. P., Robitaille, R. Neuromuscular synaptogenesis: coordinating partners with multiple functions. Nature Reviews Neuroscience. 15 (11), 703-718 (2014).
- Fatt, P., Katz, B. An analysis of the end-plate potential recorded with an intracellular electrode. Journal of Physiology. 115 (3), 320-370 (1951).
- Todd, K. J., Robitaille, R. Purinergic modulation of synaptic signalling at the neuromuscular junction. Pflugers Archive. 452 (5), 608-614 (2006).
- Hennig, G. W., et al. Use of Genetically Encoded Calcium Indicators (GECIs) Combined with Advanced Motion Tracking Techniques to Examine the Behavior of Neurons and Glia in the Enteric Nervous System of the Intact Murine Colon. Frontiers of Cellular Neuroscience. 9, 436 (2015).
- Heredia, D. J., Schubert, D., Maligireddy, S., Hennig, G. W., Gould, T. W. A Novel Striated Muscle-Specific Myosin-Blocking Drug for the Study of Neuromuscular Physiology. Frontiers of Cellular Neuroscience. 10, 276 (2016).
- Johnson, B. R., Hauptman, S. A., Bonow, R. H. Construction of a simple suction electrode for extracellular recording and stimulation. Journal of Undergraduate Neuroscience Education. 6 (1), A21-A26 (2007).
- Hong, S. J., Chang, C. C. Use of geographutoxin II (mu-conotoxin) for the study of neuromuscular transmission in mouse. British Journal of Pharmacology. 97 (3), 934-940 (1989).
- Heredia, D. J., Feng, C. Y., Hennig, G. W., Renden, R. B., Gould, T. W. Activity-induced Ca2+ signaling in perisynaptic Schwann cells of the early postnatal mouse is mediated by P2Y1 receptors and regulates muscle fatigue. Elife. 7, e30839 (2018).
- Cho, J. H., et al. The GCaMP-R Family of Genetically Encoded Ratiometric Calcium Indicators. ACS Chemical Biology. 12 (4), 1066-1074 (2017).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены