Method Article
Ex Vivo Proyección de imagen del calcio celular específicos de señalización en la sinapsis tripartita del diafragma del ratón
En este artículo
Resumen
Aquí presentamos un protocolo de calcio imagen señalización en poblaciones individuales de tipos de células en la Unión neuromuscular murino.
Resumen
La actividad eléctrica de las células en los tejidos puede ser monitoreada por técnicas electrofisiológicas, pero éstos se limitan generalmente para el análisis de células individuales. Ya que un aumento del calcio intracelular (Ca2 +) en el citosol ocurre a menudo debido a la actividad eléctrica, o en respuesta a una multitud de otros estímulos, este proceso puede ser monitoreado por la proyección de imagen de células cargadas con fluorescente sensible al calcio colorantes. Sin embargo, es difícil esta respuesta en un tipo de células individuales dentro del tejido de todo la imagen porque estos tintes son tomados por todos los tipos de células dentro del tejido. En cambio, los indicadores genético codificados calcio (GECIs) pueden expresarse mediante un tipo de célula individual y fluorescencia en respuesta a un aumento de intracelular Ca2 +, lo que permite la proyección de imagen de Ca2 + en poblaciones enteras de tipos de células individuales. Aquí aplicamos el uso de GECIs GCaMP3/6 a la Unión neuromuscular de ratón, células de Schwann de sinapsis entre las neuronas motoras, el músculo esquelético y terminal/perisynaptic tripartita. Demostramos la utilidad de esta técnica en preparaciones de tejido clásico ex vivo . El uso de un divisor óptico, realizar proyección de imagen de doble longitud de onda de Ca2 + señales de dinámica y estática etiqueta de la placa neuromuscular (NMJ) en un enfoque que podría ser fácilmente adaptado para monitorear dos GECI específicos de la célula o voltaje genéticamente codificado indicadores (GEVI) simultáneamente. Finalmente, discutimos las rutinas que utilizan para capturar mapas espaciales de intensidad de fluorescencia. Juntos, pueden emplearse estas técnicas ópticas, transgénicos y analíticas para el estudio de la actividad biológica de las subpoblaciones de células distintas en el NMJ en una amplia variedad de contextos.
Introducción
El NMJ, como todas las sinapsis, se compone de tres elementos: una terminal presináptica deriva de una neurona, una célula postsynaptic neurona/efector, y un perisynaptic glial de la célula1,2. Mientras que los aspectos básicos de la transmisión sináptica se demostraron por primera vez en esta sinapsis3, muchos aspectos de este proceso siguen siendo desconocidos, en parte debido a la expresión de las moléculas del mismo por los distintos elementos celulares de esta sinapsis. Por ejemplo, se expresan receptores para acetilcolina (ACh) tanto el nucleótido de purina adenina ATP que conjuntamente son liberados por las neuronas motoras en lo vertebrado NMJ, músculo, células de Schwann y las neuronas motoras, así que complica la interpretación de cualquier efecto funcional ejercida por estas sustancias (p. ej., liberación de transmisor o respuesta, generación de fuerza muscular)4. Por otra parte, aunque los componentes tripartitos de la NMJ son simples en comparación con, por ejemplo, las neuronas en el sistema nervioso central que a menudo exhiben múltiples entradas sinápticas, si las neuronas motoras, las células musculares o las células de Schwann varían en respuesta a estímulos en en su intrínseca heterogeneidad (p. ej., derivación embrionaria, subtipo de fibra, morfología) es confuso. Para abordar cada uno de estos temas, sería ventajoso seguir simultáneamente la respuesta de muchas células dentro de un elemento sináptica, como pista, a la vez, una respuesta en cualquiera de los otros elementos. Estrategias convencionales utilizando colorantes químicos para medir calcio señalización no pueden alcanzar estos dos objetivos, porque aplicar baño de tinte es tomado por varios tipos de la célula después de la aplicación al tejido, y tinte intracelular cargado puede utilizarse para visualizar individuales o pequeñas cohortes de las células. Aquí, utilizando ratones transgénicos que expresaban GECIs diseñado para medir calcio celular específico señalización, junto con la proyección de imagen específica y herramientas de software5, que demostrar la primera de estas dos metas generales y discutir cómo la adición de nuevos herramientas de transgénicos ayudaría a alcanzar al segundo. Esta técnica será útil para cualquier persona interesada en el seguimiento de la dinámica del calcio u otro celular señalización observable de eventos a través de sensores ópticos codificada por el gen en varias poblaciones de la célula al mismo tiempo.
Protocolo
Cría de animales y los experimentos se realizaron según los institutos nacionales de salud guía para el cuidado y uso de animales de laboratorio y la IACUC en la Universidad de Nevada.
1. preparación de los diafragmas y los nervios frénicos de ratones transgénicos
- Comprar ratones transgénicos y cartillas del oligonucleótido a genotipo de estos ratones.
Nota: Los iniciadores están listados en la página de "Información" para cada uno de estos ratones.- Criar un ratón de 3 a 6 meses expresando una copia del apropiada transgénicos/knock-in Cre-controlador alelo y cero copias del alelo GCaMP3/6 condicional con un segundo ratón de la misma edad, expresando uno o dos ejemplares de la condicional GCaMP3 / 6 alelo y cero copias del alelo Cre-driver.
- Genotipo del PUP y marca los Cre y condicional GCaMP3/6 alelos — éstos en lo sucesivo se llamará ratones transgénicos doble (e.g., Myf5-Cre, GCaMP3 condicional)6.
Nota: Esta forma, todos los datos se derivan de los ratones que expresaban una copia de la Cre y condicional GCaMP3/6 alelos. Esto es particularmente importante cuando se añade en otros ratones mutantes (p. ej., agujeros ciegos) para estos cruces.
- Cuando los ratones transgénicos doble son de la edad apropiada (p. ej., día postnatal 0 o 5 [P0 o P5] o adultos), eutanasia los ratones decapitando con tijeras (para los ratones más jóvenes que P10) o colocarlos en una cámara de inhalación isoflurane, cuando son ya no responde a pellizcar la cola con un par de pinzas, están listos para sacrificio.
- El animal de sacrificio por decapitación con un par de tijeras.
- Sección transversal en el animal entero justo debajo del hígado y un poco más el corazón y los pulmones con tijeras de iridectomía.
- Diseccionar, el hígado, el corazón y los pulmones, teniendo cuidado de mantener una longitud del nervio frénico que es suficientemente largo para ser dibujado en un electrodo de succión (es decir, 1-2 cm).
Nota: El nervio frénico izquierdo puede ser identificado como un pedazo blanco de tejido que entra en la porción medial del diafragma izquierdo. No debe cortarse al retirar los pulmones. El nervio frénico derecho funciona dentro de una pieza de fascia que también contiene la vena cava superior y es más delgado y más blanco que la vena cava. Juntos, ambos penetran el diafragma intermedio derecho. - Además quitar la caja torácica y la columna vertebral, excepto la cresta delgada alrededor de la membrana.
- Poner la muestra del nervio frénico y el diafragma en un tubo de microcentrífuga con solución de Krebs-Ringer con 594-αBTX de 1 μg/mL durante 10 minutos en la oscuridad.
Nota: Esta concentración de 594-αBTX etiquetas de receptores de ACh (AChRs) sin bloquear su función (observación personal).
2. estimulación y registro de los potenciales de acción muscular
- Con pernos minutien, inmovilizar el diafragma por fijación sobre un plato de 6 cm revestida con gel dieléctrico de silicona llena con 8 mL de solución de Krebs-Ringer oxigenada y colóquela sobre la platina del microscopio. Perfusión del diafragma con más solución de Krebs-Ringer (8 mL/min) durante 30 minutos.
Nota: Esto enjuaga el 594-αBTX independiente, así como equilibra el tejido después de la disección. - Hacer un electrodo de succión según los métodos establecidos7.
- Con 4 aumentos, utilizando un micromanipulador, mueva el electrodo de succión sobre el nervio frénico izquierdo y aplicar succión jalando el cilindro de una jeringa de 5 mL conectada a la tubería que se une al electrodo de succión.
Nota: Cuando dibuja con éxito en el electrodo de succión, el nervio frénico es tenso. Encender el estimulador y estimular el frénico nervio poniendo el manual interruptor 1 x. - Asegúrese de que el diafragma se contrae en respuesta a la estimulación de 1 Hz examinando visualmente con luz trasmitida. Si no es así, ajuste la tensión girando la perilla de tensión progresivamente para lograr un impulso supramaximal, que puede ser verificado por un examen visual de la contracción muscular. Si todavía no es visible, soplar el nervio con la jeringa y tratar de dibujarlo nuevo aplicando succión.
- Con 4 aumentos, utilizando un micromanipulador, mueva el electrodo de succión sobre el nervio frénico izquierdo y aplicar succión jalando el cilindro de una jeringa de 5 mL conectada a la tubería que se une al electrodo de succión.
- Cierre la perfusión y añadir el inhibidor BHC miosina de músculo-específica del6 o el canal voltaje-bloqueado del sodio antagonista μ-Conotoxina8 a una concentración final de 100 μm.
- 100 μm BHC, pipetear 4 μL del stock de 200 mM en DMSO y prediluir en 1 mL de solución de Krebs-Ringer.
- Extraer 1 mL de solución de Krebs-Ringer el plato.
- Añadir la CSF prediluida, al plato.
Nota: Esta dilución ayuda a prevenir la inducción por DMSO sin diluir de una respuesta fluorescente no transitoria en células de expresión GCaMP3. - Espere 30 minutos y girar en la perfusión de solución de Krebs-Ringer fresca para otros 20-30 minutos.
- Prepare el electrodo de la grabación.
- Usando guantes, coloque un vidrio el de borosilicato con un diámetro exterior (OD) de 1 mm y un diámetro interno (ID) de 0,4 mm en un tirador de la micropipeta y apriete los diales para fijar en su posición. Cierre la puerta tirador.
- Utilizando un extractor de P-97, programa el siguiente ajuste: calor en 900, tire 120, velocidad en 75, tiempo en 250, presión a 500 y no hay lazos adicionales.
Nota: Resistance (R) se mide mediante los controles del software del amplificador: el software de adquisición de datos confirma resistencia resolviendo la formula V = ir El controlador de software pasa una corriente conocida (I) (típicamente 1 nA) a través de los electrodos y mide el cambio en el voltaje (V), lo que nos permite resolver para R. - Para membranas embrionarias, asegúrese de que la resistencia es cerca de 60 MΩ y diafragmas mayores, 10-20 MΩ. Coloque el electrodo de la grabación con 3 M de KCl.
- Con 10 aumentos, baje el electrodo muscular, utilizando un micromanipulador segundo en el lado opuesto de la etapa como un electrodo de estimulación.
- Utilizando el software de adquisición de datos electrofisiológicos, espere hasta que el potencial de membrana reposo cambia de 0 a -65 mV o más abajo.
- Estimular a 1 Hz y verificar la presencia de un potencial de acción muscular comprobando un gran potencial que exhibe un modesto overshoot (potencial que se eleva por encima de 0 mV cuando empieza en -65 mV o más abajo). No confundir el artefacto de estimulación con un potencial de acción.
Nota: Potenciales son significativamente más largos en duración (~ 5 ms) de artefactos de estimulación.
3. la proyección de imagen de la fluorescencia de la muestra
- Con 20 aumentos, localizar la banda de la placa de extremo en el centro del músculo buscando NMJs 594-αBTX – etiquetados bajo excitación luz verde/amarillo (550 nanómetro). Cambiar a la excitación de luz azul (470 nm) imagen Ca2 + respuestas en músculo, motoneuronas o las células de Schwann.
- Si lo desea, configurar el divisor de imagen con Filtros pasabanda y un filtro dicroico de single-edge para la proyección de imagen de doble longitud de onda.
- Para calcular la fluorescencia máxima (Fmax) exhibida por el tejido GCaMP3/6-expresando, añadir 12 μl 3 M de cloruro de potasio (KCl) a las preparaciones de diafragma6.
- Realizar experimentos con la barra de brillo en la barra de búsqueda mesa al 110% del nivel en el que el tejido GCaMP3/6-expresión muestra saturación a 20 aumentos, sin binning en respuesta a KCl.
- Grabar a 20 fotogramas por segundo y no te pierdas ningún evento rápido.
- Estimular con s 1-45 de 20 a 40 Hz de estimulación nerviosa mediante la entrega de un tren de impulsos utilizando el electrodo de succión o agregar a agonistas farmacológicos por el uso del baño o por perfusión y recoger la dinámica fluorescente Ca2 + respuestas en subtipo de una célula junto con la señal de estática 594-αBTX NMJ.
Nota: Si específicas de tejido rojos o far-red GECI o GEVI ratones se convierten en disponibles para su uso en el NMJ, puede utilizados para recoger dos señales dinámicas que refleja dos elementos celulares diferenciados en el NMJ. - Cuando los experimentos electrofisiológicos o proyección de imagen se acaban porque se han logrado los resultados deseados, inundar de agua a través de las líneas de perfusión y aspirar agua 2 x - 3 x por el electrodo de succión para asegurar que no acumular sales.
4. exportación y análisis de los datos de un mapa de intensidad de fluorescencia de desviación estándar (SDiu16)
- Grabar secuencias de imágenes grabadas como pilas de 16-bit TIFF y cargarlos en el sistema deseado imágenes del análisis de datos para el análisis.
- En el menú de archivo del software d 8, seleccione imagen pila de interés y haga clic para cargar.
- Una vez que se carga el video, escanear a través del tiempo para identificar una sección que no tiene ninguna actividad fluorescente celular.
Nota: Esta región se utilizará para crear una muestra de fondo. - Presionada la tecla Mayús y haga clic en para dibujar una región de la caja de interés (ROI) en la zona identificada como el área de muestra de fondo.
- Después de crear el cuadro, presione la barra espaciadora para generar un diagrama de cambio de actividad de fondo.
- Haga clic derecho en el rastro y seleccione la opción clasificados para presentar la opción al ROI de la descarga como texto para hacer el rastro como un archivo de texto de coordenadas xy.
- Una vez que se carga el video, escanear a través del tiempo para identificar una sección que no tiene ninguna actividad fluorescente celular.
- Volviendo al video de interés, scan de nuevo para identificar la región de tiempo donde se produce la actividad de interés.
- Utilizando el botón central del ratón, seleccionar esta región de tiempo en el cuadro de tiempo amarillo.
- Haga clic derecho sobre el video y selecciona Stack OPS y después Stat mapa 5.
Nota: Esto generará un mapa de desviación estándar (SD mapa) en la ventana izquierda. - Haga clic en el mapa de SD y luego oprima el ] tecla 19 x para aplicar el mapa de calor de color apropiado.
- Haga el mapa SD y seleccione STM cargar y guardar, que presentará la opción Guardar stm como tiff para guardar el mapa de SD.
- Entonces, pulse el [ clave 19 x para volver al mapa de color de escala de grises.
- Presione C y luego D para traer herramientas de mapeo de la densidad. Usando el botón izquierdo del ratón y el botón central de ratón, ajustar el umbral para incluir toda la actividad fluorescente que se muestra en el mapa de SD.
- Pulse C para cerrar las herramientas de densidad manteniendo la configuración de umbral.
- Haga el mapa SD y seleccione STM partículas y luego Encontrar PTCLS.
Nota: Esto permitirá identificar las células individuales que expresan actividad fluorescente. - Haga el mapa SD una vez más y seleccione Crear partículas ROIs.
Nota: Esto superponen las celdas seleccionadas en el video original de interés. - Manteniendo Shiftcon el botón derecho en cualquiera de la partícula ahora identificada ROIs en el video original.
- Seleccione marcador ROI y medida Int en ROI.
Nota: Esto generará actividad fluorescente individual de parcelas para cada ROI identificado en el vídeo de interés. Estos se pueden guardar pulsando uno de estos y selección de surtidos, seguidos del ROI de la descarga como texto.
- Toda lógica subyacente a estas operaciones, consulte el código de fuente archivos9.
Resultados
Varios ejemplos de cambios de intensidad de fluorescencia, mediados por el aumento de intracelular Ca2 + dentro de tipos definida de la célula de la NMJ, Mostrar la utilidad de este enfoque. Estos resultados se presentan como mapas de intensidad de fluorescencia espacial, que proporcionan la localización de las células respondieron a esta pregunta, así como la intensidad de sus respuestas, lo que permite la evaluación de cuántas células responden y cuánto cada célula responde a un determinado estímulo. Por ejemplo, como se muestra en la figura 1, tomamos videos de las Ca2 + respuestas en una población de terminal/perisynaptic Schwann las células (TPSCs) en las NMJs del diafragma de un P7 Wnt1-Cre; GCaMP3 condicional-expresión de ratón en respuesta a la estimulación del nervio frénico e identificar las subpoblaciones de las células respondieron por mapas de intensidad de fluorescencia espacial. Estos mapas de intensidad de la fluorescencia se presentan como mapas de calor y codificadas por colores según una tabla de búsqueda de color de fuego (fuego CLUT). Grabamos estos videos con y sin separación de la imagen para ver simultáneamente los racimos de AChRs α-BTX-etiquetado en el centro del diafragma (vídeos 1 y 2), un enfoque que podría ser fácilmente adaptado para capturar GECI dinámico o GEVI respuestas de dos distintas células tipo, siempre que cada uno de ellos exhibe excitación sin traslapo y espectros de emisión.
En la figura 2, se realizó el mismo experimento de la estimulación del nervio en el diafragma de un P4 Myf5 Cre; GCaMP3 condicional-ratón y reflejada las Ca2 + respuestas en las células musculares. Curiosamente, cuando utiliza el bloqueador de miosina BHC o el esquelética músculo-específica voltaje-bloqueado del sodio canal (Nav1.4) bloqueador μ-Conotoxina (figura 2A y 3 de Video o figura 2B y 4 de Video, respectivamente) , visualizamos Ca2 + transitorios que recorren toda la longitud de la fibra muscular, que representa la acción potencial y mediada por la liberación de Ca2 + desde el retículo sarcoplásmico, o simplemente la longitud de la banda de la placa de extremo, representando el placa de extremo potencial y mediado por extracelular Ca2 + afluencia mediante la adición de AChR.In a la identificación de subpoblaciones de células respondieron con intensidad de fluorescencia espacial mapas (mapas de la SD), como en la figura 1, también medimos el cambio en la fluorescencia con el tiempo en una población de estas células del músculo con espaciotemporal (ST) los mapas. Cada uno de estos experimentos representa un tipo de células diferentes, una edad diferente, un trato diferente (nervio estímulo vs estimulación nerviosa en presencia de fármacos diferentes) y diferentes tipos de análisis (espacial y espacio-temporal mapas de la intensidad de la fluorescencia). Estas cifras también ilustran una de las características más útiles de los ratones transgénicos expresando su GCaMP, es decir, la capacidad de estimular repetidamente la misma muestra de la imagen y, por lo tanto, probar el efecto de condiciones de tratamiento diferentes.

Figura 1: Medición de la actividad inducida por Schwann célula Ca2 + respuestas en el diafragma y el nervio frénico de P7 Wnt1-Cre; ratones de condicional GCaMP3 . (A) (izquierda) una imagen de intensidad de fluorescencia media, mostrando niveles de fluorescencia de fondo de Schwann las células a lo largo de las ramas del nervio frénico y en la Unión neuromuscular (NMJ), fue capturada antes de la estimulación nerviosa (Prestim). Los valores de esta fluorescencia del fondo se restan de valores de fluorescencia obtenidos después de la estimulación del nervio. (Derecha) Un mapa espacial de la desviación estándar de unidades de intensidad de fluorescencia de 16 bits (SDiu16) de Ca2 + respuestas generadas después de 30 s de 40 Hz de estimulación del nervio frénico (Stim mapa o mapa SD) muestra una respuesta robusta en la terminal/perisynaptic Schwann células (TPSCs) en el NMJ. El fuego CLUT heatmap es en SDiu16 y la barra de escala es en micras. Todas las imágenes en los paneles B - E son el mismo aumento que en el panel A. (B) (izquierda) el diafragma mismo fue etiquetado con 594 conjugados α-Bungarotoxina (α-BTX), que se une a las etiquetas de los receptores de la acetilcolina (AChRs) y excitado con luz verde/amarillo para identificar el NMJ. (Derecha) Este panel muestra una imagen de brightfield del diafragma mismo, mostrando la punta de un electrodo de registro intracelular (flecha), que puede ser guiado a un NMJ, basado en α-BTX etiquetado. (C) el Ca2 + transitorias características (p. ej., intensidad, Inicio después de la estimulación, duración) de las células individuales o grupos de células puede ser evaluado por delimitar regiones en el mapa de intensidad espacial como partículas (izquierda), que representa los colores como regiones de interés (ROIs) y (D) trazar su intensidad con el tiempo. (E) este panel muestra imágenes de doble longitud de onda de GCaMP3 respuestas mediadas por fluorescente Ca2 + y NMJs 594-α-etiquetado en el mismo diafragma utilizando el divisor de imagen Gemini después del estímulo del nervio. Haga clic aquí para ver una versión más grande de esta figura.

Video 1: película sin imagen partir de inducida por la actividad de las células de Schwann Ca 2 + respuestas en P7, como se describe en detalle en el Figura 1 leyenda. Por favor haga clic aquí para ver este video. (Clic derecho para descargar)
Video 2: película con imagen partir de inducida por la actividad de las células de Schwann Ca 2 + respuestas y 594- Α-BTX-labeled AChRs en P7, como se describe en detalle en el Figura 1 leyenda. Por favor haga clic aquí para ver este video. (Clic derecho para descargar)
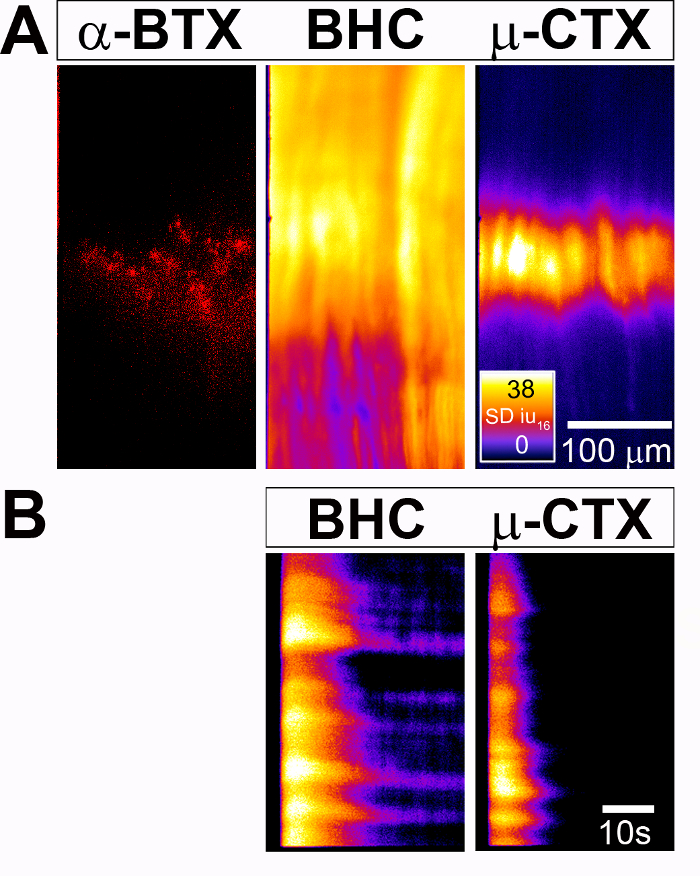
Figura 2: Medición del músculo inducida por la actividad celular Ca2 + respuestas en el diafragma del P4 Myf5-Cre; ratones de condicional GCaMP3 . AChR nicotínicos (izquierda) (A) grupos de la banda de la tapa céntrica del diafragma están marcados con 594-α-BTX. (Medio) Un mapa espacial de Ca2 + transitorias intensidades (SD mapa), generado después de 30 s de 40 Hz de estimulación del nervio frénico en presencia del inhibidor de la miosina BHC, muestra una respuesta a lo largo de toda la región de todas las células del músculo diafragma. (Derecha) En contraste, un SD mapa generado por el mismo diafragma después de la misma estimulación, pero en presencia de la Nav1.4 antagonista μ-Conotoxina (μ-CTX), exhibe un espacial restringida respuesta en la región medial del músculo diafragma todas las células que corresponde a la banda de placa enriquecida con racimo de Cais. El fuego CLUT heatmap es en SDiu16 y la barra de escala es en micras. (B) este panel muestra mapas espacio-temporales de Ca2 + intensidad transitoria en el tiempo (mapas de ST) en una población de células del músculo (y-axis) seguido en el tiempo (x-eje). La barra de escala está en segundos. Haga clic aquí para ver una versión más grande de esta figura.

Video 3: película de la célula del músculo inducida por actividad Ca 2 + respuestas en presencia del bloqueador de miosina BHC en P4, como se describe en detalle en el Figura 2A leyenda. Por favor haga clic aquí para ver este video. (Clic derecho para descargar)

Video 4: película de la célula del músculo inducida por actividad Ca 2 + respuestas en presencia de la Na v 1.4 antagonista μ-Conotoxina en P4, como se describe en detalle en el Figura 2B leyenda. Por favor haga clic aquí para ver este video. (Clic derecho para descargar)
Discusión
Aquí le ofrecemos algunos ejemplos de medición de Ca2 + respuestas en células específicas en tejido neuromuscular intacto usando ratones expresan GECI. Para realizar exitosamente estos experimentos, es imperativo de no lesionar el nervio frénico durante la disección. Para imagen de Ca2 + respuestas en las células de Schwann en baja o alta energía (es decir, 20 X o 60 X), es necesario utilizar BHC o μ-Conotoxina al movimiento del bloque. Para la proyección de imagen de baja potencia de Ca2 + respuestas en las células musculares, es posible medir en ausencia de estos fármacos, lo que permite la adquisición simultánea del músculo y músculo Ca2 + transitorias intensidades de cambios de longitud durante la de estimulación nerviosa de alta frecuencia6. Al realizar múltiples experimentos en la misma muestra, es necesario separar cada uno por al menos 15 minutos, tiempo durante el cual la muestra puede ser inundada. Estos pasos permiten la proyección de imagen repetida de estimulación inducida por Ca2 + respuestas desde el mismo campo de vista en la misma muestra durante al menos 3-5 horas. También es importante prediluidos fármacos disueltos en DMSO descrito para BHC, como el DMSO aplicado directamente sobre el tejido GCaMP-expresión induce respuestas de fluorescencia irreversible, independiente del estímulo.
Encontramos que por razones que son confusas, Wnt1-Cre; conditionalGCaMP3/6 ratones no muestran estimulación nerviosa o inducida por el agonista de la Ca2 + respuestas en las células de Schwann después P15 - P20. Sin embargo, Sox10-Cre; condicional GCaMP3/6 ratones continúan exhiben estas respuestas por lo menos tan tarde como P56, la edad más antigua que hemos examinado. Por el contrario, Myf5 condicional GCaMP3/6 ratones exhiben respuestas tan viejas como un año, la mayor edad examinado.
Aunque expresando GECI ratones ofrecen oportunidades únicas para el Ca2 + respuestas en poblaciones enteras de las células de un subtipo específico de la proyección de imagen, existen algunas limitaciones, como la incapacidad para realizar la proyección de imagen radiométrica y, así, extraer Ca cuantitativa medidas de 2 + . También existen limitaciones a la cantidad de profundidad del tejido que estas respuestas pueden ser reflejadas mediante microscopía de fluorescencia de campo amplio (es decir, en lugar de mediante microscopía confocal o multifotón). Por lo tanto, mientras que la delgadez de la membrana es favorable para la aplicación de las técnicas presentadas aquí, captura de células Ca2 + respuestas específicas en los tipos celulares de la NMJ en otros músculos que son más gruesos requiera sub- disección u otras clases de Microscopía de fluorescencia.
Estas herramientas genéticas y ópticas representan un avance importante sobre anteriores Ca2 + técnicas, por que podrían ser reflejadas sólo múltiples tipos de células o algunas células individuales dentro de un tipo de imagen. Una ventaja adicional es que Ca2 + las respuestas pueden ser conlleva reflejadas durante largos períodos de tiempo de las mismas células utilizando ratones GECI, considerando que esto no es fácilmente posible usando tradicional química Ca2 +-vinculante tintes fluorescentes. Finalmente, utilizando un divisor de imagen, realizar proyección de imagen de doble longitud de onda de una señal dinámica dentro de tipo de una célula (las células de Schwann) y una etiqueta fija dentro de un segundo (células musculares) y, así, mostrar cómo múltiples de células específicas calcio o tensión las respuestas pueden ser evaluado) por ejemplo, un ratón células de Schwann Cre-conducción cruzado a un ratón de GCaMP de Cre-dependiente condicional según lo divulgado aquí, cruzó a un ratón transgénico de Cre-independiente expresando un músculo específico de célula GECI o GEVI con excitación de fluorescencia no superpuestos / espectros de emisión10, permitiría seguimiento simultáneo de Ca2 + o voltaje los cambios dinámicos en las células de Schwann y músculo). Estas herramientas podrían ayudar a evaluar si la respuesta de una célula de tipo a un estímulo específico, como las purinas ATP o la adenosina producto de su descomposición, es directa o indirectamente mediado por un efecto directo sobre otro tipo de célula en el NMJ.
El objetivo principal de estos estudios fue evaluar el spatiotemporal Ca2 + patrón de respuesta de subtipos celulares al estímulo del nervio, pero las técnicas empleadas para lograrlo pueden desplegarse hacia otras metas. Por ejemplo, pueden ser utilizados para analizar el Ca2 + respuestas en presencia de ciertos antagonistas o de ciertos orígenes mutantes, como en ciertos modelos animales de enfermedad de motoneurona, distrofia muscular o enfermedad de Charcot-Marie-diente, para analizar la CA2 + respuesta a agonistas específicos para evaluar la expresión del receptor, para evaluar la heterogeneidad de las características de Ca2 + respuesta dentro de un subtipo de células a un estímulo, o comparar Ca2 + las respuestas en un subtipo de célula a otro funcional respuestas dentro de ese tipo (potenciales de placa terminal o acción músculo electrophysiologically grabados, acortamiento muscular imagen ópticamente, tensión registrada por el transductor de fuerza muscular, etc.) o a otros parámetros (por ejemplo, post hoc evaluación de la morfología de la célula de Schwann del nervio muscular o expresión molecular mediante inmunohistoquímica). Juntos, estos estudios muestran cómo la célula específica GECI o ratones GEVI pueden utilizarse para iluminar una amplia gama de procesos fisiológicos en una sinapsis compuesto de insumos genéticamente identificables, específicos de la célula.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo fue financiado con fondos de los institutos nacionales de salud (NIH) GM103554 y GM110767 a (T.W.G.) y del centro nacional para recursos de investigación 5P20RR018751 y el Instituto Nacional de Ciencias de médicas General 8P 20 GM103513 (a G.W.H.).
Materiales
| Name | Company | Catalog Number | Comments |
| Myf5-Cre mice | Jax | #007893 | Drives muscle cell expression as early as E136 |
| Wnt1-Cre mice | Jax | #003829 | Drives expression into all Schwann cells at E13 but not P209 |
| Sox10-Cre mice | Jax | #025807 | Drives Schwann cell expression at older ages |
| Conditional GCaMP3 mice | Jax | #029043 | Expresses GCaMP3 in cell-specific fashion |
| Conditional GCaMP6f mice | Jax | #024105 | Expresses GCaMP6f in cell-specific fashion |
| BHC (3-(N-butylethanimidoyl)-4-hydroxy-2H-chromen-2-one) | Hit2Lead | #5102862 | Blocks skeletal muscle myosin but not neurotransmission6 |
| CF594-α-BTX | Biotium | #00007 | Labels acetylcholine receptor clusters at NMJ |
| µ-conotoxin GIIIb | Peptides Int'l | #CONO20-01000 | Blocks Nav1.4 voltage-dependent sodium channel8 |
| Silicone Dielectric Gel; aka Sylgard | Ellswoth Adhesives | # Sil Dielec Gel .9KG | Allows for the immobilization of the diaphragm by minutien pins |
| Minutien pins (0.1mm diameter) | Fine Science Tools | 26002-10 | Immobilizes diaphragm onto silicone dielectric gel |
| Eclipse FN1 upright microscope | Nikon | MBA74100 | Allows staging and observation of specimen |
| Basic Fixed Microscope Platform with Manual XY Microscope Translator | Autom8 | MXMScr | Allows movement of specimen |
| Manual micromanipulator | Narishige | M-152 | Holds recording and stimulating electrodes |
| Microelectrode amplifier | Molecular Devices | Axoclamp 900A | Allows sharp electrode intracellular electrophysiological recording |
| Microelectrode low-noise data acquisition system | Molecular Devices | Digidata 1550 | Allows electrophysiological data acquisition |
| Microelectrode data analysis system | Molecular Devices | PCLAMP 10 Standard | Performs electrophysiological data analysis |
| Square wave stimulator | Grass | S48 | Stimulates nerve to excite muscle |
| Stimulus Isolation Unit | Grass | PSIU6 | Reduces stimulation artifacts |
| Borosilicate filaments, 1.0 mm outer diameter, 0.5mm internal diameter | Sutter | FG-GBF100-50-15 | Impales and records nerve-evoked muscle potentials |
| Borosilicate filaments, 1.5 mm outer diameter, 1.17mm internal diameter | Sutter | BF150-117-15 | Lengthened and used for suction electrode |
| Micropipette Puller | Sutter | P-97 | Pulls and prepares recording electrodes |
| 1200x1200 pixel, back-illuminated cMOS camera | Photometrics | Prime 95b | Sensitive camera that allows high-resolution, high-speed imaging |
| Light Source | Lumencor | Spectra X | Provides illumination from LEDs for fluorescence obsevation |
| Infinity-corrected fluorescent water immersion objectives, W.D. 2mm | Nikon | CFI60 | Provide long working distances for visualization of specimen |
| Fiber Optic Illuminator with Halogen lamp | Sumita | LS-DWL-N | Provides illumination for brightfield observation |
| W-View Gemini Image Splitter | Hamamatsu | A12801-01 | Projects 1 pair of dual wavelength images separated by a dichroic to single camera |
| Single-band Bandpass Filters (512/25-25 and 630/92-25) | SemRock | FF01-512/25-25; FF01-630/92-25 | Permits dual band imaging |
| 560 nm Single-Edge Dichroic Beamsplitter | Sem Rock | FF560-FDi01-25x36 | Dichroic mirror which separates beams of light to allow dual-wavelength imaging |
| Imaging data acquisition system | Nikon | NIS Elements - MQS31000 | Allows imaging data acquisition |
| Wavelength control module | Nikon | MQS41220 | Module for imaging data acqusiition |
| Emission splitter hardware module | Nikon | MQS41410 | Module for imaging data acqusiition |
| Imaging data analysis system | NA | Volumetry 8D5, Fiji | Allows analysis of fluorescence intensity and other imaging data |
Referencias
- Sanes, J. R., Lichtman, J. W. Development of the vertebrate neuromuscular junction. Annual Review of Neuroscience. 22, 389-442 (1999).
- Darabid, H., Perez-Gonzalez, A. P., Robitaille, R. Neuromuscular synaptogenesis: coordinating partners with multiple functions. Nature Reviews Neuroscience. 15 (11), 703-718 (2014).
- Fatt, P., Katz, B. An analysis of the end-plate potential recorded with an intracellular electrode. Journal of Physiology. 115 (3), 320-370 (1951).
- Todd, K. J., Robitaille, R. Purinergic modulation of synaptic signalling at the neuromuscular junction. Pflugers Archive. 452 (5), 608-614 (2006).
- Hennig, G. W., et al. Use of Genetically Encoded Calcium Indicators (GECIs) Combined with Advanced Motion Tracking Techniques to Examine the Behavior of Neurons and Glia in the Enteric Nervous System of the Intact Murine Colon. Frontiers of Cellular Neuroscience. 9, 436 (2015).
- Heredia, D. J., Schubert, D., Maligireddy, S., Hennig, G. W., Gould, T. W. A Novel Striated Muscle-Specific Myosin-Blocking Drug for the Study of Neuromuscular Physiology. Frontiers of Cellular Neuroscience. 10, 276 (2016).
- Johnson, B. R., Hauptman, S. A., Bonow, R. H. Construction of a simple suction electrode for extracellular recording and stimulation. Journal of Undergraduate Neuroscience Education. 6 (1), A21-A26 (2007).
- Hong, S. J., Chang, C. C. Use of geographutoxin II (mu-conotoxin) for the study of neuromuscular transmission in mouse. British Journal of Pharmacology. 97 (3), 934-940 (1989).
- Heredia, D. J., Feng, C. Y., Hennig, G. W., Renden, R. B., Gould, T. W. Activity-induced Ca2+ signaling in perisynaptic Schwann cells of the early postnatal mouse is mediated by P2Y1 receptors and regulates muscle fatigue. Elife. 7, e30839 (2018).
- Cho, J. H., et al. The GCaMP-R Family of Genetically Encoded Ratiometric Calcium Indicators. ACS Chemical Biology. 12 (4), 1066-1074 (2017).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados