Method Article
السابقين فيفو تصوير الكالسيوم الخاصة بالخلية إشارات في المشبك الثلاثية للحجاب الحاجز الماوس
In This Article
Summary
نقدم هنا بروتوكولا للكالسيوم في صورة إشارات في سكان أنواع الخلايا الفردية في الوصلات العصبية العضلية مورين.
Abstract
يمكن رصد النشاط الكهربائي للخلايا في الأنسجة بالتقنيات الكهربية، ولكن هذه عادة ما يقتصر على تحليل الخلايا الفردية. نظراً لزيادة الكالسيوم داخل الخلايا (Ca2 +) في سيتوسول غالباً ما تحدث بسبب النشاط الكهربائي، أو استجابة لعدد ضخم محفزات الأخرى، يمكن رصد هذه العملية بتصوير الخلايا محملة الفلورسنت المراعية للكالسيوم الأصباغ. ومع ذلك، من الصعب صورة هذه الاستجابة في نوع خلايا فردية داخل الأنسجة كاملة لأن يتم تناول هذه الأصباغ بجميع أنواع الخلايا داخل الأنسجة. على النقيض من ذلك، مؤشرات الكالسيوم المشفرة جينياً (جيسيس) يمكن التعبير عنها حسب نوع خلية فردية وفلوريس في استجابة لزيادة من داخل الخلية Ca2 +، مما سمح التصوير من Ca2 + إشارات في مجموعات سكانية بأكملها من أنواع الخلايا الفردية. هنا، علينا تطبيق الاستخدام من جيسيس GCaMP3/6 على الوصلات العصبية العضلية الماوس، وخلايا شوان المشبك ثلاثية بين الخلايا العصبية الحركية، والهيكل العظمى والعضلات، والمحطة الطرفية/بيريسينابتيك. علينا أن نبدي بفائدة هذا الأسلوب في الكلاسيكية السابقين فيفو الاستعدادات الأنسجة. استخدام تقسيم بصري، نقوم بالتصوير المزدوج-الطول الموجي لدينامية Ca2 + إشارات وتسمية ثابتة من الوصلات العصبية العضلية (NMJ) في نهج التي يمكن تكييفها بسهولة لرصد اثنين جيتشي الخلية المحددة أو الجهد وراثيا المرمزة المؤشرات (جيفي) في نفس الوقت. وأخيراً، نحن نناقش الإجراءات المستخدمة لالتقاط خرائط مكانية لشدة الأسفار. معا، يمكن أن تستخدم هذه التقنيات البصرية والمعدلة وراثيا والتحليلية لدراسة النشاط البيولوجي للفئات السكانية الفرعية خلية متميزة في NMJ في مجموعة متنوعة من السياقات.
Introduction
NMJ، مثل جميع نقاط الاشتباك العصبي، ويتألف من ثلاثة عناصر هي: محطة presynaptic المستمدة من خلية، خلية بوستسينابتيك العصبية/المستجيب، وخلية بيريسينابتيك الدبقية1،2. في حين أظهرت الجوانب الأساسية لانتقال متشابك أولاً في هذا المشبك3، العديد من جوانب هذه العملية تظل مجهولة، جزئيا بسبب التعبير عن جزيئات نفس عناصر خلوية متميزة من هذا المشبك. على سبيل المثال، يتم التعبير عن مستقبلات لكل من البيورين نوكليوتيد الأدنين ATP واستيل (ACh)، الذي شارك تم إصدارها من قبل الخلايا العصبية الحركية في NMJ الفقارية، بالعضلات وخلايا شوان والخلايا العصبية الحركية، مما يعقد تفسير أي تأثير الوظيفية التي تمارس بها هذه المواد (مثلاً، الإفراج عن الإرسال أو الرد، توليد قوة العضلات)4. وعلاوة على ذلك، على الرغم من أن مكونات الثلاثية NMJ بسيطة مقارنة إلى، على سبيل المثال، الخلايا العصبية في الجهاز العصبي المركزي الذي غالباً ما يحمل مدخلات متعددة متشابك، عما إذا كانت الخلايا العصبية الحركية، والخلايا العضلية أو خلايا شوان تختلف في الاستجابة للمحفزات على أساس على ما مضمن عدم التجانس (مثلاً، اشتقاق الجنينية، النوع الفرعي للألياف، ومورفولوجيا) غير واضح. بغية معالجة كل مسألة من هذه المسائل، أنه سيكون من المفيد لتعقب الاستجابة للعديد من الخلايا داخل أحد العناصر متشابك، فضلا عن المسار، في الوقت نفسه، هذه استجابة في أي من عناصر منفصلة أخرى في نفس الوقت. الاستراتيجيات التقليدية باستخدام الأصباغ الكيميائية لقياس إشارات الكالسيوم لا يمكن تحقيق هذين الهدفين، لأنه هو تناول تطبيق حمام صبغة بأنواع متعددة من الخلايا بعد التطبيق للأنسجة، ويمكن استخدام صبغة إينتراسيلولارلي تحميل فقط تصور الأفواج الفردية أو الصغيرة من الخلايا. هنا، استخدام الفئران المعدلة وراثيا معربا عن جيسيس مصممة لقياس إشارات الكالسيوم خلية على حدة، جنبا إلى جنب مع تصوير محددة و أدوات البرمجيات5، يمكننا إثبات الأول من هذين الهدفين عموما، ومناقشة كيفية الإضافة جديد أدوات معدلة وراثيا سوف يساعد على تحقيق الثاني. سوف تكون هذه التقنية مفيدة لأي شخص مهتم في تتبع ديناميات الكالسيوم أو الخلوية الأخرى مما يشير إلى أحداث يمكن ملاحظتها من خلال أجهزة الاستشعار البصرية ترميز الجينات في السكان خلية متعددة في نفس الوقت.
Protocol
وتربية الحيوانات والتجارب أجريت وفقا "المعاهد الوطنية للصحة دليل" للرعاية واستخدام الحيوانات المختبرية وإياكوك في جامعة نيفادا.
1. إعداد أغشية والأعصاب فرنك من الفئران المحورة وراثيا
- شراء الفئران المحورة وراثيا والإشعال اليغنوكليوتيد للنمط الوراثي هذه الفئران.
ملاحظة: يتم سرد الإشعال على صفحة "المعلومات" لكل من هذه الفئران.- تولد ماوس 3-6 شهرا معربا عن نسخة واحدة من اليل Cre-سائق المعدلة وراثيا/تدق في المناسبة وصفر نسخاً من اليل GCaMP3/6 شرطي مع ماوس ثانية من نفس العمر معربا عن نسخ واحد أو اثنين من الشرطية GCaMP3/ 6 اليل وصفر نسخاً من اليل سائق لجنة المساواة العرقية.
- النمط الوراثي الجراء ومارك تلك التي لديها لجنة المساواة العرقية والشرطي GCaMP3/6 الآليلات – هذه ستسمى من الآن فصاعدا الفئران المعدلة وراثيا مزدوج (مثلاً، Myf5-لجنة المساواة العرقية، GCaMP3 الشرطي)6.
ملاحظة: سوف تستمد جميع البيانات من الفئران معربا عن نسخة واحدة من كل من لجنة المساواة العرقية والشرطي GCaMP3/6 الآليلات بهذه الطريقة،. هذا مهم خاصة عند إضافة في الفئران الأخرى متحولة (مثلاً، بالضربة القاضية) لهذه الصلبان.
- عندما تكون الفئران المعدلة وراثيا مزدوجة للسن المناسبة (مثلاً، يوم الولادة 0 أو 5 [P0 أو P5] أو الكبار)، euthanize الفئران بقطع رأس لهم مع المقص (بالنسبة للفئران أصغر سنا من P10) أو عن طريق وضعها في دائرة لاستنشاق isoflurane — عندما تكون لم تعد تستجيب معسر الذيل مع زوج من الملقط، أنهم مستعدون للتضحية.
- التضحية الحيوان بقطع الرأس مع زوج من مقص.
- قسم العرض عبر الحيوان كامل أسفل الكبد وفقط فوق القلب والرئتين مع مقص iridectomy.
- تشريح بعيداً في الكبد والقلب والرئتين، مع الحرص على الحفاظ على طول العصب فرينيك طويلة بما فيه الكفاية أن تستدرج إلى شفط كهربائي (أي، 1-2 سم).
ملاحظة: يمكن التعرف على العصب الأيسر فرنك كقطعة بيضاء من الأنسجة التي يدخل الجزء الآنسي من الحجاب الحاجز الأيسر. يجب أن لا تكون قطع عند إزالة الرئتين. العصب حق فرنك يعمل داخل قطعة من لفافة تحتوي على الأجوف فينا متفوقة أيضا وهو أرق وأكثر بياضا من الأجوف فينا. معا، وكلاهما اختراق الحاجز الآنسي حق. - كذلك إزالة في القفص الصدري والعمود الفقري، باستثناء ريدج رقيقة حول الحجاب الحاجز.
- وضع الحجاب الحاجز والأعصاب فرنك العينة في [ميكروفوج] أنابيب مع الحل كريبس في المسابقة مع 594 1 ميكروغرام/ملليلتر-αBTX لمدة 10 دقائق في الظلام.
ملاحظة: هذا التركز من 594-αBTX تسميات مستقبلات ACh (اختتام) دون عرقلة وظيفتها (ملاحظة شخصية).
2-حفز وتسجيل من إمكانيات عمل العضلات
- باستخدام دبابيس مينوتين، شل الحجاب الحاجز التي تعلق على طبق 6-سم المغلفة مع هلام السيليكون عازل ومليئة ~ 8 مل من اﻷوكسيجين كريبس-المسابقة الحل ووضعه على خشبة المسرح المجهر. نتخلل الحجاب الحاجز مع أكثر من حل المسابقة كريبس (8 مل/دقيقة) لمدة 30 دقيقة.
ملاحظة: هذا رنسيس 594-αBTX غير منضم، فضلا عن اكويليبراتيس الأنسجة بعد التشريح. - تجعل من قطب كهربائي شفط وفقا للأساليب المتبعة7.
- 4 X التكبير، واستخدام ميكرومانيبولاتور، حرك مسرى شفط العصب فرينيك الأيسر وتطبيق الشفط بسحب ماسورة 5 مل حقنه متصلة بالانبوب متصل بالشفط الكهربائي.
ملاحظة: عند وضع بنجاح في مسرى الشفط، مشدود العصب فرنك. تشغيل مشجعا وحفز فرينيك العصب بالتقليب اليدوي التبديل 1 x. - ضمان أن الحجاب الحاجز عقود استجابة لتحفيز 1 هرتز بفحص ذلك بصريا مع الإضاءة برايتفيلد. إذا لم يكن الأمر كذلك، ضبط الجهد عن طريق تحويل مقبض الجهد تدريجيا لتحقيق نبض سوبراماكسيمال، التي يمكن التحقق منها بإجراء فحص مرئي لتقلص العضلات. إذا كان لا يزال غير مرئي، تفجير العصب مع المحاقن ومحاولة لرسم مرة أخرى عن طريق تطبيق شفط.
- 4 X التكبير، واستخدام ميكرومانيبولاتور، حرك مسرى شفط العصب فرينيك الأيسر وتطبيق الشفط بسحب ماسورة 5 مل حقنه متصلة بالانبوب متصل بالشفط الكهربائي.
- إيقاف التروية وإضافة مثبط البيلاروسية الميوسين الخاصة بالعضلات6 أو عن طريق بوابة الجهد الصوديوم قناة خصم μ-كونوتوكسين8 إلى تركيز نهائي من 100 ميكرومتر.
- لجعل 100 ميكرومتر البيلاروسية، "الماصة؛" 4 ميليلتر من الأسهم 200 ملم في [دمس] وبريديلوتي أنه في 1 مل من محلول كريبس في المسابقة.
- إزالة 1 مل من محلول كريبس في المسابقة من الطبق.
- إضافة البيلاروسية بريديلوتيد، إلى الطبق.
ملاحظة: يساعد هذا بريديلوشن على منع التعريفي بغير مخفف [دمس] استجابة الفلورية غير عابرة في التعبير عن GCaMP3 الخلايا. - انتظر 30 دقيقة وثم تشغيل التروية الطازج كريبس-المسابقة حل لآخر 20-30 دقيقة.
- إعداد التسجيل الكهربائي.
- ضع البورسليكات زجاج فيلامينتيد مع قطر خارجي (OD) 1 مم وقطر داخلي (ID) من 0.4 مم إلى ساحبة ميكروبيبيتي ارتداء القفازات، وتشديد الأوجه المشبك في الموقف. أغلق باب ساحبة.
- ساحبة P-97، باستخدام برنامج الإعداد التالية: الحرارة في 900، سحب على 120، والسرعة في 75، مرة في 250، الضغط على 500، ولا حلقات إضافية.
ملاحظة: يقاس Resistance (R) باستخدام عناصر تحكم البرمجيات من مكبر للصوت: برنامج اقتناء البيانات تؤكد المقاومة قبل حل الصيغة الخامس = الأشعة تحت الحمراء. وحدة تحكم البرمجيات يمر حالية معروفة (ط) (عادة 1 غ) عن طريق الكهربائي ويقيس التغير في الجهد (V)، وبالتالي تمكننا من حل ر. - لأغشية جنينية، تأكد أن المقاومة قرب 60 MΩ، ولكبار السن أغشية، MΩ 10-20. تحميل مسرى التسجيل مع 3 م بوكل.
- 10 X التكبير، أقل الكهربائي في العضلات، واستخدام ميكرومانيبولاتور ثاني في الجانب الآخر من المسرح كقطب محفزة.
- باستخدام برنامج اقتناء البيانات الكهربية، انتظر حتى إمكانات غشاء يستريح يتغير من 0 إلى-65 mV أو أدناه.
- تحفز في 1 هرتز، والتحقق من وجود إمكانية عمل العضلات بالتحقق من وجود احتمال كبير أن يسلك الانحسار متواضعة (احتمال أن ترتفع فوق 0 mV عند بدء تشغيله في-65 mV أو أدناه). لا تخلط بين قطعة أثرية التحفيز إمكانات العمل.
ملاحظة: إمكانات أطول بشكل ملحوظ في مدة (~ 5 مللي ثانية) من التحف التحفيز.
3-تصوير للأسفار العينة
- في 20 X التكبير، حدد موقع الفرقة اندبلت في المركز للعضلات التي تبحث عن 594-αBTX – المسماة نمجس تحت الإثارة الضوء الأخضر/الأصفر (550 نيوتن متر). قم بالتبديل إلى الإثارة الضوء الأزرق (470 nm) على صورة Ca2 + الردود في العضلات أو العصبون، أو خلايا شوان.
- إذا رغبت في ذلك، إعداد التقسيم الصورة مع مرشحات ممر الموجه وعامل تصفية واحد-حافة مزدوج اللون لتصوير ثنائي-الطول الموجي.
- من أجل حساب الأسفار القصوى (فماكس) تعرض بواسطة أنسجة GCaMP3/6-وإذ يعرب عن، إضافة ميليلتر 12 م 3 كلوريد البوتاسيوم (بوكل) ل الأعمال التحضيرية الحجاب الحاجز6.
- القيام بتجارب مع شريط السطوع على شريط جدول بحث تعيين إلى 110 في المائة المستوى الذي يسلك الأنسجة GCaMP3/6-وإذ يعرب عن التشبع في 20 X التكبير، دون binning في الاستجابة إلى بوكل.
- سجل في 20 لقطة في الثانية وأن لا تفوت أي الأحداث سريعة.
- حفز مع s 1-45 من 20-40 هرتز لتحفيز العصب بإيصال قطار من النبضات استخدام الشفط الكهربائي أو إضافة يضع الدوائية بتطبيق حمام أو نضح وجمع Ca2 + الردود الفلورسنت دينامية في خلية واحدة نوع فرعي جنبا إلى جنب مع إشارة NMJ ثابت 594-αBTX.
ملاحظة: إذا كانت الأنسجة على حدة الأحمر أو استعملنا جيتشي أو جيفي الفئران تصبح متوفرة للاستخدام في NMJ، يمكن استخدامها لجمع إشارتين ديناميكية تعكس عنصرين الخلوية متميزة في NMJ. - عند الانتهاء من تجارب التصوير أو الكهربية لأن النتائج المرجوة قد تحققت، نتخلل المياه من خلال خطوط نضح وتمتص المياه 2 x-x 3 عن طريق الشفط الكهربائي لضمان بناء الأملاح لا.
4-التصدير وتحليل البيانات من قبل "خريطة الانحراف المعياري لكثافة الفلورية" (SDiu16)
- تسجيل تسلسل الصور المسجلة كرزمة TIFF 16-بت وتحميلها على نظام تحليل بيانات التصوير المطلوب للتحليل.
- في القائمة ملف للبرنامج 8 د، حدد المكدس الصورة للفائدة ، ثم انقر فوق تحميل.
- بمجرد تحميل الفيديو، المسح الضوئي من خلال الوقت لتحديد مقطع يحتوي على أي نشاط الفلورسنت الخلوية.
ملاحظة: سيتم استخدام هذه المنطقة لإنشاء نموذج خلفية. - اضغط على المفتاح Shift وانقر لرسم منطقة مربع الفائدة (ROI) في منطقة حددت كمنطقة العينة الخلفية.
- بعد إنشاء المربع، اضغط على شريط الفضاء لتوليد مؤامرة لتغيير خلفية النشاط.
- انقر بالزر الأيمن التتبع وتحديد الخيار متنوعة لتقديم الخيار تفريغ عائد الاستثمار كنص لجعل التتبع كملف نص إحداثي س وص.
- بمجرد تحميل الفيديو، المسح الضوئي من خلال الوقت لتحديد مقطع يحتوي على أي نشاط الفلورسنت الخلوية.
- نقل مرة أخرى إلى شريط الفيديو للفائدة، تفحص مرة أخرى لتحديد المنطقة الزمنية حيث يتم حدوث نشاط المصلحة.
- باستخدام زر الماوس الأوسط، حدد المنطقة الزمنية في المربع الأصفر وقت.
- انقر بالزر الأيمن على الفيديو وحدد المكدس مكتب خدمات المشاريع ، ومن ثم خريطة Stat الخيار 5.
ملاحظة: سيؤدي هذا إلى إنشاء مخطط انحراف المعياري (SD خريطة) في الإطار الأيسر. - انقر فوق على خريطة التنمية المستدامة ومن ثم اضغط ] مفتاح x 19 لتطبيق خريطة حرارة اللون المناسب.
- انقر بالزر الأيمن على الخريطة SD وحدد STM تحميل وحفظ، الذي سوف يقدم خيار حفظ stm كالمشاجرة لحفظ مخطط التنمية المستدامة.
- ثم، اضغط [ مفتاح x 19 للعودة إلى خارطة لون رمادي.
- اضغط C ثم D لإحضار أدوات رسم خرائط الكثافة. باستخدام زر الماوس الأيسر ومركز زر الماوس، قم بضبط العتبة تشمل كل نشاط الفلورسنت هو موضح في خريطة التنمية المستدامة.
- اضغط C لإغلاق أدوات الكثافة مع الحفاظ على إعدادات العتبة.
- انقر بالزر الأيمن خريطة التنمية المستدامة وتحديد جزيئات تحقيق الاستقرار والانتساب ، ومن ثم العثور على بتكلس.
ملاحظة: هذا سيتم تحديد خلايا فردية معربا عن نشاط الفلورسنت. - انقر بالزر الأيمن على الخريطة SD مرة أخرى وحدد إنشاء رويس الجسيمات.
ملاحظة: هذا سوف ركب الخلايا المحددة على شريط الفيديو الأصلي للفائدة. - أثناء الضغط على المفتاح Shift، انقر بالزر الأيمن على أي واحد من الجسيمات التي تم تحديدها الآن رويس في الفيديو الأصلي.
- حدد علامة العائد على الاستثمار و تدبير Int في العائد على الاستثمار.
ملاحظة: سيؤدي هذا إلى إنشاء نشاط الأفراد الفلورسنت مؤامرات لكل عائد الاستثمار المحددة في شريط فيديو للاهتمام. هذه يمكن حفظها بواسطة زر الماوس الأيمن فوق أي واحد من هؤلاء وتحديد أسورتيد، تليها دوروا تفريغ كنص.
- لمنطق مفصلة الكامنة وراء هذه العمليات، الرجاء مراجعة ملف التعليمات البرمجية المصدر9.
النتائج
عدة أمثلة للتغييرات كثافة الأسفار، توسط الزيادات من داخل الخلية Ca2 + ضمن أنواع الخلايا المحددة NMJ، تظهر فائدة هذا النهج. وترد هذه النتائج كخرائط كثافة fluorescence المكاني، الذي يقدم موقع الخلايا المستجيبة، وكذلك الكثافة من ردودها، مما يسمح لتقييم الاستجابة كم عدد الخلايا، وكل خلية من كم يستجيب لمعين التحفيز. على سبيل المثال، كما هو مبين في الشكل 1، وقد اتخذنا أشرطة الفيديو من Ca2 + الردود في عدد سكان من المحطة الطرفية/بيريسينابتيك شوان الخلايا (تبسكس) في نمجس للحجاب الحاجز من P7 Wnt1-لجنة المساواة العرقية؛ GCaMP3 الشرطي-معربا عن الماوس استجابة للتحفيز على العصب فرنك وحددت الفئات السكانية الفرعية الخلايا المستجيبة بخرائط كثافة fluorescence المكانية. يتم عرض هذه الخرائط من شدة الأسفار كخرائط الحرارة ومرمزة وفقا لجدول بحث لون نار (النار كلوت). نحن مسجل أشرطة الفيديو هذه مع أو بدون تقسيم الصورة لعرض مجموعات اختتام BTX α-المسمى في وسط الحجاب الحاجز (كليب 1 و 2)، في نفس الوقت نهج التي يمكن بسهولة أن تتكيف على التقاط جيتشي ديناميكية أو جيفي ردود من اثنين متميزة الخلية أنواع، شريطة أن كل واحد منهم يسلك الإثارة غير متداخلة وأطياف الانبعاث.
في الشكل 2، أجرينا التجربة تحفيز العصب نفسه على الحجاب الحاجز P4 Myf5-لجنة المساواة العرقية؛ والشرطي GCaMP3-الإعراب عن الماوس وتصويرها Ca2 + الردود في خلايا العضلات. من المثير للاهتمام، عندما كنا مانع الميوسين البيلاروسية أو الهيكل العظمى العضلات الخاصة بالجهد عن طريق بوابة قناة الصوديوم (Nav1.4) مانع μ-كونوتوكسين (الشكل 2 ألف و 3 الفيديو أو الشكل 2B و الفيديو 4، على التوالي) ، يمكننا تصور Ca2 + العابرين أن السفر كامل طول الألياف العضلية، يمثل العمل المحتملة ووساطة من الإفراج من Ca2 + من الشبكة شبكية، أو مجرد طول الفرقة اندبلت، تمثل خرائط اندبلت المحتملة ووساطة من Ca2 + تدفق خارج الخلية عن طريق إضافة AChR.In إلى تحديد الفئات السكانية الفرعية خلايا المستجيبة بكثافة fluorescence المكانية (SD الخرائط)، كما هو الحال في الشكل 1، قمنا أيضا بقياس التغيير في الأسفار على مر الزمن في عدد من هذه الخلايا العضلية مع الزمانية المكانية (ش) خرائط. يمثل كل واحد من هذه التجارب نوع خلية مختلفة وعصر مختلف، ومعاملة مختلفة (العصب التحفيز مقابل تحفيز العصب حضور مختلف العقاقير) وأنواع مختلفة من التحليل (المكاني مقابل الزمانية المكانية كثافة fluorescence خرائط). وتوضح هذه الأرقام أيضا واحدة من الميزات الأكثر فائدة للإعراب عن جكامب الفئران المحورة وراثيا، هي القدرة على حفز مرارا وتكرارا والصورة نفس العينة، واختبار تأثير ظروف معاملة مختلفة لذلك،.

الشكل 1: القياس الناجمة عن نشاط شوان الخلية Ca2 + الردود في الحجاب الحاجز والأعصاب فرنك من P7 Wnt1-لجنة المساواة العرقية؛ GCaMP3 الشرطي الفئران. (أ) (إلى اليسار) صورة fluorescence متوسط كثافة، تبين مستويات الخلفية من الأسفار في شوان الخلايا على طول أفرع العصب فرنك وفي الوصلات العصبية العضلية (NMJ)، ألقي القبض عليه قبل تحفيز العصب (بريستيم). تم طرح قيم هذه الأسفار الخلفية من الأسفار القيم التي تم الحصول عليها بعد تحفيز الأعصاب. (اليمين) خارطة مكانية للانحراف المعياري لوحدات كثافة fluorescence 16-بت (سديو16) Ca2 + الاستجابات التي تم إنشاؤها بعد 30 s 40 هرتز لتحفيز العصب فرينيك (خريطة Stim أو مخطط للتنمية المستدامة) ويبين ردا قويا في المحطة الطرفية/بيريسينابتيك شوان خلايا (تبسكس) في NMJ. Heatmap كلوت النار في16 من سدو وشريط مقياس ميكرون. كل الصور في لوحات ب - ه يتم التكبير نفسه كتلك الموجودة في الفريق A. (ب) (إلى اليسار) الحجاب الحاجز نفسه كان يحمل مترافق 594 α-بونجاروتوكسين (α-BTX)، الذي يربط وتسميات مستقبلات أستيل (اختتام)، ومتحمس مع الضوء الأخضر/الأصفر للتعرف NMJ. (اليمين) هذا الفريق يظهر صورة برايتفيلد للحجاب الحاجز نفسه، يظهر تلميح مسرى التسجيل داخل الخلايا (السهم)، الذي يمكن الاسترشاد NMJ، استناداً إلى وسم α-BTX. (ج) Ca2 + عابر ميزات (مثل، الكثافة، بداية بعد التحفيز، والمدة) من خلايا فردية أو مجموعات من الخلايا يمكن تقييمه بترسيم المناطق الفردية في خريطة الكثافة المكانية كجسيمات (يسار)، يمثل لهم مناطق مرمزة الفائدة (رويس)، و (د) التآمر كثافة على مر الزمن. (ه) هذا الفريق يظهر الصور المزدوجة-الطول الموجي GCaMP3 بوساطة الفلورسنت Ca2 + الردود و 594-α-المسمى نمجس في الحجاب الحاجز نفسه استخدام التقسيم صورة الجوزاء بعد تحفيز الأعصاب. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-

1 فيديو: فيلم دون تقسيم الصورة الناجمة عن نشاط خلية شوان Ca 2 + الردود على P7، كما هو موضح بالتفصيل في الشكل 1 أسطورة. من فضلك انقر هنا لمشاهدة هذا الفيديو. (انقر بالزر الأيمن التحميل.)
الفيديو 2: الفيلم بتقسيم الصورة الناجمة عن نشاط خلية شوان Ca 2 + الردود و 594- اختتام BTX α-المسمى في P7، كما هو موضح بالتفصيل في الشكل 1 أسطورة. من فضلك انقر هنا لمشاهدة هذا الفيديو. (انقر بالزر الأيمن التحميل.)
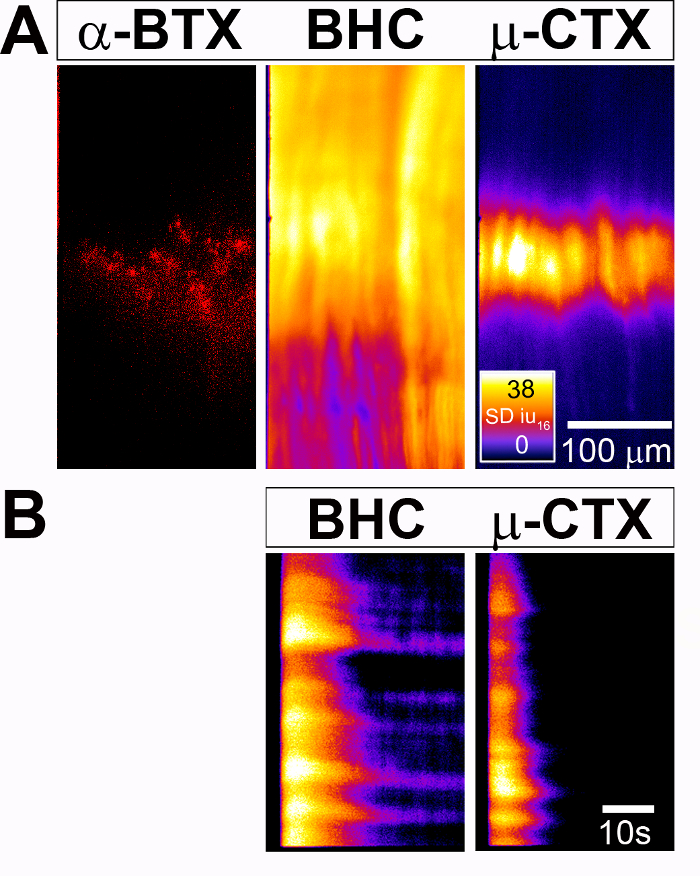
الشكل 2: قياس العضلات الناجمة عن نشاط الخلية Ca2 + الردود في الحجاب الحاجز من P4 Myf5-لجنة المساواة العرقية؛ GCaMP3 الشرطي الفئران. (أ) "يجيزان النيكوتين" (يسار) المسماة مجموعات من الفرقة اندبلت موقعا مركزياً للحجاب الحاجز مع 594-α-BTX. (وسط) خارطة مكانية Ca2 + عابر كثافات (SD الخريطة)، التي تم إنشاؤها بعد 30 s 40 هرتز لتحفيز العصب فرنك حضور المانع الميوسين البيلاروسية، ويبين استجابة في جميع أنحاء المنطقة بأسرها من جميع خلايا عضلة الحجاب الحاجز. (اليمين) في المقابل، مخطط التنمية المستدامة التي تم إنشاؤها من الحجاب الحاجز نفسه بعد تنشيط نفسه، ولكن بحضور ناv1.4 خصم μ-كونوتوكسين (μ-CTX)، يسلك تقييد مكانياً استجابة في منطقة وسطى في عضلة الحجاب الحاجز كافة الخلايا التي يتوافق مع الفرقة اندبلت أثري الكتلة الأمريكية. Heatmap كلوت النار سديو16 وشريط مقياس في ميكرون. (ب) هذا الفريق تبين الخرائط الزمانية المكانية من Ca2 + كثافات عابرة على مر الزمن (ST) خرائط) في عدد أن خلايا العضلات (y-المحور) يتبع على مر الزمن (x-المحور). شريط المقياس بالثواني. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-

3 فيديو: فيلم للعضلات الناجمة عن نشاط الخلية Ca 2 + ردود حضور مانع الميوسين البيلاروسية في P4، كما هو موضح بالتفصيل في الشكل 2 ألف أسطورة. من فضلك انقر هنا لمشاهدة هذا الفيديو. (انقر بالزر الأيمن التحميل.)

4 فيديو: فيلم للعضلات الناجمة عن نشاط الخلية Ca 2 + ردود حضور الجمعية الوطنية v خصم 1.4 μ-كونوتوكسين في P4، كما هو موضح بالتفصيل في الشكل 2 أسطورة. من فضلك انقر هنا لمشاهدة هذا الفيديو. (انقر بالزر الأيمن التحميل.)
Discussion
هنا نقدم بعض الأمثلة لقياس Ca2 + الردود في خلايا معينة في الأنسجة العضلية سليمة معربا عن جيتشي الفئران باستخدام. بغية تنفيذ هذه التجارب بنجاح، من الضروري لا تصيب العصب فرينيك أثناء التشريح. الصورة Ca2 + الردود في خلايا شوان في السلطة أما منخفضة أو عالية (أي20 X أو 60 X)، من الضروري استخدام البيلاروسية أو μ-كونوتوكسين لكتلة الحركة. لتصوير الطاقة المنخفضة من Ca2 + الردود في خلايا العضلات، فمن الممكن لقياس هذه في غياب هذه الأدوية، مما يسمح باقتناء المتزامنة للعضلات والعضلات Ca2 + عابر كثافة طول التغييرات خلال تحفيز العصب عالي التردد6. عند إجراء تجارب متعددة على نفس العينة، من الضروري أن تفصل كل واحدة قبل 15 دقيقة على الأقل، ويمكن من خلال الوقت الذي perfused العينة. تسمح هذه الخطوات لتصوير المتكررة الناجمة عن تحفيز Ca2 + الردود من نفس الحقل للعرض في نفس العينة على الأقل 3-5 ساعات. من المهم أيضا للمخدرات بريديلوتي حله في [دمس] كما هو موضح للبيلاروسية، كما يدفع [دمس] تطبق مباشرة على الأنسجة جكامب-الإعراب عن الردود الأسفار لا رجعة فيه، ومستقلة عن التحفيز.
وجدنا أنه لأسباب غير واضحة، Wnt1-لجنة المساواة العرقية؛ الفئران conditionalGCaMP3/6 لا يحمل تحفيز العصب أو Ca2 + ردود فعل مؤثر في خلايا شوان بعد P15-P20. ومع ذلك، Sox10-لجنة المساواة العرقية؛ وتواصل الفئران الشرطي GCaMP3/6 يحمل هذه الردود على الأقل في وقت متأخر من P56، أقدم عمر أنه قد درسنا. في المقابل، يحمل الفئران المشروطة Myf5 GCaMP3/6 الردود القديمة كما أنها سنة واحدة، أقدم عمر درس.
بينما الفئران جيتشي-الإعراب عن توفر فرصاً فريدة للتصوير Ca2 + الردود في شعوب بأكملها من الخلايا من نوع فرعي محدد، هناك بعض القيود، مثل عدم القدرة على القيام بالتصوير راتيوميتريك، وهكذا، استخراج كمية المرجع المصدق 2 + القياسات. وهناك أيضا قيود على مقدار عمق الأنسجة التي يمكن تصويرها هذه الاستجابات باستخدام ويديفيلد fluorescence مجهرية (أي، بدلاً من استخدام الفحص المجهري [كنفوكل] أو مولتيفوتون). ولذلك، بينما ركاكة الحجاب الحاجز قابلة لتطبيق التقنيات المعروضة هنا، أسر الخاصة بالخلية Ca2 + الردود في أنواع الخلايا من NMJ في العضلات الأخرى التي أكثر سمكا قد يتطلب تشريح الفرعية أو الأنواع الأخرى من مجهر الأسفار.
وتمثل هذه الأدوات البصرية والوراثية تقدما هاما أكثر من السابق Ca2 + تقنيات، التي يمكن تصويرها فقط أنواع متعددة من الخلية أو الخلايا الفردية قليلة داخل خلية واحدة نوع التصوير. ميزة إضافية أن Ca2 + الردود يمكن ريبيتابلي تصويرها لفترات طويلة من الزمن من نفس الخلايا باستخدام الفئران جيتشي، بينما لا يكون ذلك ممكناً بسهولة باستخدام التقليدية الكيميائية Ca2 +-ملزمة الأصباغ الفلورية. وأخيراً، استخدام الفاصل صورة، نحن القيام بتصوير ثنائي-الطول الموجي من إشارة دينامية داخل خلية واحدة نوع (خلايا شوان) وتسمية ثابتة داخل ثانية (خلايا العضلات)، وهكذا، تظهر كيف متعددة خاصة بخلية الكالسيوم أو الجهد يمكن أن تكون الردود تقييمها ( مثلماوس خلية شوان Cre قيادة عبروا إلى ماوس جكامب تعتمد لجنة المساواة العرقية على شرطي كما ذكرت هنا، عبرت إلى ماوس مستقلة عن لجنة المساواة العرقية المحورة وراثيا معربا عن العضلات الخاصة بخلية جيتشي أو جيفي مع الإثارة الأسفار غير متداخلة/ 10من أطياف الانبعاث، أن يتيح تعقب المتزامنة من Ca2 + و/أو الجهد التغيرات الدينامية في خلايا شوان والعضلات). هذه الأدوات يمكن أن يساعد في تقييم ما إذا كانت استجابة نوع خلية واحدة لحافز معين، مثل بورين ATP أو أن الادينوسين انهيار المنتج، المباشر أو الوساطة غير مباشر بتأثير مباشر على نوع الخلية آخر في NMJ.
كان الهدف الرئيسي لهذه الدراسات لتقييم الزمانية المكانية Ca2 + استجابة نمط الخلية الأنواع الفرعية لتحفيز الأعصاب، ولكن يمكن نشر التقنيات المستخدمة لتحقيق هذا الهدف نحو أهداف أخرى. على سبيل المثال، يمكن استخدامها لتحليل Ca2 + الردود حضور بعض الخصوم أو في بعض الخلفيات متحولة، كما هو الحال في نماذج حيوانية معينة من الأمراض العصبية الحركية أو ضمور العضلات أو مرض شاركو-ماري الأسنان، لتحليل Ca2 + استجابة ليضع محددة لتقييم التعبير مستقبلات، لتقييم عدم تجانس Ca2 + استجابة الميزات داخل نوع فرعي خلية إلى حافز، أو لمقارنة Ca2 + الردود في نوع فرعي من خلية إلى أخرى وظيفية الردود داخل هذا النوع (إمكانات اندبلت أو عمل العضلات اليكتروفيسيولوجيكالي مسجل، تقصير العضلات المصورة ضوئياً، التوتر العضلي محول--سجلت القوة، إلخ) أو لمعلمات أخرى (مثلاً، وظيفة المخصص التقييم مورفولوجيا خلية شوان العصبية/العضلات أو التعبير الجزيئي عبر إيمونوهيستوتشيميستري). معا، هذه الدراسات تبين جيتشي كيف الخلية المحددة أو الفئران جيفي يمكن استخدامها لإلقاء الضوء على طائفة واسعة من العمليات الفيزيولوجية في المشبك يتكون من مدخلات محددة وراثيا، وخلية على حدة.
Disclosures
الكتاب ليس لها علاقة بالكشف عن.
Acknowledgements
وأيد هذا العمل بتمويل من المعاهد الوطنية للصحة (المعاهد الوطنية للصحة) GM103554 و GM110767 إلى (T.W.G.) والمركز الوطني "بحوث الموارد" 5P20RR018751 و GM103513 8 ف 20 المعهد الوطني للعلوم الطبية العامة (إلى G.W.H.).
Materials
| Name | Company | Catalog Number | Comments |
| Myf5-Cre mice | Jax | #007893 | Drives muscle cell expression as early as E136 |
| Wnt1-Cre mice | Jax | #003829 | Drives expression into all Schwann cells at E13 but not P209 |
| Sox10-Cre mice | Jax | #025807 | Drives Schwann cell expression at older ages |
| Conditional GCaMP3 mice | Jax | #029043 | Expresses GCaMP3 in cell-specific fashion |
| Conditional GCaMP6f mice | Jax | #024105 | Expresses GCaMP6f in cell-specific fashion |
| BHC (3-(N-butylethanimidoyl)-4-hydroxy-2H-chromen-2-one) | Hit2Lead | #5102862 | Blocks skeletal muscle myosin but not neurotransmission6 |
| CF594-α-BTX | Biotium | #00007 | Labels acetylcholine receptor clusters at NMJ |
| µ-conotoxin GIIIb | Peptides Int'l | #CONO20-01000 | Blocks Nav1.4 voltage-dependent sodium channel8 |
| Silicone Dielectric Gel; aka Sylgard | Ellswoth Adhesives | # Sil Dielec Gel .9KG | Allows for the immobilization of the diaphragm by minutien pins |
| Minutien pins (0.1mm diameter) | Fine Science Tools | 26002-10 | Immobilizes diaphragm onto silicone dielectric gel |
| Eclipse FN1 upright microscope | Nikon | MBA74100 | Allows staging and observation of specimen |
| Basic Fixed Microscope Platform with Manual XY Microscope Translator | Autom8 | MXMScr | Allows movement of specimen |
| Manual micromanipulator | Narishige | M-152 | Holds recording and stimulating electrodes |
| Microelectrode amplifier | Molecular Devices | Axoclamp 900A | Allows sharp electrode intracellular electrophysiological recording |
| Microelectrode low-noise data acquisition system | Molecular Devices | Digidata 1550 | Allows electrophysiological data acquisition |
| Microelectrode data analysis system | Molecular Devices | PCLAMP 10 Standard | Performs electrophysiological data analysis |
| Square wave stimulator | Grass | S48 | Stimulates nerve to excite muscle |
| Stimulus Isolation Unit | Grass | PSIU6 | Reduces stimulation artifacts |
| Borosilicate filaments, 1.0 mm outer diameter, 0.5mm internal diameter | Sutter | FG-GBF100-50-15 | Impales and records nerve-evoked muscle potentials |
| Borosilicate filaments, 1.5 mm outer diameter, 1.17mm internal diameter | Sutter | BF150-117-15 | Lengthened and used for suction electrode |
| Micropipette Puller | Sutter | P-97 | Pulls and prepares recording electrodes |
| 1200x1200 pixel, back-illuminated cMOS camera | Photometrics | Prime 95b | Sensitive camera that allows high-resolution, high-speed imaging |
| Light Source | Lumencor | Spectra X | Provides illumination from LEDs for fluorescence obsevation |
| Infinity-corrected fluorescent water immersion objectives, W.D. 2mm | Nikon | CFI60 | Provide long working distances for visualization of specimen |
| Fiber Optic Illuminator with Halogen lamp | Sumita | LS-DWL-N | Provides illumination for brightfield observation |
| W-View Gemini Image Splitter | Hamamatsu | A12801-01 | Projects 1 pair of dual wavelength images separated by a dichroic to single camera |
| Single-band Bandpass Filters (512/25-25 and 630/92-25) | SemRock | FF01-512/25-25; FF01-630/92-25 | Permits dual band imaging |
| 560 nm Single-Edge Dichroic Beamsplitter | Sem Rock | FF560-FDi01-25x36 | Dichroic mirror which separates beams of light to allow dual-wavelength imaging |
| Imaging data acquisition system | Nikon | NIS Elements - MQS31000 | Allows imaging data acquisition |
| Wavelength control module | Nikon | MQS41220 | Module for imaging data acqusiition |
| Emission splitter hardware module | Nikon | MQS41410 | Module for imaging data acqusiition |
| Imaging data analysis system | NA | Volumetry 8D5, Fiji | Allows analysis of fluorescence intensity and other imaging data |
References
- Sanes, J. R., Lichtman, J. W. Development of the vertebrate neuromuscular junction. Annual Review of Neuroscience. 22, 389-442 (1999).
- Darabid, H., Perez-Gonzalez, A. P., Robitaille, R. Neuromuscular synaptogenesis: coordinating partners with multiple functions. Nature Reviews Neuroscience. 15 (11), 703-718 (2014).
- Fatt, P., Katz, B. An analysis of the end-plate potential recorded with an intracellular electrode. Journal of Physiology. 115 (3), 320-370 (1951).
- Todd, K. J., Robitaille, R. Purinergic modulation of synaptic signalling at the neuromuscular junction. Pflugers Archive. 452 (5), 608-614 (2006).
- Hennig, G. W., et al. Use of Genetically Encoded Calcium Indicators (GECIs) Combined with Advanced Motion Tracking Techniques to Examine the Behavior of Neurons and Glia in the Enteric Nervous System of the Intact Murine Colon. Frontiers of Cellular Neuroscience. 9, 436 (2015).
- Heredia, D. J., Schubert, D., Maligireddy, S., Hennig, G. W., Gould, T. W. A Novel Striated Muscle-Specific Myosin-Blocking Drug for the Study of Neuromuscular Physiology. Frontiers of Cellular Neuroscience. 10, 276 (2016).
- Johnson, B. R., Hauptman, S. A., Bonow, R. H. Construction of a simple suction electrode for extracellular recording and stimulation. Journal of Undergraduate Neuroscience Education. 6 (1), A21-A26 (2007).
- Hong, S. J., Chang, C. C. Use of geographutoxin II (mu-conotoxin) for the study of neuromuscular transmission in mouse. British Journal of Pharmacology. 97 (3), 934-940 (1989).
- Heredia, D. J., Feng, C. Y., Hennig, G. W., Renden, R. B., Gould, T. W. Activity-induced Ca2+ signaling in perisynaptic Schwann cells of the early postnatal mouse is mediated by P2Y1 receptors and regulates muscle fatigue. Elife. 7, e30839 (2018).
- Cho, J. H., et al. The GCaMP-R Family of Genetically Encoded Ratiometric Calcium Indicators. ACS Chemical Biology. 12 (4), 1066-1074 (2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved