Method Article
Ex Vivoセル固有カルシウム マウス ダイヤフラムの三者のシナプスでシグナル伝達のイメージング
要約
マウスの神経筋接合部で個々 のセル型の集団のイメージ カルシウムにプロトコルをご紹介します。
要約
電気生理学的手法による組織内の細胞の電気的活動を監視できますが、これらは通常個々 の細胞の分析に限られています。細胞のイメージングを搭載蛍光カルシウムに敏感な細胞内カルシウム (Ca2 +) 細胞質の増加は多くの場合電気的活動のため発生しますまたは、無数の他の刺激に応答して、このプロセスを監視できますので染料。 しかし、これらの染料は、組織内のすべてのセル型からとられるので全体の組織内の個々 のセル型のこの反応をイメージすることは困難です。対照的に、遺伝的コード化カルシウム指示薬 (GECIs) 個々 のセル型で表現できるので、細胞内 Ca2 +Ca2 +の全人口におけるシグナル伝達のイメージングが可能の増加への応答で蛍光を発する個々 のセルの種類。ここでは、マウス神経筋接合部に使用 GECIs GCaMP3/6 の適用、シュワン細胞の運動神経細胞、骨格筋、「ターミナル/間の三者のシナプス。古典的な前のヴィヴォティッシュの準備でこの手法の有用性を示す.光スプリッターを使用すると、我々 実行動的 Ca2 +シグナルのデュアル波長イメージングと神経筋接合部 (NMJ) の静的なラベル 2 つのセルに固有の GECI または遺伝的コード化の電圧監視に容易に適応させることができる方法で指標 (GEVI) 同時に。最後に、蛍光強度の空間マップをキャプチャするために使用されるルーチンをについて説明します。一緒に、さまざまなコンテキストで NMJ で明瞭な細胞の亜集団の生物活性を検討するこれらの光、トランスジェニック、分析技術を使用できます。
概要
NMJ は、すべてのシナプスのような 3 つの要素で構成されます: シナプス前終末に由来するニューロンは、シナプス後ニューロン/エフェクター細胞とグリア perisynaptic セル1,2。シナプス伝達の基本的な側面は、このシナプス3で披露された最初中、このプロセスの多くの側面のこのシナプスの異なる細胞要素によって同じ分子の発現のために部分、不明なまま。いずれかの解釈をこのように複雑運動ニューロン、シュワン細胞、筋肉、脊椎動物の略記で運動ニューロンによって解放共同、プリン アデニン ヌクレオチド ATP とアセチルコリン (ACh) の両方の受容体を表現するなどこれらの物質 (例えば伝達物質放出または応答の、筋力生成) の4によって加えられる機能に影響します。さらに、略記の三者のコンポーネントは単純な比較に、たとえば、複数のシナプス入力をよく表わす中枢神経系ニューロン運動神経細胞、筋細胞や Schwann 細胞による刺激に応じて変化するかどうか本質的な不均一性 (例えば、萌芽期の誘導、繊維のサブタイプ、形態) は明確ではないです。これらの各問題を対処するために有利なトラック、同時に、その他の個別の要素のいずれかでこのような反応と同様、1 つのシナプス要素内の多くの細胞の応答を同時に追跡することです。バス適用色素は組織に適用された後複数の細胞のタイプによってとらし、細胞内で読み込まれている色素は、視覚化するのみ使用できますのでカルシウム シグナルを測定する化学染料を使用して従来の戦略はこれら 2 つの目標を達成できません。セルの個人や小集団。ここでは、セル固有カルシウム シグナル、特定のイメージングとソフトウェア ツール5、これらの 2 つの全体的な目標の最初から、議論を測定するように設計 GECIs を発現するトランスジェニック マウスを用いた方法のまた新しいトランスジェニック ツールは、2 番目の達成を助けるでしょう。この手法はカルシウム動態や同時に複数のセル人口の遺伝子符号化光センサーを通してイベント観測可能なオブジェクトをシグナルその他の携帯電話の追跡に興味がある人の役に立つでしょう。
プロトコル
動物飼育および実験はされたのケアおよび実験動物の使用とネバダ大学で IACUC 国立の機関健康ガイドに従って実行されます。
1. ダイヤフラムおよびトランスジェニック マウスからの横隔神経の準備
- トランスジェニック マウスおよびオリゴヌクレオチドのプライマー遺伝子型がこれらのマウスを購入します。
注: プライマーは、これらのマウスのそれぞれの「情報」ページに表示されます。- 適切な遺伝子/ノックアウトの Cre ドライバーの対立遺伝子の 1 つのコピーとGCaMP3 の条件の 1 つまたは 2 つのコピーを表現する同じ年齢の第 2 マウスで条件付きGCaMP3/6アレルのゼロのコピーを表現する 3-6 カ月齢のマウスを繁殖させる/6の対立遺伝子と Cre ドライバーの対立遺伝子のゼロのコピー。
- 遺伝子 Cre と条件付き GCaMP3/6 対立遺伝子の両方を持っている子犬とマークのもの-ダブル-トランスジェニック マウスを呼ばれる今後これら (例えば、 Myf5 Cre、条件付き GCaMP3)6。
注: この方法では、すべてのデータは Cre と条件付き GCaMP3/6 対立遺伝子の両方のコピーを発現するマウスから派生させます。これらの交差する他の突然変異体のマウス (例えばノックアウト) に追加する場合、これは特に重要です。
- ダブル トランスジェニック マウスが適切な年齢のとき (例えば生後 0 または 5 [P0 または P5] または成人向け)、(マウス P10 より若い) 用ハサミでそれらを decapitating またはイソフルレン吸入室にそれらを配置することによって、マウスを安楽死させる-彼らは、鉗子のペアと尾をつまんにもはや対応、彼らは犠牲の準備ができています。
- はさみのペアで斬首で動物を犠牲に。
- 全体の動物の肝臓のすぐ下と心臓や肺虹彩ハサミの真上を横切る横断面。
- 肝臓、心臓、(すなわち1-2 cm) の吸引電極に引き込まれるに十分な長さは、横隔神経の長さを維持するように注意しながら、肺を解剖まで。
メモ: 左の横隔神経は横隔膜の内側部に入る組織の白い部分として識別できます。肺を削除するときは、カットされませんする必要があります。右横隔神経は、上大静脈を含むまたより薄く、上大静脈よりも白く筋膜の部分の内で実行されます。一緒に、彼らは両方浸透内側右の横隔膜です。 - さらに、胸部と横隔膜の周りの細い畝を除いて脊柱を削除します。
- 1 μ G/ml 594-暗闇の中で 10 分間 αBTX とクレブス リンガー液管および microfuge の横隔膜と横隔神経のサンプルを置きます。
注: 594-αBTX のこの集中機能 (個人観測) をブロックせず ACh 受容体 (AChRs) のラベルします。
2. 刺激と筋活動電位の記録
- ダイヤフラムを固定 minutien ピンを使用して、固定することによって 6 cm 皿にシリコーンゲル誘電体で被覆された ~ 8 ml の酸素のクレブス リンガー液と顕微鏡ステージ上に配置します。30 分以上のクレブス リンガー液 (8 mL/分) で絞りを灌流します。
注: 非連結 594-αBTX、リンスし同様郭清後組織をあります。 - 確立された方法7によると吸引電極を作る。
- マニュピュレーターを使用して、4 倍の倍率で左横隔神経上に吸引電極を移動し、吸引電極に接続されているチューブに接続されている 5 mL シリンジのバレルを抜いて吸引を適用します。
注: 吸引電極に正常に描画されると、横隔神経がピンと張ったです。刺激をオンにし、横隔膜を刺激する、手動反転による神経スイッチ × 1。 - 横隔膜が視覚的に明視野照明でそれを調べることによって 1 Hz の刺激への応答の契約を確認します。ない場合は、激のパルスは、筋収縮の目視検査で確認することができますを達成するために段階的電圧ノブを回して電圧を調整します。まだ表示されていない場合は、注射器で神経を吹き消す吸引を適用することによって再度描画しようとします。
- マニュピュレーターを使用して、4 倍の倍率で左横隔神経上に吸引電極を移動し、吸引電極に接続されているチューブに接続されている 5 mL シリンジのバレルを抜いて吸引を適用します。
- 灌流の電源を切り、最終濃度 100 μ M に特定の筋ミオシン阻害剤 BHC6または電位依存性ナトリウム チャネル拮抗薬 μ-コノトキシン8を追加します。
- 100 μ M の BHC をするためには、DMSO で 200 mM の在庫の 4 μ L をピペットし、クレブス リンガー液の 1 mL に predilute。
- お皿からクレブス リンガー液の 1 mL を削除します。
- Prediluted BHC を皿に追加します。
注: この predilution は、GCaMP3 発現細胞の非一時的な蛍光応答の原液 DMSO による誘導を防ぐのに役立ちます。 - 30 分待って、別の 20-30 分のための新鮮なのクレブス リンガー液の灌流に入れます。
- 記録電極を準備します。
- 手袋を装着はマイクロ ピペットの引き手に 1 mm と 0.4 mm の内径 (ID) の外径 (OD) のホウケイ酸 filamented ガラスを配置、位置にそれをクランプするダイヤルを締めます。引き手のドアを閉じます。
- P-97 引き手を使用して次の設定をプログラム: 900 で熱、120 でプル、速度 75 で、250、500、およびない追加のループの圧力で時間。
注: Resistance (R) は、増幅器のソフトウェア コントロールを使用して、測定: データ集録ソフトウェア V 式を解くことによって抵抗を確認 = 赤外線ソフトウェア コント ローラー電極を介して既知電流 (I) (通常 1 nA) を通過し、r. のために解決できる電圧 (V) の変化を測定 - 胚のダイヤフラムのため抵抗は 60 MΩ の近く、古いダイヤフラム、10-20 MΩ のことを確認します。3 M の KCl と記録電極をロードします。
- 10 倍の倍率で刺激電極としてステージの反対側に 2 番目のマイクロマニピュレーターを使用して筋肉に電極を下げます。
- 電気生理学的データ集録ソフトウェアを使用して、静止膜電位 0 からに変わったら-65 mV またはそれ以下。
- 1 Hz で刺激し、適度なオーバー シュートを示す大きな可能性をチェックして筋活動電位の存在を確認 (0 を超える可能性-65 で起動時に mV mV またはそれ以下)。活動電位刺激人工物を混同しないでください。
注意: 電位が大幅に長い期間 (~ 5 ms) 刺激アイテムよりも。
3. サンプルの蛍光イメージング
- 20 倍の倍率で緑/黄色光励起下の NMJs の 594-αBTX-ラベルを探して筋終板帯中心を探します (550 nm)。青の光励起に切り替える (470 nm) 筋肉、運動ニューロン、シュワン細胞画像 Ca2 +応答します。
- 必要に応じて、設定画像分割バンドパス フィルターとデュアル波長イメージング用ダイクロイック シングル エッジ フィルター。
- GCaMP3/6 表現の組織によって示される最大蛍光 (Fmax) を計算するためにダイヤフラムの準備6に 12 μ L の 3 M 塩化カリウム (KCl) を追加します。
- GCaMP3/6 表現する組織が KCl に応えてビニングなし 20 倍の倍率で彩度を展示物レベルの 110% に設定参照テーブルのバーで明るさバーで実験を実行します。
- 高速イベントをお見逃しなくする 1 秒あたり 20 フレームで記録します。
- 吸引電極を用いたインパルスの鉄道を提供することにより神経刺激の 20-40 hz 1 45 s 刺激またはバス アプリケーションまたは灌流によって薬理学的アゴニストを追加し、1 つ細胞サブタイプの動的蛍光 Ca2 +応答を収集一緒に静的 594 αBTX NMJ 信号。
注: 組織固有または遠赤 GECI または GEVI マウスは略記で使用可能になると場合、略記で 2 つの携帯電話の要素を反映した 2 つの動的信号を収集する彼ら使用できます。 - 画像や電気生理学的実験を終了するは、望ましい結果が達成されているため、灌流線を通して水を灌流し、水 2 倍 - 3 倍を介して、塩を構築しないように吸引電極を吸います。
4. エクスポートと蛍光強度 (SDiu16) の標準偏差マップによるデータの分析
- 16 ビット TIFF スタックとして記録映像を記録し、分析に必要な画像データ解析システムに読み込みます。
- ソフトウェアの 8 d ファイル] メニューの [選択対象の画像のスタックしロードするクリックします。
- ビデオが読み込まれると、一度細胞蛍光活性を持たないセクションを識別するために時間をスキャンできます。
注: この領域は、背景のサンプルを作成する使用されます。 - Shift キーを押しし、背景サンプル領域として特定のエリアに関心 (ROI) ボックスの領域を描画するをクリックします。
- ボックスを作成すると、バック グラウンド活動変化のプロットを作成するスペースバーを押します。
- トレースを右クリックし、xy 座標テキストファイルとしてトレースするテキストとしてダンプ ROIにオプションを提示する各種のオプションを選択します。
- ビデオが読み込まれると、一度細胞蛍光活性を持たないセクションを識別するために時間をスキャンできます。
- 関心のビデオに戻って動いて、関心のアクティビティが発生している領域を識別するために再びスキャンします。
- マウスの中央ボタンを使用して、黄色の時間ボックスでこの領域を選択します。
- ビデオを右クリックし、スタックの OPSと、 Stat マップオプション 5 を選択します。
注: これは、左側のウィンドウで標準偏差マップ (SD マップ) が生成されます。 - SD 地図上をクリックして、次プレス]に適切な色のヒート マップを適用する 19 x。
- SD マップを右クリックし選択STM の読み込みし、保存、SD マップを保存するstm tiff として保存するオプションが表示されます。
- その後、プレス[キー 19 x グレースケール カラー マップに戻ります。
- 密度マッピング ツールを動作させるには、 Cその後、 Dキーを押します。マウスの左ボタンとマウスの中央ボタンを使用して、SD 地図に示すように蛍光灯のすべての活動を含むようにしきい値を調整します。
- しきい値設定を維持しながら、[密度] ツールを閉じるにCキーを押します。
- SD マップを右クリックし、 STM 粒子をクリックし、検索し、PTCLSを選択します。
注: これは蛍光活動を表現する個々 のセルを識別します。 - SD マップをもう一度右クリックし、粒子・ ロワの作成を選択します。
注: これは関心の元のビデオの選択したセルを重ね合わせます。 - シフトを押しながら元のビデオに今識別された粒子・ ロワのいずれかを右クリックします。
- 投資収益率のマーカーとROI の測定 Intを選択します。
注: これは興味のビデオの各特定の投資収益率の蛍光の個々 の活動のプロットが生成されます。これらはこれらのいずれかを右クリックして保存し、テキストとしてダンプ ROIによって続いて盛り合わせを選択できます。
- これらの操作の基礎となる詳細なロジック、ソース コード ファイル9を参照してください。
結果
蛍光強度の変化、細胞内 Ca2 +の略記には、定義済みのセル型内での増加を介するのいくつかの例では、このアプローチの有用性を示しています。これらの結果、応答細胞の場所だけでなく、どのように多くの細胞応答とどのくらいの各セルの特定応答評価することができます、その反応の強度を提供する空間の蛍光強度マップとして表示します。刺激。たとえば、図 1のように、私たちのビデオを取ったターミナル/perisynaptic シュワンの人口における Ca2 +反応の細胞 (TPSCs) P7 Wnt1 Cre; のダイヤフラムの NMJs で条件付き GCaMP3-横隔神経刺激によるマウスを表現し、空間の蛍光強度マップによって応答細胞の集団を識別します。熱マップ火カラー ルックアップ テーブル (CLUT 火) に従って色分けと、蛍光強度のこれらのマップが掲載されています。我々 と同時に横隔膜 (動画 1と2)、真ん中に α BTX ラベル AChRs のクラスターを表示する画像を分割せずにこれらのビデオを記録した動的 GECI または GEVI をキャプチャする合わせることができる簡単にする方法2 つの個別の応答の細胞型、それらの各々 は非重複の励起・発光スペクトルが展示されます。
図 2P4 Myf5 Cre; 条件付き GCaMP3のダイアフラムで同じ神経刺激実験を行った-マウスを表現し、筋細胞内 Ca2 +応答をイメージします。興味深いことに、ミオシン ブロッカー BHC や骨格筋固有の電圧ゲートを使用する場合ナトリウム チャネル (Nav1.4) ブロッカー μ-コノトキシン (図 2 aとビデオ 3や図 2 bとビデオ 4、それぞれ)、我々 は Ca2 +過渡筋線維の完全な長さの旅行から筋小胞体、または終板バンドの長さだけ電位と Ca2 +のリリースによって仲介されるアクションを表す、表すを可視化、終板電位と空間の蛍光強度と応答細胞の集団を識別する AChR.In 添加による細胞外 Ca2 +流入によって仲介されるマップ (SD)、図 1のように、我々 はまた、変化を測定時空間 (ST) とこれらの筋肉細胞の人口で時間をかけて蛍光でマップされます。これらの実験はそれぞれ異なる細胞型、異年齢、別の治療 (異なる薬剤の存在下で神経刺激と神経刺激)、分析 (空間と時空間のさまざまな種類蛍光強度マップ)。これらの数字はまた遺伝子組換え GCaMP 発現マウス、すなわち繰り返し刺激して同じサンプルのイメージを作成し、そのため、別の処理条件の影響をテスト能力の最も有用な機能の 1 つを示しています。

図 1: 測定活動に伴うシュワン細胞 Ca2 +応答の横隔膜と横隔神経の P7 Wnt1 Cre;条件付き GCaMP3マウスします。(A) (左)、細胞神経筋接合部 (NMJ)、横隔神経の枝に沿ってシュワンの蛍光のバック グラウンド レベルを示す平均蛍光強度イメージは神経刺激 (Prestim) の前に捕獲されました。この背景の蛍光性の値は、神経刺激後に得られる蛍光値から引かれています。(右)16 ビット蛍光強度単位 (SDiu16) 30 以降後生成された Ca2 +応答の標準偏差の空間地図横隔神経刺激 (スティミュラス マップまたは SD マップ) の 40 の Hz の s ターミナル/perisynaptic シュワンの頑健な応答を示しています。細胞 (TPSCs) で略記します。火 CLUT ヒートマップは SDiu16で、ミクロン単位では、スケール バー。パネルB - Eのすべての画像は、パネルAのそれらと同じ倍率です。(B) (左) 同じダイヤフラムは、594 共役 α-ブンガロトキシン部位 (α-BTX)、バインドとアセチルコリン受容体 (AChRs) のラベルと略記を識別するために緑/黄色光で励起が付いていた。(右)このパネルは、同じダイヤフラムの明視野画像を示していますは、α BTX ラベリングに基づく、NMJ に導くことができる、細胞内記録電極 (矢印) の先端を示します。(C) Ca2 +一時的な特徴 (例えば強さ、刺激、発症期間) (左)、粒子として読み手空間強度マップの各地域境界を定めるして個々 のセルまたはセルのグループを評価できますそれらは時間をかけてその強度をプロットの関心 (ROIs) と (D) に色分けされた地域を表します。(E) このパネルは、同じ横隔膜神経刺激後ジェミニ画像スプリッターを使用しての GCaMP3 を介した蛍光 Ca2 +応答と 594 α ラベル NMJs のデュアル波長画像を示しています。この図の拡大版を表示するのにはここをクリックしてください。

ビデオ 1: シュワン細胞の活動に伴う Ca の画像を分割せずに映画2 +P7 で詳細に説明されているように応答、図 1伝説。してくださいここをクリックしてこのビデオを表示します。(右クリックしてダウンロード)
ビデオ 2: 画像はシュワン細胞の活動に伴う Ca の分裂と映画2 +レスポンス ・ 594Α BTX ラベル AChRs P7 で詳細に説明されているように、図 1伝説。してくださいここをクリックしてこのビデオを表示します。(右クリックしてダウンロード)
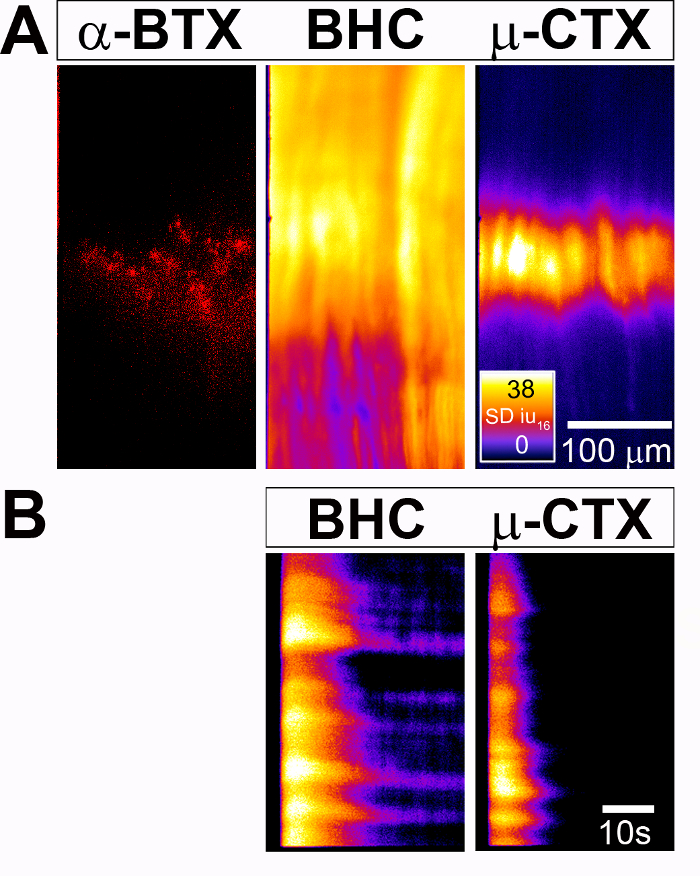
図 2: 測定活動に伴う筋細胞 Ca2 +応答 P4 Myf5 Cre; のダイヤフラムの条件付き GCaMP3マウスします。(A) (左) ニコチン AChR 横隔膜の位置鏡板バンドのクラスターは、594-α-BTX が付いています。(中央)30 後に生成される Ca2 +非定常強度 (SD マップ) の空間地図 BHC、ミオシン阻害剤存在下で横隔神経刺激の 40 Hz のすべて横隔膜筋細胞の全体、地域全体の応答を示しています。(右)対照的に、同じ刺激が Nav1.4 拮抗薬 μ-コノトキシン (μ-CTX) の存在下で同じダイヤフラムから生成された SD マップ展示空間制約すべて横隔膜筋の内側の領域での応答セルAChR のクラスター濃縮鏡板バンドに対応しています。火 CLUT ヒートマップは SDiu16で、ミクロン単位では、スケール バー。(B) このパネル マップを示しています時空間 Ca2 +の一時的な強度 (ST マップ) を時間をかけて筋細胞の人口の (y-軸) 時間の経過後 (x-軸)。スケール バーは、秒単位です。この図の拡大版を表示するのにはここをクリックしてください。

ビデオ 3: 活動に伴う筋細胞 Ca の映画2 +P4 で詳細に説明されているようにあるミオシン ブロッカー BHC の存在下での応答、図 2A伝説。してくださいここをクリックしてこのビデオを表示します。(右クリックしてダウンロード)

ビデオ 4: 活動に伴う筋細胞 Ca の映画2 +Na の存在下で反応v1.4 拮抗薬 μ-コノトキシン P4 で詳細に説明されているように、図 2B伝説。してくださいここをクリックしてこのビデオを表示します。(右クリックしてダウンロード)
ディスカッション
ここでは、Ca2 +応答 GECI 発現マウスを用いたそのままの筋組織の特定のセルを測定するいくつかの例を提供します。これらの実験を正常に実行するために横隔神経を傷つけないように解剖中が不可欠です。低または高電力 (すなわち20 X、60 X) でシュワン細胞の Ca2 +応答をイメージするには、BHC またはブロックの動きに μ-コノトキシンのいずれかを使用する必要です。低消費電力用筋細胞内 Ca2 +応答の中に長さの変化筋 Ca2 +非定常強度と筋の同時取得が可能、これらの薬の不在でそれらを測定することが可能です。高周波神経刺激6。同じサンプルの複数の実験を実行すると、サンプル中の時間潅流されたことが、少なくとも 15 分に各 1 つを分離する必要は。手順は、少なくとも 3-5 時間の刺激による Ca2 +応答同じサンプルのビューの同じフィールドからの繰り返されたイメージングできます。また、DMSO GCaMP 表現の組織に直接適用は不可逆的な刺激に依存しない蛍光応答を誘導するよう BHC のとおり DMSO に溶解 predilute 薬が重要です。
我々 は発見した理由は明らかではない、 Wnt1 Cre;conditionalGCaMP3/6マウスは、P15 - P20 後神経刺激またはアゴニストによるシュワン細胞内 Ca2 +応答を展示する失敗します。ただし、 Sox10 Cre;条件付き GCaMP3/6マウスは、P56、少なくとも限り遅く行った最も古い時代のこれらの応答を示し続けてください。対照的に、 Myf5 条件付き GCaMP3/6マウス展示応答を検討した最古の年齢 1 年と同じくらい古いです。
レシオ メトリック イメージングを実行して、したがって、定量的な Ca を抽出することができないなど、いくつかの制限があります GECI 発現マウスは、Ca2 +応答の特定のサブタイプの細胞全体の集団でのイメージングのためのユニークな機会を提供する、2 +測定。また、組織からこれらの応答は広視野蛍光顕微鏡 (すなわち、共焦点または多光子顕微鏡を使用してではなく) を使用してイメージ化することができますの深さの量には制限があります。したがって、横隔膜の薄さはここで紹介する手法の適用のために適して、厚い筋肉で NMJ のセル型のセル固有 Ca2 +応答をキャプチャする必要がありますサブの郭清や他の種類の蛍光顕微鏡。
これらの遺伝的・光学的ツールは、以前 Ca2 +イメージング技術、種類の細胞だけまたは 1 つのセル型の中でいくつかの個々 のセルを描出できた上重要な進歩を表しています。付加的な利点は Ca2 +応答できますパルスパワー イメージ化されること時間の長い期間の GECI マウスを用いた同じ細胞からこれは伝統的な化学 Ca2 +を使用して容易に可能ではありません-蛍光染料をバインドします。最後に、画像スプリッターを使用して、我々 は 1 つのセル型 (シュワン細胞) の中でダイナミック信号と 2 番目 (筋細胞) 内の固定ラベルのデュアル波長イメージングを実行し、したがって、複数セル固有のカルシウムが表示や応答をすることができます電圧評価 (例えば、ここでは、報告された条件付き Cre 依存 GCaMP マウスに渡ったシュワン細胞 Cre を動かすマウス Cre 依存のトランスジェニック マウス筋細胞固有の表現に GECI または GEVI と交差蛍光励起の非オーバー ラップ/発光スペクトル10、できるようになるシュワンおよび筋肉細胞のダイナミックな Ca2 +または電圧変化の同時追跡)。このようなツールは、1 つのセル型のプリン ATP やその内訳製品アデノシンなどの特定の刺激への応答は直接または間接的略記で別のセルタイプに直接影響によって仲介されるかどうかを評価を助けることができます。
これらの研究の主な目的は、Ca2 +応答の時空パターン神経刺激による細胞サブタイプを評価が、これを達成する技法は他の目標に向かって展開できます。例えば、運動ニューロン疾患、筋ジストロフィーやシャルコー ・ マリー ・ トゥース病、分析するための特定の動物モデルにおける Ca2 +応答特定の拮抗薬の存在下で、または特定の突然変異の背景を分析する使用できます、Ca2 +応答への受容体 Ca2 +応答機能を刺激する細胞サブタイプ内の不均一性を評価するためにまたは他の機能に対する細胞サブタイプの Ca2 +反応を比較する式を評価する特定のアゴニスト応答(生理記録された筋終板やアクションの活動電位、光学的イメージ筋の短縮、力探触子記録筋肉の緊張等)その型またはその他のパラメーター (例えばホックを投稿するには神経/筋シュワン細胞の形態や分子発現の免疫組織化学での評価)。一緒に、これらの研究を示してどのように細胞特異 GECI または GEVI マウスは遺伝子を特定できる、セル固有の入力から成るシナプスの生理学的なプロセスの広い範囲を照らすに使用ことができます。
開示事項
著者が明らかに何もありません。
謝辞
この仕事は、資金の健康 (NIH) の GM103554 と GM110767 (T.W.G.) に国立衛生研究所国立研究資源 5P20RR018751 センターから国立総合医学研究所 8 P 20 GM103513 (G.W.H.) にも対応しました。
資料
| Name | Company | Catalog Number | Comments |
| Myf5-Cre mice | Jax | #007893 | Drives muscle cell expression as early as E136 |
| Wnt1-Cre mice | Jax | #003829 | Drives expression into all Schwann cells at E13 but not P209 |
| Sox10-Cre mice | Jax | #025807 | Drives Schwann cell expression at older ages |
| Conditional GCaMP3 mice | Jax | #029043 | Expresses GCaMP3 in cell-specific fashion |
| Conditional GCaMP6f mice | Jax | #024105 | Expresses GCaMP6f in cell-specific fashion |
| BHC (3-(N-butylethanimidoyl)-4-hydroxy-2H-chromen-2-one) | Hit2Lead | #5102862 | Blocks skeletal muscle myosin but not neurotransmission6 |
| CF594-α-BTX | Biotium | #00007 | Labels acetylcholine receptor clusters at NMJ |
| µ-conotoxin GIIIb | Peptides Int'l | #CONO20-01000 | Blocks Nav1.4 voltage-dependent sodium channel8 |
| Silicone Dielectric Gel; aka Sylgard | Ellswoth Adhesives | # Sil Dielec Gel .9KG | Allows for the immobilization of the diaphragm by minutien pins |
| Minutien pins (0.1mm diameter) | Fine Science Tools | 26002-10 | Immobilizes diaphragm onto silicone dielectric gel |
| Eclipse FN1 upright microscope | Nikon | MBA74100 | Allows staging and observation of specimen |
| Basic Fixed Microscope Platform with Manual XY Microscope Translator | Autom8 | MXMScr | Allows movement of specimen |
| Manual micromanipulator | Narishige | M-152 | Holds recording and stimulating electrodes |
| Microelectrode amplifier | Molecular Devices | Axoclamp 900A | Allows sharp electrode intracellular electrophysiological recording |
| Microelectrode low-noise data acquisition system | Molecular Devices | Digidata 1550 | Allows electrophysiological data acquisition |
| Microelectrode data analysis system | Molecular Devices | PCLAMP 10 Standard | Performs electrophysiological data analysis |
| Square wave stimulator | Grass | S48 | Stimulates nerve to excite muscle |
| Stimulus Isolation Unit | Grass | PSIU6 | Reduces stimulation artifacts |
| Borosilicate filaments, 1.0 mm outer diameter, 0.5mm internal diameter | Sutter | FG-GBF100-50-15 | Impales and records nerve-evoked muscle potentials |
| Borosilicate filaments, 1.5 mm outer diameter, 1.17mm internal diameter | Sutter | BF150-117-15 | Lengthened and used for suction electrode |
| Micropipette Puller | Sutter | P-97 | Pulls and prepares recording electrodes |
| 1200x1200 pixel, back-illuminated cMOS camera | Photometrics | Prime 95b | Sensitive camera that allows high-resolution, high-speed imaging |
| Light Source | Lumencor | Spectra X | Provides illumination from LEDs for fluorescence obsevation |
| Infinity-corrected fluorescent water immersion objectives, W.D. 2mm | Nikon | CFI60 | Provide long working distances for visualization of specimen |
| Fiber Optic Illuminator with Halogen lamp | Sumita | LS-DWL-N | Provides illumination for brightfield observation |
| W-View Gemini Image Splitter | Hamamatsu | A12801-01 | Projects 1 pair of dual wavelength images separated by a dichroic to single camera |
| Single-band Bandpass Filters (512/25-25 and 630/92-25) | SemRock | FF01-512/25-25; FF01-630/92-25 | Permits dual band imaging |
| 560 nm Single-Edge Dichroic Beamsplitter | Sem Rock | FF560-FDi01-25x36 | Dichroic mirror which separates beams of light to allow dual-wavelength imaging |
| Imaging data acquisition system | Nikon | NIS Elements - MQS31000 | Allows imaging data acquisition |
| Wavelength control module | Nikon | MQS41220 | Module for imaging data acqusiition |
| Emission splitter hardware module | Nikon | MQS41410 | Module for imaging data acqusiition |
| Imaging data analysis system | NA | Volumetry 8D5, Fiji | Allows analysis of fluorescence intensity and other imaging data |
参考文献
- Sanes, J. R., Lichtman, J. W. Development of the vertebrate neuromuscular junction. Annual Review of Neuroscience. 22, 389-442 (1999).
- Darabid, H., Perez-Gonzalez, A. P., Robitaille, R. Neuromuscular synaptogenesis: coordinating partners with multiple functions. Nature Reviews Neuroscience. 15 (11), 703-718 (2014).
- Fatt, P., Katz, B. An analysis of the end-plate potential recorded with an intracellular electrode. Journal of Physiology. 115 (3), 320-370 (1951).
- Todd, K. J., Robitaille, R. Purinergic modulation of synaptic signalling at the neuromuscular junction. Pflugers Archive. 452 (5), 608-614 (2006).
- Hennig, G. W., et al. Use of Genetically Encoded Calcium Indicators (GECIs) Combined with Advanced Motion Tracking Techniques to Examine the Behavior of Neurons and Glia in the Enteric Nervous System of the Intact Murine Colon. Frontiers of Cellular Neuroscience. 9, 436 (2015).
- Heredia, D. J., Schubert, D., Maligireddy, S., Hennig, G. W., Gould, T. W. A Novel Striated Muscle-Specific Myosin-Blocking Drug for the Study of Neuromuscular Physiology. Frontiers of Cellular Neuroscience. 10, 276 (2016).
- Johnson, B. R., Hauptman, S. A., Bonow, R. H. Construction of a simple suction electrode for extracellular recording and stimulation. Journal of Undergraduate Neuroscience Education. 6 (1), A21-A26 (2007).
- Hong, S. J., Chang, C. C. Use of geographutoxin II (mu-conotoxin) for the study of neuromuscular transmission in mouse. British Journal of Pharmacology. 97 (3), 934-940 (1989).
- Heredia, D. J., Feng, C. Y., Hennig, G. W., Renden, R. B., Gould, T. W. Activity-induced Ca2+ signaling in perisynaptic Schwann cells of the early postnatal mouse is mediated by P2Y1 receptors and regulates muscle fatigue. Elife. 7, e30839 (2018).
- Cho, J. H., et al. The GCaMP-R Family of Genetically Encoded Ratiometric Calcium Indicators. ACS Chemical Biology. 12 (4), 1066-1074 (2017).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved