Method Article
Подготовка культуры главной ячейки высокого качества из рыбы Pituitaries
В этой статье
Резюме
Здесь мы описываем протокол готовить и поддерживать первичный гипофиза клеточных культур от оризии (Oryzias latipes). Оптимизированные условия в этом протоколе учитывать важные параметры, такие как осмотического давления, температуры и рН, подражая физиологических условиях рыба, тем самым позволяя физиологически более значимых результатов.
Аннотация
Культура клетки первичной является мощным инструментом обычно используется учеными для изучения клеточных свойства и механизмы изолированных клеток в контролируемой среде. Несмотря на огромные различия в физиологии млекопитающих и рыб протоколы культуры клетки первичной из рыбы часто основаны на условиях млекопитающих культуры, часто с незначительными изменениями. Экологические различия затрагивают не только температуру тела, но и сыворотке крови параметров, таких как осмотического давления, pH и буферной емкости рН. Как клетки культуры средств массовой информации и аналогичные рабочие решения призваны имитировать характеристики внеклеточной жидкости и/или сыворотки крови, к которой адаптируется ячейки, важно, что эти параметры настроены специально для животных в вопросе.
Текущий протокол описывает оптимизирован основной культуры условия для оризии (Oryzias latipes). Протокол предоставляет подробные шаги на как изолировать и поддержания здоровой отделить гипофиза клетки для более чем одной недели и включает в себя следующие шаги: 1. Регулировка осмотического давления до значения найдены в плазме крови оризии, 2. Корректировка Температура инкубации до температуры нормальной оризии (здесь в объекте аквариума) и 3. корректировка pH и бикарбонат буфера значения сопоставима с других рыб, обитающих на аналогичных температурах. Результаты представлены с использованием описанных протокола содействовать физиологически значимые результаты для оризии и может использоваться в качестве справочного руководства учеными, делая культуры главной ячейки от других не млекопитающих видов.
Введение
Культура клеток является одним из основных инструментов, используемых в молекулярных биологических исследований, обеспечивая отличную модель системы для ответа на различные биологические вопросы, начиная от нормальной клеточной физиологии наркотиков скрининг и канцерогенеза1. Главные ячейки, изолированные непосредственно из тканей животных с помощью ферментных и/или механические методы, часто считаются биологически более актуальным, чем клеточных линий, как биологической реакции может быть ближе к ситуации в естественных условиях . Протоколы для подготовки начального клеточных культур должны быть оптимизированы для каждого вида и ячейки типа интереса для того, чтобы имитировать характеристики, к которым приспособлен ячейки и получить физиологически ощутимые результаты.
Многочисленные протоколы описания условий культуры mammalian клетки систем, в то время как аналогичные протоколы описания основной культуры условий для рыбы клетки довольно скудные в сравнении. Клетки являются уязвимыми к быстрым изменениям температуры, рН и осмотического давления и особенно уязвимы во время процедуры диссоциации. Коммерческие солевых растворов и культуральных сред, используемых для культур клеток млекопитающих не являются оптимальными для костистых рыб, особенно в том, что касается pH буфера охранной и осмотического давления. Таким образом, важно измерить и настроить решения физиологически соответствующие уровни этих параметров в видов, представляющих интерес.
Основная гипофиза культур были сделаны из нескольких видов костистых рыб, в том числе сазан (Cyprinus Карпио)2,3, трава Карп (Ctenopharyngodon растительноядной)4, Золотая рыбка (auratus караси )5,6радужной форели (Oncorhynchus mykiss), угорь (Ангилья Ангилья)7, тилапии (Oreochromis mossambicus)8, данио рерио (Danio рерио)9, а Треска (за morhua)10. Помимо регулировки температуры инкубации видов интерес, некоторые из этих протоколов инкубировали клетки на млекопитающих как условия, которые могут быть оптимальным для видов, представляющих интерес, с рН от 7,2 до 7,5 в атмосфере увлажненный содержит 3-5% CO2. Кроме того это не ясно, если осмоляльность растворов, используемых для подготовки некоторых из этих начальных клеточных культур были скорректированы и стабильной между различными решениями.
Текущий протокол основывается на предыдущей работе с первичных культур от атлантической трески10 и включает в себя корректировку температуры инкубации, осмоляльность, рН и рН буферные системы, включая парциальное давление углекислого газа (ЦУП2), чтобы Физиология оризии (O. latipes). Оризии является пресноводных рыб небольшой (3 – 4 см), родом из Восточной Азии. В эти дни, он используется как модель видов во многих научно-исследовательских лабораториях во всем мире, как он сравнительно легко размножаются и высокой устойчивостью к многих общих заболеваний рыб11. Существует несколько преимуществ использования оризии как модель, включая отклонение температуры от 4 – 40 ° C11, время коротких поколения, прозрачный эмбрионов, секс определение Джин12и последовательности генома13, а также многие другие генетические ресурсы.
Основная культура условия в этом протоколе оптимизированы соответствует температура 26 ° C, что medakas хранятся в объекте рыбы. Кроме того уменьшается от 320 мОсм/кг от атлантической трески, живущих в соленой воде до 290 мОсм/кг для оризии, живущих в пресной воде и в соответствии с нормальной осмотического давления плазмы оризии14осмотического давления. В сравнении типичный осмотического давления плазмы млекопитающих находится в диапазоне 275 – 295 мОсм15. Рыба живет в различных температур и имеют жабры, которые находятся в непосредственном контакте с водой, делая pH и буферной емкости крови и межклеточной жидкости в рыбе, отличаются от тех, в млекопитающих. У млекопитающих культуры средств массовой информации, как правило, включают буферные системы, которые приводят к рН около 7,4, когда средства массовой информации являются достижение равновесного уровня стандартного атмосферу 5% CO2 в увлажненный воздух при температуре 37 ° C. PH-зависит от температуры и значение для нейтральной рН (в воде) увеличивается с снижение температуры16. РН плазмы типичный костистых рыб колеблется от 7,7 до 7.917. Оптимизации этого протокола включают сокращение от рН 7,85 трески, хранится 12 ° c до pH 7,75 для оризии хранится на 26 ° C, увеличивая CO2 от 0,5% до 1%.
Кроме того Емкость буфера бикарбонат довольно сильно отличается в рыб и млекопитающих. CO2 легко осуществляется через жабры рыб и ЦУП2 в воде составляет лишь небольшую часть ЦУП2 в легких18. Изменение температуры или ЦУП2 приведет к изменению pH и буферной среды. Следовательно, pH ни ЦУП2 рекомендуется для инкубации клеток млекопитающих является оптимальным для рыбы клетки, и таким образом, средства массовой информации культуры должны быть оптимизированы с системами буфер, содержащий физиологически соответствующие значения для рыбы и отдельных видов, представляющих интерес. Этот протокол описывает как подготовить культуры главной ячейки от оризии pituitaries и включают корректировки инкубации температуры, осмоляльность, рН и рН буферной системы, помимо других важных параметров, которые необходимо учитывать при подготовке главной ячейки культур от не млекопитающих видов.
протокол
Норвежский университет естественных наук, следующие руководящие принципы для ухода и благополучия животных исследования были утверждены животных эксперименты, проведенные в этом исследовании.
1. Подготовка решений
- Калибровка осмометре и рН метр инструментов согласно инструкциям производителя для обеспечения правильного измерения.
-
Подготовка 500 мл Ca2 +- и мг2 +-бесплатно Дульбекко фосфат амортизированное saline (dPBS), корректировка pH до 7.75 (шаг 1.2.1) и осмотического давления до 290 мОсм/кг (шаг 1.2.2) до стерильной фильтрации (шаг 1.2.3).
- Регулировка рН до 7.75 с калиброванной рН метр, тщательно добавив капли раствора NaOH 1 M внимательно помешивая решение.
- Измерить осмотического давления решения с помощью калиброванного осмометре и рассчитать количество маннитол, необходимых для повышения осмотического давления до 290 мОсм/кг. Добавьте необходимое количество маннитол, а затем измерить осмоляльность решения снова для обеспечения правильной настройки.
Примечание: Количество маннитол необходимо зависит от осмотического давления измерения, который обычно колеблется между различными партиями. Одна молекула маннитол равен 1 осмотическое частиц. - Стерильными фильтр dPBS решение, с помощью фильтра 0,2 мкм.
Примечание: Решение может храниться при температуре 4 ° C для по крайней мере 3 месяцев.
- Подготовка 500 мл Лейбовиц (L-15) культуры среды без L-глютамина и бикарбонат и дополнить его с 10 мм NaHCO3 (шаг 1.3.1), 4,5 мм глюкозы (шаг 1.3.2) и коммерчески доступных глютамин 2 мм (шаг 1.3.3). Отрегулируйте решение 290 мОсм/кг (шаг 1.3.4), стерильные фильтр (шагом 1.3.5) и добавить 2,5 мл раствора пенициллина и стрептомицина (шаг 1.3.6).
Примечание: Решение может храниться при температуре 4 ° C для по крайней мере 4 недель.- Добавьте 420 мг NaHCO3 500 мл питательной среды для достижения решения 10 мм.
- Добавление 405 мг глюкозы 500 мл питательной среды для достижения решения 4,5 мм.
- Добавьте 5 мл 100 x акций решения глютамина в 500 мл питательной среды для достижения решения 2 мм. Размешайте до растворения всех растворенных веществ.
- Настройте решение 290 мОсм/кг с маннитол, используя осмометре (как в шаге 1.2.2).
- Выполните стерильной фильтрации L-15 среды, используя фильтр 0.2 мкм.
- После стерильной фильтрации добавьте 2,5 мл раствора пенициллина и стрептомицина, соответствующий 50 ед/мл пенициллина и 50 мкг/мл стрептомицина.
- Подготовка 50 мл раствора трипсина, используя 1 мг/мл типа трипсина (0,1%), II-S растворяют в модифицированных dPBS (подготовленных на шаге 1.2). Сделать аликвоты 2 мл в стерильных пластиковых трубок и хранить их при-20 ° C до использования.
Примечание: Аликвоты 2 мл может храниться при температуре-20 ° C для по крайней мере 3 месяцев. - Подготовка 50 мл раствора ингибитор трипсина, используя 1 мг/мл (0,1%) трипсина ингибитор типа I-s и дополнить его с 2 мкг/мл DNase я растворен в модифицированных dPBS (подготовленных на шаге 1.2). Сделать аликвоты 2 мл в стерильных пластиковых трубок и хранить их при-20 ° C до использования.
Примечание: Аликвоты 2 мл может храниться при температуре-20 ° C для по крайней мере 3 месяцев.
2. Подготовка оборудования
- Подготовка стеклянной пипетки пожаром, полировка подсказка для диссоциации клеток. Советы с 2 разных размера категории (средний открытия 0,6 – 0,8 мкм и небольшое отверстие 0,4 – 0,6 мкм), играя время и расстояние от пламени, одновременно поворачивая пипеткой. Место стеклянной пипетки в чистой стеклянной тары и автоклав их (с помощью твердых режим при 105 ° C для 45 мин).
- Подготовьте полистирольные коробки со льдом.
- Подготовьте пластиковой трубки с 1,5 мл модифицированных dPBS (подготовленных на шаге 1.2) для переноса pituitaries, чтобы во время вскрытия и держать его на льду.
- Подготовка 15 мл тюбик 10 мл модифицированных dPBS (подготовленных на шаге 1.2) и держать его на льду до диссоциации клеток.
- Подготовьте свежие или разморозить аликвоты трипсина и решения ингибитор трипсина (подготовлен в шагах 1.4 и 1.5) и держать их на льду до использования.
- Установите ванну водой до 26 ° C перед началом рассечение позволить воде для достижения желаемой температуры перед химической диссоциации pituitaries.
- Очистите все инструменты диссекции с 70% этанол до, во время и после использования, в том числе штраф щипцы для использования для рассечения и тонкой иглы и воска плита для закреплять рыбу. Используйте чистые перчатки (изменить и очистить часто) во время всей процедуры, чтобы избежать потенциального заражения клеток.
3. гипофиза диссекции и диссоциации клеток
- Усыпить рыбы, погружая его в слякоть льда (0 ° C). Оставьте рыбу в слякоть льда для по крайней мере 1 мин для обеспечения необратимого гипотермического шок.
Примечание: Иммобилизации и равновесия потеря будет происходить через несколько секунд. Убедитесь, что рыба полностью погружен в воду льда и не лежат поверх льда, как последний приведет к удушению и потенциал кожи ожоги вместо быстрого и гуманного гипотермического шок. - Быстро передать воска плита под микроскопом рассечение рыбу в сети и уничтожить позвоночника, удар иглы через шею.
- Закрепите голову рыбы на воск пластину с помощью тонкой иглы, путем вставки иглы в спереди (через рот) и один на каждой стороне головы (за мозг) стабилизировать голову перед рассечение.
- Просмотр рыбы под микроскопом диссекции и аккуратно соскребите весы на верхней части головы, с использованием тонкой щипцы с угловым наконечником.
- Тщательно вставьте угловой наконечник тонкой щипцы под кожу со стороны головы и удалить крыши черепа, медленно перемещая щипцы в направлении устья, удерживая крепко щипцы, включающего крыши черепа.
- Спинной мозг полностью отрезаны используя щипцы с угловым наконечником.
Примечание: Время является важным фактором, поэтому работать эффективно и точно ограничить время провел от вскрытия pituitaries, до тех пор, пока клетки покрыты в блюдо. После некоторой практики, гипофиза диссекции следует принять около 2-3 мин на рыб, из которых только около 10 s необходимо выбрать гипофиза, когда мозг уже подвергается. - Осторожно переверните мозга к рот, чтобы разоблачить гипофиза и проанализируем его чистым пинцетом с прямой наконечник. Передать пластиковая трубка, содержащая 1,5 мл изменения dPBS гипофиза (подробности см. в шаге 2.3) размещены на льду. Проверьте наконечник щипцы под микроскопом, чтобы обеспечить гипофиза успешно добавлены к трубе и ничего не осталось на щипцы.
Примечание: Вскрыть столько pituitaries, при необходимости, в зависимости от количества блюд культуры, которые будут подготавливаться одновременно. Как правило Рассчитайте по крайней мере 10 pituitaries от взрослых рыб на блюдо, чтобы иметь соответствующую плотность клеток (который зависит от течению приложения). - Спин вниз pituitaries в настольная центрифуга для 1 – 2 секунд при комнатной температуре. Осторожно удалить с помощью пипетки стеклянные dPBS и заботиться, чтобы избежать удаления любой pituitaries.
- Добавьте 1 мл раствора трипсина (подготовленных на шаге 1.4) мыть pituitaries, спина их вниз в настольной центрифуги для 1 – 2 секунд и удалить большую часть жидкости с помощью пипетки стеклянные перед добавлением дополнительных 1 мл раствора трипсина.
- Инкубировать трубку в водяной бане на 26 ° C в течение 30 мин, желательно с нежно тряска, или альтернативно, Флик трубки пару раз в течение инкубационного периода.
- Спин вниз pituitaries в настольная центрифуга для 1 – 2 секунд при комнатной температуре и убедитесь, что все pituitaries расположены в нижней части трубки. Удалить большую часть раствор трипсина с стеклянной пипетки и добавьте 1 мл раствора ингибитор трипсина (подготовленных на шаге 1.5) инактивирует трипсина и стирать pituitaries.
- Сбор pituitaries в нижней части трубки, спиннинг их вниз в настольной центрифуги для 1 – 2 секунд при комнатной температуре. Удалите часть жидкости с стеклянной пипетки и добавьте 1 мл раствора ингибитор трипсина (подготовленных на шаге 1.5). Поместите трубку на водяной бане в 26 ° C в течение 20 минут, желательно с нежно тряска, или альтернативно, Флик трубки пару раз в инкубационный период для инактивации трипсина.
- Приготовить блюдо культуры поли d лизин покрытием ячейки 35 мм с Центральной стекла дном, добавив 2 мл L-15 среды и давая что Инкубируйте по крайней мере 10 мин на 26 ° C и с 1% CO2 , так что он может достичь нужной температуры и рН до гальванических клеток.
Примечание: Пластиковые клетки культуры блюдо может также использоваться. Основным преимуществом использования блюдо с централизованной стекла дно является что район, где клетки покрыты меньше, и поэтому меньше гипофиза клетки необходимы за блюдо. Некоторые нисходящие приложения может также потребовать низа стекла (то есть, некоторые методы обработки изображений). - Установка охлаждения центрифуги для 15 мл пробирок до 4 ° C, чтобы позволить ему достичь желаемой температуры перед началом механические диссоциации.
- Собрать pituitaries в нижней части трубки, спиннинг вниз трубки с решением ингибитор трипсина (от шага 3.11) в настольная центрифуга для 1 – 2 секунд при комнатной температуре и убедитесь, что все pituitaries расположены в нижней части трубки до тщательно Удаление большую часть решения ингибитор трипсина, с помощью стеклянной пипетки.
Примечание: Выполните все следующие действия протокола в лавочке ламинарного потока (ЛВС) сертифицирован для работы клеток во избежание заражения клеток. - Добавьте 1 mL ледяной модифицированных dPBS (подготовленных на шаге 2.4) на куски ткани гипофиза и нежно сосать кусочки ткани вверх и вниз (6 – 7 x) в огонь полировка стекла пипетки (подготовленных на шаге 2.1).
Примечание: Температура является важным аспектом, так что держите все решения при 4 ° C. С этого момента выполните все шаги на льду, когда это возможно. - Спин вниз куски ткани в настольная центрифуга для 1 – 2 секунд при комнатной температуре и тщательно передать новой 15 мл трубки помещены на льду в верхней части dPBS, содержащий диссоциированных клетки (почти 1 мл). Избегайте перемещать пипетку в нижней части трубки, где остались кусочки ткани.
- Повторите шаг 3.16 – 3.17, отделения клеток в 1 мл ледяной dPBS в то время, пока все 10 мл dPBS используется. Начните использовать стеклянные пипетки с среднего размера открытия и переключиться на стеклянной пипетки с меньше открытия в конце (за последние 3 – 4 мл dPBS добавил) диссоциации. Если до сих пор видны куски ткани в конце процедуры диссоциации, увеличить дозирование до приблизительно 10 x к 2 последние шаги dPBS для диссоциации и наконец оставляют остаточной ткани штук. Нежно ресуспензируйте клетки и избегать создания пузыри, как это может вызвать повреждение клеток, когда клетки придают поверхности пузырьков.
Примечание: Это критический шаг настоящего Протокола и требует определенной подготовки для достижения хорошего результата. - Уравновесить трубку в центрифуге (предварительно охлаждается до 4 ° C) и спин вниз клетки на 200 x g 10 мин при 4 ° C. Убедитесь, что Марк стороне трубки, где будет Пелле клеток.
- Осторожно извлеките трубку из центрифуги и мягко передавать супернатант с стеклянной пипетки пластиковые трубки пустой 15 мл непосредственно после центрифугирования. Убедитесь в том удалить большую часть супернатанта, но будьте осторожны, чтобы не потерять Малый Пелле (часто невидимые) клеток.
- Тщательно Ресуспензируйте Пелле клеток в 50 – 100 мкл L-15 питательной среды.
Примечание: На данном этапе, можно подсчитать количество ячеек или выполнять проверку жизнеспособности (например, ячейку, считая присутствии Трипановый синий с помощью Горяева), но остерегайтесь, что использование частью суспензию клеток для этой цели снизит урожай. Избегайте использования тома большой подвеска как это увеличит риск клеток, диффундирующих вне центра блюдо. - Осторожно капать диссоциированных клетки в середине блюдо культуры клеток, содержащих 2 мл L-15 среды (подготовленных на шаге 3.13). Позволяют клеткам опускаться на дно посуды для примерно 5 минут перед перемещением их в инкубатор, чтобы избежать необходимости распространился за пределы утопленная часть стекла дно клетки.
- Инкубируйте блюдо на 26 ° C и 1% CO2 разрешить все клетки для мойки тщательно и прикрепить к нижней части блюдо.
- После 30 мин посмотрите на клетки в Микроскоп, чтобы убедиться, что они придают культуры блюдо.
- Продолжать инкубировать клетки на 26 ° C и 1% CO2.
- Тщательно изменить большинство (но не все) носитель каждые 3 – 4 дня.
Примечание: Избегайте изменения среды более часто, как это может нарушить клетки и сделать их отделить от стекла дно. Использование ячейки для экспериментов в течение недели после посева их.
Результаты
Этот протокол описывает подготовку культуры главной ячейки от оризии pituitaries и обеспечивает здоровые клетки, которые могут поддерживаться в культуре для по крайней мере одной недели. Протокол основан на физиологические соответствующие значения для оризии14 и дополнительно оптимизирован для гипофиза ткани в взрослых рыб, с помощью рН 7,75 и осмотического давления 290 мОсм/кг в течение всей процедуры от уборки ткани с покрытием клетки в культуре (рис. 1 и рис. 2).
Представитель результаты экспериментов на начальных клеточных культур, производимых этим протоколом отображаются в рисунке 3, рис. 4и 5. Результаты, представленные здесь, трансгенных оризии линии, где лютеинизирующий гормон (ЛГ)-gonadotrope клетки Экспресс Зеленый флуоресцентный белок (КГВ), используемых в19. Рисунок 3 показывает поле представителя в блюдо культуры главной ячейки от дня 0 на 7 день после посева, включая оба изображения ярко поле и Флюоресцентная микроскопия, показаны GFP-выражая Lh-gonadotrope клеток. С помощью около 10 взрослых оризии pituitaries за блюдо обычно приводит к плотности около 5 x 10-4 -1 х 105 клетки за блюдо после посева. Жизнеспособность клеток гипофиза в культуре рассчитывается на основе общего числа GFP-выражая клеток в культуре в день 1, 3 и 7 после покрытия, по сравнению с день 0 (Рисунок 4). График, показанный на рисунке 4 показывает, что количество умирающих клеток является почти постоянным с течением времени, с более чем 95% клеток живых после 1 дня, тогда как более 90% все еще жив после 3 дней. Хотя есть небольшое снижение жизнеспособности клеток с временем, большинство клеток (около 75%) все еще живы спустя неделю в культуре. Электрофизиологические записи GFP-выражая Lh-gonadotrope клеток (выполняется, как описано в Strandabø, и др.) 20 показывают, что клетки способны огонь потенциалы действия спонтанно после 4 дней в культуре (Рисунок 5A). Кроме того после стимуляции гонадолиберин, первоначальный переходных гиперполяризации клеточной мембраны сопровождается резким увеличением стрельбы частоты, что наряду с деполяризации и увеличение продолжительности действия потенциалов (Рисунок 5B).
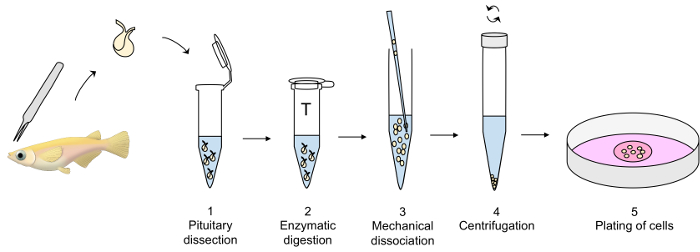
Рисунок 1: обзор техники культуры гипофиза главной ячейки. Pituitaries расчлененный с тонкой щипцами и передана пластиковой трубки, содержащий измененные dPBS на льду (шаг 1 из протокола) до ферментативного пищеварения pituitaries с трипсина на 26 ° C (шаг 2), а затем инактивации с ингибитор трипсина на 26 ° C (не показан). Механический диссоциации ферментативно усваивается pituitaries с стеклянной пипетки тщательно выполнен в dPBS на льду (шаг 3), а затем центрифугированием при температуре 4 ° C (шаг 4). Наконец ячейка Пелле растворяется в питательной среды и клетки, покрытием в ячейку культуры блюдо (шаг 5). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 2: детали оризии гипофиза диссекции. (A) Глава иммобилизованных оризии (спинной вид) удержал плиты воска, и верхней части крыши черепа удаляется с тонкой щипцами подвергать верхней части мозга. (B) спинной разорваны, и мозга, перевернул к передней части головы таким образом, что подвергается гипофиза. (C) гипофиза собирается с чистым, прекрасным щипцами. Стрелка указывает на гипофиза в группе B и C. Шкалы бар = 1000 мкм. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 3: оризии гипофиза начальных клеточной культуры. Эти панели показывают изображения с высоким разрешением конфокальный представитель оризии гипофиза главной ячейки культуры в день 0, день 3 и 7 день после посева. Верхняя панель показывает микроскопии светлые области изображения представителя поля в блюдо, средней панели показывает флуоресцентной микроскопии изображений же поле зрения отображения GFP-выражая Lh-gonadotrope клеток, и нижней панели наложения двух. Шкалы бар = 20 мкм. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
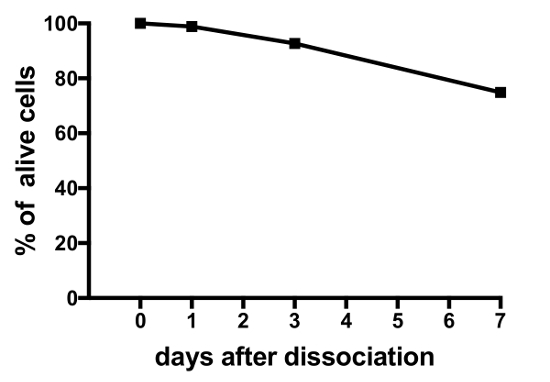
Рисунок 4: жизнеспособности оризии гипофиза клеток в культуре. Эта цифра показывает жизнеспособность гипофиза начальных клеточных культур, измеренных в день 0, 1, 3 и 7 после посева. Номера рассчитываются с использованием открытого программного обеспечения CellProfiler V2 и основаны на общее количество ячеек GFP-выражая Lh-gonadotrope на блюдо в разное время точках, по сравнению с время 0. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
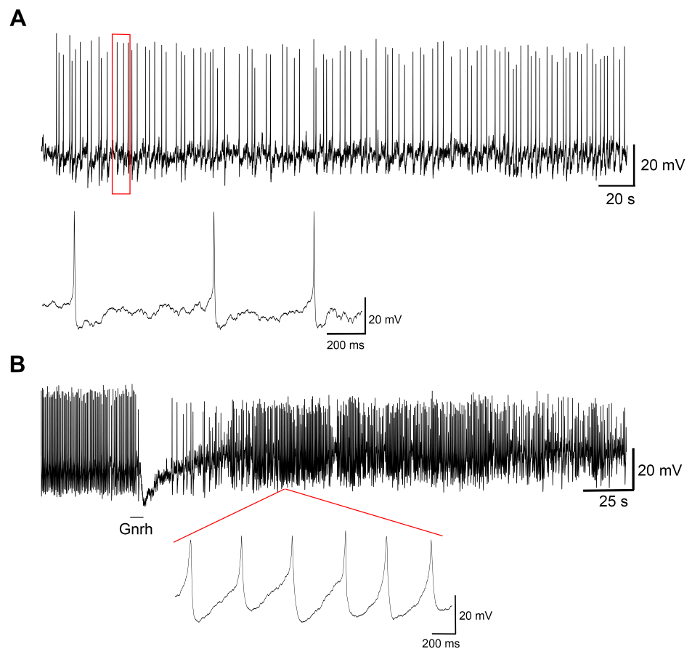
Рисунок 5: электрофизиологических записи клеток гипофиза. Эти панели показывают электрофизиологических записей из GFP-выражая Lh-gonadotrope клетки в культуре клеток первичного выполнены на 4-й день после посева, показаны (A) представитель след спонтанное потенциалы действия, а затем (Б) стимуляция с гонадолиберин Gnrh1 для 10 s. Gnrh1 стимуляция вызывает двухфазный ответ с гиперполяризации клеточной мембраны, а затем деполяризации и увеличение продолжительности действия потенциалов (измеряется на 50% пик) от 8,9 ± 3.0 мс до стимуляции 29.2 ± 9.9 мс после стимуляция. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Обсуждение
В vitro клетки культуры системы обеспечивают мощные инструменты для исследователей для ответа множество различных биологических вопросов, если используется в правильном пути1. Важно помнить, что диссоциированных клетки, которые потеряли их соединения в соседние клетки могут быть получены различные функциональные свойства, чем они первоначально имел в естественных условиях. Чтобы избежать риск неправильной интерпретации результатов, полученных в экспериментах в пробирке , важно рассмотреть вопрос о корректировке процедуре культуры главной ячейки для видов и ячейки тип интереса. Даже умеренные корректировки стандартных культуры процедуры и решения, используемые часто достаточно глубоко изменить культуру условий конкретной ячейки типа.
Этот протокол описывает оптимизированные условия для подготовки и сохранения культуры главной ячейки от взрослых оризии pituitaries, которые могут быть достигнуты путем настройки параметров, таких как температура, осмоляльность, рН и ЦУП2 решения используется, для соответствуют физиологическим условиям этого вида. РН зависит от температуры и следовательно, также корректироваться между разными видами костистых рыб, живущих в разных температур17. Осмоляльность всех решений, используемых при диссоциации клеток и культивирования также должна быть скорректирована с целью улучшить состояние клеток. Особенно если есть расхождения в осмотического давления между различными решениями, используемый во время процедуры изоляции, он может иметь разрушительное воздействие на культуру качества, ведет к снижению жизнеспособности (авторов собственные неопубликованные результаты). Гиперосмотических решения приведет к клетки сокращаться (и наоборот), тем самым мешая целостность мембран и мембранных белков функции21. Важным моментом в этом контексте является параметры, такие как осмотического давления и pH не обычно измеренных ни стабильной между различными партиями коммерческих буферов и культуральных сред, используемых в условиях млекопитающих культуры. Различия в осмотического давления и рН между различными решениями, используемый во время процедуры изоляции следует избегать в любое время.
Успешность этого протокола улучшена путем профессиональной подготовки, так что ожидается исследователям необходимо некоторое время, чтобы познакомиться с различными шагами техники. Например время от вскрытия pituitaries до тех пор, пока клетки покрыты в блюдо пропорционален здоровья клеток. Механический диссоциации pituitaries, с помощью пипетки стеклянные является особенно важным шагом протокола, и это требует определенной подготовки для достижения хорошего результата. Диссоциация процедура может ввести осмотического и механических подчеркивают, что вредно для ячейки. Добавление небольших объемов модифицированных dPBS в повторяющиеся шаги для механических диссоциации обеспечивает мягкий диссоциации процедура, где уже диссоциированных клетки будут переданы новой трубки и слева нетронутая, в то время как исследователь продолжает отделить дополнительные клетки из ткани в виде нового тома dPBS.
Этот протокол оптимизирован для взрослых оризии гипофиза клеток. Различных видов, тканей или даже различных этапах жизни животного в пределах же ткани требуют оптимизации условий культуры. Например, клетки, полученные из незрелых животных могут быть более хрупким и, следовательно, более восприимчивы к апоптозу клеток смерть и, таким образом, может потребовать нужно настроить протокол, особенно к мягкие процедуры диссоциации. Механический диссоциации с помощью пипетки стеклянные является очень важным шагом процедуры, как слишком осторожным механических диссоциации приведет к меньше выгоды, в то время как один слишком грубо может побудить смерти apoptosis или клетки. Если различные ферменты, считаются для диссоциации, это может быть необходимо использовать разные пищеварение время и фермента концентрации. Оризии pituitaries очень маленький и относительно легко отмежеваться с использованием описанных протокола. Однако оптимизации для других видов может потребовать использования сетки фильтра после диссоциации для удаления мусора. Успех этого протокола также во многом зависит выполнение шагов в стерильных условиях, чтобы избежать загрязнения клетки.
Количество ячеек для семян за блюдо зависит количество pituitaries в начале, а также успех процедуры диссоциации. Есть примерно около 15000 клетки в нетронутыми взрослых оризии гипофиза. Однако клетки теряются во время процесса диссоциации и это следует учитывать при расчете числа pituitaries, необходимые для эксперимента. Использование по крайней мере 10 pituitaries за блюдо обычно приведет к плотности около 50 000 – 100 000 ячеек на блюдо. На плотность агрегации не образуют в любой значительный объем, даже после 7 дней в культуре. Заметно, агрегации кажется плотность зависит, как плотнее клетки являются семенами, тем больше они кажутся агрегирования. Некоторые процедуры могут потребовать более плотной культуры и, таким образом, оптимальная плотность посева следует рассматривать в зависимости от вниз по течению. Это важный момент, чтобы принимать во внимание при планировании количество pituitaries для использования за блюдо.
Наиболее распространенные нисходящие приложения используют начальных клеточных культур в течение первых нескольких дней после посева. Представленные здесь, от жизнеспособности клеток электрофизиологических записи, результаты показывают, что это возможно получить хорошие результаты от начальных клеточных культур, подготовлен с использованием описанных протокол на срок до 1 недели после посева. Тем не менее культур может храниться дольше, и здоровые клетки по-прежнему присутствуют после более чем 2 недель в культуре (авторов собственные неопубликованные результаты). Оптимизированные условия, представленные в настоящем Протоколе облегчает физиологически ощутимые результаты и может быть полезным для других ученых, подготовка первичной клеточных культур от клеток не млекопитающих.
Раскрытие информации
Авторы не имеют ничего объявить.
Благодарности
Этот проект финансировался норвежского университета науки о жизни и исследовательский совет Норвегии, номер гранта 243811 и 244461 (программа аквакультуры). Мы благодарны Лурдес Карреон Тан в Норвежском университете науки о жизни для сохранения объекта рыбы.
Материалы
| Name | Company | Catalog Number | Comments |
| Dulbecco’s Phosphate Buffered Saline (dPBS), without calcium chloride and magnesium chloride | Sigma (Merck, Damstadt, Germany) | D8537 | Adjust solution to pH 7.75 with 1M NaOH and 290 mOsm with mannitol. |
| L-15 medium (Leibovitz), witout L-glutamine | Sigma (Merck, Damstadt, Germany) | L5520 | Supplement 500 ml culture medium with 10mM NaHCO3, 4.5 mM glucose, 2 mM Glutamax. Adjust solution to 290 mOsm with mannitol and filter solution through a 0.2 µm PES sterile filter, before adding 2.5 ml Penicillin-Streptomycin solution (see below for details). |
| NaOH | Sigma (Merck, Damstadt, Germany) | S5881 | Add drops of 1M solution to increase pH of dPBS and culture medium to 7.75. |
| NaHCO3 | Sigma (Merck, Damstadt, Germany) | S5761 | 10 mM NaHCO3 equals 420 mg per 500 ml culture medium. |
| D-mannitol | Sigma (Merck, Damstadt, Germany) | 63565 | Use to increase osmolality of dPBS and culture medium. Calculate correct amount needed to reach an osmolality of 290 mOsm. |
| D-glucose | Sigma (Merck, Damstadt, Germany) | G5400 | 4.5 mM D-glucose equals 405 mg per 500 ml culture medium. |
| GlutaMAX Supplement | Gibco (Life Technologies, Paisley, UK) | 35050-061 | Alternative to L-glutamine, with increased stability. 2 mM Glutamax equals 5 ml of 100X stock in 500 ml culture medium. |
| Penicillin-Streptomycin | Sigma (Merck, Damstadt, Germany) | P0781 | Stock solution 10,000 units penicillin and 10 mg streptomycin per mL. Use 2.5 ml of stock solution in 500 ml L-15 medium (equivalent of 50 U/ml Penicillin and 50 µg/ml Streptomycin). |
| Trypsin type II-S | Sigma (Merck, Damstadt, Germany) | T7409 | Prepare 1 mg/ml in dPBS solution. |
| Trypsin inhibitor type I-S | Sigma (Merck, Damstadt, Germany) | T6522 | Prepare 1 mg/ml in dPBS solution, supplement with 2 µg/ml Dnase I (see details below). |
| Dnase I | Sigma (Merck, Damstadt, Germany) | D5025 | Use in trypsin inhibitor solution (see above). |
| 0.2 µm Polyethersulfone (PES) sterile filter system | Corning Inc. (Corning, NY) | 431097 | Use for sterile filtration of dPBS and L-15 medium after adjustments. |
| 35 mm cell culture dish with glass bottom, poly d-lysine coated | MatTek Corporation (Ashland, MA) | P35GC-1.5-10-C | Can also be replaced by plastic dish, depending on downstream application. |
| Dumont #5 fine forceps | Fine Science Tools (CA) | 11254-20 | Straigt tip |
| Dumont #5/45 fine forceps | Fine Science Tools (CA) | 11253-25 | Angled 45° tip |
| Stereo microscope SZ61 | Olympus Corp. (Tokyo, Japan) | Use for dissection of pituitaries. | |
| Alegra X-22R Centrufuge | Beckman Coulter Inc. (Brea, CA) | With cooling option (similar to current model XR-30). | |
| Water bath | Techne (Staffordshire, UK) | Any water bath with the possibility of adjusting temperature will do. | |
| Pasteur glass pipettes | VWR (NY) | 612-1701 | Outer diameter 1.6 mm, fire polish and autoclave before use. |
| Galaxy MiniStar table centrifuge | VWR (NY) | 521-2844 | Any small table centrigue will do. |
| Fine needles / insect pins | Fine Science Tools (CA) | 26001-40 | Diameter 0.03 mm. Other fine needles can be used instead. |
| Wax plate | Custom made by adding melted paraffin wax in large petri dish. |
Ссылки
- Freshney, R. I. . Culture of Animal Cells: A Manual of Basic Technique and Specialized Applications. , (2010).
- Ribeiro, L. P., Ahne, W. Fish cell culture: initiation of a line of pituitary cells from carp (Cyprinus carpio) to study the release of gonadotropin in vitro. In Vitro. 18 (5), 419-420 (1982).
- Ribeiro, L., Ahne, W., Lichtenberg, V. Primary culture of normal pituitary cells of carp (Cyprinus carpio) for the study of gonadotropin release. In Vitro. 19 (1), 41-45 (1983).
- Wong, A. O., Ng, S., Lee, E. K., Leung, R. C., Ho, W. K. Somatostatin inhibits (d-Arg6, Pro9-NEt) salmon gonadotropin-releasing hormone- and dopamine D1-stimulated growth hormone release from perifused pituitary cells of chinese grass carp, Ctenopharyngodon idellus. General and Comparative Endocrinology. 110 (1), 29-45 (1998).
- Chang, J. P., et al. Use of a pituitary cell dispersion method and primary culture system for the studies of gonadotropin-releasing hormone action in the goldfish, Carassius auratus. I. Initial morphological, static, and cell column perifusion studies. General and Comparative Endocrinology. 77 (2), 256-273 (1990).
- Weil, C., Hansen, P., Hyam, D. Use of pituitary cells in primary culture to study the secretion in rainbow-trout - Setting up and validating the system as assessed by its responsiveness to mammalian and salmon gonadotropin-releasing hormone. General and Comparative Endocrinology. 62 (2), 202-209 (1986).
- Montero, M., LeBelle, N., Vidal, B., Dufour, S. Primary cultures of dispersed pituitary cells from estradiol-pretreated female silver eels (Anguilla anguilla L): Immunocytochemical characterization of gonadotropic cells and stimulation of gonadotropin release. General and Comparative Endocrinology. 104 (1), 103-115 (1996).
- Xu, S. H., Cooke, I. M. Voltage-gated currents of tilapia prolactin cells. General and Comparative Endocrinology. 150 (2), 219-232 (2007).
- Lin, S. W., Ge, W. Differential regulation of gonadotropins (FSH and LH) and growth hormone (GH) by neuroendocrine, endocrine, and paracrine factors in the zebrafish-An in vitro approach. General and Comparative Endocrinology. 160 (2), 183-193 (2009).
- Hodne, K., von Krogh, K., Weltzien, F. A., Sand, O., Haug, T. M. Optimized conditions for primary culture of pituitary cells from the Atlantic cod (Gadus morhua). The importance of osmolality, pCO2, and pH. General and Comparative Endocrinology. 178 (2), 206-215 (2012).
- Wittbrodt, J., Shima, A., Schartl, M. Medaka - a model organism from the far East. Nature Reviews Genetics. 3, 53-64 (2002).
- Matsuda, M., et al. DMY is a Y-specific DM-domain gene required for male development in the medaka fish. Nature. 417 (6888), 559-563 (2002).
- Kasahara, M., et al. The medaka draft genome and insights into vertebrate genome evolution. Nature. 447 (7145), 714-719 (2007).
- Miyanishi, H., Inokuchi, M., Nobata, S., Kaneko, T. Past seawater experience enhances seawater adaptability in medaka, Oryzias latipes. Zoological Letters. 2 (12), (2016).
- Waymouth, C. Osmolality of mammalian blood and of media for culture of mammalian cells. In Vitro. 6 (2), 109-127 (1970).
- Cameron, J. N. Acid-base homeostasis - past and present perspectives. Physiological Zoology. 62 (4), 845-865 (1989).
- Claiborne, J. B., Edwards, S. L., Morrison-Shetlar, A. I. Acid-base regulation in fishes: cellular and molecular mechanisms. Journal of Experimental Zoology. 293 (3), 302-319 (2002).
- Perry, S. F., Tufts, B. L. . Fish respiration. , (1998).
- Hildahl, J., et al. Developmental tracing of luteinizing hormone β-subunit gene expression using green fluorescent protein transgenic medaka (Oryzias latipes) reveals a putative novel developmental function. Developmental Dynamics. 241 (11), 1665-1677 (2012).
- Strandabø, R. A. U., et al. Signal transduction involved in GnRH2-stimulation of identified LH-producing gonadotropes from lhb-GFP transgenic medaka (Oryzias latipes). Molecular and Cellular Endocrinology. 372 (1-2), 128-139 (2013).
- Verbalis, J. G. Brain volume regulation in response to changes in osmolality. Neuroscience. 168 (4), 862-870 (2010).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены