Method Article
הכנה של תרבות התא העיקרי באיכות גבוהה של דגים Pituitaries
In This Article
Summary
כאן נתאר פרוטוקול להכין ולשמור על תרביות תאים יותרת המוח הראשי של medaka (Oryzias latipes). תנאי ממוטבת פרוטוקול זה להתחשב פרמטרים חשובים כגון טמפרטורה, osmolality ו- pH מאת לחקות את התנאים הפיזיולוגיים של הדג, ובעקבותיו פיזיולוגית משמעותי יותר תוצאות.
Abstract
התרבות התא העיקרי הוא כלי רב עוצמה בשימוש נפוץ על ידי מדענים לחקור מנגנונים של תאים מבודדים בסביבה מבוקרת ולמאפיינים הסלולר. למרות השוני העצום פיזיולוגי בין יונקים ודגים, התא הראשי תרבות פרוטוקולים דגים מבוססים לעתים קרובות על תנאים בתרבית של תרבות, לעיתים קרובות עם שינויים מזעריים בלבד. ההבדלים סביבתיים משפיעים על טמפרטורת הגוף אלא גם נסיוב הדם פרמטרים כגון osmolality, ה-pH pH מאגר קיבולת. תא תרבות המדיה ופתרונות עבודה דומה נועדו לחקות את מאפייני נוזל חוץ-תאי ו/או בסרום הדם אשר תא הוא מותאם, זה חיוני כי פרמטרים אלו מותאמות במיוחד כדי בבעל.
בפרוטוקול הנוכחי מתאר תנאים אופטימליים תרבות ראשי medaka (Oryzias latipes). הפרוטוקול מספק שלבים מפורטים כיצד לבודד ולתחזק בריא הפומבית תאים יותרת המוח במשך יותר משבוע, כולל את השלבים הבאים: 1. התאמת osmolality על הערכים שנמצאו פלזמה דם medaka, 2. התאמת בטמפרטורת דגירה לטמפרטורת medaka רגיל (כאן במתקן aquarium), ו-3. ההתאמה של מאגר ה-pH של ביקרבונט לערכים להשוות מינים אחרים של דגים חיים בטמפרטורה דומה. התוצאות שהוצגו באמצעות פרוטוקול המתואר לקדם תוצאות משמעותיות מבחינה פיזיולוגית medaka, יכול לשמש כמדריך הפניה על ידי מדענים ביצוע תרביות תאים ראשי ממינים אחרים שאינם מידע יונקים.
Introduction
תרבית תאים הוא אחד הכלים המרכזיים המשמשים למחקר ביולוגי מולקולרי, מספקת מערכת דגם מעולה עונה על שאלות ביולוגיות שונות ועד פיסיולוגיה תאית נורמלי סמים ההקרנה, carcinogenesis1. ראשי תאים, מבודד ישירות מן הרקמה החיה בשיטות אנזימטי ו/או מכני, לעיתים קרובות נחשבים יותר ביולוגית רלוונטית יותר שורות תאים כמו התגובה הביולוגי עשוי להיות קרוב יותר למצב ויוו . צריך להיות מוטבת פרוטוקולים עבור הכנת תרביות תאים הראשי עבור כל סוג מינים ותא של הריבית על מנת לחקות את המאפיינים אשר תא הוא מותאם, להשיג תוצאות משמעותיות מבחינה פיזיולוגית.
פרוטוקולים רבים מתארים תרבות התנאים עבור מערכות בתרבית של תאים, בעוד פרוטוקולים דומה המתארים התרבות העיקרית תנאים תאי דגים נדירים למדי בהשוואה. התאים הם פגיעים השינויים המהירים טמפרטורה, pH ו osmolality ולאחר חלשים במיוחד במהלך ההליך דיסוציאציה. פתרונות מלח מסחרי ומדיה תרבות המשמש בתרבית של תאים מהונדסים אינן מיטביות עבור דג teleost, במיוחד מבחינת מערכות מאגר pH osmolality. חשוב, לכן למדוד ולהתאים את הפתרונות לרמות רלוונטי מבחינה פיזיולוגית של פרמטרים אלה בהמינים של ריבית.
תרבויות יותרת המוח הראשי נעשו מתוך מספר teleost מיני דגים קרפיון מצוי (קרפיון carpio)2,3, דשא קרפיון (לאדלה Ctenopharyngodon)4, דג זהב (קרסיוס לדייק )5, פורל הקשת (Oncorhynchus mykiss)6, צלופח האירופית (אנגווילה אנגווילה)7, אמנון (Oreochromis mossambicus)8, דג זברה (רזבורה rerio)9, ו בקלה האוקיינוס האטלנטי (Gadus morhua)10. מלבד התאמת הטמפרטורה הדגירה המינים עניין, מספר פרוטוקולים אלה יש מודגרות התאים-מידע יונקים דמויי תנאים שעשויים להיות שיוצרת עבור המינים של עניין, עם pH מ- 7.2 7.5 באווירה humidified המכילה 3-5% CO2. בנוסף, זה לא ברור אם osmolality של פתרונות משתמשים להכנת מספר תרבויות התא הראשי אלה הותאמו ויציב בין פתרונות שונים.
בפרוטוקול הנוכחי מבוסס על העבודות הקודמות עם ראשי תרבויות בקלה האוקיינוס האטלנטי10 , ומורכב התאמות בטמפרטורת דגירה, osmolality, ה-pH pH מאגר מערכות, כולל את לחץ חלקי של פחמן דו חמצני (pCO2), כדי הפיזיולוגיה של medaka (O. latipes). Medaka הוא קטן (3-4 ס מ) דג של מים מתוקים, ילידי מזרח אסיה. בימים אלה, הוא משמש כמין מודל במעבדות מחקר רבים ברחבי העולם, כפי שהוא קל יחסית להתרבות, עמידים מאוד בפני רבים נפוצים דגים מחלות11. ישנם מספר יתרונות השימוש medaka כמודל, כולל עמידות בטמפרטורה של 4 – 40 ° C11, זמן דור קצר, העוברים שקוף, עם קביעת מין ג'ין12, קובצי רצף הגנום של13, וכן רבים אחרים זמינות משאבים גנטי.
תנאי התרבות העיקרי פרוטוקול זה המותאמים בצורה מיטבית כדי להתאים את הטמפרטורה של 26 ° C זה medakas נשמרים במתקן דגים. עוד יותר, osmolality מצומצמת מ- 320 mOsm/kg של בקלה האוקיינוס האטלנטי חי במים מלוחים עד 290 mOsm/kg במשך medaka לחיות במים מתוקים והוא בהתאם osmolality נורמלי של פלזמה medaka14. לשם השוואה, osmolality טיפוסי של פלסמה יונקים הוא בטווח של 275 – 295 mOsm15. הדג במגוון רחב של טמפרטורות ויש הזימים הנמצאים במגע ישיר עם המים, לעשות את יכולת ה-pH ומאגר של הדם, נוזל חוץ-תאי דגים שונים מאלה ביונקים. בתרבית של תרבות התקשורת כוללים בדרך כלל מערכות מאגר שתוצאתה pH של בסביבות 7.4 כאשר התקשורת הם equilibrated לאווירת רגיל של 5% CO2 באוויר humidified ב 37 º C. ה-pH הוא הטמפרטורה תלוי הערך עבור ה-pH נייטרלי (במים) עולה עם הטמפרטורה יורדת16. טיפוסי דגים teleost פלזמה pH נע בין 7.7 7.917. אופטימיזציה של פרוטוקול זה כללה ירידה מ- pH 7.85 בקלה שמרו ב 12 ° C ל pH 7.75 medaka המשיך בטמפרטורה 26 ° C על ידי הגדלת CO2 מ- 0.5% ל 1%.
בנוסף, היכולת מאגר ביקרבונט שונה לגמרי של דגים, יונקים. CO2 בקלות חילופי מעל הגג בדגים, ה pCO2 במים רק חלק קטן של pCO2 ב- ריאות18. שינוי הטמפרטורה או ה pCO2 תשנה את ה-pH ואת מאגר של המדיום. כתוצאה מכך, ה-pH וגם ה pCO2 מומלצת המקננת בתרבית של תאים הוא אופטימלי תאי דגים, לכן, התקשורת התרבות ניתן למטב במערכות מאגר המכיל ערכים רלוונטיים מבחינה פיזיולוגית דגים ו מינים מסוימים של עניין. פרוטוקול זה מתאר כיצד להכין התא הראשי של medaka pituitaries תרבויות, כוללים התאמות של דגירה טמפרטורה, osmolality, pH ו- pH מאגר מערכת, בנוסף אחרים פרמטרים חשובים שיש לקחת בחשבון בעת הכנת התא הראשי תרבויות ממינים מידע שאינם יונקים.
Protocol
הניסויים בבעלי חיים שבוצעה במחקר זה אושרו על-ידי אוניברסיטת הנורבגית מדעי החיים, הקווים המנחים הבאים טיפול ולרווחתם של בעלי חיים למחקר.
1. הכנת פתרונות
- כיילו את המכשירים מד osmometer ו- pH לפי הוראות היצרן כדי לוודא המידות הנכונות.
-
הכנת 500 מ"ל של Ca2 +- ומ ג2 +-חינם באגירה פוספט תמיסת מלח של Dulbecco (dPBS), התאמת רמת ה-pH ל 7.75 (שלב 1.2.1), את osmolality כדי 290 mOsm/kg (שלב 1.2.2) לפני סינון סטרילי (שלב 1.2.3).
- להתאים את ה-pH ל 7.75 עם מד pH מכוילת על-ידי הוספת בקפידה טיפות NaOH 1 M פתרון תוך בקפידה תוך ערבוב את הפתרון.
- למדוד את osmolality של הפתרון באמצעות osmometer מכויל ולחשב את הכמות של מניטול הדרושים כדי להגדיל את osmolality כדי mOsm 290/ק"ג. להוסיף את הכמות הנדרשת של מניטול, ואז למדוד את osmolality של הפתרון שוב על מנת לוודא את ההתאמה הנכונה.
הערה: הסכום של מניטול הדרוש תלוי osmolality נמדד, אשר בדרך כלל משתנה בין קבוצות שונות. מולקולה אחת של מניטול שווה 1 חלקיק osmotic. - סטרילי-מסנן הפתרון dPBS באמצעות מסנן 0.2 µm.
הערה: הפתרון ניתן לאחסן ב 4 מעלות צלזיוס במשך לפחות 3 חודשים.
- הכנת 500 מ"ל של ליבוביץ (L-15) בינוני תרבות ללא-גלוטמין, ביקרבונט, תוספת זה עם 10 מ מ NaHCO3 (שלב 1.3.1), גלוקוז 4.5 מ מ (שלב 1.3.2) ו 2 מ מ גלוטמין זמין מסחרית (שלב 1.3.3). להתאים את הפתרון mOsm 290/ק"ג (שלב 1.3.4), מסנן סטרילי זה (שלב 1.3.5), ולהוסיף 2.5 מ של פתרון פניצילין-סטרפטומיצין (שלב 1.3.6).
הערה: הפתרון ניתן לאחסן ב 4 מעלות צלזיוס לפחות 4 שבועות.- הוסף 420 מ ג של NaHCO3 לכל 500 מ"ל של תרבות מדיום כדי להשיג פתרון 10 מ מ.
- הוסף 405 מ"ג גלוקוז לכל 500 מ"ל של תרבות מדיום כדי להשיג פתרון 4.5 מ מ.
- הוסף 5 מ של 100 x מלאי של פתרון גלוטמין 500 מ"ל של תרבות מדיום כדי להשיג פתרון 2 מ מ. מערבבים עד מומסים בגבול כל הם התפרקה.
- להתאים את הפתרון mOsm 290/kg עם מניטול באמצעות של osmometer (כפי שבוצעה בשלב 1.2.2).
- ביצוע של סינון סטרילי של המדיום L-15 באמצעות מסנן 0.2 µm.
- לאחר סינון סטרילי, להוסיף 2.5 מ של פתרון פניצילין-סטרפטומיצין, המתאים U/mL 50 של פניצילין, µg 50/mL של סטרפטומיצין.
- להכין 50 מ של הפתרון טריפסין באמצעות 1 מ"ג/מ"ל של טריפסין (0.1%) סוג ש-II-S מומס dPBS שונה (להכין בשלב 1.2). להפוך aliquots של 2 mL צינורות פלסטיק סטרילית ואחסן אותם ב-20 ° C עד השימוש.
הערה: Aliquots של 2 מ ל ניתן לאחסן ב-20 מעלות צלזיוס במשך לפחות 3 חודשים. - הכנת 50 מ של מעכבי טריפסין הפתרון באמצעות 1 מ"ג/מ"ל של (0.1%) טריפסין מעכב סוג אני-S, משלימים את זה עם 2 µg/mL של DNase אני מומס dPBS שונה (להכין בשלב 1.2). להפוך aliquots של 2 mL צינורות פלסטיק סטרילית ואחסן אותם ב-20 ° C עד השימוש.
הערה: Aliquots של 2 מ ל ניתן לאחסן ב-20 מעלות צלזיוס במשך לפחות 3 חודשים.
2. הכנת ציוד
- הכן פיפטות זכוכית על ידי אש ליטוש הטיפ על דיסוציאציה התא. לגרום לתיאורי עם 2 קטגוריות גודל שונה (פתיחה בינונית של 0.6-0.8 מיקרומטר, פתח קטן של 0.4-0.6 מיקרומטר) על ידי משחק עם הזמן, המרחק בין הלהבה בזמן בו זמנית מפנה את פיפטה. למקם את פיפטות זכוכית מיכל הזכוכית נקי, החיטוי אותם (באמצעות מצב מוצק ב 105 מעלות צלזיוס למשך 45 דקות).
- הכנת קופסה פוליסטירן עם קרח.
- הכן צינור פלסטיק עם 1.5 מיליליטר ששונה dPBS (להכין בשלב 1.2) להעביר את pituitaries כדי בזמן ולשמור אותו בקרח.
- הכן צינור 15 מ"ל עם 10 מ"ל של dPBS שונה (להכין בשלב 1.2) ולשמור אותו בקרח עד דיסוציאציה התא.
- להכין טרי או להפשיר aliquots של טריפסין ופתרונות מעכבי טריפסין (להכין בשלבים 1.4 ו- 1.5) ולשמור אותם על קרח עד השימוש.
- הגדר את המים הרותחים 26 ° C לפני שמתחילים את הקרע כדי לאפשר להם להגיע לטמפרטורה הרצויה לפני הדיסוציאציה הכימית של pituitaries.
- נקה כל כלי חיתוך עם אתנול 70% לפני, במהלך, ואחרי שימוש, כולל מלקחיים בסדר לשימוש את הקרע ומחטים צלחת שעווה בסדר להפיל. את הדג. שימוש בכפפות נקי (לשנות ולנקות בתדירות גבוהה) במהלך ההליך כולו כדי למנוע זיהום פוטנציאליים של התאים.
3. יותרת המוח לנתיחה, דיסוציאציה תא
- המתת חסד את הדג על ידי אנו ממליצים אותה ice הרפש (0 ° C). השאירו את הדגים הרפש קרח לפחות 1 דקות להבטיח מכת חום בלתי הפיך.
הערה: הנייח ואיבוד שיווי משקל יתרחש לאחר מספר שניות. ודא הדג לגמרי שקוע במים קרח לא משקר על הקרח, האחרון יוביל מחנק, נשרף פוטנציאליים במקום הלם חום מהירה והומאני. - להעביר את הדג ברשת צלחת שעווה תחת המיקרוסקופ לנתיחה ובמהירות להשמיד את עמוד השדרה על ידי אגרוף המחט דרך הצוואר.
- להצמיד את ראש הדג לצלחת השעווה באמצעות מחטים בסדר, על ידי החדרת מחט אחת מקדימה (מעל הפה), אחד בכל צד של הראש (מאחורי המוח) כדי לייצב את הראש לפני הקרע.
- הצג את הדג תחת המיקרוסקופ לנתיחה, לגרד בעדינות את המאזניים בחלק העליון של הראש באמצעות מלקחיים בסדר עם קצה זוויתי.
- בזהירות בקצה בזווית של המלקחיים בסדר מתחת לעור מהצד של הראש האצוהו גג הגולגולת על ידי נעים באיטיות המלקחיים בכיוון של הפה, תוך החזקת אחיזה חזקה כדי המלקחיים תוחמת את הגג הגולגולת.
- לחתוך חוט השדרה לחלוטין באמצעות מלקחיים עם קצה זוויתי.
הערה: הזמן הוא גורם חשוב, ולכן לעבוד ביעילות ובילה במדויק כדי להגביל את משך הזמן של ניתוח pituitaries עד התאים הם מצופים בצלחת. לאחר אימון, ניתוח יותרת המוח צריך לקחת בסביבות 2-3 דקות לכל הדגים, אשר רק סביב 10 s יש צורך לבחור את בלוטת יותרת המוח כאשר המוח כבר נחשף. - בזהירות להתהפך המוח לכיוון הפה כדי לחשוף את בלוטת יותרת המוח, לנתח את זה. עם מלקחיים נקי עם טיפ ישר. בלוטת יותרת המוח להעביר צינור פלסטיק המכיל 1.5 mL שונה dPBS (לפרטים, ראה שלב 2.3) מניחים על קרח. בדוק את קצה המלקחיים מתחת למיקרוסקופ כדי להבטיח בלוטת יותרת המוח מתווסף בהצלחה הצינורית נשאר כלום ב המלקחיים.
הערה: לנתח כמה שיותר pituitaries לפי הצורך, בהתאם למספר מנות תרבות ואנחנו רוצים להיות מוכנים בו זמנית. כלל אצבע, לחשב לפחות 10 pituitaries דגים בוגרים לכל מאכל יש צפיפות המתאים של תאים (אשר תלוי ביישום במורד הזרם). - ספין למטה pituitaries ומפרידה שולחן עבור 1 – 2 s בטמפרטורת החדר. בזהירות להסיר את dPBS באמצעות פיפטה של זכוכית, לטפל כדי למנוע הסרת כל pituitaries.
- להוסיף 1 מ"ל של הפתרון טריפסין (להכין בשלב 1.4) לשטוף את pituitaries, לסובב אותם למטה ומפרידה שולחן עבור s 1 – 2, ולהסיר רוב הנוזל באמצעות פיפטה מזכוכית לפני הוספת נוספים של 1 מ"ל של טריפסין פתרון.
- דגירה הצינור באמבט מים בטמפרטורה 26 ° C למשך 30 דקות, רצוי עם טלטולים עדינים, או לחלופין, קפיצי ברכבת התחתית מספר פעמים במהלך תקופת הדגירה.
- ספין למטה pituitaries ומפרידה שולחן עבור 1 – 2 s בטמפרטורת החדר וודא כי כל pituitaries ממוקמים בחלק התחתון של הצינור. להסיר את מרבית הפתרון טריפסין עם פיפטה מזכוכית ולהוסיף 1 מ"ל של הפתרון מעכבי טריפסין (להכין בשלב 1.5) כדי להשבית את טריפסין. ולשטוף את pituitaries.
- לאסוף את pituitaries בחלק התחתון של הצינור על ידי מסובב אותם למטה ומפרידה שולחן עבור 1 – 2 s בטמפרטורת החדר. להסיר את רוב הנוזל עם פיפטה מזכוכית ולהוסיף 1 מ"ל של הפתרון מעכבי טריפסין (להכין בשלב 1.5). למקם את הצינור באמבט מים בטמפרטורה 26 ° C למשך 20 דקות, רצוי עם טלטולים עדינים, או לחלופין, קפיצי ברכבת התחתית מספר פעמים במהלך תקופת הדגירה כדי להשבית את טריפסין.
- להכין תבשיל תרבות תא פולי-d-ליזין-מצופה 35 מ מ עם חלק תחתון זכוכית המרכזי על ידי הוספת 2 מ"ל של מדיום L-15 ולתת את תקופת דגירה של פחות 10 דקות בטמפרטורה 26 ° C, ב- 1% CO2 , כך שזה יכול להגיע נכון טמפרטורה, pH לפני ציפוי התאים.
הערה: לצלחת תרבות תא פלסטיק יכול גם לשמש. היתרון העיקרי של שימוש צלחת עם חלק תחתון זכוכית מרכזי הוא כי האזור שבו התאים הם מצופה הוא קטן יותר, לכן, פחות תאים יותרת המוח נדרשים לכל תבשיל. במורד יישומים מסוימים עשויים לדרוש גם חלק תחתון זכוכית (כלומר, כמה טכניקות הדמיה). - הגדר לצנטריפוגה קירור עד שהשפופרות 15 מ"ל 4 ° C כדי לאפשר לו להגיע לטמפרטורה הרצויה לפני שמתחילים את הדיסוציאציה מכני.
- לאסוף pituitaries בחלק התחתון של הצינור על ידי ספינינג למטה ברכבת התחתית עם הפתרון מעכבי טריפסין (מתוך שלב 3.11) ומפרידה שולחן עבור 1 – 2 s בטמפרטורת החדר וודא כי כל pituitaries ממוקמים בתחתית השפופרת לפני בזהירות הסרת מרבית הפתרון מעכבי טריפסין באמצעות פיפטה של זכוכית.
הערה: בצע את כל השלבים הבאים של פרוטוקול ספסל זרימה שכבתית (נולדנו) מוסמך לעבודה תא למנוע זיהום של התאים. - להוסיף 1 מ"ל של קרח dPBS שונה (להכין בשלב 2.4) החלקים רקמת יותרת המוח ותשאבו בעדינות את חתיכות רקמה למעלה ולמטה (x 6 – 7) פיפטה מזכוכית מלוטשת-אש (להכין בשלב 2.1).
הערה: הטמפרטורה היא היבט חיוני, אז תמשיך כל הפתרונות ב 4 º C. מנקודה זו ואילך, לבצע את כל השלבים על קרח במידת האפשר. - ספין למטה חתיכות רקמה ומפרידה שולחן עבור 1 – 2 s בטמפרטורת החדר ולהעביר בזהירות את החלק העליון של dPBS המכילות את התאים dissociated (כמעט 1 מ"ל) צינור 15 מ"ל על קרח. להימנע מלעבור על פיפטה בחלק התחתון של הצינור שבו נותרו חתיכות רקמה.
- חזור על שלב 3.16 – 3.17, בריא תאי 1 מ"ל של dPBS קר כקרח בכל פעם, עד נעשה שימוש כל 10 מ"ל של dPBS. להתחיל להשתמש על פיפטה מזכוכית עם פתיחת בגודל בינוני, לעבור פיפטה מזכוכית עם חור קטן יותר לקראת הסוף (עבור mL 3-4 האחרון של dPBS הוסיף) הדיסוציאציה. אם יש עדיין גלויים חתיכות רקמה לקראת סוף התהליך דיסוציאציה, להגדיל את pipetting ל- x כ 10 לכיוון המדרגות אתמול 2 של dPBS על דיסוציאציה, בסופו של דבר להשאיר את חתיכות רקמה שיורית. Resuspend התאים בעדינות, הימנע מיצירת בועות, שכן היא עלולה לגרום נזק לתאים, כאשר התאים לצרף פני השטח של הבועות.
הערה: זהו שלב קריטי של פרוטוקול זה והוא דורש הכשרה כדי להשיג תוצאה טובה. - לאזן את הצינור צנטריפוגה (טרום מקורר עד 4 ° C) ו ספין למטה התאים ב x 200 גר' 10 דקות ב 4 º C. הקפד לסמן את הצד של הצינור שבו יהיה בגדר התא.
- בזהירות להסיר את הצינור לצנטריפוגה ולהעביר בעדינות את תגובת שיקוע עם פיפטה מזכוכית שפופרת פלסטיק ריק 15 מ"ל ישירות לאחר צנטריפוגה. הקפד להסיר את מרבית תגובת שיקוע אבל לטפל כדי למנוע איבוד בגדר תא (לעתים קרובות בלתי נראה) קטן.
- בזהירות resuspend בגדר תא ב- 50 – 100 µL L-15 תרבות בינוני.
הערה: בשלב זה, זה ניתן לספור את התאים ו/או לבצע בדיקת הכדאיות (כגון תא ספירת בנוכחות trypan blue באמצעות של hemocytometer), אבל צריך להיזהר כי באמצעות חלק התליה תא למטרה זו תפחית את התשואה. הימנעו משימוש אמצעי אחסון גדול התלוי יגדיל את הסיכון של תאים לשדר מחוץ למרכז של המנה. - לטפטף בזהירות את התאים dissociated באמצע המנה התרבות התא המכיל 2 מ"ל של המדיום L-15 (להכין בשלב 3.13). לאפשר את התאים לשקוע לתחתית של המנה כ 5 דקות לפני העברתם החממה, כדי להימנע מהצורך התאים התפשט אל מחוץ החלק השקוע של הזכוכית.
- דגירה המנה-26 ° C ו- 1% CO2 כדי לאפשר כל התאים לשקוע ביסודיות ולצרף לתחתית של המנה.
- לאחר 30 דקות, תראה התאים במיקרוסקופ כדי לוודא שהם צירפו לצלחת תרבות.
- להמשיך דגירה התאים-CO 26 ° C ו- 1%2.
- בקפידה לשנות רוב (אך לא כולם) של המדיום כל 3-4 ימים.
הערה: הימנע שינוי המדיום בתדירות גבוהה יותר, כמו זה עשוי להפריע את התאים ולגרום להם לנתק מהתחתית זכוכית. השתמש התאים עבור ניסויים תוך שבוע לאחר זריעה אותם.
תוצאות
פרוטוקול זה מתאר את הכנת תרבות התא הראשי של medaka pituitaries ומספק תאים בריאים זה יכול להישמר בתרבות לפחות אחת לשבוע. הפרוטוקול מבוסס על הערכים הרלוונטיים פיזיולוגיים medaka14 , בנוסף ממוטבת כדי רקמת יותרת המוח בדגים הבוגרים, באמצעות pH של 7.75 של osmolality של mOsm 290/ק"ג במהלך ההליך כולו מן מהקצירה רקמות מצופה תאים בתרבות (איור 1 ואיור 2).
נציג תוצאות של ניסויים על תרבויות התא העיקרי המיוצר על ידי פרוטוקול זה מוצגים באיור 3 איור 4, איור 5. לקבלת תוצאות שהוצגו כאן, קו medaka הטרנסגניים, היכן luteinizing הורמון (Lh)-תאים gonadotrope אקספרס של חלבון פלואורסצנטי ירוק (GFP), היה שימוש19. איור 3 מראה שדה נציג בצלחת של תרבות התא הראשי מיום 0 ליום 7 לאחר זריעה, כולל גם תמונות מיקרוסקופיית שדה בהיר, פלורסנט, מציג את התאים לבטא-GFP Lh-gonadotrope. שימוש pituitaries medaka למבוגרים סביב 10 לכל מאכל בדרך כלל תוצאות צפיפות של 5 x 104 – עונה 1 פרק 105 תאים לכל מאכל לאחר זריעה. הכדאיות של התאים יותרת המוח בתרבות מחושב בהתבסס על המספר הכולל של תאים GFP-ביטוי בתרבות ביום 1, 3 ו- 7 לאחר ציפוי, לעומת יום 0 (איור 4). הגרף המוצג באיור 4 מציין מספר התאים גוסס הוא כמעט קבוע לאורך זמן, עם יותר מ- 95% של התאים בחיים לאחר יום 1, בעוד למעלה מ-90% הוא עדיין בחיים לאחר 3 ימים. למרות שיש ירידה קטנה הכדאיות תא עם הזמן, רוב התאים (בסביבות 75%) הם עדיין בחיים אחרי שבוע בתרבות. הקלטות אלקטרופיזיולוגיות של תאים לבטא-GFP Lh-gonadotrope (שבוצעה כמתואר ב- Strandabø, et al.) 20 מראים כי התאים נוכל לירות פוטנציאל פעולה באופן ספונטני לאחר 4 ימים בתרבות (איור 5A). עוד יותר, על גירוי של ההורמון releasing – גונדוטרופין, hyperpolarization ארעי הראשונית של קרום התא ואחריו עלייה דרמטית ירי תדר זה בו-זמני עם דפולריזציה, משך מוגברת של הפעולה פוטנציאל (איור 5B).
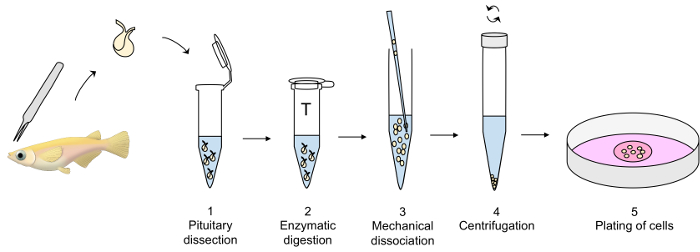
איור 1: סקירה של הטכניקה התרבות התא הראשי יותרת המוח- Pituitaries ביתר עם מלקחיים בסדר והועברו צינור פלסטיק המכיל dPBS שונה על קרח (שלב 1 של הפרוטוקול) עד עיכול אנזימטי pituitaries עם טריפסין בטמפרטורה 26 ° C (שלב 2), ואחריו של איון עם מעכב טריפסין בטמפרטורה 26 ° C (לא מוצג). הדיסוציאציה מכני של pituitaries enzymatically מתעכל עם פיפטה מזכוכית מתבצעת בזהירות dPBS על הקרח (שלב 3), ואחריו צנטריפוגה ב 4 ° C (שלב 4). לבסוף, הוא בגדר תא מומס תרבות בינוני והתאים מצופה החוצה בקערה התרבות התא (שלב 5). אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.

איור 2: פרטים על הקרע יותרת המוח medaka. (א) ראש קיבוע medaka (תצוגת הגבי) מוצמדת צלחת שעווה, ואת החלק העליון של הגג הגולגולת מוסר עם מלקחיים בסדר לחשוף את החלק העליון של המוח. (B) חוט השדרה היא ניתקה, המוח התהפכה לכיוון החלק הקדמי של הראש כך בלוטת יותרת המוח חשוף. (ג) בלוטת יותרת המוח נאסף עם מלקחיים נקי, בסדר. ראש חץ מצביע על בלוטת יותרת המוח בחלונית B ו- C. סרגל קנה מידה = 1,000 מיקרומטר. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.

איור 3: התרבות התא הראשי יותרת המוח Medaka. לוחות אלה להציג תמונות וידאו ברזולוציה גבוהה של תרבות התא הראשי יותרת המוח medaka נציג יום 0 יום 3, יום 7 לאחר זריעה. הפאנל העליון מציג תמונות מיקרוסקופיית שדה בהיר של שדה נציג בצלחת, הלוח האמצעי מציג תמונות מיקרוסקופ פלואורסצנטי של אותו שדה הראייה הצגת תאים לבטא-GFP Lh-gonadotrope, החלונית התחתונה היא כיסוי של השניים. סרגל קנה מידה = 20 מיקרומטר. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
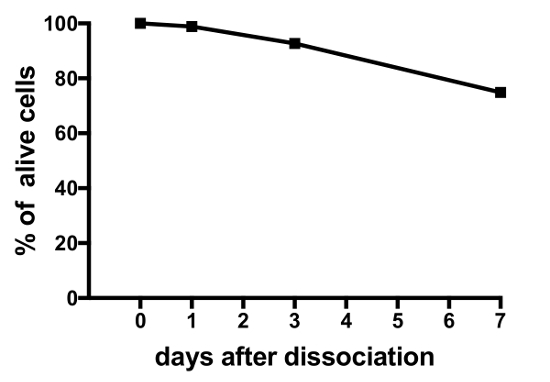
איור 4: יכולת הקיום של יותרת המוח medaka תאים בתרבות. איור זה מציג את הכדאיות של התרבויות התא הראשי יותרת המוח הנמדד ביום 0, 1, 3 ו- 7 לאחר זריעה. המספרים מחושבים באמצעות תוכנת קוד פתוח CellProfiler V2, מבוססים על המספר הכולל של ביטוי-GFP Lh-gonadotrope תאים לכל מאכל בנקודות זמן שונות, לעומת זמן 0. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
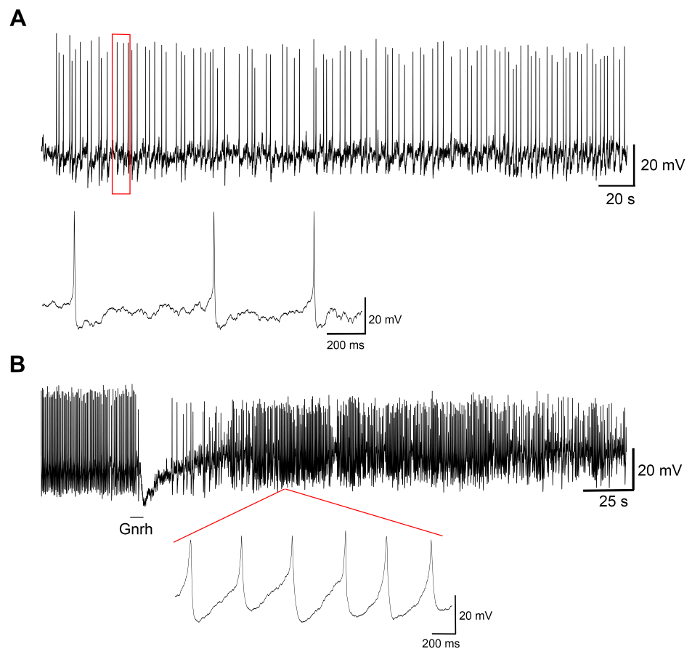
איור 5: הקלטות אלקטרופיזיולוגיות של תאים יותרת המוח- אלה מראות אלקטרופיזיולוגיות הקלטות מתא לבטא-GFP Lh-gonadotrope בתרבות התא העיקרי בנטילת יום 4 לאחר זריעה, מציג (A) עקבות נציג של פוטנציאל פעולה ספונטנית, ואחריו (B) גירוי עם גונדוטרופין – releasing ההורמון Gnrh1 10 s. הגירוי Gnrh1 מעוררת תגובה biphasic עם hyperpolarization של קרום התא, ואחריו דפולריזציה מוגברת משך פוטנציאל הפעולה (נמדד בשיא 50%) מ 8.9 ± ms 3.0 לפני הגירוי עד 29.2 ± ms 9.9 לאחר גירוי. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
Discussion
במבחנה תא תרבות מערכות לספק כלים רבי-עוצמה עבור חוקרים לענות שפע של שאלות ביולוגיות שונות אם המשמשים את הדרך הנכונה1. חשוב לזכור כי התאים הפומבית איבדו את קשריהם עם התאים הסמוכים יתכן שהשגתם מאפיינים פונקציונליים שונים ממה שהיה להם במקור בתוך vivo. כדי להימנע להיות בסיכון של מפרש את התוצאות שהתקבלו ניסויים במבחנה , חשוב לשקול התאמת ההליך התרבות התא העיקרי בסוג מינים ותא עניין. התאמות אפילו מתונה של נהלים סטנדרטיים תרבות ופתרונות משמש לעתים קרובות מספיק עמוקות לשנות את תנאי התרבות של סוג תא מסוים.
פרוטוקול זה מתאר תנאים מיטביים להכנה של שמירה על התא העיקרי של מבוגרים medaka pituitaries, אשר יכולה להיות מושגת על-ידי התאמת פרמטרים כגון טמפרטורה, osmolality, pH ו- pCO2 הפתרונות המשמש, אל תרבויות להתאים את התנאים הפיזיולוגיים של מין זה. ה-pH תלויה בטמפרטורה, צריכה, לכן, גם להיות מותאם בין מינים שונים של דגים teleost תיה טמפרטורות שונות17. Osmolality של כל הפתרונות בשימוש במהלך תא דיסוציאציה culturing צריך גם להיות מותאם על מנת לשפר את מצבם של התאים. במיוחד, אם יש פער osmolality בין פתרונות שונים בשימוש במהלך ההליך בידוד, זה יכול להיות ההשפעות ההרסניות על איכות תרבות, שמוביל הכדאיות ירד (התוצאות םירצוי עצמו לא פורסם). Hyperosmotic פתרונות יגרום את התאים לכווץ (ולהיפך), ובכך מפריעים ועם הקרומיות קרום חלבונים פונקציה21. נקודה חשובה בהקשר זה היא פרמטרים כגון osmolality ו- pH אינם בדרך כלל נמדד ולא יציב בין קבוצות שונות של מאגרי מסחרי ומדיה תרבות בשימוש בתנאים בתרבית של תרבות. ההבדלים osmolality ו- pH בין פתרונות שונים בשימוש במהלך ההליך בידוד להימנע בכל עת.
שיעור ההצלחה של פרוטוקול זה משופרת על ידי הכשרה, אז הוא צפוי החוקרים צריכים קצת זמן להכיר את השלבים השונים של הטכניקה. למשל, הפעם מניתוח pituitaries עד התאים הם מצופים בצלחת הפוך קשורה בריאות. הדיסוציאציה מכני של pituitaries באמצעות פיפטה מזכוכית הוא שלב קריטי במיוחד של הפרוטוקול, והוא דורש קצת אימונים על מנת להשיג תוצאה טובה. ההליך דיסוציאציה יכולה להציג osmotic ועל מכניים תדגישו מזיק לתאים. התוספת של כרכים קטנים של dPBS ששונה בשלבים חוזרות ונשנות על דיסוציאציה מכני מבטיחה הליך דיסוציאציה עדין שבו כבר הפומבית תאים מועברים על צינור חדש ונותרה, בעוד החוקר ממשיכה מביצועם תאים נוספים מן הרקמה של אמצעי אחסון חדש של dPBS.
פרוטוקול זה ממוטבת עבור תאים יותרת המוח medaka למבוגרים. מינים שונים, רקמות או שלבי חיים שונים אפילו החיה בתוך רקמת אותו דורשים אופטימיזציות התנאים תרבות. למשל, תאים המתקבל חיות לא בוגר עלול להיות יותר עדין ולכן רגישים יותר לכיוון אפופטוזיס תא מוות ו, לכן, המחייב התאמת הפרוטוקול, במיוחד לקראת הליך דיסוציאציה עדינה. דיסוציאציה מכאנית בעזרת פיפטה מזכוכית הוא שלב קריטי מאוד של ההליך, כמו דיסוציאציה מכני זהיר מדי יוביל רווח נמוך יותר, ואילו קשה מדי עלול לגרום אפופטוזיס ו/או לתא המוות. אם אנזימים שונים נחשבים על דיסוציאציה, ייתכן צורך להשתמש ריכוז וזמן אנזים עיכול שונות. Medaka pituitaries הם קטנים מאוד, קל יחסית מביצועם באמצעות פרוטוקול המתואר. עם זאת, אופטימיזציות עבור מינים אחרים עשוי לדרוש את השימוש מסנן רשת לאחר דיסוציאציה להסיר את הלכלוך. ההצלחה של פרוטוקול זה תלוי גם במידה רבה על ביצוע הפעולות בתנאים סטריליים כדי להימנע מזיהום התאים.
מספר תאי זרע לכל המנה תלויה מספר pituitaries בהתחלה, כמו גם ההצלחה של הפרוצדורה דיסוציאציה. ישנם בערך כ 15,000 תאים יותרת המוח medaka למבוגרים ללא פגע. עם זאת, תאים אובדים במהלך תהליך דיסוציאציה, זה צריך להיות אחראים בעת חישוב מספר pituitaries לצורך ניסוי. שימוש pituitaries לפחות 10 לכל מאכל בדרך כלל תוצאה של צפיפות של סביב 50,000 – 100,000 תאים לכל תבשיל. בשעה זו צפיפות, צבירת לא בצורה סכום משמעותי כלשהו, אפילו לאחר 7 ימים בתרבות. באופן ניכר, צבירת שנראה צפיפות תלויה, כמו צפופה התאים הם נזרע, יותר הם נראים צבירה. תהליכים מסוימים עשויים לדרוש תרבות צפופה ו, לכן, יש לשקול צפיפות זריעה אופטימלית בהתאם ליישום במורד הזרם. זה נקודה חשובה שיש לקחת בחשבון בעת תכנון מספר pituitaries לשימוש לכל תבשיל.
יישומים במורד הזרם הנפוץ ביותר להשתמש תרבויות התא העיקרי בתוך הימים הראשונים לאחר זריעה. התוצאות שהוצגו כאן, מן הכדאיות תא להקלטות אלקטרופיזיולוגיות, להראות שזה ניתן לקבל תוצאות טובות מתרבויות התא העיקרי שהוכן באמצעות פרוטוקול המתואר במשך עד שבוע לאחר זריעה. למרות זאת, תרבויות עשוי להישמר זמן רב יותר, תאים בריאים עדיין קיימות לאחר מעל שבועיים בתרבות (התוצאות םירצוי עצמו לא פורסם). בתנאים אופטימליים הוצג פרוטוקול זה מקלה על תוצאות משמעותיות מבחינה פיזיולוגית, עשוי להיות מועיל עבור מדענים אחרים הכנת תרביות תאים ראשי מתאי מידע שאינם יונקים.
Disclosures
המחברים יש ריהצהל.
Acknowledgements
הפרויקט מומן על ידי אוניברסיטת הנורבגית מועצת המחקר של נורבגיה, מספר גרנט 243811 ו- 244461 (חקלאות ימית תוכנית) ומדעי החיים. אנו אסירי תודה לורדס טאן Carreon באוניברסיטה נורבגי למדעי החיים לשמירה על המתקן דגים.
Materials
| Name | Company | Catalog Number | Comments |
| Dulbecco’s Phosphate Buffered Saline (dPBS), without calcium chloride and magnesium chloride | Sigma (Merck, Damstadt, Germany) | D8537 | Adjust solution to pH 7.75 with 1M NaOH and 290 mOsm with mannitol. |
| L-15 medium (Leibovitz), witout L-glutamine | Sigma (Merck, Damstadt, Germany) | L5520 | Supplement 500 ml culture medium with 10mM NaHCO3, 4.5 mM glucose, 2 mM Glutamax. Adjust solution to 290 mOsm with mannitol and filter solution through a 0.2 µm PES sterile filter, before adding 2.5 ml Penicillin-Streptomycin solution (see below for details). |
| NaOH | Sigma (Merck, Damstadt, Germany) | S5881 | Add drops of 1M solution to increase pH of dPBS and culture medium to 7.75. |
| NaHCO3 | Sigma (Merck, Damstadt, Germany) | S5761 | 10 mM NaHCO3 equals 420 mg per 500 ml culture medium. |
| D-mannitol | Sigma (Merck, Damstadt, Germany) | 63565 | Use to increase osmolality of dPBS and culture medium. Calculate correct amount needed to reach an osmolality of 290 mOsm. |
| D-glucose | Sigma (Merck, Damstadt, Germany) | G5400 | 4.5 mM D-glucose equals 405 mg per 500 ml culture medium. |
| GlutaMAX Supplement | Gibco (Life Technologies, Paisley, UK) | 35050-061 | Alternative to L-glutamine, with increased stability. 2 mM Glutamax equals 5 ml of 100X stock in 500 ml culture medium. |
| Penicillin-Streptomycin | Sigma (Merck, Damstadt, Germany) | P0781 | Stock solution 10,000 units penicillin and 10 mg streptomycin per mL. Use 2.5 ml of stock solution in 500 ml L-15 medium (equivalent of 50 U/ml Penicillin and 50 µg/ml Streptomycin). |
| Trypsin type II-S | Sigma (Merck, Damstadt, Germany) | T7409 | Prepare 1 mg/ml in dPBS solution. |
| Trypsin inhibitor type I-S | Sigma (Merck, Damstadt, Germany) | T6522 | Prepare 1 mg/ml in dPBS solution, supplement with 2 µg/ml Dnase I (see details below). |
| Dnase I | Sigma (Merck, Damstadt, Germany) | D5025 | Use in trypsin inhibitor solution (see above). |
| 0.2 µm Polyethersulfone (PES) sterile filter system | Corning Inc. (Corning, NY) | 431097 | Use for sterile filtration of dPBS and L-15 medium after adjustments. |
| 35 mm cell culture dish with glass bottom, poly d-lysine coated | MatTek Corporation (Ashland, MA) | P35GC-1.5-10-C | Can also be replaced by plastic dish, depending on downstream application. |
| Dumont #5 fine forceps | Fine Science Tools (CA) | 11254-20 | Straigt tip |
| Dumont #5/45 fine forceps | Fine Science Tools (CA) | 11253-25 | Angled 45° tip |
| Stereo microscope SZ61 | Olympus Corp. (Tokyo, Japan) | Use for dissection of pituitaries. | |
| Alegra X-22R Centrufuge | Beckman Coulter Inc. (Brea, CA) | With cooling option (similar to current model XR-30). | |
| Water bath | Techne (Staffordshire, UK) | Any water bath with the possibility of adjusting temperature will do. | |
| Pasteur glass pipettes | VWR (NY) | 612-1701 | Outer diameter 1.6 mm, fire polish and autoclave before use. |
| Galaxy MiniStar table centrifuge | VWR (NY) | 521-2844 | Any small table centrigue will do. |
| Fine needles / insect pins | Fine Science Tools (CA) | 26001-40 | Diameter 0.03 mm. Other fine needles can be used instead. |
| Wax plate | Custom made by adding melted paraffin wax in large petri dish. |
References
- Freshney, R. I. . Culture of Animal Cells: A Manual of Basic Technique and Specialized Applications. , (2010).
- Ribeiro, L. P., Ahne, W. Fish cell culture: initiation of a line of pituitary cells from carp (Cyprinus carpio) to study the release of gonadotropin in vitro. In Vitro. 18 (5), 419-420 (1982).
- Ribeiro, L., Ahne, W., Lichtenberg, V. Primary culture of normal pituitary cells of carp (Cyprinus carpio) for the study of gonadotropin release. In Vitro. 19 (1), 41-45 (1983).
- Wong, A. O., Ng, S., Lee, E. K., Leung, R. C., Ho, W. K. Somatostatin inhibits (d-Arg6, Pro9-NEt) salmon gonadotropin-releasing hormone- and dopamine D1-stimulated growth hormone release from perifused pituitary cells of chinese grass carp, Ctenopharyngodon idellus. General and Comparative Endocrinology. 110 (1), 29-45 (1998).
- Chang, J. P., et al. Use of a pituitary cell dispersion method and primary culture system for the studies of gonadotropin-releasing hormone action in the goldfish, Carassius auratus. I. Initial morphological, static, and cell column perifusion studies. General and Comparative Endocrinology. 77 (2), 256-273 (1990).
- Weil, C., Hansen, P., Hyam, D. Use of pituitary cells in primary culture to study the secretion in rainbow-trout - Setting up and validating the system as assessed by its responsiveness to mammalian and salmon gonadotropin-releasing hormone. General and Comparative Endocrinology. 62 (2), 202-209 (1986).
- Montero, M., LeBelle, N., Vidal, B., Dufour, S. Primary cultures of dispersed pituitary cells from estradiol-pretreated female silver eels (Anguilla anguilla L): Immunocytochemical characterization of gonadotropic cells and stimulation of gonadotropin release. General and Comparative Endocrinology. 104 (1), 103-115 (1996).
- Xu, S. H., Cooke, I. M. Voltage-gated currents of tilapia prolactin cells. General and Comparative Endocrinology. 150 (2), 219-232 (2007).
- Lin, S. W., Ge, W. Differential regulation of gonadotropins (FSH and LH) and growth hormone (GH) by neuroendocrine, endocrine, and paracrine factors in the zebrafish-An in vitro approach. General and Comparative Endocrinology. 160 (2), 183-193 (2009).
- Hodne, K., von Krogh, K., Weltzien, F. A., Sand, O., Haug, T. M. Optimized conditions for primary culture of pituitary cells from the Atlantic cod (Gadus morhua). The importance of osmolality, pCO2, and pH. General and Comparative Endocrinology. 178 (2), 206-215 (2012).
- Wittbrodt, J., Shima, A., Schartl, M. Medaka - a model organism from the far East. Nature Reviews Genetics. 3, 53-64 (2002).
- Matsuda, M., et al. DMY is a Y-specific DM-domain gene required for male development in the medaka fish. Nature. 417 (6888), 559-563 (2002).
- Kasahara, M., et al. The medaka draft genome and insights into vertebrate genome evolution. Nature. 447 (7145), 714-719 (2007).
- Miyanishi, H., Inokuchi, M., Nobata, S., Kaneko, T. Past seawater experience enhances seawater adaptability in medaka, Oryzias latipes. Zoological Letters. 2 (12), (2016).
- Waymouth, C. Osmolality of mammalian blood and of media for culture of mammalian cells. In Vitro. 6 (2), 109-127 (1970).
- Cameron, J. N. Acid-base homeostasis - past and present perspectives. Physiological Zoology. 62 (4), 845-865 (1989).
- Claiborne, J. B., Edwards, S. L., Morrison-Shetlar, A. I. Acid-base regulation in fishes: cellular and molecular mechanisms. Journal of Experimental Zoology. 293 (3), 302-319 (2002).
- Perry, S. F., Tufts, B. L. . Fish respiration. , (1998).
- Hildahl, J., et al. Developmental tracing of luteinizing hormone β-subunit gene expression using green fluorescent protein transgenic medaka (Oryzias latipes) reveals a putative novel developmental function. Developmental Dynamics. 241 (11), 1665-1677 (2012).
- Strandabø, R. A. U., et al. Signal transduction involved in GnRH2-stimulation of identified LH-producing gonadotropes from lhb-GFP transgenic medaka (Oryzias latipes). Molecular and Cellular Endocrinology. 372 (1-2), 128-139 (2013).
- Verbalis, J. G. Brain volume regulation in response to changes in osmolality. Neuroscience. 168 (4), 862-870 (2010).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved