Method Article
Preparação de uma cultura de célula primária de alta qualidade do peixe Pituitaries
Neste Artigo
Resumo
Aqui descrevemos um protocolo para preparar e manter as culturas de células da hipófise primário de medaka (Oryzias latipes). As condições otimizadas no presente protocolo considerar parâmetros importantes, tais como temperatura, pH e pressão osmótica imitando as condições fisiológicas dos peixes, possibilitando resultados fisiologicamente mais significativos.
Resumo
Cultura de pilha primária é uma poderosa ferramenta comumente usada pelos cientistas para estudar as propriedades celulares e mecanismos de células isoladas em um ambiente controlado. Apesar das vastas diferenças na fisiologia entre mamíferos e peixes, protocolos de cultura de célula primária de peixe são frequentemente com base em condições de cultura mamíferos, frequentemente com apenas pequenas modificações. As diferenças ambientais afetam não só a temperatura do corpo, mas também soro sanguíneo parâmetros tais como a osmolaridade, pH e capacidade tampão de pH. Como meios de cultura celular e soluções de trabalho semelhantes são feitas para imitar as características do líquido extracelular e/ou soro de sangue para que uma célula é adaptada, é fundamental que esses parâmetros são ajustados especificamente para o animal em questão.
O atual protocolo descreve as condições de cultura primária otimizado para medaka (Oryzias latipes). O protocolo fornece etapas detalhadas sobre como isolar e manter saudável dissociado células da hipófise para mais de uma semana e inclui as seguintes etapas: 1. a adaptação da osmolalidade para os valores encontrados no plasma de sangue medaka, 2. a adaptação do temperatura de incubação à temperatura normal medaka (aqui na instalação de aquário) e 3. o ajuste do pH e bicarbonato buffer para valores comparáveis a outras espécies de peixes vivem em temperaturas semelhantes. Os resultados apresentados usando o protocolo descrito promovem resultados fisiologicamente significativos para medaka e podem ser usados como um guia de referência pelos cientistas fazer culturas de células primárias de outras espécies não-mamíferos.
Introdução
Cultura de pilha é uma das principais ferramentas usadas em pesquisa biológica molecular, proporcionando um excelente modelo sistema para responder perguntas biológicas diferentes, variando de fisiologia celular normal a droga triagem e carcinogênese1. As células primárias, isoladas diretamente do tecido animal usando métodos enzimáticos e/ou mecânicos, são muitas vezes consideradas biologicamente mais relevantes do que linhas celulares como a resposta biológica pode estar mais perto a situação na vivo . Protocolos para a preparação de culturas de células primárias devem ser otimizados para cada tipo de espécie e célula de interesse, a fim de imitar as características para que uma célula é adaptada e obter resultados significativos fisiologicamente.
Inúmeros protocolos descrevem as condições de cultura para sistemas de células de mamíferos, enquanto protocolos semelhantes descrevendo as condições de cultura primária de células de peixes são bastante escassos em comparação. As células são vulneráveis a mudanças rápidas de temperatura, pH e pressão osmótica e são particularmente frágeis durante o procedimento de dissociação. Soluções de sal comerciais e meios de cultura utilizados para culturas de células de mamíferos não são ideais para peixes teleósteos, especialmente em termos de sistema (s) tampão de pH e pressão osmótica. É, portanto, importante medir e ajustar as soluções aos níveis fisiologicamente relevantes desses parâmetros na espécie de interesse.
Foram feitas culturas primárias da hipófise de várias espécies de peixes teleósteos, incluindo a carpa comum (Cyprinus carpio)2,3, capim (Ctenopharyngodon idella)4, peixe dourado (Carassius auratus deda carpa )5, truta arco-íris (Oncorhynchus mykiss)6, enguia europeia (Anguilla anguilla)7, tilápia (Oreochromis mossambicus)8, peixe-zebra (Danio rerio)9, e Bacalhau do Atlântico (Gadus morhua)10. Para ajustar a temperatura de incubação para as espécies de interesse, além de vários desses protocolos têm incubadas as células em condições semelhantes a mamíferos que podem ser ideais para as espécies de interesse, com um pH de 7.2 a 7.5 em um ambiente umidificado contendo 3-5% de CO2. Além disso, é claro se a pressão osmótica de soluções utilizadas para a preparação de várias destas culturas de célula primária foram ajustada e estável entre diferentes soluções.
O protocolo atual é baseado no trabalho anterior com culturas primárias do bacalhau do Atlântico10 e inclui ajustes de temperatura de incubação, osmolaridade, pH e sistemas-tampão pH, incluindo a pressão parcial de dióxido de carbono (pCO2), para a fisiologia do medaka (o. latipes). Medaka é um peixe de água doce pequeno (3 – 4 cm), nativo do sudeste da Ásia. Hoje em dia, é usado como uma espécie de modelo em muitos laboratórios de pesquisa ao redor do mundo, como é relativamente fácil para procriar e altamente resistente a muitos peixes comuns doenças11. Existem várias vantagens de usar o medaka como um modelo, incluindo uma tolerância de temperatura de 4 – 40 ° C11, um tempo de geração curto, embriões transparentes, um sexo-determinando gene12e um genoma sequenciado13, bem como muitos outros recursos genéticos disponíveis.
As condições de cultura primária neste protocolo são otimizadas para coincidir com a temperatura de 26 ° C que medakas são mantidos na instalação de peixe. Além disso, a osmolalidade é reduzida de 320 mOsm/kg de bacalhau do Atlântico vivem em água salgada para 290 mOsm/kg para medaka vivem em água doce e de acordo com a osmolalidade normal de medaka plasma14. Em comparação, a osmolalidade típica dos mamíferos plasma está na faixa de 275-295 mOsm15. Vive em uma variedade de temperaturas e possuem brânquias que estão em contacto directo com a água, tornando a capacidade de buffer e o pH do sangue e fluido extracelular em peixes diferentes em mamíferos. Meios de cultura mamíferos geralmente incluem sistemas tampão que resultam em um pH de cerca de 7,4 quando a mídia está equilibrada para uma atmosfera padrão de 5% de CO2 no ar umidificado a 37 ° C. O pH é dependente de temperatura e o valor de pH neutro (em água) aumenta com uma diminuição de temperatura16. Típico de peixes teleósteos plasma pH varia de 7,7 a 7,917. A otimização do presente protocolo incluíram uma redução de pH 7,85 bacalhau mantida a 12 ° C pH 7.75 para medaka mantida a 26 ° C, aumentando o CO2 de 0,5% a 1%.
Além disso, a capacidade de tampão bicarbonato é bastante diferente em peixes e mamíferos. CO2 é facilmente trocado sobre as brânquias em peixes e o pCO2 na água é apenas uma pequena fração da pCO2 no pulmão18. Alterar a temperatura ou o pCO2 alterará o pH e o tampão do meio. Consequentemente, o pH, nem o pCO2 recomendado pela incubação de células de mamíferos é ideal para células de peixe e, portanto, os meios de cultura devem ser otimizados com sistemas tampão contendo valores fisiologicamente relevantes para os peixes e os determinada espécie de interesse. Este protocolo descreve como preparar culturas de células primárias de pituitaries medaka e incluem ajustes de pH, osmolaridade, pH e temperatura reserva do sistema de incubação, além de outros parâmetros importantes a considerar ao preparar a célula primária culturas de espécies não-mamíferos.
Protocolo
As experiências com animais realizadas neste estudo foram aprovadas pela Universidade Norueguesa de Ciências da vida, seguir as orientações para o cuidado e bem-estar dos animais de pesquisa.
1. preparação de soluções
- Calibre os instrumentos de medidor de aparelhos e pH de acordo com as instruções do fabricante para garantir uma medição correta.
-
Preparar 500 mL de Ca2 +- e Mg2 +-livre fosfato salino de Dulbecco (dPBS), ajustar o pH a 7.75 (etapa 1.2.1) e a pressão osmótica para 290 mOsm/kg (etapa 1.2.2) antes de uma filtração estéril (etapa 1.2.3).
- Ajuste o pH a 7.75 com um medidor de pH calibrado cuidadosamente adicionando gotas de uma solução de NaOH 1 M, agitando cuidadosamente a solução.
- Medir a osmolalidade da solução usando um aparelhos calibrados e calcular a quantidade de manitol, necessário para aumentar a pressão osmótica para 290 mOsm/kg. Adicione a quantidade necessária de manitol e em seguida medir a osmolalidade da solução novamente para garantir o ajuste correto.
Nota: A quantidade de manitol necessário depende a osmolalidade medida, que normalmente varia entre diferentes lotes. Uma molécula de manitol é igual a 1 partícula osmótica. - Estéril-filtrar a solução de dPBS usando um filtro de 0,2 µm.
Nota: A solução pode ser armazenada a 4 ° C pelo menos 3 meses.
- Preparar 500 mL de meio de cultura Leibovitz (L-15) sem L-glutamina e bicarbonato e complementar com 10mm NaHCO3 (passo 1.3.1), glicose de 4,5 mM (etapa 1.3.2) e glutamina comercialmente disponível de 2 mM (etapa 1.3.3). Ajustar a solução para 290 mOsm/kg (etapa 1.3.4), filtro estéril (passo 1.3.5) e adicionar 2,5 mL de uma solução de penicilina-estreptomicina (etapa 1.3.6).
Nota: A solução pode ser armazenada a 4 ° C pelo menos 4 semanas.- Adicione 420 mg de NaHCO3 por 500 mL de meio de cultura para alcançar uma solução de 10 mM.
- Adicione 405 mg de glucose por 500 mL de meio de cultura para alcançar uma solução de 4,5 mM.
- Adicione 5 mL de 100 ações de x de uma solução de glutamina em 500 mL de meio de cultura para alcançar uma solução de 2 mM. Mexa até que todos os solutos são dissolvidos.
- Ajuste a solução para 290 mOsm/kg com manitol usando um aparelhos (como o realizado na etapa 1.2.2).
- Realize uma filtração estéril do meio de L-15 usando um filtro de 0,2 µm.
- Após a filtração estéril, adicione 2,5 mL de uma solução de penicilina-estreptomicina, correspondente a 50 U/mL de penicilina e 50 µ g/mL de estreptomicina.
- Prepare-se 50 mL de uma solução de tripsina usando 1 mg/mL (0,1%) tipo de tripsina QUE II-S dissolvido na dPBS modificados (preparado na etapa 1.2). Faça alíquotas de 2 mL em tubos de plástico estéril e armazená-los a-20 º C até o uso.
Nota: Alíquotas de 2 mL podem ser armazenadas a-20 º C pelo menos 3 meses. - Prepare-se 50 mL de uma solução de inibidor de tripsina usando 1 mg/mL de (0,1%) tripsina inibidor tipo S e completá-lo com 2 µ g/mL de DNase eu dissolvido na dPBS modificados (preparado na etapa 1.2). Faça alíquotas de 2 mL em tubos de plástico estéril e armazená-los a-20 º C até o uso.
Nota: Alíquotas de 2 mL podem ser armazenadas a-20 º C pelo menos 3 meses.
2. preparação do equipamento
- Prepare-se pipetas de vidro pelo fogo da ponta para a dissociação de célula de polimento. Fazer dicas com 2 categorias de tamanho diferentes (uma abertura média de 0,6-0,8 µm e uma pequena abertura de 0,4 – 0,6 µm), jogando com o tempo e a distância entre a chama rodando simultaneamente a pipeta. Coloque as pipetas de vidro em um recipiente de vidro limpo e autoclave-los (usando o modo sólido a 105 ° C por 45 min).
- Prepare uma caixa de isopor com gelo.
- Prepare um tubo de plástico com 1,5 mL de dPBS modificados (preparado na etapa 1.2) para transferir os pituitaries para durante a dissecção e mantê-lo no gelo.
- Prepare um tubo de 15 mL com 10 mL de dPBS modificados (preparado na etapa 1.2) e mantê-lo no gelo até a dissociação de célula.
- Prepare fresco ou descongelar alíquotas das soluções de inibidor de tripsina (preparadas em etapas 1.4 e 1.5) e tripsina e mantê-los no gelo até o uso.
- Configure o banho de água a 26 ° C antes de iniciar a dissecação para permitir que a água atingir a temperatura desejada antes a dissociação química dos pituitaries.
- Limpe todas as ferramentas de dissecação com etanol a 70% antes, durante e após o uso, incluindo a pinça fina para usar para a dissecção e agulhas finas e uma placa de cera para fixar os peixes. Usar luvas limpas (alterar e limpar frequentemente) durante todo o procedimento para evitar uma potencial contaminação das células.
3. na hipófise dissecção e dissociação de célula
- Eutanásia o peixe por imersão em lama de gelo (0 ° C). Deixe o peixe da lama de gelo pelo menos 1 min garantir um choque hipotérmico irreversível.
Nota: Perda de imobilização e equilíbrio ocorrerá após alguns segundos. Verifique se o peixe está completamente submersa na água gelo e não reside em cima do gelo, como o último conduzirá à asfixia e potencial pele queima em vez de um choque hipotérmico rápido e humano. - Rapidamente o peixe em uma rede de transferência para uma placa de cera sob o microscópio de dissecação e destruir a coluna por um soco de agulha no pescoço.
- Pino da cabeça do peixe para a placa de cera usando agulhas finas, inserindo uma agulha na parte dianteira (sobre a boca) e um em cada lado da cabeça (atrás do cérebro) para estabilizar a cabeça perante a dissecação.
- Ver o peixe sob o microscópio de dissecação e delicadamente, raspe as escamas na parte superior da cabeça usando a pinça fina com uma ponta em ângulo.
- Cuidadosamente Introduza a ponta angular da pinça fina sob a pele do lado da cabeça e remover o teto do crânio, movendo lentamente a pinça na direção da boca, mantendo um aperto firme para a pinça encerram o teto do crânio.
- Corte a medula espinhal completamente usando a pinça com ponta em ângulo.
Nota: O tempo é um fator importante, para trabalhar eficientemente e com precisão limitar o tempo gasto desde a dissecação dos pituitaries até que as células são banhadas no prato. Depois de alguma prática, dissecação da hipófise deve levar em torno de 2 – 3 min por peixe, dos quais apenas cerca de 10 s são necessários para atender a hipófise quando o cérebro já está exposto. - Vire cuidadosamente o cérebro em direção a boca para expor a hipófise e dissecá-lo com uma pinça limpa com uma ponta reta. Transferir a pituitária para um tubo de plástico contendo 1,5 mL modificado dPBS (para obter detalhes, consulte Passo 2.3) colocado no gelo. Verifique se a ponta da pinça sob o microscópio para garantir que a hipófise com êxito é adicionada ao tubo e nada é deixado a fórceps.
Nota: Disse como muitos pituitaries conforme necessário, dependendo do número de pratos de cultura que vão ser preparados simultaneamente. Como regra geral, calcule pelo menos 10 pituitaries de peixe adulto por prato para ter uma densidade adequada de células (que depende da aplicação a jusante). - Spin para baixo as pituitaries em uma centrífuga de mesa para 1-2 s à temperatura ambiente. Retire o dPBS usando uma pipeta de vidro cuidadosamente e tome cuidado para evitar a remoção de qualquer pituitaries.
- Adicione 1 mL da solução de tripsina (preparada na etapa 1.4) para lavar as pituitaries, girá-los para baixo em uma centrífuga de mesa para 1-2 s e remover a maior parte do líquido usando uma pipeta de vidro antes de adicionar um adicional 1 mL de solução de tripsina.
- Incubar o tubo em um banho de água a 26 ° C durante 30 minutos, de preferência com agitação suave, ou alternativamente, agite o tubo algumas vezes durante o período de incubação.
- Spin para baixo as pituitaries em uma centrífuga de mesa para 1-2 s à temperatura ambiente e certifique-se de todos os pituitaries estão localizados na parte inferior do tubo. Remover a maior parte da solução de tripsina com uma pipeta de vidro e adicione 1 mL da solução de inibidor de tripsina (preparada na etapa 1.5) para inactivar a tripsina e lavar os pituitaries.
- Recolha os pituitaries na parte inferior do tubo girando-os para baixo em uma centrífuga de mesa para 1-2 s à temperatura ambiente. Remover a maior parte do líquido com uma pipeta de vidro e adicione 1 mL da solução de inibidor de tripsina (preparada na etapa 1.5). Colocar o tubo em um banho de água a 26 ° C durante 20 minutos, de preferência com agitação suave, ou alternativamente, agite o tubo algumas vezes durante o período de incubação para inactivar a tripsina.
- Prepare um prato de cultura de célula poli-d-lisina-revestido de 35 milímetros com um fundo de vidro central adicionando 2 mL do meio de L-15 e deixar que incube durante pelo menos 10 min a 26 ° C e com 1% de CO2 para que conseguir atingir a temperatura e o pH antes de chapear as pilhas.
Nota: Também pode ser usada numa placa de cultura de células de plástico. A principal vantagem de usar um prato com um fundo de vidro centralizado é que a área onde as células são banhadas é menor, e portanto, menos células da hipófise são necessárias por prato. Algumas aplicações a jusante também podem requerer um fundo de vidro (ou seja, algumas técnicas de imagem). - Defina a refrigeração centrífuga para tubos de 15 mL a 4 ° C, para permitir-lhe chegar à temperatura desejada antes de iniciar a dissociação mecânica.
- Recolher os pituitaries na parte inferior do tubo por girando para baixo o tubo com a solução de inibidor de tripsina (da etapa 3.11) em uma centrífuga de mesa para 1-2 s à temperatura ambiente e certifique-se de todos os pituitaries estão localizados na parte inferior do tubo antes cuidadosamente remover a maior parte da solução do inibidor de tripsina utilizando uma pipeta de vidro.
Nota: Execute todas as etapas seguintes do protocolo em uma bancada de fluxo laminar (LAF) certificadas pelo trabalho de célula evitar uma contaminação das células. - Adicione 1 mL de gelado dPBS modificados (preparado na etapa 2.4) para as peças de tecido na hipófise e chupar delicadamente os pedaços de tecido e descer (6 – 7. x) em uma pipeta de vidro polido fogo (preparada no passo 2.1).
Nota: A temperatura é um aspecto essencial, portanto, mantenha todas as soluções a 4 ° C. Deste ponto em diante, execute todas as etapas no gelo quando possível. - Gire para baixo as peças de tecido em uma centrífuga de mesa para 1-2 s à temperatura ambiente e transferir cuidadosamente a parte superior do dPBS contendo as células dissociadas (quase 1 mL) para um novo tubo de 15 mL colocado no gelo. Evite se mover da pipeta para o fundo do tubo, onde ficam as peças de tecido.
- Repita a etapa 3.16 – 3.17, dissociando as células em 1 mL de dPBS gelada de cada vez, até que todos os 10 mL de dPBS é usado. Comece usando uma pipeta de vidro com uma abertura de tamanho médio e alternar para uma pipeta de vidro com uma abertura menor no final (para os último 3 – 4 mL de dPBS adicionado) da dissociação. Se há pedaços de tecido ainda visível no final do processo de dissociação, aumentar a pipetagem de aproximadamente 10 x para as 2 últimas etapas de dPBS para dissociação e finalmente deixar os pedaços de tecido residual. Ressuspender as células suavemente e evitar a criação de bolhas como pode causar danos nas células quando as células anexa à superfície das bolhas.
Nota: Esta é uma etapa crítica do presente protocolo e requer algum treinamento para obter um bom resultado. - Equilibrar o tubo no centrifugador (pre-resfriado a 4 ° C) e spin-down as células a 200 x g durante 10 minutos a 4 ° C. Certifique-se de marcar a lateral do tubo onde será o centrifugado.
- Retire cuidadosamente o tubo de centrífuga e suavemente, transferir o sobrenadante com uma pipeta de vidro para um tubo de plástico vazia 15 mL diretamente após a centrifugação. Não se esqueça de remover a maior parte do sobrenadante, mas tome cuidado para não perder o pequeno centrifugado (muitas vezes invisíveis).
- Cuidadosamente Ressuspender as células em 50 a 100 µ l de meio de cultura de L-15.
Nota: Neste passo, é possível contar as células e/ou executar um teste de viabilidade (como uma célula de contagem na presença de azul de trypan usando um hemocytometer), mas cuidado que utilizando parte da suspensão de células para o efeito irá diminuir o rendimento. Evite usar um volume grande de suspensão como aumentará o risco de células difusão fora do centro do prato. - Escorrer cuidadosamente as células dissociadas no meio do prato de cultura de células contendo 2 mL do meio de L-15 (preparado na etapa 3.13). Permitir que as células para afundar até o fundo do prato por aproximadamente 5 min antes de movê-los para a incubadora, para evitar que as células espalhar fora da parte submersa da parte inferior de vidro.
- Incube o prato no 26 ° C e 1% CO2 para permitir que todas as células afundar completamente e anexar para o fundo do prato.
- Depois de 30 min, olhe para as células no microscópio para certificar-se de que eles têm ligado para o prato de cultura.
- Continue a incubar as células a 26 ° C e 1% de CO2.
- Cuidadosamente, mudar da maioria (mas não todos) o médio a cada 3-4 dias.
Nota: Evite alterar o meio mais frequentemente, que possa perturbar as células e fazê-los desanexar da parte inferior do vidro. Use as células para experiências dentro de uma semana após a semeadura-los.
Resultados
Este protocolo descreve a preparação de uma cultura de célula primária de pituitaries medaka e fornece as células saudáveis que podem ser mantidas em uma cultura pelo menos uma semana. O protocolo é baseado em valores correspondentes fisiológicos medaka14 e além disso é otimizado para o tecido da hipófise em peixes adultos, usando um pH de 7.75 e uma osmolalidade de 290 mOsm/kg durante todo o procedimento desde a colheita de tecidos para o chapeado células em cultura (Figura 1 e Figura 2).
Resultados representativos de experimentos em culturas de célula primária produzidas pelo presente protocolo são exibidos na Figura 3, Figura 4e Figura 5. Para os resultados aqui apresentados, um transgénico medaka linha, onde luteinizante hormônio (Lh)-células gonadotróficas expressar a proteína verde fluorescente (GFP), foi utilizada19. A Figura 3 mostra um campo representativo no prato de uma cultura de células primárias do dia 0 ao 7º dia após a semeadura, incluindo ambas as imagens de microscopia de campo claro e fluorescente, mostrando as células expressando GFP Lh-gonadotróficas. Usar cerca de 10 pituitaries medaka adulto por prato geralmente resulta em uma densidade de cerca de 5 x 104 – 1 x 105 células por prato após a semeadura. A viabilidade das células da hipófise na cultura é calculada com base no número total de células GFP-expressando a cultura no dia 1, 3 e 7 após o chapeamento, em relação ao dia 0 (Figura 4). O gráfico mostrado na Figura 4 indica que o número de células morrendo é quase constante ao longo do tempo, com mais de 95% das células vivas depois de 1 dia, enquanto mais de 90% ainda está vivo depois de 3 dias. Embora haja uma pequena queda na viabilidade celular, com o tempo, a maioria das células (cerca de 75%) ainda estão vivos depois de uma semana na cultura. Eletrofisiológicas gravações de células expressando GFP Lh-gonadotróficas (realizadas conforme descrito em Strandabø, et al) 20 mostram que as células são capazes de potenciais de ação de fogo espontaneamente após 4 dias na cultura (Figura 5A). Além disso, após a estimulação do hormônio liberador de gonadotrofinas, uma inicial transitória hiperpolarização da membrana celular é seguida por um aumento dramático em disparar a frequência que é concomitante com uma despolarização e uma duração maior da ação potenciais (Figura 5B).
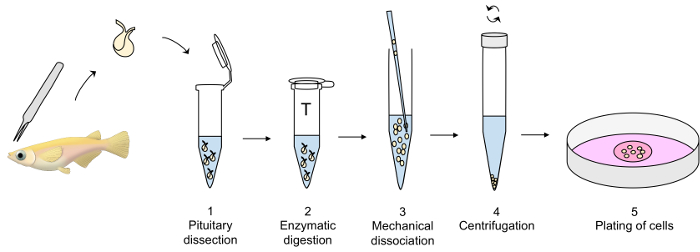
Figura 1: visão geral sobre a técnica de cultura celular de primária da hipófise. Pituitaries são dissecados com pinça fina e transferidos para um tubo de plástico contendo dPBS modificados no gelo (etapa 1 do protocolo) até a digestão enzimática das pituitaries com tripsina a 26 ° C (etapa 2), seguido por uma inativação com um inibidor de tripsina a 26 ° C (não mostrado). A dissociação mecânica dos pituitaries enzimaticamente digeridos com uma pipeta de vidro cuidadosamente é executada em dPBS no gelo (etapa 3), seguido por uma centrifugação a 4 ° C (passo 4). Finalmente, o centrifugado é dissolvido em meio de cultura e as células chapeadas para fora em um prato de cultura celular (passo 5). Clique aqui para ver uma versão maior desta figura.

Figura 2: detalhes da dissecação da hipófise medaka. (A), a cabeça de um imobilizado medaka (vista dorsal) é fixado a uma placa de cera, e o topo do telhado do crânio é retirado com pinça fina para expor a parte superior do cérebro. (B), a medula espinhal é cortada, e o cérebro virou em direção à frente da cabeça tal que a hipófise é exposta. (C), a hipófise é recolhida com pinça limpa, tudo bem. Ponta da seta aponta para a hipófise em painel B e C. Barra de escala = 1.000 µm. clique aqui para ver uma versão maior desta figura.

Figura 3: cultura de pituitária primária célula Medaka. Estes painéis mostram imagens confocal de alta resolução de uma cultura de pituitária primária célula medaka representativo no dia 0, dia 3 e o 7º dia após a semeadura. O painel superior mostra imagens de microscopia de campo claro de um campo representativo no prato, o painel do meio mostra imagens de microscopia fluorescente do mesmo campo de visão exibindo células expressando GFP Lh-gonadotróficas, e o painel inferior é uma sobreposição dos dois. Barra de escala = 20 µm. clique aqui para ver uma versão maior desta figura.
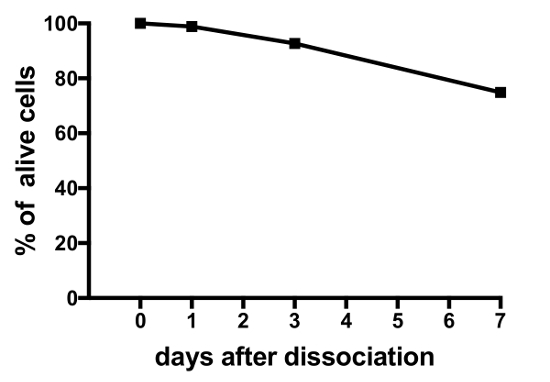
Figura 4: viabilidade da hipófise medaka em cultura de células. Esta figura mostra a viabilidade das culturas na hipófise célula primária medida no dia 0, 1, 3 e 7 após a semeadura. Os números são calculados usando o software open-source CellProfiler V2 e são baseados no número total de células expressando GFP Lh-gonadotróficas por prato nos pontos de tempo diferente, em relação ao tempo 0. Clique aqui para ver uma versão maior desta figura.
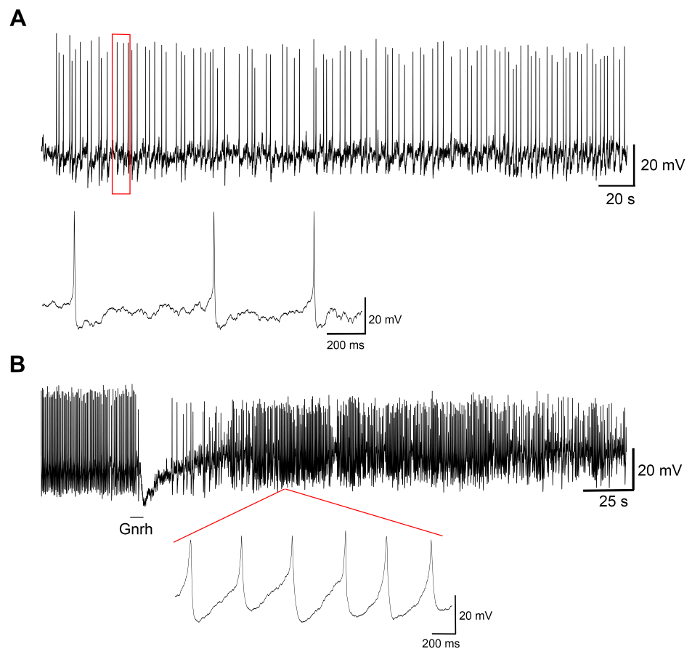
Figura 5: gravações eletrofisiológicas de células da hipófise. Estes painéis mostram gravações eletrofisiológicas de uma célula de Lh-gonadotróficas GFP-expressando em uma cultura de célula primária realizada no dia 4 após semeadura, mostrando (A) um traço representativo de potenciais de ação espontâneos, seguido por (B) um estimulação com o hormônio liberador de gonadotrofinas Gnrh1 por 10 s. A estimulação Gnrh1 induz uma resposta bifásica com uma hiperpolarização da membrana celular, seguida por uma despolarização e maior duração dos potenciais de ação (medido em 50% de pico) de 8,9 ± 3,0 ms antes da estimulação para 29,2 ± 9,9 ms após o estimulação. Clique aqui para ver uma versão maior desta figura.
Discussão
Sistemas de cultura in vitro células fornecem ferramentas poderosas para os investigadores responder a uma infinidade de questões biológicas diferentes se usado no caminho certo1. É importante lembrar que células dissociadas que perderam suas conexões com as células vizinhas ter obtido diferentes propriedades funcionais do que tinham originalmente em vivo. Para evitar ser correndo o risco de má interpretação dos resultados obtidos em experimentos em vitro , é importante considerar ajustando o procedimento de cultura primária de células para o tipo de espécie e célula de interesse. Mesmo moderadas ajustes de procedimentos padrão de cultura e soluções utilizados geralmente são suficientes para alterar profundamente as condições de cultura de um tipo específico de célula.
Este protocolo descreve condições otimizadas para preparação e manutenção de culturas de células primárias de pituitaries medaka adulto, que podem ser conseguidos ajustando parâmetros tais como a pressão osmótica, temperatura, pH e pCO2 das soluções utilizadas, a coincidir com as condições fisiológicas desta espécie. O pH é dependente de temperatura e deve, portanto, também ser ajustado entre as diferentes espécies de peixes teleósteos, vivendo em diferentes temperaturas de17. A pressão osmótica de todas as soluções usadas durante a dissociação de célula e cultivo também deve ser ajustada para melhorar a condição das células. Especialmente, se houver uma discrepância na osmolalidade entre diferentes soluções utilizadas durante o procedimento de isolamento, ele pode ter efeitos devastadores sobre a qualidade de cultura, levando a uma diminuição da viabilidade (os resultados dos autores próprios não publicados). Soluções de hiper-osmóticos fará com que as células a encolher (e vice-versa), assim, interferir com a integridade de membrana e proteínas de membrana função21. Um ponto importante neste contexto é que parâmetros como pressão osmótica e o pH não são geralmente medido nem estável entre diferentes lotes de buffers comerciais e meios de cultura utilizados em condições de cultura dos mamíferos. Diferenças de osmolaridade e pH entre diferentes soluções utilizadas durante o procedimento de isolamento devem ser evitadas em todos os momentos.
A taxa de sucesso do presente protocolo é melhorada por formação, então espera-se pesquisadores precisam algum tempo para se familiarizar com as diferentes etapas da técnica. Por exemplo, o tempo de dissecação dos pituitaries até que as células são banhadas no prato é inversamente relacionado à saúde celular. A dissociação mecânica dos pituitaries usando uma pipeta de vidro é um passo particularmente crítico do protocolo e requer algum treinamento para obter um bom resultado. O procedimento de dissociação pode apresentar estresse osmótico e mecânica que é prejudicial para as células. A adição de pequenos volumes de dPBS modificados em etapas repetidas para a dissociação mecânica garante um procedimento de dissociação suave onde células já dissociadas são transferidas para um tubo novo e intocada, de esquerda, enquanto o pesquisador continua a dissocia as células adicionais do tecido em um novo volume de dPBS.
Este protocolo é otimizado para as células da hipófise medaka adulto. Estágios de vida diferentes do animal dentro do mesmo tecido, tecidos ou espécies diferentes exigem otimizações das condições de cultura. Por exemplo, células provenientes de animais imaturos podem ser mais frágeis e, portanto, mais suscetíveis para apoptose e morte de células e, portanto, podem exigir a necessidade de ajustar o protocolo, especialmente em direção a um procedimento de dissociação mais suave. A dissociação mecânica usando uma pipeta de vidro é um passo muito crítico do processo, como uma dissociação mecânica muito cuidadosa vai levar a um ganho mais baixo, enquanto um bruto também pode induzir a apoptose e/ou células de morte. Se diferentes enzimas são consideradas para dissociação, é necessário utilizar uma concentração de tempo e enzimas de digestão diferentes. Pituitaries Medaka são muito pequenas e relativamente fácil de dissociar usando o protocolo descrito. No entanto, otimizações para outras espécies podem exigir o uso de um filtro de malha após a dissociação para remover os resíduos. O sucesso do presente protocolo também depende em grande parte executando as etapas em condições estéreis para evitar contaminar as células.
O número de células a semente por prato depende do número de pituitaries no início, bem como o sucesso do processo de dissociação. Há cerca de 15.000 por volta das células em uma pituitária intacta medaka adulto. No entanto, as células são perdidas durante o processo de dissociação e este deve ser contabilizado para o cálculo do número de pituitaries necessários para uma experiência. Utilização de pelo menos 10 pituitaries per prato normalmente resultará em uma densidade de ao redor 50.000-100.000 células por prato. Esta densidade, agregação não forma em qualquer quantidade significativa, mesmo depois de 7 dias em cultura. Visivelmente, agregação parece ser densidade dependente, como a mais densa das células são semeadas, mais eles parecem agregar. Certos procedimentos podem exigir uma cultura mais densa e, portanto, a densidade de semeadura ideal deve ser considerada dependendo da aplicação a jusante. É um ponto importante a ter em consideração ao planejar o número de pituitaries para usar por prato.
Aplicações a jusante mais comuns utilizar culturas de célula primária dentro os primeiros dias após a semeadura. Os resultados apresentados aqui, desde a viabilidade celular para as gravações eletrofisiológicas, mostraram que é possível obter bons resultados de culturas de células primárias preparadas usando o protocolo descrito por até 1 semana após a semeadura. No entanto, culturas podem ser mantidas mais, e células saudáveis ainda estão presentes após mais de 2 semanas na cultura (os resultados dos autores próprios não publicados). As condições otimizadas apresentadas neste protocolo facilita resultados significativos fisiologicamente e pode ser benéficas para outros cientistas, preparando as culturas de células primárias de células não-mamíferos.
Divulgações
Os autores não têm nada a declarar.
Agradecimentos
Este projecto foi financiado pela Universidade Norueguesa de Ciências da vida e o Conselho de pesquisa da Noruega, número de concessão, 243811 e 244461 (programa de aquicultura). Estamos gratos à Lourdes Carreon Tan na Universidade Norueguesa de Ciências da vida para manter as instalações de peixe.
Materiais
| Name | Company | Catalog Number | Comments |
| Dulbecco’s Phosphate Buffered Saline (dPBS), without calcium chloride and magnesium chloride | Sigma (Merck, Damstadt, Germany) | D8537 | Adjust solution to pH 7.75 with 1M NaOH and 290 mOsm with mannitol. |
| L-15 medium (Leibovitz), witout L-glutamine | Sigma (Merck, Damstadt, Germany) | L5520 | Supplement 500 ml culture medium with 10mM NaHCO3, 4.5 mM glucose, 2 mM Glutamax. Adjust solution to 290 mOsm with mannitol and filter solution through a 0.2 µm PES sterile filter, before adding 2.5 ml Penicillin-Streptomycin solution (see below for details). |
| NaOH | Sigma (Merck, Damstadt, Germany) | S5881 | Add drops of 1M solution to increase pH of dPBS and culture medium to 7.75. |
| NaHCO3 | Sigma (Merck, Damstadt, Germany) | S5761 | 10 mM NaHCO3 equals 420 mg per 500 ml culture medium. |
| D-mannitol | Sigma (Merck, Damstadt, Germany) | 63565 | Use to increase osmolality of dPBS and culture medium. Calculate correct amount needed to reach an osmolality of 290 mOsm. |
| D-glucose | Sigma (Merck, Damstadt, Germany) | G5400 | 4.5 mM D-glucose equals 405 mg per 500 ml culture medium. |
| GlutaMAX Supplement | Gibco (Life Technologies, Paisley, UK) | 35050-061 | Alternative to L-glutamine, with increased stability. 2 mM Glutamax equals 5 ml of 100X stock in 500 ml culture medium. |
| Penicillin-Streptomycin | Sigma (Merck, Damstadt, Germany) | P0781 | Stock solution 10,000 units penicillin and 10 mg streptomycin per mL. Use 2.5 ml of stock solution in 500 ml L-15 medium (equivalent of 50 U/ml Penicillin and 50 µg/ml Streptomycin). |
| Trypsin type II-S | Sigma (Merck, Damstadt, Germany) | T7409 | Prepare 1 mg/ml in dPBS solution. |
| Trypsin inhibitor type I-S | Sigma (Merck, Damstadt, Germany) | T6522 | Prepare 1 mg/ml in dPBS solution, supplement with 2 µg/ml Dnase I (see details below). |
| Dnase I | Sigma (Merck, Damstadt, Germany) | D5025 | Use in trypsin inhibitor solution (see above). |
| 0.2 µm Polyethersulfone (PES) sterile filter system | Corning Inc. (Corning, NY) | 431097 | Use for sterile filtration of dPBS and L-15 medium after adjustments. |
| 35 mm cell culture dish with glass bottom, poly d-lysine coated | MatTek Corporation (Ashland, MA) | P35GC-1.5-10-C | Can also be replaced by plastic dish, depending on downstream application. |
| Dumont #5 fine forceps | Fine Science Tools (CA) | 11254-20 | Straigt tip |
| Dumont #5/45 fine forceps | Fine Science Tools (CA) | 11253-25 | Angled 45° tip |
| Stereo microscope SZ61 | Olympus Corp. (Tokyo, Japan) | Use for dissection of pituitaries. | |
| Alegra X-22R Centrufuge | Beckman Coulter Inc. (Brea, CA) | With cooling option (similar to current model XR-30). | |
| Water bath | Techne (Staffordshire, UK) | Any water bath with the possibility of adjusting temperature will do. | |
| Pasteur glass pipettes | VWR (NY) | 612-1701 | Outer diameter 1.6 mm, fire polish and autoclave before use. |
| Galaxy MiniStar table centrifuge | VWR (NY) | 521-2844 | Any small table centrigue will do. |
| Fine needles / insect pins | Fine Science Tools (CA) | 26001-40 | Diameter 0.03 mm. Other fine needles can be used instead. |
| Wax plate | Custom made by adding melted paraffin wax in large petri dish. |
Referências
- Freshney, R. I. . Culture of Animal Cells: A Manual of Basic Technique and Specialized Applications. , (2010).
- Ribeiro, L. P., Ahne, W. Fish cell culture: initiation of a line of pituitary cells from carp (Cyprinus carpio) to study the release of gonadotropin in vitro. In Vitro. 18 (5), 419-420 (1982).
- Ribeiro, L., Ahne, W., Lichtenberg, V. Primary culture of normal pituitary cells of carp (Cyprinus carpio) for the study of gonadotropin release. In Vitro. 19 (1), 41-45 (1983).
- Wong, A. O., Ng, S., Lee, E. K., Leung, R. C., Ho, W. K. Somatostatin inhibits (d-Arg6, Pro9-NEt) salmon gonadotropin-releasing hormone- and dopamine D1-stimulated growth hormone release from perifused pituitary cells of chinese grass carp, Ctenopharyngodon idellus. General and Comparative Endocrinology. 110 (1), 29-45 (1998).
- Chang, J. P., et al. Use of a pituitary cell dispersion method and primary culture system for the studies of gonadotropin-releasing hormone action in the goldfish, Carassius auratus. I. Initial morphological, static, and cell column perifusion studies. General and Comparative Endocrinology. 77 (2), 256-273 (1990).
- Weil, C., Hansen, P., Hyam, D. Use of pituitary cells in primary culture to study the secretion in rainbow-trout - Setting up and validating the system as assessed by its responsiveness to mammalian and salmon gonadotropin-releasing hormone. General and Comparative Endocrinology. 62 (2), 202-209 (1986).
- Montero, M., LeBelle, N., Vidal, B., Dufour, S. Primary cultures of dispersed pituitary cells from estradiol-pretreated female silver eels (Anguilla anguilla L): Immunocytochemical characterization of gonadotropic cells and stimulation of gonadotropin release. General and Comparative Endocrinology. 104 (1), 103-115 (1996).
- Xu, S. H., Cooke, I. M. Voltage-gated currents of tilapia prolactin cells. General and Comparative Endocrinology. 150 (2), 219-232 (2007).
- Lin, S. W., Ge, W. Differential regulation of gonadotropins (FSH and LH) and growth hormone (GH) by neuroendocrine, endocrine, and paracrine factors in the zebrafish-An in vitro approach. General and Comparative Endocrinology. 160 (2), 183-193 (2009).
- Hodne, K., von Krogh, K., Weltzien, F. A., Sand, O., Haug, T. M. Optimized conditions for primary culture of pituitary cells from the Atlantic cod (Gadus morhua). The importance of osmolality, pCO2, and pH. General and Comparative Endocrinology. 178 (2), 206-215 (2012).
- Wittbrodt, J., Shima, A., Schartl, M. Medaka - a model organism from the far East. Nature Reviews Genetics. 3, 53-64 (2002).
- Matsuda, M., et al. DMY is a Y-specific DM-domain gene required for male development in the medaka fish. Nature. 417 (6888), 559-563 (2002).
- Kasahara, M., et al. The medaka draft genome and insights into vertebrate genome evolution. Nature. 447 (7145), 714-719 (2007).
- Miyanishi, H., Inokuchi, M., Nobata, S., Kaneko, T. Past seawater experience enhances seawater adaptability in medaka, Oryzias latipes. Zoological Letters. 2 (12), (2016).
- Waymouth, C. Osmolality of mammalian blood and of media for culture of mammalian cells. In Vitro. 6 (2), 109-127 (1970).
- Cameron, J. N. Acid-base homeostasis - past and present perspectives. Physiological Zoology. 62 (4), 845-865 (1989).
- Claiborne, J. B., Edwards, S. L., Morrison-Shetlar, A. I. Acid-base regulation in fishes: cellular and molecular mechanisms. Journal of Experimental Zoology. 293 (3), 302-319 (2002).
- Perry, S. F., Tufts, B. L. . Fish respiration. , (1998).
- Hildahl, J., et al. Developmental tracing of luteinizing hormone β-subunit gene expression using green fluorescent protein transgenic medaka (Oryzias latipes) reveals a putative novel developmental function. Developmental Dynamics. 241 (11), 1665-1677 (2012).
- Strandabø, R. A. U., et al. Signal transduction involved in GnRH2-stimulation of identified LH-producing gonadotropes from lhb-GFP transgenic medaka (Oryzias latipes). Molecular and Cellular Endocrinology. 372 (1-2), 128-139 (2013).
- Verbalis, J. G. Brain volume regulation in response to changes in osmolality. Neuroscience. 168 (4), 862-870 (2010).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados