Method Article
إعداد ثقافة الخلية الأولية عالية الجودة من الأسماك بيتويتاريس
In This Article
Summary
هنا يمكننا وصف بروتوكول لإعداد والحفاظ على ثقافات خلايا الغدة النخامية الأولية من الميداكا (Oryzias latipes). الشروط الأمثل في هذا البروتوكول تراعي المعالم الهامة مثل درجة الحرارة، أوسمولاليتي، ودرجة الحموضة عن طريق محاكاة الظروف الفسيولوجية للأسماك، مما يمكن من نتائج أكثر جدوى من الناحية الفسيولوجية.
Abstract
ثقافة الخلية الأولية أداة قوية تستخدم عادة من قبل العلماء لدراسة الخصائص الخلوية والآليات للخلايا المعزولة في بيئة تسيطر عليها. على الرغم من الاختلافات الشاسعة في الفسيولوجيا بين الثدييات والأسماك، بروتوكولات الثقافة الخلية الأولية من الأسماك كثيرا ما تستند إلى ظروف الثقافة الثدييات، غالباً مع تعديلات طفيفة فقط. الاختلافات البيئية تؤثر على درجة حرارة الجسم، ليس فقط، بل أيضا المعلمات مصل الدم مثل أوسمولاليتي ودرجة الحموضة pH سعة المخزن المؤقت. كما خلية ثقافة الإعلام وحلول العمل مماثلة تهدف إلى تقليد خصائص السوائل خارج الخلية و/أو مصل الدم الذي خلية تكييفها، من الأهمية بمكان أن يتم ضبط هذه المعلمات على وجه التحديد للحيوان في السؤال.
البروتوكول الحالي توضح شروط الثقافة الأولية الأمثل الميداكا (Oryzias latipes). البروتوكول يوفر خطوات تفصيلية حول كيفية عزل والحفاظ على صحة فصل خلايا الغدة النخامية لأكثر من أسبوع، ويتضمن الخطوات التالية: 1. تعديل osmolality إلى القيم الموجودة في بلازما الدم الميداكا، 2. التعديل درجة حرارة الحضانة إلى درجة الحرارة العادية الميداكا (هنا في المرفق الحوض)، و 3. تعديل درجة الحموضة وبيكربونات المخزن المؤقت إلى قيم قابلة للمقارنة بالأنواع الأخرى من الأسماك تعيش في درجات حرارة مماثلة. النتائج المعروضة باستخدام بروتوكول وصف تعزيز نتائج مجدية من الناحية الفسيولوجية الميداكا، ويمكن أن يستخدمها العلماء مما يجعل الثقافات الخلية الأولية من الأنواع غير الثدييات الأخرى كدليل مرجعي.
Introduction
ثقافة الخلية واحدة من الأدوات الرئيسية المستخدمة في البحوث البيولوجية الجزيئية، وتوفير نظام نموذجا ممتازا للإجابة على أسئلة بيولوجية مختلفة تتراوح بين الفيزيولوجيا الخلوية العادية ل الفحص والتسرطن المخدرات1. غالباً ما تعتبر الخلايا الأولية، معزولة مباشرة من الأنسجة الحيوانية باستخدام أساليب الانزيمية و/أو الميكانيكية، بيولوجيا أكثر أهمية من خطوط الخلايا الاستجابة البيولوجية قد تكون أقرب إلى الحالة في فيفو . ينبغي أن يكون الأمثل بروتوكولات من أجل إعداد الثقافات الخلية الأولية لكل نوع خلية والأنواع ذات الاهتمام من أجل محاكاة الخصائص التي خلية تكييف والحصول على نتائج مفيدة من الناحية الفسيولوجية.
بروتوكولات عديدة توضح شروط الثقافة نظم خلايا الثدييات، بينما بروتوكولات مماثلة تصف ظروف الثقافة الأولية للخلايا الأسماك شحيحة بل في المقارنة. الخلايا عرضه للتغيرات السريعة في درجة الحرارة ودرجة الحموضة وأوسمولاليتي، وهشة لا سيما أثناء إجراء الانفصال. حلول الملح التجاري وثقافة وسائل الإعلام المستخدمة لخلايا الثدييات الثقافات ليست الأمثل للأسماك تيليوست، لا سيما من حيث درجة الحموضة العازلة نظام كفؤ و osmolality. ولذلك، من المهم لقياس وضبط الحلول إلى المستويات ذات الصلة الفيزيولوجية لهذه المعلمات في الأنواع ذات الأهمية.
الثقافات الغدة النخامية الأولية قد بذلت من العديد من أنواع الأسماك تيليوست، بما في ذلك الكارب العادي () (Cyprinus carpio)2،3، عشب الكارب (idella كارب)4ذهبية (الذهبي Carassius )5، تراوت قوس قزح (Oncorhynchus mykiss)6, ثعبان (أنغيلا أنغيلا)7، البلطي (Oreochromis mossambicus)8،9من الزرد (دانيو rerio)، و سمك القد الأطلسي (جادوس مروة)10. وبصرف النظر عن ضبط درجة حرارة الحضانة لهذه أنواع الفوائد، العديد من هذه البروتوكولات قد المحتضنة الخلايا في ظروف شبيهة بالثدييات التي قد تكون دون المستوى الأمثل لهذا نوع الاهتمام، مع درجة حموضة من 7.2 إلى 7.5 في جو هوميديفيد تحتوي على 3-5% CO2. وبالإضافة إلى ذلك، أنها غير واضحة إذا عدلت osmolality الحلول المستخدمة في إعداد العديد من هذه الثقافات الخلية الأولية ومستقرة بين حلول مختلفة.
البروتوكول الحالي يستند إلى العمل السابق مع الثقافات الأولية من سمك القد الأطلسي10 ويشمل تعديلات لدرجة حرارة الحضانة و osmolality ودرجة الحموضة والحموضة العازلة النظم، بما في ذلك الضغط الجزئي لثاني أكسيد الكربون (pCO2)، إلى فسيولوجيا الميداكا (O. latipes). الميداكا من أسماك المياه العذبة صغيرة (3-4 سم) أصلي إلى شرق آسيا. في هذه الأيام، يتم استخدامه كأنواع نموذجية في العديد من المختبرات البحثية العالم، كما أنه من السهل نسبيا لتربية ومقاومة عالية للعديد من الأمراض السمكية المشتركة11. هناك العديد من المزايا لاستخدام الميداكا كنموذج، بما في ذلك تسامح درجة حرارة من 4 – 40 درجة مئوية11، وقت قصير الجيل، الأجنة شفافة، تحديد الجنس الجيني12، و تسلسل الجينوم13، كذلك العديد من الآخرين الموارد الجينية المتاحة.
شروط الثقافة الأولية في هذا البروتوكول هي الأمثل لتتناسب مع درجة الحرارة 26 درجة مئوية في إبقاء في ميداكاس في مرفق الأسماك. علاوة على ذلك، osmolality خفضت من موسم 320/كغ من سمك القد الأطلسي التي تعيش في المياه المالحة لموسم 290/كغ بالنسبة الميداكا التي تعيش في المياه العذبة وهو وفقا osmolality العادي الميداكا البلازما14. وبالمقارنة، osmolality نموذجية للبلازما الثدييات في النطاق من 275-295 موسم15. الأسماك يعيش في مجموعة متنوعة من درجات الحرارة والخياشيم التي على اتصال مباشر مع الماء، مما يجعل قدرة على درجة الحموضة والمخزن المؤقت للدم والسوائل خارج الخلية في الأسماك مختلفة عن تلك الموجودة في الثدييات. عادة ما تتضمن الثدييات ثقافة الإعلام نظم المخزن المؤقت الذي ينتج الرقم الهيدروجيني من حوالي 7.4 عند وسائل الإعلام هي اكويليبراتيد إلى جو قياسية من 5% CO2 في الهواء هوميديفيد عند 37 درجة مئوية. هو الرقم الهيدروجيني درجة الحرارة تعتمد والقيمة من أجل زيادة الأس الهيدروجيني المحايدة (في المياه) مع انخفاض درجة حرارة16. الأسماك تيليوست نموذجي البلازما pH يتراوح من 7.7 إلى 7.917. وشملت الاستفادة المثلى من هذا البروتوكول الحد من درجة الحموضة 7.85 لسمك القد أبقى على 12 درجة مئوية إلى درجة الحموضة 7.75 الميداكا أبقى على 26 درجة مئوية بزيادة أول أكسيد الكربون2 من 0.5% إلى 1%.
وباﻹضافة إلى ذلك، سعة المخزن المؤقت بيكربونات يختلف تماما في الأسماك والثدييات. CO2 يتم تبادلها بسهولة عبر الخياشيم في الأسماك و pCO2 في الماء سوى جزء صغير من pCO2 في الرئة18. تغيير درجة الحرارة أو pCO2 سيقوم بتغيير درجة الحموضة والمخزن المؤقت من المتوسط. ونتيجة لذلك، درجة الحموضة ولا pCO2 وأوصت تفرخ خلايا الثدييات الأمثل لخلايا الأسماك، وذلك، ينبغي أن يكون الأمثل وسائل الإعلام الثقافة مع نظم المخزن المؤقت الذي يحتوي على القيم ذات الصلة الناحية الفسيولوجية للأسماك نوع معين من الفائدة. هذا البروتوكول توضح كيفية إعداد الثقافات الخلية الأولية من بيتويتاريس الميداكا وتشمل التعديلات حضانة osmolality ودرجة الحموضة، درجة الحرارة ودرجة الحموضة المخزن المؤقت للنظام، بالإضافة إلى المعلمات الأخرى الهامة في الاعتبار عند إعداد الخلية الابتدائية الثقافات من الأنواع غير الثدييات.
Protocol
ووافقت جامعة النرويج لعلوم الحياة، والمبادئ التوجيهية التالية للعناية والرعاية لأبحاث الحيوانات التجارب على الحيوانات في هذه الدراسة.
1-إعداد الحلول
- معايرة أدوات متر أوسموميتير والحموضة وفقا لإرشادات الشركة المصنعة لضمان صحة القياسات.
-
إعداد 500 مل من Ca2 +-و Mg2 +-الحرة فوسفات مخزنة المالحة في دولبيكو (دببس)، تعديل درجة الحموضة إلى 7.75 (الخطوة 1.2.1) وأوسمولاليتي إلى 290 موسم/كغ (الخطوة 1.2.2) قبل ترشيح عقيمة (الخطوة 1.2.3).
- ضبط درجة الحموضة إلى 7.75 مع مقياس الأس الهيدروجيني معايرة بعناية إضافة قطرات حل هيدروكسيد الصوديوم 1 م مع التحريك بعناية في الحل.
- قياس أوسمولاليتي للحل باستخدام أوسموميتير معايرة وحساب كمية المانيتول بحاجة إلى زيادة أوسمولاليتي لموسم 290/كغ. إضافة الكمية المطلوبة من المانيتول ومن ثم قياس osmolality الحل مرة أخرى لضمان التكيف الصحيح.
ملاحظة: مقدار المانيتول اللازمة يعتمد على osmolality قياسه، الذي يتراوح عادة بين مجموعات مختلفة. جزيء واحد من المانيتول يساوي 1 الجسيمات ناضح. - معقمة-تصفية دببس الحل باستخدام عامل تصفية 0.2 ميكرون.
ملاحظة: الحل قد تكون مخزنة في 4 درجات مئوية لمدة 3 أشهر على الأقل.
- إعداد 500 مل من يبوفيتش (L-15) الثقافة المتوسطة دون لام الجلوتامين وبيكربونات، وتكمل مع 10 ملم NaHCO3 (الخطوة 1.3.1)، الجلوكوز 4.5 مم (الخطوة 1.3.2)، ومم 2 المتاحة تجارياً الجلوتامين (الخطوة 1.3.3). ضبط الحل لموسم 290/كغ (الخطوة 1.3.4)، تصفية العقيمة أنه (الخطوة 1.3.5)، وإضافة 2.5 مل حل البنسلين والستربتوميسين (الخطوة 1.3.6).
ملاحظة: الحل قد تكون مخزنة في 4 درجات مئوية لمدة 4 أسابيع على الأقل.- إضافة مغ 420 NaHCO3 الواحدة 500 مل من الثقافة المتوسطة للتوصل إلى حل 10 ملم.
- إضافة 405 ملغ جلوكوز في 500 مل من الثقافة المتوسطة للتوصل إلى حل 4.5 مم.
- إضافة 5 مل أسهم x 100 حل الجلوتامين في 500 مل من الثقافة المتوسطة للتوصل إلى حل 2 مم. يقلب حتى يتم حل جميع الذوائب.
- ضبط الحل لموسم 290/كغ مع المانيتول باستخدام أوسموميتير (كما يقوم في خطوة 1.2.2).
- إجراء ترشيح عقيمة المتوسطة L-15 استخدام فلتر 0.2 ميكرون.
- بعد الترشيح العقيمة، إضافة 2.5 مل الحل البنسلين والستربتوميسين، تناظر 50 يو/مليلتر من البنسلين و 50 ميكروغرام/مل من والستربتوميسين.
- إعداد 50 مل حل التربسين باستخدام 1 ملغ/مل نوع التربسين (0.1%) ثانيا-S المذابة في دببس تم التعديل (تم إعداده في الخطوة 1، 2). جعل مختبرين 2 مل في أنابيب بلاستيكية معقمة وتخزينها في-20 درجة مئوية حتى الاستخدام.
ملاحظة: يمكن تخزين مختبرين لمل 2 في-20 درجة مئوية لمدة 3 أشهر على الأقل. - إعداد 50 مل حل مثبط التربسين استخدام 1 ملغ/مل من (0.1%) التربسين مثبط لنوع أنا-S، وتكملة لها مع 2 ميكروغرام/مل من الدناز أنا حله في دببس تم التعديل (تم إعداده في الخطوة 1، 2). جعل مختبرين 2 مل في أنابيب بلاستيكية معقمة وتخزينها في-20 درجة مئوية حتى الاستخدام.
ملاحظة: يمكن تخزين مختبرين لمل 2 في-20 درجة مئوية لمدة 3 أشهر على الأقل.
2-إعداد المعدات
- إعداد الزجاج الماصات بنيران التلميع التلميح لتفكك الخلية. جعل نصائح مع فئات مختلفة من حجم 2 (افتتاح متوسطة من 0.6 – 0.8 ميكرومتر وفتحه صغيرة من 0.4 – 0.6 ميكرومتر) عن طريق اللعب مع الوقت والمسافة من اللهب أثناء تشغيل في نفس الوقت الماصة. مكان الماصات الزجاجية في حاوية زجاجية نظيفة والاوتوكلاف لهم (باستخدام طريقة صلبة عند 105 درجة مئوية لمدة 45 دقيقة).
- إعداد مربع البوليستيرين مع الجليد.
- إعداد أنبوب بلاستيكي مع 1.5 مل دببس المعدلة (من إعداد في الخطوة 1، 2) لنقل بيتويتاريس إلى أثناء التشريح وإبقائه على الجليد.
- إعداد أنبوب 15 مل مع 10 مل دببس المعدلة (إعداد في الخطوة 1، 2) وإبقائه على الجليد حتى تفكك الخلية.
- إعداد طازجة أو ذوبان الجليد مختبرين التربسين وحلول مثبط التربسين (أعد الخطوات 1.4 و 1.5) والاحتفاظ بها على الجليد حتى الاستخدام.
- تعيين حمام الماء إلى 26 درجة مئوية قبل البدء التشريح السماح للمياه لتصل إلى درجة الحرارة المطلوبة قبل تفكك المواد الكيميائية من بيتويتاريس.
- تنظيف جميع أدوات تشريح مع الإيثانول 70% قبل وأثناء وبعد الاستخدام، بما في ذلك الملقط خير استخدام للتشريح والإبر الدقيقة وصفيحة شمع لدبوس الأسماك. استخدام قفازات نظيفة (تغيير وتنظيف متكرر) أثناء الإجراء بأكمله لتفادي تلوث محتملة الخلايا.
3-الغدة النخامية التشريح وتفكك الخلية
- Euthanize السمك بتخبط عليه في طين الجليد (0 درجة مئوية). تترك الأسماك في طين الجليد لمدة 1 دقيقة على الأقل لضمان حدوث صدمة باردا لا رجعة فيه.
ملاحظة: سوف يحدث فقدان التوازن والتثبيت بعد بضع ثوان. تأكد من الأسماك هي مغمورة تماما في الماء المثلج ولا يكذب على رأس الجليد، والأخير سوف يؤدي إلى اختناق وحروق الجلد المحتملة بدلاً من صدمة باردا السريع وإنسانية. - بسرعة نقل الأسماك في الشباك للوحة شمع تحت مجهر التشريح وتدمير العمود الفقري بلكمة إبرة عن طريق العنق.
- دبوس رئيس الأسماك إلى لوحة الشمع باستخدام الإبر الدقيقة، بإدخال إبرة واحدة في الجبهة (عبر الفم) وواحدة على كل جانب من الرأس (خلف الدماغ) لتحقيق الاستقرار في الرأس قبل التشريح.
- عرض الأسماك تحت مجهر التشريح ولطف كشط قبالة الجداول في الجزء العلوي من الرأس استخدام الملقط غرامة مع تلميح زاوية.
- إدراج تلميح الزاوية الملقط غرامة تحت الجلد من جانب الرئيس وإزالة سقف الجمجمة التي تتحرك ببطء الملقط باتجاه الفم، وحين عقد من أحكام قبضتهم على الملقط أرفق سقف الجمجمة بعناية.
- قطع الحبل الشوكي تماما استخدام الملقط مع تلميح زاوية.
ملاحظة: الوقت عامل مهم، لذا عمل كفاءة ودقة للحد من الوقت ينفق من التشريح بيتويتاريس حتى يتم مطلي الخلايا في الطبق. بعد بعض الممارسة، تشريح الغدة النخامية وينبغي أن تأخذ حوالي 2 – 3 دقيقة لكل الأسماك، منها فقط حوالي 10 s هناك حاجة لاختيار الغدة النخامية عندما يتعرض الدماغ فعلا. - عناية الوجه المخ أكثر نحو الفم للكشف عن الغدة النخامية وتشريح أنه مع ملقط نظيف مع طرف مستقيم. نقل الغدة النخامية إلى أنبوب بلاستيك تحتوي على 1.5 مل تعديل دببس (لمزيد من التفاصيل، راجع الخطوة رقم 2، 3) على الجليد. تحقق من طرف الملقط تحت المجهر التأكد من أن الغدة النخامية هي إضافة إلى الأنبوب بنجاح ولم يبق على الملقط.
ملاحظة: تشريح العديد من بيتويتاريس حسب الحاجة، اعتماداً على عدد الأطباق الثقافة التي سوف تكون مستعدة في وقت واحد. وكقاعدة عامة، حساب بيتويتاريس 10 على الأقل من الأسماك الكبار كل طبق يكون بكثافة مناسبة للخلايا (والذي يعتمد على تطبيق المتلقين للمعلومات). - زيادة ونقصان لأسفل بيتويتاريس في أجهزة الطرد مركزي منضدية ل s 1 – 2 في درجة حرارة الغرفة. إزالة دببس استخدام ماصة زجاجية والعناية لتجنب إزالة أي بيتويتاريس بعناية.
- أضف 1 مل الحل التربسين (من إعداد في الخطوة 1، 4) تغسل في بيتويتاريس، تدور لهم أسفل في أجهزة الطرد مركزي منضدية ل s 1 – 2، وإزالة معظم السائل باستخدام ماصة زجاجية من قبل إضافة 1 مل إضافية لحل التربسين.
- احتضان الأنبوبة في حمام مائي عند 26 درجة مئوية مدة 30 دقيقة، ويفضل مع الهز لطيف، أو بدلاً من ذلك، نفض الغبار الأنبوبة عدة مرات أثناء فترة الحضانة.
- تدور أسفل بيتويتاريس في أجهزة الطرد مركزي منضدية ل s 1 – 2 في درجة حرارة الغرفة والتأكد من أن جميع بيتويتاريس وتقع في الجزء السفلي من الأنبوب. إزالة معظم الحل التربسين مع ماصة زجاجية وإضافة 1 مل الحل مثبط التربسين (إعداد في الخطوة 1، 5) إلغاء تنشيط التربسين وتغسل في بيتويتاريس.
- جمع بيتويتاريس في الجزء السفلي من الأنبوب بالغزل منهم إلى أسفل في أجهزة الطرد مركزي منضدية ل s 1 – 2 في درجة حرارة الغرفة. إزالة معظم السائل مع ماصة زجاجية وإضافة 1 مل الحل مثبط التربسين (إعداد في الخطوة 1، 5). ضع الأنبوبة في حمام مائي عند 26 درجة مئوية لمدة 20 دقيقة، يفضل مع الهز لطيف، أو بدلاً من ذلك، نفض الغبار الأنبوبة عدة مرات أثناء فترة الحضانة لإلغاء تنشيط التربسين.
- تحضير طبق ثقافة خلية بولي-د-يسين-المغلفة 35 ملم مع قاع وسط زجاج بإضافة 2 مل متوسطة L-15 والسماح باحتضانها لمالا يقل عن 10 دقيقة في 26 درجة مئوية ومع أول أكسيد الكربون 1%2 حيث أنه يمكن أن تصل درجة الحرارة الصحيحة ودرجة الحموضة قبل طلاء الخلايا.
ملاحظة: طبق ثقافة خلية بلاستيك يمكن أيضا استخدامها. والميزة الرئيسية لاستخدام طبق مع أسفل زجاج مركزي هو أن المنطقة حيث يتم مطلي الخلايا أصغر، وذلك، خلايا الغدة النخامية أقل مطلوبة من كل طبق. قد تتطلب بعض التطبيقات المصب أيضا من أسفل زجاج (أي، بعض تقنيات التصوير). - تعيين النابذة التبريد لأنابيب 15 مل إلى 4 درجة مئوية للسماح له بالوصول إلى درجة الحرارة المطلوبة قبل بدء تفكك الميكانيكية.
- جمع بيتويتاريس في الجزء السفلي من الأنبوب بالغزل أسفل الأنبوبة مع الحل مثبط التربسين (من الخطوة 3.11) في أجهزة الطرد مركزي منضدية ل s 1 – 2 في درجة حرارة الغرفة وتأكد من جميع بيتويتاريس تقع في الجزء السفلي من الأنبوب قبل بعناية إزالة معظم الحل مثبط التربسين باستخدام ماصة زجاج.
ملاحظة: تنفيذ كافة الخطوات التالية للبروتوكول في مقعد الاندفاق الصفحي (الجيش اللبناني) معتمدة لعمل الخلية لتفادي تلوث من الخلايا. - إضافة 1 مل من المثلج دببس تم التعديل (تم إعداده في الخطوة 2، 4) إلى قطع أنسجة الغدة النخامية وتمتص بلطف قطع الأنسجة صعودا وهبوطاً (6 – 7 س) في ماصة زجاج المصقول النار (أعدت في الخطوة 2، 1).
ملاحظة: درجة حرارة جانبا أساسيا، وحتى تبقى جميع الحلول في 4 درجات مئوية. من هذه النقطة فصاعدا، تنفيذ جميع الخطوات على الجليد عندما يكون ذلك ممكناً. - وتدور أسفل قطع الأنسجة في أجهزة الطرد مركزي منضدية ل s 1 – 2 في درجة حرارة الغرفة بعناية بنقل الجزء العلوي من دببس تحتوي على خلايا معزولة (تقريبا 1 مل) إلى أنبوب 15 مل جديدة المفروضة على الجليد. تجنب نقل ماصة اتجاه الجزء السفلي من الأنبوب حيث يتم ترك قطع الأنسجة.
- كرر الخطوة 3، 16 – 3.17، فصل الخلايا الموجودة في 1 مل من المثلج دببس في كل مرة، حتى يتم استخدام كل 10 مل من دببس. بدء استخدام ماصة زجاجية مع افتتاح متوسطة الحجم والتبديل إلى ماصة زجاجية مع فتحه صغيرة نهاية (لمل 3-4 آخر من دببس وأضاف) للانفصال. إذا كان هناك قطع الأنسجة لا تزال واضحة نهاية الإجراء الانفصال، زيادة بيبيتينج إلى ما يقارب 10 x نحو 2 الخطوات الأخيرة من دببس للانفصال، وأخيراً ترك قطع الأنسجة المتبقية. ريسوسبيند الخلايا بلطف وتجنب خلق فقاعات كما أنه قد يسبب تلف الخلايا عند إرفاق الخلايا إلى سطح الفقاعات.
ملاحظة: هذا هو الخطوة الحاسمة لهذا البروتوكول ويتطلب بعض التدريب لتحقيق نتيجة جيدة. - تحقيق التوازن بين الأنبوب في جهاز الطرد المركزي (قبل تبريده إلى 4 درجات مئوية) وزيادة ونقصان لأسفل الخلايا في x 200 غ لمدة 10 دقائق في 4 درجات مئوية. تأكد من وضع علامة على الجانب من الأنبوب حيث سيكون بيليه الخلية.
- بعناية إزالة الأنبوب من أجهزة الطرد المركزي ونقل بلطف المادة طافية مع ماصة زجاجية إلى أنبوب بلاستيكية فارغة 15 مل مباشرة بعد الطرد المركزي. تأكد من إزالة معظم المادة طافية ولكن الحرص لتجنب فقدان بيليه الخلية (غالباً غير مرئي) الصغيرة.
- ريسوسبيند بيليه الخلية بعناية في 50 – 100 ميليلتر من مستنبت L-15.
ملاحظة: في هذه الخطوة، من الممكن لعد الخلايا و/أو إجراء اختبار صلاحية (مثل خلية العد حضور تريبان الأزرق باستخدام هيموسيتوميتير)، ولكن حذار أن استخدام جزء من تعليق خلية لهذا الغرض سوف يخفض الغلة. تجنب استخدام وحدة تخزين تعليق كبير كما أنها سوف تزيد من خطر الخلايا نشرها خارج مركز الطبق. - بعناية بالتنقيط الخلايا معزولة في وسط الطبق ثقافة الخلية التي تحتوي على 2 مل المتوسطة L-15 (أعد الخطوة 3.13). السماح للخلايا لتنزل إلى الجزء السفلي من الطبق لمدة 5 دقائق تقريبا قبل أن ينتقل منها إلى الحاضنة، لتجنب وجود الخلايا تنتشر خارج الجزء الغارق من أسفل الزجاج.
- احتضان الطبق على 26 درجة مئوية و 1% CO2 للسماح لكافة الخلايا بالوعة دقيق ونعلق على الجزء السفلي من الطبق.
- وبعد 30 دقيقة، ننظر في الخلايا في المجهر للتأكد من أنها قد تعلق على الطبق الثقافة.
- الاستمرار في احتضان الخلايا في شركة 26 درجة مئوية و 1%2.
- تغيير بعناية معظم (ولكن ليس كلها) المتوسط كل 3 – 4 أيام.
ملاحظة: تجنب تغيير الوسيلة أكثر تواترا، كما أنها قد تخل بالخلايا وجعلها في فصل من أسفل الزجاج. استخدام الخلايا لإجراء تجارب عليها في غضون أسبوع بعد البذر منها.
النتائج
وصف إعداد ثقافة الخلية الأولية من بيتويتاريس الميداكا هذا البروتوكول وتوفير الخلايا السليمة التي يمكن الحفاظ على ثقافة لمدة أسبوع واحد على الأقل. البروتوكول يستند إلى القيم ذات الصلة الفسيولوجية الميداكا14 وهو الأمثل بالإضافة إلى ذلك إلى أنسجة الغدة النخامية في الأسماك الكبار، باستخدام الرقم الهيدروجيني 7.75 وأوسمولاليتي موسم 290/كغ خلال الإجراء بأكمله من حصاد الأنسجة مطلي الخلايا في الثقافة (الشكل 1 و الشكل 2).
يتم عرض النتائج تمثيلية من تجارب على الثقافات الخلية الأولية التي تنتجها هذا البروتوكول في الشكل 3، الرقم 4، و الرقم 5. للنتائج المعروضة هنا، خط الميداكا المحورة وراثيا، حيث تطوير هرمون (Lh)-الخلايا جونادوتروبي التعبير عن البروتينات الفلورية الخضراء (التجارة والنقل)، وتمت الاستفادة منها19. ويبين الشكل 3 حقل تمثيلاً في الطبق ثقافة الخلية الأولية من اليوم 0 لليوم السابع بعد البذر، بما في ذلك كل الصور مجهرية مشرق الميدان ونيون، تظهر الخلايا جونادوتروبي Lh معربا عن التجارة والنقل. استخدام حوالي 10 الميداكا الكبار بيتويتاريس كل طبق عادة النتائج في كثافة حوالي 5 × 104 – 1 × 105 خلايا كل طبق بعد البذر. جدوى خلايا الغدة النخامية في الثقافة يحسب على أساس العدد الإجمالي للخلايا معربا عن التجارة والنقل في الثقافة في يوم 1 و 3 و 7 بعد الطلاء، مقارنة بيوم 0 (الشكل 4). الرسم البياني هو موضح في الشكل 4 يشير إلى أن عدد الخلايا الموت تقريبا ثابتة على مر الزمن، مع ما يزيد على 95% الخلايا على قيد الحياة بعد يوم واحد، في حين أن ما يزيد على 90 في المائة لا يزال حيا بعد 3 أيام. على الرغم من أن هناك انخفاض بسيط في بقاء الخلية مع مرور الوقت، يتم معظم الخلايا (حوالي 75 ٪) لا يزال على قيد الحياة بعد أسبوع في الثقافة. التسجيلات الكهربية للخلايا جونادوتروبي Lh معربا عن التجارة والنقل (أداء كما هو موضح في Strandabø, et al.) 20 تبين أن الخلايا قادرة على إطلاق إمكانات العمل تلقائياً بعد 4 أيام في الثقافة (الشكل 5A). علاوة على ذلك، على تحفيز هرمون الإفراج – تروج، فرط الاستقطاب عابر أولية من غشاء الخلية تبعتها زيادة هائلة في إطلاق التردد الذي ملازم مع ديبولاريزيشن وزيادة مدة العمل إمكانيات (الشكل 5 (ب)).
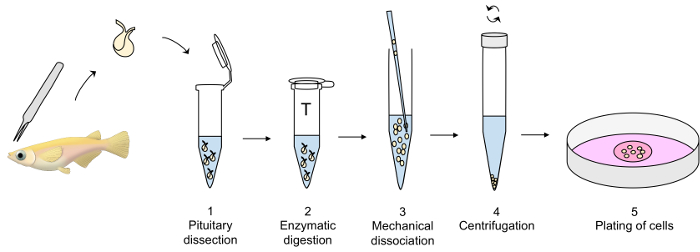
رقم 1: نظرة عامة حول تقنية الثقافة الغدة النخامية الابتدائية الخلية. بيتويتاريس هي تشريح مع الملقط الجميلة ونقلها إلى أنبوب بلاستيك التي تحتوي على دببس تم التعديل على الجليد (الخطوة 1 من البروتوكول) حتى الهضم الأنزيمي من بيتويتاريس مع التربسين في 26 درجة مئوية (الخطوة 2)، متبوعاً المنظمة مع مثبط التربسين في 26 درجة مئوية (غير معروضة). التفكك الميكانيكية من بيتويتاريس انزيماتيكالي هضمها مع ماصة زجاجية يتم بعناية في دببس على الجليد (الخطوة 3)، متبوعاً الطرد المركزي عند 4 درجة مئوية (الخطوة 4). وأخيراً، يحل بيليه خلية في المتوسط الثقافة والخلايا مطلي خارجاً في طبق ثقافة خلية (الخطوة 5). الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-

رقم 2: تفاصيل عن تشريح الغدة النخامية الميداكا. (أ) رئيس الميداكا المعطل تداولها (عرض الظهرية) مثبتة على طبق من شمع، وتتم إزالة الجزء العلوي من سطح الجمجمة بالملقط غرامة لفضح الجزء العلوي من الدماغ. يتم فصل (ب) الحبل الشوكي، والمخ انقلبت عليه نحو الجزء الأمامي الرأس مثل أن يتعرض لها الغدة النخامية. (ج) الغدة النخامية يتم جمعها مع الملقط نظيفة، وغرامة. ويشير رأس السهم إلى الغدة النخامية في لوحة ب وج. شريط المقياس = 1,000 ميكرومتر. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-

الشكل 3: الثقافة الغدة النخامية الابتدائية خلية الميداكا. إظهار هذه الألواح الاستبانة [كنفوكل] ثقافة الغدة النخامية الابتدائية خلية الميداكا الممثل في اليوم 0 واليوم 3 يوم 7 بعد البذر. تظهر اللوحة العلوية الصور مجهرية مشرق الحقل من حقل الممثل في الطبق، الفريق الأوسط يظهر الفحص المجهري نيون الصور لنفس الحقل للعرض عرض الخلايا جونادوتروبي Lh معربا عن التجارة والنقل، والفريق أقل تراكب من الاثنين. شريط المقياس = 20 ميكرومتر. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
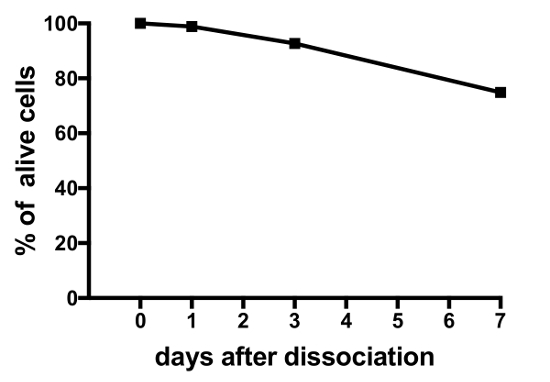
الشكل 4: جدوى النخامية الميداكا الخلايا في الثقافة- يظهر هذا الشكل بقاء ثقافات الغدة النخامية الابتدائية الخلية تقاس في اليوم 0, 1 و 3 و 7 بعد البذر. الأرقام التي يتم حسابها باستخدام برمجيات المصدر المفتوح سيلبروفيلير V2 وتستند إلى العدد الكلي للخلايا جونادوتروبي Lh معربا عن التجارة والنقل كل طبق عند نقاط زمنية مختلفة، مقارنة بالوقت 0. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
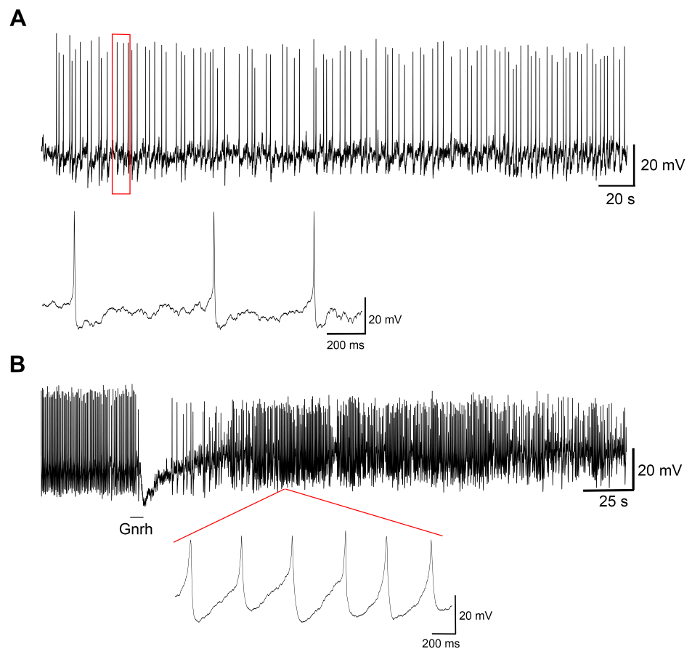
الرقم 5: التسجيلات الكهربية من خلايا الغدة النخامية. هذه اللوحات إظهار التسجيلات الكهربية من خلية جونادوتروبي Lh معربا عن التجارة والنقل في ثقافة خلية الابتدائية المنجز في اليوم الرابع بعد البذر، عرض (أ) تتبع ممثل من إمكانات العمل العفوي، تليها (ب) التحفيز مع تروج – الإفراج عن هرمون Gnrh1 لمدة 10 ق. التحفيز Gnrh1 يستحث استجابة ثنائية الطور مع فرط الاستقطاب في غشاء الخلية، تليها ديبولاريزيشن وزيادة المدة لإمكانات العمل (يتم قياسها في ذروة 50 ٪) من 8.9 ± 3.0 مرض التصلب العصبي المتعدد قبل التنشيط إلى 29.2 ± ms 9.9 بعد التحفيز. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
Discussion
في المختبر خلية ثقافة أنظمة توفر أدوات قوية للباحثين للإجابة على عدد كبير أسئلة البيولوجية المختلفة إذا ما استخدمت ب الطريقة الصحيحة1. من المهم أن نتذكر أن ينتابها الخلايا التي فقدوا صلاتهم بالخلايا المجاورة قد حصلوا على خصائص وظيفية مختلفة مما كانت أصلاً في فيفو. لتجنب التعرض لخطر إساءة تفسير النتائج المستخلصة من تجارب في المختبر ، من المهم النظر في تعديل الإجراء ثقافة الخلية الأولية لنوع الأنواع وخلية للفائدة. التعديلات حتى المعتدل من الإجراءات القياسية الثقافة والحلول المستخدمة غالباً ما تكون كافية لعميق يغير شروط ثقافة من نوع الخلية المحددة.
ويصف هذا البروتوكول الظروف الأمثل لإعداد وصيانة الثقافات الخلية الأولية من بيتويتاريس الميداكا الكبار، التي يمكن أن يتحقق عن طريق ضبط معلمات مثل أوسمولاليتي ودرجة الحموضة، درجة الحرارة و pCO2 الحلول المستخدمة، إلى تطابق الشروط الفيزيولوجية لهذه الأنواع. هو درجة الحرارة تعتمد درجة الحموضة و، ولذلك أيضا أن تعدل بين الأنواع المختلفة من الأسماك تيليوست التي تعيش في درجات حرارة مختلفة17. ينبغي أيضا تعديل osmolality جميع الحلول المستخدمة أثناء تفكك الخلية واستزراع بغية تحسين حالة الخلايا. خاصة، إذا كان هناك اختلاف في أوسمولاليتي بين مختلف الحلول المستخدمة أثناء الإجراء العزلة، فإنه يمكن أن يكون لها آثار مدمرة على نوعية الثقافة، مما أدى إلى استمرارية انخفاض (نتائج صاحبي الخاصة غير منشورة). سوف يسبب حلول الملين الخلايا إلى انكماش (و العكس بالعكس)، وبالتالي التدخل في سلامة الأغشية وغشاء بروتين الدالة21. نقطة هامة في هذا السياق أن المعلمات مثل أوسمولاليتي والحموضة ليست عادة ما يقاس ولا مستقرة بين مجموعات مختلفة من المخازن التجارية وثقافة وسائل الإعلام المستخدمة في ظروف الثقافة الثدييات. وينبغي تجنب الاختلافات في أوسمولاليتي والحموضة بين مختلف الحلول المستخدمة أثناء إجراء العزل في جميع الأوقات.
تحسين معدل نجاح هذا البروتوكول بالتدريب، حيث أنه من المتوقع الباحثين بحاجة إلى بعض الوقت للتعرف على الخطوات المختلفة لهذه التقنية. على سبيل المثال، الوقت من تشريح بيتويتاريس حتى يتم مطلي الخلايا في الطبق ارتباطاً عكسيا بصحة الخلية. التفكك الميكانيكية من بيتويتاريس استخدام ماصة زجاجية خطوة حاسمة بشكل خاص للبروتوكول وأنه يتطلب بعض التدريب لتحقيق نتيجة جيدة. يمكن إدخال إجراءات الانفصال من الإجهاد ناضح والميكانيكية التي تعتبر ضارة بالخلايا. إضافة كميات صغيرة من دببس معدلة في الخطوات المتكررة للانفصال الميكانيكية يضمن إجراء الانفصال الطف حيث نقل الخلايا منفصلان فعلا إلى الأنبوب الجديد واليسار لم يمسها، بينما يواصل الباحث فصل خلايا إضافية من الأنسجة في وحدة تخزين جديدة من دببس.
هذا البروتوكول هو الأمثل لخلايا الغدة النخامية الميداكا الكبار. الأنواع المختلفة أو الأنسجة، أو مراحل الحياة المختلفة حتى الحيوان داخل النسيج نفسه تتطلب تحسينات لظروف الثقافة. على سبيل المثال، قد تكون الخلايا التي تم الحصول عليها من الحيوانات غير ناضجة أكثر هشاشة، وبالتالي أكثر عرضه للمبرمج وخلية الموت، وهكذا، قد تقتضي الحاجة إلى تعديل البروتوكول، ولا سيما تجاه إجراء الانفصال الطف. التفكك الميكانيكية باستخدام ماصة زجاجية خطوة حاسمة جداً من الإجراءات، تفكك ميكانيكية حذراً للغاية سوف يؤدي إلى ربح أقل، بينما قد حمل أحد الخام جداً الموت المبرمج و/أو الخلية. إذا كانت تعتبر الإنزيمات المختلفة للانفصال، فإنه قد يكون من الضروري استخدام تركيز الوقت وإنزيم هضم مختلفة. بيتويتاريس الميداكا صغيرة جداً وسهلة نسبيا لننأى باستخدام بروتوكول وصف. ومع ذلك، قد تتطلب تحسينات للأنواع الأخرى استخدام عامل تصفية شبكة بعد الانفصال لإزالة الحطام. ويتوقف نجاح هذا البروتوكول أيضا إلى حد كبير على تنفيذ الخطوات تحت ظروف معقمة لتجنب تلويث الخلايا.
عدد الخلايا للبذور في الطبق يعتمد على عدد بيتويتاريس في البداية، فضلا عن نجاح إجراءات الانفصال. هناك ما يقرب حوالي 15,000 الخلايا في الغدة النخامية سليمة الميداكا الكبار. ومع ذلك، الخلايا يتم فقدان أثناء عملية الانفصال وهذا ينبغي أن يستأثر عند حساب عدد بيتويتاريس اللازمة لتجربة. استخدام بيتويتاريس على الأقل 10 كل طبق سينتج عادة بكثافة حول الخلايا 50,000 – 100,000 كل طبق. في هذه الكثافة، التجميع لا تشكل في أي مبلغ كبير، حتى بعد 7 أيام في الثقافة. ملحوظ، التجميع ويبدو أن كثافة تتوقف، أكثر كثافة المصنف الخلايا، كلما يبدو أنها تجميع. قد تتطلب بعض الإجراءات ثقافة أكثر كثافة، وذلك، ينبغي النظر في كثافة البذر الأمثل اعتماداً على التطبيق المتلقين للمعلومات. أنها نقطة مهمة تأخذ في الاعتبار عند التخطيط لعدد بيتويتاريس استخدام كل طبق.
تطبيقات المتلقين للمعلومات الأكثر شيوعاً استخدام الثقافات الخلية الأولية خلال الأيام القليلة الأولى بعد البذر. وتبين النتائج المعروضة هنا، من بقاء الخلية إلى التسجيلات الكهربية، أنه من الممكن الحصول على نتائج جيدة من الثقافات الخلية الابتدائية المعدة باستخدام بروتوكول وصف لمدة تصل إلى أسبوع واحد بعد البذر. ومع ذلك، الثقافات يمكن الإبقاء على فترة أطول، والخلايا السليمة لا تزال موجودة بعد أكثر من أسبوعين في الثقافة (نتائج صاحبي الخاصة غير منشورة). الأمثل الشروط الواردة في هذا البروتوكول يسهل نتائج مجدية من الناحية الفسيولوجية وقد تكون مفيدة لغيرهم من العلماء إعداد الثقافات الابتدائية خلية من خلايا غير الثدييات.
Disclosures
الكتاب ليس لها علاقة بإعلان.
Acknowledgements
تم تمويل هذا المشروع من جامعة النرويج لعلوم الحياة ومجلس البحوث في النرويج، رقم المنحة 243811 و 244461 (برنامج تربية الأحياء المائية). ونحن ممتنون للورد كاريون تان في جامعة النرويج لعلوم الحياة لصيانة المرفق الأسماك.
Materials
| Name | Company | Catalog Number | Comments |
| Dulbecco’s Phosphate Buffered Saline (dPBS), without calcium chloride and magnesium chloride | Sigma (Merck, Damstadt, Germany) | D8537 | Adjust solution to pH 7.75 with 1M NaOH and 290 mOsm with mannitol. |
| L-15 medium (Leibovitz), witout L-glutamine | Sigma (Merck, Damstadt, Germany) | L5520 | Supplement 500 ml culture medium with 10mM NaHCO3, 4.5 mM glucose, 2 mM Glutamax. Adjust solution to 290 mOsm with mannitol and filter solution through a 0.2 µm PES sterile filter, before adding 2.5 ml Penicillin-Streptomycin solution (see below for details). |
| NaOH | Sigma (Merck, Damstadt, Germany) | S5881 | Add drops of 1M solution to increase pH of dPBS and culture medium to 7.75. |
| NaHCO3 | Sigma (Merck, Damstadt, Germany) | S5761 | 10 mM NaHCO3 equals 420 mg per 500 ml culture medium. |
| D-mannitol | Sigma (Merck, Damstadt, Germany) | 63565 | Use to increase osmolality of dPBS and culture medium. Calculate correct amount needed to reach an osmolality of 290 mOsm. |
| D-glucose | Sigma (Merck, Damstadt, Germany) | G5400 | 4.5 mM D-glucose equals 405 mg per 500 ml culture medium. |
| GlutaMAX Supplement | Gibco (Life Technologies, Paisley, UK) | 35050-061 | Alternative to L-glutamine, with increased stability. 2 mM Glutamax equals 5 ml of 100X stock in 500 ml culture medium. |
| Penicillin-Streptomycin | Sigma (Merck, Damstadt, Germany) | P0781 | Stock solution 10,000 units penicillin and 10 mg streptomycin per mL. Use 2.5 ml of stock solution in 500 ml L-15 medium (equivalent of 50 U/ml Penicillin and 50 µg/ml Streptomycin). |
| Trypsin type II-S | Sigma (Merck, Damstadt, Germany) | T7409 | Prepare 1 mg/ml in dPBS solution. |
| Trypsin inhibitor type I-S | Sigma (Merck, Damstadt, Germany) | T6522 | Prepare 1 mg/ml in dPBS solution, supplement with 2 µg/ml Dnase I (see details below). |
| Dnase I | Sigma (Merck, Damstadt, Germany) | D5025 | Use in trypsin inhibitor solution (see above). |
| 0.2 µm Polyethersulfone (PES) sterile filter system | Corning Inc. (Corning, NY) | 431097 | Use for sterile filtration of dPBS and L-15 medium after adjustments. |
| 35 mm cell culture dish with glass bottom, poly d-lysine coated | MatTek Corporation (Ashland, MA) | P35GC-1.5-10-C | Can also be replaced by plastic dish, depending on downstream application. |
| Dumont #5 fine forceps | Fine Science Tools (CA) | 11254-20 | Straigt tip |
| Dumont #5/45 fine forceps | Fine Science Tools (CA) | 11253-25 | Angled 45° tip |
| Stereo microscope SZ61 | Olympus Corp. (Tokyo, Japan) | Use for dissection of pituitaries. | |
| Alegra X-22R Centrufuge | Beckman Coulter Inc. (Brea, CA) | With cooling option (similar to current model XR-30). | |
| Water bath | Techne (Staffordshire, UK) | Any water bath with the possibility of adjusting temperature will do. | |
| Pasteur glass pipettes | VWR (NY) | 612-1701 | Outer diameter 1.6 mm, fire polish and autoclave before use. |
| Galaxy MiniStar table centrifuge | VWR (NY) | 521-2844 | Any small table centrigue will do. |
| Fine needles / insect pins | Fine Science Tools (CA) | 26001-40 | Diameter 0.03 mm. Other fine needles can be used instead. |
| Wax plate | Custom made by adding melted paraffin wax in large petri dish. |
References
- Freshney, R. I. . Culture of Animal Cells: A Manual of Basic Technique and Specialized Applications. , (2010).
- Ribeiro, L. P., Ahne, W. Fish cell culture: initiation of a line of pituitary cells from carp (Cyprinus carpio) to study the release of gonadotropin in vitro. In Vitro. 18 (5), 419-420 (1982).
- Ribeiro, L., Ahne, W., Lichtenberg, V. Primary culture of normal pituitary cells of carp (Cyprinus carpio) for the study of gonadotropin release. In Vitro. 19 (1), 41-45 (1983).
- Wong, A. O., Ng, S., Lee, E. K., Leung, R. C., Ho, W. K. Somatostatin inhibits (d-Arg6, Pro9-NEt) salmon gonadotropin-releasing hormone- and dopamine D1-stimulated growth hormone release from perifused pituitary cells of chinese grass carp, Ctenopharyngodon idellus. General and Comparative Endocrinology. 110 (1), 29-45 (1998).
- Chang, J. P., et al. Use of a pituitary cell dispersion method and primary culture system for the studies of gonadotropin-releasing hormone action in the goldfish, Carassius auratus. I. Initial morphological, static, and cell column perifusion studies. General and Comparative Endocrinology. 77 (2), 256-273 (1990).
- Weil, C., Hansen, P., Hyam, D. Use of pituitary cells in primary culture to study the secretion in rainbow-trout - Setting up and validating the system as assessed by its responsiveness to mammalian and salmon gonadotropin-releasing hormone. General and Comparative Endocrinology. 62 (2), 202-209 (1986).
- Montero, M., LeBelle, N., Vidal, B., Dufour, S. Primary cultures of dispersed pituitary cells from estradiol-pretreated female silver eels (Anguilla anguilla L): Immunocytochemical characterization of gonadotropic cells and stimulation of gonadotropin release. General and Comparative Endocrinology. 104 (1), 103-115 (1996).
- Xu, S. H., Cooke, I. M. Voltage-gated currents of tilapia prolactin cells. General and Comparative Endocrinology. 150 (2), 219-232 (2007).
- Lin, S. W., Ge, W. Differential regulation of gonadotropins (FSH and LH) and growth hormone (GH) by neuroendocrine, endocrine, and paracrine factors in the zebrafish-An in vitro approach. General and Comparative Endocrinology. 160 (2), 183-193 (2009).
- Hodne, K., von Krogh, K., Weltzien, F. A., Sand, O., Haug, T. M. Optimized conditions for primary culture of pituitary cells from the Atlantic cod (Gadus morhua). The importance of osmolality, pCO2, and pH. General and Comparative Endocrinology. 178 (2), 206-215 (2012).
- Wittbrodt, J., Shima, A., Schartl, M. Medaka - a model organism from the far East. Nature Reviews Genetics. 3, 53-64 (2002).
- Matsuda, M., et al. DMY is a Y-specific DM-domain gene required for male development in the medaka fish. Nature. 417 (6888), 559-563 (2002).
- Kasahara, M., et al. The medaka draft genome and insights into vertebrate genome evolution. Nature. 447 (7145), 714-719 (2007).
- Miyanishi, H., Inokuchi, M., Nobata, S., Kaneko, T. Past seawater experience enhances seawater adaptability in medaka, Oryzias latipes. Zoological Letters. 2 (12), (2016).
- Waymouth, C. Osmolality of mammalian blood and of media for culture of mammalian cells. In Vitro. 6 (2), 109-127 (1970).
- Cameron, J. N. Acid-base homeostasis - past and present perspectives. Physiological Zoology. 62 (4), 845-865 (1989).
- Claiborne, J. B., Edwards, S. L., Morrison-Shetlar, A. I. Acid-base regulation in fishes: cellular and molecular mechanisms. Journal of Experimental Zoology. 293 (3), 302-319 (2002).
- Perry, S. F., Tufts, B. L. . Fish respiration. , (1998).
- Hildahl, J., et al. Developmental tracing of luteinizing hormone β-subunit gene expression using green fluorescent protein transgenic medaka (Oryzias latipes) reveals a putative novel developmental function. Developmental Dynamics. 241 (11), 1665-1677 (2012).
- Strandabø, R. A. U., et al. Signal transduction involved in GnRH2-stimulation of identified LH-producing gonadotropes from lhb-GFP transgenic medaka (Oryzias latipes). Molecular and Cellular Endocrinology. 372 (1-2), 128-139 (2013).
- Verbalis, J. G. Brain volume regulation in response to changes in osmolality. Neuroscience. 168 (4), 862-870 (2010).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved