Method Article
Preparación de un cultivo de alta calidad primaria celular de peces Pituitaries
En este artículo
Resumen
Aquí se describe un protocolo para preparar y mantener cultivos primarios de células hipofisarias de medaka (Oryzias latipes). Las condiciones optimizadas en este protocolo consideren parámetros importantes como la temperatura, osmolaridad y pH imitando las condiciones fisiológicas de los peces, permitiendo resultados fisiológico más significativos.
Resumen
Cultivo celular primario es una potente herramienta comúnmente utilizada por los científicos para estudiar propiedades celulares y mecanismos de las células aisladas en un entorno controlado. A pesar de grandes diferencias en la fisiología entre mamíferos y peces, protocolos de cultura de célula primaria del pescado se basan a menudo en condiciones de cultivo mamíferos, a menudo con sólo pequeñas modificaciones. Las diferencias ambientales afectan no sólo la temperatura corporal, sino también parámetros de suero de sangre como la osmolalidad, pH y capacidad amortiguadora de pH. Como medios de cultivo celular y similares soluciones de trabajo están pensadas para mímico las características del líquido extracelular y/o suero de la sangre a la que una célula se adapta, es crucial que estos parámetros se ajustan específicamente al animal en cuestión.
El protocolo actual describe las condiciones optimizadas en cultivo primario de medaka (Oryzias latipes). El protocolo proporciona pasos detallados sobre cómo aislar y mantener saludable disociaron las células pituitarias durante más de una semana e incluye los siguientes pasos: 1. la regulación de la osmolalidad a los valores encontrados en el plasma sanguíneo de medaka, 2. el ajuste de la temperatura de incubación a temperatura de medaka normal (aquí en las instalaciones de acuario) y 3. el ajuste del buffer de pH y bicarbonato a valores comparables a otras especies de peces que viven a temperaturas similares. Los resultados presentados utilizando el protocolo descrito promoción resultados fisiológicamente significativas de medaka y pueden ser utilizados como una guía de referencia por los científicos hacer cultivos celulares primarios de células de otras especies de animales no mamíferos.
Introducción
Cultivo de células es uno de los principales instrumentos utilizados en la investigación biológica molecular, proporciona un sistema modelo excelente para responder a diferentes cuestiones biológicas que van desde la fisiología celular normal a drogas proyección y carcinogénesis1. Células primarias, aisladas de los tejidos animales mediante métodos enzimáticos o mecánicos, a menudo se consideran biológicamente más relevantes que las líneas celulares como la respuesta biológica puede estar más cerca de la situación en vivo . Protocolos para la preparación de cultivos celulares primarios deben ser optimizados para cada tipo de célula y especies de interés para imitar las características para que una célula se adapta y obtener resultado fisiológico significativo.
Numerosos protocolos describen las condiciones de cultivo para los sistemas de células de mamífero, mientras que protocolos similares que describen las condiciones de cultivo primario de células de peces son bastante escasos en comparación. Las células son vulnerables a cambios rápidos de temperatura, el pH y la osmolalidad y son particularmente frágiles durante el procedimiento de disociación. Soluciones de sal comerciales y medios de cultivo utilizados para los cultivos de células de mamífero no son óptimos para los peces teleósteos, especialmente en términos de sistemas tampón de pH y la osmolalidad. Por lo tanto, es importante medir y ajustar las soluciones a niveles fisiológicamente relevantes de estos parámetros en las especies de interés.
Se hicieron cultivos hipofisarios primarios de varias especies de peces teleósteos, como la carpa común (carpio de Cyprinus)2,3, hierba (Ctenopharyngodon idella)4, goldfish (Carassius auratus dela carpa )5, trucha arco iris (Oncorhynchus mykiss)6,7de anguila europea (Anguilla anguilla), tilapia (Oreochromis mossambicus)8, pez cebra (Danio rerio)9, y Bacalao Atlántico (Gadus morhua)10. Aparte de ajustar la temperatura de incubación para las especies de interés, varios de estos protocolos incuban las células en condiciones similares a mamíferos que pueden ser subóptimas para la especie de interés, con un pH de 7.2 a 7.5 en un ambiente humidificado que contiene 3-5% CO2. Además, es confuso si la osmolalidad de las soluciones utilizadas para la preparación de varios de estos cultivos celulares primarios de células se ajustaron y estable entre diferentes soluciones.
El actual protocolo se basa en trabajos previos con cultivos primarios de bacalao del Atlántico10 y cuenta con ajustes de temperatura de incubación, osmolalidad, pH y sistemas buffer de pH, incluyendo la presión parcial de dióxido de carbono (pCO2), a la fisiología de medaka (o. latipes). Medaka es pequeña (3 – 4 cm) pez de agua dulce, nativo de Asia oriental. Estos días, se utiliza como una especie de modelo en muchos laboratorios de investigación alrededor del mundo, ya que es relativamente fácil de criar y muy resistente a muchos comunes peces enfermedades11. Hay varias ventajas de utilizar medaka como un modelo, incluyendo una tolerancia a la temperatura de 4 – 40 ° C11, un tiempo de generación corto, embriones transparentes, una determinación de sexo genética12y un genoma secuenciado13, así como muchos otros recursos genéticos disponibles.
Las condiciones de cultivo primario en este protocolo están optimizadas para que coincida con la temperatura de 26 ° C que medakas se mantienen en el fondo de pescado. Además, la osmolalidad es reducida de 320 mOsm/kg de bacalao del Atlántico viven en agua salada a 290 mOsm/kg para medaka viven en agua dulce y está de acuerdo con la osmolalidad normal del plasma de medaka14. En comparación, el típico osmolalidad del plasma mamífero está en el rango de 275 a 295 mOsm15. Vive en una gran variedad de temperaturas los peces y tienen branquias que están en contacto directo con agua, lo que la capacidad tampón y pH de la sangre y el líquido extracelular en peces diferentes de los de mamíferos. Medios de cultivo de mamíferos suelen incluir sistemas de tampón que se producir en un pH de aproximadamente 7.4 los medios de comunicación están equilibrados para una atmósfera estándar de 5% CO2 en aire humidificado a 37 ° C. El pH es dependiente de la temperatura y el valor de pH neutro (en agua) aumenta con una disminución de la temperatura16. PH del plasma de peces teleósteos típico oscila entre 7.7 y 7.917. La optimización de este protocolo incluye una reducción de pH 7.85 bacalao mantenido a 12 º C a pH 7.75 medaka mantenida a 26 ° C al aumentar el CO2 de 0,5% a 1%.
Además, la capacidad de buffer de bicarbonato es muy diferente en los peces y mamíferos. CO2 se intercambian fácilmente por las branquias en los peces y la pCO2 en agua es sólo una pequeña fracción de la pCO2 en el pulmón18. Cambio de la temperatura o la pCO2 va a cambiar el pH y el tampón del medio. En consecuencia, ni el pH ni la pCO2 se recomienda para la incubación de células de mamíferos es óptimo para las células de los peces, y por lo tanto, los medios de cultivo debe ser optimizado con sistemas buffer que contiene los valores fisiológicamente relevantes para los peces y la especie particular de interés. Este protocolo describe cómo preparar cultivos celulares primarios de células de pituitaries medaka e incluir ajustes de la incubación temperatura, osmolaridad, pH y pH buffer sistema, además de otros parámetros importantes a considerar cuando se prepara la célula primaria cultivos de especies no mamíferos.
Protocolo
Los experimentos con animales realizados en este estudio fueron aprobados por la Universidad Noruega de Ciencias de la vida, las siguientes pautas para el cuidado y bienestar de los animales de investigación.
1. preparación de soluciones
- Calibrar los instrumentos de metro osmómetro y pH según las instrucciones del fabricante para asegurar medidas correctas.
-
Preparar 500 mL de Ca2 +- y Mg2 +-libre con tampón fosfato salino de Dulbecco (dPBS), ajustar el pH a 7.75 (paso 1.2.1) y la osmolalidad de 290 mOsm/kg (paso 1.2.2) antes de una filtración estéril (paso 1.2.3).
- Ajustar el pH a 7.75 con un medidor de pH calibrado añadiendo con cuidado gotas de una solución de NaOH de 1 M agitando cuidadosamente la solución.
- Medir la osmolalidad de la solución utilizando un osmómetro calibrado y calcular la cantidad de manitol necesario para aumentar la osmolalidad de 290 mOsm/kg. Añada la cantidad necesaria de manitol y luego medir la osmolalidad de la solución para asegurar el ajuste correcto.
Nota: La cantidad de manitol necesitada depende de la osmolalidad medida, que generalmente varía entre diferentes lotes. Una molécula de manitol equivale a 1 partícula osmótica. - Filtro estéril la solución dPBS usando un filtro de 0.2 μm.
Nota: La solución puede almacenarse a 4 ° C durante al menos 3 meses.
- Preparar 500 mL de medio de cultivo de Leibovitz (L-15) sin L-glutamina y bicarbonato y complementar con 10 mM NaHCO3 (paso 1.3.1), 4,5 mM de glucosa (paso 1.3.2) y glutamina disponibles en el mercado de 2 mM (paso 1.3.3). Ajustar la solución a 290 mOsm/kg (paso 1.3.4), filtro estéril (paso 1.3.5) y añadir 2,5 mL de una solución de penicilina-estreptomicina (paso 1.3.6).
Nota: La solución puede conservarse a 4 ° C durante al menos 4 semanas.- Añadir 420 mg de NaHCO3 por 500 mL de medio de cultivo para lograr una solución de 10 mM.
- Añadir 405 mg de glucosa por cada 500 mL de medio de cultivo para lograr una solución de 4,5 mM.
- Añadir 5 mL de 100 acciones de x de una solución de glutamina en 500 mL de medio de cultivo para lograr una solución de 2 mM. Revolver hasta que los solutos se disuelven.
- Ajustar la solución a 290 mOsm/kg con manitol utilizando un osmómetro (ya que se realiza en el paso 1.2.2).
- Realizar una filtración estéril del medio L-15 usando un filtro μm 0.2.
- Después de la filtración estéril, añadir 2,5 mL de una solución de penicilina-estreptomicina, correspondiente a 50 U/mL de penicilina y 50 μg/mL de estreptomicina.
- Preparar 50 mL de una solución de tripsina utilizando 1 mg/mL (0,1%) tipo de tripsina QUE II-S se disuelve en la dPBS modificado (preparado en el paso 1.2). Hacer alícuotas de 2 mL en tubos de plástico estériles y almacenarlos a-20 ° C hasta su uso.
Nota: Partes alícuotas de 2 mL pueden almacenarse a-20 ° C durante al menos 3 meses. - Preparar 50 mL de una solución de inhibidor de tripsina utilizando 1 mg/mL (0,1%) tripsina inhibidor tipo I-S y complementar con 2 μg/mL de DNasa disuelto en la dPBS modificado (preparado en el paso 1.2). Hacer alícuotas de 2 mL en tubos de plástico estériles y almacenarlos a-20 ° C hasta su uso.
Nota: Partes alícuotas de 2 mL pueden almacenarse a-20 ° C durante al menos 3 meses.
2. preparación de equipos
- Pipetas de vidrio para preparar fuego pulido la punta para la disociación celular. Hacer sugerencias con 2 categorías de diverso tamaño (una abertura media de 0,6 – 0,8 μm y una pequeña abertura de 0,4 – 0,6 μm) jugando con el tiempo y la distancia de la llama mientras al mismo tiempo gira la pipeta. Colocar las pipetas de vidrio en un recipiente limpio de vidrio y autoclave (usando el modo sólido a 105 ° C por 45 min).
- Preparar una caja de poliestireno con hielo.
- Preparar un tubo de plástico con 1,5 mL de dPBS modificado (preparado en el paso 1.2) para transferir los pituitaries a durante la disección y mantenerlo en hielo.
- Preparar un tubo de 15 mL con 10 mL de dPBS modificado (preparado en el paso 1.2) y mantener en hielo hasta la disociación celular.
- Preparar frescos o descongelar las alícuotas de la tripsina y soluciones de inhibidor de tripsina (preparadas en pasos 1.4 y 1.5) y mantenerse en hielo hasta su uso.
- Establecer el baño de agua a 26 ° C antes de iniciar la disección para permitir que el agua alcance la temperatura deseada antes de la disociación química de los pituitaries.
- Limpie todas las herramientas de disección con etanol al 70% antes, durante y después del uso, incluyendo Pinzas finas para utilizar para que la disección y agujas finas y una placa de cera para los peces. Usar guantes limpios (cambiar y limpiar con frecuencia) durante todo el procedimiento para evitar una posible contaminación de las células.
3. pituitaria disección y disociación celular
- Eutanasia el pescado sumergiéndolo en hielo molido (0 ° C). Dejar el pescado en hielo molido para al menos 1 minuto para un choque hipotérmico irreversible.
Nota: Pérdida de equilibrio y la inmovilización se producirá después de unos segundos. Asegúrese de que el pescado esté totalmente sumergido en el agua con hielo y no mentir sobre el hielo, este último dará lugar a la asfixia y quemaduras de piel potenciales en lugar de un choque hipotérmico rápido y protectora de animales. - Rápida transferencia de los peces en una red para una placa de cera bajo el microscopio de disección y destruir la espina dorsal por un golpe de la aguja a través del cuello.
- Perno de la cabeza de los peces a la placa de cera con agujas finas, insertando una aguja en la parte delantera (en la boca) y uno a cada lado de la cabeza (detrás del cerebro) para estabilizar la cabeza antes de la disección.
- Ver los peces bajo el microscopio de disección y Raspe suavemente las escamas en la parte superior de la cabeza con unas pinzas finas con una punta en ángulo.
- Cuidadosamente insertar la punta en ángulo de las pinzas finas debajo de la piel por el lado de la cabeza y quitar el techo del cráneo moviendo lentamente el fórceps en la dirección de la boca, mientras mantiene un agarre firme a las pinzas que encierra el techo del cráneo.
- Cortar la médula espinal completamente con unas pinzas con la punta en una ángulo.
Nota: El tiempo es un factor importante, así que trabajar eficientemente y con precisión limitar el tiempo pasado de la disección de los pituitaries hasta que las células se platean en el plato. Después de alguna práctica, disección hipofisaria debe tomar alrededor de 2 a 3 minutos por peces, de los cuales sólo alrededor de 10 s se necesitan para la pituitaria cuando el cerebro ya está expuesto. - Cuidadosamente voltee el cerebro a la boca para exponer la glándula pituitaria y diseccionar con pinzas limpias con una punta recta. Transferencia de la glándula pituitaria a un tubo plástico que contiene 1,5 mL modificado dPBS (para más detalles, consulte el paso 2.3) colocados en hielo. Compruebe la punta de las pinzas bajo el microscopio para asegurarse de que la hipófisis se agrega correctamente al tubo y nada queda en el fórceps.
Nota: Disecar pituitaries tantas como sea necesario, dependiendo del número de platos de la cultura que van a ser preparados al mismo tiempo. Como regla general, calcular por lo menos 10 pituitaries de peces adultos por plato para tener una densidad adecuada de las células (que depende de la aplicación aguas abajo). - Desactivación de los pituitaries en una centrífuga de mesa para 1 – 2 s a temperatura ambiente. Cuidadosamente Quite la dPBS utilizando una pipeta de vidrio y evitar retirar cualquier pituitaries.
- Añadir 1 mL de la solución de tripsina (preparada en el paso 1.4) para lavar los pituitaries, los hace girar hacia abajo en una centrífuga de mesa para 1 – 2 s y eliminar la mayor parte del líquido con una pipeta de vidrio antes de agregar un 1 mL adicional de solución de tripsina.
- Incubar el tubo en un baño de agua a 26 ° C durante 30 minutos, preferiblemente con agitación suave, o alternativamente, mueva el tubo un par de veces durante el período de incubación.
- Desactivación de los pituitaries en una centrífuga de mesa para 1 – 2 s a temperatura ambiente y asegúrese de que pituitaries todos se encuentran en la parte inferior del tubo. Eliminar la mayor parte de la solución de tripsina con una pipeta de vidrio y añada 1 mL de la solución de inhibidor de tripsina (preparada en el paso 1.5) para inactivar la tripsina y lavar los pituitaries.
- Recoger los pituitaries en la parte inferior del tubo haciendo girarlos abajo en una centrífuga de mesa para 1 – 2 s a temperatura ambiente. Eliminar la mayor parte del líquido con una pipeta de vidrio y añada 1 mL de la solución de inhibidor de tripsina (preparada en el paso 1.5). Coloque el tubo en un baño de agua a 26 ° C durante 20 minutos, preferiblemente con agitación suave, o alternativamente, mueva el tubo un par de veces durante el período de incubación para inactivar la tripsina.
- Preparar una placa de cultivo celular poly-d-lisina-revestida de 35 mm con fondo de vidrio central agregando 2 mL de medio de L-15 y dejar incubar durante al menos 10 minutos a 26 ° C y con 1% de CO2 por lo que puede llegar a la temperatura y el pH antes de platear las células.
Nota: Una placa de cultivo de células de plástico también puede ser utilizada. La principal ventaja de usar un plato con fondo de vidrio centralizado es que el área donde se platean las células es menor, y por lo tanto, menos las células pituitarias son necesarias por plato. Algunas aplicaciones posteriores pueden requerir también un fondo de cristal (es decir, algunas técnicas de imagen). - Establecer la centrifugadora de enfriamiento de los tubos de 15 mL a 4 ° C permite alcanzar la temperatura deseada antes de iniciar la disociación mecánica.
- Recoger los pituitaries en la parte inferior del tubo de giro hacia abajo el tubo con la solución de inhibidor de tripsina (de paso 3.11) en una centrífuga de mesa para 1 – 2 s a temperatura ambiente y asegúrese de que pituitaries todos se encuentran en la parte inferior del tubo antes de cuidadosamente extracción de la mayor parte de la solución de inhibidor de tripsina utilizando una pipeta de vidrio.
Nota: Realice todos los pasos del protocolo en un banco de flujo laminar (LAF) certificados para que el trabajo de la célula evitar la contaminación de las células. - Añadir 1 mL de dPBS modificadas helados (preparado en el paso 2.4) a las piezas de tejido pituitario y aspirar suavemente las piezas de tejido arriba y abajo (6 – 7 x) en una pipeta de vidrio pulidas a fuego (preparada en el paso 2.1).
Nota: La temperatura es un aspecto esencial, así que mantenga todas las soluciones a 4 º C. Partir de este momento, realizar todos los pasos en el hielo siempre que sea posible. - Desactivación de las piezas de tejido en una centrífuga de mesa para 1 – 2 s a temperatura ambiente y transferir cuidadosamente la parte superior de la dPBS que contiene las células disociadas (casi 1 mL) a un nuevo tubo de 15 mL a hielo. Evite mover la pipeta hacia la parte inferior del tubo donde se dejan los pedazos de tejido.
- Repita el paso 3.16, 3.17, disociar las células en 1 mL de dPBS helada a la vez, hasta los 10 mL de dPBS. Comenzar a usar una pipeta de vidrio con una abertura de tamaño mediano y a una pipeta de vidrio con una abertura más pequeña hacia el final (para el último 3 – 4 mL de dPBS añadido) de la disociación. Si hay pedazos de tejido todavía visible hacia el final del procedimiento de disociación, aumentar el pipeteo de aproximadamente 10 x hacia los 2 últimos pasos de dPBS de disociación y finalmente dejar las piezas de tejido residual. Resuspender suavemente las células y evitar la creación de burbujas ya que puede causar daño celular cuando las células se unen a la superficie de las burbujas.
Nota: Este es un paso crítico de este protocolo y requiere algo de entrenamiento para lograr un buen resultado. - Equilibrar el tubo en la centrífuga (previamente enfriado a 4 ° C) y rotación de las células a 200 x g durante 10 min a 4 ° C. Asegúrese de marcar el lado del tubo donde va a ser el precipitado de células.
- Retire con cuidado el tubo de la centrífuga y suavemente transferir el sobrenadante con una pipeta de vidrio de un tubo de plástico vacía 15 mL directamente después de la centrifugación. Asegúrese de eliminar la mayor parte del sobrenadante, pero tenga cuidado de no perder el precipitado de células (a menudo invisible) pequeño.
- Con cuidado Resuspender el precipitado de células en 50 – 100 μl de medio de cultivo L-15.
Nota: En este paso, es posible contar las células o realizar una prueba de viabilidad (por ejemplo, una celda de conteo en presencia de azul de tripano usando un hemocitómetro), pero ten cuidado que utilizando una parte de la suspensión celular para ello bajará el rendimiento. Evitar el uso de un volumen de suspensión grande como aumentará el riesgo de las células difunde fuera del centro del plato. - Goteo con cuidado las células disociadas en el centro de la placa de cultivo celular que contiene 2 mL del medio L-15 (preparado en el paso 3.13). Permitir que las células se hunda hasta el fondo del plato durante aproximadamente 5 minutos antes de pasar a la incubadora, para evitar que las células de extensión fuera de la parte hundida de la parte inferior de cristal.
- Incubar la placa a 26 ° C y 1% de CO2 para permitir que todas las células hundirse completamente y colocar en el fondo del plato.
- Después de 30 minutos, mirar las células en el microscopio para asegurarse de que han unido a la placa de cultivo.
- Seguir a incubar las células en 26 ° C y 1% de CO2.
- Cuidadosamente cambiar la mayoría de (pero no todos) el medio cada 3-4 días.
Nota: Evite cambiar el medio con mayor frecuencia, ya que puede alterar las células y hacerlos despegar de la parte inferior de cristal. Utilizar las células para los experimentos dentro de una semana después de la siembra les.
Resultados
Este protocolo describe la preparación de una cultura de célula primaria de pituitaries medaka y proporciona a las células sanas que se pueden mantener en una cultura de por lo menos una semana. El protocolo se basa en valores fisiológicos relevantes para medaka14 y además está optimizado para el tejido hipofisario en peces adultos, con un pH de 7.75 y una osmolalidad de 290 mOsm/kg durante todo el procedimiento de la recolección de tejido para el plateado células en cultivo (figura 1 y figura 2).
Resultados representativos de experimentos en cultivos celulares primarios de células producidos por este protocolo se muestran en la figura 3, figura 4y figura 5. Para los resultados aquí presentados, un transgénico medaka línea, luteinizante hormona (Lh)-gonadotrope células expresan la proteína verde fluorescente (GFP), fue utilizado19. La figura 3 muestra un campo representativo en el plato de una cultura de célula primaria desde el día 0 al día 7 después de la siembra, incluyendo ambas imágenes de microscopía de campo brillante y fluorescente, mostrando las células del gonadotrope de Lh expresando GFP. Utilizando pituitaries medaka adulto 10 por plato generalmente resulta en una densidad de alrededor de 5 x 104 – 1 x 105 células por plato después de la siembra. La viabilidad de las células hipofisarias en cultura se calcula basándose en el número total de células de expresión de GFP en la cultura en el día 1, 3 y 7 después de la galjanoplastia, en comparación con el día 0 (figura 4). El gráfico que se muestra en la figura 4 indica que el número de células moribundas es casi constante en el tiempo, con más del 95% de las células vivas después de 1 día, mientras que más del 90% es todavía vivo después de 3 días. Aunque hay una pequeña disminución en la viabilidad celular con el tiempo, la mayoría de las células (alrededor del 75%) todavía están vivas después de una semana en la cultura. Grabaciones electrofisiológicas de las células del gonadotrope de Lh expresando GFP (realizadas como se describe en Strandabø, et al.) 20 muestran que las células son capaces de disparar potenciales de acción espontáneamente después de 4 días en cultivo (figura 5A). Además, sobre el estímulo de la hormona liberadora de gonadotropina, una hiperpolarización transitoria inicial de la membrana celular es seguido por un aumento dramático en frecuencia que es concomitante a una despolarización y mayor duración de la acción de la leña potenciales (figura 5B).
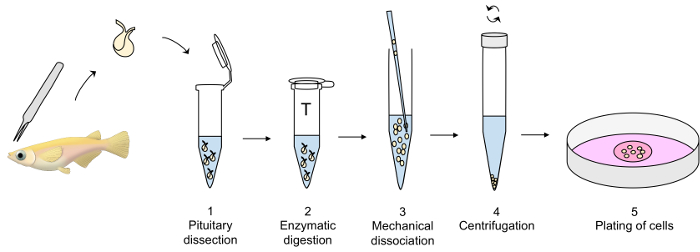
Figura 1: Resumen de la técnica de cultura pituitarios de la célula primaria. Pituitaries son disecados con pinzas finas y transferidos a un tubo plástico que contiene modificado dPBS de hielo (paso 1 del Protocolo) hasta la digestión enzimática de los pituitaries con tripsina a 26 ° C (paso 2), seguido por una inactivación con un inhibidor de la tripsina a 26 ° C (no mostrado). La disociación mecánica de los pituitaries enzimáticamente digeridos con una pipeta de vidrio se realiza cuidadosamente en la dPBS de hielo (paso 3), seguido de una centrifugación a 4 ° C (paso 4). Por último, se disuelve el precipitado de células en medio de cultivo y las células plateadas hacia fuera en una placa de cultivo celular (paso 5). Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: detalles de la disección hipofisaria medaka. (A) la cabeza de un inmovilizado medaka (vista dorsal) es fijado a una placa de cera, y la parte superior del techo del cráneo se quita con pinzas finas para exponer la parte superior del cerebro. (B) la médula espinal es cortada, y el cerebro se volcó hacia la parte delantera de la cabeza que la hipófisis está expuesta. (C) la hipófisis se recogen con unas pinzas limpias y finas. Punta de flecha señala a la hipófisis en el panel B y C. Barra de escala = 1.000 μm. haga clic aquí para ver una versión más grande de esta figura.

Figura 3: cultura pituitarios de la célula primaria de Medaka. Estos paneles muestran imágenes de una cultura pituitarios de la célula primaria de medaka representante confocales de alta resolución en el día 0, día 3 y día 7 después de la siembra. El panel superior muestra las imágenes de microscopía de campo brillante de un campo representativo en el plato, el panel central muestra imágenes de microscopia fluorescente del mismo campo de visión mostrando GFP-expresando Lh-gonadotrope células, y la parte inferior es una superposición de los dos. Barra de escala = 20 μm. haga clic aquí para ver una versión más grande de esta figura.
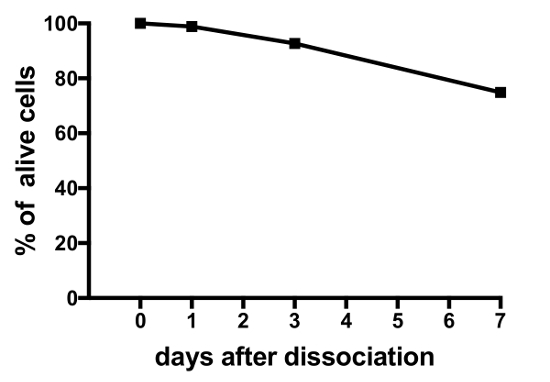
Figura 4: viabilidad de hipófisis medaka células en cultura. Esta figura muestra la viabilidad de las culturas pituitarios de la célula primaria medido en el día 0, 1, 3 y 7 después de la siembra. Los números se calculan utilizando el software de la abrir-fuente CellProfiler V2 y se basan en el número total de células del gonadotrope de Lh GFP-expresando por plato en momentos diferentes, en comparación con el tiempo 0. Haga clic aquí para ver una versión más grande de esta figura.
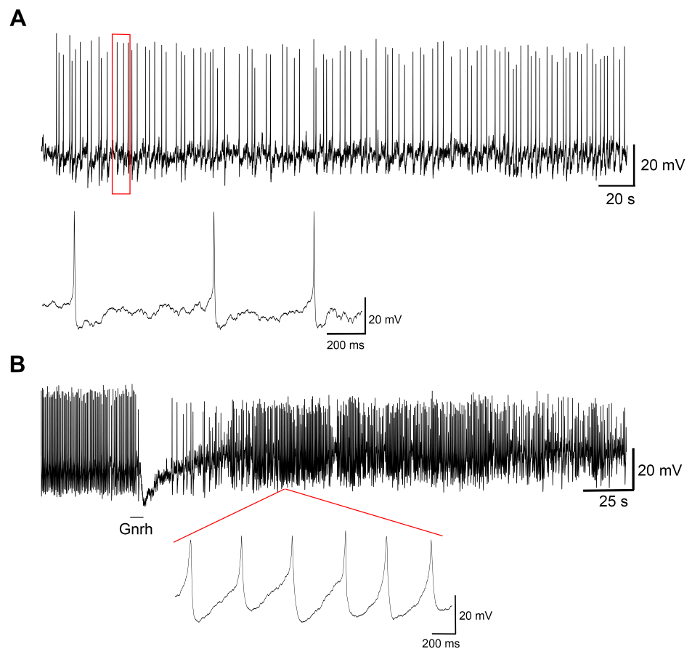
Figura 5: las grabaciones electrofisiológicas de las células hipofisarias. Estos paneles muestran las grabaciones electrofisiológicas de un GFP-expresando Lh-gonadotrope células en un cultivo de células de primaria realizado en el día 4 después de siembra, mostrando (A) una representante traza espontáneas de potenciales de acción, seguido por (B) una estimulación con la hormona liberadora de gonadotropina Gnrh1 10 s. La estimulación de Gnrh1 induce una respuesta bifásica con una hiperpolarización de la membrana de las células, seguida por una despolarización y mayor duración de los potenciales de acción (medido en el pico de 50%) de 8,9 ± 3,0 ms antes de la estimulación a 29.2 ± 9,9 ms después de la estimulación. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Sistemas de cultivo in vitro de la célula proporcionan potentes herramientas para los investigadores responder a una plétora de diferentes cuestiones biológicas si se utiliza en la forma correcta1. Es importante recordar que las células disociadas que han perdido sus conexiones con las células vecinas pueden han obtenido diferentes propiedades funcionales que originalmente tenían en vivo. Para evitar riesgo de malinterpretando los resultados obtenidos en experimentos en vitro , es importante considerar ajustar el procedimiento de cultura de célula primaria a la especie y célula de tipo de interés. Incluso moderados ajustes de procedimientos standard de cultivo y soluciones que se utilizan son a menudo suficientes para alterar profundamente las condiciones de cultivo de un tipo de célula específica.
Este protocolo describe condiciones optimizadas para la preparación y mantenimiento de cultivos celulares de primaria de pituitaries medaka adulto, que pueden lograrse mediante el ajuste de parámetros como la temperatura, osmolaridad, pH y pCO2 de las soluciones utilizadas, a coincidir con las condiciones fisiológicas de esta especie. El pH es dependiente de la temperatura y por lo tanto, debe ajustarse también entre diferentes especies de peces teleósteos en diferentes temperaturas17. La osmolalidad de las soluciones de todos durante la disociación celular y cultivo se debe ajustar también con el fin de mejorar la condición de las células. Sobre todo, si hay una discrepancia en la osmolalidad entre diferentes soluciones utilizadas durante el procedimiento de aislamiento, puede tener efectos devastadores sobre la calidad de la cultura, llevando a una viabilidad disminuida (los resultados inéditos de autores). Soluciones hiperosmóticas hará que las células para reducir el tamaño (y viceversa), tal modo interfiriendo con la integridad de la membrana y la membrana proteína función21. Un punto importante en este contexto es que parámetros como la osmolalidad y el pH no son generalmente medidos ni estable entre diferentes lotes de almacenadores intermediarios comerciales y medios de cultivo utilizados en condiciones de cultivo mamíferos. Diferencias de osmolaridad y pH entre diferentes soluciones utilizadas durante el procedimiento de aislamiento deben evitarse en todo momento.
La tasa de éxito de este protocolo es mejorada por el entrenamiento, por lo que se espera los investigadores necesitan tiempo para familiarizarse con los diferentes pasos de la técnica. Por ejemplo, el tiempo de la disección de los pituitaries hasta que las células se platean en el plato es inversamente proporcional a la salud celular. La disociación mecánica de los pituitaries utilizando una pipeta de cristal es un paso particularmente crítico del protocolo y requiere algo de entrenamiento para lograr un buen resultado. El procedimiento de disociación puede presentar estrés osmótico y mecánico que es perjudicial para las células. La adición de pequeños volúmenes de dPBS modificado en medidas repetidas para la disociación mecánica garantiza un procedimiento de disociación más apacible donde las células disociadas ya se transfieren a un tubo nuevo y se fue intacto, mientras que el investigador sigue disociar las células adicionales del tejido en un nuevo volumen de dPBS.
Este protocolo está optimizado para las células pituitarias adultos medaka. Diferentes especies, los tejidos o incluso diferentes estadios del animal dentro del mismo tejido requieren optimización de las condiciones de cultivo. Por ejemplo, las células obtenidas de animales inmaduros pueden ser más frágiles y, por tanto, más susceptibles a la apoptosis y muerte celular y, por lo tanto, puede requerir la necesidad de ajustar el protocolo, especialmente hacia un procedimiento de disociación más apacible. La disociación mecánica utilizando una pipeta de cristal es un paso muy crítico del procedimiento, como una disociación mecánica demasiado cuidadosa conducirá a un aumento inferior, mientras que uno demasiado áspero puede inducir apoptosis o célula muerte. Si se consideran diferentes enzimas para la disociación, podría ser necesario utilizar una concentración de tiempo y de la enzima de digestión diferente. Pituitaries medaka son muy pequeñas y relativamente fácil de disociar usando el protocolo descrito. Sin embargo, optimizaciones para otras especies podrían requerir el uso de un filtro de malla después de la disociación para eliminar los desechos. El éxito de este protocolo también depende en gran medida los pasos bajo condiciones estériles para evitar la contaminación de las células.
El número de células a las semillas por plato depende de la cantidad de pituitaries al inicio, así como el éxito del procedimiento de disociación. Hay aproximadamente unos 15.000 células en una glándula pituitaria intacta medaka adultos. Sin embargo, las células se pierden durante el proceso de disociación y esto debe explicarse al calcular el número de pituitaries necesarios para un experimento. Utilizando por lo menos 10 pituitaries por plato resultará generalmente en una densidad de alrededor de 50.000 – 100.000 células por plato. En esta densidad, agregación no forma en cantidad significativa, incluso después de 7 días en cultivo. Perceptiblemente, la agregación parece densidad dependiente, como la más densa de las células se siembran, más parecen agregados. Ciertos procedimientos pueden requerir una cultura más densa y, por lo tanto, la densidad óptima de siembra debe ser considerada dependiendo de la aplicación de aguas abajo. Es un punto importante a tener en cuenta al planear el número de pituitaries utilizar por plato.
Las aplicaciones más comunes de bajada utilizan cultivos celulares primarios dentro de los primeros días después de la siembra. Los resultados presentados aquí, de la viabilidad celular a las grabaciones electrofisiológicas, demuestran que es posible obtener buenos resultados de cultivos de células primarias preparados utilizando el protocolo descrito por hasta una semana después de la siembra. Sin embargo, las culturas pueden mantenerse más tiempo, y las células sanas todavía presentes después de más de 2 semanas en cultura (los resultados inéditos de autores). Las condiciones optimizadas presentadas en este protocolo facilita resultados fisiológicamente significativas y puede ser beneficiosas para otros científicos preparar cultivos de células primarias de las células animales no mamíferos.
Divulgaciones
Los autores no tienen nada que declarar.
Agradecimientos
Este proyecto fue financiado por la Universidad Noruega de Ciencias de la vida y el Consejo de investigación de Noruega, número de concesión 243811 y 244461 (programa de acuicultura). Agradecemos a Lourdes Carreon Tan en la Universidad Noruega de Ciencias de la vida para el mantenimiento de las instalaciones de peces.
Materiales
| Name | Company | Catalog Number | Comments |
| Dulbecco’s Phosphate Buffered Saline (dPBS), without calcium chloride and magnesium chloride | Sigma (Merck, Damstadt, Germany) | D8537 | Adjust solution to pH 7.75 with 1M NaOH and 290 mOsm with mannitol. |
| L-15 medium (Leibovitz), witout L-glutamine | Sigma (Merck, Damstadt, Germany) | L5520 | Supplement 500 ml culture medium with 10mM NaHCO3, 4.5 mM glucose, 2 mM Glutamax. Adjust solution to 290 mOsm with mannitol and filter solution through a 0.2 µm PES sterile filter, before adding 2.5 ml Penicillin-Streptomycin solution (see below for details). |
| NaOH | Sigma (Merck, Damstadt, Germany) | S5881 | Add drops of 1M solution to increase pH of dPBS and culture medium to 7.75. |
| NaHCO3 | Sigma (Merck, Damstadt, Germany) | S5761 | 10 mM NaHCO3 equals 420 mg per 500 ml culture medium. |
| D-mannitol | Sigma (Merck, Damstadt, Germany) | 63565 | Use to increase osmolality of dPBS and culture medium. Calculate correct amount needed to reach an osmolality of 290 mOsm. |
| D-glucose | Sigma (Merck, Damstadt, Germany) | G5400 | 4.5 mM D-glucose equals 405 mg per 500 ml culture medium. |
| GlutaMAX Supplement | Gibco (Life Technologies, Paisley, UK) | 35050-061 | Alternative to L-glutamine, with increased stability. 2 mM Glutamax equals 5 ml of 100X stock in 500 ml culture medium. |
| Penicillin-Streptomycin | Sigma (Merck, Damstadt, Germany) | P0781 | Stock solution 10,000 units penicillin and 10 mg streptomycin per mL. Use 2.5 ml of stock solution in 500 ml L-15 medium (equivalent of 50 U/ml Penicillin and 50 µg/ml Streptomycin). |
| Trypsin type II-S | Sigma (Merck, Damstadt, Germany) | T7409 | Prepare 1 mg/ml in dPBS solution. |
| Trypsin inhibitor type I-S | Sigma (Merck, Damstadt, Germany) | T6522 | Prepare 1 mg/ml in dPBS solution, supplement with 2 µg/ml Dnase I (see details below). |
| Dnase I | Sigma (Merck, Damstadt, Germany) | D5025 | Use in trypsin inhibitor solution (see above). |
| 0.2 µm Polyethersulfone (PES) sterile filter system | Corning Inc. (Corning, NY) | 431097 | Use for sterile filtration of dPBS and L-15 medium after adjustments. |
| 35 mm cell culture dish with glass bottom, poly d-lysine coated | MatTek Corporation (Ashland, MA) | P35GC-1.5-10-C | Can also be replaced by plastic dish, depending on downstream application. |
| Dumont #5 fine forceps | Fine Science Tools (CA) | 11254-20 | Straigt tip |
| Dumont #5/45 fine forceps | Fine Science Tools (CA) | 11253-25 | Angled 45° tip |
| Stereo microscope SZ61 | Olympus Corp. (Tokyo, Japan) | Use for dissection of pituitaries. | |
| Alegra X-22R Centrufuge | Beckman Coulter Inc. (Brea, CA) | With cooling option (similar to current model XR-30). | |
| Water bath | Techne (Staffordshire, UK) | Any water bath with the possibility of adjusting temperature will do. | |
| Pasteur glass pipettes | VWR (NY) | 612-1701 | Outer diameter 1.6 mm, fire polish and autoclave before use. |
| Galaxy MiniStar table centrifuge | VWR (NY) | 521-2844 | Any small table centrigue will do. |
| Fine needles / insect pins | Fine Science Tools (CA) | 26001-40 | Diameter 0.03 mm. Other fine needles can be used instead. |
| Wax plate | Custom made by adding melted paraffin wax in large petri dish. |
Referencias
- Freshney, R. I. . Culture of Animal Cells: A Manual of Basic Technique and Specialized Applications. , (2010).
- Ribeiro, L. P., Ahne, W. Fish cell culture: initiation of a line of pituitary cells from carp (Cyprinus carpio) to study the release of gonadotropin in vitro. In Vitro. 18 (5), 419-420 (1982).
- Ribeiro, L., Ahne, W., Lichtenberg, V. Primary culture of normal pituitary cells of carp (Cyprinus carpio) for the study of gonadotropin release. In Vitro. 19 (1), 41-45 (1983).
- Wong, A. O., Ng, S., Lee, E. K., Leung, R. C., Ho, W. K. Somatostatin inhibits (d-Arg6, Pro9-NEt) salmon gonadotropin-releasing hormone- and dopamine D1-stimulated growth hormone release from perifused pituitary cells of chinese grass carp, Ctenopharyngodon idellus. General and Comparative Endocrinology. 110 (1), 29-45 (1998).
- Chang, J. P., et al. Use of a pituitary cell dispersion method and primary culture system for the studies of gonadotropin-releasing hormone action in the goldfish, Carassius auratus. I. Initial morphological, static, and cell column perifusion studies. General and Comparative Endocrinology. 77 (2), 256-273 (1990).
- Weil, C., Hansen, P., Hyam, D. Use of pituitary cells in primary culture to study the secretion in rainbow-trout - Setting up and validating the system as assessed by its responsiveness to mammalian and salmon gonadotropin-releasing hormone. General and Comparative Endocrinology. 62 (2), 202-209 (1986).
- Montero, M., LeBelle, N., Vidal, B., Dufour, S. Primary cultures of dispersed pituitary cells from estradiol-pretreated female silver eels (Anguilla anguilla L): Immunocytochemical characterization of gonadotropic cells and stimulation of gonadotropin release. General and Comparative Endocrinology. 104 (1), 103-115 (1996).
- Xu, S. H., Cooke, I. M. Voltage-gated currents of tilapia prolactin cells. General and Comparative Endocrinology. 150 (2), 219-232 (2007).
- Lin, S. W., Ge, W. Differential regulation of gonadotropins (FSH and LH) and growth hormone (GH) by neuroendocrine, endocrine, and paracrine factors in the zebrafish-An in vitro approach. General and Comparative Endocrinology. 160 (2), 183-193 (2009).
- Hodne, K., von Krogh, K., Weltzien, F. A., Sand, O., Haug, T. M. Optimized conditions for primary culture of pituitary cells from the Atlantic cod (Gadus morhua). The importance of osmolality, pCO2, and pH. General and Comparative Endocrinology. 178 (2), 206-215 (2012).
- Wittbrodt, J., Shima, A., Schartl, M. Medaka - a model organism from the far East. Nature Reviews Genetics. 3, 53-64 (2002).
- Matsuda, M., et al. DMY is a Y-specific DM-domain gene required for male development in the medaka fish. Nature. 417 (6888), 559-563 (2002).
- Kasahara, M., et al. The medaka draft genome and insights into vertebrate genome evolution. Nature. 447 (7145), 714-719 (2007).
- Miyanishi, H., Inokuchi, M., Nobata, S., Kaneko, T. Past seawater experience enhances seawater adaptability in medaka, Oryzias latipes. Zoological Letters. 2 (12), (2016).
- Waymouth, C. Osmolality of mammalian blood and of media for culture of mammalian cells. In Vitro. 6 (2), 109-127 (1970).
- Cameron, J. N. Acid-base homeostasis - past and present perspectives. Physiological Zoology. 62 (4), 845-865 (1989).
- Claiborne, J. B., Edwards, S. L., Morrison-Shetlar, A. I. Acid-base regulation in fishes: cellular and molecular mechanisms. Journal of Experimental Zoology. 293 (3), 302-319 (2002).
- Perry, S. F., Tufts, B. L. . Fish respiration. , (1998).
- Hildahl, J., et al. Developmental tracing of luteinizing hormone β-subunit gene expression using green fluorescent protein transgenic medaka (Oryzias latipes) reveals a putative novel developmental function. Developmental Dynamics. 241 (11), 1665-1677 (2012).
- Strandabø, R. A. U., et al. Signal transduction involved in GnRH2-stimulation of identified LH-producing gonadotropes from lhb-GFP transgenic medaka (Oryzias latipes). Molecular and Cellular Endocrinology. 372 (1-2), 128-139 (2013).
- Verbalis, J. G. Brain volume regulation in response to changes in osmolality. Neuroscience. 168 (4), 862-870 (2010).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados