Method Article
Préparation d’une Culture de cellules primaires de haute qualité de poisson hypophyses
Dans cet article
Résumé
Nous décrivons ici un protocole pour établir et maintenir des cultures primaires de cellules hypophysaires de medaka (Oryzias latipes). Les conditions optimisées dans le présent protocole compte paramètres importants tels que la température et l’osmolalité pH en imitant les conditions physiologiques du poisson, ce qui permet des résultats physiologiquement plus significatifs.
Résumé
Culture cellulaire primaire est un outil puissant couramment utilisé par les scientifiques pour étudier les propriétés cellulaires et les mécanismes des cellules isolées dans un environnement contrôlé. Malgré les grandes différences dans la physiologie entre les mammifères et les poissons, les protocoles de culture de cellules primaires de poissons reposent souvent sur des conditions de culture chez les mammifères, souvent avec des modifications mineures. Les différences environnementales affectent non seulement la température corporelle, mais aussi le sérum sanguin paramètres tels que l’osmolalité, du pH et pouvoir tampon pH. Comme milieux de culture cellulaire et des solutions de travail similaires sont censées imiter les caractéristiques du liquide extracellulaire et/ou sérum sanguin auquel une cellule est adaptée, il est crucial que ces paramètres soient adaptées spécifiquement à l’animal en question.
Le protocole actuel décrit les conditions de culture primaire optimisé pour medaka (Oryzias latipes). Le protocole fournit des instructions détaillées sur la façon d’isoler et de maintenir en bonne santé dissocient des cellules hypophysaires pendant plus d’une semaine et comprend les étapes suivantes : 1. l’adaptation de l’osmolalité aux valeurs trouvées dans le plasma sanguin de medaka, 2. l’adaptation de la température d’incubation à température normale medaka (ici dans l’installation de l’aquarium) et 3. l’ajustement du pH et du bicarbonate tampon aux valeurs comparables à d’autres espèces de poissons vivant à des températures similaires. Les résultats présentés en utilisant le protocole décrit promouvoir physiologiquement significatives résulats médaka et peuvent être utilisés comme un guide de référence par les scientifiques faisant des cultures de cellules primaires des autres espèces non mammifères.
Introduction
Culture cellulaire est l’un des principaux outils utilisés dans la recherche en biologie moléculaire, grâce à un système excellent modèle pour répondre à des questions biologiques différentes allant de la physiologie cellulaire normale à drogues dépistage et carcinogenèse1. Les cellules primaires, prélevés directement les tissus d’origine animale par des méthodes enzymatiques et/ou mécaniques, sont souvent considérés comme biologiquement plus pertinentes que les lignées cellulaires comme la réaction biologique peut se rapprocher de la situation in vivo . Protocoles pour la préparation de cultures de cellules primaires doivent être optimisés pour chaque type d’espèces et de cellules d’intérêt afin de reproduire les caractéristiques auxquelles une cellule est adaptée et obtenir des résultats significatifs physiologiquement.
Nombreux protocoles décrivent les conditions de culture pour les systèmes cellulaires de mammifères, tandis que les protocoles similaires, décrivant les conditions de culture primaire de cellules de poissons sont plutôt rares en comparaison. Les cellules sont vulnérables aux changements rapides de température, le pH et l’osmolalité et sont particulièrement fragiles lors de la procédure de dissociation. Commerciales solutions salines et milieux de culture utilisés pour les cultures de cellules de mammifères ne sont pas optimaux pour les poissons téléostéens, surtout en ce qui concerne les systèmes tampon de pH et l’osmolalité. Par conséquent, il est important de mesurer et d’ajuster les solutions aux niveaux physiologiquement pertinents de ces paramètres chez les espèces d’intérêt.
Les cultures primaires hypophysaires ont été apportées de plusieurs espèces de poissons téléostéens, notamment la carpe commune (Cyprinus carpio)2,3, herbe la carpe herbivore (Ctenopharyngodon idella)4, cyprin doré (Carassius auratus )5,6de la truite arc-en-ciel (Oncorhynchus mykiss), l’anguille européenne (Anguilla anguilla)7, le tilapia (Oreochromis mossambicus)8, poisson zèbre (Danio rerio)9, et Morue de l’Atlantique (Gadus morhua)10. Mis à part le réglage de la température d’incubation de l’espèce d’intérêt, plusieurs de ces protocoles ont incubé les cellules de mammifères comme conditions pouvant être sous-optimale pour les espèces d’intérêt, avec un pH de 7,2 à 7,5 en atmosphère humidifiée contenant de 3 à 5 % de CO2. En outre, il est difficile de savoir si l’osmolalité des solutions utilisées pour la préparation de plusieurs de ces cultures de cellules primaires ont été ajustée et stable entre différentes solutions.
Le protocole actuel repose sur des travaux antérieurs avec des cultures primaires de morue de l’Atlantique10 et comprend les réglages de la température d’incubation, osmolalité, pH et pH tampon systèmes, y compris la pression partielle de dioxyde de carbone (pCO2), à la physiologie des médakas (o. latipes). Chez les sujets exposés sont un poisson d’eau douce de petite taille (3 à 4 cm), originaire d’Asie du sud-est. Ces jours-ci, il est utilisé comme une espèce de modèle dans de nombreux laboratoires de recherche dans le monde entier, car il est relativement facile à reproduire et très résistants à beaucoup de maladies poisson commun11. Il y a plusieurs avantages à utiliser des médakas comme modèle, y compris une tolérance à la température de 4 à 40 ° C11, un temps de génération court, embryons transparents, un déterminant le sexe génétique12et un génome séquencé13, ainsi que plusieurs autres ressources génétiques disponibles.
Les conditions de culture primaire dans le présent protocole sont optimisées pour correspondre à la température de 26 ° C régressées conservés à dans l’usine de poisson. En outre, l’osmolalité est ramenée de 320 mOsm/kg de morue vivant dans l’eau salée à 290 mOsm/kg pour le médaka vivant en eau douce et est conforme à l’osmolarité normale de medaka plasma14. En comparaison, l’osmolalité typique du plasma chez les mammifères est de l’ordre de 275 – 295 mOsm15. Poisson vit dans une variété de températures et ont des branchies qui sont en contact direct avec l’eau, ce qui rend la capacité de pH et de la mémoire tampon du sang et de liquide extracellulaire chez les poissons différentes de celles des mammifères. Milieux de culture chez les mammifères comprennent généralement des systèmes tampons qui permettent à un pH d’environ 7,4 lors les médias soient équilibrés à une atmosphère standard de 5 % de CO2 dans l’air humidifié à 37 ° C. Le pH est dépendante de la température et la valeur de pH neutre (en eau) augmente avec une baisse de température16. Typique de poissons téléostéens plasma pH varie de 7,7 à 7,917. L’optimisation du présent protocole notamment une diminution de pH 7,85 cabillaud conservées à 12 ° C à un pH de 7,75 pour médaka maintenue à 26 ° C en augmentant le CO2 de 0,5 % à 1 %.
En outre, la capacité de tampon bicarbonate est très différente dans les poissons et les mammifères. CO2 est facilement échangés sur les branchies chez les poissons et le BCP2 dans l’eau n’est qu’une petite fraction du pCO2 dans le poumon18. Changement de la température ou la pCO2 va changer le pH et le tampon du milieu. Par conséquent, ni le pH ni la pCO2 suggérés en incubant les cellules de mammifères est optimal pour les cellules de poissons, et par conséquent, les milieux de culture doit être optimisée avec des systèmes tampons qui contiennent des valeurs physiologiquement pertinents pour les poissons et les espèce d’intérêt. Ce protocole décrit comment préparer des cultures de cellules primaires de glandes pituitaires médaka et inclut les ajustements de la système d’incubation température, osmolalité, pH et pH tampon, en plus d’autres paramètres importants à considérer lors de la préparation de cellules primaires cultures des espèces non mammifères.
Protocole
L’expérimentation animale dans cette étude ont été approuvées par l’Université norvégienne de Sciences de la vie, les directives suivantes pour les soins et le bien-être des animaux de recherche.
1. préparation des Solutions
- Étalonner les instruments d’osmomètre et pH mètre selon les instructions du fabricant pour assurer des mesures correctes.
-
Préparer 500 mL de Ca2 +- et Mg2 +-libre tampon phosphate salin de Dulbecco (SPD), ajuster le pH à 7,75 (étape 1.2.1) et l’osmolalité à 290 mOsm/kg (étape 1.2.2) avant une filtration stérilisante (étape 1.2.3).
- Ajuster le pH à 7,75 avec un pH-mètre calibré en ajoutant avec précaution les gouttes d’une solution de NaOH 1 M en remuant soigneusement la solution.
- Mesurer l’osmolarité de la solution en utilisant un osmomètre calibré et calculer la quantité de mannitol nécessaire à l’augmentation de l’osmolalité à 290 mOsm/kg. Ajouter la quantité requise de mannitol et ensuite mesurer l’osmolarité de la solution pour vérifier l’ajustement correct.
Remarque : La quantité de mannitol nécessaire dépend de l’osmolalité mesurée, qui varie généralement entre différents lots. Une molécule de mannitol est égale à 1 particule osmotique. - Stérile-filtrer la solution SPD à l’aide d’un filtre de 0,2 µm.
Remarque : La solution peut être conservée à 4 ° C pendant au moins 3 mois.
- Préparer 500 mL de milieu de culture de Leibovitz (L-15) sans L-glutamine et du bicarbonate et compléter avec 10 mM NaHCO3 (étape 1.3.1), 4,5 mM de glucose (étape 1.3.2) et 2 mM de glutamine disponible dans le commerce (étape 1.3.3). Ajuster la solution à 290 mOsm/kg (étape 1.3.4), filtre stérile (étape 1.3.5) et ajouter 2,5 mL d’une solution de pénicilline-streptomycine (point 1.3.6).
Remarque : La solution peut être conservée à 4 ° C pendant au moins 4 semaines.- Ajouter 420 mg de NaHCO3 / 500 mL de milieu de culture pour parvenir à une solution de 10 mM.
- Ajouter 405 mg de glucose par 500 mL de milieu de culture pour parvenir à une solution de 4,5 mM.
- Ajouter 5 mL de 100 actions de x d’une solution de glutamine dans 500 mL de milieu de culture pour parvenir à une solution de 2 mM. Remuer jusqu'à ce que tous les solutés sont dissous.
- Ajuster la solution à 290 mOsm/kg avec mannitol en utilisant un osmomètre (interprété dans temps 1.2.2).
- Effectuer une filtration stérile du milieu L-15 filtre 0,2 µm.
- Après la filtration stérile, ajouter 2,5 mL d’une solution de pénicilline-streptomycine, correspondant à 50 U/mL de pénicilline et de 50 µg/mL de streptomycine.
- Préparer 50 mL d’une solution de trypsine à l’aide de 1 mg/mL de type de la trypsine (0,1 %) II-S dissous dans la mis à jour le SPD (préparé à l’étape 1.2). Faire des parties aliquotes de 2 mL dans des tubes stériles en plastique et les conserver à-20 ° C jusqu'à l’utilisation.
Remarque : Les aliquotes de 2 mL peuvent être stockés à-20 ° C pendant au moins 3 mois. - Préparation de 50 mL d’une solution d’inhibiteur de trypsine à l’aide de 1 mg/mL (0,1 %) la trypsine inhibiteur type j’ai-s et compléter avec 2 µg/mL de DNase j’ai dissous dans la mis à jour le SPD (préparé à l’étape 1.2). Faire des parties aliquotes de 2 mL dans des tubes stériles en plastique et les conserver à-20 ° C jusqu'à l’utilisation.
Remarque : Les aliquotes de 2 mL peuvent être stockés à-20 ° C pendant au moins 3 mois.
2. préparation du matériel
- Préparer les pipettes en verre par la pointe pour la dissociation cellulaire de polissage au feu. Faire des trucs avec 2 catégories de taille différente (une ouverture moyenne de 0,6 – 0,8 µm et une petite ouverture de 0,4 à 0,6 µm) en jouant avec le temps et la distance de la flamme tout en tournant simultanément la pipette. Placer les pipettes de verre dans un récipient en verre propre et autoclave (en utilisant le mode solid à 105 ° C pendant 45 min).
- Préparer une boîte en polystyrène avec de la glace.
- Préparez un tube en plastique avec 1,5 mL de mis à jour le SPD (préparé à l’étape 1.2) pour transférer l’hypophyse au cours de la dissection et de garder sur la glace.
- Préparer un tube de 15 mL, 10 ml de mis à jour le SPD (préparé à l’étape 1.2) et les conserver sur la glace jusqu'à la dissociation cellulaire.
- Préparer fraîches ou décongeler des aliquotes de la trypsine et de la solutions d’inhibiteur de la trypsine (préparées à l’étape 1.4 et 1.5) et garder sur la glace jusqu'à l’utilisation.
- Mettre le bain d’eau à 26 ° C avant de commencer la dissection afin de permettre à l’eau à la température désirée avant la dissociation chimique de l’hypophyse.
- Nettoyez tous les outils de dissection avec l’éthanol à 70 % avant, pendant et après l’utilisation, y compris des pinces fines à utiliser pour la dissection et de fines aiguilles et d’une plaque de cire pour épingler le poisson. Utiliser des gants propres (changer et nettoyer fréquemment) pendant toute la procédure pour éviter une éventuelle contamination des cellules.
3. hypophysaire Dissection et Dissociation cellulaire
- Euthanasier le poisson en l’immergeant dans la neige fondante de glace (0 ° C). Laisser le poisson dans la bouillie de glace pendant au moins 1 minute pour s’assurer un choc hypothermique irréversible.
NOTE : Perte d’équilibre et d’immobilisation surviendra après quelques secondes. Assurez-vous que le poisson soit totalement immergé dans l’eau glacée et ne se trouve pas sur le dessus de la glace, car ce dernier va entraîner la suffocation et potentielle peau brûle au lieu d’un choc hypothermique, rapid et sans cruauté. - Rapidement transférer les poissons dans un filet sur une plaque de cire sous le microscope à dissection et détruire la colonne vertébrale par un coup de poing de l’aiguille à travers le col.
- Épinglez la tête du poisson sur la plaque de cire à l’aide de fines aiguilles, en insérant une aiguille à l’avant (sur la bouche) et un de chaque côté de la tête (derrière le cerveau) pour stabiliser la tête avant la dissection.
- Voir les poissons sous le microscope à dissection et grattez doucement les écailles au dessus de la tête à l’aide de pinces fines avec un embout coudé.
- Soigneusement, insérer l’extrémité inclinée de la pince fine sous la peau du côté de la tête et enlever le toit crânien en déplaçant lentement la pince dans la direction de la bouche, tout en tenant fermement à la pince enfermant le crâne.
- Couper la moelle épinière complètement à l’aide de pinces avec un embout coudé.
NOTE : Temps est un facteur important, afin de travailler efficacement et avec précision pour limiter le temps passé de la dissection de la glande pituitaire jusqu'à ce que les cellules sont plaqués dans l’assiette. Après quelques essais, dissection hypophysaire devrait prendre environ 2 à 3 min par poisson, dont seulement environ 10 s sont nécessaires pour prendre l’hypophyse quand le cerveau est déjà exposé. - Retournez soigneusement le cerveau vers la bouche pour exposer l’hypophyse et il disséquer avec une pince propre avec une pointe droite. Transférer l’hypophyse dans un tube en plastique contenant 1,5 mL modifiée SPD (pour plus de détails, reportez-vous à l’étape 2.3) mis dans la glace. Vérifier l’extrémité de la pince au microscope pour s’assurer que l’hypophyse est correctement ajoutée au tube et rien n’est laissé sur la pince.
NOTE : Disséquer les hypophyses autant que nécessaire, selon le nombre de récipients de culture qui vont être préparés simultanément. En règle générale, calculer au moins 10 hypophyses de poissons adultes par plat a une densité appropriée des cellules (qui dépend de l’application en aval). - Tournez en bas les hypophyses dans une centrifugeuse de table pour 1 – 2 s à température ambiante. Retirez le SPD à l’aide d’une pipette de verre délicatement et veiller à ne pas enlever les glandes pituitaires.
- Ajouter 1 mL de la solution de trypsine (préparée à l’étape 1.4) pour laver les hypophyses, leur filer vers le bas dans une centrifugeuse de table pour 1 – 2 s et enlever la majeure partie du liquide à l’aide d’une pipette de verre avant d’ajouter 1 mL de solution de trypsine supplémentaire.
- Incuber le tube dans un bain d’eau à 26 ° C pendant 30 min, de préférence avec agitant doucement, ou vous pouvez également feuilleter le tube quelques fois au cours de la période d’incubation.
- Tournez en bas les hypophyses dans une centrifugeuse de table pour 1 – 2 s à la température ambiante et assurez-vous que toutes les glandes pituitaires sont situés au fond du tube. Enlever la plus grande partie de la solution de trypsine avec une pipette de verre et ajouter 1 mL de la solution d’inhibiteur de la trypsine (préparée à l’étape 1.5) pour inactiver la trypsine et laver la glande pituitaire.
- Collecter les hypophyses au fond du tube en les tournant vers le bas dans une centrifugeuse de table pour 1 – 2 s à température ambiante. Enlever la majeure partie du liquide avec une pipette de verre et ajouter 1 mL de la solution d’inhibiteur de la trypsine (préparée à l’étape 1.5). Placer le tube sur un bain d’eau à 26 ° C pendant 20 min, de préférence avec agitant doucement, ou vous pouvez également feuilleter le tube quelques fois au cours de la période d’incubation pour inactiver la trypsine.
- Préparer une boîte de Petri 35 mm cellule poly-d-lysine-enduit avec un fond de verre central en ajoutant 2 mL de milieu de L-15 et qui laisser incuber pendant au moins 10 min à 26 ° C et avec 1 % de CO2 pour qu’il peut atteindre la bonne température et le pH avant les cellules de placage.
NOTE : Une boîte de Petri de cellule en plastique peut également être utilisé. L’avantage principal d’utiliser un plat avec un fond de verre centralisé est que la zone où les cellules sont plaqués est plus petite, et donc, moins de cellules hypophysaires sont tenus par plat. Certaines applications en aval peuvent également nécessiter un fond de verre (par exemple, certaines techniques d’imagerie). - Définissez la centrifugeuse de refroidissement pour les tubes de 15 mL à 4 ° C, pour lui permettre d’atteindre la température désirée avant de commencer la dissociation mécanique.
- Recueillir l’hypophyse au bas du tube de la filature vers le bas le tube avec la solution d’inhibiteur de la trypsine (de l’étape 3.11) dans une centrifugeuse de table pour 1 – 2 s à la température ambiante et s’assurer que toutes les glandes pituitaires sont situés au fond du tube avant soigneusement élimination de la plupart de la solution d’inhibiteur de trypsine à l’aide d’une pipette de verre.
Remarque : Effectuez toutes les étapes suivantes du protocole dans un banc de flux laminaire (LAF), certifiés pour le travail de la cellule éviter une contamination des cellules. - Ajouter 1 mL de glacee SPD modifiés (préparé à l’étape 2.4) dans les pièces de tissu hypophysaire et sucer doucement les morceaux de tissus haut et bas (6 – 7 x) dans une pipette de verre poli au feu (préparée à l’étape 2.1).
Remarque : La température est un aspect essentiel, afin de garder toutes les solutions à 4 ° C. Partir de ce moment, exécutez toutes les étapes sur la glace lorsque cela est possible. - Tournez en bas les morceaux de tissus dans une centrifugeuse de table pour 1 – 2 s à la température ambiante et transvaser avec soin la partie supérieure de la SPD contenant les cellules dissociées (presque 1 mL) dans un nouveau tube de 15 mL mis dans la glace. Évitez de déplacer la pipette vers le bas du tube où les morceaux de tissus sont laissés.
- Répétez l’étape 3.16 – 3.17, dissocier les cellules dans 1 mL de SPD glacé à la fois, jusqu'à ce que tous les 10 mL de SPD est utilisé. Commencer à utiliser une pipette de verre avec une ouverture de taille moyenne et l’interrupteur à une pipette de verre avec une ouverture plus petite vers la fin (pour les dernier 3 – 4 mL de SPD ajouté) de la dissociation. S’il y a des morceaux de tissus encore visibles vers la fin de la procédure de dissociation, augmenter le pipetage à environ 10 x vers les 2 dernières étapes du SPD pour la dissociation et enfin laisser les morceaux de tissu résiduel. Remettre en suspension les cellules doucement et éviter de créer des bulles car cela pourrait causer des dommages aux cellules lorsque les cellules s’attachent à la surface des bulles.
NOTE : C’est une étape essentielle du présent protocole et nécessite une formation pour obtenir un bon résultat. - Équilibrer le tube dans la centrifugeuse (préalablement refroidi à 4 ° C) et la centrifuger les cellules à 200 x g pendant 10 min à 4 ° C. Assurez-vous de marquer le côté du tube où sera le culot cellulaire.
- Retirer délicatement le tube de la centrifugeuse et transférer délicatement le surnageant avec une pipette de verre à un tube en plastique vide de 15 mL directement après la centrifugation. N’oubliez pas de retirer la plupart de surnageant, mais veiller à ne pas perdre la petite pastille de cellule (souvent invisible).
- Soigneusement Resuspendre le culot dans 50 à 100 µL de milieu de culture L-15.
NOTE : À cette étape, il est possible de compter les cellules et/ou effectuer un test de viabilité (comme une cellule de comptage en présence de bleu de trypan utilisant un hémocytomètre), mais attention qu’utilisant une partie de la suspension cellulaire pour cela fera baisser le rendement. Évitez d’utiliser un volume de suspension grand car il va augmenter le risque de diffusion en dehors du centre de l’assiette des cellules. - Soigneusement égoutter les cellules dissociées dans le milieu de la boîte de Petri de cellule contenant 2 mL du milieu L-15 (préparé à l’étape 3.13). Laissez les cellules à couler au fond du plat pendant environ 5 min avant de les dans l’incubateur, afin d’éviter que les cellules se propager à l’extérieur de la partie engloutie du fond du verre.
- Incuber le plat à 26 ° C et 1 % de CO2 pour permettre à toutes les cellules à couler abondamment et attacher au fond du plat.
- Après 30 min, regardez les cellules au microscope pour s’assurer qu’ils ont attaché à la boîte de Pétri.
- Continuer à incuber les cellules à 26 ° C et 1 % de CO2.
- Modifier avec soin la plupart (mais pas tous) le support tous les 3-4 jours.
Remarque : Évitez de changer le milieu plus fréquemment, car cela peut perturber les cellules et leur faire détacher le fond de verre. Utiliser les cellules pour des expériences moins d’une semaine après les semis.
Résultats
Ce protocole décrit la préparation d’une culture de cellules primaires de glandes pituitaires médaka et fournit des cellules saines qui peuvent être maintenues dans une culture pendant au moins une semaine. Le protocole repose sur des valeurs pertinentes physiologiques pour le médaka14 et est en outre optimisé pour le tissu hypophysaire chez les poissons adultes, à l’aide d’un pH de 7,75 et une osmolalité de 290 mOsm/kg pendant toute la procédure de la récolte de tissus pour le plaqué cellules en culture (Figure 1 et Figure 2).
Les résultats représentatifs des expériences sur cultures de cellules primaires produites par le présent protocole sont affichés dans la Figure 3, Figure 4et Figure 5. Pour les résultats présentés ici, un médaka transgénique line, où lutéinisante (Lh) l’hormone-gonadotrope cellules expriment la protéine fluorescente verte (GFP), a été utilisé19. La figure 3 montre un champ représentatif dans le plat d’une culture de cellules primaires du jour 0 au jour 7 après l’ensemencement, y compris les deux images de microscopie de champ lumineux et fluorescents, montrant les cellules exprimant le GFP Lh-gonadotrope. Chaque plat avec environ 10 hypophyses médakas adultes habituellement se traduit par une densité d’environ 5 x 104 – 1 x 105 cellules par plat après l’ensemencement. La viabilité des cellules hypophysaires en culture est calculée en fonction du nombre total de cellules exprimant GFP dans la culture au jour 1, 3 et 7 après l’ensemencement, comparativement à jour 0 (Figure 4). Le graphique illustré à la Figure 4 indique que le nombre de cellules mourantes est presque constant au fil du temps, avec plus de 95 % des cellules vivantes après 1 jour, alors que plus de 90 % est encore en vie après 3 jours. Bien qu’il y a un léger recul dans la viabilité des cellules avec le temps, la plupart des cellules (environ 75 %) sont encore en vie après une semaine de culture. Enregistrements électrophysiologiques des cellules exprimant le GFP Lh-gonadotrope (interprétées comme décrit dans Strandabø, et al.) 20 montrent que les cellules sont capables de tirer des potentiels d’action spontanément après 4 jours de culture (Figure 5 a). En outre, lors de la stimulation de la gonadolibérine, une hyperpolarisation transitoire initiale de la membrane cellulaire est suivie d’une augmentation spectaculaire de la fréquence qui est concomitante avec une dépolarisation et une plus longue durée de l’action de tir potentiels (Figure 5 b).
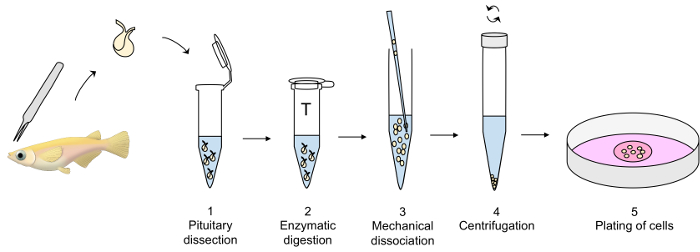
Figure 1 : vue d’ensemble de la technique de culture de cellules primaires hypophysaires. Glande pituitaire est disséqués avec une pince fine et transférée dans un tube en plastique contenant mis à jour le SPD sur la glace (étape 1 du protocole) jusqu'à ce que la digestion enzymatique de la glande pituitaire à la trypsine à 26 ° C (étape 2), suivie d’une inactivation avec un inhibiteur de la trypsine à 26 ° C (non illustré). La dissociation mécanique de l’hypophyse enzymatiquement digérée avec une pipette de verre est soigneusement effectuée au SPD sur la glace (étape 3), suivie d’une centrifugation à 4 ° C (étape 4). Enfin, le culot cellulaire est dissous dans le milieu de culture et les cellules plaqués dehors dans un plat de culture cellulaire (étape 5). S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 2 : détails de la dissection hypophysaire médaka. (A), le chef d’un médaka immobilisé (vue dorsale) est épinglé à une plaque de cire, et la partie supérieure de la toiture du crâne est enlevée avec une pince fine pour exposer la partie supérieure du cerveau. (B), la moelle épinière est interrompue et le cerveau basculé vers l’avant de la tête, telle que l’hypophyse est exposée. (C), l’hypophyse est recueilli avec une pince propre et fine. Pointe de flèche pointe vers l’hypophyse dans le groupe B et C. Echelle = 1 000 µm. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 3 : la culture de cellules primaires hypophysaires Medaka. Ces panneaux montrent des images confocales haute résolution d’une culture de cellules primaires hypophysaires médaka représentatif au jour 0 jour 3 et jour 7 après l’ensemencement. Le panneau supérieur montre des images de microscopie lumineuse d’un champ représentatif dans le plat, le panneau central montre des images de microscopie fluorescente du champ de vision même affichage des cellules exprimant le GFP Lh-gonadotrope et le panneau inférieur est une superposition des deux. Echelle = 20 µm. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
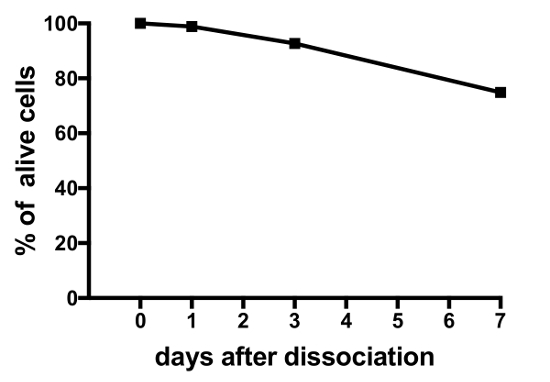
Figure 4 : viabilité de l’hypophyse chez les sujets exposés des cellules en culture. Cette figure illustre la viabilité des cultures des cellules primaires hypophysaire mesurée au jour 0, 1, 3 et 7 après l’ensemencement. Les chiffres sont calculés en utilisant le logiciel open-source CellProfiler V2 et sont basés sur le nombre total de cellules exprimant le GFP Lh-gonadotrope par plat aux points de temps différents, par rapport au temps 0. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
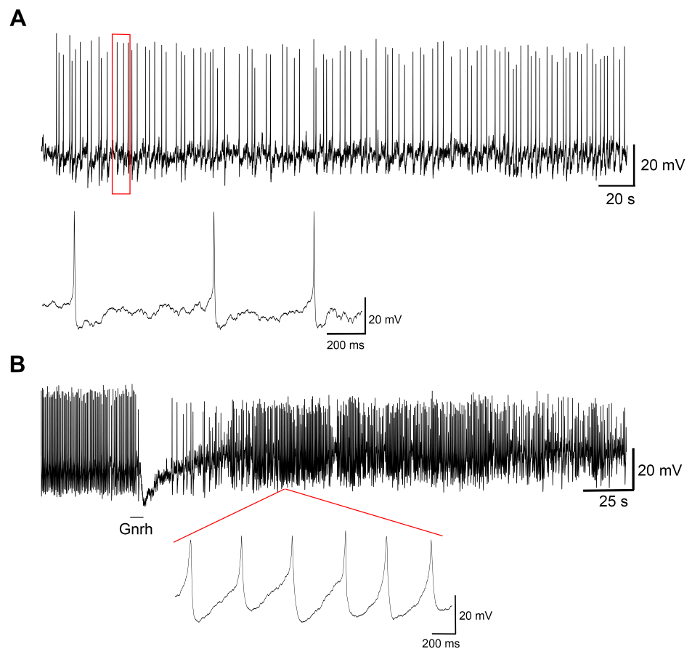
Figure 5 : enregistrements électrophysiologiques des cellules hypophysaires. Ces panneaux montrent des enregistrements électrophysiologiques d’une cellule exprimant le GFP Lh-gonadotrope dans une culture de cellules primaires effectuée à J4 après l’ensemencement, montrant (A) une trace représentative des potentiels d’action spontanées, suivi par (B) un stimulation par la gonadolibérine Gnrh1 pour 10 s. La stimulation Gnrh1 induit une réponse biphasique avec une hyperpolarisation de la membrane cellulaire, suivie d’une dépolarisation et une plus longue durée des potentiels d’action (mesurée à 50 % maximum) de 8,9 ± 3,0 ms avant la stimulation à 29,2 ± 9,9 ms après la stimulation. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Discussion
Systèmes de culture in vitro cell fournissent des outils puissants pour les chercheurs de répondre à une multitude de questions biologiques si utilisé dans le droit chemin1. Il est important de se rappeler que les cellules dissociées qui ont perdu leurs connexions aux cellules voisines peuvent avoir obtenu des propriétés fonctionnelles différentes qu’ils avaient initialement in vivo. Pour éviter d’être au risque d’une mauvaise interprétation des résultats obtenus à partir des expériences in vitro , il est important de considérer le réglage de la mise en culture cellulaire primaire relativement aux espèces et cellules d’intérêt. Ajustements même modérées des procédures standard de culture et de la solutions utilisées sont souvent suffisantes pour modifier profondément les conditions de culture, d’un type de cellule spécifique.
Ce protocole décrit des conditions optimisées pour la préparation et au maintien des cultures de cellules primaires d’hypophyses médakas adultes, ce qui peuvent être obtenus en ajustant les paramètres comme la température, l’osmolalité, du pH et BCP2 des solutions utilisées, à correspondent aux conditions physiologiques de l’espèce. Le pH est dépendante de la température et doit, par conséquent, également être ajusté entre différentes espèces de poissons téléostéens vivant à différentes températures,17. L’osmolalité de toutes les solutions utilisées au cours de la dissociation cellulaire et de culture doit également être ajustée afin d’améliorer la condition des cellules. En particulier, s’il y a une incompatibilité osmolalité entre différentes solutions utilisées au cours de la procédure d’isolement, il peut avoir des effets dévastateurs sur la qualité de la culture, conduisant à une viabilité réduite (résultats non publiés des auteurs). Des solutions hyperosmotiques entraînera les cellules à se rétrécir (et vice versa), interférant ainsi avec l’intégrité de la membrane et la membrane protein function21. Un point important dans ce contexte est que les paramètres tels que l’osmolalité et pH ne sont pas habituellement mesurée ni stable entre les différents lots de tampons commerciaux et des milieux de culture utilisés dans des conditions de culture chez les mammifères. Différences entre différentes solutions utilisées au cours de la procédure d’isolement osmolalité et pH doivent être évitées à tout moment.
Le taux de réussite de ce protocole est amélioré par la formation, donc il devrait les chercheurs doivent quelque temps pour se familiariser avec les différentes étapes de la technique. Par exemple, le temps de dissection de l’hypophyse, jusqu'à ce que les cellules sont plaqués dans l’assiette est inversement lié à la santé de la cellule. La dissociation mécanique de l’hypophyse à l’aide d’une pipette de verre est une étape particulièrement cruciale du protocole et nécessite une formation pour obtenir un bon résultat. La procédure de dissociation peut introduire des stress osmotique et mécanique qui est nocif pour les cellules. L’ajout de petits volumes de mis à jour le SPD à mesures répétées pour la dissociation mécanique garantit une procédure de dissociation plus douce où cellules dissociées déjà transférés dans un nouveau tube et gauche intacte, tandis que le chercheur continue à dissocier les cellules supplémentaires provenant du tissu dans un nouveau volume de SPD.
Ce protocole est optimisé pour les cellules hypophysaires chez les sujets adultes exposés. Différentes espèces, de tissus ou même différents stades de vie de l’animal dans le même tissu nécessitent des optimisations des conditions de culture. Par exemple, les cellules obtenues à partir des animaux immatures peuvent être plus fragiles et donc plus sensibles à l’apoptose et la mort des cellules et, par conséquent, peut nécessiter la nécessité d’ajuster le protocole, en particulier vers une procédure plus douce de la dissociation. La dissociation de mécanique à l’aide d’une pipette de verre est une étape très critique de la procédure, comme une dissociation mécanique trop prudente entraînera un gain plus faible, alors qu’une trop forte peut induire la mort l’apoptose ou de la cellule. Si différentes enzymes sont considérés pour la dissociation, il peut être nécessaire d’utiliser une concentration de temps et de l’enzyme de digestion différents. Glande pituitaire chez les sujets exposés est très petits et relativement facile à se dissocier en utilisant le protocole décrit. Toutefois, les optimisations pour d’autres espèces peuvent nécessiter l’utilisation d’un filtre à tamis après la dissociation pour enlever les débris. Le succès de ce protocole dépend aussi en grande partie suivant les étapes dans des conditions stériles pour éviter de contaminer les cellules.
Le nombre de cellules à semences par plat dépend du nombre de glandes pituitaires au début, ainsi que le succès de la procédure de dissociation. Il y a à peu près environ 15 000 cellules dans l’hypophyse intacte médakas adultes. Cependant, les cellules sont perdues pendant le processus de dissociation et cela doit être comptabilisée dans le calcul du nombre de glandes pituitaires nécessaires à une expérience. Chaque plat, avec au moins 10 hypophyses entraînera généralement une densité de près de 50 000 – 100 000 cellules par plat. Cette densité, agrégation ne forme pas d’aucune quantité significative, même après 7 jours de culture. Visiblement, agrégation semble être densité dépendante, aussi dense que les cellules sont ensemencées, plus ils semblent s’agréger. Certaines procédures peuvent exiger une culture plus dense et, par conséquent, la densité de semis optimale devrait être considérée selon l’application en aval. C’est un point important à prendre en considération lorsque vous planifiez le nombre de glandes pituitaires à utiliser par plat.
Applications en aval plus courantes utilisent des cultures cellulaires primaires dans les premiers jours après l’ensemencement. Les résultats présentés ici, de la viabilité cellulaire des enregistrements électrophysiologiques, montrent qu’il est possible d’obtenir de bons résultats de cultures de cellules primaires préparés selon le protocole décrit jusqu'à 1 semaine après le semis. Néanmoins, les cultures peuvent être conservés plus longtemps, et des cellules saines sont encore présents après plus de 2 semaines dans la culture (résultats non publiés des auteurs). Les conditions optimisées, présentées dans le présent protocole facilite des résultats significatifs physiologiquement et peut être bénéfiques pour d’autres scientifiques, préparation de cultures de cellules primaires de cellules non mammifères.
Déclarations de divulgation
Les auteurs n’ont rien à déclarer.
Remerciements
Ce projet a été financé par l’Université norvégienne de Sciences de la vie et le Conseil de recherche norvégien, numéro de licence 243811 et 244461 (programme d’Aquaculture). Nous sommes reconnaissants à Lourdes Castelain Tan à l’Université norvégienne des Sciences de la vie pour le maintien de l’usine de poisson.
matériels
| Name | Company | Catalog Number | Comments |
| Dulbecco’s Phosphate Buffered Saline (dPBS), without calcium chloride and magnesium chloride | Sigma (Merck, Damstadt, Germany) | D8537 | Adjust solution to pH 7.75 with 1M NaOH and 290 mOsm with mannitol. |
| L-15 medium (Leibovitz), witout L-glutamine | Sigma (Merck, Damstadt, Germany) | L5520 | Supplement 500 ml culture medium with 10mM NaHCO3, 4.5 mM glucose, 2 mM Glutamax. Adjust solution to 290 mOsm with mannitol and filter solution through a 0.2 µm PES sterile filter, before adding 2.5 ml Penicillin-Streptomycin solution (see below for details). |
| NaOH | Sigma (Merck, Damstadt, Germany) | S5881 | Add drops of 1M solution to increase pH of dPBS and culture medium to 7.75. |
| NaHCO3 | Sigma (Merck, Damstadt, Germany) | S5761 | 10 mM NaHCO3 equals 420 mg per 500 ml culture medium. |
| D-mannitol | Sigma (Merck, Damstadt, Germany) | 63565 | Use to increase osmolality of dPBS and culture medium. Calculate correct amount needed to reach an osmolality of 290 mOsm. |
| D-glucose | Sigma (Merck, Damstadt, Germany) | G5400 | 4.5 mM D-glucose equals 405 mg per 500 ml culture medium. |
| GlutaMAX Supplement | Gibco (Life Technologies, Paisley, UK) | 35050-061 | Alternative to L-glutamine, with increased stability. 2 mM Glutamax equals 5 ml of 100X stock in 500 ml culture medium. |
| Penicillin-Streptomycin | Sigma (Merck, Damstadt, Germany) | P0781 | Stock solution 10,000 units penicillin and 10 mg streptomycin per mL. Use 2.5 ml of stock solution in 500 ml L-15 medium (equivalent of 50 U/ml Penicillin and 50 µg/ml Streptomycin). |
| Trypsin type II-S | Sigma (Merck, Damstadt, Germany) | T7409 | Prepare 1 mg/ml in dPBS solution. |
| Trypsin inhibitor type I-S | Sigma (Merck, Damstadt, Germany) | T6522 | Prepare 1 mg/ml in dPBS solution, supplement with 2 µg/ml Dnase I (see details below). |
| Dnase I | Sigma (Merck, Damstadt, Germany) | D5025 | Use in trypsin inhibitor solution (see above). |
| 0.2 µm Polyethersulfone (PES) sterile filter system | Corning Inc. (Corning, NY) | 431097 | Use for sterile filtration of dPBS and L-15 medium after adjustments. |
| 35 mm cell culture dish with glass bottom, poly d-lysine coated | MatTek Corporation (Ashland, MA) | P35GC-1.5-10-C | Can also be replaced by plastic dish, depending on downstream application. |
| Dumont #5 fine forceps | Fine Science Tools (CA) | 11254-20 | Straigt tip |
| Dumont #5/45 fine forceps | Fine Science Tools (CA) | 11253-25 | Angled 45° tip |
| Stereo microscope SZ61 | Olympus Corp. (Tokyo, Japan) | Use for dissection of pituitaries. | |
| Alegra X-22R Centrufuge | Beckman Coulter Inc. (Brea, CA) | With cooling option (similar to current model XR-30). | |
| Water bath | Techne (Staffordshire, UK) | Any water bath with the possibility of adjusting temperature will do. | |
| Pasteur glass pipettes | VWR (NY) | 612-1701 | Outer diameter 1.6 mm, fire polish and autoclave before use. |
| Galaxy MiniStar table centrifuge | VWR (NY) | 521-2844 | Any small table centrigue will do. |
| Fine needles / insect pins | Fine Science Tools (CA) | 26001-40 | Diameter 0.03 mm. Other fine needles can be used instead. |
| Wax plate | Custom made by adding melted paraffin wax in large petri dish. |
Références
- Freshney, R. I. . Culture of Animal Cells: A Manual of Basic Technique and Specialized Applications. , (2010).
- Ribeiro, L. P., Ahne, W. Fish cell culture: initiation of a line of pituitary cells from carp (Cyprinus carpio) to study the release of gonadotropin in vitro. In Vitro. 18 (5), 419-420 (1982).
- Ribeiro, L., Ahne, W., Lichtenberg, V. Primary culture of normal pituitary cells of carp (Cyprinus carpio) for the study of gonadotropin release. In Vitro. 19 (1), 41-45 (1983).
- Wong, A. O., Ng, S., Lee, E. K., Leung, R. C., Ho, W. K. Somatostatin inhibits (d-Arg6, Pro9-NEt) salmon gonadotropin-releasing hormone- and dopamine D1-stimulated growth hormone release from perifused pituitary cells of chinese grass carp, Ctenopharyngodon idellus. General and Comparative Endocrinology. 110 (1), 29-45 (1998).
- Chang, J. P., et al. Use of a pituitary cell dispersion method and primary culture system for the studies of gonadotropin-releasing hormone action in the goldfish, Carassius auratus. I. Initial morphological, static, and cell column perifusion studies. General and Comparative Endocrinology. 77 (2), 256-273 (1990).
- Weil, C., Hansen, P., Hyam, D. Use of pituitary cells in primary culture to study the secretion in rainbow-trout - Setting up and validating the system as assessed by its responsiveness to mammalian and salmon gonadotropin-releasing hormone. General and Comparative Endocrinology. 62 (2), 202-209 (1986).
- Montero, M., LeBelle, N., Vidal, B., Dufour, S. Primary cultures of dispersed pituitary cells from estradiol-pretreated female silver eels (Anguilla anguilla L): Immunocytochemical characterization of gonadotropic cells and stimulation of gonadotropin release. General and Comparative Endocrinology. 104 (1), 103-115 (1996).
- Xu, S. H., Cooke, I. M. Voltage-gated currents of tilapia prolactin cells. General and Comparative Endocrinology. 150 (2), 219-232 (2007).
- Lin, S. W., Ge, W. Differential regulation of gonadotropins (FSH and LH) and growth hormone (GH) by neuroendocrine, endocrine, and paracrine factors in the zebrafish-An in vitro approach. General and Comparative Endocrinology. 160 (2), 183-193 (2009).
- Hodne, K., von Krogh, K., Weltzien, F. A., Sand, O., Haug, T. M. Optimized conditions for primary culture of pituitary cells from the Atlantic cod (Gadus morhua). The importance of osmolality, pCO2, and pH. General and Comparative Endocrinology. 178 (2), 206-215 (2012).
- Wittbrodt, J., Shima, A., Schartl, M. Medaka - a model organism from the far East. Nature Reviews Genetics. 3, 53-64 (2002).
- Matsuda, M., et al. DMY is a Y-specific DM-domain gene required for male development in the medaka fish. Nature. 417 (6888), 559-563 (2002).
- Kasahara, M., et al. The medaka draft genome and insights into vertebrate genome evolution. Nature. 447 (7145), 714-719 (2007).
- Miyanishi, H., Inokuchi, M., Nobata, S., Kaneko, T. Past seawater experience enhances seawater adaptability in medaka, Oryzias latipes. Zoological Letters. 2 (12), (2016).
- Waymouth, C. Osmolality of mammalian blood and of media for culture of mammalian cells. In Vitro. 6 (2), 109-127 (1970).
- Cameron, J. N. Acid-base homeostasis - past and present perspectives. Physiological Zoology. 62 (4), 845-865 (1989).
- Claiborne, J. B., Edwards, S. L., Morrison-Shetlar, A. I. Acid-base regulation in fishes: cellular and molecular mechanisms. Journal of Experimental Zoology. 293 (3), 302-319 (2002).
- Perry, S. F., Tufts, B. L. . Fish respiration. , (1998).
- Hildahl, J., et al. Developmental tracing of luteinizing hormone β-subunit gene expression using green fluorescent protein transgenic medaka (Oryzias latipes) reveals a putative novel developmental function. Developmental Dynamics. 241 (11), 1665-1677 (2012).
- Strandabø, R. A. U., et al. Signal transduction involved in GnRH2-stimulation of identified LH-producing gonadotropes from lhb-GFP transgenic medaka (Oryzias latipes). Molecular and Cellular Endocrinology. 372 (1-2), 128-139 (2013).
- Verbalis, J. G. Brain volume regulation in response to changes in osmolality. Neuroscience. 168 (4), 862-870 (2010).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon