Method Article
Анализ одной ячейки транскриптомики эндокринных клеток поджелудочной железы мыши
В этой статье
Резюме
Мы описываем метод для изоляции эндокринных клеток эмбриона, неонатальной и послеродовой поджелудочная железа, последовал сингл клеточной РНК последовательности. Этот метод позволяет анализ поджелудочной железы эндокринной линии развития, ячейка неоднородность и транскриптомики динамику.
Аннотация
Эндокринных клеток поджелудочной железы, которые сгруппированы в островки, регулируют стабильности глюкозы крови и энергии метаболизма. Типы отдельных клеток в островки, включая секреции инсулина β-клетками, отличаются от общей эндокринных прародителями на эмбриональной стадии. Незрелые эндокринные клетки расширить через пролиферации клеток и зрелые период долго постнатального развития. Однако механизмы, лежащие в основе этих процессов четко не определены. Одноместный клеточной РНК последовательности является перспективным подходом для характеризации различных клеточных популяций и трассировки клеток линии дифференциация путей. Здесь мы описываем метод для одноклеточных РНК секвенирование изолированных поджелудочной железы β клеток эмбриона, неонатальной и послеродовой поджелудочная железа.
Введение
Поджелудочная железа является жизненно важным органом метаболизма у млекопитающих. Поджелудочной железы состоит из эндокринной и экзокринной отсеков. Эндокринных клеток поджелудочной железы, включая инсулин продуцирующих клеток β и глюкагон продуцирующие клетки α, кластер вместе в островки Лангерганса и соответственно регулировать системных глюкозы гомеостаза. Дисфункцию эндокринных клеток приводит к сахарный диабет, который стал проблемой общественного здравоохранения во всем мире.
Эндокринных клеток поджелудочной железы являются производными от Ngn3+ прародителями во время эмбриогенеза1. Позже в перинатальный период, эндокринные клетки размножаются незрелых островков формы. Эти незрелые клетки продолжают развиваться и постепенно стать зрелой островков, которые становятся Богато васкуляризированной регулировать гомеостаз глюкозы крови в2взрослых.
Хотя были определены группы транскрипционный анализ факторов, которые регулируют β дифференцировки клеток, точные созревания путь β-клеток до сих пор неясно. Кроме того процесс созревания клеток β также включает в себя регулирование ячейки номер расширения3,4 и поколение сотовой неоднородность5,6. Однако механизмы регулирования этих процессов не были хорошо изучены.
Одноместный клеточной РНК последовательность является мощный подход, который может профиль субпопуляции клеток и отслеживать клеток линии развития пути7. Воспользовавшись этой технологии, ключ, который может быть расшифрована события, которые происходят во время разработки поджелудочной островок на одной ячейки уровня8. Среди одноклеточных РНК последовательность протоколов смарт seq2 позволяет поколение полнометражного cDNA с улучшена чувствительность и точность и использование стандартных реагентов на более низких затрат9. Смарт seq2 занимает около двух дней, чтобы построить кДНК библиотеки для секвенирования10.
Здесь, мы предлагаем метод для изоляции флуоресцировани обозначенного β клеток от поджелудочная железа из плода для взрослых Ins1-ЗП трансгенных мышей11, используя активированный флуоресценции клеток, сортируя (FACS) и производительность транскриптомики анализ на уровень одной ячейки, используя технологию смарт seq2 (рис. 1). Этот протокол может быть продлен для анализа transcriptomes всех типов эндокринных клеток поджелудочной железы в государствах нормальной, патологических и старения.
протокол
Все методы, описанные здесь были одобрены институциональный уход животных и использование Комитет (IACUC) Пекинского университета.
1. поджелудочная железа изоляции
-
Для E17.5 (эмбриональных день 17,5) эмбрионов:
- По оценкам эмбриональных день 0,5 основанные на момент времени, когда Вагинальные вилка появляется.
- Пожертвуйте беременных мышей администрацией CO2 . Спрей брюшной мех с 70% спирта.
- V-образный надрез сделайте ножницами из области половых органов, расширение с ребрами. Этот процесс будет полностью открыть брюшной полости.
- Вскрыть матки из брюшной полости и поместите его в блюдо 10 см, содержащие холодной PBS.
- Вскрыть эмбрионов из матки с тонким наконечником щипцы под стереомикроскопом, удаление других тканей, таких как плаценты и пуповины. Поместите все эмбрионы в 10 см блюдо, содержащие холодной PBS.
- Разорвать эмбрионов брюшной полости и выкопать висцеральных ткани с помощью пинцета, локоть. Перевести висцеральных ткани в блюдо черно нижний 6 см, содержащие холодной PBS.
- Поджелудочная железа расположена в верхней левой части живота и придает желудка, селезенки и двенадцатиперстную кишку (Желтая пунктирная линия на рисунке 2A)12. Отсоединить поджелудочная железа из висцеральных ткани с помощью щипцов и объединения ткани поджелудочной железы в 20 мл флакон с 5 мл раствора холодной коллагеназы 0.5 мг/мл: коллагеназа P 0.5 мг/мл в буфере изоляции (HBSS, содержащие 10 мм HEPES, 12 MgCl 5 мм глюкозы, рН 7,4).
-
Для мышей P0-P15 (послеродовой день 0-15):
- Пожертвовать и исправить мыши путем присоединения конечностей к кусок benchtop протектор с лентой. Спрей брюшной мех с 70% спирта.
- Полностью откройте брюшной полости, как описано в шаге 1.1.3. Вытяните кишечника и на левой стороне мыши. Эта процедура будет подвергать лопастями двенадцатиперстной кишки, желудка и селезенки, поджелудочной железы. Тщательно анализировать все лепестки поджелудочной железы (рис. 2B)12 и воедино ткани поджелудочной железы в 20 мл флакон с 5 мл раствора 0,5 мг/мл холодной коллагеназы.
-
Для мышей P18-P60 (послеродовой день 18-60):
- Приготовляют раствор коллагеназы. Держите на льду пока готовы для использования.
- Пожертвовать мыши и откройте брюшной полости, как упоминалось выше (шаг 1.1.2 и 1.1.3).
Примечание: Не повредит печени, любую рану в печень будет уменьшить давление потока в желчных протоков и снижают эффективность перфузии следующего шага. - Удаление Мечевидный. Вытяните кишечника и с правой стороны мыши и нажать левой и правой медиальной долей печени для каждой стороны, чтобы разоблачить желчного пузыря (белая стрелка в рисунке 2 c) и общего желчного протока.
- Зажим двенадцатиперстную кишку с парой небольших судов зажимы на верхней и нижней позиции, фланкируя на сайт, где желчных протоков входит в двенадцатиперстную кишку (Рисунок 2D).
Примечание: Не зажимайте желудка или селезеночной лопастями поджелудочной железы. Коллагеназы решение не будет поступать в желудка и селезенки мочку поджелудочной железы в следующий шаг, если зажата. - Заполните шприц с 5 мл раствора 0,5 мг/мл холодной коллагеназы и вставьте иглой 30 G в желчном пузыре. Аккуратно и плавно манипулировать иглы через общего желчного протока.
- Perfuse поджелудочной железы путем инъекций 1 – 5 мл 0,5 мг/мл холодной коллагеназы решения, в зависимости от размера мыши. Инъекция должна быть медленной и постоянной для предотвращения иглы от скольжения из протоков и для предотвращения разрыва под высоким давлением жидкости в кишечнике. Инъекции завершается, когда поджелудочная железа полностью развернут.
- Вскрыть поджелудочной железы (Желтая пунктирная линия в 2D рис) из брюшной полости, используя пинцет сразу после перфузии. Место ткани в 20 мл флакон с 5 мл раствора холодной коллагеназы 0.5 мг/мл. Если более чем одна мышь на время, perfuse мышей один за другим и бассейн тканей в холодной коллагеназы раствора в 20 мл во флаконе, до тех пор, пока все мышей были расчленены.
2. коллагеназы пищеварение и островок изоляции
- Место флакон 20 мл, содержащие ткани поджелудочной железы в ванну воды 37 ° C и Инкубируйте 3 минут, чтобы сбалансировать температуры.
- Осторожно встряхните трубки для еще 3-5 мин. Если ткани поджелудочной железы полностью накачан, он постепенно отмежеваться на куски небольшой ткани до тех пор, пока он, наконец, это рассеяны равномерно. Пищеварение время варьируется в зависимости от размер поджелудочной железы и эффективности перфузии.
- Фильтр переваривается продукт через стрейнер 0,25 мм нейлон в новых центрифуг Тюбик 50 мл. Тщательно промойте ситечко с помощью 20 мл шприц с ледяной PBS.
- Для E17.5-P15 поджелудочная железа перейдите к шагу 3.1.
- P18-P60 поджелудочная железа центрифуги на 200 x g за 1 мин и удалить супернатант. Вновь приостановите ткани с холодной PBS.
- Залейте 5 мл суспензии ткани в блюдо черно нижний 6 см. Панкреатических островков небольшой, компактный, молочно белый структуры и ацинарной ткани сыпучих и полупрозрачного белого. Выберите островков с 200 мкл пипетки и перенести их в 1,5 мл трубка, содержащая небольшое количество холодных PBS.
3. трипсина пищеварения или островков поджелудочной железы ткани
- Центрифуга трубка, содержащая ткани поджелудочной железы или островков на 200 x g 1 мин при температуре 4 ° C и удалить супернатант не нарушая гранулы.
- Вновь приостановить лепешка с 0,25% трипсина ЭДТА и инкубировать в ванну воды 37 ° C. После 4 минут инкубации мягко и иногда аспирационная (Пипетка) за 1 мин, используя 200 мкл советы.
Примечание: Для E17.5-P3 поджелудочная железа, добавляют 1 мл трипсина ЭДТА. P4-P15 поджелудочная железа добавьте 3 мл трипсина ЭДТА. Для 100-300 островков добавляют 1 мл трипсина ЭДТА. Отрегулируйте громкость трипсина-ЭДТА в зависимости от количества ткани. - Остановить пищеварение, добавив 0.4 x объем холодной плода бычьим сывороточным (ФБС) и смешать с нежным вихря.
- Центрифуга на 250 x g 3 мин при 4 ° C. Выбросите супернатант не нарушая гранулы.
- Вновь приостановить клетки с 200 мкл буфера холодной СУИМ (HBSS, содержащей 1% FBS, рН 7,4). Клетки перехода к 5 мл СУИМ.
- Быстро вращайте СУИМ трубки позволяют суспензию клеток пройти через фильтр для удаления остатков непереваренной большой ткани. Подвеска одну ячейку в трубе теперь готов к FACS сортировки.
4. одноклеточных Lysis
-
Подготовьте буфер lysis клетки.
Примечание: Выполните все эксперименты под капотом УФ стерилизации с ламинарным потоком. Все трубы, пластины и наконечники должны быть РНКазы - DNase- бесплатно. Обеззараживанию капот и пипетки с РНКазы прочь решения перед использованием.- Оттепель реагентов на льду: dNTP (10 мм), праймера oligo-dT (10 мкм) и ERCC складе раствор (1:20).
- Разбавить ERCC до 1:5 x 105 с нуклеиназы свободной воды.
- Рассчитайте объем буфера lysis клетки необходимы. Добавление 0.1 мкл битор РНКазы (40 U/мкл), 1,9 мкл 0,2% (vol/vol) Тритон X-100, 1 мкл dNTP, 1 мкл праймера oligo-dT и 0,05 мкл разбавленного ERCC в окончательный объем 4.05 мкл для каждой ячейки.
- Алиготе буфер lysis клетки в 0,2 мл тонкостенных 8-полоса ПЦР трубы или 96-луночных пластины. Центрифуга для трубы или пластины для 30 s при 4 ° C.
Примечание: Центрифуги 0,2 мл тонкостенных 8-полоса ПЦР трубы на 7500 x g и 96-луночных пластины на 800 x g в следующих шагах.
-
Одной ячейки комплектации и lysis.
- Вручную выбрать СУИМ отсортированный единичных клеток Ins1-ЗП+ в буфере СУИМ в 8-газа ПЦР трубок с помощью 30 – 40 мкм капиллярные Пипетка, или непосредственно сортировки единичных клеток Ins1-ЗП+ в 96-луночных пластины. Тома, содержащего одну ячейку считается менее 0,3 мкл.
Примечание: Использование вперед разброс высота (FSC-H) против вперед разброс области (FSC-) стробирования стратегия Дуплет дискриминации, против FSC-H стороне разброс области (SSC-A) для мусора и флуоресценции стробирования для сортировки клеток (рис. 3A-3C) Ins1-ЗП+ . Для метода сбора сортировки клеток-мишеней в 1,5 мл, содержащие 300 мкл буфера СУИМ. Соответствующие окончательные концентрация составляет 5 – 10 клеток/мкл. Скорректировать объем буфера. Для метода коллекции пластины сортировка одноклеточных в каждой скважине 96-луночных плиты после ручной инструмент. 7 , 13 - Вихревой трубы или пластины Лизируйте клетки и освободить РНК. Центрифуга для трубы или пластины для 30 s на 4 ° C и немедленно поместить их на льду.
Примечание: Клетки могут храниться при температуре-80 ° C на одну неделю.
- Вручную выбрать СУИМ отсортированный единичных клеток Ins1-ЗП+ в буфере СУИМ в 8-газа ПЦР трубок с помощью 30 – 40 мкм капиллярные Пипетка, или непосредственно сортировки единичных клеток Ins1-ЗП+ в 96-луночных пластины. Тома, содержащего одну ячейку считается менее 0,3 мкл.
5. одноклеточных cDNA усилители
-
Обратная транскрипция (RT).
- Оттепель на льду RT реагентов (Таблица 1).
- Проинкубируйте образцы на 72 ° C 3 мин и немедленно положить трубы или пластины на льду для по крайней мере 1 min. кратко центрифуга трубы или пластины для 30 s при 4 ° C.
Примечание: Использование тепловая велосипедист с крышкой 105 ° C подогревом для всех инкубаций. - Подготовьте смесь RT для всех реакций, как описано в таблице 1.
- Отказаться от 5.7 мкл RT смеси для каждого образца, довести объем до в общей сложности 10 мкл. Аккуратно водоворот смеси и центрифуги для 30 s при 4 ° C.
- Поместите образцы в тепловая велосипедист и запустить программу RT следующим: 42 ° C 90 мин, 10 циклов (50 ° C на 2 мин, 42 ° С 2 мин), 70 ° C на 15 мин и удерживайте при 4 ° C.
-
Предварительно амплификации PCR.
- Оттепель ПЦР реактивы (Таблица 2) на льду.
- Подготовьте смесь ПЦР для всех реакций, как описано в таблице 2.
- Отказаться от 15 мкл, комплекса ПЦР для каждого образца, который содержит перв стренги реакций. Аккуратно водоворот смеси и центрифуги для 30 s при 4 ° C.
- Поместите образцы в тепловая велосипедист и запустить программу следующие ПЦР: 98 ° С в течение 3 мин, 18 циклов (98 ° C 20 s, 67 ° C 15 s, 72 ° C для 6 мин), 72 ° C за 5 мин и удерживайте при 4 ° C.
Примечание: Продукт PCR может храниться при температуре 4 ° C для менее чем за одну неделю или в-20 ° C /-80 ° C до 6 месяцев.
-
PCR очистки.
- Добавьте 25 мкл вновь приостановлено ДНК очистка бусин (1 x) для каждого образца из предыдущего шага и перемешать хорошо, вихрь. Затем быстро спина трубки или пластин при комнатной температуре для сбора жидкости, но избежать поселение бусины.
Примечание: Сбалансировать ДНК очистки бусины в комнатной температуре в течение 15 мин и вихревой тщательно перед использованием. - Инкубируйте 5 мин при комнатной температуре.
- Место трубки или пластины на соответствующий магнитный стоять до тех пор, пока раствор не станет прозрачным, а затем тщательно снимите и выбросьте супернатант.
- Добавить 200 мкл свежеприготовленные 80% этанола мыть бусины в магнитного стенд, Инкубируйте 30 сек, затем осторожно снимите и выбросьте этанола раствор.
Примечание: 80% (vol/vol) этанола раствор должен быть свежеприготовленные каждый раз. - Повторите шаг 5.3.4 для в общей сложности двух стирок.
- Осторожно снимите и выбросьте остальные этанола раствор и воздух сухой бусины во время трубки или пластины на магнитного стенд.
Примечание: Избегайте чрезмерного высыхания бусы для обеспечения максимальной элюции эффективности. - Добавьте 11 мкл нуклеиназы свободной воды элюировать ДНК целевой из бисера и смешайте хорошо вихря. Затем быстро спина трубки или тарелку и поместите его на магнитную подставку до тех пор, пока раствор не станет прозрачным. Передача 10 мкл пример новой ПЦР-пробирку.
Примечание: Если димеры существует после одного раунда очистки, основанный на обнаружении распределения размера cDNA, очищайте снова полностью удалить димеры. Димеры могут влиять расчет доходности cDNA, если разрешено остаться в образце.
- Добавьте 25 мкл вновь приостановлено ДНК очистка бусин (1 x) для каждого образца из предыдущего шага и перемешать хорошо, вихрь. Затем быстро спина трубки или пластин при комнатной температуре для сбора жидкости, но избежать поселение бусины.
-
Проверка качества cDNA.
- Случайным образом выберите образцы для определения cDNA общей мощности с помощью флуориметр.
- Оцените уровни выражения гена маркер в реальном масштабе времени PCR (ПЦР) (Рисунок 4E). Удаление 1 мкл пример разбавлять 40 раз и выполнять ПЦР с помощью пластины 384-Ну. Подготовьте смесь ПЦР, как описано в таблице 3. Велоспорт условия: 95 ° C в течение 10 мин, 45 циклов (95 ° C в течение 10 сек, 60 ° C 15 s, 72 ° C для 15 s).
- Случайным образом выберите образцы для определения распределения размеров, с помощью инструмента параллельно капиллярного электрофореза.
6. кДНК библиотеки строительных
-
Tagmentation реакция на Tn5 Транспозаза.
- Обнаружить cDNA общая доходность ПЦР выбранных клеток из шага с помощью флуориметр 5.4.2. Использование 2 нг cDNA как исходного материала.
- Оттепель реагенты реакции tagmentation (Таблица 4) на льду.
- Подготовка tagmentation реакции в 0,2 мл тонкостенных 8-полоса ПЦР-пробирку, как описано в таблице 4и тщательно перемешать, вихрь. Затем быстро вращаться вниз решения при комнатной температуре.
- Проинкубируйте образцы при 55 ° C для 10 мин и удерживайте при 4 ° C.
- Сразу же добавьте 2 мкл 5 x TS для каждого образца, содержащие tagmented ДНК, чтобы остановить реакции. Тщательно перемешать, вихря, а затем быстро вращаться вниз решения при комнатной температуре.
- Инкубируйте смесь для 5 мин при комнатной температуре. ДНК должны быть обработаны для окончательного обогащения ПЦР немедленно.
-
Амплификация фрагментов лигируют адаптер.
- Оттепель ПЦР реактивы (Таблица 5) на льду.
- Подготовка смеси ПЦР обогащения, как описано в таблице 5и тщательно перемешать, вихрь. Затем быстро вращаться вниз решения при комнатной температуре.
- Выполнять ПЦР, используя следующую программу: 72 ° C в течение 10 мин, 98 ° C за 30 s, 8 циклов (98 ° C в течение 15 сек, 60 ° C за 30 s, 72 ° C в течение 3 мин), 72 ° C за 5 мин и удерживайте при 4 ° C.
Примечание: Количество циклов зависит от суммы ожидаемой библиотеки ДНК.
-
ПЦР очистки с выбором размера.
- Добавьте 14 мкл вновь приостановлено ДНК очистка бусин (0,7 x) для каждого образца из предыдущего шага и перемешать хорошо, вихрь. Затем быстро спина трубки при комнатной температуре для сбора жидкости, но избежать поселение бусины.
Примечание: Сбалансировать ДНК очистки бусины в комнатной температуре в течение 15 мин и вихревой тщательно перед использованием. - Инкубируйте 5 мин при комнатной температуре.
- Поместите трубку на соответствующие магнитного стенд до тех пор, пока раствор не станет прозрачным, тщательно супернатант передать новой трубки газа и отменить предыдущие полосой трубы.
- Добавить 3 мкл вновь приостановлено ДНК очистка бусин (0,15 x) для каждого образца в трубку полосой и микс также от вихря. Затем быстро вращайте трубу при комнатной температуре.
- Инкубируйте 5 мин при комнатной температуре.
- Место трубки или пластины на соответствующий магнитный стоять до тех пор, пока раствор не станет прозрачным, а затем тщательно снимите и выбросьте супернатант.
- Добавить 200 мкл свежеприготовленные 80% этанола мыть бусины в магнитного стенд, Инкубируйте 30 сек, затем осторожно снимите и выбросьте этанола раствор.
Примечание: 80% (vol/vol) этанола раствор должен быть свежеприготовленные каждый раз. - Повторите шаг 6.3.7 для в общей сложности двух стирок.
- Осторожно снимите и выбросьте остальные этанола раствор и воздух сухой бусины во время трубки или пластины на магнитного стенд.
Примечание: Избегайте чрезмерного высыхания бусы для обеспечения максимальной элюции эффективности. - Добавьте 11 мкл нуклеиназы свободной воды элюировать ДНК целевой из бисера и смешайте хорошо вихря. Затем быстро спина трубки или тарелку и поместите его на магнитную подставку до тех пор, пока раствор не станет прозрачным. Передача 10 мкл пример новой трубки полосой.
- Добавьте 14 мкл вновь приостановлено ДНК очистка бусин (0,7 x) для каждого образца из предыдущего шага и перемешать хорошо, вихрь. Затем быстро спина трубки при комнатной температуре для сбора жидкости, но избежать поселение бусины.
-
Проверка качества окончательной кДНК библиотеки.
- Измерить концентрацию каждой библиотеки с помощью флуориметр и проверить распределение по размерам, с помощью инструмента параллельно капиллярного электрофореза.
Примечание: ДНК урожайность обычно составляет 15 – 25 нг для каждой библиотеки. Фрагменты, начиная от 250 bp до 450 bp будет соблюдаться. Если димеры остаются после очистки, что подтверждается проверка распределения размера, очищают с 1 x ДНК очистки бусы еще один раз.
- Измерить концентрацию каждой библиотеки с помощью флуориметр и проверить распределение по размерам, с помощью инструмента параллельно капиллярного электрофореза.
-
Объединение библиотек
- На основе размера примерный фрагмент, бассейн равное количество ДНК от каждого образца, обеспечивая, что никто из них не содержат те же комбинации адаптеры N6XX и N8XX.
7. ДНК-последовательности
- Тема перепутываются библиотеки 51 bp один конец последовательности с помощью высокопроизводительного секвенирования системы. Выполните последовательность после производителя протокол. Секвенирование глубина каждой ячейки составляет около 1 миллиона читает в среднем8, по крайней мере 0,5 млн читает в ячейке14.
8. Биоинформатика анализы
-
Последовательность, оценки качества и выравнивание.
- Оценить качество последовательного читает с помощью FastQC (v0.11.3)15 со следующими параметрами: «fastqc--экстракт -o output_dir input_fastq».
- Слияние в геноме мыши с ERCC последовательностей, с помощью команды «кошка mm10.fa ERCC.fa > mm10_ERCC.fa».
- Построить bowtie2 (v2.2.5)16 индекса со следующими параметрами: «bowtie2-строить mm10_ERCC.fa mm10_ERCC».
- Выравнивание с помощью tophat2 читает17 (v2.1.0) со следующими параметрами: «tophat2 -o output_dir -G gene.gtf--транскриптом-индекс trans_index mm10_ERCC input_fastq».
-
Определить уровни выражения гена.
- Считывает count сопоставлены для каждого гена, с помощью HTSeq (v 0.6.0)18 со следующими параметрами: '' htseq граф - БАМ - р pos -ф не - 30 gene.gtf accepted_hits.bam > read_count.txt''.
- Нормализуют уровни выражения гена для стенограмм за миллион (TPM)19.
-
Контроль качества клеток.
- Исключить ячейки с менее чем 0,5 млн сопоставленных читает или менее 4000 генов (TPM > 1).
Примечание: критерий исключения зависит от типов клеток и последовательности глубины. - Сохранить клетки, выражая Эндокринные маркеры (например, Ins1 для β-клеток, ГКГ для α клетки) и исключить ячейки, выражая-эндокринных маркеров (например, Spi1 для лейкоцитов).
- Исключить ячейки с менее чем 0,5 млн сопоставленных читает или менее 4000 генов (TPM > 1).
-
Анализ главных компонент (PCA)
- Идентифицировать высоко вариабельные генов согласно ERCC Спайк модули, как описано выше20.
- Выполняют PCA с помощью функции «PCA» в R пакет21FactoMineR (v1.31.4), с log2(TPM + 0.1) высоко вариабельные генов.
- Визуализируйте результаты СПС с ggplot2 (v2.0.0)22.
-
Иерархические кластеризации.
- Идентифицировать гены с высоким нагрузкам главных компонент (PC), используя функцию «dimdesc» FactoMineR (v1.31.4)21.
- Выполнять иерархической кластеризации с помощью функции «heatmap.2» в gplots (версия 3.0.1) R пакет23с log2 (TPM + 1) относительные значения высокой ПК загрузки генов.
Результаты
Поджелудочная железа были расчленены от мышей эмбриональных, неонатальной и послеродовой (рисунок 2A и 2B). Для мышей старше 18 день послеродового пищеварительной эффект зависит от степени перфузии; Таким образом, инъекции является наиболее важным шагом для изоляции островок (рис. 2 c-2E и Таблица 6). Столько коллагеназы был введен как можно заполнить поджелудочной железы во время этого шага. Полностью завышенным поджелудочной железы показана на рисунке 2D. Если перфузии не является успешным (Рисунок 2E), но образец драгоценные, поджелудочной железы может быть разорвана на мелкие кусочки для достаточно пищеварения позже.
После перфузии ткани поджелудочной железы был усваиваются на мелкие кусочки выпустить островков (Рисунок 2F). Чтобы сократить время сортировки СУИМ, мы обогатили эндокринные клетки, выбирая островки заранее. Размер островки может варьироваться в зависимости от возраста мыши и интенсивности пищеварения. Иногда островки не круглой формы. Островки должен быть выбран согласно цвет и компактный состояние (Рисунок 2 g и Таблица 6). Если штамм трансгенные мыши имеет Репортер ген, например GFP или ППП для эндокринных клеток, островки может также взял под флуоресцентным микроскопом.
Ins1-ЗП+ клетки были очищены, FACS, сортировка (Рисунок 3А-3 C), а затем отдельные клетки были собраны с использованием капиллярные пипетки для одной ячейки РНК seq (рис. 3D). Успешно усиливается cDNA должны иметь полную длину выше 500 bp и обогащаться от 1,5 КБ до 2 КБ. Кроме того существует, как правило, 500-600 ВР обогащения cDNA, наблюдается в Ins1-ЗП+ клеток, которые могут представлять собой инсулина стенограммы (рис. 4A). Однако там были некоторые аномальных ситуаций наблюдаемых10 (Таблица 6). К примеру, фрагментов кДНК вблизи 100 bp являются Димеры праймера (рис. 4B), которые обычно вызваны чрезмерным грунтовки, которые должны быть удалены, повторив шаг очищение ДНК. Существование Димеры праймера могут влиять расчеты доходности всего cDNA, которые используются для строительства следующих библиотеки. Фрагментов кДНК между 100 bp и 500 bp обычно представляют деградированных cDNA (рис. 4 c), что вызвано плохой ячейки статуса или реагента проблемы, такие как РНКазы загрязнения. При этом условии мы должны определить причины деградации ДНК и исключить нарушения. Например обеспечить хороший ячейки статуса, должны быть осмыслены тканей и клеток должны сортироваться быстро и аккуратно, и операции должны выполняться осторожно во избежание любых видов загрязнителей.
После очистки кДНК библиотек для виртуализации мы получили фрагментов кДНК различных размеров, следуя инструкциям для добавления различных соотношениях бисера очистки ДНК образца. Например, мы можем получить cDNA, начиная от 250 bp 450 bp Добавление 0,7 x и 0,15 x ДНК очистки бусы на первый и второй раунды очистки, соответственно (рис. 4 d). Этот шаг имеет высокий уровень успеха. Однако если есть фрагменты приблизительно 100 bp, он предложил, чтобы очистить библиотеки снова с 1 x ДНК бусины очистки для удаления димеров (Таблица 6). Оставленных димеров будут исказить количественного определения ДНК и будет влиять образец объединение результатов, что приводит к неравномерным сбора от каждого образца.
Мы проанализировали данные последовательности с подходы биоинформатики (Рисунок 5A). Показатели качества последовательности должно быть больше чем 30 во время виртуализации качества оценки (Рисунок 5B). После выравнивания 80-90% читает, как ожидается, сопоставить ссылку генома. Для получения высокого качества клеток для вниз по течению анализов, мы исключены клетки с менее 0,5 млн сопоставленных читает или с менее 4000 обнаружены гены (рис. 5 c и 5 D). После PCA и иерархической кластеризации мы характеризуется различными группами клеток и определены гены, которые гетерогенно были выражены в8различных групп.

Рисунок 1: Схематичный обзор для одной ячейки РНК seq мыши клеток поджелудочной железы эндокринной. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 2: рассечение поджелудочной железы, перфузии и островок собирание. (A) рассечение эмбриональной ткани поджелудочной железы (Нижняя) из эмбриона E17.5 (верхний). Желтая пунктирная линия разграничивает ткани поджелудочной железы. Шкалы бар = 1000 мкм. (B) рассечение послеродовой ткани поджелудочной железы (справа) от P10 мыши (слева). Шкалы бар = 1000 мкм. (C-D) ткани поджелудочной железы P60 мыши до (C) и (D) перфузии. Желтая пунктирная линия разграничивает ткани поджелудочной железы. Белая стрелка указывает желчного пузыря. (E) частично перфузии тканей поджелудочной железы мыши P60. Красная стрелка показывает хорошо перфузии области поджелудочной железы. Синие стрелки указывает плохо перфузии области поджелудочной железы. (F) поджелудочной железы ткани до (вверху) и после (внизу) коллагеназы переваривания. (G) стрелки указывают на островки, которые были выпущены от коллагеназы переваривается ткани поджелудочной железы. Шкалы бар = 200 µm. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 3: вручную выбирать ячейки с 30-40 мкм капиллярные пипетки под микроскопом. (A-C) Поэтапный СУИМ стробирования для сортировки клеток Ins1-ЗП+ . (D) яркие круги показывают клетки и трубка является капиллярные пипетки. Выберите ячейки с лучше морфологии (стрелка) и игнорировать кластерного клетки (стрелки). Шкалы бар = 200 µm. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 4: Качество обнаружения cDNA и библиотека размер распределения клеток Ins1-ЗП+ инструмент параллельной капиллярного электрофореза. (A) представитель результат успешно предварительно усиленный cDNA. Как правило, cDNA профиль должен быть выше 500 bp с пика ~1.5–2 КБ. (B) представитель результат предварительно усиленный cDNA с пик димера праймера. Пик димера праймера составляет приблизительно 100 bp. (C) профиль предварительно усиленный cDNA с фрагментами между 100 bp и 500 bp указывает на возможность cDNA деградации. (D) размер распределение кДНК библиотеки колеблется от 250 bp и 450 bp после очистки шагов, упомянутых в настоящем Протоколе. (E) выражение уровня Ins2 в библиотеках cDNA ПЦР (слева) и относительной последовательности данных (справа). X-axes представляют собой собственный 8 проб в одну ячейку. Ось y (слева) представляет собой нормализованное ΔCt относительно Gapdh (CtGapdh- CtIns2 + 6) и оси y (справа) представляет собой выражение, нормированный уровень Ins2 относительно Gapdh (журнал2(TPM Ins2 / доверенного платформенного модуляGapdh)). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
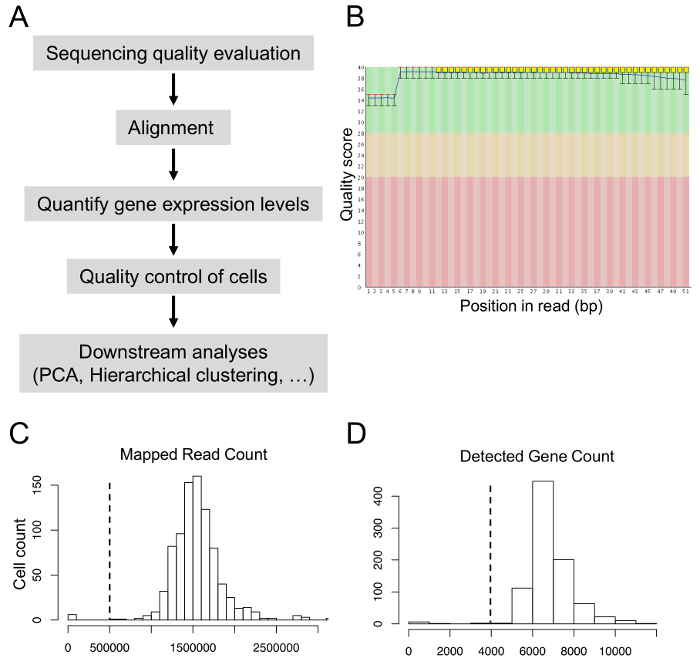
Рисунок 5: Биоинформатика анализ данных одной ячейки транскриптом. (A) конвейер биоинформатики анализов. (B) последовательность показателей качества во всех базах гласит. (C) распределение сопоставленных чтения count. (D) распределение обнаруженных ген игр. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
| Компонент | Объем (мкл) |
| Обратной транскриптазы (200 U/мкл) | 0.5 |
| АБС битор РНКазы | 0.25 |
| Перв стренги буфера (5 x) | 2 |
| DTT (100 мм) | 0.5 |
| Бетаин (5 М) | 2 |
| MgCl2 (1м) | 0,06 |
| ОПС (100 МКМ) | 0.1 |
| Нуклеаза свободной воды | 0.29 |
| Итого | 5.7 |
Таблица 1: RT реагент смешать компоненты в 5,7 мкл реакции для каждого образца.
| Компонент | Объем (мкл) |
| Перв стренги реакция | 10 |
| ДНК-полимераза (2 x транспортный) | 12.5 |
| Это праймеры PCR (10 мкм) | 0.25 |
| Нуклеаза свободной воды | 2.25 |
| Итого | 25 |
Таблица 2: Реагента до амплификации PCR смешать компоненты в 25 мкл реакции для каждого образца
| Компонент | Объем (мкл) |
| SYBR зеленый Мастер микс | 5 |
| Грунтовки (5 мкм) | 0.5 |
| Нуклеаза свободной воды | 2.5 |
| cDNA | 2 |
| Итого | 10 |
Таблица 3: ПЦР реагент смешать компоненты в 10 мкл реакции с использованием стандартной плиты 384-хорошо.
| Компонент | Объем (мкл) |
| 5 x TTBL | 1.6 |
| 2 нг cDNA | Переменная |
| ddH2O | Переменная |
| TTE Mix V5 | 2 |
| Итого | 8 |
Таблица 4: Tagmentation реагент смешать компоненты в 8 мкл реакции для каждого образца.
| Компонент | Объем (мкл) |
| ddH2O | 1.6 |
| Результатом предыдущего шага | 10 |
| 5 вкладка x | 4 |
| N6XX | 2 |
| N8XX | 2 |
| ТЭ | 0.4 |
| Итого | 20 |
Таблица 5: Обогащение ПЦР реагент смесь компонентов в 20 мкл реакции для каждого образца.
| Шаг | Проблема | Возможность | Решение |
| 1.3.4 | Проскальзывания зажимы | Внешняя поверхность кишечника мокрой вызванных существование небольшое количество межклеточной жидкости и collegenase leakness | Аккуратно замените стенку двенадцатиперстной кишки и других органа стены в брюшной полости с ватные тампоны |
| 1.3.6 | Кишечник взрыв | Давление жидкости слишком высока в кишечнике | Замедлить скорость впрыска |
| 2.6 | Островки придерживаться экзокринной ткани при выборе островков | Недостаточно пищеварение | Продлить продолжительность переваривания и покачивая прочность |
| 5.3 | CDNA урожайность низкая после амплификации PCR | Клетки находятся в плохом состоянии | Держите клетки, свежими и в хорошем состоянии |
| 5.4 или 6.4 | Димеры праймера можно увидеть | Чрезмерная праймеры | Очистить cDNA еще раз с бисером очистки ДНК (0.8:1 или соотношение 1:1) |
| 5.4 | Деградированных cDNA после амплификации PCR | Низкое качество клеток или загрязненных реагентов | Держите клетки в хорошем состоянии или изменить реагентов |
| 6.3 | Количество ДНК низкой после строительства библиотеки | Слишком мало циклов PCR или качество cDNA не хорошо | Увеличить количество циклов или обеспечения качества cDNA прежде чем библиотека строительства |
Таблица 6: Устранение неполадок.
Обсуждение
В этом протоколе мы продемонстрировали эффективный и простой в использовании метод для изучения одной ячейки выражение профили клеток поджелудочной железы β. Этот метод может использоваться для выполнения одной ячейки транскриптомики анализов и изолировать эндокринных клеток эмбриона, неонатальной и послеродовой поджелудочная железа.
Наиболее важным этапом является изоляция одного β-клеток в хорошем состоянии. Полностью перфузии поджелудочная железа лучше реагировать на последующее пищеварение. Недостаточной перфузии, которое обычно происходит в спинной поджелудочной железы, приведет к низкой островок урожайности. После перфузии время пищеварения и покачивая интенсивности требуют особого внимания. Чрезмерной пищеварение, результате длительный инкубационный раз и энергичные встряхивания, можно разбить островки на куски. Недостаточности переваривания не будет полностью отдельные островки от прилегающих тканей. После переваривания поджелудочная железа островки были очищены собирание вручную, а не плотность градиентного центрифугирования. Хотя плотность градиентного центрифугирования можно обогатить островков, многие небольшие островки или островков, связанных с ацинарной ткани ошибочно отбрасываются. Старайтесь избегать комплектации ацинарной ткани, которая может привести к неэффективной трипсина пищеварение и уменьшить чистоту β-клеток.
Независимые биологических реплицирует необходимы для разграничения биологических последствий изменчивости и партии. Если два биологических реплицирует аналогичная картина в PCA и включают аналогичные подгрупп в Кластеризация результатов, эти образцы могут выявить надежный биологической вариативности. В противном случае дополнительные биологические реплицирует необходимы для подтверждения результатов. Для метаболических органа например, поджелудочной железы состояние клетки, связанное с суточного часов24 может учитывать различия партии. Для решения этой проблемы, мы рекомендуем, собирая все образцы в то же время дня.
Ограничение этого подхода является низкая пропускная способность, потому что мы должны построить библиотеку для каждой ячейки. Из-за чрезмерного грунтовки в реакции cDNA до и после строительства библиотеки обычно следует очищаться дважды, чтобы полностью удалить Димеры праймера. Эти процессы требуют времени. Недавно измененный Протокол25 было сообщено, что может решить эту проблему в некоторой степени. В этом протоколе клетки специфические штрих-код этикетки фрагментов кДНК во время шага обратной транскрипции. Таким образом, cDNA каждой ячейки могут быть объединены вместе и затем должна быть очищена, следуют строительство библиотеки. Это изменение значительно увеличивает пропускную способность библиотеки строительства. Однако этот модифицированный метод менее чувствителен и обнаруживает меньше генов в клетки. Кроме того этот метод является 3' подсчитывая метод с сокращением чтения освещение. Таким образом смарт seq2 по-прежнему является наиболее подходящим методом для поджелудочной железы развития.
Поджелудочной железы подготовки от других видов могут быть разными. Для человека поджелудочной железы островки может быть изолирован после предыдущих протоколов26,27. Затем изолированные островки может быть отделен в одиночных клетках28 и выполнять анализ одной ячейки с помощью этого метода. Этот метод может быть широко применяется для исследования развития млекопитающих поджелудочной железы, болезней и регенерации.
Раскрытие информации
Авторы не имеют ничего сообщать.
Благодарности
Мы благодарим Национальный центр наук белка, Пекин (Пекинский университет) и Peking-Цинхуа центр вычислительной платформы науки о жизни. Эта работа была поддержана Министерством науки и техники Китая (2015CB942800), Национальный фонд Китая естественных наук (31521004, 31471358 и 31522036), и финансирование от Peking-Цинхуа Центр наук о жизни в C.-R.X.
Материалы
| Name | Company | Catalog Number | Comments |
| Collagenase P | Roche | 11213873001 | |
| Trypsin-EDTA (0.25 %), phenol red | Thermo Fisher Scientific | 25200114 | |
| Fetal bovine serum (FBS) | Hyclone | SH30071.03 | |
| Dumont #4 Forceps | Roboz | RS-4904 | |
| Dumont #5 Forceps | Roboz | RS-5058 | |
| 30 G BD Needle 1/2" Length | BD | 305106 | |
| Stereo Microscope | Zeiss | Stemi DV4 | |
| Stereo Fluorescence microscope | Zeiss | Stereo Lumar V12 | |
| Centrifuge | Eppendorf | 5810R | |
| Centrifuge | Eppendorf | 5424R | |
| Polystyrene Round-Bottom Tube with Cell-Strainer Cap | BD-Falcon | 352235 | |
| 96-Well PCR Microplate | Axygen | PCR-96-C | |
| Silicone Sealing Mat | Axygen | AM-96-PCR-RD | |
| Thin Well PCR Tube | Extragene | P-02X8-CF | |
| Cell sorter | BD Biosciences | BD FACSAria | |
| Capillary pipette | Sutter | B100-58-10 | |
| RNaseZap | Ambion | AM9780 | |
| ERCC RNA Spike-In Mix | Life Technologies | 4456740 | |
| Distilled water | Gibco | 10977 | |
| Triton X-100 | Sigma-Aldrich | T9284 | |
| dNTP mix | New England Biolabs | N0447 | |
| Recombinant RNase Inhibitor | Takara | 2313 | |
| Superscript II reverse transcriptase | Invitrogen | 18064-014 | |
| First-strand buffer (5x) | Invitrogen | 18064-014 | |
| DTT | Invitrogen | 18064-014 | |
| Betaine | Sigma-Aldrich | 107-43-7 | |
| MgCl2 | Sigma-Aldrich | 7786-30-3 | |
| Nuclease-free water | Invitrogen | AM9932 | |
| KAPA HiFi HotStart ReadyMix (2x) | KAPA Biosystems | KK2601 | |
| VAHTS DNA Clean Beads XP beads | Vazyme | N411-03 | |
| Qubit dsDNA HS Assay Kit | Invitrogen | Q32854 | |
| AceQ qPCR SYBR Green Master Mix | Vazyme | Q121-02 | |
| TruePrep DNA Library Prep Kit V2 for Illumina | Vazyme | TD502 | Include 5x TTBL, 5x TTE, 5x TS, 5x TAB, TAE |
| TruePrep Index Kit V3 for Illumina | Vazyme | TD203 | Include 16 N6XX and 24 N8XX |
| High Sensitivity NGS Fragment Analysis Kit | Advanced Analytical Technologies | DNF-474 | |
| 1x HBSS without Ca2+ and Mg2+ | 138 mM NaCl; 5.34 mM KCl 4.17 mM NaHCO3; 0.34 mM Na2HPO4 0.44 mM KH2PO4 | ||
| Isolation buffer | 1 × HBSS containing 10 mM HEPES, 1 mM MgCl2, 5 mM Glucose, pH 7.4 | ||
| FACS buffer | 1 × HBSS containing 15 mM HEPES, 5.6 mM Glucose, 1% FBS, pH 7.4 | ||
| NaCl | Sigma-Aldrich | S5886 | |
| KCl | Sigma-Aldrich | P9541 | |
| NaHCO3 | Sigma-Aldrich | S6297 | |
| Na2HPO4 | Sigma-Aldrich | S5136 | |
| KH2PO4 | Sigma-Aldrich | P5655 | |
| D-(+)-Glucose | Sigma-Aldrich | G5767 | |
| HEPES | Sigma-Aldrich | H4034 | |
| MgCl2 | Sigma-Aldrich | M2393 | |
| Oligo-dT30VN primer | 5'-AAGCAGTGGTATCAA CGCAGAGTACT30VN-3' | ||
| TSO | 5'-AAGCAGTGGTATCAAC GCAGAGTACATrGrG+G-3' | ||
| ISPCR primers | 5'-AAGCAGTGGTAT CAACGCAGAGT-3' | ||
| Gapdh Forward primer | 5'-ATGGTGAAGGTC GGTGTGAAC-3' | ||
| Gapdh Reverse primer | 5'-GCCTTGACT GTGCCGTTGAAT-3' | ||
| Ins2 Forward primer | 5'-TGGCTTCTTC TACACACCCA-3' | ||
| Ins2 Reverse primer | 5'-TCTAGTTGCA GTAGTTCTCCA-3' |
Ссылки
- Gu, G., Dubauskaite, J., Melton, D. A. Direct evidence for the pancreatic lineage: NGN3+ cells are islet progenitors and are distinct from duct progenitors. Development. 129 (10), 2447-2457 (2002).
- Oliver-Krasinski, J. M., Stoffers, D. A. On the origin of the beta cell. Genes & Development. 22 (15), 1998-2021 (1998).
- Dor, Y., Brown, J., Martinez, O. I., Melton, D. A. Adult pancreatic beta-cells are formed by self-duplication rather than stem-cell differentiation. Nature. 429 (6987), 41-46 (2004).
- Smukler, S. R., et al. The adult mouse and human pancreas contain rare multipotent stem cells that express insulin. Cell Stem Cell. 8 (3), 281-293 (2011).
- Dorrell, C., et al. Human islets contain four distinct subtypes of beta cells. Nature Communications. 7, 11756(2016).
- Bader, E., et al. Identification of proliferative and mature beta-cells in the islets of Langerhans. Nature. 535 (7612), 430-434 (2016).
- Saliba, A. E., Westermann, A. J., Gorski, S. A., Vogel, J. Single-cell RNA-seq: Advances and future challenges. Nucleic Acids Research. 42 (14), 8845-8860 (2014).
- Qiu, W. L., et al. Deciphering pancreatic islet beta cell and alpha cell maturation pathways and characteristic features at the single-cell level. Cell Metabolism. 25 (5), 1194-1205 (2017).
- Picelli, S., et al. Smart-seq2 for sensitive full-length transcriptome profiling in single cells. Nature Methods. 10 (11), 1096-1098 (2013).
- Picelli, S., et al. Full-length RNA-seq from single cells using Smart-seq2. Nature Protocols. 9 (1), 171-181 (2014).
- Piccand, J., et al. Pak3 promotes cell cycle exit and differentiation of beta-cells in the embryonic pancreas and is necessary to maintain glucose homeostasis in adult mice. Diabetes. 63 (1), 203-215 (2014).
- Veite-Schmahl, M. J., Regan, D. P., Rivers, A. C., Nowatzke, J. F., Kennedy, M. A. Dissection of the mouse pancreas for histological analysis and metabolic profiling. Journal of Visualized Experiments. (126), (2017).
- Hu, P., Zhang, W., Xin, H., Deng, G. Single cell isolation and analysis. Frontiers in Cell and Developmental Biology. 4, 116(2016).
- Haque, A., Engel, J., Teichmann, S. A., Lonnberg, T. A practical guide to single-cell RNA-sequencing for biomedical research and clinical applications. Genome Medicine. 9 (1), 75(2017).
- Andrews, S. FastQC: A quality control tool for high throughput sequence data. , Available from: https://www.bioinformatics.babraham.ac.uk/projects/fastqc/ (2010).
- Langmead, B., Salzberg, S. L. Fast gapped-read alignment with Bowtie 2. Nature Methods. 9 (4), 357-359 (2012).
- Kim, D., et al. TopHat2: accurate alignment of transcriptomes in the presence of insertions, deletions and gene fusions. Genome Biology. 14 (4), (2013).
- Anders, S., Pyl, P. T., Huber, W. HTSeq--a Python framework to work with high-throughput sequencing data. Bioinformatics. 31 (2), Oxford, England. 166-169 (2015).
- Wagner, G. P., Kin, K., Lynch, V. J. Measurement of mRNA abundance using RNA-seq data: RPKM measure is inconsistent among samples. Theory in Biosciences. 131 (4), 281-285 (2012).
- Brennecke, P., et al. Accounting for technical noise in single-cell RNA-seq experiments. Nature Methods. 10 (11), 1093-1095 (2013).
- Le, S., Josse, J., Husson, F. FactoMineR: An R package for multivariate analysis. Journal of Statistical Software. 25 (1), (2008).
- Hadley, W. ggplot2: Elegant graphics for data analysis. , Springer Science & Business Media. (2009).
- Warnes, G., Bolker, B., Bonebakker, L., Gentleman, R., Huber, W., Liaw, A., Lumley, T., Mächler, M., Magnusson, A., Möller, S. gplots: Various R Programming Tools for Plotting Data. , Available from: https://cran.r-project.org/package=gplots (2016).
- Marcheva, B., et al. Disruption of the clock components CLOCK and BMAL1 leads to hypoinsulinaemia and diabetes. Nature. 466 (7306), 627-631 (2010).
- Li, L., et al. Single-cell RNA-seq analysis maps development of human germline cells and gonadal niche interactions. Cell Stem Cell. , (2017).
- Qi, M., et al. Human pancreatic islet isolation: Part I: Digestion and collection of pancreatic tissue. Journal of Visualized Experiments. (27), (2009).
- Qi, M., et al. Human pancreatic islet isolation: Part II: Purification and culture of human islets. Journal of Visualized Experiments. (27), (2009).
- Teo, A. K. K., et al. Single-cell analyses of human islet cells reveal de-differentiation signatures. Cell Death Discovery. 4 (14), (2018).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены