Method Article
Transcriptomic תא בודד ניתוחים של תאים בלבלב האנדוקרינית העכבר
In This Article
Summary
אנו מתארים שיטה בידודו של תאים האנדוקרינית הלבלב עובריים, neonatal ופוסט ואחריו רצפי RNA בתא יחיד. שיטה זו מאפשרת ניתוח של השושלת האנדוקרינית הלבלב פיתוח, תא dynamics הטרוגניות, transcriptomic.
Abstract
תאים האנדוקרינית הלבלב, אשר מקובצים ב איונים, לווסת את חילוף החומרים האנרגיה והיציבות של גלוקוז בדם. סוגי תאים נפרדים באיונים, כולל הורמון האינסולין תאי β, נבדלים אבות האנדוקרינית נפוצה בשלב העוברי. תאים אנדוקריני ילדותי להרחיב באמצעות התפשטות תאים ולומדים במהלך תקופה ארוכה כמחנכת התפתחותית. עם זאת, המנגנונים תהליכים אלה אינם מוגדרים בבירור. תא בודד RNA-רצף היא גישה מבטיחה עבור אפיון אוכלוסיות תאים נפרדים מסלולים עקיבה תא שושלת היוחסין בידול. כאן, אנו מתארים שיטה עבור RNA בתא יחיד-הרצף של תאי β בלבלב מבודד מן הלבלב עובריים, neonatal ופוסט.
Introduction
הלבלב הוא איבר חיוני מטבולית אצל יונקים. הלבלב מורכבת האנדוקרינית אקסוקרינית של תאים. תאים האנדוקרינית הלבלב, לרבות מייצרי אינסולין תאי β α תאים מייצרי גלוקגון, אשכול ביחד ב- איי לנגרהנס ולווסת coordinately גלוקוז מערכתית הומאוסטזיס. תפקוד לקוי של התאים האנדוקריניים תוצאות סוכרת, אשר הפך בעיה מרכזית בבריאות הציבור ברחבי העולם.
בתאי האנדוקרינית הלבלב נגזרות Ngn3+ אבות במהלך מופרה1. מאוחר יותר, במהלך תקופת הלידה, התאים האנדוקריניים להתרבות כדי איונים ילדותי טופס. תאים אלה ילדותי להמשיך לפתח ולהפוך בהדרגה איונים בוגרת, אשר הופכים vascularized בעושר לווסת את הגלוקוז בדם הומאוסטזיס מבוגרים2.
למרות זוהתה קבוצה של גורמי תעתיק, המסדירים β תאית התמיינות, מסלול מדויק ההבשלה של תאי β הוא עדיין לא ברור. יתר על כן, תהליך ההבשלה של תאי β גם כרוך ברגולציה של התא-3,הרחבה-מספר-4 הדור של הטרוגניות הסלולר5,6. עם זאת, מנגנוני הרגולציה של תהליכים אלה לא טוב נחקרו.
תא בודד RNA-רצף היא גישה רב-עוצמה פרופיל תא subpopulations, לאתר את התא שושלת היוחסין מסלולים התפתחותית7. מנצל את הטכנולוגיה הזאת, המפתח האירועים המתרחשים במהלך התפתחות הלבלב איון יכול לפענח ברמה תא בודד8. בין הפרוטוקולים רצפי RNA בתא יחיד, חכם-seq2 מאפשר את הדור של cDNA באורך מלא עם רגישות משופרת, דיוק, השימוש של ריאגנטים סטנדרטי-עלות נמוכה יותר9. חכם-seq2 לוקח כ יומיים לבנות ספריית cDNA רצף10.
כאן, אנו מציעים שיטה בידודו של תאי β התווית על-ידי קרינה פלואורסצנטית מ הלבלב של העובר כדי העכברים הטרנסגניים למבוגרים Ins1-RFP11, באמצעות תא לפעיל על-ידי קרינה פלואורסצנטית מיון (FACS), וניתוחים הביצועים של transcriptomic רמת תא בודד, באמצעות טכנולוגיית Smart-seq2 (איור 1). פרוטוקול זה ניתן להרחיב כדי לנתח את transcriptomes מכל הסוגים התא האנדוקרינית הלבלב במצבים נורמליים, פתולוגי, הזדקנות.
Protocol
כל השיטות המתוארות כאן אושרו על ידי טיפול בעלי חיים מוסדיים ועל שימוש הוועדה (IACUC) באוניברסיטת פקין.
1. לבלב בידוד
-
עבור עוברי E17.5 (עובריים יום 17.5):
- מעריכים היום עובריים 0.5 בהתבסס על נקודת זמן כאשר התקע הנרתיק מופיעה.
- להקריב את העכברים בהריון על ידי המינהל2 CO. לרסס את הפרווה בטן עם אלכוהול 70%.
- עושים חתך בצורת V עם מספריים של הרחבת האזור הגניטלי לצלעות. תהליך זה ייפתח לחלוטין חלל הבטן.
- לנתח את הרחם מתוך חלל הבטן ומניחים אותו בקערה 10 ס מ המכיל PBS קר.
- לנתח את העוברים מן הרחם עם מלקחיים דק-היטה תחת stereomicroscope, הסרת רקמות אחרות, כגון השליה, חבל הטבור. מקם כל העוברים צלחת 10 ס מ המכיל PBS קר.
- כשהבנו העוברים של חלל הבטן, לחפור החוצה את רקמות מהבטן עם פינצטה המרפק. העברת רקמות מהבטן לתוך תבשיל שחורת התחתית 6 ס מ המכיל PBS קר.
- הלבלב ממוקם את החלק השמאלי העליון של הבטן, מייחסת הקיבה, הטחול, תריסריון (צהוב קו מנוקד איור2 א)12. לנתק את הלבלב מן הרקמה הקרביים באמצעות מלקחיים, בריכה רקמת הלבלב יחד לתוך בקבוקון 20 מ"ל המכיל 5 מ של 0.5 מ"ג/מ"ל collagenase קר פתרון: 0.5 מ"ג/מ"ל collagenase P במאגר בידוד (HBSS המכיל 10 מ מ. HEPES, מ מ 1 MgCl2 5 מ מ גלוקוז, pH 7.4).
-
עבור עכברים P0-P15 (כמחנכת יום 0-15):
- להקריב ולתקן את העכבר על-ידי שמירה הגפיים כדי חתיכה של benchtop מגן עם קלטת. לרסס את הפרווה בטן עם אלכוהול 70%.
- פתח לגמרי את חלל הבטן כפי שמתואר בשלב 1.1.3. משוך את המעי החוצה, לצד השמאלי של העכבר. פרוצדורה זו תחשוף את האונות תריסריון, קיבה, הטחול של הלבלב. בזהירות לנתח כל האונות של הלבלב (איור 2B)12 , בריכה רקמת הלבלב יחד לתוך בקבוקון 20 מ"ל המכיל 5 מ של 0.5 מ"ג/מ"ל collagenase קר פתרון.
-
עבור עכברים P18-P60 (כמחנכת יום 18-60):
- להכין את הפתרון collagenase. לשמור בקירור עד מוכן לשימוש.
- להקריב את העכבר ופתח הבטני כאמור לעיל (שלב 1.1.2 ו 1.1.3).
הערה: לא לפגוע בכבד, פצע כלשהו אל הכבד להפחית את הלחץ זרימה לתוך המרה, להפחית את היעילות זלוף של השלב הבא. - הסר מצאתי. משוך את המעי החוצה, לצד הימני של העכבר, ודחף האונות שמאל, נכון המדיאלי של הכבד מכל צד כדי לחשוף את כיס המרה (חץ לבן ב- 2C איור), את צינור המרה.
- תהדק את התריסריון עם זוג מלחצות כלי קטן במיקום עליון ותחתון, איגוף האתר שבו המרה נכנס התריסריון (איור דו-ממדי).
הערה: לא תהדק את האונות קיבה או הטחול של הלבלב. הפתרון collagenase לא יזרום לתוך האונה הקיבה, הטחול של הלבלב בשלב הבא אם כשכרטיס. - ממלאים מזרק 5 מ של 0.5 מ"ג/מ"ל collagenase קר פתרון והכנס מחט 30 גרם לתוך כיס המרה. בזהירות, בצורה חלקה, לתמרן את המחט צינור המרה.
- Perfuse הלבלב על ידי הזרקת 1 – 5 מ"ל של פתרון collagenase קר 0.5 מ"ג/מ"ל, בהתאם לגודל של העכבר. הזריקה צריך להיות איטי וקבוע כדי למנוע את המחט מחליק החוצה צינור וכדי למנוע המעי ייפרץ בלחצים גבוהים נוזלי. הזריקה הושלמה כאשר הלבלב מורחבת במלואה.
- לנתח הלבלב (הקו המנוקד צהוב ב איור 2D) מתוך חלל הבטן בעזרת מלקחיים מיד לאחר זלוף. מקם את הרקמה בקבוקון 20 מ"ל המכיל 5 מ של 0.5 מ"ג/מ"ל collagenase קר פתרון. אם מניפולציה העכבר יותר מפעם אחת בכל פעם, perfuse העכברים אחד, בריכה הרקמות אל תוך קר collagenase פתרון בקבוקון 20 mL עד כל העכברים יש כבר גזור.
2. collagenase לעיכול, בידוד איון
- מקם את המבחנה 20 מ"ל המכיל את רקמת הלבלב לתוך אמבט מים 37 ° C, תקופת דגירה של 3 דקות equilibrate את הטמפרטורה.
- לנער בעדינות את הצינור עוד 3 עד 5 דקות. אם רקמת הלבלב הוא מנופח באופן מלא, זה בהדרגה מביצועם לחתיכות קטנות רקמות עד סוף סוף מפוזרת בצורה אחידה. הפעם עיכול משתנה בהתאם לגודל הלבלב ואת היעילות זלוף.
- לסנן את המוצר מתעכל דרך מסננת ניילון 0.25 מ מ לתוך שפופרת צנטרפוגה 50 מ ל חדש. לשטוף ביסודיות את מסננת באמצעות מזרק 20 מ"ל המכיל PBS קר כקרח.
- עבור E17.5-P15 הלבלב, דלג לשלב 3.1.
- עבור P18-P60 הלבלב, צנטריפוגה ב x 200 גרם עבור 1 דקות ולמחוק את תגובת שיקוע. מחדש להשעות את הרקמה עם PBS קר.
- יוצקים 5 מ של המתלה רקמה לתוך תבשיל שחורת התחתית 6 ס מ. באיי לנגרהנס מבנים לבן קטן, קומפקטי, חלבי, רקמת acinar הוא רופף לבן שקוף. לבחור איונים עם פיפטה μL 200 ולהעביר אותם לתוך צינור 1.5 mL המכילים כמות קטנה של PBS קר.
3. טריפסין העיכול של רקמת הלבלב או איונים
- Centrifuge את הצינור המכיל רקמות הלבלב או איים ב x 200 גרם עבור 1 דקות ב 4 ° C ולמחוק את תגובת שיקוע מבלי להפריע בגדר.
- מחדש להשעות את גלולה עם 0.25% טריפסין-EDTA, דגירה באמבט מים 37 º C. לאחר 4 דקות של דגירה, בעדינות, אבל לפעמים תשאף (פיפטה) עבור 1 דקות באמצעות טיפים μL 200.
הערה: הלבלב E17.5-P3, הוסיפו 1 מ"ל טריפסין-EDTA. P4-P15 הלבלב, הוסיפו 3 מ"ל טריפסין-EDTA. 100-300 איונים, הוסיפו 1 מ"ל טריפסין-EDTA. כוונן את עוצמת הקול של טריפסין-EDTA לפי כמות רקמת. - לעצור את תהליך העיכול על-ידי הוספת נפח 0.4 x קר סרום שור עוברית (FBS) ומערבבים על ידי מערבולת עדין.
- צנטריפוגה ב 250 x g עבור מינימום 3-4 מעלות צלזיוס. למחוק את תגובת שיקוע מבלי להפריע בגדר.
- מחדש להשעות את התאים עם 200 μL קר FACS מאגר (HBSS המכיל 1% FBS, pH 7.4). העברת תאים שפופרת 5 מ ל FACS.
- במהירות סיבוב הצינור FACS כדי לאפשר התליה תא לעבור דרך המסנן כדי להסיר רקמות גדולות מעוכל פסולת. התליה תא בודד בצינור מוכן כעת FACS למיון.
4. החד-תאיים פירוק
-
להכין מאגר פירוק התא.
הערה: לבצע ניסויים כל ברדס עיקור UV עם זרימה שכבתית. כל צינורות, צלחות ועצות פיפטה צריך להיות RNase- / נטול DNase. Decontaminate את המנוע ואת פיפטות RNase פתרון משם לפני השימוש.- להפשיר את ריאגנטים על הקרח: dNTP (10 מ מ), oligo-dT פריימר (10 μM) ו- ERCC במניה פתרון (1:20).
- לדלל את ERCC ל- 1:5 x 105 עם נוקלאז ללא מים.
- חישוב הנפח של התא פירוק מאגר הדרושים. הוסף μL 0.1 של RNase מעכב (40 U/μL), μL 1.9 של 0.2% (vol/כרך) טריטון X-100, 1 μL של dNTP, μL 1 של פריימר oligo-dT 0.05 μL של ERCC מדולל לאמצעי הסופי של μL 4.05 עבור כל תא.
- Aliquot מאגר פירוק התא 0.2 מ"ל קיר דק 8-פס המבחנות או צלחות 96-ובכן. Centrifuge את צינורות או לוחות עבור 30 s-4 מעלות צלזיוס.
הערה: צנטריפוגה 0.2 מ"ל קיר דק 8-פס המבחנות 7,500 x g ו- 96-ובכן צלחות ב g x 800 בשלבים הבאים.
-
איסוף מתא בודד, פירוק.
- באופן ידני פיק FACS מתמיינים Ins1-RFP+ תאים בודדים במאגר FACS חשפנות-8 המבחנות באמצעות פיפטה נימי מיקרומטר של 30-40, או ישירות למיין תאים בודדים Ins1-RFP+ לתוך צלחות 96-ובכן. באמצעי האחסון שמכיל את תא יחיד נחשב פחות מ 0.3 μL.
הערה: שימוש פיזור קדימה גובה (FSC-H) לעומת העבר פיזור אזור (FSC-A) המגביל את האסטרטגיה כפיל אפליה, לעומת FSC-H בצד אזור פיזור (האס-A) פסולת, קרינה פלואורסצנטית gating למיון תא (איור 3 א-3C) Ins1-RFP+ . על שיטת איסוף, מיון תאי היעד לתוך צינור 1.5 mL המכיל מאגר FACS μL 300. הריכוז הסופי המתאים הוא 5-10 תאים/μL. להתאים את עוצמת הקול של מאגר בהתאם. על שיטת איסוף צלחת, למיין חד-תא לתוך כל טוב של צלחת 96-ובכן בעקבות ההדרכה של הכלי. 7 , 13 - מערבולת צינורות או צלחות lyse התאים ולשחרר את הרנ א. Centrifuge את צינורות או לוחות עבור 30 s ב 4 ° C ומיד למקם אותם על קרח.
הערה: התאים שניתן לאחסן ב-80 מעלות צלזיוס למשך שבוע.
- באופן ידני פיק FACS מתמיינים Ins1-RFP+ תאים בודדים במאגר FACS חשפנות-8 המבחנות באמצעות פיפטה נימי מיקרומטר של 30-40, או ישירות למיין תאים בודדים Ins1-RFP+ לתוך צלחות 96-ובכן. באמצעי האחסון שמכיל את תא יחיד נחשב פחות מ 0.3 μL.
5. החד-תאיים cDNA הגברה
-
שעתוק במהופך (RT).
- להפשיר את ריאגנטים RT (טבלה 1) על קרח.
- דגירה בדגימות ב-72 מעלות למשך 3 דקות, מיד לשים צינורות או צלחות על קרח דק 1. לפחות לזמן קצר centrifuge את צינורות או לוחות עבור 30 s-4 מעלות צלזיוס.
הערה: השתמש הצנטרפוגה תרמי עם מכסה 105 ° C מחומם עבור כל incubations. - להכין את תערובת RT כל התגובות, כפי שמתואר בטבלה 1.
- לוותר על μL 5.7 של RT מערבבים היטב עד שכל דוגמית להביא את אמצעי האחסון לסך של 10 μL. מערבולת בעדינות התערובת ו צנטריפוגה ב-30 s-4 מעלות צלזיוס.
- למקם את הדגימות הצנטרפוגה תרמי והפעל את התוכנית RT כדלקמן: 42 מעלות צלזיוס במשך 90 דקות, 10 מחזורים (50 מעלות צלזיוס למשך 2 דקות, 42 º C למשך 2 דקות), 70 מעלות צלזיוס במשך 15 דקות ולא להחזיק על 4 מעלות צלזיוס.
-
PCR-הגברה מראש.
- להפשיר את ריאגנטים PCR (טבלה 2) על קרח.
- להכין את תערובת ה-PCR כל התגובות, כפי שמתואר בטבלה 2.
- לוותר על μL 15 של PCR מערבבים היטב עד שכל דוגמית, אשר מכיל את התגובות הראשונה-strand. מערבולת בעדינות התערובת ו צנטריפוגה ב-30 s-4 מעלות צלזיוס.
- למקם את הדגימות הצנטרפוגה תרמי ולהתחיל התוכנית הבאה של ה-PCR: 98 ° C למשך 3 דקות, 18 מחזורים (98 ° C עבור 20 s, 67 ° C 15 s, 72 מעלות צלזיוס במשך 6 דקות), 72 מעלות צלזיוס במשך 5 דקות והחזק ב 4 º C.
הערה: המוצר PCR ניתן לאחסן ב 4 מעלות צלזיוס למשך פחות מ שבוע או ב-20 ° C /-80 מעלות צלזיוס עד 6 חודשים.
-
PCR-טיהור.
- להוסיף 25 μL של ה-DNA מחדש על תנאי טיהור חרוזים (1 x) כל דגימה מן הצעד הקודם לערבב היטב על ידי מערבולת. . ואז, במהירות לסובב את צינור או צלחות בטמפרטורת החדר כדי לאסוף את הנוזל אלא למנוע את ההתנחלות של חרוזים.
הערה: Equilibrate חרוזים טיהור DNA לטמפרטורת החדר 15 דקות ו מערבולת ביסודיות לפני השימוש. - תקופת דגירה של 5 דקות בטמפרטורת החדר.
- מקום ברכבת התחתית או בלוחית הולם מגנטי לעמוד עד הפתרון ברור, אז בזהירות להסיר ולמחוק את תגובת שיקוע.
- להוסיף 200 μL הטרי 80% אתנול לשטוף את החרוזים בעוד דוכן מגנטי, תקופת דגירה של 30 s, ואז בזהירות להסיר, למחוק את הפתרון אתנול.
הערה: הפתרון אתנול 80% (vol/כרך) טריים להכין בכל פעם. - חזור על צעד 5.3.4 סך של שני שוטף.
- בזהירות להסיר ולמחוק את הנותרים אתנול פתרון ואוויר יבש את החרוזים תוך הצינור או שהלוח לדוכן מגנטי.
הערה: למנוע ייבוש יתר על המידה את החרוזים כדי להבטיח את היעילות המרבית • תנאי. - להוסיף 11 μL של מים נטולי נוקלאז elute המטרה הדנ א של החרוזים ולערבב היטב על ידי מערבולת. לאחר מכן, במהירות לסובב את צינור או בצלחת ומניחים אותו על דוכן מגנטי עד הפתרון ברור. העברת μL 10 מדגם צינור ה-PCR.
הערה: אם הדימרים קיימים לאחר סבב אחד של טיהור, המבוססת על זיהוי הפצה של גודל cDNA, לטהר שוב כדי להסיר את הדימרים לחלוטין. הדימרים יכול להשפיע על חישוב התשואה cDNA אם מותר להישאר במדגם.
- להוסיף 25 μL של ה-DNA מחדש על תנאי טיהור חרוזים (1 x) כל דגימה מן הצעד הקודם לערבב היטב על ידי מערבולת. . ואז, במהירות לסובב את צינור או צלחות בטמפרטורת החדר כדי לאסוף את הנוזל אלא למנוע את ההתנחלות של חרוזים.
-
בדיקת האיכות של cDNA.
- באופן אקראי לבחור דוגמאות כדי לזהות את התשואה הכוללת cDNA באמצעות fluorometer.
- להעריך את רמות ביטוי גנים סמן על ידי ה-PCR בזמן אמת (qPCR) (איור 4E). הסר μL 1 של המדגם למהול 40 פעמים ולבצע qPCR באמצעות צלחת 384-. טוב. מכינים את תערובת qPCR כמפורט בטבלה3. תנאי הרכיבה: 95 מעלות צלזיוס למשך 10 דקות, 45 מחזורים (95 ° C עבור 10 s, 60 ° C 15 s, 72 ° C 15 s).
- באופן אקראי לבחור דוגמאות כדי לזהות את התפלגות גודל שימוש בכלי אלקטרופורזה נימי מקבילים.
6. cDNA בניית הספרייה
-
תגובה Tagmentation על ידי transposase Tn5.
- לזהות את התשואה הכולל cDNA תאי שנבחר qPCR מהשלב 5.4.2 באמצעות fluorometer. שימוש 2 ng של cDNA בתור חומר המוצא.
- הפשרת ריאגנטים תגובה tagmentation (טבלה 4) על קרח.
- להכין את התגובה tagmentation בשפופרת 0.2 מ"ל קיר דק 8-פס PCR, כפי שמתואר בטבלה 4, ומערבבים בזהירות על ידי מערבולת. לאחר מכן, במהירות ספין למטה הפתרון בטמפרטורת החדר.
- דגירה בדגימות ב 55 מעלות צלזיוס למשך 10 דקות ולהחזיק ב 4 º C.
- מיד להוסיף 2 μL של 5 x TS כל מדגם המכיל את tagmented דנ א כדי לעצור את התגובה. לערבב היטב על ידי מערבולת ולאחר מכן במהירות ספין למטה הפתרון בטמפרטורת החדר.
- דגירה את התערובת למשך 5 דקות בטמפרטורת החדר. ה-DNA תעובד העשרה הסופית ה-PCR מיד.
-
הגברה של קטעים ובין אם-לא מתאם.
- להפשיר את ריאגנטים PCR (טבלה 5) על קרח.
- הכנת המיקס PCR העשרה, כפי שמתואר בטבלה 5, ומערבבים בזהירות על ידי מערבולת. לאחר מכן, במהירות ספין למטה הפתרון בטמפרטורת החדר.
- לבצע את ה-PCR באמצעות התוכנית הבאה: 72 מעלות צלזיוס למשך 10 דקות, 98 ° C ל 30 s, 8 מחזורים (98 ° C 15 s, 60 ° C ל 30 s, 72 מעלות צלזיוס למשך 3 דקות), 72 מעלות צלזיוס במשך 5 דקות והחזק ב 4 º C.
הערה: מספר מחזורים תלוי בכמות ה-DNA ספריית הצפוי.
-
טיהור PCR עם בחירת גודל.
- להוסיף μL 14 של הדנ א מחדש על תנאי טיהור חרוזים (0.7 x) כל דגימה מן הצעד הקודם לערבב היטב על ידי מערבולת. . ואז, במהירות לסובב את הצינור בטמפרטורת החדר כדי לאסוף את הנוזל אלא למנוע את ההתנחלות של חרוזים.
הערה: Equilibrate חרוזים טיהור DNA לטמפרטורת החדר 15 דקות ו מערבולת ביסודיות לפני השימוש. - תקופת דגירה של 5 דקות בטמפרטורת החדר.
- למקם את הצינורית מעמד מגנטי המתאים עד הפתרון ברור, בזהירות להעביר את תגובת שיקוע רצועת צינור חדש וזורקים הפס צינור הקודם.
- להוסיף 3 μL של חרוזים טיהור DNA מחדש על תנאי (0.15 x) כדי שכל דוגמית פסים התחתית, לערבב היטב על ידי מערבולת. . ואז, במהירות לסובב את הצינור בטמפרטורת החדר.
- תקופת דגירה של 5 דקות בטמפרטורת החדר.
- מקום ברכבת התחתית או בלוחית הולם מגנטי לעמוד עד הפתרון ברור, אז בזהירות להסיר ולמחוק את תגובת שיקוע.
- להוסיף 200 μL הטרי 80% אתנול לשטוף את החרוזים בעוד דוכן מגנטי, תקופת דגירה של 30 s, ואז בזהירות להסיר, למחוק את הפתרון אתנול.
הערה: הפתרון אתנול 80% (vol/כרך) טריים להכין בכל פעם. - חזור על צעד 6.3.7 סך של שני שוטף.
- בזהירות להסיר ולמחוק את הנותרים אתנול פתרון ואוויר יבש את החרוזים תוך הצינור או שהלוח לדוכן מגנטי.
הערה: למנוע ייבוש יתר על המידה את החרוזים כדי להבטיח את היעילות המרבית • תנאי. - להוסיף 11 μL של מים נטולי נוקלאז elute המטרה הדנ א של החרוזים ולערבב היטב על ידי מערבולת. לאחר מכן, במהירות לסובב את צינור או בצלחת ומניחים אותו על דוכן מגנטי עד הפתרון ברור. העברת μL 10 המדגם פס צינור חדש.
- להוסיף μL 14 של הדנ א מחדש על תנאי טיהור חרוזים (0.7 x) כל דגימה מן הצעד הקודם לערבב היטב על ידי מערבולת. . ואז, במהירות לסובב את הצינור בטמפרטורת החדר כדי לאסוף את הנוזל אלא למנוע את ההתנחלות של חרוזים.
-
בדיקת האיכות של ספריית cDNA הסופי.
- למדוד את הריכוז של כל ספריה באמצעות fluorometer וסמנו את התפלגות גודל שימוש בכלי אלקטרופורזה נימי מקבילים.
הערה: התשואה הדנ א הוא בדרך כלל בין 15 – 25 ng עבור כל ספריה. שברי החל 250 bp 450-bp יתקיימו. אם הדימרים נותרים לאחר טיהור, כפי שאושר על-ידי בדיקת התפלגות גודל, לטהר עם 1 x חרוזים טיהור DNA עוד פעם אחת.
- למדוד את הריכוז של כל ספריה באמצעות fluorometer וסמנו את התפלגות גודל שימוש בכלי אלקטרופורזה נימי מקבילים.
-
ספריית איגום
- בהתבסס על גודל משוער פרגמנט, בריכת כמויות שוות של ה-DNA מ כל דגימה, המבטיח כי אף אחד מהם לא מכילים את השילובים זהה של מתאמי N6XX ו- N8XX.
7. רצפי DNA
- נושא ספריות לבר-קוד 51 רצף יחיד-end של bp, באמצעות מערכת רצף תפוקה גבוהה. לבצע רצף לפי הפרוטוקול של היצרן. העומק רצף של כל תא הוא כ- 1 מיליון קורא בממוצע8, לפחות 0.5 מיליון קורא לכל תא14.
8. ביואינפורמטיקה ניתוחים
-
יישור והערכת איכות רצף.
- להעריך את איכות הקריאות ברצף באמצעות FastQC (v0.11.3)15 עם הפרמטרים הבאים: "fastqc - תמצית -o output_dir input_fastq".
- למזג את הגנום עכבר עם הרצפים ERCC באמצעות הפקודה "חתול mm10.fa ERCC.fa > mm10_ERCC.fa".
- לבנות bowtie2 (v2.2.5) מדד16 עם הפרמטרים הבאים: "bowtie2-לבנות mm10_ERCC.fa mm10_ERCC".
- ליישר קריאות באמצעות tophat2 (v2.1.0)17 עם הפרמטרים הבאים: "tophat2 -o output_dir -G gene.gtf - transcriptome-index trans_index mm10_ERCC input_fastq".
-
לכמת רמות ביטוי גנים.
- ספירת ממופה הקראת עבור כל הגן באמצעות HTSeq (v 0.6.0)18 עם הפרמטרים הבאים: ' htseq-count - f bam - r pos -s לא gene.gtf accepted_hits.bam, 30 > read_count.txt '.
- לנרמל את רמות ביטוי גנים כדי תעתיקים לכל מיליון (TPM)19.
-
בקרת איכות של תאים.
- לא לכלול תאים עם קריאות ממופה פחות מ- 0.5 מיליון או פחות מ-4,000 גנים (TPM > 1).
הערה: הקריטריון של הדרה תלוי סוגי תאים ואת רצף עומק. - שומרים על התאים לבטא סמני האנדוקרינית (למשל, Ins1 של תאי β, Gcg עבור α תאים), לא לכלול תאים הבעת אי-אנדוקרינית סמנים (למשל, Spi1 של לויקוציטים).
- לא לכלול תאים עם קריאות ממופה פחות מ- 0.5 מיליון או פחות מ-4,000 גנים (TPM > 1).
-
ניתוח גורמים ראשיים (PCA)
- לזהות גנים משתנה מאוד לפי ERCC ספייק-in, כפי שתואר לעיל20.
- לבצע PCA שימוש בפונקציה "שהסתברו" של ה-R לארוז FactoMineR (v1.31.4)21, עם log2(TPM + 0.1) של גנים משתנה מאוד.
- להמחיש את התוצאות PCA עם ggplot2 (טעינת v 2.0.0)22.
-
קיבוץ באשכולות הירארכי.
- לזהות גנים עם loadings גורמים ראשיים (PC) הגבוהה ביותר באמצעות הפונקציה "dimdesc" FactoMineR (v1.31.4)21.
- לבצע קיבוץ באשכולות היררכי באמצעות הפונקציה "heatmap.2" ב- R חבילת gplots (v 3.0.1)23, עם log2 (TPM + 1) ערכים יחסיים של המחשב גבוהה טעינת גנים.
תוצאות
הלבלב היו גזור מן העכברים עובריים, neonatal ופוסט (איור 2 א ו- 2B). עבור עכברים שגילם 18 יום לאחר הלידה, האפקט העיכול תלויה מידת זלוף; לכן, הזריקה הוא הצעד החשוב ביותר עבור בידוד איון (איור 2C-2E ו לטבלה 6). כמה שיותר collagenase שהוזרק כפי שהיה ניתן להשלים הלבלב במהלך שלב זה. הלבלב המנופח לחלוטין מוצג איור דו-ממדי. אם זלוף אינה מוצלחת (איור 2E), אבל המדגם הוא יקר, הלבלב יכול להיקרע לחתיכות קטנות לעיכול מספיק מאוחר יותר.
לאחר זלוף, רקמת הלבלב היה מתעכל לחתיכות קטנות כדי לשחרר איים קטנים (2F איור). כדי לקצר את זמן המיון FACS, אנחנו מועשר התאים האנדוקריניים על-ידי בחירת ע מראש. גודל איים קטנים עשויים להשתנות בהתאם עידן העכבר לבין עוצמת העיכול. לעיתים, איים קטנים אינם עגול בצורתו. איונים יש לבחור על פי צבע ומדינה קומפקטי (איור 2G , טבלה 6). אם המתח העכבר הטרנסגניים יש גן הכתב, כגון ה-GFP או RFP עבור תאים אנדוקריני, ע יכול גם לאסוף אותה תחת מיקרוסקופ זריחה.
תאים Ins1-RFP+ היו מטוהרת על-ידי FACS מיון (איור 3 אג-3) והרים אז תאים בודדים היו באמצעות פיפטה נימי של תא בודד RNA-seq (דמות תלת-ממד). CDNA בהצלחה מוגבר צריך להיות באורך מלא מעל 500 bp, להעשיר מ 1.5 kb עד 2 kb. יתר על כן, בדרך כלל העשרת bp 500-600 של cDNA נצפו תאי Ins1-RFP+ , אשר עשוי לייצג את התמלילים אינסולין (איור 4A). עם זאת, היו כמה מצבים חריגים שנצפה10 (טבלה 6). לדוגמה, השברים cDNA ליד 100 bp הם הדימרים פריימר (איור 4B), אשר נגרמים בדרך כלל על ידי תחל מופרז, כי יש להסיר על ידי חזרה על הצעד טיהור DNA. קיומו של הדימרים פריימר עשויים להשפיע החישובים של התשואות cDNA הכולל, אשר משמשים לבניית ספריה הבאים. השברים cDNA בין 100 bp ו-500 bp בדרך כלל מייצגים השפיל cDNA (איור 4C), אשר נגרמת על ידי בעיות המצב או מגיב רע תא, כגון RNase זיהום. בתנאים האלה, אנחנו צריכים לזהות את הגורם DNA השפלה ולהשמיט את ההפרעה. למשל, כדי להבטיח מצב טוב תא, ניתנות לעיכול רקמות תאים מיון במהירות ובעדינות ו פעולות יש לבצע בזהירות כדי למנוע כל סוג של מזהמים.
לאחר הטיהור של ספריות cDNA עבור רצף, השגנו קטעים cDNA בגדלים שונים על פי ההוראות להוספת יחסים שונים של חרוזי טיהור DNA המדגם. לדוגמה, אנו יכולים להשיג cDNA החל 250 bp bp על-ידי הוספת x 0.7 ו- 0.15 x חרוזים טיהור DNA הראשון, השני 450 סיבובים של טיהור, בהתאמה (איור 4D). שלב זה יש אחוזי הצלחה גבוהים. עם זאת, אם ישנם חלקים של 100 bp, הוא הציע לטהר את הספריות שוב עם 1 x חרוזים טיהור DNA כדי להסיר הדימרים (טבלה 6). הדימרים unremoved להטות את כימות דנ א, ישפיע הדבר על המדגם באגירת תוצאות, כשהתוצאה היא רכישת נתונים לא אחיד של כל דגימה.
ניתחנו את הנתונים רצף עם גישות לביואינפורמטיקה (איור 5A). ציוני איכות רצף צריך להיות גדול מ- 30 במהלך רצף הערכת איכות (איור 5B). לאחר יישור, 80-90% הקריאות צפויים למפות הגנום הפניה. כדי לקבל איכות גבוהה תאים עבור ניתוחים במורד הזרם, אנחנו לא נכלל תאים עם פחות מ- 0.5 מיליון קריאות ממופה או עם פחות מ 4000 זוהו גנים (איור 5C וד' 5). לאחר PCA ואישכול הירארכי, אנו מאופיין קבוצות שונות של תאים, לזהות את הגנים heterogeneously שבאו לידי ביטוי ב-8קבוצות שונות.

איור 1: סקירה סכמטי של RNA בתא יחיד-seq של תאים בלבלב האנדוקרינית העכבר. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.

איור 2: הלבלב לנתיחה, זלוף, איון האיסוף. (א) דיסקציה של רקמת הלבלב עובריים (נמוך יותר) מעוּבּר E17.5 (העליון). קו מקווקו צהוב demarcates את רקמת הלבלב. סרגל קנה מידה = 1,000 מיקרומטר. (B) דיסקציה של רקמת הלבלב כמחנכת (מימין) של עכבר P10 (משמאל). סרגל קנה מידה = 1,000 מיקרומטר. (C-D) רקמת הלבלב של עכבר P60 לפני (C) ואחרי זלוף (D). קו מקווקו צהוב demarcates את רקמת הלבלב. חץ לבן מציין כיס המרה. (E) רקמת הלבלב באופן חלקי perfused של עכבר P60. חץ אדום מציין את האזור היטב perfused של הלבלב. החצים הכחולים מציין את האזורים perfused לקוי של הלבלב. רקמה (F) הלבלב לפני (העליון), לאחר עיכול collagenase (נמוך יותר). חיצים (G) הצבע איונים שפורסמו מרקמות הלבלב collagenase מתעכל. סרגל קנה מידה = 200 מיקרומטר. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.

איור 3: באופן ידני אוסף תאים עם 30-40 µm פיפטה נימי תחת מיקרוסקופ. (A-C) צעד חכם FACS gating לצורך מיון תאי Ins1-RFP+ . (D) הבהיר עיגולים לציין תאים, הצינור פיפטה נימי. בחר את התאים עם יותר מורפולוגיה (חץ) ולהתעלם התאים באשכולות (חץ). סרגל קנה מידה = 200 מיקרומטר. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.

איור 4: זיהוי איכות של התפלגות גודל cDNA וספרייה של תאים Ins1-RFP+ על ידי מכשיר מקביל אלקטרופורזה נימי. (א) הנציג תוצאה של cDNA בהצלחה מראש מוגבר. בדרך כלל, פרופיל cDNA צריך להיות מעל 500 bp עם שיא kb ~1.5–2. (B) התוצאה נציג של cDNA מוגבר מראש עם פריימר דיימר לשיא. פריימר דיימר השיא הוא כ 100 bp. (ג) לפרופיל של cDNA מוגבר מראש עם שברי בין 100 bp ו-500 bp מציין את האפשרות של cDNA השפלה. ספריה (D) התפלגות גודל cDNA הנעים בין 250 bp ובעקבות לחץ דם 450 המדרגות טיהור המוזכרים בפרוטוקול זה. (E) הביטוי רמות של Ins2 בספריות cDNA qPCR (משמאל), יחסית רצף נתונים (מימין). X-axes מייצגים ברורים 8 דגימות תא בודד. ציר ה-y (משמאל) מייצג ΔCt מנורמל ביחס Gapdh (CtGapdh- CtIns2 + 6) וציר ה-y (מימין) מייצג רמת ביטוי מנורמל Ins2 ביחס Gapdh (יומן2(TPM Ins2 / ה-TPMGapdh)). אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
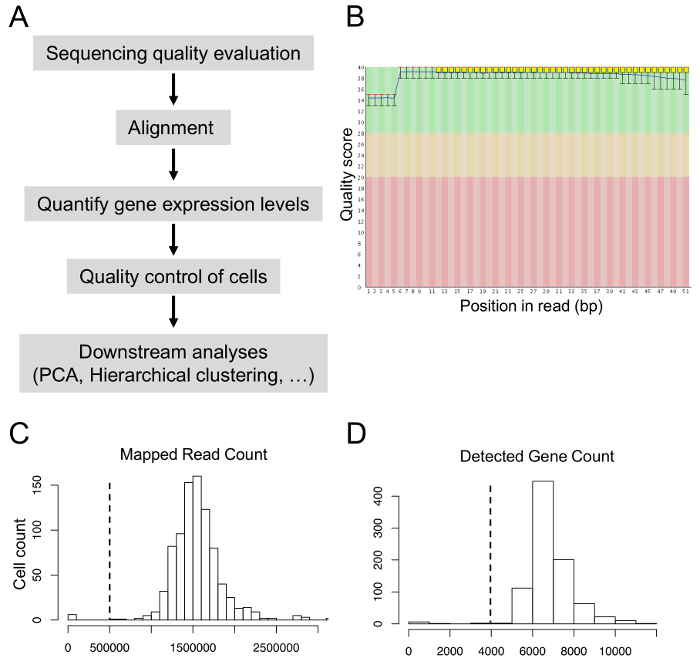
איור 5: ביואינפורמטיקה ניתוח של הנתונים בתא יחיד transcriptome. (א) צינור של ביואינפורמטיקה ניתוחים. (B) רצף ציוני איכות על פני כל הבסיסים של קריאות. (ג) חלוקת ספירת קריאה ממופה. (ד) הפצה של הרוזן ג'ין שזוהו. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
| רכיב | נפח (µL) |
| רוורס טרנסקריפטאז (200 U µL) | 0.5 |
| RNase מעכב | 0.25 |
| הראשון-strand מאגר (5 x) | 2 |
| DTT (100 מ מ) | 0.5 |
| Betaine (5 מ') | 2 |
| MgCl2 (1 מ') | 0.06 |
| TSO (100 מיקרומטר) | 0.1 |
| נוקלאז ללא מים | 0.29 |
| סה | 5.7 |
טבלה 1: ריאגנט RT לערבב מרכיבים בתגובה µL 5.7 עבור כל דגימה.
| רכיב | נפח (µL) |
| התגובה הראשונה-strand | 10 |
| DNA פולימראז (2 x רדימיקס) | 12.5 |
| היא תחל PCR (10 מיקרומטר) | 0.25 |
| נוקלאז ללא מים | 2.25 |
| סה | 25 |
טבלה 2: ריאגנט קדם הגברה PCR לערבב מרכיבים בתגובה µL 25 עבור כל דגימה
| רכיב | נפח (µL) |
| SYBR ירוק מיקס מאסטר | 5 |
| תחל (5 מיקרומטר) | 0.5 |
| נוקלאז ללא מים | 2.5 |
| cDNA | 2 |
| סה | 10 |
טבלה 3: ריאגנט qPCR לערבב מרכיבים בתגובה µL 10 באמצעות צלחת 384-ובכן תקן.
| רכיב | נפח (µL) |
| 5 x TTBL | 1.6 |
| 2 ng cDNA | משתנה |
| ddH2O | משתנה |
| TTE מיקס V5 | 2 |
| סה | 8 |
טבלה 4: ריאגנט Tagmentation לערבב מרכיבים לתגובה µL 8 עבור כל דגימה.
| רכיב | נפח (µL) |
| ddH2O | 1.6 |
| תוצר של הצעד הקודם | 10 |
| 5 x טאב | 4 |
| N6XX | 2 |
| N8XX | 2 |
| טה | 0.4 |
| סה | 20 |
טבלה 5: העשרה PCR ריאגנט רכיבים לערבב בתגובה 20 µL עבור כל דגימה.
| שלב | הבעיה | האפשרות | פתרון |
| 1.3.4 | החלקה של התפסים | המשטח החיצוני של המעי הוא רטוב הנגרמת על ידי קיומה של כמות קטנה של leakness של נוזלים ושל collegenase אינטרסטיציאליות | בעדינות להחליף את הקיר התריסריון וקירות איברים אחרים בחלל הבטן עם ספוגיות כותנה |
| 1.3.6 | פרץ במעי | לחץ הנוזל הוא גבוה מדי במעי | להאט את מהירות הזרקת |
| 2.6 | איונים לדבוק רקמות אקסוקרינית בבחירת איונים | Insufficent העיכול | להאריך את משך העיכול ורעדתי כוח |
| 5.3 | התשואה cDNA הוא נמוך לאחר ה-PCR-הגברה | התאים הם במצב רע | לשמור תאים טרי במצב טוב |
| 5.4 או 6.4 | פריימר הדימרים ניתן לראות | תחל מופרז | לטהר את cDNA פעם נוספת עם חרוזים טיהור DNA (0.8:1 או יחס 1:1) |
| 5.4 | CDNA מפורק אחרי ה-PCR-הגברה | איכות ירודה של תאים או ריאגנטים מזוהמים | לשמור תאים במצב טוב או לשנות ריאגנטים |
| 6.3 | כמות ה-DNA הוא נמוך לאחר בניית הספרייה | מחזורי PCR מעט מדי או האיכות של cDNA אינו טוב | להגדיל את מספר מחזורי או להבטיח איכות cDNA לפני בניית הספרייה |
טבלה 6: פתרון בעיות.
Discussion
ב פרוטוקול זה, הפגנו שיטה יעילה, קלה לשימוש עבור הלומדים את פרופילי ביטוי תא בודד של תאי β בלבלב. ניתן להשתמש בשיטה זו כדי לבודד תאים האנדוקרינית הלבלב עובריים, neonatal ופוסט, כדי לבצע ניתוח transcriptomic תא בודד.
השלב הקריטי ביותר הוא בידודו של תאי β יחיד במצב טוב. הלבלב באופן מלא perfused כדאי להגיב עיכול עוקבות. לא מספיק זלוף, אשר בדרך כלל מתרחשת בלבלב הגבי, יביא תשואה נמוכה איון. לאחר זלוף, הפעם עיכול, ומנענע בעוצמה דורשים תשומת לב מיוחדת. עיכול יתר, שנוצר דגירה ארוך טיימס וחסון רועדת, יכולה לשבור את איונים לחתיכות. עיכול לא מספיק לא לגמרי בין ע לרקמות סמוכות. לאחר עיכול של הלבלב, איים קטנים היו טהור על ידי הרמת היד ולא על ידי צנטריפוגה הדרגתיות צפיפות. למרות צפיפות צנטריפוגה מעבר צבע יכול להעשיר איונים, איונים קטנים או איונים מחובר עם רקמת acinar רבים מתבטלים בטעות. נסה להימנע איסוף רקמת acinar, אשר עשויים לגרום לעיכול לא יעיל טריפסין ולהפחית את הטוהר של תאי β.
משכפל ביולוגי עצמאי יש צורך להבחנה בין השפעות ביולוגיות השתנות ו אצווה. אם ביולוגית שני משכפל יש דפוס פעולה דומה ב PCA לכלול קבוצות משנה דומה בקיבוץ באשכולות תוצאות, הדוגמיות הללו עשויים לגלות אמין השתנות ביולוגי. אחרת, משכפל ביולוגיים נוספים נדרשים לאשר את התוצאות. עבור איבר חילוף החומרים כגון הלבלב, המדינה תא המשויך את שעון היממה24 עשוי להסביר הבדלים אצווה. כדי לפתור בעיה זו, אנו ממליצים איסוף כל הדגימות באותו הזמן של היום.
המגבלה של גישה זו היא תפוקה נמוכה כי חייבים לבנות ספרייה עבור כל תא. בשל יתר תחל בהתגובה cDNA לפני ואחרי הספריה הבנייה בדרך כלל מומלץ לטהר פעמיים כדי להסיר לחלוטין את הדימרים פריימר. תהליכים אלה הם זמן רב. לאחרונה, דווח של פרוטוקול ששונה25 זה יכול לפתור את הבעיה הזו במידה מסוימת. ב פרוטוקול זה, תאים ספציפיים ברקוד תוויות קטעי cDNA במהלך השלב שעתוק במהופך. לכן, cDNA של כל תא יכול להיות איחדו יחד ולאחר מכן להיות מטוהרים, ולאחריו בניית ספריה. שינוי זה מגדיל באופן משמעותי את התפוקה של ספריית הבנייה. אולם, שיטה זו ששונה הוא פחות רגיש, מזהה גנים פחות בכל תא. בנוסף, שיטה זו היא 3' ספירת פעולת שירות עם כיסוי קרא מופחת. לכן, חכם-seq2 הוא עדיין השיטה המתאימה ביותר לפיתוח הלבלב.
הכנת הלבלב ממינים אחרים עשוי להיות שונה. עבור לבלב אנושי, איים קטנים ניתן לבודד בעקבות הפרוטוקולים הקודמים26,27. לאחר מכן, איים מבודדים יכול להיות חלופה מועדפת לתוך תאים בודדים28 , לבצע ניתוח מתא בודד בשיטה זו. בשיטה זו ניתן להחיל באופן נרחב למחקר של התפתחות הלבלב יונקים, מחלות והתחדשות.
Disclosures
המחברים אין לחשוף.
Acknowledgements
אנו מודים המרכז הלאומי על חלבון מדעי, בייג'ינג (אוניברסיטת פקינג) ואל מרכז פקין-צינג עבור פלטפורמת מחשוב מדעי החיים. עבודה זו נתמכה על ידי משרד המדע, טכנולוגיה של סין (2015CB942800) את נבחרת מדעי הטבע קרן של סין (31521004, 31471358 ו 31522036), מימון ממרכז פקין-צינג עבור מדעי החיים ג-R.X.
Materials
| Name | Company | Catalog Number | Comments |
| Collagenase P | Roche | 11213873001 | |
| Trypsin-EDTA (0.25 %), phenol red | Thermo Fisher Scientific | 25200114 | |
| Fetal bovine serum (FBS) | Hyclone | SH30071.03 | |
| Dumont #4 Forceps | Roboz | RS-4904 | |
| Dumont #5 Forceps | Roboz | RS-5058 | |
| 30 G BD Needle 1/2" Length | BD | 305106 | |
| Stereo Microscope | Zeiss | Stemi DV4 | |
| Stereo Fluorescence microscope | Zeiss | Stereo Lumar V12 | |
| Centrifuge | Eppendorf | 5810R | |
| Centrifuge | Eppendorf | 5424R | |
| Polystyrene Round-Bottom Tube with Cell-Strainer Cap | BD-Falcon | 352235 | |
| 96-Well PCR Microplate | Axygen | PCR-96-C | |
| Silicone Sealing Mat | Axygen | AM-96-PCR-RD | |
| Thin Well PCR Tube | Extragene | P-02X8-CF | |
| Cell sorter | BD Biosciences | BD FACSAria | |
| Capillary pipette | Sutter | B100-58-10 | |
| RNaseZap | Ambion | AM9780 | |
| ERCC RNA Spike-In Mix | Life Technologies | 4456740 | |
| Distilled water | Gibco | 10977 | |
| Triton X-100 | Sigma-Aldrich | T9284 | |
| dNTP mix | New England Biolabs | N0447 | |
| Recombinant RNase Inhibitor | Takara | 2313 | |
| Superscript II reverse transcriptase | Invitrogen | 18064-014 | |
| First-strand buffer (5x) | Invitrogen | 18064-014 | |
| DTT | Invitrogen | 18064-014 | |
| Betaine | Sigma-Aldrich | 107-43-7 | |
| MgCl2 | Sigma-Aldrich | 7786-30-3 | |
| Nuclease-free water | Invitrogen | AM9932 | |
| KAPA HiFi HotStart ReadyMix (2x) | KAPA Biosystems | KK2601 | |
| VAHTS DNA Clean Beads XP beads | Vazyme | N411-03 | |
| Qubit dsDNA HS Assay Kit | Invitrogen | Q32854 | |
| AceQ qPCR SYBR Green Master Mix | Vazyme | Q121-02 | |
| TruePrep DNA Library Prep Kit V2 for Illumina | Vazyme | TD502 | Include 5x TTBL, 5x TTE, 5x TS, 5x TAB, TAE |
| TruePrep Index Kit V3 for Illumina | Vazyme | TD203 | Include 16 N6XX and 24 N8XX |
| High Sensitivity NGS Fragment Analysis Kit | Advanced Analytical Technologies | DNF-474 | |
| 1x HBSS without Ca2+ and Mg2+ | 138 mM NaCl; 5.34 mM KCl 4.17 mM NaHCO3; 0.34 mM Na2HPO4 0.44 mM KH2PO4 | ||
| Isolation buffer | 1 × HBSS containing 10 mM HEPES, 1 mM MgCl2, 5 mM Glucose, pH 7.4 | ||
| FACS buffer | 1 × HBSS containing 15 mM HEPES, 5.6 mM Glucose, 1% FBS, pH 7.4 | ||
| NaCl | Sigma-Aldrich | S5886 | |
| KCl | Sigma-Aldrich | P9541 | |
| NaHCO3 | Sigma-Aldrich | S6297 | |
| Na2HPO4 | Sigma-Aldrich | S5136 | |
| KH2PO4 | Sigma-Aldrich | P5655 | |
| D-(+)-Glucose | Sigma-Aldrich | G5767 | |
| HEPES | Sigma-Aldrich | H4034 | |
| MgCl2 | Sigma-Aldrich | M2393 | |
| Oligo-dT30VN primer | 5'-AAGCAGTGGTATCAA CGCAGAGTACT30VN-3' | ||
| TSO | 5'-AAGCAGTGGTATCAAC GCAGAGTACATrGrG+G-3' | ||
| ISPCR primers | 5'-AAGCAGTGGTAT CAACGCAGAGT-3' | ||
| Gapdh Forward primer | 5'-ATGGTGAAGGTC GGTGTGAAC-3' | ||
| Gapdh Reverse primer | 5'-GCCTTGACT GTGCCGTTGAAT-3' | ||
| Ins2 Forward primer | 5'-TGGCTTCTTC TACACACCCA-3' | ||
| Ins2 Reverse primer | 5'-TCTAGTTGCA GTAGTTCTCCA-3' |
References
- Gu, G., Dubauskaite, J., Melton, D. A. Direct evidence for the pancreatic lineage: NGN3+ cells are islet progenitors and are distinct from duct progenitors. Development. 129 (10), 2447-2457 (2002).
- Oliver-Krasinski, J. M., Stoffers, D. A. On the origin of the beta cell. Genes & Development. 22 (15), 1998-2021 (1998).
- Dor, Y., Brown, J., Martinez, O. I., Melton, D. A. Adult pancreatic beta-cells are formed by self-duplication rather than stem-cell differentiation. Nature. 429 (6987), 41-46 (2004).
- Smukler, S. R., et al. The adult mouse and human pancreas contain rare multipotent stem cells that express insulin. Cell Stem Cell. 8 (3), 281-293 (2011).
- Dorrell, C., et al. Human islets contain four distinct subtypes of beta cells. Nature Communications. 7, 11756(2016).
- Bader, E., et al. Identification of proliferative and mature beta-cells in the islets of Langerhans. Nature. 535 (7612), 430-434 (2016).
- Saliba, A. E., Westermann, A. J., Gorski, S. A., Vogel, J. Single-cell RNA-seq: Advances and future challenges. Nucleic Acids Research. 42 (14), 8845-8860 (2014).
- Qiu, W. L., et al. Deciphering pancreatic islet beta cell and alpha cell maturation pathways and characteristic features at the single-cell level. Cell Metabolism. 25 (5), 1194-1205 (2017).
- Picelli, S., et al. Smart-seq2 for sensitive full-length transcriptome profiling in single cells. Nature Methods. 10 (11), 1096-1098 (2013).
- Picelli, S., et al. Full-length RNA-seq from single cells using Smart-seq2. Nature Protocols. 9 (1), 171-181 (2014).
- Piccand, J., et al. Pak3 promotes cell cycle exit and differentiation of beta-cells in the embryonic pancreas and is necessary to maintain glucose homeostasis in adult mice. Diabetes. 63 (1), 203-215 (2014).
- Veite-Schmahl, M. J., Regan, D. P., Rivers, A. C., Nowatzke, J. F., Kennedy, M. A. Dissection of the mouse pancreas for histological analysis and metabolic profiling. Journal of Visualized Experiments. (126), (2017).
- Hu, P., Zhang, W., Xin, H., Deng, G. Single cell isolation and analysis. Frontiers in Cell and Developmental Biology. 4, 116(2016).
- Haque, A., Engel, J., Teichmann, S. A., Lonnberg, T. A practical guide to single-cell RNA-sequencing for biomedical research and clinical applications. Genome Medicine. 9 (1), 75(2017).
- Andrews, S. FastQC: A quality control tool for high throughput sequence data. , Available from: https://www.bioinformatics.babraham.ac.uk/projects/fastqc/ (2010).
- Langmead, B., Salzberg, S. L. Fast gapped-read alignment with Bowtie 2. Nature Methods. 9 (4), 357-359 (2012).
- Kim, D., et al. TopHat2: accurate alignment of transcriptomes in the presence of insertions, deletions and gene fusions. Genome Biology. 14 (4), (2013).
- Anders, S., Pyl, P. T., Huber, W. HTSeq--a Python framework to work with high-throughput sequencing data. Bioinformatics. 31 (2), Oxford, England. 166-169 (2015).
- Wagner, G. P., Kin, K., Lynch, V. J. Measurement of mRNA abundance using RNA-seq data: RPKM measure is inconsistent among samples. Theory in Biosciences. 131 (4), 281-285 (2012).
- Brennecke, P., et al. Accounting for technical noise in single-cell RNA-seq experiments. Nature Methods. 10 (11), 1093-1095 (2013).
- Le, S., Josse, J., Husson, F. FactoMineR: An R package for multivariate analysis. Journal of Statistical Software. 25 (1), (2008).
- Hadley, W. ggplot2: Elegant graphics for data analysis. , Springer Science & Business Media. (2009).
- Warnes, G., Bolker, B., Bonebakker, L., Gentleman, R., Huber, W., Liaw, A., Lumley, T., Mächler, M., Magnusson, A., Möller, S. gplots: Various R Programming Tools for Plotting Data. , Available from: https://cran.r-project.org/package=gplots (2016).
- Marcheva, B., et al. Disruption of the clock components CLOCK and BMAL1 leads to hypoinsulinaemia and diabetes. Nature. 466 (7306), 627-631 (2010).
- Li, L., et al. Single-cell RNA-seq analysis maps development of human germline cells and gonadal niche interactions. Cell Stem Cell. , (2017).
- Qi, M., et al. Human pancreatic islet isolation: Part I: Digestion and collection of pancreatic tissue. Journal of Visualized Experiments. (27), (2009).
- Qi, M., et al. Human pancreatic islet isolation: Part II: Purification and culture of human islets. Journal of Visualized Experiments. (27), (2009).
- Teo, A. K. K., et al. Single-cell analyses of human islet cells reveal de-differentiation signatures. Cell Death Discovery. 4 (14), (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved