Method Article
Perfusable сосудистая сеть с моделью ткани в устройстве Microfluidic
В этой статье
Резюме
Протокол описывает инженер perfusable сосудистой сети в сфероида. Окружающие микроокружения сфероида разрабатывается побудить ангиогенеза и подключить сфероида к микроканалов microfluidic устройства. Метод позволяет перфузии сфероида, который является долгожданный технику в трехмерном культур.
Аннотация
Сфероиде (многоклеточных совокупности) рассматривается как хорошая модель живых тканей в организме человека. Несмотря на значительные улучшения в культурах сфероида perfusable сосудистой сети в сфероидов остается важнейшей задачей для долгосрочной культуры, необходимо поддерживать и развивать их функции, такие как выражения протеина и морфогенеза. Протокол представляет новый метод для интеграции perfusable сосудистой сети в пределах сфероида microfluidic устройства. Чтобы побудить perfusable сосудистой сети в сфероида, ангиогенных ростки, подключенных к микроканалов на сфероиде руководствовались используя ангиогенных факторов от человеческих легких фибробластов, культивируемых в сфероида. Ростки ангиогенных достиг сфероида, объединилась с эндотелиальных клеток, совместно культивируемых в сфероида и формируется непрерывный сосудистой сети. Сосудистой сети может perfuse интерьер сфероида без какой-либо утечки. Сконструированный сосудистой сети может далее использоваться в качестве маршрута для поставки питательных веществ и удаления отходов, имитируя циркуляцию крови в vivo. Этот метод предоставляет новую платформу в культуре сфероида сторону лучше перепросмотре живых тканей.
Введение
Переход от монослойном культивировании (двухмерный) к трехмерной культуре мотивируется необходимость работы с моделями культуры, которые имитируют клеточных функций живых тканей1,2,3. Плоские и жесткие пластиковые субстраты, широко используется в культуре клеток не напоминают большую часть внеклеточных средах в человеческом теле. В самом деле многие исследования показывают, что трехмерная культуры воссоздать ткани конкретных архитектуры, механические и биохимических подсказки и связи ячеек, которые не наблюдались в обычных двумерных культуры4, 5,6,,78.
Мультиклеточные агрегат или сфероида, является одним из наиболее перспективных методов для реализации этой трехмерной культуры9,10. Клетки секретируют внеклеточного матрикса (ECM) и может взаимодействовать с другими в сфероида. Хотя некоторые другие биоинженерии подходы11,12,13,14, например, клеток укладки, успешно реплицировать пространственная сложность человеческого тела, эти подходы имеют только два или три виды клеток для облегчения анализа и сосредоточены на только одной функции органов-мишеней. В отличие от клеток в сфероидов подвергаются различные культуры среды в зависимости от их позиции в сфероида из-за разнородных поставки питательных веществ и кислорода и паракринными Аутокринный сигнальных молекул в сфероида. Эта особенность сфероидов частично имитирует в естественных условиях состояния культуры и включить клетки в сфероидов для создания гораздо более сложной, организованной ткани структуры в vitro чем те, которые культивировали в укладки ткани9, 15 , 16. Обратите внимание, что если сфероиде состоит из одного вида клеток, функции клеток в сфероида не равномерное вследствие неоднородной среды в сфероида. В последние несколько лет сфероиде культур позволило эмбриональных стволовых клеток (ЭСК), индуцированных плюрипотентных стволовых клеток (iPSCs) или ткани резидентов стволовые клетки, чтобы имитировать в естественных условиях развития последовательностей и воссоздать мини органы как мозг17, печени18и почек19,20.
Несмотря на значительный прогресс в сфероида культуры техники по-прежнему проблематично культивирования большой сфероидов долгое время. В трехмерные ткани клетки должны быть расположены в пределах 150-200 мкм кровеносного сосуда из-за ограниченное количество кислорода и питательных веществ,21. Сосудистой сети в пределах сфероида необходимы для пилки обмена веществ между кровью и тканями в естественных условиях. Для достижения этой цели, другие группы совместно культивируемых эндотелиальных клеток с целевой ячейки22,,2324 или индуцированной дифференцировка плюрипотентных клеток в CD31-положительных клеток20. Тем не менее сообщил корабля как структуры не имеют открытые концы lumina на поставку кислорода и питательных веществ в центр сфероида. Чтобы имитировать сосудистой роль питают клетки в трехмерном культуре, открытого и perfusable сосудистой сети должны разрабатываться в сфероида.
В течение последних нескольких лет некоторые исследовательские группы в поле микротехники сообщили методы построить perfusable сосудистой сети, спонтанно формируется в устройстве microfluidic используя ангиогенных факторов от cocultured фибробластов клетки25 ,26. Эти сосудистой сети имеют аналогичные морфология с их коллегами в естественных условиях и может быть перестроен факторами окружающей среды, что делает их пригодными для подражая сосудистой функции в культуре сфероида. Цель настоящего Протокола заключается в строительстве perfusable сосудистой сети в сфероида, используя microfluidic платформа27. Microfluidic устройство изменяется от ранее сообщалось устройство25 , так что сфероиде могут быть включены. Направляя ангиогенных секреции от клетки фибробластов в сфероиде эндотелиальных клеток в микроканалов, ангиогенных ростки от микроканалов, анастамозные с сфероида и сформировали perfusable сосудистой сети. Этот метод позволяет прямой поставкой широкого круга веществ, таких как флуоресцентных молекул и микрометр шкала бусины в интерьер сфероиде, который обеспечивает основу для долгосрочной культуры ткани с сосудистой сети.
протокол
1. Изготовление прессформы Microfluidic устройства
- Дизайн-шаблон microfluidic устройства с использованием имеющегося программного обеспечения (Clewin5 или AutoCAD 2016, и т.д.). Для функции Clewin5 смотрите руководство пользователя (http://manualzz.com/doc/7159150/clewin-user-s-manual).
Примечание: Файл дизайн доступен в дополнительных файлов 1. - Перенесите файл дизайн микро модель генератора и загрузить инструмент с маской хром покрытием с позитивного фоторезиста.
- Разоблачить позитивного фоторезиста в области шаблон, с помощью микро модель генератора.
- Развитие позитивного фоторезиста, используя разработчик (Таблица материалов) и промойте маску с дейонизированной водой (DI).
- Использование хрома etchant (Таблица материалов), etch хрома в пораженном участке, где был удален позитивный фоторезист. Смыть маску водой ди.
- Удалите оставшиеся фоторезиста на маску с помощью ацетона.
Примечание: Маски прозрачности может быть альтернативой для Cr маски. - Подготовьте чистую кремниевой пластины (4 дюйма, P(100)) и спин пальто Гексаметилдисилазан (ГМДО) при 3000 об/мин за 30 s.
- Softbake HMDS 5 мин при 120 ° C и прохладный пластины для 5 мин при комнатной температуре.
- Spincoat негативного фоторезиста (таблица материалов) на 500 rpm для 10 s и 1200 об/мин за 30 s.
Примечание: Состояние покрытия спина должна принести слоёв фоторезиста с толщиной примерно 100 мкм на пластинах после фотолитографии. - Prebake негативного фоторезиста для 45 мин при 95 ° C и прохладный вафельные для 60 мин при комнатной температуре.
- Проверка интенсивности света в каждом эксперименте и рассчитать время экспозиции для общей экспозиционной дозы энергии на 250 МВт/см2. Место фотошаблонов (шаг 1.1-1.6) на пластины и подвергать их УФ-излучения.
- Postbake негативного фоторезиста за 1 мин при температуре 65 ° C и 5 мин при 95 ° C. Разрешить вафельные остыть в течение 1 мин при комнатной температуре.
- Разработка слой негативного фоторезиста для 15 мин в первой ванной разработчик (Таблица материалов) и 2 мин в втором баня. Промойте пластины в первой ванной изопропиловый спирт (IPA) для 10 s и второй ванной АПИ для 10 s.
- Hardbake негативного фоторезиста на 30 минут при 200 ° C и прохладный пластины для 5 мин при комнатной температуре.
- Измерьте толщину слоя негативного фоторезиста, используя профилировщик поверхности.
- Поместите пластины в эксикатор, подключенных к вакуумного насоса и 200 мкл силана (trichloro(1H,1H,2H,2H-perfluorooctyl)silane). Включите насос за 10 мин, затем выключите его и держите пластины в эксикатор для 4 ч.
2. Изготовление шаги и Ассамблея PDMS слоев
- Литой полидиметилсилоксан (PDMS) предварительно полимера (PDMS база: Вулканизирующий агент = 10:1 (w/w)) и Дега в вакуумной камере за 2 ч.
- Лечение PDMS при 80° C в воздух вентилируемые печи на ночь.
- Отделите PDMS из кремниевой пластины.
- Пробейте отверстия 1A - 3B (рис. 1) и культура сфероида хорошо. Используйте удар диаметром 2 мм для отверстий 1A - 3B и диаметром 1 мм удар для сфероида хорошо.
- Очистите плиты PDMS и стекла Крышка выскальзования (24 × 24 мм) с клейкой лентой, неоднократно наклеивания и отшелушивающим ленты. Затем обработать PDMS плиты с воздуха плазмой для 40 s (40 МВт, 50 sccm).
- Бонд PDMS плиты на стекла Крышка выскальзования высылать воздушные пузыри от поверхности между PDMS плиты и крышка выскальзования и лечения при 80 ° C в течение 12 часов.
3. сфероида подготовка
Примечание: В исследовании, красный флуоресцирующий белок, выражая человеческие пупочной вены эндотелиальных клеток (ППК-HUVECs) и выражая Зеленый флуоресцирующий белок HUVECs (GFP-HUVECs) используются в сфероида и микроканалов, соответственно, чтобы отличить происхождение HUVECs после строительства perfusable сосудистой сети. Если происхождение HUVECs не нужна, неподписанном HUVECs являются достаточно для эксперимента.
- Оттепель ЗП-HUVECs (3.0 × 105 клеток/флакона) и легкое человека фибробластов (hLF) (1.0 × 106 клеток/флакона) и добавить их в 10 мл среды для эндотелиальные клетки и клетки фибробластов, соответственно (Таблица материалов). Культура их в 100-мм блюдо на 37 ° C и 5% CO2 на 2-3 дней для югу вырожденная ЗП-HUVECs и hLFs. Эта подготовка будет выход ~ 200 сфероидов.
- Отсоединить ЗП-HUVECs и hLFs из блюд с 2 мл 0,05% трипсина-ЭДТА и остановить трипсина реакции с 4 мл DMEM, содержащие 10% (v/v) плода бычьим сывороточным (ФБС) и 1% (v/v) пенициллина/стрептомицина.
- После центрифугирования в 220 g x 3 мин удалить супернатант и Ресуспензируйте ЗП-HUVECs и hLFs в эндотелиальных средне окончательный клеток концентрации на 2,5 × 104 и 1.0 × 105 кл/мл, соответственно.
- Аккуратно добавьте 200 мкл суспензии клеток (5000 ячейки для ЗП-HUVECs) и 20 000 hLFs на хорошо в 96-луночных плита с ультра-низким привязки поверхностью.
- Инкубируйте 96-луночных пластины при 37 ° C и 5% CO2 в течение 2-4 дней.
Примечание: Поскольку сфероида диаметр зависит от культуры периода и первоначальный мобильный номер в 96-луночных пластины, он может управляться этими двумя параметрами.
4. клетки посева в Microfluidic устройства
Примечание: Именования для отверстия, каналы и сфероида хорошо демонстрируются на рисунке 1. Мы определяем день 0 как день, когда ячейка уборки в устройство microfluidic закончена. Схема экспериментальной график показан на рисунке 2.
- Загрузка сфероида день −1)
Примечание: Следующий шаг должен выполняться на льду для предотвращения гелеобразования коллагена и фибрином.- Растворите фибриногена в фосфатный буфер (PBS) для окончательного концентрации 2,80 мг/мл.
- Подготовьте нейтрализованы коллагена (3,0 мг/мл в PBS) согласно протоколу производителя.
- Объедините 107.2 мкл раствора фибриногена (2,80 мг/мл), 8.0 мкл нейтрализованы коллагена (3,0 мг/мл) и 3.6 мкл Апротинин (5 ед/мл) в реакции в трубку. Это решение обозначено как «мастер смесь решение» (МС).
Примечание: Объем достаточен для загрузки одним сфероид. Если имеется более одного сфероида, умножьте количество сфероидов каждого тома. - Растворите тромбина в PBS для конечной концентрации 50 ед/мл.
Примечание: Аликвоты 50 ед/мл тромбина (20 мкл/трубка) хранятся в −30 ° C и разморожен перед каждой эксперимент. - Место пластину 96-луночных, содержащий сфероидов внутри шкафа биобезопасности.
- Подготовьте два Петри 35-мм внутри шкафа, с одно блюдо на льду (1 блюдо) и другое блюдо на benchtop (блюдо 2) биобезопасности. Накапайте 99 µL из MS в центре блюдо 1 (рис. 3a) в форме капли.
- Обрежьте кончики 2 желтый (10-100 мкл) и 3 Очистите наконечники (1-100 мкл) для сбора сфероидов от 96-луночных пластины, смешивая тромбина с МС, точные коллекции сфероидов, впрыскивать сфероидов в устройство и инъекционных средств массовой информации в устройство , соответственно. Размер пор кончика должно быть немного больше, чем диаметр отверстия 1A - 3B каналов 1 и 3 или сфероида хорошо в канале 2 для snug вписывается.
Примечание: Далее, если не указано иное, используйте пипетку советы, сократить в этом шаге. Фотография среза советы доступны на рисунке 4. - Собирать сфероиде с 100 мкл среды от 96-луночных пластины и добавить его в блюдо 2 (рис. 3a).
- Подберите сфероида с минимальным объемом средств массовой информации из блюдо 2. Удерживая дозаторов вертикально, сфероида должен двигаться в направлении нижней части кончика пипетки самотеком. Сфероида выкинуть прикоснувшись наконечник пипетки на мениск MS капелька в блюдо 1 (рис. 3a).
Примечание: Следующие шаги 4.1.10 & 4.1.11 должны выполняться быстро. - 1 мкл тромбина (50 ед/мл) и перемешать аккуратно с кончик желтый пипетки.
- С пипеткой, равным 7 мкл подобрать сфероида и медленно, поместите его в скважину сфероида (рис. 3b).
- Инкубируйте 15 мин при 37 ° C для гелеобразования фибрина.
- Медленно вводить эндотелиальной среднего от отверстия 1A и 3A и заполнить каналы 1 и 3 с СМИ (20 ~ 30 мкл/канал).
- Поместите устройство в 100-мм блюдо с мокрой Kimwipe для предотвращения испарения СМИ от устройства (рис. 3 c).
- Поместите устройство на 37 ° C и 5% CO2 для 24 h удалить пузырьки на стыке между СМИ и фибрином.
- HUVECs день 0) Загрузка
- Оттепель GFP-HUVECs (3,0 x 105 клеток/флакона) и добавить их в 10 мл эндотелиальной среды. Культура их в тарелку 100-мм при 37 ° C и 5% CO2 на 2-3 дней, чтобы достичь суб confluency. Одно блюдо югу вырожденная GFP-HUVECs достаточно для приготовления 8-10 устройств.
- Отсоединить GFP-HUVECs из блюд с 2 мл 0,05% трипсина-ЭДТА и остановить трипсина реакции с 4 мл DMEM, содержащие 10% (v/v) плода бычьим сывороточным (ФБС) и 1% (v/v) пенициллина/стрептомицина.
- После центрифугирования в 220 g x 3 мин Ресуспензируйте GFP-HUVECs в среде эндотелиальной 5.0 x 106 клеток/мл.
- Инъекционные суспензии клеток HUVECs в канал 1 через отверстие 1B (20 мкл/канал).
- Наклоните устройство microfluidic 90°, поместите его на стороне и инкубировать при 37 ° C за 30 минут, чтобы обеспечить соблюдение HUVECs фибрина в канале 2.
- Подтвердите вложение HUVECs на фибрин. Когда количество HUVECs, придает на стыке между гелем и среднего не является достаточным, сосудистую может быть отключен в корне сосудистых после нескольких дней культуры устройства (рис. 5). В протоколе, успех перфузии составляет > 50%.
- Повторите шаги 4.2.4 и 4.2.5 для канала 3.
- Культура клетки в 100-мм блюдо с влажной Kimwipe при 37 ° C и 5% CO2 на 7-14 дней.
- День 1 ~) Обмен СМИ
- Обмен половина средств массовой информации в каналах 1 и 3 каждый день.
5. окрашивания ядер
- Подготовьте параформальдегида 4% (PFA) в PBS.
- Извлеките из каналы 1 и 3 и 20 мкл 4% PFA на канал. Чтобы заменить решение в 4% PFA, повторить удаление решения из устройства и добавление 4% PFA три раза.
- Инкубируйте устройство на 4 ° C на ночь.
- Удалите 4% PFA от устройства и мыть каналы три раза с PBS.
- 20 мкл 10 мкг/мл Люминесцентную краску (Таблица материалов), на канал пятно клеточных ядер. Для обмена решение в устройство, повторите удаление решения из устройства и добавление 10 мкг/мл Люминесцентную краску три раза.
- Храните прибор при температуре 4 ° C на 24 часа.
6. жидкости перфузии сфероида
- Подготовьте сфероида после культивирования для более чем 7 дней в устройстве при 37 ° C и 5% CO2 для завершения непрерывной сосудистые пути.
- Удалите носитель из отверстия 1A, 1B, 3A и 3B.
- Ввести 10 мкл 10 мкм решения флуоресцеин Изотиоцианаты (FITC)-декстрана в PBS в отверстия 1A и 1B.
- Мониторинг потока микрошарики или FITC краска под инвертированным микроскопом.
7. Количественная оценка длины Росток
Примечание: ImageJ ver. 1,49 программное обеспечение используется для анализа изображения в этом исследовании.
- Перекрытие изображений GFP-HUVECs дней, 0, 1, 3, 5 и 7.
- Вычтите положение кончика сосудистую день 0 из той же позиции на снимки, сделанные на 1, 3, 5 и 7 дней.
- Определите рост сосудов подсказка от корневого позиции (рис. 6). Расстояние между сосудистой наконечник и корень был определен как длина прорастают в этом исследовании (рис. 7b).
8. Количественная оценка сосудистой углов
Примечание: Сосудистая угол был определен как угол состояла сосудистой угол, корень и центр сфероида (рис. 7 c).
- Бинаризация флуоресцентного изображения coculture сфероида, содержащих ЗП-HUVECs и измерить положение «центр тяжести», функции анализа в ImageJ. В этом исследовании измеренные «центр тяжести» положение определяется как центр сфероида (рис. 6).
- Определите положение сосудистой советы и корни в так же, как в шаге 7.
- Измерьте сосудистой углов с помощью функции анализа в ImageJ программного обеспечения.
Результаты
Рисунок 1 показывает, Дизайн и фото microfluidic устройства. Она имеет три параллельных каналов, в котором канал 2 содержит сфероида хорошо. Для культуры HUVEC используются каналы 1 и 3 и 2 канал для сфероида. Каждый канал отделяется трапециевидной microposts предназначен шаблон PDMS. Microposts предотвратить гидрогеля на канале 2 от утечки в каналах 1 и 3, поверхностное натяжение и позволяют обмена веществ между сфероида и HUVECs в микроканалов28.
7а Рисунок показывает центр microfluidic устройства после заполнения ячейки. Яркие области и флуоресцентных изображений, снятых в день 0 показывают, что фибрина Гель заполнены только канал 2 без какой-либо утечки в каналы 1 и 3, и HUVECs успешно подключился к боковине гель фибрина. Светлые области изображения находится в фокусе на обоих загруженного сфероида и microposts, указав, что сфероида должным образом урегулирован в нижней части устройства. Ростки ангиогенных наблюдаются на 1 день и длина проростков увеличивается с течением времени (рис. 7b). На 3 день длинный Росток достиг сфероида, и на 7 день, большая часть ангиогенных ростки достигла сфероида (среднее расстояние от каналы 1 и 3 на сфероиде < 500 мкм). В лучшем случае после 4 дней в культуре устройства, можно наблюдать поток через сосудистые люмен. Сосудистые угол был определен как направления кончик сосудистой и центр сфероида от сосудистых корня. Рисунок 7 c показывает количественных сосудистой угол во время 7 дней в культуре устройства. Сосудистая углы сократилась в зависимости от времени, указывающее, что ростки ангиогенных мигрировали к сфероида.
Рисунок 8 показывает раздел сосудистой сети, где слились ЗП-HUVECs и GFP-HUVECs. ЗП-HUVECs и GFP-HUVECs соответственно сформировали единый сосудистой люмен как показано стрел, который четко указывают ангиогенных ростки от каналы 1 и 3, анастамозные для ЗП-HUVECs в сфероида и сформировали непрерывной сосудистой сети. Для подтверждения perfusability сосудистой сети, FITC-декстран было впрыснуто в канал 1. FITC-декстрана в канале 1 пропустило в построенных сосудистой сети и интерьер сфероида и наконец достигли канал 3 (рис. 9). Во время перфузии FITC-декстран решения нет никакой утечки из сосудистой сети в внесосудистой пространства. Ранее было показано, что малые молекулы, вводят в просвете сосудов проходят через сосудистую стенку и реагировать с клетками в внесосудистой регионах. Кроме того коэффициент проницаемости сосудистой сети было показано рядом что в естественных условиях27. Эти результаты подразумевают что интегрированной сосудистой сети может поставлять питательные вещества для сфероида и удаления отходов продукта.
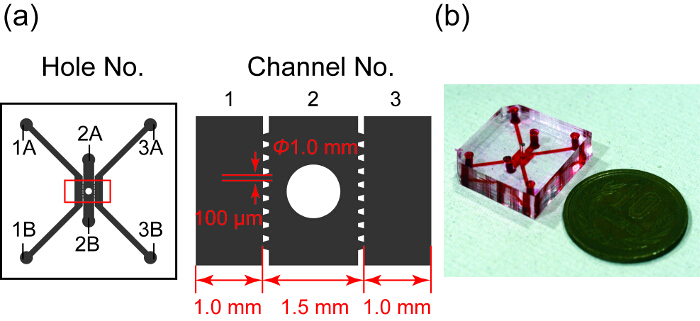
Рисунок 1 : Дизайн и фотография устройства microfluidic. a обзор дизайн microfluidic устройства. Серая область указывает три microfluidic каналы, разделенные трапециевидной microposts. Канал 2 имеет хорошо сфероида культуры. Правом рисунке показано увеличенное изображение в красный прямоугольник в левом. (b) фотография microfluidic устройства, чьи каналы заполнены с красными чернилами. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 2 : Экспериментальная время. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 3 : Метод для загрузки в устройство microfluidic сфероида. a обеспечения падение MS и СМИ с сфероиде в двух отдельных блюд. Затем перевести сфероида на MS с тромбина. (b) Схематический разрез устройства во время инъекции сфероида. Избыточное количество геля вытекает через отверстия 2A и 2B. Однако сфероида остается в нижней части устройства из-за физической изоляции. (c) схема устройства, когда они находятся в инкубаторе. Мокрые Kimwipe был помещен в блюдо 100-мм и два блюда 35-мм с устройством были поставлены на Kimwipe. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 4 : Фотографии наконечники вырезать для посева на устройство ячейки. Левый белый кончик предназначен для отверстия 1A, 1B, 3A и 3C и передачи сфероида капля геля фибрина (шаги 4.1.9, 4.1.13, 4.2.4 и 4.2.6). Средний Желтый наконечник предназначен для коллекции сфероида от 96-луночных (шаг 4.1.7). Право белым кончиком предназначен для хорошо сфероида (шаг 4.1.11). Советы перед вырезать также показан на фотографии. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
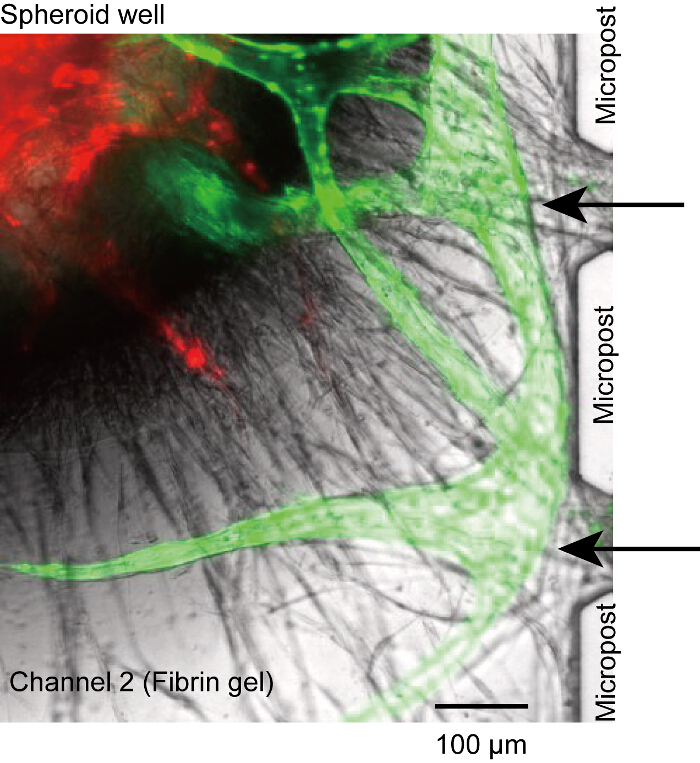
Рисунок 5 : Non-perfusable сосудистую. Ангиогенных ростки от микроканалов не удалось подключиться к открытию между microposts и потерял связь между люмен и микроканалов (черные стрелки). Это вызвано недостаточной HUVECs посеяны в каналах 1 и 3. Красный: ППП-HUVECs в сфероида, зеленый: GFP-HUVECs от микроканалов. Клетки были культивировали в устройстве на 14 дней. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 6 : Определение сосудистой корень, наконечник и центр сфероида. () метод для определения позиции сосудистой корня и наконечник, чтобы измерить длину прорастают. После пристрелки покадровой флуоресцентного изображения, флуоресцентный изображение, принятое за несколько дней после культивирования в устройстве вычитается в изображении на день 0. Мы измерили длину ростки после вычитания ImageJ программного обеспечения. (b) определение центр сфероида. Флуоресцентного изображения ЗП-HUVECs binarized и измеряется в ее центр тяжести ImageJ программного обеспечения. Мы определяем центроид как центр сфероида. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
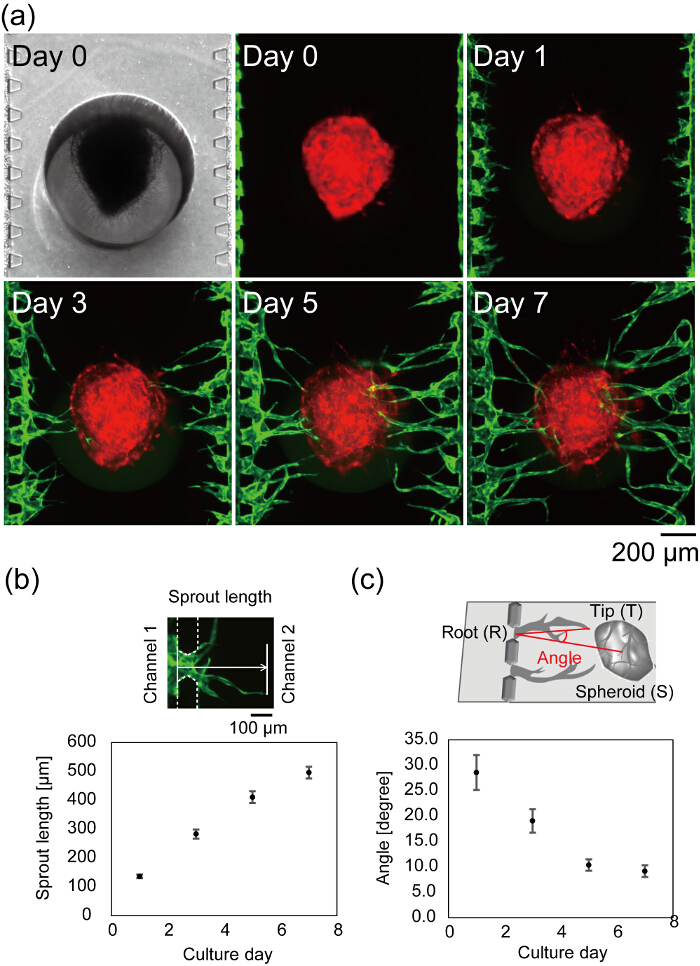
Рисунок 7 : Формирование сосудистой сети в устройстве microfluidic. (a) промежуток времени изображения центра microfluidic устройства после заполнения ячейки. Красный: ППП-HUVECs культивировали в сфероида, зеленый: GFP-HUVECs собирают в каналах 1 и 3. Количественный анализ Росток Длина (b) и сосудистой угол (c) (n = 42 ростки в 3 устройств, погрешностей указывают стандартные ошибки (ФБ)). Росток длина был определен как расстояние от позиции HUVECs в день 0 сосудистой оконечности (b, сверху). Угол (∠TRS) определяется сосудистой корень (R), наконечник (T) и центр сфероида (S) (c, сверху). Для определения сосудистой корень, подсказки и центр сфероида см. Рисунок 6 . Эти данные были получены с помощью ImageJ программного обеспечения. Схемы, объясняя определение длины прорастают и сосудистой угол изменяются от Насимото, ю. и др. 27. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 8 : Формирование сосудистой люмен микроканалов и сфероида, HUVECs. () флуоресцентных изображение обзор образца после 14 дней в культуре устройства. Желтый прямоугольник указывает позицию x-y оптических секции показано в пункте (b). (b) x-y, y-z и x-z оптических Секция сконструированный сосудистой сети. Белые стрелки указывают просвета сосудов. Красный: ППП-HUVECs культивировали в сфероида, зеленый: GFP-HUVECs культивировали в микроканалов, синий: клеточных ядер. () показывает не голубой флуоресценцией, потому что (а) представляет собой изображение до фиксации. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
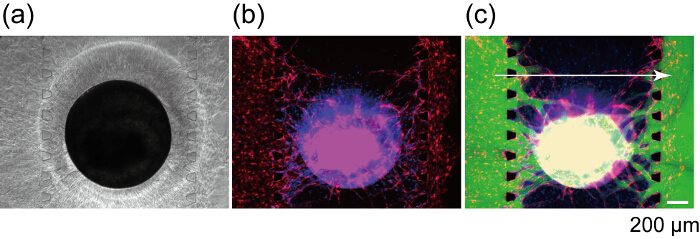
Рисунок 9 : Перфузии сфероида, с использованием сконструированного сосудистой сети. Яркие области (а) и флуоресцентные (b) изображения сфероида после 7 дней в культуре устройства. (c) флуоресцентного изображения же сфероида после FITC-декстрана (70 кДа) загрузки. Красный: ППП-HUVECs в сфероида и каналы 1 и 3, зеленый: FITC-декстрана, синий: клеточных ядер. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Дополнительный файл 1: дизайн устройства microfluidic. Файл находится в формате dxf. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
Предыдущие доклады показывают, что hLFs выделяют коктейль из нескольких ангиогенных факторов, таких, как Ангиопоэтин-1, Ангиогенин, фактора роста гепатоцитов, превращая фактор роста α, фактора некроза опухоли и некоторые внеклеточного матрикса белки29, 30. Этот assay полагается на секрецию ангиогенных из hLFs в coculture сфероиде, который является ограничение техники. Таким образом крайне важно для формирования стабильной сосудистой установить сфероиде coculture в нижней части хорошо, таким образом, чтобы расстояние между сфероида coculture и HUVECs в каналах 1 и 3 может быть сокращен. Сосудистые длиной от фибробластов был обратно пропорциональна расстоянию между эндотелиальных клеток и фибробластов31, так что короче расстояние является выгодным для стабильного формирования сосудов. Однако чтобы открыть отверстие сфероида (1 мм в диаметре) без повреждения каналы 1 и 3, минимальная ширина канала 2 был 1,5 мм.
Хотя сфероида оседает на дне колодца, сосудистая корни иногда были отключены от microposts или микроканалов (рис. 5). В этом случае не реагент может достичь сосудистой люмен через микроканалов (каналы 1 или 3). Хотя мы не могли решить эту проблему полностью, мы предполагаем, что эта проблема обусловлена недостаточное количество HUVECs на поверхности геля фибрина (шаг 4.2.1-4.2.6). Убедитесь, что HUVECs стабильно Прикрепите боковой стенке канала 2.
К успешным инъекций сфероиде в колодец, оптимизировать внутренний и наружный диаметр микропипеткой советы на шаге 4.1.7 имеет важное значение: 1) внутренний диаметр должен быть больше, чем сфероида. 2 Наружный диметр должны соответствовать на край колодца, так что никакой утечки геля происходит в верхней части колодца во время инъекции и чаевые могут быть легко удалены после инъекции геля. В настоящем Протоколе (φ1 мм сфероиде хорошо) около 700 мкм-максимальный диаметр для инъекционного сфероида. Если хорошо диаметр предназначен больше, чем в настоящем Протоколе, больше сфероидов могут быть введены, потому что можно отрезать кончик иметь больше внутреннего диаметра. Сфероида диаметра можно легко контролировать путем изменения количества клеток, найденным в 96-луночных пластины.
Во-первых, этот протокол показывает Роман microfluidic платформа для построения perfusable сосудистой сети в сфероида. Хотя coculture с HUVECs позволяет формирование судна подобных структур в сфероида18,23,24, это были не perfusable из-за мертвых заканчивается lumina. Потому что фибробласты, клетки существуют в универсальный тканях (кости, Адипоцит и рака, и т.д.), путем добавления некоторых других ориентации клетки coculture сфероида, васкуляризации различного вида сфероидов можно ожидать, что можно имитировать в VIVO лучше, чем обычные сфероида культуры окружающей среды. Чтобы расширить применение техники, будущая работа будет включать васкуляризации сфероидов без добавления клетки фибробластов. Некоторые недавние работ доклад костного стромальные клетки32 и мышечные клетки33 может вызвать ангиогенеза в microfluidic приборы. Используя стромальные или мышечные клетки вместо клетки фибробластов увеличит количество тканей, которые могут быть васкуляризированной microfluidic устройство. Этот протокол обеспечивает базовую платформу васкуляризации ткани, что долгожданный технику в области три размерные культур.
Раскрытие информации
Автор заявляют, что они не имеют никаких финансовых интересов.
Благодарности
Эта работа была поддержана гребень JST (Грант № JPMJCR14W4), общества для поощрения от науки (JSP) KAKENHI (номер 25600060, 16K 16386 Грант), центр инновационной программы от МПКСНТ и JST, проект был сосредоточен на разработке технологии оценки ключ от Японское агентство для медицинских исследований и развития, AMED, Mizuho Фонд содействия развитию наук. Микротехнологий поддержали Киотский университет нано технологии концентратора.
Материалы
| Name | Company | Catalog Number | Comments |
| AutoCAD 2017 | Autodesk | AutoCAD 2017 | |
| A chromium mask coated with AZP 1350. | CLEAN SURFACE TECHNOLOGY | CBL2506Bu-AZP | |
| Micro pattern generator | Heidelberg | uPG101 | |
| MF CD-26 developer | Rohm and haas electronic materials | - | Developer in protocol 1.4 |
| S-Clean | Sasaki Chemical | S-24 | Chromium etchant in protocol 1.5 |
| Aceton | Wako | 012-00343 | |
| Silicon Wafer | Canosis | SiJ-4 | |
| Spin Coater | MIKASA | 1H-D7 | |
| Hexamethyldisilazane (HMDS) | Tokyo Ohka Kogyo | H0089 | |
| SU-8 3050 | MicroChem | - | Negative photoresist in protocol 1.9 |
| UV Exposure | Nanometric Technology Inc | LA310s | |
| SU-8 Developer | MicroChem | Y020100 | Developer for the negative photoresist in protocol 1.13 |
| 2-propanol | Wako | 163-04841 | |
| Surhace profiler | Vecco | Veeco Dektak XT-S | |
| (Trichloro (1H, 1H, 2H, 2H-perfluorooctyl) silane | Sigma | 448931 | |
| Polydimethylsiloxane (PDMS) | Dow Corning Toray | 184W/C | |
| Biopsy Punch (1.0mm) | Kai Industries | BP-10F | |
| Biopsy Punch (2.0mm) | Kai Industries | BP-20F | |
| Plasma System | Femto Science | COVANCE | |
| Cover glass | MATSUNAMI GLASS | C024241 | |
| Culture Dishes | Iwaki | 1000-035 | |
| RFP Expressing Human Umbilical Vein Endothelial Cell | Angio Proteomie | cAP-0001RFP | |
| Normal Human Lung Fibroblasts | Lonza | CC-2512 | |
| Endothelial Cell Growth Medium | Lonza | CC-3162 | |
| Fibroblast Growth Media Kits | Lonza | CC-3132 | |
| DMEM | Thermo Fisher Scientific | 11965092 | |
| Fetal Bovine Serum | Thermo Fisher Scientific | 26140079 | |
| Penicillin-Streptomycin Solution | Wako | 168-23191 | |
| 0.05w/v% Trypsin-0.53mmol/l EDTA• 4Na Solution with Phenol Red | Wako | 204-16935 | |
| PBS (Phosphate Buffered Salts) | Takara bio | T900 | |
| 96-well plate | Sumitomo bakelite | 631-21031 | |
| 1000ul Chip | NIPPON Genetics | FG-402 | |
| 200ul Chip | NIPPON Genetics | FG-301 | |
| 10ul Chip | NIPPON Genetics | 37650 | |
| CO2 incubator | Thermo Fisher Scientific | Model 370 | |
| GFP Expressing Human Umbilical Vein Endothelial Cell | Angio Proteomie | cAP-0001GFP | |
| Fibrinogen from bovine plasma | Sigma | F8630 | |
| Aprotinin from bovine lung | Sigma | A6279 | |
| Collagen I | Corning | 354236 | |
| Thrombin from bovine plasma | Sigma | T4648 | |
| Hoechst 33342 | Invitrogen | H21492 | Fluorescent dye to stain nuclei in protocol 5.5 |
| Paraformaldehyde Solution | Wako | 163-25983 | |
| Inverted Fluorescence Microscope | OLYMPUS | IX71 | |
| Degital CCD Camera | OLYMPUS | ORCA-R2 | |
| Confocal Laser Scanning Biological Microscope | OLYMPUS | FV1000 | |
| Inverted Fluorescence Microscope | OLYMPUS | IX-83 | |
| Fluorescein isothiocyanate-dextran | Sigma | FD70S |
Ссылки
- Abbott, A. Cell culture: Biology's new dimension. Nature. 424 (6951), 870-872 (2003).
- Pampaloni, F., Reynaud, E. G., Stelzer, E. H. K. The third dimension bridges the gap between cell culture and live tissue. Nature Reviews Molecular Cell Biology. 8 (10), 839-845 (2007).
- Shamir, E. R., Ewald, A. J. Three-dimensional organotypic culture: experimental models of mammalian biology and disease. Nature Reviews Molecular Cell Biology. 15 (10), 647-664 (2014).
- Abu-Absi, S. F., Friend, J. R., Hansen, L. K., Hu, W. S. Structural polarity and functional bile canaliculi in rat hepatocyte spheroids. Experimental Cell Research. 274 (1), 56-67 (2002).
- Bissell, M. J., Radisky, D. C., Rizki, A., Weaver, V. M., Petersen, O. W. The organizing principle: microenvironmental influences in the normal and malignant breast. Differentiation. 70 (9-10), 537-546 (2002).
- Liu, Y., et al. Novel role for netrins in regulating epithelial behavior during lung branching morphogenesis. Current Biology. 14 (10), 897-905 (2004).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-U147 (2009).
- Torisawa, Y. S., Shiku, H., Kasai, S., Nishizawa, M., Matsue, T. Proliferation assay on a silicon chip applicable for tumors extirpated from mammalians. International Journal of Cancer. 109 (2), 302-308 (2004).
- Fennema, E., Rivron, N., Rouwkema, J., van Blitterswijk, C., de Boer, J. Spheroid culture as a tool for creating 3D complex tissues. Trends in Biotechnology. 31 (2), 108-115 (2013).
- Sutherland, R. M. Cell And Environment Interactions In Tumor Microregions - The Multicell Spheroid Model. Science. 240 (4849), 177-184 (1988).
- Rothbauer, M., Zirath, H., Ertl, P. Recent advances in microfluidic technologies for cell-to-cell interaction studies. Lab on a Chip. , (2017).
- Matsuura, K., Utoh, R., Nagase, K., Okano, T. Cell sheet approach for tissue engineering and regenerative medicine. Journal of Controlled Release. 190, 228-239 (2014).
- Esch, E. W., Bahinski, A., Huh, D. Organs-on-chips at the frontiers of drug discovery. Nature Reviews Drug Discovery. 14 (4), 248-260 (2015).
- Bhatia, S. N., Ingber, D. E. Microfluidic organs-on-chips. Nature Biotechnology. 32 (8), 760-772 (2014).
- Lancaster, M. A., Knoblich, J. A. Organogenesis in a dish: Modeling development and disease using organoid technologies. Science. 345 (6194), (2014).
- Hirschhaeuser, F., et al. Multicellular tumor spheroids: An underestimated tool is catching up again. Journal of Biotechnology. 148 (1), 3-15 (2010).
- Lancaster, M. A., et al. Cerebral organoids model human brain development and microcephaly. Nature. 501 (7467), 373 (2013).
- Takebe, T., et al. Vascularized and functional human liver from an iPSC-derived organ bud transplant. Nature. 499 (7459), 481 (2013).
- Taguchi, A., et al. Redefining the In Vivo Origin of Metanephric Nephron Progenitors Enables Generation of Complex Kidney Structures from Pluripotent Stem Cells. Cell Stem Cell. 14 (1), 53-67 (2014).
- Takasato, M., et al. Kidney organoids from human iPS cells contain multiple lineages and model human nephrogenesis. Nature. 526 (7574), 564-568 (2015).
- Auger, F. A., Gibot, L., Lacroix, D., Yarmush, M. L. . Annual Review of Biomedical Engineering. 15, 177-200 (2013).
- Inamori, M., Mizumoto, H., Kajiwara, T. An Approach for Formation of Vascularized Liver Tissue by Endothelial Cell-Covered Hepatocyte Spheroid Integration. Tissue Engineering Part A. 15 (8), 2029-2037 (2009).
- Kunz-Schughart, L. A., et al. Potential of fibroblasts to regulate the formation of three-dimensional vessel-like structures from endothelial cells in vitro. American Journal of Physiology-Cell Physiology. 290 (5), C1385-C1398 (2006).
- Rouwkema, J., De Boer, J., Van Blitterswijk, C. A. Endothelial cells assemble into a 3-dimensional prevascular network in a bone tissue engineering construct. Tissue Engineering. 12 (9), 2685-2693 (2006).
- Kim, S., Lee, H., Chung, M., Jeon, N. L. Engineering of functional, perfusable 3D microvascular networks on a chip. Lab on a Chip. 13 (8), 1489-1500 (2013).
- Moya, M. L., Hsu, Y. H., Lee, A. P., Hughes, C. C. W., George, S. C. In Vitro Perfused Human Capillary Networks. Tissue Engineering Part C-Methods. 19 (9), 730-737 (2013).
- Nashimoto, Y., et al. Integrating perfusable vascular networks with a three-dimensional tissue in a microfluidic device. Integrative Biology. 9 (6), 506-518 (2017).
- Huang, C. P., et al. Engineering microscale cellular niches for three-dimensional multicellular co-cultures. Lab on a Chip. 9 (12), 1740-1748 (2009).
- Newman, A. C., et al. Analysis of Stromal Cell Secretomes Reveals a Critical Role for Stromal Cell-Derived Hepatocyte Growth Factor and Fibronectin in Angiogenesis. Arteriosclerosis Thrombosis and Vascular Biology. 33 (3), 513 (2013).
- Newman, A. C., Nakatsu, M. N., Chou, W., Gershon, P. D., Hughes, C. C. W. The requirement for fibroblasts in angiogenesis: fibroblast-derived matrix proteins are essential for endothelial cell lumen formation. Molecular Biology of the Cell. 22 (20), 3791-3800 (2011).
- Griffith, C. K., et al. Diffusion limits of an in vitro thick prevascularized tissue. Tissue Engineering. 11 (1-2), 257-266 (2005).
- Zheng, Y., et al. Angiogenesis in Liquid Tumors: An In Vitro Assay for Leukemic-Cell-Induced Bone Marrow Angiogenesis. Advanced Healthcare Materials. 5 (9), 1014-1024 (2016).
- Osaki, T., Sivathanu, V., Kamm, R. D. Crosstalk between developing vasculature and optogenetically engineered skeletal muscle improves muscle contraction and angiogenesis. Biomaterials. 156, 65-76 (2018).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены