Method Article
미세 소자에서 조직 모델 perfusable 혈관 네트워크
요약
프로토콜에는 회전 타원 체에 perfusable 혈관 네트워크를 설계 하는 방법을 설명 합니다. 회전 타원 체의 주변 microenvironment 신생 유도 microchannels 미세 장치에는 회전 타원 체 연결을 고안 이다. 메서드를 사용 하면 3 차원 문화에 오랫동안 기다려온 기술 회전 타원 체의 관류를 수 있습니다.
초록
회전 타원 체 (다세포 집계)는 인간의 신체에서 살아있는 조직의 좋은 모델으로 간주 됩니다. 회전 타원 체 문화에서 중요 한 발전에도 불구 하 고 perfusable 혈관 네트워크는 spheroids에 유지 하 고 단백질 식 및 morphogenesis 같은 그들의 기능을 개발 하는 데 필요한 장기 문화에 대 한 중요 한 도전 남아 있습니다. 프로토콜 미세 장치에서 회전 타원 체 내 perfusable 혈관 네트워크를 통합 하는 새로운 방법을 선물 한다. Perfusable 혈관 네트워크는 회전 타원 체에 유도, 신생 콩나물 microchannels에 연결 된 인간의 폐 섬유 아 세포는 회전 타원 체에 경작에서 신생 요소를 활용 하 여는 회전 타원 체를 유도 했다. 신생 콩나물 회전 타원 체, 회전 타원 체, 공동 경작 하는 내 피 세포와 합병을 도달 하 고 지속적인 혈관 네트워크를 형성 했다. 혈관 네트워크 어떤 유출 없이 회전 타원 체의 내부를 perfuse 수 있습니다. 생성 된 혈관 네트워크 영양분의 공급과 혈액 순환 비보를 흉내 낸 폐기물의 제거에 대 한 경로로 추가 사용 수 있습니다. 메서드를 사용 하면 조직 생활의 더 나은 재현 부로 회전 타원 체 문화에서 새로운 플랫폼을 제공합니다.
서문
생활의 세포질 기능을 모방 하는 문화 모델을 사용 하는 필요에 의해 자극 된다 3 차원 문화에 단층 (2 차원) 문화에서 변화 조직1,2,3. 일반적으로 세포 배양에 사용 하는 평평 하 고 단단한 플라스틱 기판 대부분을 인체에 extracellular 환경의 닮는 다 하지. 사실, 많은 연구가 보여주는 그 3 차원 문화 재현 조직 관련 건축, 기계 및 생 화 확 적인 신호 및 셀 통신, 기존의 2 차원 문화4에서에서 관찰 되었습니다 하지, 5,6,,78.
다세포 집계 또는 회전 타원 체,이 3 차원 문화9,10을 실현 하기 위해 가장 유망한 기술 중 하나입니다. 세포는 세포 외 기질 (ECM)을 분 비 하 고는 회전 타원 체에서 다른 사용자와 상호 작용할 수 있습니다. 비록 다른 바이오 접근11,12,,1314, 셀 스택 등 인체의 공간 복잡도 성공적으로 복제, 이러한 접근만 2 또는 3 분석의 용이성 및 대상 기관에 초점 을된 하나의 기능에 대 한 셀의 종류. 대조적으로, spheroids에 세포 영양분, 산소, paracrine autocrine 신호는 회전 타원 체에 분자의 다른 유형의 공급으로 인해 회전 타원 체에 그들의 위치에 따라 다른 문화 환경에 노출 됩니다. Spheroids의이 기능은 부분적으로 모방 문화 상태 vivo에서 그리고 생체 외에서 스태킹 조직9, 에서 교양 보다 훨씬 더 복잡 하 고, 조직 조직 만들 spheroids 셀 구조 사용 15 , 16.는 회전 타원 체는 세포의 단일 종류의 구성 되어, 경우는 회전 타원 체에 세포의 기능 하지 않습니다는 회전 타원 체에서 이기종 환경으로 인해 균일 한. 지난 몇 년 동안, 회전 타원 체 문화 허용 배아 줄기 세포 (ESCs), 유도 만능 줄기 세포 (Ipsc) 또는 vivo에서 발달 순서를 모방 하 여 미니-17뇌 등 장기를 다시 조직 상주 줄기 세포 간18및 신장19,20.
회전 타원 체 문화 기술에 있는 뜻깊은 진도도 불구 하 고 오랜 동안 큰 spheroids 경작은 여전히 문제가 있다입니다. 3 차원 조직에서 세포를 150-200 µ m의 혈관 내 산소와 영양소21의 한정 된 공급 때문에 필요 합니다. 회전 타원 체 내 혈관 네트워크는 혈액과 조직 비보사이 교환 물질을 정리 하는 데 필요한. 이를 위해, 다른 그룹 공동 대상 셀22,,2324 과 내 피 세포를 배양 하거나 CD31-긍정적인 세포20로 만능 세포의 분화를 유도. 그럼에도 불구 하 고, 보고 된 선박-같은 구조는 회전 타원 체의 중심에 산소와 양분을 공급 하는 루미나의 열린 끝을 있지 않습니다. 3 차원 문화에 있는 세포 영양 혈관 역할을 모방 하는 회전 타원 체에 오픈 및 perfusable 혈관 네트워크를 개발 해야 합니다.
지난 몇 년 동안 microengineering 필드에 일부 연구 그룹 보고 cocultured fibroblast 세포25에서에서 신생 요소를 이용 하 여 미세 장치에 자발적으로 형성 된 perfusable 혈관 네트워크를 구성 하는 방법 ,26. 이러한 혈관 네트워크에 그들의 생체 내에서 유사한 형태학 있고 그들을 회전 타원 체 문화에 혈관 기능을 흉내 낸에 대 한 적당 한 만드는 환경 요인에 의해 개장 될 수 있다. 이 프로토콜의 목적은 미세 플랫폼27을 사용 하 여 회전 타원 체에 perfusable 혈관 네트워크를 구성 하는 것입니다. 미세 장치는 회전 타원 체 통합 될 수 있도록 이전에 보고 된 장치25 에서 수정 됩니다. Microchannels에서 내 피 세포에는 회전 타원 체에서 fibroblast 세포에서 신생 비 여, 신생은 회전 타원 체와 anastomosed microchannels에서 콩나물 하 고 perfusable 혈관 네트워크를 형성 했다. 이 메서드는 다양 한 형광 분자 및 혈관 네트워크와 장기 조직 문화에 대 한 프레임 워크를 제공 하는 회전 타원 체의 내부에 마이크로 미터 규모 구슬 같은 물질의 직접 배달 수 있습니다.
프로토콜
1입니다. 미세 장치 금형의 제작
- 상용 소프트웨어를 사용 하 여 미세 소자의 패턴 디자인 (Clewin5 또는 AutoCAD 2016, 등.). Clewin5의 기능에 대 한 사용자 설명서 (http://manualzz.com/doc/7159150/clewin-user-s-manual)를 참조 하십시오.
참고: 디자인 파일은 보조 파일 1에서 사용할 수 있습니다. - 마이크로 패턴 발생기에 디자인 파일을 전송 하 고 긍정적인 감광 제 코팅 크롬 마스크 도구를 로드 합니다.
- 마이크로 패턴 발생기를 사용 하 여 패턴 영역에서 긍정적인 감광 노출.
- 개발자 (테이블의 재료)를 사용 하 여 긍정적인 감광 제를 개발 하 고 마스크 이온된 (DI) 수와 린스.
- Using 크롬 현상 (자료 테이블), 긍정적인 감광 제 제거 되었습니다 노출된 영역에 크롬 에칭. 마스크 디 물으로 린스.
- 남은 아세톤을 사용 하 여 마스크에 포토 레지스트를 제거 합니다.
참고: 투명도 마스크 Cr 마스크에 대 한 대안을 수 있습니다. - 깨끗 한 실리콘 웨이퍼를 준비 (4 인치, P(100)) 및 스핀 코트 hexamethyldisilazane (HMDS) 30 3000 rpm에서 s.
- Softbake HMDS 120 ° C와 멋진 웨이퍼 상 온에서 5 분에서 5 분.
- Spincoat 10 s 500 rpm 및 30에 대 한 1200 rpm에서 부정적인 감광 제 (자료 테이블) s.
참고: 스핀 코팅 조건 해야 얻을 감광 레이어 웨이퍼에 약 100 µ m의 두께 가진 사진 평판 후. - 95 ° C에서 45 분에 대 한 부정적인 감광 prebake 고 실 온에서 60 분에 대 한 웨이퍼를 냉각 하십시오.
- 각 실험에서 UV 빛의 강도 확인 하 고 250 mW/cm2에서 총 노출 에너지 복용량에 대 한 노출 시간을 계산 합니다. 웨이퍼에 포토 마스크 (단계 1.1-1.6)을 놓고는 자외선에 노출 합니다.
- Postbake 1 분 65 ° C에서와 95 ° c.에 5 분에 대 한 부정적인 감광 제 실 온에서 1 분 동안 진정 웨이퍼를 허용 합니다.
- 첫 번째 개발자 (자료 테이블) 목욕에서 하 고 두 번째 목욕에서 2 분 15 분에 대 한 부정적인 감광 레이어를 개발 합니다. 10에 대 한 첫 번째 소 프로 파 놀 (IPA) 목욕에 웨이퍼를 씻어 s 10에 대 한 두 번째 IPA 목욕에서 s.
- Hardbake 200 ° C와 멋진 웨이퍼 상 온에서 5 분에서 30 분에 대 한 부정적인 감광 제.
- 표면 프로파일러를 사용 하 여 부정적인 포토 레지스트 층의 두께 측정 합니다.
- 진공 펌프에 연결 된 desiccator 웨이퍼 놓고 silane (trichloro(1H,1H,2H,2H-perfluorooctyl)silane)의 200 µ L을 추가. 10 분 동안 펌프 다음 그것을 해제 켜고 4 h desiccator에 웨이퍼를 유지.
2. 제조 단계 및 PDMS 층 어셈블리
- 캐스팅 사전입니다 (PDMS) 폴리머 (PDMS 자료: 경화제 = 10:1 (w/w))와 2 시간에 대 한 진공 챔버에 드.
- 치료 PDMS 공기 통풍 오븐 하룻밤에 80 ° C에서.
- 실리콘 웨이퍼에서 PDMS를 벗기십시오.
- 펀치 구멍 1A-3B (그림 1)와 잘 회전 타원 체 문화. -3B, 고 1 m m 직경은 회전 타원 체에 대 한 잘 펀치 구멍 1A에 대 한 2 m m 직경 펀치를 사용 합니다.
- 반복적으로 집착 하 고 테이프를 벗 하 여 접착 테이프를 가진 PDMS 슬 래 브와 유리 커버 슬립 (24 m m × 24 m m)를 청소 합니다. 다음 치료 40 공기 플라즈마 PDMS 석판 s (40 mW, 50 sccm).
- PDMS 슬 래 브와 커버 슬립 80 ° C 12 h 이상에서 치료 사이의 표면에서 모든 기포를 추방 하기 위해 유리 커버 슬립에 PDMS 슬 래 브 본드.
3. 회전 타원 체 준비
참고:이 연구에서 빨간색 형광 단백질을 표현 하는 인간의 배꼽 정 맥 내 피 세포 (RFP-HUVECs) 고 표현 하는 녹색 형광 단백질 HUVECs (GFP-HUVECs)에 사용 된 회전 타원 체와 microchannels, 각각의 구별 Perfusable 혈관 네트워크의 건설 후 HUVECs. HUVECs의 필요 하지 않은 경우 레이블된 HUVECs 실험을 위해 충분 하다.입니다.
- RFP-HUVECs (3.0 × 105 셀/유리병)과 인간의 폐 섬유 (hLF) (1.0 × 106 셀/유리병) 해 동을 내 피 세포와 섬유 세포에 대 한 매체의 10 mL에 각각 추가 합니다 (자료 테이블). 문화 그들 37 ° C, 5% CO2 에서 100 mm 접시에 2-3 일에 대 한 하위 confluent RFP HUVECs 및 hLFs. 이 준비는 200 ~ spheroids를 얻을 것입니다.
- RFP HUVECs 및 hLFs 0.05% 트립 신-EDTA의 2 mL와 함께 요리에서 분리 하 고 10% (v/v) 태아 둔감 한 혈 청 (FBS) 및 1% (v/v) 페니실린/스 포함 된 DMEM의 4 mL와 트립 신 반응을 중지.
- 3 분 220 x g에서 원심 분리 후 상쾌한, 제거 하 고 마지막 셀 농도 2.5 × 104 와 1.0 × 105 셀/mL, 내 피 중간에 RFP HUVECs와 hLFs를 각각 resuspend.
- 부드럽게 낮은 바인딩 표면 96 잘 접시에 잘 당 셀 정지 (5000 셀 RFP HUVECs에 대 한) 및 hLFs에 대 한 20000 셀의 200 µ L를 추가 합니다.
- 2-4 일 동안 37 ° C, 5% CO2 96 잘 접시를 품 어.
참고: 회전 타원 체 직경 문화 기간과 96 잘 접시에 초기 휴대폰 번호에 따라, 이후 그것은 제어할 수 있습니다 이러한 두 매개 변수에 의해.
4입니다. 세포 미세 장치에 뿌리기
참고: 채널 구멍과 회전 타원 체에 대 한 명명 규칙 잘 그림 1에서 시연 됩니다. 우리 세포 미세 장치에 수확 끝나면 하루 하루 0을 정의 합니다. 실험 일정의 회로도 그림 2에 표시 됩니다.
- 일 − 1) 회전 타원 체 로드
참고: 다음 단계 콜라겐과 섬유 소의 겔 화를 방지 하기 위해 얼음에 수행 되어야 합니다.- 2.80 mg/mL의 최종 농도 대 한 버퍼링 하는 인산 염 (PBS)에 fibrinogen 디졸브.
- 제조 업체의 프로토콜에 따라 중화 콜라겐 (PBS에 3.0 mg/mL)를 준비 합니다.
- Fibrinogen 솔루션 (2.80 mg/mL)의 107.2 µ L, 중화 콜라겐 (3.0 mg/mL), 8.0 µ L 및 3.6 µ L 반응 관에서 당 aprotinin (5 U/mL)의 결합. 이 솔루션은 "마스터 믹스 솔루션" 표시 됩니다 (MS).
참고: 볼륨 충분 한 회전 타원 체를 로드 됩니다. 하나 이상의 회전 타원 체 있는 경우에, spheroids의 수로 각 볼륨을 곱하면 됩니다. - 50 U/mL의 최종 농도 대 한 PBS에 트 롬 빈을 디졸브.
참고: 50 U/mL 트 롬 빈 (20 µ L/튜브)의 Aliquots −30 ° C에 저장 되 고 각 실험 전에 해 동. - Biosafety 캐비닛 내부 spheroids를 포함 하는 96 잘 접시를 놓습니다.
- Biosafety 내각, 얼음 (1 접시) 1 접시와 벤치탑 (2 접시)에 다른 접시 안에 두 35 m m 접시를 준비 합니다. 접시 1 (그림 3a) 물방울 형성의 중심에 피펫으로 99 µ L의 MS입니다.
- (10-100 µ L) 2 노란색의 끝을 트림와 3 피 펫 팁 (1-100 µ L) MS, spheroids의 정밀한 수집 장치에 있는 spheroids를 주입 하 고 장치에 미디어를 주입와 트 롬 빈을 혼합 96 잘 접시에서 spheroids의 컬렉션에 대 한 취소 각각. 팁의 기 공 크기 구멍 1A-채널 1과 3의 3B의 직경 보다 약간 더 큰 또는 채널 2 아늑한에서에서 회전 타원 체에 맞게.
참고:이 하, 달리 언급 하지 않는 한 사용 하 여이 단계에서 잘라내기 피 펫 팁. 그림4에서 컷된 팁의 사진을 이용하실 수 있습니다. - 96 잘 접시에서 매체의 100 µ L로 회전 타원 체를 수집 하 고 접시 2 (그림 3a) 추가.
- 접시 2에서에서 미디어의 최소 볼륨으로 회전 타원 체 선택 합니다. pipettor을 똑바로 잡고는 회전 타원 체 중력에 의해 피펫으로 팁의 아래쪽으로 이동 해야 합니다. 접시 1 (그림 3a)에 MS 물방울의 초승달 모양에 피펫으로 팁으로는 회전 타원 체를 꺼냅니다.
참고: 다음 단계 4.1.10 & 4.1.11 신속 하 게 수행 되어야 한다. - 트 롬 빈 (50 U/mL)의 1 µ L을 추가 하 고 노란색 피펫으로 팁으로 부드럽게 혼합.
- 7 µ L로 설정 하는 피 펫으로는 회전 타원 체를 선택 하 고 천천히 회전 타원 체 잘 (그림 3b) 그것을 넣습니다.
- 섬유 소의 겔 화에 대 한 37 ° C에서 15 분 동안 품 어.
- 미디어와 구멍 1A와 3A 및 채우기 채널 1과 3에서에서 내 피 매체를 천천히 주입 (20 ~ 30 µ L/채널).
- 미디어 장치 (그림 3c)에서 증발을 방지 하기 위해 젖은 Kimwipe와 100 mm 접시에는 장치를 놓습니다.
- 미디어와 섬유 소 사이의 인터페이스에서 거품 제거를 24 h에 대 한 37 ° C, 5% CO2 장치를 놓습니다.
- 로드 하는 데 0) HUVECs
- Thaw GFP-HUVECs (105 셀/유리병 x 3.0)을 내 피 매체의 10 mL를 추가 합니다. 하위 confluency 도달 하 2-3 일 동안 37 ° C, 5% CO2 에서 100 mm 접시에 그들을 문화. 하위 confluent GFP-HUVECs의 1 접시 준비 8-10 장치에 대 한 충분 하다.
- GFP-HUVECs 0.05% 트립 신-EDTA의 2 mL와 함께 요리에서 분리 하 고 10% (v/v) 태아 둔감 한 혈 청 (FBS) 및 1% (v/v) 페니실린/스 포함 된 DMEM의 4 mL와 트립 신 반응을 중지.
- 3 분 220 x g에서 원심 분리 후 106 셀/mL x 5.0에 GFP-HUVECs 내 피 중간에 resuspend.
- 채널 1 구멍 1b HUVECs 세포 현 탁 액 주입 (20 µ L/채널).
- 미세 장치 90 °를 기울기, 측면에 배치와 준수는 HUVECs 채널 2에에서 섬유 소를 30 분 동안 37 ° C에서 품 어.
- 섬유 소에 HUVECs의 첨부 파일을 확인 합니다. 젤와 매체 간의 인터페이스에 연결 된 HUVECs 수가 부족 한 경우는 맥 관 구조 장치 문화 (그림 5)의 몇 일 후 혈관 루트에서 끊을 수 있습니다. 프로토콜에는 관류의 성공률은 > 50%.
- 채널 3 4.2.4-4.2.5 단계를 반복 합니다.
- 7-14 일 동안 37 ° C, 5% CO2 젖은 Kimwipe와 100 mm 접시에 문화 세포.
- 1 일 ~) 미디어 교환
- 채널 1과 3에에서 미디어의 절반 매일 교환 합니다.
5입니다. 핵 얼룩
- PBS에서 4 %paraformaldehyde (PFA)를 준비 합니다.
- 채널 1과 3에서에서 미디어를 제거 하 고 4%의 20 µ L 추가 채널당 PFA. 4%에서 솔루션을 대체 하기 위하여 PFA, 반복 장치에서 솔루션 제거 및 추가 4% PFA 3 번.
- 4 ° C에서 장치를 밤새 품 어.
- 4% 제거 장치 및 세척 PFA PBS와 채널 3 번.
- 세포 핵 얼룩 채널 당 10 µ g/mL 형광 염료 (자료 테이블)의 20 µ L를 추가 합니다. 장치에 솔루션을 교환 하는 장치에서 솔루션을 제거 하 고 10 µ g/mL를 추가 형광 염료 3 번 반복 합니다.
- 24 h에 대 한 4 ° C에서 장치를 저장 합니다.
6. 유체 관류는 회전 타원 체의
- 7 일 동안 37 ° C, 5% CO2 장치에는 지속적인 혈관 통로의 완료에 대 한 배양 후는 회전 타원 체를 준비 합니다.
- 구멍 1A, 1B, 3A, 3B에서 매체를 제거 합니다.
- 10 µ L fluorescein isothiocyanate (FITC) 10 µ M 솔루션의 소개-dextran PBS에 구멍 1A 및 1B에.
- Microbeads 또는 거꾸로 현미경 FITC 염료의 흐름을 모니터링 합니다.
7입니다. 새싹 길이의 정량화
참고:이 연구에서 이미지의 분석의 모든 ImageJ 버전 1.49 소프트웨어 사용 됩니다.
- GFP HUVECs 일 0, 1, 3, 5 및 7의 이미지를 오버랩.
- 하루 1, 3, 5 및 7 일에 촬영 한 이미지에서 같은 위치에서 0의 맥 관 구조 팁의 위치를 뺍니다.
- 루트 위치 (그림 6)에서 혈관 끝의 성장을 결정 합니다. 혈관 팁 및 루트 사이의 거리는이 연구 (그림 7b) 새싹 길이로 정의 했다.
8입니다. 혈관 각도의 정량화
참고: 혈관 각도 각도 혈관 각도, 루트 및 회전 타원 체 (그림 7c)의 중심 구성으로 정의 되었다.
- RFP HUVECs를 포함 하는 coculture 회전 타원 체의 형광 이미지를 binarize 하 고 분석 함수 ImageJ에 의해 "중심" 위치를 측정 한다. 이 연구에서는 측정된 "중심" 위치는 회전 타원 체 (그림 6)의 중심으로 정의 됩니다.
- 7 단계에서 같은 방법으로 혈관 팁 및 뿌리의 위치를 결정 합니다.
- ImageJ 소프트웨어에서 분석 기능을 사용 하 여 혈관 각도 측정 합니다.
결과
그림 1 에서는 설계 및 미세 소자의 사진. 그것은 3 개의 병렬 채널, 어느 채널에서 2는 회전 타원 체 잘 들어 있습니다. HUVEC 문화에 사용 되는 채널 1과 3 이며 채널 2는 회전 타원 체에 대 한. 각 채널 패턴 PDMS 하도록 설계 된 사다리꼴 microposts로 구분 됩니다. microposts에서 채널 1과 3에 표면 장력에 의해 새 채널 2에서에서 하이드로 겔을 방지 하 고 microchannels28회전 타원 체와 HUVECs 사이의 물질 교환 허용.
그림 7a 셀 시드 후 미세 소자의 센터를 보여 줍니다. 밝은 분야 및 형광 이미지 0에 찍은 섬유 소 젤 채널 1, 3에 채널 2 어떤 누설 없는 가득 그리고 HUVECs는 성공적으로 섬유 소 젤의 측 벽에 부착 된 표시. 밝은 분야 이미지는 모두는 로드 회전 타원 체에 초점에는 및 microposts는 회전 타원 체는 장치의 하단에 제대로 정착을 나타내는. 신생 콩나물 1 일과 시간 (그림 7b)는 콩나물의 길이에 관찰 된다. 3 일 긴 새싹은 회전 타원 체에 도달 하 고 7 일에 신생 콩나물의 대부분 회전 타원 체 (회전 타원 체 < 500 µ m 채널 1과 3에서에서 평균 거리)에 도달. 최상의 경우 장치 문화, 4 일 후 혈관 루멘을 통해 관찰할 수 있습니다. 혈관 각 관 끝의 방향과 혈관 루트에서 회전 타원 체의 중심으로 정의 되었다. 그림 7 c 장치 문화에서 7 일 동안 정량된 혈관 각도 보여줍니다. 혈관 각도 감소 신생 콩나물은 회전 타원 체로 마이그레이션 되었는지 나타내는 시간-종속 방식.
그림 8 은 RFP HUVECs 및 GFP HUVECs 병합 있다 혈관 네트워크의 섹션을 나타냅니다. RFP HUVECs 및 HUVECs GFP 전할 화살표 머리, 명확 하 게 1와 3는 회전 타원 체에 RFP HUVECs에 anastomosed 채널에서 신생 콩나물을 표시 하 고 지속적인 혈관 네트워크를 형성 하 여 같이 단일 혈관 루멘 형성. 확인 하려면 혈관 네트워크의 perfusability, FITC dextran 채널 1에 주입 했다. FITC-dextran 채널 1에서에서 생성 된 혈관 네트워크는 회전 타원 체의 내부로 흘러 그리고 마지막으로 채널 3 (그림 9)에 도달. FITC dextran 솔루션의 관류 동안 extravascular 공간으로 혈관 네트워크에서 누설이 있다. 이전 혈관 루멘에 주입 하는 작은 분자 혈관 벽을 통과 하 고 extravascular 지역에 있는 세포와 반응 보였다. 또한, 혈관 네트워크의 침투성 계수는 vivo에서27가까이 보였다. 이러한 결과 통합된 혈관 네트워크는 회전 타원 체에 영양분을 공급 하 고 폐기물의 제품을 제거 수를 의미.
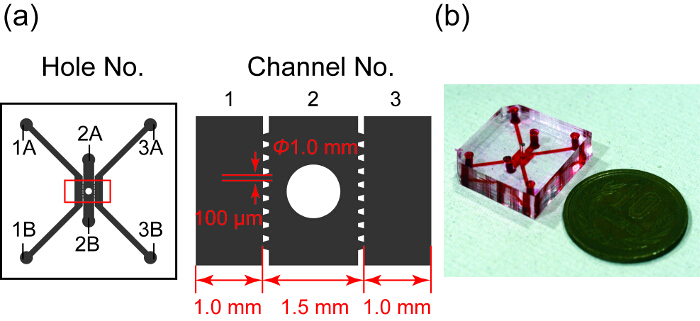
그림 1 : 설계 및 미세 소자의 사진. (a) 미세 장치 디자인의 개요. 회색 지역 사다리꼴 microposts로 구분 하는 3 개의 미세 채널을 나타냅니다. 채널 2는 회전 타원 체 문화에 대 한 잘이 있다. 오른쪽 그림은 왼쪽에 빨간 사각형에 확대 보기를 보여 줍니다. (b) 해당 채널 빨간 잉크 가득 미세 소자의 사진. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.

그림 2 : 실험 시간. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.

그림 3 : 미세 장치에는 회전 타원 체를 로드 하는 방법. (a) 두 개의 별도 요리에 MS와는 회전 타원 체와 미디어의 한 방울을 만들기. 그런 다음, 트 롬 빈으로 MS에는 회전 타원 체를 전송. (는 회전 타원 체의 주입 하는 동안 장치 b) 회로도 단면 보기 젤의 초과 금액 구멍 2A 및 2B 통해 밖으로 흐르고 있다. 그러나,는 회전 타원 체 물리적 감 금 때문에 장치 아래에 유지 됩니다. (c) 인큐베이터에 있을 때 장치의 회로도 장치와 두 개의 35 밀리미터 요리는 Kimwipe에 넣어 했다와 젖은 Kimwipe 100 mm 접시에 배치 되었다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.

그림 4 : 휴대 장치에 뿌리기 위해 피 펫 팁의 사진 컷. 왼쪽된 화이트 팁 구멍 1A, 1B, 3A, 3 C와 섬유 소 젤 (4.1.9, 단계 4.1.13, 4.2.4 4.2.6) 한 방울에 전송 회전 타원 체입니다. 가운데 노란색 팁 96-잘 (4.1.7 단계)에서 회전 타원 체의 컬렉션입니다. 바로 화이트 팁 회전 타원 체 잘 (단계 4.1.11)입니다. 잘라내기 전에 팁 사진에도 표시 됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
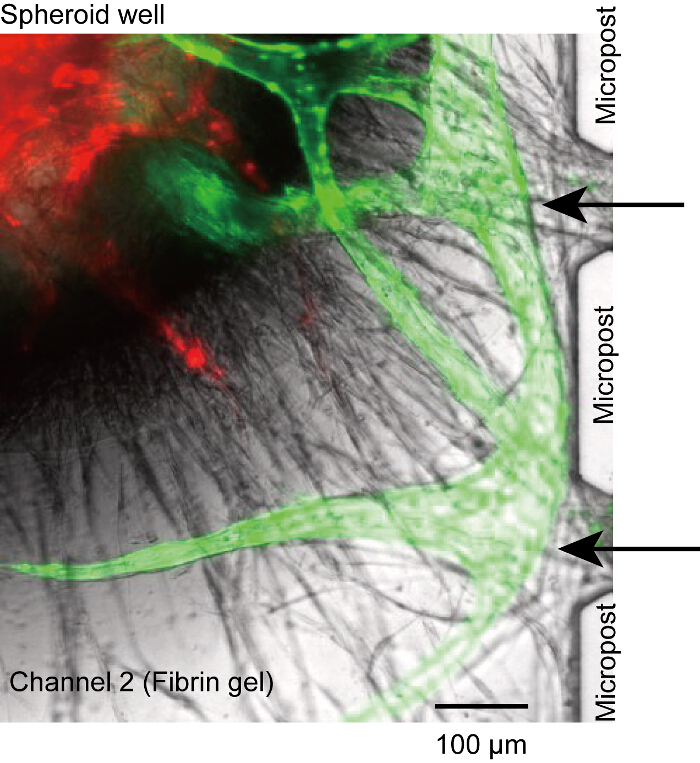
그림 5 : 비 perfusable 맥 관 구조. 신생 콩나물 microchannels에서 microposts 사이의 오프닝에 연결 하지 않았다 고 루멘 microchannels (검은 화살표) 사이의 연결을 잃었다. 그것은 채널 1과 3에서에서 시드 부족 HUVECs에 의해 발생 합니다. 레드: RFP-HUVECs는 회전 타원 체에 그린: microchannels에서 GFP-HUVECs. 셀 장치에 14 일 동안 배양 했다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.

그림 6 : 혈관 루트, 팁 및는 회전 타원 체의 중심의 정의. (a) 혈관 뿌리와 새싹 길이 측정 하는 팁의 위치를 결정 방법. 시간 경과 형광 이미지 정렬 후 형광 이미지 촬영 장치에서 경작 후 몇 일 일 0에 이미지에 의해 뺍니다. 우리는 ImageJ 소프트웨어 빼기 후 콩나물의 길이 측정. (b)는 회전 타원 체의 중심의 정의입니다. RFP HUVECs의 형광 이미지는 binarized 하 고 ImageJ 소프트웨어에 의해 그것의 중심에서 측정. 우리는 회전 타원 체의 중심으로 중심을 정의합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
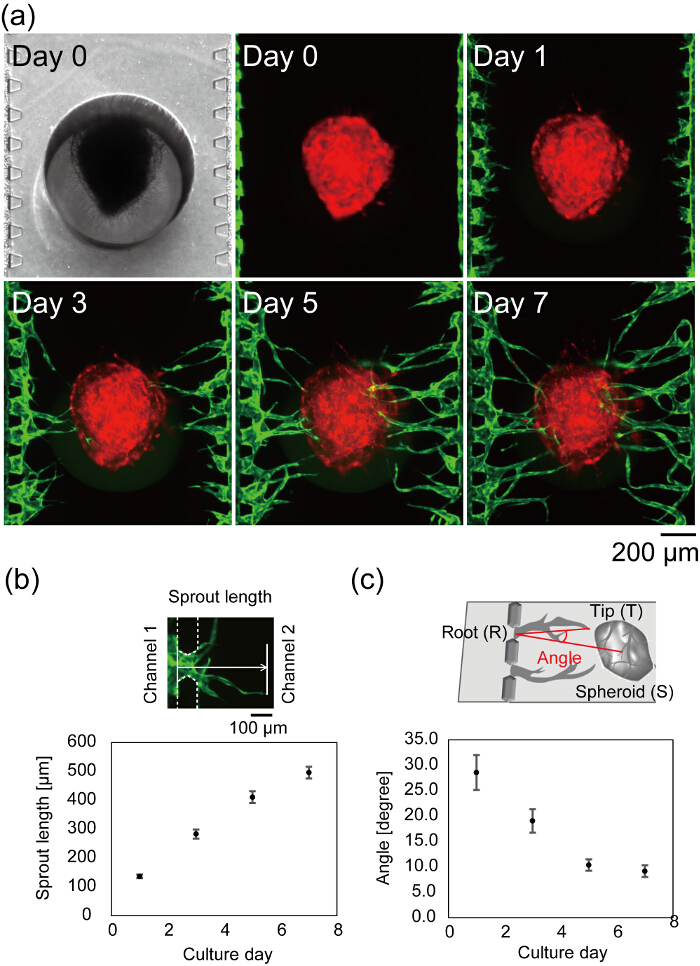
그림 7 : 미세 장치에 혈관 네트워크의 형성. (a) 시간 경과 셀 시드 후 미세 소자의 센터의 이미지. 빨간색: 회전 타원 체, 녹색에서 RFP HUVECs 교양: GFP-HUVECs 채널 1과 3에에서 수확. 새싹 길이 (b)과 혈관 각도 (c)의 정량 분석 (n = 42 콩나물 3 장치, 오차 막대 (남동) 표준 오류가 표시 됩니다). 새싹 길이 날 0 (b, 위쪽) 혈관 끝에 HUVECs의 위치에서 거리로 정의 했다. 각도 (∠TRS)은 혈관 루트 (R), 팁 (T)는 회전 타원 체 (S) (c, 위)의 센터에 의해 정의 되었다. 혈관 루트, 팁 및는 회전 타원 체의 중심의 정의 그림 6 을 참조 하십시오. 이러한 데이터 ImageJ 소프트웨어를 사용 하 여 얻은 했다. 회로도 새싹 길이 혈관 각도의 정의 설명 하는 Nashimoto, 영 외 에서 수정 27. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.

그림 8 : Microchannels에서 회전 타원 체에서 HUVECs에 의해 혈관 루멘의 형성. (a) 형광 영상 장치 문화에서 14 일 후 샘플의 개요. 노란색 사각형 (b)에 표시 된 광학 섹션의 x-y 위치를 나타냅니다. (b) x-y, y-z와 x-z 광학 섹션 생성 된 혈관 네트워크의. 흰색 화살표는 혈관 루멘을 나타냅니다. 빨간색: 회전 타원 체, 녹색에서 RFP HUVECs 교양: GFP-HUVECs 블루 microchannels에서 배양: 세포 핵. (a) (a)는 고정 하기 전에 이미지 때문에 없음 블루 형광을 보여줍니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
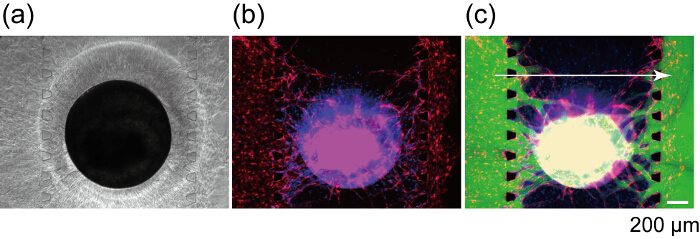
그림 9 : 생성 된 혈관 네트워크를 사용 하 여 회전 타원 체의 관류. 밝은 분야 (a) 및 장치 문화에서 7 일 후 회전 타원 체의 형광 이미지 (b). (FITC dextran 후 동일한 회전 타원 체의 c) 형광 이미지 (70 kDa) 로드. 레드: 회전 타원 체에 채널 1, 3, RFP HUVECs 그린: 블루 FITC dextran: 세포 핵. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
보조 파일 1: 미세 장치 디자인. Dxf 형식에서 파일이입니다. 이 파일을 다운로드 하려면 여기를 클릭 하십시오.
토론
이전 보고서 보기 hLFs angiopoietin 1, angiogenin, hepatocyte 성장 인자, 성장 인자 α, 종양 괴 사 인자와 일부 세포 외 기질 단백질29, 변형 등의 여러 신생 요인의 칵테일을 분 비 30. 이 분석 결과에서 coculture 회전 타원 체, 기술의 한계는 hLFs에서 신생 비에 의존 합니다. 따라서, 그것은 coculture 회전 타원 체와 채널 1과 3에서에서 HUVECs 사이의 거리를 단축 될 수 있다 우물의 바닥에 coculture 회전 타원 체를 설정 하는 안정적인 혈관 형성 중요 합니다. 짧은 거리는 안정적인 혈관 형성에 대 한 유리 섬유 아 세포에서 혈관 길이 내 피 세포 및 섬유 아 세포31, 사이의 거리에 반비례 했다. 그러나, 손상 채널 1 및 3 없이 회전 타원 체 구멍 (직경에서 1 m m)를 열고, 채널 2의 최소 폭 1.5 m m 이었다.
회전 타원 체 우물의 바닥에 침전 한다, 비록 혈관 뿌리 때때로 microposts 또는 microchannels (그림 5)에서 분리 했다. 이 경우에, 아무 시 혈관 루멘 microchannels (채널 1 또는 3)을 통해 도달할 수 있습니다. 비록 우리가 하지 완전히이 문제를 해결할 수, 우리는 문제 HUVECs의 부족 한 수의 섬유 소 젤 (단계 4.2.1-4.2.6)의 표면에는 추정 한다. HUVECs 채널 2의 측 벽을 안정적으로 연결 되었는지 확인 합니다.
우물에는 회전 타원 체의 성공적인 주입, 향해 중요 하다 최적화 단계 4.1.7 micropipette 팁의 내부 및 외부 직경: 1) 내부 직경은 회전 타원 체의 그것 보다 더 큰 되어야 합니다. 2) 외부 직경은 발생 되지 않습니다 젤의 우물의 상단에 주입 하는 동안 팁 젤 주입 후 쉽게 제거 될 수 있도록 잘의 가장자리에 적합 해야 한다. 현재 프로토콜 (잘 회전 타원 체의 φ1 m m), 약 700 µ m에서는 주사 회전 타원 체에 대 한 최대 직경입니다. 잘 직경이이 프로토콜에서 보다 더 큰 설계, 팁 더 큰 내부 직경을 줄일 수 있기 때문에 더 큰 spheroids 주입 수 있습니다. 회전 타원 체 직경 96 잘 접시에 수확 하는 휴대폰 번호를 변경 하 여 쉽게 제어할 수 있습니다.
이 프로토콜 첫째로 소설 미세 플랫폼은 회전 타원 체에 perfusable 관 네트워크 구축을 보여줍니다. HUVECs와 coculture 회전 타원 체18,,2324배 모양의 구조 형성 수 있습니다, 하지만 이들은 perfusable는 루미나의 막다른 때문. 구와 coculture 회전 타원 체, spheroids의 다양 한 종류의 vascularization 일부 다른 대상 셀의 추가 의해 (뼈, 체형과 암, 등), 다양 한 조직에 존재 하는 세포는 예상 될 수 있다, 때문에 어떤에 를 모방 수 있습니다. vivo 기존의 회전 타원 체 문화 보다 더 나은 환경. 기술의 응용 프로그램을 확장 하려면 미래의 일 fibroblast 세포의 추가 없이 spheroids의 vascularization를 포함할 것입니다. 일부 최근 작품 보고서 골 stromal 세포32 와 근육 세포33 미세 장치에 신생을 유도할 수 있다. Fibroblast 세포 대신 stromal 또는 근육 세포를 활용 하 여 조직 미세 장치에 나가도록 수의 수를 증가할 것입니다. 이 프로토콜은 3 차원 문화 분야에서 오랜 기술 조직 vascularization을 위한 기본 플랫폼을 제공 합니다.
공개
저자 들은 아무 경쟁 금융 관심사 선언 합니다.
감사의 말
이 작품은 크레스트 JST (보조금 번호 JPMJCR14W4), 사회 대는 승진의 과학 (JSP) KAKENHI (25600060, 16 K 16386 번호 부여), 문 부 과학성 및 JST, 프로젝트에서 키 평가 기술 개발에 초점을 맞춘 혁신 프로그램의 센터에 의해 지원 되었다 의료 연구 및 개발, 아메드, 미즈호 기초 과학의 승진을 위한 일본 기관. 소는 교토 대학교 나노 기술 허브에 의해 지원 되었다.
자료
| Name | Company | Catalog Number | Comments |
| AutoCAD 2017 | Autodesk | AutoCAD 2017 | |
| A chromium mask coated with AZP 1350. | CLEAN SURFACE TECHNOLOGY | CBL2506Bu-AZP | |
| Micro pattern generator | Heidelberg | uPG101 | |
| MF CD-26 developer | Rohm and haas electronic materials | - | Developer in protocol 1.4 |
| S-Clean | Sasaki Chemical | S-24 | Chromium etchant in protocol 1.5 |
| Aceton | Wako | 012-00343 | |
| Silicon Wafer | Canosis | SiJ-4 | |
| Spin Coater | MIKASA | 1H-D7 | |
| Hexamethyldisilazane (HMDS) | Tokyo Ohka Kogyo | H0089 | |
| SU-8 3050 | MicroChem | - | Negative photoresist in protocol 1.9 |
| UV Exposure | Nanometric Technology Inc | LA310s | |
| SU-8 Developer | MicroChem | Y020100 | Developer for the negative photoresist in protocol 1.13 |
| 2-propanol | Wako | 163-04841 | |
| Surface profiler | Veeco | Veeco Dektak XT-S | |
| (Trichloro (1H, 1H, 2H, 2H-perfluorooctyl) silane | Sigma | 448931 | |
| Polydimethylsiloxane (PDMS) | Dow Corning Toray | 184W/C | |
| Biopsy Punch (1.0mm) | Kai Industries | BP-10F | |
| Biopsy Punch (2.0mm) | Kai Industries | BP-20F | |
| Plasma System | Femto Science | COVANCE | |
| Cover glass | MATSUNAMI GLASS | C024241 | |
| Culture Dishes | Iwaki | 1000-035 | |
| RFP Expressing Human Umbilical Vein Endothelial Cell | Angio Proteomie | cAP-0001RFP | |
| Normal Human Lung Fibroblasts | Lonza | CC-2512 | |
| Endothelial Cell Growth Medium | Lonza | CC-3162 | |
| Fibroblast Growth Media Kits | Lonza | CC-3132 | |
| DMEM | Thermo Fisher Scientific | 11965092 | |
| Fetal Bovine Serum | Thermo Fisher Scientific | 26140079 | |
| Penicillin-Streptomycin Solution | Wako | 168-23191 | |
| 0.05w/v% Trypsin-0.53mmol/l EDTA• 4Na Solution with Phenol Red | Wako | 204-16935 | |
| PBS (Phosphate Buffered Salts) | Takara bio | T900 | |
| 96-well plate | Sumitomo bakelite | 631-21031 | |
| 1000ul Chip | NIPPON Genetics | FG-402 | |
| 200ul Chip | NIPPON Genetics | FG-301 | |
| 10ul Chip | NIPPON Genetics | 37650 | |
| CO2 incubator | Thermo Fisher Scientific | Model 370 | |
| GFP Expressing Human Umbilical Vein Endothelial Cell | Angio Proteomie | cAP-0001GFP | |
| Fibrinogen from bovine plasma | Sigma | F8630 | |
| Aprotinin from bovine lung | Sigma | A6279 | |
| Collagen I | Corning | 354236 | |
| Thrombin from bovine plasma | Sigma | T4648 | |
| Hoechst 33342 | Invitrogen | H21492 | Fluorescent dye to stain nuclei in protocol 5.5 |
| Paraformaldehyde Solution | Wako | 163-25983 | |
| Inverted Fluorescence Microscope | OLYMPUS | IX71 | |
| Degital CCD Camera | OLYMPUS | ORCA-R2 | |
| Confocal Laser Scanning Biological Microscope | OLYMPUS | FV1000 | |
| Inverted Fluorescence Microscope | OLYMPUS | IX-83 | |
| Fluorescein isothiocyanate-dextran | Sigma | FD70S |
참고문헌
- Abbott, A. Cell culture: Biology's new dimension. Nature. 424 (6951), 870-872 (2003).
- Pampaloni, F., Reynaud, E. G., Stelzer, E. H. K. The third dimension bridges the gap between cell culture and live tissue. Nature Reviews Molecular Cell Biology. 8 (10), 839-845 (2007).
- Shamir, E. R., Ewald, A. J. Three-dimensional organotypic culture: experimental models of mammalian biology and disease. Nature Reviews Molecular Cell Biology. 15 (10), 647-664 (2014).
- Abu-Absi, S. F., Friend, J. R., Hansen, L. K., Hu, W. S. Structural polarity and functional bile canaliculi in rat hepatocyte spheroids. Experimental Cell Research. 274 (1), 56-67 (2002).
- Bissell, M. J., Radisky, D. C., Rizki, A., Weaver, V. M., Petersen, O. W. The organizing principle: microenvironmental influences in the normal and malignant breast. Differentiation. 70 (9-10), 537-546 (2002).
- Liu, Y., et al. Novel role for netrins in regulating epithelial behavior during lung branching morphogenesis. Current Biology. 14 (10), 897-905 (2004).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-U147 (2009).
- Torisawa, Y. S., Shiku, H., Kasai, S., Nishizawa, M., Matsue, T. Proliferation assay on a silicon chip applicable for tumors extirpated from mammalians. International Journal of Cancer. 109 (2), 302-308 (2004).
- Fennema, E., Rivron, N., Rouwkema, J., van Blitterswijk, C., de Boer, J. Spheroid culture as a tool for creating 3D complex tissues. Trends in Biotechnology. 31 (2), 108-115 (2013).
- Sutherland, R. M. Cell And Environment Interactions In Tumor Microregions - The Multicell Spheroid Model. Science. 240 (4849), 177-184 (1988).
- Rothbauer, M., Zirath, H., Ertl, P. Recent advances in microfluidic technologies for cell-to-cell interaction studies. Lab on a Chip. , (2017).
- Matsuura, K., Utoh, R., Nagase, K., Okano, T. Cell sheet approach for tissue engineering and regenerative medicine. Journal of Controlled Release. 190, 228-239 (2014).
- Esch, E. W., Bahinski, A., Huh, D. Organs-on-chips at the frontiers of drug discovery. Nature Reviews Drug Discovery. 14 (4), 248-260 (2015).
- Bhatia, S. N., Ingber, D. E. Microfluidic organs-on-chips. Nature Biotechnology. 32 (8), 760-772 (2014).
- Lancaster, M. A., Knoblich, J. A. Organogenesis in a dish: Modeling development and disease using organoid technologies. Science. 345 (6194), (2014).
- Hirschhaeuser, F., et al. Multicellular tumor spheroids: An underestimated tool is catching up again. Journal of Biotechnology. 148 (1), 3-15 (2010).
- Lancaster, M. A., et al. Cerebral organoids model human brain development and microcephaly. Nature. 501 (7467), 373(2013).
- Takebe, T., et al. Vascularized and functional human liver from an iPSC-derived organ bud transplant. Nature. 499 (7459), 481(2013).
- Taguchi, A., et al. Redefining the In Vivo Origin of Metanephric Nephron Progenitors Enables Generation of Complex Kidney Structures from Pluripotent Stem Cells. Cell Stem Cell. 14 (1), 53-67 (2014).
- Takasato, M., et al. Kidney organoids from human iPS cells contain multiple lineages and model human nephrogenesis. Nature. 526 (7574), 564-568 (2015).
- Auger, F. A., Gibot, L., Lacroix, D. Annual Review of Biomedical Engineering. Yarmush, M. L. 15, 177-200 (2013).
- Inamori, M., Mizumoto, H., Kajiwara, T. An Approach for Formation of Vascularized Liver Tissue by Endothelial Cell-Covered Hepatocyte Spheroid Integration. Tissue Engineering Part A. 15 (8), 2029-2037 (2009).
- Kunz-Schughart, L. A., et al. Potential of fibroblasts to regulate the formation of three-dimensional vessel-like structures from endothelial cells in vitro. American Journal of Physiology-Cell Physiology. 290 (5), C1385-C1398 (2006).
- Rouwkema, J., De Boer, J., Van Blitterswijk, C. A. Endothelial cells assemble into a 3-dimensional prevascular network in a bone tissue engineering construct. Tissue Engineering. 12 (9), 2685-2693 (2006).
- Kim, S., Lee, H., Chung, M., Jeon, N. L. Engineering of functional, perfusable 3D microvascular networks on a chip. Lab on a Chip. 13 (8), 1489-1500 (2013).
- Moya, M. L., Hsu, Y. H., Lee, A. P., Hughes, C. C. W., George, S. C. In Vitro Perfused Human Capillary Networks. Tissue Engineering Part C-Methods. 19 (9), 730-737 (2013).
- Nashimoto, Y., et al. Integrating perfusable vascular networks with a three-dimensional tissue in a microfluidic device. Integrative Biology. 9 (6), 506-518 (2017).
- Huang, C. P., et al. Engineering microscale cellular niches for three-dimensional multicellular co-cultures. Lab on a Chip. 9 (12), 1740-1748 (2009).
- Newman, A. C., et al. Analysis of Stromal Cell Secretomes Reveals a Critical Role for Stromal Cell-Derived Hepatocyte Growth Factor and Fibronectin in Angiogenesis. Arteriosclerosis Thrombosis and Vascular Biology. 33 (3), 513(2013).
- Newman, A. C., Nakatsu, M. N., Chou, W., Gershon, P. D., Hughes, C. C. W. The requirement for fibroblasts in angiogenesis: fibroblast-derived matrix proteins are essential for endothelial cell lumen formation. Molecular Biology of the Cell. 22 (20), 3791-3800 (2011).
- Griffith, C. K., et al. Diffusion limits of an in vitro thick prevascularized tissue. Tissue Engineering. 11 (1-2), 257-266 (2005).
- Zheng, Y., et al. Angiogenesis in Liquid Tumors: An In Vitro Assay for Leukemic-Cell-Induced Bone Marrow Angiogenesis. Advanced Healthcare Materials. 5 (9), 1014-1024 (2016).
- Osaki, T., Sivathanu, V., Kamm, R. D. Crosstalk between developing vasculature and optogenetically engineered skeletal muscle improves muscle contraction and angiogenesis. Biomaterials. 156, 65-76 (2018).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
ISSN 2578-2614
Copyright © 2025 MyJoVE Corporation. 판권 소유
당사 웹 사이트에서는 사용자의 경험을 향상시키기 위해 쿠키를 사용합니다.
당사 웹 사이트를 계속 사용하거나 '계속'을 클릭하는 것은 당사 쿠키 수락에 동의하는 것을 의미합니다.