Method Article
Perfusable rete vascolare con un modello di tessuto in un dispositivo microfluidico
In questo articolo
Riepilogo
Il protocollo descrive come progettare una rete vascolare perfusable in uno sferoide. Microambiente circostante di sferoide è inventato per indurre l'angiogenesi e collegare la sferoide a microcanali in un dispositivo microfluidico. Il metodo consente la perfusione della sferoide, che è una tecnica tanto atteso nelle culture tridimensionale.
Abstract
Uno sferoide (un aggregato pluricellulare) è considerato come un buon modello di tessuti viventi nel corpo umano. Nonostante il progresso significativo nelle culture sferoide, una rete vascolare perfusable in sferoidi rimane una sfida critica per coltura a lungo termine necessario per mantenere e sviluppare le loro funzioni, come espressioni della proteina e la morfogenesi. Il protocollo presenta un nuovo metodo per integrare una rete vascolare perfusable all'interno della sferoide in un dispositivo microfluidico. Per indurre una rete vascolare perfusable nella sferoide, germogli angiogenici collegati a microcanali sono stati guidati per la sferoide utilizzando fattori angiogenici da fibroblasti polmonari umane coltivate nella sferoide. I germogli angiogenici raggiunto sferoide, che si fuse con le cellule endoteliali co-coltivate in sferoide e formano una rete vascolare continua. La rete vascolare potrebbe irrorare l'interno della sferoide senza alcuna perdita. La rete vascolare costruita può essere utilizzata ulteriormente come un itinerario per rifornimento delle sostanze nutrienti e la rimozione dei prodotti di scarto, che imita il sangue circolazione in vivo. Il metodo fornisce una nuova piattaforma nella cultura di sferoide verso migliore ricapitolazione dei tessuti viventi.
Introduzione
Passaggio da una cultura (bidimensionale) monostrato a una cultura tridimensionale è motivato dalla necessità di lavorare con modelli di cultura che imitano le funzioni cellulari di vivere tessuti1,2,3. Piatti e rigidi substrati plastici comunemente usati nella coltura delle cellule non assomigliano a maggior parte degli ambienti extracellulare nel corpo umano. Infatti, molti studi dimostrano che cultura tridimensionale ricrea tessuto-specifica architettura, meccanici e biochimici spunti e comunicazione cellula-cellula, che non sono state osservate in coltura convenzionale bidimensionale4, 5,6,7,8.
Un aggregato pluricellulare o sferoide, è una delle tecniche più promettenti per rendersi conto di questa cultura tridimensionale9,10. Le cellule secernono la matrice extracellulare (ECM) e possono interagire con altri utenti la sferoide. Anche se alcuni altri bioingegneria si avvicina13,12,11,14, come cellula di impilamento, replicare con successo la complessità spaziale del corpo umano, questi approcci hanno solo due o tre tipi di cellule per la facilità di analisi e concentrato sulla sola funzione di organi bersaglio. Al contrario, le cellule in sferoidi sono esposte agli ambienti di cultura diversa a seconda delle loro posizioni in sferoide dovuto il rifornimento eterogeneo di nutrienti, ossigeno e paracrini e autocrini segnalando le molecole nella sferoide. Questa caratteristica di sferoidi imita parzialmente in vivo condizione cultura e attiva le cellule in sferoidi a creare tessuti molto più complesso, organizzato struttura in vitro rispetto a quelle coltivate in sovrapposizione tessuto9, 15 , 16. si noti che se uno sferoide è costituito da un solo tipo di cellule, la funzione delle cellule nella sferoide non è uniforme a causa dell'ambiente eterogeneo nella sferoide. Negli ultimi anni, culture sferoide ammessi cellule staminali embrionali (ESC), ha indotte le cellule staminali pluripotenti (iPSCs) o cellule staminali tessuto-residente di imitare in vivo dello sviluppo sequenze e ricreare mini-organi come il cervello17, del fegato del rene e1819,20.
Nonostante i significativi progressi nelle tecniche di cultura sferoide, coltura sferoidi grande per lungo tempo è ancora problematica. In un tessuto tridimensionale, le cellule hanno bisogno di trovarsi all'interno di 150-200 µm di un vaso sanguigno a causa della quantità limitata di ossigeno e sostanze nutritive21. Reti vascolari all'interno della sferoide sono necessari per lo scambio di sostanze tra sangue e tessuti in vivodi ricapitolare. Per raggiungere questo obiettivo, altri gruppi hanno co-colture di cellule endoteliali con destinazione cellule22,23,24 o indotto la differenziazione delle cellule pluripotenti in CD31-positivo cellule20. Tuttavia, le strutture di vaso-come riferite non hanno le estremità aperte del lumina di fornire ossigeno e sostanze nutritive per il centro della sferoide. Per simulare il ruolo vascolare per nutrire le cellule nella cultura tridimensionale, a tempo indeterminato e perfusable rete vascolare deve essere sviluppato nella sferoide.
Durante gli ultimi anni, alcuni gruppi di ricerca nel campo Microtecnica riportati metodi per costruire una rete vascolare perfusable, formata spontaneamente in un dispositivo microfluidico utilizzando fattori angiogenici dalle cellule del fibroblasto cocultured25 ,26. Queste reti vascolari hanno una morfologia simile alle loro controparti in vivo e possono essere ristrutturate da fattori ambientali, che li rende adatti per mimare le funzioni vascolari in una cultura di sferoide. Lo scopo del presente protocollo è quello di costruire una rete vascolare perfusable in uno sferoide utilizzando una piattaforma di microfluidica27. Il dispositivo microfluidico è modificato dal dispositivo precedentemente segnalati25 in modo che può essere incorporato uno sferoide. Indirizzando la secrezione angiogenici dalle cellule del fibroblasto in uno sferoide alle cellule endoteliali a microcanali, angiogenico germogli da microcanali anastomizzato con la sferoide e formato una rete vascolare perfusable. Questo metodo permette una consegna diretta di una vasta gamma di sostanze, quali molecole fluorescenti e perline di micrometro-scala all'interno di uno sferoide, che fornisce il quadro per una coltura a lungo termine del tessuto con reti vascolari.
Protocollo
1. fabbricazione della muffa dispositivo microfluidico
- Progettare il modello del dispositivo microfluidico utilizzando il software disponibile in commercio (Clewin5 o AutoCAD 2016, ecc.). Per la funzione della Clewin5, vedere il manuale dell'utente (http://manualzz.com/doc/7159150/clewin-user-s-manual).
Nota: Il file di disegno è disponibile in 1 File supplementari. - Trasferire il file di disegno in un generatore di pattern micro e caricare lo strumento con una maschera di cromo rivestita con il photoresist positivo.
- Esporre il photoresist positivo nell'area di modello utilizzando un generatore di micro fantasia.
- Sviluppare il photoresist positivo utilizzando lo sviluppatore (Tabella materiali) e sciacquare la maschera con acqua deionizzata (DI).
- Utilizzando il mordenzante di cromo (Tabella materiali), etch il cromo sulla superficie esposta, dove è stato rimosso il photoresist positivo. Sciacquare la maschera con dell'acqua distillata.
- Rimuovere il restante photoresist sulla maschera utilizzando acetone.
Nota: La maschera di trasparenza può essere un'alternativa per la maschera di Cr. - Preparare un wafer di silicio pulito (4 pollici, P(100)) e spin cappotto esametildisilazano (HMDS) a 3.000 giri/min per 30 s.
- Softbake HMDS per 5 min a 120 ° C e raffreddare la cialda per 5 min a temperatura ambiente.
- Spincoat il photoresist negativo (tabella materiali) a 500 giri/min per 10 s e 1.200 rpm per 30 s.
Nota: La condizione di rivestimento di rotazione deve cedere gli strati di photoresist con uno spessore di circa 100 µm sui wafer dopo fotolitografia. - Prebake il photoresist negativo per 45 min a 95 ° C e raffreddare la cialda per 60 min a temperatura ambiente.
- Controllare l'intensità della luce UV in ogni esperimento e calcolare il tempo di esposizione per una dose di energia di esposizione totale a 250 mW/cm2. Posizionare il photomask (passo 1.1-1.6) sul wafer ed esporli alla luce UV.
- Postbake il photoresist negativo per 1 min a 65 ° C e 5 min a 95 ° C. Consentire la cialda raffreddare per 1 min a temperatura ambiente.
- Sviluppare lo strato di photoresist negativo per 15 minuti nel primo bagno sviluppatore (Tabella materiali) e a 2 min nel secondo bagno. Sciacquare la cialda nel primo bagno di isopropanolo (IPA) per 10 s e nel secondo bagno IPA per 10 s.
- Hardbake il photoresist negativo per 30 min a 200 ° C e raffreddare la cialda per 5 min a temperatura ambiente.
- Misurare lo spessore dello strato di photoresist negativo utilizza un profiler di superficie.
- Posizionare la cialda in un essiccatore collegato ad una pompa a vuoto e aggiungere 200 µ l di silano (trichloro(1H,1H,2H,2H-perfluorooctyl)silane). Accendere la pompa per 10 min, poi spegnerlo e mantenere la cialda nell'essiccatore per 4 h.
2. fabbricazione passaggi e l'assemblaggio di strati PDMS
- Eseguire il cast il polidimetilsilossano (PDMS) pre-polimero (PDMS base: agente indurente = 10:1 (w/w)) e degassare in una camera a vuoto per 2 h.
- Cura PDMS a 80° C in un forno di sfiato aria durante la notte.
- Staccare il PDMS da wafer di silicio.
- Perforare i fori 1A - 3B (Figura 1) e la cultura di sferoide bene. Utilizzare un punzone di diametro di 2 mm per fori 1A - 3B e un diametro di 1 mm di perforazione per la sferoide bene.
- Pulire la lastra PDMS e un vetro vetrino coprioggetti (24 × 24 mm) con nastro adesivo, ripetutamente attaccando e staccando il nastro. Trattare quindi la lastra PDMS con plasma ad aria per 40 s (40 mW, 50 sccm).
- Legare la lastra PDMS sul vetro vetrini coprioggetto di espellere eventuali bolle d'aria dalla superficie tra la lastra PDMS e il coprioggetto e la cura a 80 ° C per almeno 12 ore.
3. sferoide preparazione
Nota: Nello studio, proteina fluorescente rossa esprimendo ombelicale umano vena cellule endoteliali (RFP-HUVECs) e che esprimono la proteina fluorescente verde HUVECs (GFP-HUVECs) vengono utilizzati nel sferoide e microcanali, rispettivamente, per distinguere l'origine di HUVECs dopo la costruzione di una rete vascolare perfusable. Se l'origine di HUVECs non è necessario, senza etichetta HUVECs sono sufficienti per l'esperimento.
- Scongelare la RFP-HUVECs (3,0 × 105 cellule/flaconcino) e dei fibroblasti di polmone umano (hLF) (1,0 × 106 cellule/flaconcino) e aggiungerli in 10 mL di medium per le cellule endoteliali e fibroblasti, rispettivamente (Tabella materiali). Cultura li in un piatto di 100 mm a 37 ° C e 5% CO2 per 2-3 giorni per sub-confluente RFP-HUVECs e hLFs. Questa preparazione resa ~ 200 sferoidi.
- Staccare la RFP-HUVECs e hLFs dai piatti con 2 mL di tripsina-EDTA 0,05% e interrompere la reazione di tripsina con 4 mL di DMEM contenente 10% (v/v) siero bovino fetale (FBS) e 1% (v/v) penicillina/streptomicina.
- Dopo centrifugazione a 220 x g per 3 min, rimuovere il supernatante e risospendere il RFP-HUVECs e hLFs nel medio endoteliale e le concentrazioni di cella finale a 2,5 × 104 e 1,0 × 105 cellule/mL, rispettivamente.
- Delicatamente aggiungere 200 µ l della sospensione delle cellule (5.000 cellule per RFP-HUVECs) e 20.000 cellule per hLFs per pozzetto in una piastra a 96 pozzetti con superficie obbligatoria ultra-bassa.
- Incubare la piastra a 96 pozzetti a 37 ° C e 5% CO2 per un periodo di 2-4 giorni.
Nota: Poiché il diametro della sferoide dipende il periodo di coltura e il numero iniziale delle cellule della piastra a 96 pozzetti, può essere controllato da questi due parametri.
4. semina nel dispositivo microfluidico cellulare
Nota: La convenzione di denominazione per i fori, canali e la sferoide bene sono illustrati nella Figura 1. Definiamo il giorno quando è terminata la raccolta delle cellule nel dispositivo microfluidico giorno 0. Schema di sequenze temporali sperimentale è illustrato nella Figura 2.
- Caricamento della sferoide − 1 giorno)
Nota: Il passaggio seguente deve essere eseguito sul ghiaccio per evitare la gelificazione del collagene e della fibrina.- Sciogliere il fibrinogeno in tampone fosfato salino (PBS) per una concentrazione finale di 2,80 mg/mL.
- Preparare collagene neutralizzato (3,0 mg/mL in PBS) secondo il protocollo del produttore.
- Combinare 107,2 µ l di soluzione di fibrinogeno (2,80 mg/mL), 8.0 µ l di collagene neutralizzato (3,0 mg/mL) e 3,6 µ l di aprotinina (5 U/mL) per reazione in un tubo. Questa soluzione è etichettata "master mix soluzione" (MS).
Nota: Il volume è sufficiente per il caricamento di uno sferoide. Se non c'è più di uno sferoide, moltiplicare ogni volume per il numero di sferoidi. - Sciogliere la trombina in PBS per una concentrazione finale di 50 U/mL.
Nota: Le aliquote di trombina di 50 U/mL (20 µ l/tubo) sono conservate a − 30 ° C e vengono scongelate prima di ogni esperimento. - Posizionare la piastra a 96 pozzetti contenenti sferoidi all'interno della cappa di biosicurezza.
- Preparare due piastre di Petri di 35 mm all'interno della cappa di biosicurezza, con un piatto sul ghiaccio (piatto 1) e l'altro piatto sul banco (piatto 2). Dispensare 99 µ l di MS al centro del piatto 1 (Figura 3a) per formare una goccia.
- Tagliare le punte delle 2 gialli (10-100 µ l) e 3 trasparente puntali per pipette (1-100 µ l) per la raccolta di sferoidi dalla piastra 96 pozzetti, miscelazione di trombina con MS, precisa raccolta di sferoidi, iniettando sferoidi nel dispositivo e iniettare il dispositivo multimediale , rispettivamente. Il formato del poro della punta dovrebbe essere leggermente più grande rispetto al diametro dei fori 1A - 3B dei canali 1 e 3, o in forma sferoide bene nel canale 2 per un'aderenza perfetta.
Nota: D'ora in avanti, se non specificato diversamente, utilizzare i puntali per tagliare in questo passaggio. La fotografia del tagliati suggerimenti è disponibile nella Figura 4. - Raccogliere uno sferoide con 100 µ l di terreno dalla piastra a 96 pozzetti e aggiungerlo al piatto 2 (Figura 3a).
- Ritirare la sferoide con un volume minimo di media da piatto 2. Tenendo la pipetta in posizione verticale, la sferoide dovrebbe spostare verso il basso della punta della pipetta per gravità. Espellere la sferoide toccando il puntale sul menisco della goccia MS in piatto 1 (Figura 3a).
Nota: La procedura seguente 4.1.10 & 4.1.11 dovrebbe essere eseguita rapidamente. - Aggiungere 1 µ l della trombina (50 U/mL) e mescolare delicatamente con la punta della pipetta giallo.
- Con la pipetta impostata a 7 µ l, pick up lo sferoide e lentamente posizionarlo nel pozzo della sferoide (Figura 3b).
- Incubare per 15 min a 37 ° C per la gelificazione di fibrina.
- Iniettare lentamente il mezzo endoteliale da canali 1A e 3A e riempimento di fori 1 e 3 con i media (20 ~ 30 µ l/canale).
- Collocare il dispositivo in un piatto di 100 mm con un Kimwipe umido per evitare l'evaporazione dei media dal dispositivo (Figura 3C).
- Posizionare il dispositivo a 37 ° C e 5% di CO2 per 24 h rimuovere le bolle all'interfaccia tra i media e la fibrina.
- Giorno 0) HUVECs caricamento
- Scongelare la GFP-HUVECs (3.0 x 105 cellule/flacone) e aggiungerli a 10 mL di terreno endoteliale. Della loro coltura in un piatto di 100 mm a 37 ° C e 5% di CO2 per 2-3 giorni raggiungere confluency di sub. Un piatto di Sub-confluenti GFP-HUVECs è sufficiente per la preparazione di 8-10 dispositivi.
- Staccare la GFP-HUVECs dai piatti con 2 mL di tripsina-EDTA 0,05% e interrompere la reazione di tripsina con 4 mL di DMEM contenente 10% (v/v) siero bovino fetale (FBS) e 1% (v/v) penicillina/streptomicina.
- Dopo centrifugazione a 220 x g per 3 min, Risospendere la GFP-HUVECs nel medium endoteliale a 5,0 x 106 cellule/mL.
- Iniettare la sospensione cellulare HUVECs nel canale 1 attraverso il foro 1B (20 µ l/canale).
- Inclinare il dispositivo microfluidico 90°, posizionarlo sul lato e incubare a 37 ° C per 30 min garantire che il HUVECs aderiscono alla fibrina nel canale 2.
- Confermare l'attacco di HUVECs sulla fibrina. Quando il numero di HUVECs associata all'interfaccia fra il gel e il mezzo non è sufficiente, il sistema vascolare può essere disconnesso alla radice vascolare dopo pochi giorni della cultura dispositivo (Figura 5). Nel protocollo, il tasso di successo della perfusione è > 50%.
- Ripetere i passaggi 4.2.4 e 4.2.5 per il canale 3.
- Cellule di cultura in un piatto di 100 mm con un Kimwipe umido a 37 ° C e 5% di CO2 per 7-14 giorni.
- Giorno 1 ~) scambio di supporti
- Cambio di metà dei mezzi di comunicazione nei canali 1 e 3 ogni giorno.
5. nuclei colorazione
- Preparare 4% paraformaldeide (PFA) in PBS.
- Rimuovere il supporto dai canali 1 e 3 e aggiungere 20 µ l del 4% PFA per canale. Per sostituire la soluzione in 4% PFA, ripetere la soluzione di rimozione dal dispositivo e l'aggiunta di 4% PFA tre volte.
- Incubare il dispositivo a 4 ° C durante la notte.
- Rimuovere i 4% PFA dal dispositivo e lavare i canali tre volte con PBS.
- Aggiungere 20 µ l di 10 µ g/mL il colorante fluorescente (Tabella materiali) per canale a macchiare i nuclei cellulari. Per scambiare la soluzione nel dispositivo, ripetere la soluzione la rimozione dal dispositivo e l'aggiunta di 10 µ g/mL il colorante fluorescente tre volte.
- Conservare il dispositivo a 4 ° C per 24 h.
6. liquido perfusione di uno sferoide
- Preparare la sferoide dopo la coltura per più di 7 giorni nel dispositivo a 37 ° C e 5% CO2 per il completamento di un continuo percorso vascolare.
- Rimuovere il mezzo da fori 1A, 1B, 3A e 3B.
- Introdurre 10 µ l di soluzione di 10 µM di isotiocianato di fluorescina (FITC)-destrano in PBS in fori 1A e 1B.
- Monitorare il flusso di microsfere o FITC colorante sotto un microscopio invertito.
7. quantificazione della lunghezza del germoglio
Nota: ImageJ ver. 1,49 software viene utilizzato per tutte le analisi dell'immagine in questo studio.
- Si sovrappongono le immagini di GFP-HUVECs giorni 0, 1, 3, 5 e 7.
- Sottrarre la posizione della punta del sistema vascolare del giorno 0 dalla stessa posizione alle immagini scattate nei giorni 1, 3, 5 e 7.
- Determinare la crescita della punta vascolare dalla posizione di radice (Figura 6). La distanza tra la punta vascolare e la radice è stata definita come la lunghezza del germoglio in questo studio (Figura 7b).
8. quantificazione degli angoli vascolari
Nota: Angolo vascolare è stato definito come l'angolo consisteva di angolo vascolare, radice e il centro della sferoide (Figura 7C).
- Binarize le immagini fluorescenti della sferoide coculture contenente RFP-HUVECs e misurare la posizione di "baricentro" dalla funzione di analisi in ImageJ. In questo studio, la posizione misurata "baricentro" è definita come il centro della sferoide (Figura 6).
- Determinare la posizione delle punte vascolare e radici nel stesso modo nel passaggio 7.
- Misurare gli angoli vascolari utilizzando la funzione di analisi software ImageJ.
Risultati
La figura 1 Mostra un design e foto del dispositivo microfluidico. Ha tre canali paralleli, in quale canale 2 contiene la sferoide bene. Canali 1 e 3 sono utilizzati per la coltura HUVEC e canale 2 è per la sferoide. Ogni canale è separato da microposts trapezoidale progettato per modello PDMS. La microposts evitare infiltrazioni nei canali 1 e 3 dalla tensione superficiale di idrogel nel canale 2 e consentire lo scambio di sostanze tra la sferoide e HUVECs a microcanali28.
Figura 7a Mostra il centro di un dispositivo microfluidico dopo la semina delle cellule. Campo luminoso e fluorescente immagini scattate il giorno 0 mostrano che la fibrina gel riempito solo canale 2 senza alcuna perdita nei canali 1 e 3, e HUVECs collegata correttamente al fianco del gel di fibrina. Il campo luminoso immagine è a fuoco sull'entrambi la sferoide caricata e microposts, che indica che la sferoide risolta correttamente nella parte inferiore del dispositivo. I germogli angiogenici sono osservati il giorno 1 e la lunghezza dei germogli aumenta con il tempo (Figura 7b). Il giorno 3, il germoglio più lungo ha raggiunto la sferoide ed il giorno 7, la maggior parte dei germogli angiogenici raggiunto sferoide (distanza media tra i canali 1 e 3 della sferoide < 500 µm). Nel migliore dei casi, dopo 4 giorni nella cultura periferica, flusso attraverso il lumen vascolare può essere osservato. L'angolo di vascolare è stata definita come le indicazioni della punta vascolare e il centro della sferoide dalla radice vascolare. Figura 7 c Mostra l'angolo vascolare quantificato durante 7 giorni nella cultura periferica. Gli angoli vascolari è diminuito in un modo dipendente dal tempo, che indica che i germogli angiogenici migrarono verso la sferoide.
Figura 8 indica la sezione della rete vascolare dove RFP-HUVECs e GFP-HUVECs si sono fuse. RFP-HUVECs e GFP-HUVECs coordinatamente formarono un singolo lume vascolare come mostrato da punte di freccia, che chiaramente indicano angiogenici germogli dai canali 1 e 3 anastomizzato a RFP-HUVECs nella sferoide e formato una rete vascolare continua. Per confermare la perfusability della rete vascolare, FITC-Destrano è stato iniettato nel canale 1. FITC-Destrano nel canale 1 ha fluito nella rete vascolare costruito e gli interni della sferoide ed infine ha raggiunto al canale 3 (Figura 9). Durante la perfusione di soluzione FITC-Destrano, non c'è nessuna perdita dalla rete vascolare nello spazio extravascolare. Precedentemente è stato indicato che piccole molecole iniettati nel lume vascolare passano attraverso la parete vascolare e reagiscono con le cellule nelle regioni extravascular. Inoltre, il coefficiente di permeabilità della rete vascolare è stato indicato per essere vicino a quello in vivo27. Questi risultati implicano che la rete vascolare integrata potrebbe fornire le sostanze nutrienti per la sferoide e rimuovere il prodotto di scarto.
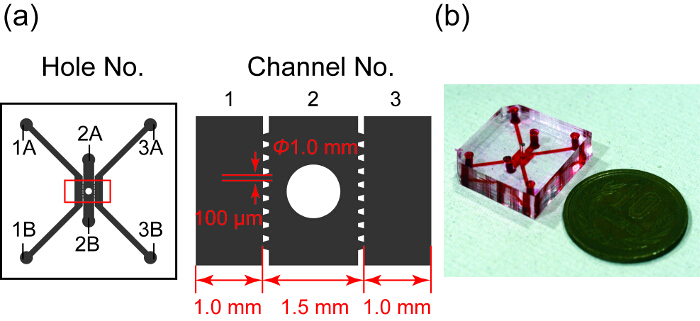
Figura 1 : Design e una fotografia del dispositivo microfluidico. (a) Panoramica della progettazione del dispositivo microfluidico. Area grigia indica tre canali microfluidici separati da microposts trapezoidale. Canale 2 ha un pozzo per una cultura di sferoide. Figura a destra mostra la visualizzazione allargata nel rettangolo rosso a sinistra. (b) fotografia del dispositivo microfluidico cui canali sono pieni di inchiostro rosso. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2 : Tempo sperimentale. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 3 : Metodo per caricare uno sferoide nel dispositivo microfluidico. (a) fare una goccia di MS e media con uno sferoide in due piatti separati. Quindi, trasferire la sferoide in MS con trombina. (b) vista in sezione schematico del dispositivo durante l'iniezione della sferoide. Quantità di gel in eccesso fuoriesce attraverso i fori 2A e 2B. Tuttavia, la sferoide rimane nella parte inferiore del dispositivo a causa del contenimento fisico. (c) schema dei dispositivi quando sono nell'incubatrice. Kimwipe bagnato è stato disposto in un piatto di 100 mm e due piatti di 35mm con il dispositivo sono stati messi sopra il Kimwipe. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 4 : Le fotografie di puntali per tagliare per semina al dispositivo cellulare. La sinistra punta bianca è per fori 1A, 1B, 3A e 3C e trasferimento sferoide per una goccia di gel di fibrina (passaggi 4.1.9, 4.1.13, 4.2.4 e 4.2.6). La punta centrale gialla è per la raccolta di sferoide da 96 pozzetti (passo 4.1.7). La punta in bianco è per il bene di sferoide (passo 4.1.11). Le punte prima di taglio sono indicate anche nella fotografia. Clicca qui per visualizzare una versione più grande di questa figura.
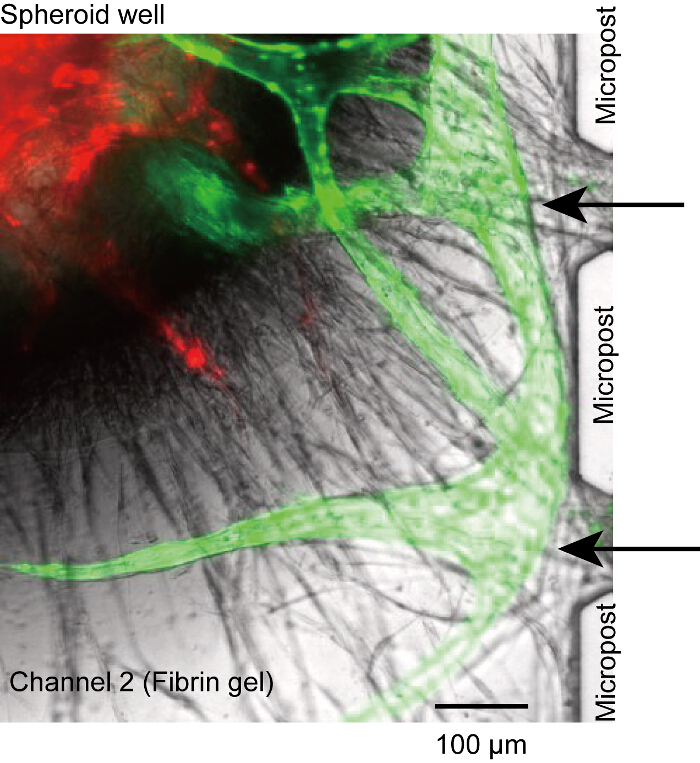
Figura 5 : Sistema vascolare non-perfusable. Germogli di angiogenici da microcanali non collegare all'apertura tra microposts e perso la connessione tra il lume e microcanali (frecce nere). È causata dall'insufficiente HUVECs seminato nei canali 1 e 3. Rosso: RFP-HUVECs in sferoide, verde: GFP-HUVECs da microcanali. Le cellule sono state coltivate nel dispositivo per 14 giorni. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 6 : Definizione della radice vascolare, suggerimento e il centro della sferoide. (a) il metodo per determinare la posizione della radice vascolare e suggerimento per misurare la lunghezza del germoglio. Dopo aver allineato le immagini fluorescenti time-lapse, il fluorescente immagine scattata pochi giorni dopo la coltura nel dispositivo viene sottratto dall'immagine il giorno 0. Abbiamo misurato la lunghezza dei germogli dopo la sottrazione dal software ImageJ. (b) definizione del centro della sferoide. Le immagini fluorescenti di RFP-HUVECs sono binarizzate e misurate al suo baricentro dal software ImageJ. Definiamo il baricentro come centro della sferoide. Clicca qui per visualizzare una versione più grande di questa figura.
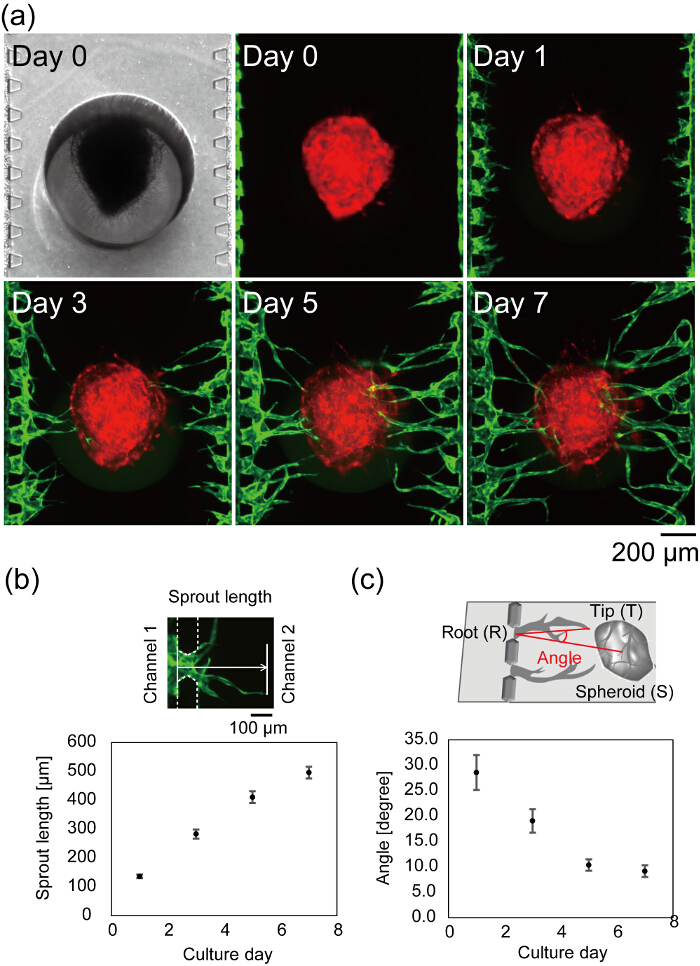
Figura 7 : Formazione di una rete vascolare nel dispositivo microfluidico. (a) time-lapse immagini di un centro di un dispositivo microfluidico dopo la semina delle cellule. Rosso: RFP-HUVECs coltivati in sferoide, verde: GFP-HUVECs raccolte nei canali 1 e 3. Analisi quantitativa del germoglio lunghezza (b) e vascolare angolo (c) (n = 42 germogli in 3 dispositivi, le barre di errore indicano gli errori standard (S.E.)). La lunghezza del germoglio è stata definita come la distanza dalla posizione di HUVECs il giorno 0 alla punta vascolare (b, top). L'angolo (∠TRS) è stata definita la radice vascolare (R), punta (T) e il centro della sferoide (S) (c, alto). Vedere la Figura 6 per la definizione della radice vascolare, suggerimento e il centro della sferoide. Questi dati sono stati ottenuti utilizzando il software ImageJ. Gli schemi che spiega la definizione della lunghezza germoglio e l'angolo vascolare vengono modificati da Nashimoto, Y. et al. 27. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 8 : Formazione del lume vascolare di HUVECs da microcanali e la sferoide. (a) fluorescente immagine di panoramica del campione dopo 14 giorni nella cultura periferica. Rettangolo giallo indica la posizione x-y della sezione ottica illustrata in (b). (b) sezione ottica x-y, y-z e x-z della rete vascolare costruita. Frecce bianche indicano lumen vascolare. Rosso: RFP-HUVECs coltivati in sferoide, verde: GFP-HUVECs coltivato a microcanali, blu: i nuclei cellulari. (a) non mostra alcuna fluorescenza blu perché (a) è l'immagine prima della fissazione. Clicca qui per visualizzare una versione più grande di questa figura.
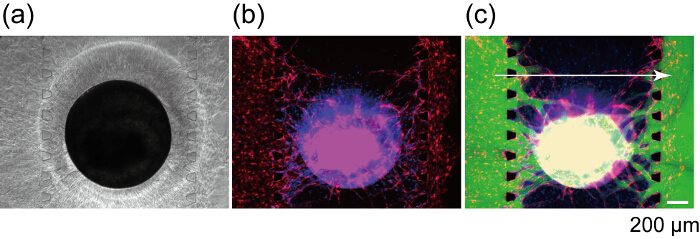
Figura 9 : Perfusione di uno sferoide utilizzando una rete vascolare costruita. Campo luminoso (a) e fluorescente (b) immagini di sferoide dopo 7 giorni nella cultura periferica. (c) immagine fluorescente della stessa sferoide dopo FITC-Destrano (70 kDa) caricamento. Rosso: RFP-HUVECs nei canali 1 e 3 e sferoide verde: FITC-Destrano, blu: i nuclei cellulari. Clicca qui per visualizzare una versione più grande di questa figura.
Complementare File 1: il design del dispositivo microfluidico. Il file è in formato dxf. Per favore clicca qui per scaricare questo file.
Discussione
I rapporti precedenti mostrano che hLFs secernono un cocktail di più fattori angiogenici, quali angiopoietina-1, angiogenina, fattore di crescita dell'epatocita, trasformando la crescita fattore-α, il fattore di necrosi tumorale e alcune proteine di matrice extracellulare29, 30. Questo test si basa sulla secrezione angiogenica da hLFs in uno sferoide coculture, che è la limitazione della tecnica. Pertanto, è fondamentale per una formazione vascolare stabile impostare uno sferoide di coculture nella parte inferiore di un pozzo, in modo che la distanza tra la sferoide coculture e HUVECs nei canali 1 e 3 può essere ridotto. La lunghezza vascolare da fibroblasti era inversamente proporzionale alla distanza tra le cellule endoteliali e fibroblasti31, in modo che la distanza più corta è vantaggiosa per formazione vascolare stabile. Tuttavia, per aprire un buco di sferoide (1 mm di diametro) senza danneggiare canali 1 e 3, la larghezza minima del canale 2 è stato di 1,5 mm.
Sebbene la sferoide si deposita nella parte inferiore del pozzo, radici vascolare occasionalmente sono stati disconnessi dal microposts o microcanali (Figura 5). In questo caso, nessun reagente potrebbe raggiungere il lume vascolare attraverso microcanali (canali 1 o 3). Anche se non potremmo risolvere completamente questo problema, si presume che il problema è a causa del numero insufficiente di HUVECs sulla superficie del gel di fibrina (punto 4.2.1-4.2.6). Assicurarsi che il HUVECs fissare stabilmente la parete laterale del canale 2.
Verso il successo iniezione di uno sferoide nel pozzo, ottimizzare il diametro interno ed esterno delle punte micropipetta nel passaggio 4.1.7 è importante: 1) il diametro interno deve essere maggiore di quella della sferoide. 2) l'esterno dimeter dovrebbe adattarsi al bordo del pozzo, affinché nessuna perdita del gel si verifica nella parte superiore del pozzo durante l'iniezione e la punta può essere facilmente rimosso dopo l'iniezione di gel. Nel presente protocollo (φ1 mm di uno sferoide ben), circa 700 µm è il diametro massimo per la sferoide iniettabile. Se il diametro del pozzo è stato progettato più grande di quello in questo protocollo, sferoidi più grande possono essere iniettati perché la punta può essere tagliata per avere più grandi diametri interni. Diametri di sferoide possono essere controllati facilmente modificando il numero di cellule raccolto nella piastra a 96 pozzetti.
Questo protocollo indica in primo luogo romanzo microfluidici piattaforma per costruire una rete vascolare perfusable in uno sferoide. Anche se il coculture con HUVECs permette la formazione di nave-come le strutture in un sferoide18,23,24, questi non erano perfusable dovuto i vicoli ciechi di lumina. Perché possono essere previsti dei fibroblasti, cellule presenti in versatili tessuti (osso, degli adipociti e cancro, ecc.), mediante l'aggiunta di alcune altre cellule targeting per la sferoide coculture, una vascolarizzazione dei vari tipi di sferoidi, che può imitare la in vivo ambiente meglio la cultura convenzionale sferoide. Per espandere l'applicazione della tecnica, lavoro futuro includerebbe la vascolarizzazione di sferoidi senza l'aggiunta di cellule del fibroblasto. Alcune recenti opere relazione del midollo osseo cellule stromal32 e muscolo cellule33 può indurre angiogenesi nei dispositivi microfluidici. Che utilizzano le cellule stromale o muscolo anziché le celle del fibroblasto aumenterebbe il numero dei tessuti che possono essere vascolarizzato nel dispositivo microfluidico. Questo protocollo fornisce una piattaforma di base per la vascolarizzazione del tessuto, che è una tecnica tanto atteso nel campo delle tre culture dimensionale.
Divulgazioni
L'autore dichiara che non hanno nessun concorrenti interessi finanziari.
Riconoscimenti
Questo lavoro è stato supportato dalla cresta JST (concessione numero JPMJCR14W4), società per la promozione della scienza (JSPS) KAKENHI (codice di autorizzazione 25600060, 16K 16386), il centro di innovazione programma dal MEXT e JST, progetto incentrato su sviluppo di tecnologia chiave valutazione da Agenzia giapponese per la ricerca medica e sviluppo, AMED, Mizuho Fondazione per la promozione delle scienze. Microfabbricazione è stata sostenuta da Kyoto University Nano tecnologia Hub.
Materiali
| Name | Company | Catalog Number | Comments |
| AutoCAD 2017 | Autodesk | AutoCAD 2017 | |
| A chromium mask coated with AZP 1350. | CLEAN SURFACE TECHNOLOGY | CBL2506Bu-AZP | |
| Micro pattern generator | Heidelberg | uPG101 | |
| MF CD-26 developer | Rohm and haas electronic materials | - | Developer in protocol 1.4 |
| S-Clean | Sasaki Chemical | S-24 | Chromium etchant in protocol 1.5 |
| Aceton | Wako | 012-00343 | |
| Silicon Wafer | Canosis | SiJ-4 | |
| Spin Coater | MIKASA | 1H-D7 | |
| Hexamethyldisilazane (HMDS) | Tokyo Ohka Kogyo | H0089 | |
| SU-8 3050 | MicroChem | - | Negative photoresist in protocol 1.9 |
| UV Exposure | Nanometric Technology Inc | LA310s | |
| SU-8 Developer | MicroChem | Y020100 | Developer for the negative photoresist in protocol 1.13 |
| 2-propanol | Wako | 163-04841 | |
| Surface profiler | Veeco | Veeco Dektak XT-S | |
| (Trichloro (1H, 1H, 2H, 2H-perfluorooctyl) silane | Sigma | 448931 | |
| Polydimethylsiloxane (PDMS) | Dow Corning Toray | 184W/C | |
| Biopsy Punch (1.0mm) | Kai Industries | BP-10F | |
| Biopsy Punch (2.0mm) | Kai Industries | BP-20F | |
| Plasma System | Femto Science | COVANCE | |
| Cover glass | MATSUNAMI GLASS | C024241 | |
| Culture Dishes | Iwaki | 1000-035 | |
| RFP Expressing Human Umbilical Vein Endothelial Cell | Angio Proteomie | cAP-0001RFP | |
| Normal Human Lung Fibroblasts | Lonza | CC-2512 | |
| Endothelial Cell Growth Medium | Lonza | CC-3162 | |
| Fibroblast Growth Media Kits | Lonza | CC-3132 | |
| DMEM | Thermo Fisher Scientific | 11965092 | |
| Fetal Bovine Serum | Thermo Fisher Scientific | 26140079 | |
| Penicillin-Streptomycin Solution | Wako | 168-23191 | |
| 0.05w/v% Trypsin-0.53mmol/l EDTA• 4Na Solution with Phenol Red | Wako | 204-16935 | |
| PBS (Phosphate Buffered Salts) | Takara bio | T900 | |
| 96-well plate | Sumitomo bakelite | 631-21031 | |
| 1000ul Chip | NIPPON Genetics | FG-402 | |
| 200ul Chip | NIPPON Genetics | FG-301 | |
| 10ul Chip | NIPPON Genetics | 37650 | |
| CO2 incubator | Thermo Fisher Scientific | Model 370 | |
| GFP Expressing Human Umbilical Vein Endothelial Cell | Angio Proteomie | cAP-0001GFP | |
| Fibrinogen from bovine plasma | Sigma | F8630 | |
| Aprotinin from bovine lung | Sigma | A6279 | |
| Collagen I | Corning | 354236 | |
| Thrombin from bovine plasma | Sigma | T4648 | |
| Hoechst 33342 | Invitrogen | H21492 | Fluorescent dye to stain nuclei in protocol 5.5 |
| Paraformaldehyde Solution | Wako | 163-25983 | |
| Inverted Fluorescence Microscope | OLYMPUS | IX71 | |
| Degital CCD Camera | OLYMPUS | ORCA-R2 | |
| Confocal Laser Scanning Biological Microscope | OLYMPUS | FV1000 | |
| Inverted Fluorescence Microscope | OLYMPUS | IX-83 | |
| Fluorescein isothiocyanate-dextran | Sigma | FD70S |
Riferimenti
- Abbott, A. Cell culture: Biology's new dimension. Nature. 424 (6951), 870-872 (2003).
- Pampaloni, F., Reynaud, E. G., Stelzer, E. H. K. The third dimension bridges the gap between cell culture and live tissue. Nature Reviews Molecular Cell Biology. 8 (10), 839-845 (2007).
- Shamir, E. R., Ewald, A. J. Three-dimensional organotypic culture: experimental models of mammalian biology and disease. Nature Reviews Molecular Cell Biology. 15 (10), 647-664 (2014).
- Abu-Absi, S. F., Friend, J. R., Hansen, L. K., Hu, W. S. Structural polarity and functional bile canaliculi in rat hepatocyte spheroids. Experimental Cell Research. 274 (1), 56-67 (2002).
- Bissell, M. J., Radisky, D. C., Rizki, A., Weaver, V. M., Petersen, O. W. The organizing principle: microenvironmental influences in the normal and malignant breast. Differentiation. 70 (9-10), 537-546 (2002).
- Liu, Y., et al. Novel role for netrins in regulating epithelial behavior during lung branching morphogenesis. Current Biology. 14 (10), 897-905 (2004).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-U147 (2009).
- Torisawa, Y. S., Shiku, H., Kasai, S., Nishizawa, M., Matsue, T. Proliferation assay on a silicon chip applicable for tumors extirpated from mammalians. International Journal of Cancer. 109 (2), 302-308 (2004).
- Fennema, E., Rivron, N., Rouwkema, J., van Blitterswijk, C., de Boer, J. Spheroid culture as a tool for creating 3D complex tissues. Trends in Biotechnology. 31 (2), 108-115 (2013).
- Sutherland, R. M. Cell And Environment Interactions In Tumor Microregions - The Multicell Spheroid Model. Science. 240 (4849), 177-184 (1988).
- Rothbauer, M., Zirath, H., Ertl, P. Recent advances in microfluidic technologies for cell-to-cell interaction studies. Lab on a Chip. , (2017).
- Matsuura, K., Utoh, R., Nagase, K., Okano, T. Cell sheet approach for tissue engineering and regenerative medicine. Journal of Controlled Release. 190, 228-239 (2014).
- Esch, E. W., Bahinski, A., Huh, D. Organs-on-chips at the frontiers of drug discovery. Nature Reviews Drug Discovery. 14 (4), 248-260 (2015).
- Bhatia, S. N., Ingber, D. E. Microfluidic organs-on-chips. Nature Biotechnology. 32 (8), 760-772 (2014).
- Lancaster, M. A., Knoblich, J. A. Organogenesis in a dish: Modeling development and disease using organoid technologies. Science. 345 (6194), (2014).
- Hirschhaeuser, F., et al. Multicellular tumor spheroids: An underestimated tool is catching up again. Journal of Biotechnology. 148 (1), 3-15 (2010).
- Lancaster, M. A., et al. Cerebral organoids model human brain development and microcephaly. Nature. 501 (7467), 373 (2013).
- Takebe, T., et al. Vascularized and functional human liver from an iPSC-derived organ bud transplant. Nature. 499 (7459), 481 (2013).
- Taguchi, A., et al. Redefining the In Vivo Origin of Metanephric Nephron Progenitors Enables Generation of Complex Kidney Structures from Pluripotent Stem Cells. Cell Stem Cell. 14 (1), 53-67 (2014).
- Takasato, M., et al. Kidney organoids from human iPS cells contain multiple lineages and model human nephrogenesis. Nature. 526 (7574), 564-568 (2015).
- Auger, F. A., Gibot, L., Lacroix, D., Yarmush, M. L. . Annual Review of Biomedical Engineering. 15, 177-200 (2013).
- Inamori, M., Mizumoto, H., Kajiwara, T. An Approach for Formation of Vascularized Liver Tissue by Endothelial Cell-Covered Hepatocyte Spheroid Integration. Tissue Engineering Part A. 15 (8), 2029-2037 (2009).
- Kunz-Schughart, L. A., et al. Potential of fibroblasts to regulate the formation of three-dimensional vessel-like structures from endothelial cells in vitro. American Journal of Physiology-Cell Physiology. 290 (5), C1385-C1398 (2006).
- Rouwkema, J., De Boer, J., Van Blitterswijk, C. A. Endothelial cells assemble into a 3-dimensional prevascular network in a bone tissue engineering construct. Tissue Engineering. 12 (9), 2685-2693 (2006).
- Kim, S., Lee, H., Chung, M., Jeon, N. L. Engineering of functional, perfusable 3D microvascular networks on a chip. Lab on a Chip. 13 (8), 1489-1500 (2013).
- Moya, M. L., Hsu, Y. H., Lee, A. P., Hughes, C. C. W., George, S. C. In Vitro Perfused Human Capillary Networks. Tissue Engineering Part C-Methods. 19 (9), 730-737 (2013).
- Nashimoto, Y., et al. Integrating perfusable vascular networks with a three-dimensional tissue in a microfluidic device. Integrative Biology. 9 (6), 506-518 (2017).
- Huang, C. P., et al. Engineering microscale cellular niches for three-dimensional multicellular co-cultures. Lab on a Chip. 9 (12), 1740-1748 (2009).
- Newman, A. C., et al. Analysis of Stromal Cell Secretomes Reveals a Critical Role for Stromal Cell-Derived Hepatocyte Growth Factor and Fibronectin in Angiogenesis. Arteriosclerosis Thrombosis and Vascular Biology. 33 (3), 513 (2013).
- Newman, A. C., Nakatsu, M. N., Chou, W., Gershon, P. D., Hughes, C. C. W. The requirement for fibroblasts in angiogenesis: fibroblast-derived matrix proteins are essential for endothelial cell lumen formation. Molecular Biology of the Cell. 22 (20), 3791-3800 (2011).
- Griffith, C. K., et al. Diffusion limits of an in vitro thick prevascularized tissue. Tissue Engineering. 11 (1-2), 257-266 (2005).
- Zheng, Y., et al. Angiogenesis in Liquid Tumors: An In Vitro Assay for Leukemic-Cell-Induced Bone Marrow Angiogenesis. Advanced Healthcare Materials. 5 (9), 1014-1024 (2016).
- Osaki, T., Sivathanu, V., Kamm, R. D. Crosstalk between developing vasculature and optogenetically engineered skeletal muscle improves muscle contraction and angiogenesis. Biomaterials. 156, 65-76 (2018).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Tutti i diritti riservati
Utilizziamo i cookies per migliorare la tua esperienza sul nostro sito web.
Continuando a utilizzare il nostro sito web o cliccando “Continua”, accetti l'utilizzo dei cookies.
