Method Article
マイクロ流体デバイスにおける組織モデルと perfusable の血管ネットワーク
要約
プロトコルでは、回転楕円体の perfusable 管ネットワークを設計する方法について説明します。血管新生を誘導するマイクロ流体デバイスのマイクロに回転楕円体を接続する回転楕円体の周囲の微小環境が工夫されています。メソッドでは、三次元培養での待望の技術は、回転楕円体の血流をことができます。
要約
回転楕円体 (多細胞集合体) は、人間の体内で生体組織の良いモデルとみなされます。回転楕円体の文化の重要な前進、にもかかわらずスフェロイドの perfusable 管のネットワークを維持し、タンパク質の発現、形態形成など、彼らの機能を開発するために必要な長期的な文化のための重要な課題のまま。プロトコルは、マイクロ流体デバイスの回転楕円体内 perfusable 血管網を統合する新しい手法を提案します。回転楕円体の perfusable 管ネットワークを誘導して、マイクロ チャネルに接続されている血管新生もやしは、回転楕円体の培養ひと肺線維芽細胞から血管新生因子を用いた回転楕円体に導かれました。血管新生もやしは、回転楕円体で共培養血管内皮細胞と結合、回転楕円体に達し、連続的な血管網を形成します。血管のネットワークをヌケモレなく回転楕円体の内部灌流でした。構築された血管網は、栄養素の供給と血液循環の生体を模倣した廃棄物の除去のためルートとしてさらに使用可能性があります。メソッドは、生体組織のよい反復に向かって回転楕円体文化の新しいプラットフォームを提供します。
概要
生活の細胞の機能を模倣文化モデルを使用する必要性によって動機づけられている三次元培養単分子膜 (二次元) 文化からシフト組織1,2,3。細胞培養でよく使用されるフラットとハードなプラスチック基板の上には、人間の体内で細胞外の環境のほとんどは似ていません。実際には、多くの研究を示す従来の二次元文化4でみられていない、三次元培養再作成組織固有のアーキテクチャに、機械的、生化学的手がかりと細胞間コミュニケーション 5,6,7,8。
多細胞集合体または回転楕円体は、この三次元培養9,10を実現するために最も有望な技術の一つです。細胞は、細胞外マトリックス (ECM) を分泌し、回転楕円体で他のユーザーと対話できます。ただし、いくつかの他の工学アプローチ11,12,13,14, 細胞が積層など人間の体の空間的複雑さを正常にレプリケートされる、これらのアプローチがある唯一の 2 つまたは 3 つ細胞分析の使いやすさと標的臓器の 1 つだけに焦点を当てた関数の種類。対照的に、回転楕円体の細胞は、栄養素や酸素、パラクリンやオートクリン シグナル分子回転楕円体での異種の供給のために回転楕円体のそれぞれの立場によって異なる文化環境にさらされています。回転楕円体のこの機能を部分的に模倣体内培養条件と有効にするはるかに複雑な整頓されていた組織を作成する回転楕円体のセル構造の in vitro積層組織9,の培養に比べて15,16. 場合は回転楕円体は、単一のセルの種類から成り、回転楕円体の細胞の機能が回転楕円体の異機種混在環境のため均一ではないことに注意してください。過去数年間でスフェロイド培養できる体内発生シーケンスを模倣し、17脳などミニ器官を再作成する住民組織幹細胞や胚性幹細胞 (Esc)、誘導多能性幹細胞 (Ips)肝臓腎臓と1819,20。
スフェロイド培養技術の大幅な進歩にもかかわらず長い間大きな回転楕円体の培養はまだ問題です。三次元組織の細胞は酸素と栄養素の21の限られた供給のため 150-200 μ m の血管内に存在する必要があります。回転楕円体の中で血管のネットワークは、血液と組織の生体間交換物質を要約する必要があります。そのためには、他のグループは共培養血管内皮細胞のターゲット細胞22,23,24か CD31 陽性細胞20多能性細胞の分化を誘導しました。それにもかかわらず、報告された血管のような構造は、回転楕円体の中心に酸素と栄養を供給するルミナの開いた端部を必要はありません。三次元培養細胞を養う血管の役割を模倣するには、オープン エンドと perfusable の血管網は、回転楕円体で開発されなければなりません。
過去数年間の間にマイクロ エンジニア リングの分野でいくつかの研究グループ報告遊走性に与える線維芽細胞25 から血管新生因子を用いたマイクロ流体デバイスで自発的に形作った perfusable 血管網を構築する方法 ,26。これらの血管のネットワークは、体内の対応する類似形態し、適してスフェロイド培養血管機能を模倣するための環境要因によって改造することができます。このプロトコルの目的は、マイクロ流体プラットフォーム27を使用して回転楕円体で perfusable 血管網を構築することです。回転楕円体に組み込むことができるように、マイクロ流体デバイスが以前に報告されたデバイス25から変更されます。マイクロ流路における内皮細胞と回転楕円体の線維芽細胞から血管新生の分泌を誘導血管新生は回転楕円体で吻合マイクロからもやしし、perfusable 血管網を形成します。このメソッドは、蛍光分子と血管網と長期培養のためのフレームワークを提供します回転楕円体の内部にマイクロ ビーズなどの物質の広い範囲の直接配信できます。
プロトコル
1. マイクロ流体デバイス金型の作製
- 市販のソフトウェアを使用してマイクロ流体デバイスの模様 (Clewin5 または AutoCAD 2016など。)。Clewin5 の関数、ユーザー マニュアル (http://manualzz.com/doc/7159150/clewin-user-s-manual) を参照してください。
注: デザイン ファイルはファイル 1 の補足で利用できます。 - 設計ファイルをマイクロ パターン発生器に転送し、ポジ型フォトレジストで被覆されたクロム マスク ツールを読み込みます。
- マイクロ パターン発生器を使用してパターン領域のポジ型フォトレジストを公開します。
- ポジ型フォトレジストの開発 (材料のテーブル) を使用して開発し、純水 (DI) を使用してマスクをすすいでください。
- クロム エッチング液 (資材表) を使用すると、ポジ型フォトレジストが削除された露出部のクロムをエッチングします。純水を使用してマスクをすすいでください。
- アセトンを使用してマスク上のフォトレジストの残りを削除します。
注: 透明度マスク Cr マスクのための代わりをすることができます。 - きれいなシリコンウェーハを準備 (4 インチ、P(100))、スピン コート ヘキサメチルジシラザン (HMDS) で 3,000 rpm 30 s。
- ソフトベーク HMDS 120 ° C とクールなウェハ常温で 5 分間で 5 分間。
- スピンコートで 10 秒の 500 rpm と 30 での 1,200 rpm ネガ型フォトレジスト (材料表) s。
注: スピン コーティング条件は、露光後ウェーハ上約 100 μ m の厚さでレジスト層を得られるです。 - 95 ° C の 45 分のネガ型フォトレジストを prebake し、室温で 60 分のウエハーをクールします。
- 各実験の UV 光の強度を確認し、250 mW/cm2での総線量をエネルギーの露出時間を計算します。ウェハにフォトマスク (ステップ 1.1 1.6) を置き、UV ライトにそれらを公開します。
- Postbake 1 分 65 ° C で、95 ° C で 5 分のネガ型フォトレジスト室温で 1 分間冷却してウェーハを許可します。
- 15 分最初の開発者 (材料表) お風呂で、2 番目のバスで 2 分のネガ型フォトレジスト層を開発します。10 の最初のイソプロパノール (IPA) お風呂でウェハをリンス s と 10 の 2 番目の IPA お風呂で s。
- ハードベーク 200 ° C とクールなウェハ常温 5 分で 30 分のネガ型フォトレジストです。
- 表面プロファイラーを使用してネガ型フォトレジスト層の厚さを測定します。
- 真空ポンプに接続されたデシケータでウェハを配置し、シラン (trichloro(1H,1H,2H,2H-perfluorooctyl)silane) 200 μ L を追加します。10 分間、ポンプをオンにそれをオフにし、4 h 用デシケータでウェハを保持します。
2. 作製手順と PDMS レイヤーのアセンブリ
- ポリジメチルシロキサン (PDMS) 前ポリマーをキャスト (PDMS ベース: 硬化剤 = 10:1 (w/w)) 2 h の真空チャンバー内で脱ガスとします。
- 治療 PDMS エアベント オーブン一晩で 80 ° c。
- シリコンウエハーから PDMS をはがします。
- パンチ穴 1A - 3B (図 1) とよく回転楕円体文化。穴 1 a の直径 2 mm のパンチを使用して - 3 b と 1 mm 径パンチも回転楕円体のため。
- PDMS スラブとガラス製カバー スリップ (24 mm × 24 mm) を粘着テープで繰り返しテープ剥がして付着してきれい。40 空気プラズマと PDMS スラブを扱う s (40 mW、50 sccm)。
- PDMS スラブとカバー スリップ 80 ° C 少なくとも 12 時間で治療の面から空気の泡を追放するガラス製カバー スリップの上に PDMS スラブを結合します。
3. 回転楕円体の準備
注: 研究では, ひと臍帯を表現する赤色蛍光タンパク質静脈血管内皮細胞 (RFP Huvec) と緑の蛍光蛋白質の表現比較 (GFP Huvec) は、起源を区別するためにそれぞれ、回転楕円体とマイクロ流路で使用されます。Perfusable 血管網の構造の後の比較。比較の起源が必要ない場合ラベル比較実験のため十分では。
- RFP Huvec (3.0 × 105セル/バイアル) およびひと肺線維芽細胞 (hLF) (1.0 × 106セル/バイアル) を解凍し、血管内皮細胞、線維芽細胞用培地 10 mL にそれぞれ追加 (材料表)。文化それら 37 ° C、5% CO2で 100 mm ディッシュで 2 〜 3 日のサブ合流 RFP Huvec hLFs の。この準備 〜 200 回転楕円体が得られます。
- RFP Huvec と 0.05% トリプシン-EDTA の 2 mL で皿から hLFs をデタッチして 10% (v/v) ウシ胎児血清 (FBS) および 1% (v/v) ペニシリン/ストレプトマイシンを含む DMEM の 4 mL のトリプシン反応を停止します。
- 3 分の 220 × g で遠心分離後、上清を除去し、再懸濁します RFP Huvec と hLFs 2.5 × 104で 1.0 × 105セル/mL、最終的な細胞濃度に内皮細胞培地でそれぞれ。
- 優しく超低結合表面の 96 ウェル プレートで、細胞懸濁液 (RFP Huvec の 5,000 セル) と 20,000 セル hLFs のウェルあたりの 200 μ L を追加します。
- 2-4 日間の期間は 37 ° C および 5% の CO2の 96 ウェル プレートを孵化させなさい。
注: 回転楕円体の直径は、培養期間と 96 ウェル プレートで初期細胞数に依存、ので、これらの 2 つのパラメーターによってそれ制御できます。
4 マイクロ流体デバイスにおける播種細胞
注: 穴、チャンネル、回転楕円体の命名規則も図 1に示すが。我々 は細胞のマイクロ流体デバイスに収穫が完了したときの日として 0 日を定義します。図 2に実験のタイムラインの概略図を示します。
- 日 − 1) 回転楕円体荷重
注: 次の手順は、コラーゲンとフィブリンのゲル化を防ぐために氷の上実行する必要があります。- リン酸緩衝生理食塩水 (PBS) 2.80 mg/mL の最終的な集中にフィブリノゲンを分解します。
- 製造元のプロトコルに従って中和コラーゲン (PBS の 3.0 mg/mL) を準備します。
- フィブリノゲン液 (2.80 mg/mL) の 107.2 μ L、中和コラーゲン (3.0 mg/mL)、8.0 μ L と 3.6 μ L 反応管内ごとアプロチニン (5 U/mL) を結合します。このソリューションが「マスター ミックス ソリューション」をラベル (MS)。
注: ボリュームは十分な 1 つの回転楕円体をロードするためです。1 つ以上の回転楕円体、回転楕円体の数によって各ボリュームを乗算します。 - 最終濃度 50 U/mL の PBS でトロンビンを溶解します。
注: 50 U/mL トロンビン (20 μ L/チューブ) の因数は +30 ° C で格納され、各実験の前に解凍されます。 - バイオ セーフティ キャビネットの内部回転楕円体を含む 96 ウェル プレートを配置します。
- 2 35 mm シャーレ バイオ セーフティ キャビネット、氷 (1 皿) の上の 1 つの皿とベンチトップ (皿 2) 他の皿の中を準備します。ピペット 99年 μ L の MS 料理 1 (図 3 a) 液滴を形成するためのセンターです。
- 2 黄色のヒント (10-100 μ L) をトリムし、3 MS、回転楕円体の正確なコレクション、デバイスに、回転楕円体を注入して、デバイスにメディアを挿入とトロンビンを混合、96 ウェル プレートから回転楕円体のコレクションのピペット チップ (1-100 μ L) をクリア、それぞれ。先端の気孔のサイズは穴 1A - チャンネル 1 と 3 の 3 b の直径よりわずかに大きくする必要があります。 または、チャネル 2 にぴったりの回転楕円体に合います。
注: 以下、特に断らない限り、ピペットのヒントを使用ここではカットします。カットのヒントの写真は図 4で利用可能です。 - 96 ウェル プレートから媒体の 100 μ L で回転楕円体を収集し、皿 2 (図 3 a) に追加します。
- 皿 2 からメディアの最低量と回転楕円体をピックアップします。直立した、pipettor を保持している間は重力によってピペット先端部の下部に向かって回転楕円体を移動してください。料理 1 (図 3 a) における MS 液滴のメニスカスにピペット先端部に触れることによって回転楕円体を取り出します。
注: 次の手順 4.1.10 & 4.1.11 を迅速に行う必要があります。 - トロンビン (50 U/mL) の 1 μ L を追加、黄色ピペット先端で軽く混ぜます。
- 設定 7 μ L ピペット、回転楕円体を拾うし、ゆっくり回転楕円体よく (図 3 b) に入れます。
- フィブリンのゲル化の 37 ° C で 15 分間インキュベートします。
- ゆっくりとメディアで穴 1 a と 3 a と塗りつぶしのチャンネル 1 と 3 から内皮細胞培地を注入 (20 〜 30 μ L/チャネル)。
- メディア デバイス (図 3 c) からの蒸発を防ぐために濡れたキムワイプで 100 mm ディッシュにデバイスを配置します。
- 24 h フィブリンとメディア間のインターフェイスで気泡を除去するための 37 ° C および 5% の CO2にデバイスを配置します。
- ロード 0 日) 比較
- GFP Huvec (105セル/バイアル × 3.0) を解凍し、内皮細胞培地 10 mL にそれらを追加します。サブ confluency に到達する 2 〜 3 日の CO2を 37 ° C、5% で 100 mm ディッシュにそれらの文化.サブ合流 GFP Huvec の一皿は、8-10 デバイスを準備するために十分です。
- 0.05% トリプシン-EDTA の 2 mL で皿から GFP Huvec をデタッチして 10% (v/v) ウシ胎児血清 (FBS) および 1% (v/v) ペニシリン/ストレプトマイシンを含む DMEM の 4 mL のトリプシン反応を停止します。
- 3 分の 220 × g で遠心分離後に、、106セル/mL x 5.0 で内皮細胞培地で GFP Huvec を再懸濁します。
- Huvec 細胞懸濁液を注入穴 1 b を経由するチャネル 1 (20 μ L/チャネル)。
- マイクロ流体デバイス 90 ° のチルト、側に配置、比較のチャネル 2 のフィブリンに従うように 30 分の 37 ° C で孵化させなさい。
- フィブリンに関する比較の添付ファイルを確認します。ゲルと媒体間のインターフェイスで接続されている比較の数が不足しているとき、デバイスの文化 (図 5) の数日後、血管を血管ルートで切断できます。灌流の成功率は、プロトコルでは、> 50%。
- チャネル 3 の 4.2.4 および 4.2.5 章の手順を繰り返します。
- 7-14 日間の CO2を 37 ° C、5% で湿らせたキムワイプを 100 mm ディッシュに培養細胞。
- 日 1 ~) メディア交換
- チャンネル 1 と 3 でメディアの半分は毎日交換します。
5. 核染色
- PBS で 4% パラホルムアルデヒド (PFA) を準備します。
- チャンネル 1 と 3 からメディアを削除し、4% の 20 μ L を追加チャンネルあたり PFA。4% でソリューションを置き換えるに PFA、繰り返しデバイスからソリューションを削除および追加 4% PFA 3 回します。
- 4 ° C でデバイスを一晩インキュベートします。
- 4% を削除デバイスと洗浄から PFA PBS でチャンネル 3 回します。
- 細胞核を染色するチャネルあたり 10 μ G/ml 蛍光染料 (材料表) の 20 μ L を追加します。デバイスでソリューションを交換するには、デバイスからソリューションを削除し、10 μ g/mL を追加蛍光染料 3 回繰り返します。
- 24 h の 4 ° C でデバイスを保存します。
6 回転楕円体の液灌流
- 連続血管経路の完了を 37 ° C、5% CO2でデバイスに 7 日以上の培養後回転楕円体を準備します。
- 穴 1 a、1 b、3 a、3 b からメディアを削除します。
- かに (FITC) の 10 μ M 溶液 10 μ L を紹介-穴 1A と 1B に PBS のデキストラン。
- ビーズや FITC 色素倒立顕微鏡下での流れを監視します。
7. 芽長の定量化
注: ImageJ 版 1.49 ソフトウェアは、すべての研究ではこのイメージの分析に使用されます。
- GFP Huvec 日 0、1、3、5、7 のイメージが重なります。
- 1、3、5、7 の日に撮影した画像を同じ位置から 0 日の血管先端の位置を減算します。
- ルートの位置 (図 6) から血管の先端の成長を決定します。血管の先端とルート間の距離は、この研究では (図 7 b) スプラウト長さとして定義されました。
8. 血管角度の定量化
注: 血管の角度は、角度によって血管角度、ルートおよび回転楕円体 (図 7 c) の中心から成っていたと定義しました。
- RFP Huvec を含む共回転楕円体の蛍光画像を 2 値化するし、ImageJ の解析関数で「重心」の位置を測定します。本研究では測定の「重心」の位置は、回転楕円体 (図 6) の中心として定義されます。
- 手順 7 で同じ方法で、血管のヒントを根の位置を決定します。
- ImageJ ソフトウェアで分析関数を使用して血管の角度を測定します。
結果
図 1は、設計とマイクロ流体デバイスの写真を示しています。3 つ並列チャンネル、どのチャネルで 2 が含まれている回転楕円体もいます。チャンネル 1 と 3 は螢光文化のため使用され、チャネル 2 は、回転楕円体。各チャンネルは、PDMS のパターンに設計された台形 microposts で区切られます。Microposts チャネル 2 のハイドロゲルの表面張力によってチャンネル 1 と 3 に漏れを防ぐし、マイクロ28回転楕円体と比較との間の物質の交換を許可します。
図 7 aは、細胞播種後マイクロ流体デバイスの中心を示しています。明視野/蛍光画像の 0 日目に撮影したフィブリン ゲルは、チャンネル 1、3 に、ヌケモレなくチャンネル 2 のみを充填し、比較はフィブリン ゲルの側壁に正常にアタッチを表示します。明視野像は、両方読み込まれている回転楕円体に焦点を当てると microposts、回転楕円体が正しく、デバイスの下部に解決を示します。血管新生もやしは、1 日と時間 (図 7 b) ともやしが増加の長さによって観察されます。3 日目、最長のスプラウトに達する回転楕円体と 7 日目、血管新生もやしのほとんどに達した回転楕円体 (楕円体 < 500 μ m までのチャンネル 1 と 3 から平均距離)。最良のケースでは、デバイスの文化で 4 日後に、血管の内腔を通過が観察できます。血管の角度は、血管の先端の方向と血管ルートから回転楕円体の中心として定義されました。図 7 cは、デバイス文化での 7 日間限定の血管の角度を示します。血管の角度は回転楕円体に向かって血管新生もやしが移行されたことを示す、時間依存的に減少しました。
図 8は、RFP Huvec と GFP Huvec を差し込まれた血管ネットワークのセクションを示します。RFP Huvec と GFP Huvec 協調矢印ヘッドを明確にチャンネル 1 と回転楕円体の RFP Huvec に吻合 3 から血管新生もやしを示すし、連続的な血管網を形成して示すように、単一の血管内腔を形成しました。血管ネットワークの perfusability を確認するには、FITC デキストランは、チャンネル 1 に注入されました。チャネル 1 の FITC デキストラン構築血管網と回転楕円体の内部に流入、最終的にチャネル 3 (図 9) に達した。FITC デキストラン液の灌血管外腔血管網からの漏れはありません。血管の内腔に挿入される小さな分子が血管壁を通過し、管外の領域の細胞と反応する以前示されました。さらに、血管網の透水係数は、その生体内で27に近いことを示されました。これらの結果は、統合された血管網が回転楕円体に栄養素を供給でき、廃棄物の製品を削除を意味します。
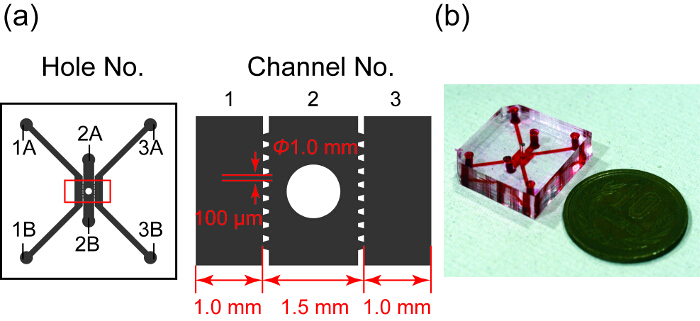
図 1: 設計とマイクロ流体デバイスの写真。(a) マイクロ流体デバイスの設計の概要します。灰色の領域は、台形 microposts で区切られた 3 つのマイクロ チャンネルを示します。チャネル 2 は、回転楕円体文化の井戸を持っています。右図は、左の赤い四角形の拡大図を示します。(b) そのチャンネルは、赤インクで満ちているマイクロ流体デバイスの写真。この図の拡大版を表示するのにはここをクリックしてください。

図 2: 実験時間。この図の拡大版を表示するのにはここをクリックしてください。

図 3: 回転楕円体をマイクロ流体デバイスにロードします。(a) 2 つの別々 の皿に MS と回転楕円体とメディアのドロップを作る。その後、MS にトロンビンと回転楕円体を転送します。(回転楕円体の注入中にデバイスの b) 模式断面図。ゲルの過剰量は穴 2A および 2B を通して流れ出します。ただし、回転楕円体は、物理的な監禁のためデバイスの下部にご利用いただけます。(c) デバイスの場合は、インキュベーターの模式図。ウェット キムワイプだった 100 mm ディッシュに配置され、デバイスに 2 つの 35 mm 料理は、キムワイプに置かれました。この図の拡大版を表示するのにはここをクリックしてください。

図 4: デバイスをシード処理セルのピペット チップの写真をカットします。左の白の先端は穴 1 a、1 b、3 a と 3 C およびフィブリン ゲル (ステップ 4.2.6、4.2.4 4.1.13 4.1.9) のドロップに転送する回転楕円体です。中央の黄色のチップは、96 ウェル (ステップ 4.1.7) から回転楕円体のコレクションです。右白の先端は回転楕円体も (ステップ 4.1.11) です。カットする前にヒントも写真のとおりです。この図の拡大版を表示するのにはここをクリックしてください。
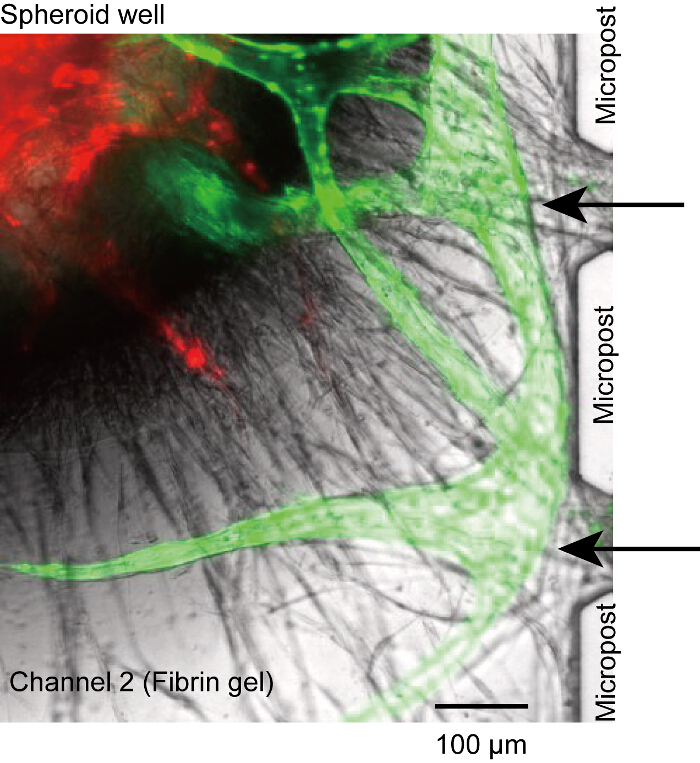
図 5: 非 perfusable 血管。マイクロ流路から血管新生もやしは microposts の間の開口部に接続していないと、ルーメンとマイクロ (黒い矢印) との間の接続が失われました。それは、チャンネル 1、3 でシードが不足して比較が原因です。赤: 緑の回転楕円体で RFP Huvec: マイクロから GFP Huvec。セルは、デバイスで 14 日間培養しました。この図の拡大版を表示するのにはここをクリックしてください。

図 6: 血管ルート、先端および回転楕円体の中心の定義。(a) 血管根と芽の長さを測定するチップの位置を決定する方法。タイムラプス蛍光画像を整列した後デバイスで培養後数日撮影蛍光イメージは 0 日目に画像によって引かれます。ImageJ ソフトウェアによって減算後、もやしの長さを測定しました。(b) 回転楕円体の中心の定義。RFP Huvec 蛍光画像は二値化され ImageJ ソフトウェアによってその重心で測定します。回転楕円体の中心に重心を定義します。この図の拡大版を表示するのにはここをクリックしてください。
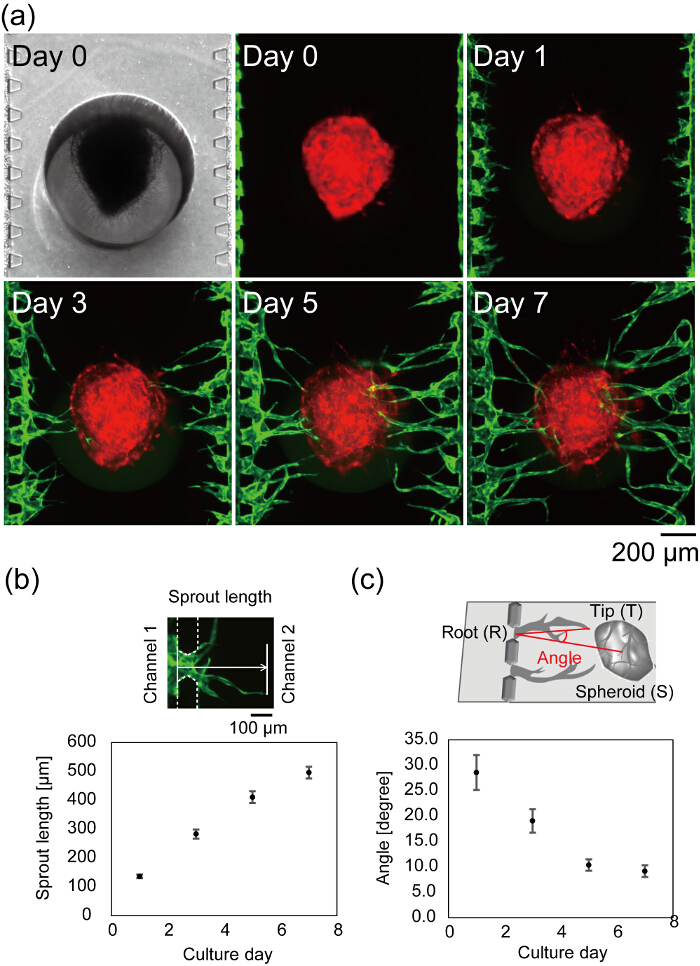
図 7: マイクロ流体デバイスにおける血管ネットワーク形成します。(細胞播種後マイクロ流体デバイスの中心の a) コマ撮り画像。赤: 回転楕円体は、緑に RFP Huvec 培養: GFP Huvec チャンネル 1 と 3 で収穫します。スプラウトの長さ (b) と (c) 血管角度の定量化 (n = 42 もやし 3 デバイスの誤差は標準誤差 (東南) を示す)。芽の長さは (b, トップ) の血管の先端に 0 日 Huvec の位置からの距離として定義されました。角度 (∠TRS) は、血管ルート (R)、先端 (T) および回転楕円体 (S) (c 上) の中心によって定義されました。血管ルート、先端および回転楕円体の中心の定義は、図 6を参照してください。これらのデータは、ImageJ ソフトウェアを使用して得られました。梨本雄らからスプラウトの長さや血管の角度の定義を説明する図が変更します。27.この図の拡大版を表示するのにはここをクリックしてください。

図 8: マイクロ チャネルおよび回転楕円体から比較によって血管内腔形成します。(デバイス文化で 14 日後サンプルの概要 a) 蛍光イメージ。黄色の四角形は、光学部 (b) に示すように x と y の位置を示します。(構築された血管ネットワークの b) x と y、y z と x z 光学セクション。白い矢印は、血管内腔を示します。赤: 回転楕円体は、緑に RFP Huvec 培養: GFP Huvec マイクロ流路、青い内培養: 細胞核。(a) を示さない青い蛍光 (、) は、固定する前にイメージするので。この図の拡大版を表示するのにはここをクリックしてください。
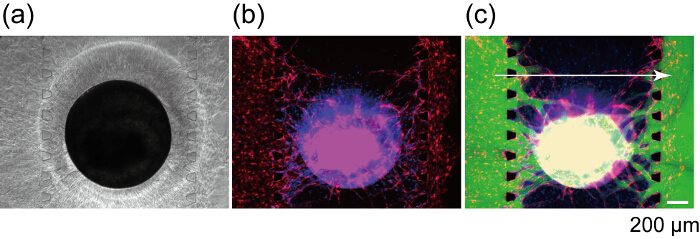
図 9: 構築血管ネットワークを用いた楕円体の灌流します。明るいフィールド (a) とデバイス文化で 7 日後に回転楕円体の蛍光画像 (b)。(c) 蛍光像 FITC デキストラン後同じ回転楕円体 (70 kDa) を読み込みます。赤: 緑の回転楕円体、チャンネル 1、3、RFP Huvec: デキストラン投与により、青: 細胞核。この図の拡大版を表示するのにはここをクリックしてください。
補足ファイル 1: マイクロ流体デバイスのデザイン。ファイルは dxf 形式です。このファイルをダウンロードするここをクリックしてください。
ディスカッション
過去のレポート表示 hLFs がカクテル アンジオポエチン 1、アンジオジェニン、肝細胞増殖因子、増殖因子-α、腫瘍壊死因子といくつか細胞外マトリックス蛋白質29、変換など、複数の血管新生因子を分泌します。 30です。この試金は hLFs 共回転楕円体法の制限である内から血管新生の分泌に依存しています。したがって、培養スフェロイドと Huvec チャンネル 1 と 3 の間の距離を短縮できるよう、井戸の底で共回転楕円体を設定する安定した血管形成のため重要です。線維芽細胞から血管の長さは短い距離は安定した血管形成有利である血管内皮細胞および線維芽細胞の31日間の距離に反比例します。ただし、有害なチャンネル 1 と 3 に開くと回転楕円体の穴 (直径 1 mm) にチャネル 2 の最小の幅 1.5 mm であった。
回転楕円体は、井戸の底で一段落、血管根時折 microposts またはマイクロ チャネル (図 5) から取り外した。この場合、試薬はマイクロ チャンネル (チャンネル 1 または 3) を血管内腔が届きません。ただし、我々 は完全にこの問題を解決可能性があります、我々 はフィブリン ゲル (ステップ 4.2.1-4.2.6) の表面に比較の不十分な数のための問題であると仮定します。Huvec 安定 2 チャネルの側壁を添付されていることを確認します。
同様に回転楕円体の挿入、に向かって 4.1.7 の手順でマイクロ ピペット先端の内径と外径の最適化は重要: 1) 内径は回転楕円体のそれよりも大きくする必要があります。2)、外側の径は井戸の端に合うべきであるので、ゲルの漏洩は発生せず井戸の上部に注入する際、ゲル注入後、先端を簡単に削除できます。現在のプロトコル (回転楕円体もの φ 1 mm) で約 700 μ m は注射の回転楕円体の最大直径です。井戸の直径はこのプロトコルよりも大きいです、大きい内部直径を持っている先端を切ることができるので大きい回転楕円体が注入ことができます。回転楕円体の直径は、96 ウェル プレートで収穫されたセル数を変更することで簡単に制御できます。
このプロトコルは、まず新規マイクロ流体回転楕円体で perfusable 血管網を構築するプラットフォームを示しています。Huvec 培養スフェロイド18,23,24血管のような構造の形成を使用できますが、これらは、ルミナの行き止まりのため perfusable でした。を模倣することができます線維芽細胞が共回転楕円体、各種回転楕円体の血管新生にいくつかの他のターゲット細胞の添加による汎用性の高い組織(骨、脂肪細胞と癌など)、存在が期待できるのでvivo環境従来回転楕円体文化より。手法の適用を拡大するには、将来の仕事には線維芽細胞添加せず回転楕円体の血管新生が含まれます。いくつか最近の作品レポート骨髄間質細胞32 ・筋細胞33は、マイクロ流体デバイスにおける血管新生を引き起こすことができます。代わりに、線維芽細胞間質や筋細胞を用いたマイクロ流体デバイスで血管が組織の数を増やすでしょう。このプロトコルは、3 つの次元の文化の分野で待望の手法である組織の血管新生の基本的なプラットフォームを提供します。
開示事項
著者は、彼らは競合する金銭的な利益があることを宣言します。
謝辞
この作品は、CREST 科学技術振興機構 (許可番号 JPMJCR14W4)、社会のための科学振興) 費 (許可番号 25600060、16 K 16386) 文部科学省からキー評価技術の開発に焦点を当てたプロジェクト、科学技術振興機構からイノベーション プログラムのセンターによって支えられました。医学研究・開発、アメッド、みずほ財団法人科学振興財団日本代理店。微細加工は京都大学ナノ技術ハブによって支えられました。
資料
| Name | Company | Catalog Number | Comments |
| AutoCAD 2017 | Autodesk | AutoCAD 2017 | |
| A chromium mask coated with AZP 1350. | CLEAN SURFACE TECHNOLOGY | CBL2506Bu-AZP | |
| Micro pattern generator | Heidelberg | uPG101 | |
| MF CD-26 developer | Rohm and haas electronic materials | - | Developer in protocol 1.4 |
| S-Clean | Sasaki Chemical | S-24 | Chromium etchant in protocol 1.5 |
| Aceton | Wako | 012-00343 | |
| Silicon Wafer | Canosis | SiJ-4 | |
| Spin Coater | MIKASA | 1H-D7 | |
| Hexamethyldisilazane (HMDS) | Tokyo Ohka Kogyo | H0089 | |
| SU-8 3050 | MicroChem | - | Negative photoresist in protocol 1.9 |
| UV Exposure | Nanometric Technology Inc | LA310s | |
| SU-8 Developer | MicroChem | Y020100 | Developer for the negative photoresist in protocol 1.13 |
| 2-propanol | Wako | 163-04841 | |
| Surface profiler | Veeco | Veeco Dektak XT-S | |
| (Trichloro (1H, 1H, 2H, 2H-perfluorooctyl) silane | Sigma | 448931 | |
| Polydimethylsiloxane (PDMS) | Dow Corning Toray | 184W/C | |
| Biopsy Punch (1.0mm) | Kai Industries | BP-10F | |
| Biopsy Punch (2.0mm) | Kai Industries | BP-20F | |
| Plasma System | Femto Science | COVANCE | |
| Cover glass | MATSUNAMI GLASS | C024241 | |
| Culture Dishes | Iwaki | 1000-035 | |
| RFP Expressing Human Umbilical Vein Endothelial Cell | Angio Proteomie | cAP-0001RFP | |
| Normal Human Lung Fibroblasts | Lonza | CC-2512 | |
| Endothelial Cell Growth Medium | Lonza | CC-3162 | |
| Fibroblast Growth Media Kits | Lonza | CC-3132 | |
| DMEM | Thermo Fisher Scientific | 11965092 | |
| Fetal Bovine Serum | Thermo Fisher Scientific | 26140079 | |
| Penicillin-Streptomycin Solution | Wako | 168-23191 | |
| 0.05w/v% Trypsin-0.53mmol/l EDTA• 4Na Solution with Phenol Red | Wako | 204-16935 | |
| PBS (Phosphate Buffered Salts) | Takara bio | T900 | |
| 96-well plate | Sumitomo bakelite | 631-21031 | |
| 1000ul Chip | NIPPON Genetics | FG-402 | |
| 200ul Chip | NIPPON Genetics | FG-301 | |
| 10ul Chip | NIPPON Genetics | 37650 | |
| CO2 incubator | Thermo Fisher Scientific | Model 370 | |
| GFP Expressing Human Umbilical Vein Endothelial Cell | Angio Proteomie | cAP-0001GFP | |
| Fibrinogen from bovine plasma | Sigma | F8630 | |
| Aprotinin from bovine lung | Sigma | A6279 | |
| Collagen I | Corning | 354236 | |
| Thrombin from bovine plasma | Sigma | T4648 | |
| Hoechst 33342 | Invitrogen | H21492 | Fluorescent dye to stain nuclei in protocol 5.5 |
| Paraformaldehyde Solution | Wako | 163-25983 | |
| Inverted Fluorescence Microscope | OLYMPUS | IX71 | |
| Degital CCD Camera | OLYMPUS | ORCA-R2 | |
| Confocal Laser Scanning Biological Microscope | OLYMPUS | FV1000 | |
| Inverted Fluorescence Microscope | OLYMPUS | IX-83 | |
| Fluorescein isothiocyanate-dextran | Sigma | FD70S |
参考文献
- Abbott, A. Cell culture: Biology's new dimension. Nature. 424 (6951), 870-872 (2003).
- Pampaloni, F., Reynaud, E. G., Stelzer, E. H. K. The third dimension bridges the gap between cell culture and live tissue. Nature Reviews Molecular Cell Biology. 8 (10), 839-845 (2007).
- Shamir, E. R., Ewald, A. J. Three-dimensional organotypic culture: experimental models of mammalian biology and disease. Nature Reviews Molecular Cell Biology. 15 (10), 647-664 (2014).
- Abu-Absi, S. F., Friend, J. R., Hansen, L. K., Hu, W. S. Structural polarity and functional bile canaliculi in rat hepatocyte spheroids. Experimental Cell Research. 274 (1), 56-67 (2002).
- Bissell, M. J., Radisky, D. C., Rizki, A., Weaver, V. M., Petersen, O. W. The organizing principle: microenvironmental influences in the normal and malignant breast. Differentiation. 70 (9-10), 537-546 (2002).
- Liu, Y., et al. Novel role for netrins in regulating epithelial behavior during lung branching morphogenesis. Current Biology. 14 (10), 897-905 (2004).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-U147 (2009).
- Torisawa, Y. S., Shiku, H., Kasai, S., Nishizawa, M., Matsue, T. Proliferation assay on a silicon chip applicable for tumors extirpated from mammalians. International Journal of Cancer. 109 (2), 302-308 (2004).
- Fennema, E., Rivron, N., Rouwkema, J., van Blitterswijk, C., de Boer, J. Spheroid culture as a tool for creating 3D complex tissues. Trends in Biotechnology. 31 (2), 108-115 (2013).
- Sutherland, R. M. Cell And Environment Interactions In Tumor Microregions - The Multicell Spheroid Model. Science. 240 (4849), 177-184 (1988).
- Rothbauer, M., Zirath, H., Ertl, P. Recent advances in microfluidic technologies for cell-to-cell interaction studies. Lab on a Chip. , (2017).
- Matsuura, K., Utoh, R., Nagase, K., Okano, T. Cell sheet approach for tissue engineering and regenerative medicine. Journal of Controlled Release. 190, 228-239 (2014).
- Esch, E. W., Bahinski, A., Huh, D. Organs-on-chips at the frontiers of drug discovery. Nature Reviews Drug Discovery. 14 (4), 248-260 (2015).
- Bhatia, S. N., Ingber, D. E. Microfluidic organs-on-chips. Nature Biotechnology. 32 (8), 760-772 (2014).
- Lancaster, M. A., Knoblich, J. A. Organogenesis in a dish: Modeling development and disease using organoid technologies. Science. 345 (6194), (2014).
- Hirschhaeuser, F., et al. Multicellular tumor spheroids: An underestimated tool is catching up again. Journal of Biotechnology. 148 (1), 3-15 (2010).
- Lancaster, M. A., et al. Cerebral organoids model human brain development and microcephaly. Nature. 501 (7467), 373(2013).
- Takebe, T., et al. Vascularized and functional human liver from an iPSC-derived organ bud transplant. Nature. 499 (7459), 481(2013).
- Taguchi, A., et al. Redefining the In Vivo Origin of Metanephric Nephron Progenitors Enables Generation of Complex Kidney Structures from Pluripotent Stem Cells. Cell Stem Cell. 14 (1), 53-67 (2014).
- Takasato, M., et al. Kidney organoids from human iPS cells contain multiple lineages and model human nephrogenesis. Nature. 526 (7574), 564-568 (2015).
- Auger, F. A., Gibot, L., Lacroix, D. Annual Review of Biomedical Engineering. Yarmush, M. L. 15, 177-200 (2013).
- Inamori, M., Mizumoto, H., Kajiwara, T. An Approach for Formation of Vascularized Liver Tissue by Endothelial Cell-Covered Hepatocyte Spheroid Integration. Tissue Engineering Part A. 15 (8), 2029-2037 (2009).
- Kunz-Schughart, L. A., et al. Potential of fibroblasts to regulate the formation of three-dimensional vessel-like structures from endothelial cells in vitro. American Journal of Physiology-Cell Physiology. 290 (5), C1385-C1398 (2006).
- Rouwkema, J., De Boer, J., Van Blitterswijk, C. A. Endothelial cells assemble into a 3-dimensional prevascular network in a bone tissue engineering construct. Tissue Engineering. 12 (9), 2685-2693 (2006).
- Kim, S., Lee, H., Chung, M., Jeon, N. L. Engineering of functional, perfusable 3D microvascular networks on a chip. Lab on a Chip. 13 (8), 1489-1500 (2013).
- Moya, M. L., Hsu, Y. H., Lee, A. P., Hughes, C. C. W., George, S. C. In Vitro Perfused Human Capillary Networks. Tissue Engineering Part C-Methods. 19 (9), 730-737 (2013).
- Nashimoto, Y., et al. Integrating perfusable vascular networks with a three-dimensional tissue in a microfluidic device. Integrative Biology. 9 (6), 506-518 (2017).
- Huang, C. P., et al. Engineering microscale cellular niches for three-dimensional multicellular co-cultures. Lab on a Chip. 9 (12), 1740-1748 (2009).
- Newman, A. C., et al. Analysis of Stromal Cell Secretomes Reveals a Critical Role for Stromal Cell-Derived Hepatocyte Growth Factor and Fibronectin in Angiogenesis. Arteriosclerosis Thrombosis and Vascular Biology. 33 (3), 513(2013).
- Newman, A. C., Nakatsu, M. N., Chou, W., Gershon, P. D., Hughes, C. C. W. The requirement for fibroblasts in angiogenesis: fibroblast-derived matrix proteins are essential for endothelial cell lumen formation. Molecular Biology of the Cell. 22 (20), 3791-3800 (2011).
- Griffith, C. K., et al. Diffusion limits of an in vitro thick prevascularized tissue. Tissue Engineering. 11 (1-2), 257-266 (2005).
- Zheng, Y., et al. Angiogenesis in Liquid Tumors: An In Vitro Assay for Leukemic-Cell-Induced Bone Marrow Angiogenesis. Advanced Healthcare Materials. 5 (9), 1014-1024 (2016).
- Osaki, T., Sivathanu, V., Kamm, R. D. Crosstalk between developing vasculature and optogenetically engineered skeletal muscle improves muscle contraction and angiogenesis. Biomaterials. 156, 65-76 (2018).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved