Method Article
רשת כלי הדם perfusable עם דגם רקמה במכשיר Microfluidic
In This Article
Summary
הפרוטוקול מתאר כיצד מהנדס רשת כלי הדם perfusable ב ספרואיד. Microenvironment שמסביב של ספרואיד הוא פיתח כדי לגרום אנגיוגנזה ולהתחבר ספרואיד של microchannels את התקן microfluidic. השיטה מאפשרת את זלוף של ספרואיד, אשר היא טכניקה המיוחל בתרבויות תלת מימדי.
Abstract
ספרואיד (צבירה multicellular) נחשב מודל של חיים רקמות בגוף האדם. למרות קידום משמעותי בתרבויות ספרואיד, רשת כלי הדם perfusable ב spheroids עדיין אתגר קריטי לתרבות לטווח ארוך נדרש לשמור ולפתח את הפונקציות שלהם, כגון חלבון ביטויים מורפוגנזה. הפרוטוקול מציג שיטה להשתלב רשת כלי הדם perfusable בתוך ספרואיד התקן microfluidic. כדי לגרום לרשת כלי הדם perfusable ספרואיד, הונחו נבטים האנגיוגנזה מחובר microchannels כדי ספרואיד ניצול גורמי אנגיוגנזה של אמבריולוגיה fibroblasts תרבותי ב ספרואיד. נבטים האנגיוגנזה הגיעו ספרואיד, התמזגה עם תאי אנדותל ותרבותית משותפת ב- ספרואיד, ויצרו רשת כלי דם רציפה. רשת כלי הדם יכול perfuse את הפנים של ספרואיד ללא דליפה כלשהי. נבנה לרשת כלי הדם ניתן להשתמש עוד יותר עבור אספקה של חומרים מזינים והסרה של חומרי פסולת, מחקה את זרימת הדם בתוך vivoכמו מסלול. השיטה מספקת פלטפורמה חדשה בתרבות ספרואיד לכיוון נעלה יותר של רקמות החי.
Introduction
המעבר בין תרבות (דו מימדי) חד שכבתי לתרבות תלת מימדי מונע ע י צורך לעבוד עם מודלים תרבות המחקים את הפונקציות הסלולר של חיים רקמות1,2,3. מצעים פלסטיק שטוחה וקשה נפוץ תרבית תאים לא דומים ביותר של סביבות חוץ-תאית בגוף האדם. למעשה, מחקרים רבים להפגין ארכיטקטורה תלת מימדי התרבות הזו של רקמות ספציפיות לשחזר מכני וביוכימי רמזים, תקשורת, אשר לא נצפו תרבות דו מימדי קונבנציונאלי4, 5,-6,-7,-8.
צבירה multicellular ספרואיד, הוא אחד של טכניקות המבטיחים ביותר להבין זה תלת מימדי התרבות9,10. התאים המפרישים את מטריצה חוץ-תאית (ECM), יכולים לקיים אינטראקציה עם אחרים ספרואיד. למרות כמה אחרים בביו-הנדסה מתקרב11,12,13,14, כגון תא בערימה, בהצלחה לשכפל את המורכבות המרחבי של הגוף האנושי, הגישות הללו יש רק שניים או שלושה סוגים של תאים עבור להקל על ניתוח ממוקד רק תפקיד אחד של אברי המטרה. לעומת זאת, תאים spheroids חשופים לסביבות תרבות שונים בהתאם עמדותיהם ספרואיד בשל הטרוגניות אספקת חומרים מזינים, חמצן, ואת paracrine autocrine מולקולות ב ספרואיד איתות. תכונה זו של spheroids מחקה באופן חלקי ויוו תרבות תנאי, ומאפשרים התאים spheroids ליצירת רקמות מורכבים הרבה יותר, מאורגנת מבנה במבחנה מאלה תרבותי הערימה רקמות9, 15 , 16. הערה אם ספרואיד מורכבת מסוג אחד של תאים, תפקוד התאים ספרואיד אינו אחיד עקב בסביבה הטרוגנית ספרואיד. בשנים האחרונות, ספרואיד תרבויות מותר בתאי גזע pluripotent בתאי גזע עובריים (ESCs), המושרה (iPSCs) או בתאי גזע רקמות תושב לחקות ויוו רצפים התפתחותיים ואף ליצור מיני-איברים כגון המוח17, הכבד18ו כליות19,20.
למרות התקדמות משמעותית בשיטות תרבות ספרואיד, culturing spheroids גדול במשך זמן רב הוא עדיין בעייתי. טישו תלת מימדי, תאים צריך להיות ממוקם בתוך 150-200 מיקרומטר של כלי דם בגלל אספקת חמצן וחומרים מזינים21מוגבלת. רשתות כלי דם בתוך ספרואיד נחוצים לסכם החלפת חומרים בין הדם ורקמות בתוך vivo. כדי להשיג זאת, קבוצות אחרות משותף תרבותי תאי אנדותל עם היעד תאים22,23,24 או המושרה את הבידול של תאים pluripotent לתוך תאים CD31-חיוביות20. ובכל זאת, המבנים כלי דמוי דווח על אין סוף פתוח לומינה לאספקת חמצן וחומרים מזינים למרכז ספרואיד. כדי לחקות את תפקיד כלי הדם לטפח תאים בתרבות תלת מימדי, פתוח, perfusable רשת כלי הדם חייב להיות שפותחה ב- ספרואיד.
במהלך השנים האחרונות, כמה קבוצות מחקר בתחום microengineering דיווח שיטות לבנות רשת כלי דם perfusable, באופן ספונטני הנוצרת במכשיר microfluidic על-ידי ניצול גורמי אנגיוגנזה מתאי פיברובלסט cocultured25 ,26. רשתות אלה כלי הדם יש של המורפולוגיה דומה לכלים המקבילים ויוו , יכול להיות שופצה על ידי גורמים סביבתיים, שהופך אותם למתאימים עבור מחקה פונקציות וסקולרית בתרבות ספרואיד. המטרה של פרוטוקול זה היא לבנות רשת כלי הדם perfusable ב ספרואיד באמצעות פלטפורמה של microfluidic27. המכשיר microfluidic הוא שונה התקן שדווחה בעבר25 כך ספרואיד ניתן לשלב. על ידי הפניית הפרשה אנגיוגנזה של תאי פיברובלסט ספרואיד לתאי אנדותל של microchannels, האנגיוגנזה נבטים של microchannels את anastomosed עם ספרואיד ויצרו רשת כלי הדם perfusable. שיטה זו מאפשרת משלוח ישיר של מגוון רחב של חומרים, כגון פלורסנט מולקולות וחרוזים מיקרומטר-סולם אל פנים ספרואיד, אשר מספקת את המסגרת תרביות רקמה לטווח ארוך עם רשתות כלי דם.
Protocol
1. ייצור התבנית Microfluidic התקן
- עיצוב התבנית של המכשיר microfluidic באמצעות תוכנה זמינים מסחרית (Clewin5 או AutoCAD 2016, וכו.). עבור הפונקציה של Clewin5, עיין במדריך למשתמש (http://manualzz.com/doc/7159150/clewin-user-s-manual).
הערה: הקובץ עיצוב זמין 1 קובץ משלים. - להעביר את הקובץ עיצוב מחולל מיקרו דפוס וטען את הכלי עם מסיכה כרום מצופה של photoresist חיובי.
- לחשוף את photoresist חיובי באזור דפוס באמצעות גנרטור דפוס מיקרו.
- לפתח את photoresist חיובי באמצעות היזם (טבלה של חומרים), יש לשטוף את המסכה במים (DI) יונים.
- באמצעות etchant של כרום (טבלה של חומרים), לחרוט הכרומיום באזור החשוף שבו הוסר את photoresist חיובי. יש לשטוף את המסכה במים DI.
- הסר photoresist על המסכה באמצעות אצטון הנותרים.
הערה: שקיפות מסיכה יכול להיות חלופה עבור המסכה Cr. - להכין רקיק סיליקון נקי (4 אינץ, P(100)) וספין מעיל hexamethyldisilazane (HMDS) ב-3000 סל ד ל 30 s.
- HMDS Softbake למשך 5 דקות על 120 ° C וקריר כשהפחד למשך 5 דקות בטמפרטורת החדר.
- Spincoat photoresist שלילי (טבלה של חומרים) ב 500 סל ד עבור 10 s ו 1,200 סל ד ל 30 s.
הערה: התנאי ציפוי ספין אמור להניב את השכבות photoresist עם עובי של 100 מיקרומטר על מוצרי קונדיטוריה לאחר פוטוליתוגרפיה. - Prebake את photoresist שלילי 45 דקות ב 95 מעלות צלזיוס, מגניב כשהפחד עבור 60 דקות בטמפרטורת החדר.
- בדוק את עוצמת אור UV ניסוי, לחשב את זמן החשיפה מנה אנרגיה חשיפה סה כ- 250 mW/cm2. מניחים את photomask (שלב 1.1-1.6) על כשהפחד, לחשוף אותם לאור UV.
- Postbake photoresist שליליות עבור 1 דקות ב- 65 ° C ו- 5 דקות-95 מעלות צלזיוס. לאפשר את לחם הקודש להתקרר למשך 1 דקות בטמפרטורת החדר.
- לפתח את השכבה photoresist שלילית למשך 15 דקות באמבט מפתח (טבלה של חומרים) הראשון ו- 2 דקות באמבטיה השני. לשטוף את לחם הקודש באמבטיה אלכוהול איזופרופיל (IPA) הראשון 10 s ובאמבט IPA השני במשך 10 s.
- Hardbake photoresist שלילי במשך 30 דקות ב- 200 ° C וקריר כשהפחד למשך 5 דקות בטמפרטורת החדר.
- למדוד את עובי השכבה photoresist שלילי בעזרת פרופיילר משטח.
- הכנס את לחם הקודש desiccator מחובר משאבת ואקום ולהוסיף 200 µL של silane (trichloro(1H,1H,2H,2H-perfluorooctyl)silane). תדליק את המשאבה 10 דקות, ולאחר מכן כבה את זה ולשמור כשהפחד ב desiccator במשך 4 שעות.
2. צעדים ייצור, ההרכבה של שכבות PDMS
- הטלת הפולימר טרום polydimethylsiloxane (PDMS) (PDMS בסיס: אשפרה הסוכן = 10:1 (w/w)), דגה בתוך תא ואקום כבר שעתיים.
- התרופה PDMS ב 80 מעלות צלזיוס בתנור עם דש אוויר בין לילה.
- לקלף את PDMS מן כשהפחד סיליקון.
- אגרוף של 1A חורים - 3B (איור 1) ואת תרבות ספרואיד היטב. להשתמש אגרוף בקוטר 2-מ מ 1A חורים - 3B, בקוטר 1 מ מ אגרוף עבור ספרואיד טוב.
- לנקות המתים PDMS ואת תגית כיסוי זכוכית (24 מ"מ × 24 מ"מ) עם דבק, מאת שוב ושוב נדבקת, פילינג ביטול את הקלטת. אז תתייחס המתים PDMS עם אוויר פלזמה 40 s (40 mW, 50 sccm).
- בונד המתים PDMS על גבי בתגית כיסוי זכוכית לגרש את כל בועות האוויר מפני השטח בין המתים PDMS ואת מכסה התרופה ב 80 מעלות צלזיוס במשך לפחות 12 שעות.
3. ספרואיד הכנה
הערה: במחקר, חלבון פלואורסצנטי אדום לבטא את חבל הטבור האנושי הווריד תאי אנדותל (RFP-HUVECs) ולבטא חלבון פלואורסצנטי ירוק (GFP-HUVECs) HUVECs משמשים ספרואיד, microchannels, בהתאמה, כדי להבחין את מקור HUVECs לאחר הקמת רשת כלי הדם perfusable. אם המקור של HUVECs לא נחוצה, ללא תווית HUVECs הן מספיק בשביל הניסוי.
- להפשיר את RFP-HUVECs (3.0 × 105 תאים/מבחנה) ואת פיברובלסט אמבריולוגיה (hLF) (1.0 × 106 תאים/מבחנה) ולהוסיף אותם לתוך 10 מ"ל של מדיום עבור תאי אנדותל ותאים פיברובלסט, בהתאמה (טבלה של חומרים). תרבות אותם בקערה 100-מ מ- 37 מעלות צלזיוס ו-5% CO2 2-3 ימים עבור תת confluent RFP-HUVECs ו- hLFs. ההכנה הזאת תניב ~ 200 spheroids.
- לנתק את RFP-HUVECs ואת hLFs מתוך מבחר המאכלים עם 2 מ של 0.05% טריפסין-EDTA, לעצור את תגובת טריפסין עם 4 מ"ל DMEM המכיל 10% (v/v) העובר סרום שור (FBS) ו- 1% (v/v) פניצילין/סטרפטומיצין.
- לאחר צנטריפוגה ב g x 220 למשך 3 דקות, הסר את תגובת שיקוע ולאחר resuspend את RFP-HUVECs ואת hLFs של המדיום אנדותל ריכוזי התא האחרון ב 2.5 × 104 ו- 1.0 × 105 תאים למ"ל, בהתאמה.
- להוסיף בעדינות µL 200 של התליה תא (5,000 תאים עבור RFP-HUVECs) ותאים 20,000 עבור hLFs לכל טוב בצלחת 96-ובכן עם משטח איגוד נמוך במיוחד.
- דגירה לצלחת 96-ובכן-37 מעלות צלזיוס ו-5% CO2 לתקופה של 2-4 ימים.
הערה: מאז הקוטר ספרואיד תלוי תרבות תקופת ואת מספר הטלפון הראשונית בצלחת 96-ובכן, זה יכול להיות נשלט על ידי שני פרמטרים אלו.
4. תא זריעה במכשיר Microfluidic
הערה: המוסכמה למתן את החורים, ערוצים, ספרואיד את טוב מודגמות באיור1. אנו מגדירים יום 0 היום לאחר קציר תאים לתוך המכשיר microfluidic יושלם. תיאור סכמטי של צירי הזמן ניסיוני מוצג באיור2.
- טעינת ספרואיד יום − 1)
הערה: בשלב הבא יש לבצעו על קרח כדי למנוע gelation של קולגן, פיברין.- להמיס פיברינוגן בתוך buffered פוספט תמיסת מלח (PBS) עבור ריכוז סופי של 2.80 mg/mL.
- להכין ינוטרלו קולגן (3.0 מ"ג/מ"ל ב- PBS) על פי הפרוטוקול של היצרן.
- לשלב µL 107.2 בפתרון פיברינוגן (2.80 mg/mL), µL 8.0 ינוטרלו הקולגן (3.0 מ"ג/מ"ל) ו- 3.6 µL של aprotinin (5 U/mL) לכל תגובה בשפופרת. פתרון זה מתויג "הפתרון מיקס מאסטר" (MS).
הערה: אמצעי האחסון נמצא מספיק עבור טעינת ספרואיד אחד. אם יש יותר מאחד ספרואיד, להכפיל כל אמצעי אחסון לפי מספר spheroids. - להמיס תרומבין ב- PBS עבור ריכוז סופי של 50 U/mL.
הערה: Aliquots של U/mL 50 תרומבין (20 µL tube) מאוחסנים −30 ° C, הם הקרת לפני ניסוי. - מקם את הצלחת 96-ובכן המכיל את spheroids בתוך ארון אבטחה.
- להכין שתי צלחות פטרי 35 מ מ בפנים אבטחה, מארון עם צלחת אחת על קרח (תבשיל 1), המנה אחרים-benchtop (תבשיל 2). Pipet 99 µL של MS במרכז צלחת 1 (איור 3a) כדי ליצור droplet.
- לקצץ את הטיפים של 2 צהוב (10-100 µL) ונקה 3 טיפים פיפטה (1-100 µL) עבור האוסף של spheroids מהצלחת 96-ובכן, ערבוב תרומבין עם MS, אוסף מדויק spheroids, להזריק את spheroids לתוך המכשיר ולאחר הזרקת מדיה לתוך המכשיר , בהתאמה. גודל הנקבוביות של הקצה צריך להיות מעט גדול יותר מקוטר החורים 1A - 3B של ערוצים 1 ו- 3 או להתאים ספרואיד גם ערוץ 2 צמוד.
הערה: בעתיד, אלא אם צוין אחרת, השתמש פיפטה בעצות לחתוך בשלב זה. הצילום של טיפים לחתוך זמין באיור4. - לאסוף ספרואיד עם 100 µL בינוני מהצלחת 96-ובכן ולהוסיף אותו תבשיל 2 (איור 3 א).
- לאסוף את ספרואיד עם נפח מינימלי של מדיה מקערה 2. בעוד אתה מחזיק את pipettor זקוף, ספרואיד תנוע לכיוון התחתון של קצה pipet על ידי הכבידה. הוצא את ספרואיד על-ידי נגיעה בקצה pipet על גבי במניסקוס ה-droplet MS מנה 1 (איור 3 א).
הערה: השלבים הבאים 4.1.10 & 4.1.11 צריכה להתבצע במהירות. - מוסיפים 1 µL של תרומבין (50 U/mL) ומערבבים בעדינות עם קצה צהוב pipet.
- עם מוגדר 7 µL הפיפטה לאסוף את ספרואיד ומניחים לאט אותו לתוך הבאר ספרואיד (איור 3b).
- תקופת דגירה של 15 דקות ב 37 ° C עבור gelation של פיברין.
- לאט לאט להחדיר האמצעי אנדותל חורים בערוצים 1A, 3A, מילוי 1 ו- 3 עם מדיה (20 ~ 30 µL/ערוץ).
- מניחים את המכשיר בצלחת 100-מ מ עם Kimwipe רטוב כדי למנוע אידוי של מדיה מהמכשיר (איור 3 c).
- מקם את המכשיר ב- 37 מעלות צלזיוס ו-5% CO2 במשך 24 שעות ביממה להסיר את הבועות על הממשק בין המדיה לבין פיברין.
- יום 0) HUVECs טעינה
- הפשרת GFP-HUVECs (3.0 x 105 תאים/מבחנה) ולהוסיף אותם 10 מ"ל של המדיום אנדותל. תרבות אותם בקערה 100-מ מ- 37 מעלות צלזיוס ו-5% CO2 2-3 ימים להגיע sub-confluency. צלחת אחת של GFP confluent תת-HUVECs מספיקה להכנת 8-10 התקנים.
- ניתוק GFP-HUVECs מתוך מבחר המאכלים עם 2 מ של 0.05% טריפסין-EDTA ולהפסיק את תגובת טריפסין עם 4 מ"ל DMEM המכיל 10% (v/v) העובר סרום שור (FBS) ו- 1% (v/v) פניצילין/סטרפטומיצין.
- לאחר צנטריפוגה ב g x 220 למשך 3 דקות, resuspend את ה-GFP-HUVECs במדיום אנדותל-5.0 x 106 תאים למ"ל.
- מזריקים HUVECs תא ההשעיה לתוך ערוץ 1 דרך החור 1B (µL לערוץ 20).
- להטות את המכשיר microfluidic 90°, להניח אותה על הצד, דגירה ב 37 מעלות צלזיוס למשך 30 דקות להבטיח HUVECs לדבוק פיברין בערוץ 2.
- לאשר את הקובץ המצורף של HUVECs על פיברין. כאשר מספר HUVECs המחוברים הממשק בין ג'ל מדיום אינה מספיקה, להערכת עלול להתנתק בבסיס כלי הדם לאחר כמה ימים של המכשיר תרבות (איור 5). בפרוטוקול, שיעור ההצלחה זלוף הוא > 50%.
- חזור על הצעדים 4.2.4 ו 4.2.5 ערוץ 3.
- התרבות תאים בצלחת 100-מ מ עם Kimwipe לחה-37 מעלות צלזיוס ו-5% CO2 7-14 ימים.
- יום 1 ~) החלפת המדיה
- להחליף חצי של אמצעי התקשורת בערוצים 1 ו- 3 כל יום.
5. הגרעינים מכתים
- להכין 4% paraformaldehyde (PFA) ב- PBS.
- הסר את המדיה בערוצים 1 ו- 3 ולהוסיף 20 µL של 4% מחברים לכל ערוץ. כדי להחליף את הפתרון ב 4% מחברים, אני חוזר הסרת הפתרון מהמכשיר והוספת 4% PFA שלוש פעמים.
- דגירה המכשיר ב 4 מעלות צלזיוס למשך הלילה.
- להסיר 4% מחברים התקן, לשטוף הערוצים שלוש פעמים עם PBS.
- הוסף 20 µL של µg/mL 10 הפלורסנט (טבלה של חומרים) לערוץ כתם גרעינים הסלולר. כדי להחליף את הפתרון במכשיר, חזור על הסרת הפתרון מהמכשיר והוספת µg 10/mL של הפלורסנט שלוש פעמים.
- לאחסן את המכשיר ב 4 ° C עבור 24 שעות.
6. נוזל זלוף של ספרואיד
- הכינו את ספרואיד לאחר culturing יותר מ 7 ימים את ההתקן-37 מעלות צלזיוס ו-5% CO2 להשלמת שביל דם רציפה.
- הסר את המדיום חורים 1A, 1B, 3A ו- 3B.
- להציג את µL 10 של 10 מיקרומטר פתרון של fluorescein isothiocyanate (FITC)-לתוספי ב- PBS לתוך חורים 1A ו- 1B.
- נטר את הזרימה של גרגרי או צבע FITC תחת מיקרוסקופ הפוכה.
7. כימות של אורך נבט
הערה: התוכנה ver. 1.49 ImageJ משמש עבור כל ניתוח של התמונה במחקר זה.
- חופפים תמונות מהימים GFP-HUVECs 0, 1, 3, 5 ו- 7.
- להחסיר את המיקום של הקצה להערכת של יום 0 מאותו מיקום על התמונות שצולמו בימים 1, 3, 5 ו-7.
- לקבוע את הצמיחה של קצה וסקולרית מהמיקום שורש (איור 6). המרחק בין קצה כלי הדם לבין השורש הוגדרה כמו אורך נבט במחקר זה (איור 7 ב).
8. כימות של זוויות כלי דם
הערה: זווית וסקולרית הוגדרה כמו הזווית הורכב על ידי כלי הדם זווית, שורש, מרכז ספרואיד (איור 7c).
- Binarize את הדימויים ספרואיד coculture המכיל RFP-HUVECs פלורסנט ולמדוד את העמדה "centroid" על ידי ניתוח פונקציה ב- ImageJ. במחקר זה, המיקום נמדד "centroid" מוגדר במרכז ספרואיד (איור 6).
- לקבוע את המיקום של עצות כלי הדם ואת השורשים באותו אופן בשלב 7.
- למדוד את הזוויות כלי הדם באמצעות ניתוח פונקציית בתוכנה ImageJ.
תוצאות
איור 1 מראה של עיצוב תמונה של המכשיר microfluidic. . יש לו שלושה ערוצי מקבילים, איזה ערוץ 2 מכיל את ספרואיד טוב... בערוצים 1 ו- 3 משמשים את התרבות HUVEC, ערוץ 2 מיועד ספרואיד. בכל אחד מהערוצים מופרדת באמצעות microposts הבסיסי נועד דפוס PDMS. Microposts למנוע את הידרוג בערוץ 2 דולפים לתוך בערוצים 1 ו- 3 על ידי מתח ומאפשרים החלפת חומרים בין ספרואיד HUVECs microchannels28.
איור 7 א מראה המרכז של מכשיר microfluidic לאחר תא זריעה. שדה בהיר ובדימויים פלורסנט ביום 0 מראים כי פיברין ג'ל מלא רק ערוץ 2 ללא כל דליפה לתוך בערוצים 1 ו- 3, HUVECs לחבר בהצלחה sidewall של הג'ל פיברין. התמונה שדה בהיר היא בפוקוס על ספרואיד בשני טעון, microposts, המציין ספרואיד כראוי התיישבו בחלק התחתון של המכשיר. נבטים האנגיוגנזה הם נצפו על יום 1 והאורך של נבטים גדל עם הזמן, (איור 7 ב). ביום 3, נבט הארוך הגיע ספרואיד את והגיעה ביום 7, רוב נבטים האנגיוגנזה ספרואיד (ממוצע המרחק בין הערוצים 1 ו-3 מיקרומטר < 500 ספרואיד). במקרה הטוב, אחרי ארבעה ימים בתרבות התקן, הזרימה לומן כלי הדם יכול להיות שנצפו. הזווית כלי הדם היה הגדיר את ההוראות של קצה וסקולרית ומרכז ספרואיד מן השורש כלי הדם. איור 7c מראה הזווית וסקולרית כימות במהלך 7 ימים בתרבות התקן. הזוויות כלי הדם ירד באופן תלוי-זמן, המציין כי נבטים האנגיוגנזה להעביר לקראת ספרואיד.
איור 8 מציין את המקטע של רשת כלי הדם שבו שמיזגת RFP-HUVECs ו- GFP-HUVECs. RFP-HUVECs ו- GFP-HUVECs נוצרו coordinately של לומן כלי דם בודדת כפי שמוצג על ידי ראשי חץ, אשר בבירור לציין האנגיוגנזה נבטים מערוצים 1 ו- 3 anastomosed כדי RFP-HUVECs ב ספרואיד ויצרו רשת כלי דם רציפה. כדי לאשר את perfusability של רשת כלי הדם, FITC-לתוספי היה מוזרק לתוך ערוץ 1. FITC-לתוספי בערוץ 1 זרמו לתוך נבנה רשת כלי הדם ואת הפנים של ספרואיד והגיעה לבסוף ערוץ 3 (איור 9). במהלך זלוף של FITC-לתוספי פתרון, יש זליגת מהרשת כלי הדם לחלל extravascular. היא שודרה בעבר כי מולקולות קטנות, תזריקו לומן כלי הדם עוברים דרך דופן כלי הדם, להגיב עם התאים באזורים extravascular. בנוסף, המקדם חדירות של רשת כלי הדם הוצגה להיות קרובים הזה אין ויוו27. תוצאות אלו לרמז רשת כלי דם משולב יכול לספק את החומרים המזינים את ספרואיד ולהסיר תוצר הפסולת.
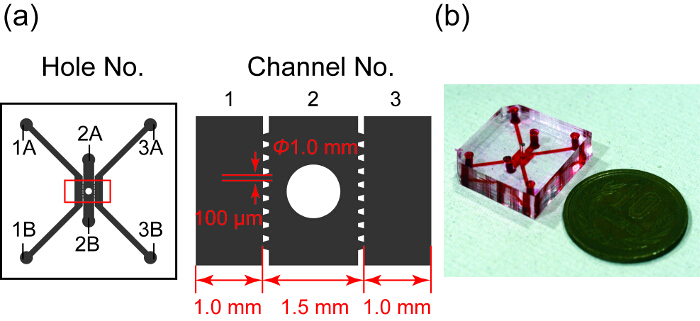
איור 1 : עיצוב, תמונה של המכשיר microfluidic. (א) סקירה של העיצוב של המכשיר microfluidic. התחום האפור מציין שלושה ערוצי microfluidic מופרדים על-ידי microposts הבסיסי. ערוץ 2 יש בו טוב עבור תרבות ספרואיד. איור נכון מציג בתצוגה מוגדלת במלבן אדום בצד שמאל. (ב) תצלום של המכשיר microfluidic ערוצי שלהם מלאים דיו אדום. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.

איור 2 : זמן הניסוי. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.

איור 3 : שיטה כדי לטעון ספרואיד לתוך המכשיר microfluidic. (א) ביצוע טיפה של MS והתקשורת עם ספרואיד שני כלים נפרדים. לאחר מכן, העבר את ספרואיד לתוך MS תרומבין. (ב) מבט חתך סכימטי המכשיר במהלך ההזרקה של ספרואיד. סכום עודף של ג'ל זורם החוצה דרך חורים 2A ו- 2B. עם זאת, ספרואיד נשאר בתחתית המכשיר בשל כליאה פיזית. (ג) מפרטים טכניים של המכשירים כאשר הם בתוך אינקובטור. Kimwipe רטוב הונח בצלחת 100-מ מ, שתי מנות 35 מ מ עם המכשיר מדדת את Kimwipe. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.

איור 4 : הצילומים של טיפים פיפטה גזור תא זריעה על המכשיר- הקצה הלבן השמאלי הוא חורים 1A, 1B, 3 א, 3 ג, ספרואיד המעביר לצניחה של פיברין ג'ל (שלבים 4.1.9, 4.1.13, 4.2.4 ו 4.2.6). הטיפ הצהוב האמצעי הוא אוסף ספרואיד מ 96-ובכן (שלב 4.1.7). הטיפ נכון לבן היא הבאר ספרואיד (שלב 4.1.11). הטיפים לפני גזור מוצגים גם בצילום. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
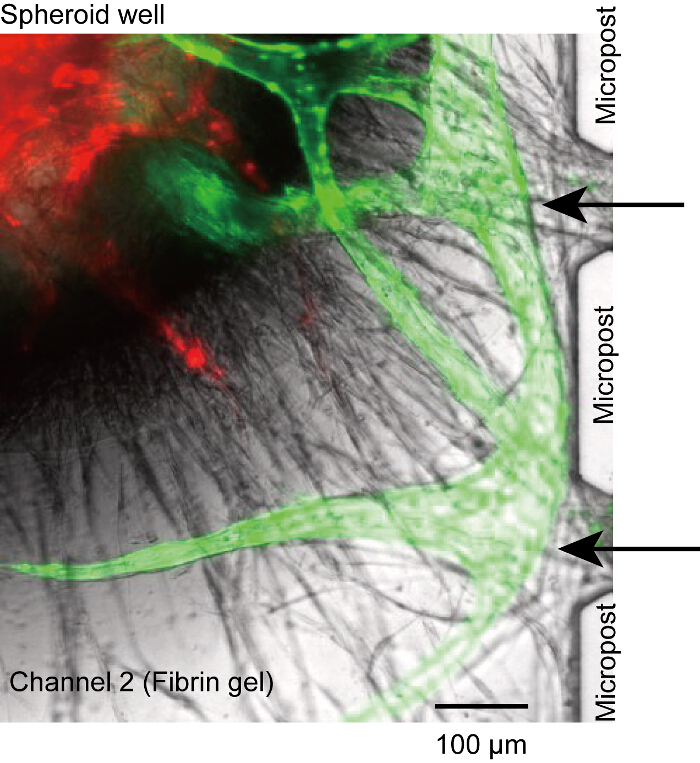
איור 5 : להערכת הלא perfusable. אנגיוגנזה נבטים של microchannels לא התחבר אל הפתח בין microposts ואיבד את החיבור בין לומן microchannels (חיצים שחורים). זה נגרם על ידי HUVECs לא מספיק נזרע בערוצים 1 ו- 3. אדום: RFP-HUVECs ב ספרואיד, ירוק: GFP-HUVECs של microchannels. התאים היו תרבותי במכשיר למשך 14 ימים. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.

איור 6 : הגדרה של השורש וסקולרית, עצה, מרכז ספרואיד. (א). שיטת כדי לקבוע את המיקום של שורש כלי הדם, עצה כדי למדוד את אורך נבט. לאחר יישור תמונות בצילום מואץ פלורסנט, התמונה פלורסנט לקח כמה ימים לאחר culturing במכשיר יופחת לפי התמונה ביום 0. מדדנו את האורך של הנבטים לאחר החיסור באמצעות תוכנת ImageJ. (ב) הגדרה של מרכז ספרואיד. הדימויים פלורסנט RFP-HUVECs binarized, נמדדת ב centroid שלה ImageJ תוכנה. אנו מגדירים את centroid למרכז ספרואיד. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
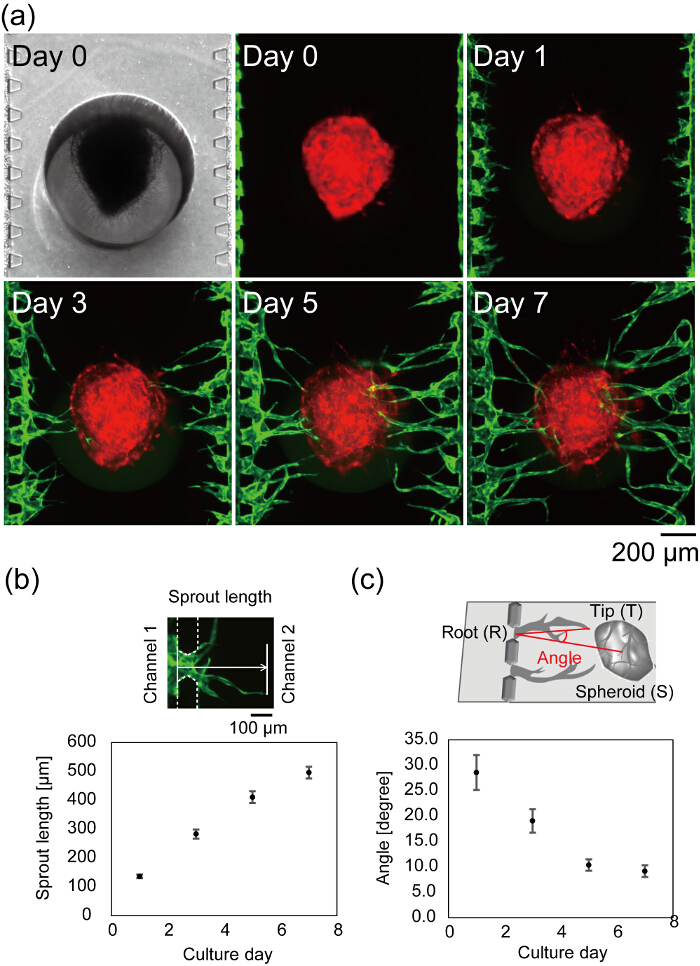
איור 7 : היווצרות רשת כלי דם במכשיר microfluidic. (א) תמונות בצילום מואץ של מרכז של מכשיר microfluidic לאחר תא זריעה. אדום: RFP-HUVECs תרבותי ב ספרואיד, ירוק: GFP-HUVECs שנקטפו בערוצים 1 ו- 3. ניתוח כמותי של נבט אורך (b), זווית כלי דם (c) (n = 42 נבטים בהתקנים 3, קווי השגיאה לציין את תקן שגיאות (S.E.)). אורך נבט מוגדר כהמרחק בין המיקום של HUVECs ביום 0 לקצה וסקולרית (ב', בראש). הזווית (∠TRS) הוגדרה על ידי השורש וסקולרית (R), טיפ (T) מרכז ספרואיד (S) (c, למעלה). ראה איור 6 עבור ההגדרה של בסיס כלי הדם, עצה, מרכז ספרואיד. נתונים אלה התקבלו באמצעות תוכנת ImageJ. התרשימים המסביר את ההגדרה של אורך ספראוט וזווית כלי הדם עוברות שינוי מ Nashimoto, י. ואח 27. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.

איור 8 : היווצרות של לומן כלי דם על-ידי HUVECs מן microchannels את ספרואיד. (א) פלורסנט תמונה של סקירה כללית של המדגם לאחר 14 ימים בתרבות התקן. מלבן צהוב מציין המיקום x-y של המקטע אופטי שמוצג (b). (ב) x-y, y-z ו- x-z סעיף אופטי של רשת כלי דם שלא נבנה. חיצים לבנים מציינים לומן כלי הדם. אדום: RFP-HUVECs תרבותי ב ספרואיד, ירוק: GFP-HUVECs תרבותי ב microchannels את, כחול: גרעינים הסלולר. (א) מראה אין קרינה פלואורסצנטית כחול כי (א) התמונה לפני הקיבעון. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
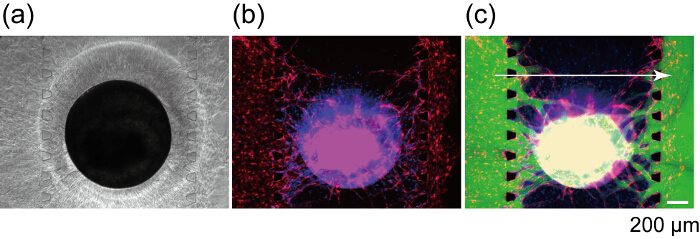
איור 9 : זלוף של ספרואיד באמצעות רשת כלי דם שלא נבנה. שדה בהיר (a) ופלורסנט (ב) תמונות של ספרואיד לאחר 7 ימים בתרבות התקן. (ג) פלורסנט דימוי ספרואיד אותו לאחר FITC-לתוספי (70 kDa) טעינה. אדום: RFP-HUVECs ספרואיד ו בערוצים 1 ו- 3, ירוק: FITC-לתוספי, כחול: גרעינים הסלולר. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
1 הקבצים המשלימים: העיצוב של המכשיר microfluidic. הקובץ הוא בפורמט dxf. אנא לחץ כאן כדי להוריד את הקובץ.
Discussion
דיווחים קודמים מראים כי hLFs מפרישים קוקטייל של מספר גורמי אנגיוגנזה, angiopoietin-1, angiogenin, hepatocyte פקטורי גדילה, שינוי צורה של גורם גדילה-α, הגידול נקרוזה מקדם, כמה מטריצה חוץ-תאית חלבונים29, 30. Assay הזה מסתמך על הפרשה האנגיוגנזה מ hLFs ב ספרואיד coculture, אשר הוא המגבלה של הטכניקה. לכן, זה קריטי עבור מערך כלי הדם יציב להגדיר ספרואיד coculture בתחתית הבאר כך המרחק בין ספרואיד coculture את HUVECs את ערוצים 1 ו- 3 יכול להתקצר. אורך כלי דם מן fibroblasts היה ביחס הפוך למרחק בין תאי אנדותל fibroblasts31, כך המרחק קצר היא יתרון עבור יציבה היווצרות כלי דם. עם זאת, לפתוח חור ספרואיד (1 מ מ קוטר) מבלי להזיק בערוצים 1 ו- 3, הרוחב המינימלי של ערוץ 2 היה 1.5 מ מ.
למרות ספרואיד ישקע בתחתית הבאר, שורשים וסקולרית נותקו לעתים microposts או microchannels (איור 5). במקרה זה, לא מגיב יכול להגיע לומן כלי הדם דרך microchannels (ערוצים 1 או 3). למרות שאנחנו לא יכול לפתור את הבעיה לחלוטין, אנחנו יכולים להניח שהבעיה היא בגלל מספר לא מספיק של HUVECs על פני השטח של הג'ל פיברין (שלב 4.2.1-4.2.6). ודא את HUVECs stably לצרף הקיר בצד של ערוץ 2.
לקראת הזריקה מוצלח של ספרואיד לתוך הבאר, אופטימיזציה של הקוטר הפנימיים והחיצוניים של טיפים micropipette בשלב 4.1.7 הוא חשוב: 1) הקוטר הפנימי צריך להיות גדול מזה של ספרואיד. 2) dimeter החיצוני צריך להתאים לקצה הטוב כך אין נזילה של הג'ל מתרחשת בחלק העליון של הבאר במהלך ההזרקה הטיפ ניתן להסיר בקלות לאחר הזרקת ג'ל. בפרוטוקול הנוכחי (φ1 מ מ ספרואיד טוב), כ-700 מיקרומטר הוא הקוטר המרבי עבור ספרואיד להזרקה. אם הקוטר טוב מיועד גדול מזה של פרוטוקול זה, יכול להיות מוזרק spheroids גדולים יותר בגלל הטיפ ניתן לחתוך יש קטרים הפנימי גדול יותר. ספרואיד קטרים ניתן לשלוט בקלות על-ידי שינוי מספר התא שנקטפו בצלחת 96-ובכן.
פרוטוקול זה מראה ראשית הרומן microfluidic פלטפורמה לבנות רשת כלי הדם perfusable ב ספרואיד. אמנם coculture עם HUVECs מאפשרת היווצרות של כלי דמוי מבנים בגודל23,18,ספרואיד24, היו אלה לא perfusable בשל קצות לומינה המלח. מכיוון שניתן לצפות פיברובלסט קיימים תאים ברקמות רב-תכליתי (עצם, adipocyte, סרטן, וכו '.), על ידי התוספת של כמה תאים מיקוד אחרים כדי ספרואיד coculture, אמוניה סוג שונים של spheroids, אשר יכול לחקות את ב ויוו הסביבה טוב יותר התרבות ספרואיד קונבנציונלי. כדי להרחיב את היישום של הטכניקה, העבודה העתידי יכלול את אמוניה spheroids ללא התוספת של פיברובלסטים. כמה האחרונות עבודות דו ח מח עצם תאי סטרומה32 ו שרירים תאים33 יכול לגרום אנגיוגנזה המכשירים microfluidic. ניצול תאי סטרומה או שריר במקום תאי פיברובלסט יגדילו את מספר רקמות זה יכול להיות vascularized את ההתקן microfluidic. פרוטוקול זה מספק פלטפורמה בסיסית רקמת vascularization, אשר היא טכניקה המיוחל בתחום של שלוש התרבויות תלת-ממדי.
Disclosures
המחבר מצהירים כי יש להם אינטרסים כלכליים אין מתחרים.
Acknowledgements
עבודה זו נתמכה על ידי קרסט JST (גרנט מספר JPMJCR14W4), החברה עבור הקידום של המדע (JSPS) KAKENHI (גרנט מספר 25600060, 16K 16386), מרכז של חדשנות תוכנית MEXT, JST, התמקד בפיתוח טכנולוגיה הערכה מפתח מן הסוכנות היפנית מחקר רפואי ופיתוח, AMED, Mizuho קרן לקידום מדעי. מיקרו-מלאכותית נתמכה על ידי אוניברסיטת קיוטו ננו טכנולוגיה Hub.
Materials
| Name | Company | Catalog Number | Comments |
| AutoCAD 2017 | Autodesk | AutoCAD 2017 | |
| A chromium mask coated with AZP 1350. | CLEAN SURFACE TECHNOLOGY | CBL2506Bu-AZP | |
| Micro pattern generator | Heidelberg | uPG101 | |
| MF CD-26 developer | Rohm and haas electronic materials | - | Developer in protocol 1.4 |
| S-Clean | Sasaki Chemical | S-24 | Chromium etchant in protocol 1.5 |
| Aceton | Wako | 012-00343 | |
| Silicon Wafer | Canosis | SiJ-4 | |
| Spin Coater | MIKASA | 1H-D7 | |
| Hexamethyldisilazane (HMDS) | Tokyo Ohka Kogyo | H0089 | |
| SU-8 3050 | MicroChem | - | Negative photoresist in protocol 1.9 |
| UV Exposure | Nanometric Technology Inc | LA310s | |
| SU-8 Developer | MicroChem | Y020100 | Developer for the negative photoresist in protocol 1.13 |
| 2-propanol | Wako | 163-04841 | |
| Surface profiler | Veeco | Veeco Dektak XT-S | |
| (Trichloro (1H, 1H, 2H, 2H-perfluorooctyl) silane | Sigma | 448931 | |
| Polydimethylsiloxane (PDMS) | Dow Corning Toray | 184W/C | |
| Biopsy Punch (1.0mm) | Kai Industries | BP-10F | |
| Biopsy Punch (2.0mm) | Kai Industries | BP-20F | |
| Plasma System | Femto Science | COVANCE | |
| Cover glass | MATSUNAMI GLASS | C024241 | |
| Culture Dishes | Iwaki | 1000-035 | |
| RFP Expressing Human Umbilical Vein Endothelial Cell | Angio Proteomie | cAP-0001RFP | |
| Normal Human Lung Fibroblasts | Lonza | CC-2512 | |
| Endothelial Cell Growth Medium | Lonza | CC-3162 | |
| Fibroblast Growth Media Kits | Lonza | CC-3132 | |
| DMEM | Thermo Fisher Scientific | 11965092 | |
| Fetal Bovine Serum | Thermo Fisher Scientific | 26140079 | |
| Penicillin-Streptomycin Solution | Wako | 168-23191 | |
| 0.05w/v% Trypsin-0.53mmol/l EDTA• 4Na Solution with Phenol Red | Wako | 204-16935 | |
| PBS (Phosphate Buffered Salts) | Takara bio | T900 | |
| 96-well plate | Sumitomo bakelite | 631-21031 | |
| 1000ul Chip | NIPPON Genetics | FG-402 | |
| 200ul Chip | NIPPON Genetics | FG-301 | |
| 10ul Chip | NIPPON Genetics | 37650 | |
| CO2 incubator | Thermo Fisher Scientific | Model 370 | |
| GFP Expressing Human Umbilical Vein Endothelial Cell | Angio Proteomie | cAP-0001GFP | |
| Fibrinogen from bovine plasma | Sigma | F8630 | |
| Aprotinin from bovine lung | Sigma | A6279 | |
| Collagen I | Corning | 354236 | |
| Thrombin from bovine plasma | Sigma | T4648 | |
| Hoechst 33342 | Invitrogen | H21492 | Fluorescent dye to stain nuclei in protocol 5.5 |
| Paraformaldehyde Solution | Wako | 163-25983 | |
| Inverted Fluorescence Microscope | OLYMPUS | IX71 | |
| Degital CCD Camera | OLYMPUS | ORCA-R2 | |
| Confocal Laser Scanning Biological Microscope | OLYMPUS | FV1000 | |
| Inverted Fluorescence Microscope | OLYMPUS | IX-83 | |
| Fluorescein isothiocyanate-dextran | Sigma | FD70S |
References
- Abbott, A. Cell culture: Biology's new dimension. Nature. 424 (6951), 870-872 (2003).
- Pampaloni, F., Reynaud, E. G., Stelzer, E. H. K. The third dimension bridges the gap between cell culture and live tissue. Nature Reviews Molecular Cell Biology. 8 (10), 839-845 (2007).
- Shamir, E. R., Ewald, A. J. Three-dimensional organotypic culture: experimental models of mammalian biology and disease. Nature Reviews Molecular Cell Biology. 15 (10), 647-664 (2014).
- Abu-Absi, S. F., Friend, J. R., Hansen, L. K., Hu, W. S. Structural polarity and functional bile canaliculi in rat hepatocyte spheroids. Experimental Cell Research. 274 (1), 56-67 (2002).
- Bissell, M. J., Radisky, D. C., Rizki, A., Weaver, V. M., Petersen, O. W. The organizing principle: microenvironmental influences in the normal and malignant breast. Differentiation. 70 (9-10), 537-546 (2002).
- Liu, Y., et al. Novel role for netrins in regulating epithelial behavior during lung branching morphogenesis. Current Biology. 14 (10), 897-905 (2004).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-U147 (2009).
- Torisawa, Y. S., Shiku, H., Kasai, S., Nishizawa, M., Matsue, T. Proliferation assay on a silicon chip applicable for tumors extirpated from mammalians. International Journal of Cancer. 109 (2), 302-308 (2004).
- Fennema, E., Rivron, N., Rouwkema, J., van Blitterswijk, C., de Boer, J. Spheroid culture as a tool for creating 3D complex tissues. Trends in Biotechnology. 31 (2), 108-115 (2013).
- Sutherland, R. M. Cell And Environment Interactions In Tumor Microregions - The Multicell Spheroid Model. Science. 240 (4849), 177-184 (1988).
- Rothbauer, M., Zirath, H., Ertl, P. Recent advances in microfluidic technologies for cell-to-cell interaction studies. Lab on a Chip. , (2017).
- Matsuura, K., Utoh, R., Nagase, K., Okano, T. Cell sheet approach for tissue engineering and regenerative medicine. Journal of Controlled Release. 190, 228-239 (2014).
- Esch, E. W., Bahinski, A., Huh, D. Organs-on-chips at the frontiers of drug discovery. Nature Reviews Drug Discovery. 14 (4), 248-260 (2015).
- Bhatia, S. N., Ingber, D. E. Microfluidic organs-on-chips. Nature Biotechnology. 32 (8), 760-772 (2014).
- Lancaster, M. A., Knoblich, J. A. Organogenesis in a dish: Modeling development and disease using organoid technologies. Science. 345 (6194), (2014).
- Hirschhaeuser, F., et al. Multicellular tumor spheroids: An underestimated tool is catching up again. Journal of Biotechnology. 148 (1), 3-15 (2010).
- Lancaster, M. A., et al. Cerebral organoids model human brain development and microcephaly. Nature. 501 (7467), 373 (2013).
- Takebe, T., et al. Vascularized and functional human liver from an iPSC-derived organ bud transplant. Nature. 499 (7459), 481 (2013).
- Taguchi, A., et al. Redefining the In Vivo Origin of Metanephric Nephron Progenitors Enables Generation of Complex Kidney Structures from Pluripotent Stem Cells. Cell Stem Cell. 14 (1), 53-67 (2014).
- Takasato, M., et al. Kidney organoids from human iPS cells contain multiple lineages and model human nephrogenesis. Nature. 526 (7574), 564-568 (2015).
- Auger, F. A., Gibot, L., Lacroix, D., Yarmush, M. L. . Annual Review of Biomedical Engineering. 15, 177-200 (2013).
- Inamori, M., Mizumoto, H., Kajiwara, T. An Approach for Formation of Vascularized Liver Tissue by Endothelial Cell-Covered Hepatocyte Spheroid Integration. Tissue Engineering Part A. 15 (8), 2029-2037 (2009).
- Kunz-Schughart, L. A., et al. Potential of fibroblasts to regulate the formation of three-dimensional vessel-like structures from endothelial cells in vitro. American Journal of Physiology-Cell Physiology. 290 (5), C1385-C1398 (2006).
- Rouwkema, J., De Boer, J., Van Blitterswijk, C. A. Endothelial cells assemble into a 3-dimensional prevascular network in a bone tissue engineering construct. Tissue Engineering. 12 (9), 2685-2693 (2006).
- Kim, S., Lee, H., Chung, M., Jeon, N. L. Engineering of functional, perfusable 3D microvascular networks on a chip. Lab on a Chip. 13 (8), 1489-1500 (2013).
- Moya, M. L., Hsu, Y. H., Lee, A. P., Hughes, C. C. W., George, S. C. In Vitro Perfused Human Capillary Networks. Tissue Engineering Part C-Methods. 19 (9), 730-737 (2013).
- Nashimoto, Y., et al. Integrating perfusable vascular networks with a three-dimensional tissue in a microfluidic device. Integrative Biology. 9 (6), 506-518 (2017).
- Huang, C. P., et al. Engineering microscale cellular niches for three-dimensional multicellular co-cultures. Lab on a Chip. 9 (12), 1740-1748 (2009).
- Newman, A. C., et al. Analysis of Stromal Cell Secretomes Reveals a Critical Role for Stromal Cell-Derived Hepatocyte Growth Factor and Fibronectin in Angiogenesis. Arteriosclerosis Thrombosis and Vascular Biology. 33 (3), 513 (2013).
- Newman, A. C., Nakatsu, M. N., Chou, W., Gershon, P. D., Hughes, C. C. W. The requirement for fibroblasts in angiogenesis: fibroblast-derived matrix proteins are essential for endothelial cell lumen formation. Molecular Biology of the Cell. 22 (20), 3791-3800 (2011).
- Griffith, C. K., et al. Diffusion limits of an in vitro thick prevascularized tissue. Tissue Engineering. 11 (1-2), 257-266 (2005).
- Zheng, Y., et al. Angiogenesis in Liquid Tumors: An In Vitro Assay for Leukemic-Cell-Induced Bone Marrow Angiogenesis. Advanced Healthcare Materials. 5 (9), 1014-1024 (2016).
- Osaki, T., Sivathanu, V., Kamm, R. D. Crosstalk between developing vasculature and optogenetically engineered skeletal muscle improves muscle contraction and angiogenesis. Biomaterials. 156, 65-76 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
ISSN 2578-2614
Copyright © 2025 MyJoVE Corporation. All rights reserved
We use cookies to enhance your experience on our website.
By continuing to use our website or clicking “Continue”, you are agreeing to accept our cookies.
