Method Article
Perfusable Red Vascular con un modelo de tejido en un dispositivo de microfluidos
En este artículo
Resumen
El protocolo describe cómo diseñar una red vascular perfusable en un esferoide. Microambiente circundante del esferoide es ideado para inducir angiogénesis y conectarse el esferoide de los microcanales en un dispositivo de microfluidos. El método permite la perfusión de la esferoide, que es una técnica largamente esperada en cultivos tridimensionales.
Resumen
Un esferoide (un agregado multicelular) es considerado como un buen modelo de tejidos vivos en el cuerpo humano. A pesar del avance significativo en las culturas del esferoide, una red vascular perfusable en los esferoides sigue siendo un reto para la cultura a largo plazo necesaria para mantener y desarrollar sus funciones, como expresiones de la proteína y la morfogénesis. El protocolo presenta un método novedoso para integrar una red vascular perfusable dentro del esferoide en un dispositivo de microfluidos. Para inducir una red vascular perfusable en el esferoide, brotes angiogénicos conectados con microcanales fueron guiados a la esferoide utilizando factores angiogénicos de fibroblastos de pulmón humanos cultivados en el esferoide. Los brotes angiogénicos alcanzaron el esferoide, que se fusiona con las células endoteliales cultivadas conjuntamente en el esferoide y forman una red vascular continua. La red vascular podría inundar el interior del esferoide sin ninguna salida. La red vascular construida puede utilizarse más como una ruta para el suministro de nutrientes y eliminación de residuos, que mímico la circulación de sangre en vivo. El método proporciona una nueva plataforma en la cultura de esferoide hacia mejor recapitulación de los tejidos vivos.
Introducción
El cambio de una cultura (bidimensional) de monocapa a una cultura tridimensional está motivado por la necesidad de trabajar con modelos de cultura que imitan las funciones celulares de la vida los tejidos1,2,3. Planos y duros plástico sustratos utilizados en cultivo de células no se parecen a la mayoría de los entornos extracelulares en el cuerpo humano. De hecho, muchos estudios demuestran que cultura tridimensionales recrear tejidos específicos la arquitectura, señales mecánicas y bioquímicas y comunicación de la célula, que no se han observado en la cultura bidimensional convencional4, 5,6,7,8.
Un agregado multicelular o esferoide, es una de las técnicas más prometedoras para realizar este cultivo tridimensional9,10. Las células secretan la matriz extracelular (ECM) y pueden interactuar con otros en el esferoide. Aunque algunos otros bioingeniería enfoques11,12,13,14, como el amontonamiento de células, replicar con éxito la complejidad espacial del cuerpo humano, estos enfoques tienen sólo dos o tres tipos de células para la facilidad de análisis y enfocada en sólo una de las funciones de órganos diana. En contraste, las células esferoides están expuestas a ambientes de cultivo diferentes dependiendo de sus posiciones en el esferoide debido a la heterogénea oferta de nutrientes, oxígeno y paracrina y autocrina señalización de moléculas en el esferoide. Esta característica de esferoides imita parcialmente en vivo cultura condición y activar las células esferoides para crear tejido mucho más complejo y organizado de la estructura en vitro que las cultivadas en el apilamiento de tejido9, 15 , 16. tenga en cuenta que si un esferoide se compone de un solo tipo de células, la función de las células en el esferoide no es uniforme debido al ambiente heterogéneo en el esferoide. En los últimos años, las culturas esferoide permitieron células de madre pluripotentes células madre embrionarias (ESCs), inducidas (iPSCs) o células madre de tejido-residente en vivo secuencias de desarrollo de imitar y recrear mini-órganos como el cerebro17, hígado18y riñón19,20.
A pesar de importantes avances en las técnicas de cultivo esferoide, cultivo esferoides grandes durante mucho tiempo es todavía problemático. En un tejido tridimensional, las células necesitan estar ubicados a menos de 150-200 μm de un vaso sanguíneo debido a la limitada fuente de oxígeno y nutrientes21. Redes vasculares en el esferoide están necesarias recapitular intercambiando sustancias entre la sangre y los tejidos in vivo. Para ello, otros grupos han co cultivadas las células endoteliales con las células de destino22,23,24 o inducido la diferenciación de las células pluripotentes en CD31-positive células20. Sin embargo, las estructuras de recipiente-como informadas no tiene los extremos abiertos del lumina para suministrar oxígeno y nutrientes al centro del esferoide. Para imitar la función vascular para nutrir las células en el cultivo tridimensional, abierta y perfusable de la red vascular debe ser desarrollada en el esferoide.
Durante los últimos años, algunos grupos de investigación en el campo de la Microtécnica informaron métodos para construir una red vascular perfusable, formada espontáneamente en un dispositivo de microfluidos utilizando factores angiogénicos de células de morfología de fibroblastos25 ,26. Estas redes vasculares tienen una morfología similar a sus contrapartes en vivo y pueden ser remodeladas por factores ambientales, haciéndolos convenientes para mímico funciones vasculares en una cultura del esferoide. El propósito de este protocolo es construir una red vascular perfusable en un esferoide usando una plataforma de microfluidos27. El dispositivo de microfluidos se modifica el dispositivo previamente divulgados25 por lo que puede ser incorporado un esferoide. Dirigiendo la secreción angiogénico de las células del fibroblasto de un esferoide a las células endoteliales en microcanales, angiogénica brota de los microcanales que se anastomosa con el esferoide y forma una red vascular perfusable. Este método permite una entrega directa de una amplia gama de sustancias, como las moléculas fluorescentes y granos micrómetro-escala en el interior de un esferoide, que proporciona el marco para un cultivo de tejidos a largo plazo con las redes vasculares.
Protocolo
1. fabricación del molde dispositivo microfluídico
- Diseñar el modelo del dispositivo microfluídico utilizando software disponible comercialmente (Clewin5 o AutoCAD 2016, etcetera.). Para la función de la Clewin5, consulte el manual del usuario (http://manualzz.com/doc/7159150/clewin-user-s-manual).
Nota: El archivo del diseño está disponible en archivo adicional 1. - Transferir el archivo de diseño a un micro generador y carga la herramienta con una máscara de cromo recubierta con el photoresist positivo.
- Exponer el photoresist positivo en la zona de patrón utilizando un generador de patrón micro.
- Desarrollar el photoresist positivo usando el revelador (Tabla de materiales) y enjuague la máscara con agua desionizada (DI).
- Usando el grabador de cromo (Tabla de materiales), grabe el cromo en el área expuesta donde fue quitado el photoresist positivo. Enjuague la máscara con agua desionizada.
- Eliminar el remanente de la fotoresistencia en la máscara usando acetona.
Nota: La máscara de transparencia puede ser una alternativa para la máscara de Cr. - Preparar una oblea de silicio limpia (4 pulgadas, P(100)) y spin capa hexamethyldisilazane (HMDS) a 3.000 rpm durante 30 s.
- HMDS Softbake durante 5 minutos a 120 ° C y la oblea se enfríe durante 5 minutos a temperatura ambiente.
- Spincoat el photoresist negativo (tabla de materiales) en 500 rpm durante 10 s y 1.200 r.p.m. durante 30 s.
Nota: La condición de la capa de vuelta debe producir las capas de Fotoprotección con un espesor de aproximadamente 100 μm en las obleas después de fotolitografía. - Prebake el photoresist negativo por 45 min a 95 ° C y enfriar la oblea durante 60 min a temperatura ambiente.
- Compruebe la intensidad de la luz UV en cada experimento y calcular el tiempo de exposición para una dosis de energía de exposición total en 250 mW/cm2. Coloque la fotomáscara (paso de 1.1-1.6) en la oblea y exponerlas a la luz UV.
- Postbake el photoresist negativo durante 1 min a 65 ° C y a 5 min a 95 ° C. Permita que la oblea se enfríe durante 1 min a temperatura ambiente.
- Desarrollar la capa de photoresist negativo durante 15 min en el primer baño de desarrollador (Tabla de materiales) y a 2 minutos en el segundo baño. Enjuague la oblea en el primer baño de isopropanol (IPA) durante 10 s y en el segundo baño de IPA para 10 s.
- Hardbake el photoresist negativo durante 30 min a 200 ° C y la oblea se enfríe durante 5 minutos a temperatura ambiente.
- Medir el espesor de la capa de photoresist negativo utilizando a un analizador de superficie.
- Colocar la oblea en un desecador conectado a una bomba de vacío y añadir 200 μL de silano (trichloro(1H,1H,2H,2H-perfluorooctyl)silane). Encienda la bomba durante 10 minutos, luego apáguelo y mantenga la oblea en el desecador durante 4 horas.
2. fabricación pasos y el conjunto de capas PDMS
- El polímero de polidimetilsiloxano (PDMS) antes del molde (base PDMS: agente endurecedor = 10:1 (w/w)) y extraiga el gas en una cámara de vacío por 2 h.
- Cura de PDMS a 80° C en un horno de aire expulsado durante la noche.
- Pele los PDMS de la oblea de silicio.
- Perforar los agujeros 1A - 3B (figura 1) y la cultura de esferoide bien. Use un punzón de 2 mm de diámetro de agujeros 1A - 3B y un diámetro de 1 mm del sacador para el esferoide bien.
- Limpiar la losa PDMS y un cubreobjetos de vidrio (24 x 24 mm) con cinta adhesiva, pegando y despegando la cinta. Luego tratar la losa PDMS con plasma aire 40 s (40 mW, 50 sccm).
- Enlace de la losa PDMS en el vidrio cubreobjetos para expulsar cualquier burbuja de aire de la superficie de la losa PDMS, cubreobjetos y curado a 80 ° C durante al menos 12 h.
3. esferoide preparación
Nota: En el estudio, la proteína fluorescente roja expresando umbilical humano vena células endoteliales (RFP-HUVECs) y proteína fluorescente verde expresando HUVECs (GFP-HUVECs) se utilizan en el esferoide y microcanales, respectivamente, para distinguir el origen de HUVECs después de la construcción de una red vascular perfusable. Si no es necesario el origen de HUVECs, HUVECs son suficientes para el experimento.
- Descongelar la RFP-HUVECs (3,0 × 105 células/frasco) y fibroblastos de pulmón humano (hLF) (1,0 × 106 células/frasco) y añadir a 10 mL de medio para las células endoteliales y células del fibroblasto, respectivamente (Tabla de materiales). La cultura les en un plato de 100 mm a 37 ° C y 5% CO2 para 2-3 días para el confluente HUVECs RFP y hLFs. Esta preparación dará ~ 200 esferoides.
- Separar el RFP HUVECs y hLFs de los platos con 2 mL de tripsina 0,05%-EDTA y detener la reacción de la tripsina con 4 mL de DMEM con 10% (v/v) de suero bovino fetal (FBS) y 1% (v/v) penicilina/estreptomicina.
- Después de la centrifugación a 220 x g durante 3 min, eliminar el sobrenadante y resuspender el RFP HUVECs y hLFs en el medio endotelial a concentración celular final 2,5 × 104 y 1,0 × 105 células/mL, respectivamente.
- Suavemente agregar 200 μL de la suspensión de células (5.000 células de RFP HUVECs) y 20.000 células para hLFs por pozo en una placa de 96 pocillos con superficie de enlace bajas.
- Incubar la placa de 96 pocillos en 37 ° C y 5% CO2 para un período de 2 a 4 días.
Nota: Puesto que el diámetro de esferoide depende el período de cultivo y el número de células iniciales en la placa de 96 pozos, puede ser controlada por estos dos parámetros.
4. célula de siembra en el dispositivo de microfluidos
Nota: La Convención de nomenclatura para los agujeros, canales y el esferoide bien se demuestran en la figura 1. Entendemos por día 0 el día cuando se termina la recolección de celulares en el dispositivo de microfluidos. Esquema de las líneas de tiempo experimental se muestra en la figura 2.
- Carga de esferoide día −1)
Nota: El siguiente paso debe realizarse en hielo para evitar la gelificación de colágeno y fibrina.- Disolver el fibrinógeno en tampón fosfato salino (PBS) para una concentración final de 2,80 mg/mL.
- Preparar el colágeno neutralizado (3.0 mg/mL en PBS) según protocolo del fabricante.
- Combinar 107.2 μl de solución de fibrinógeno (2,80 mg/mL), 8.0 μL de colágeno neutralizado (3.0 mg/mL) y 3.6 μl de aprotinina (5 U/mL) por reacción en un tubo. Esta solución se denomina "solución mix master" (MS).
Nota: El volumen es suficiente para la carga de un esferoide. Si hay más de un esferoide, multiplique cada volumen por el número de esferoides. - Trombina en PBS para una concentración final de 50 U/mL se disuelven.
Nota: Alícuotas de 50 trombina U/mL (20 μl/tubo) se almacenan a −30 ° C y se descongelan antes de cada experimento. - Coloque la placa de 96 pocillos que contienen esferoides dentro del gabinete de seguridad de la biotecnología.
- Preparar dos platos de Petri de 35 mm dentro de la bioseguridad de gabinete, con un plato en el hielo (plato 1) y el otro plato sobre la mesa (plato 2). Pipeta 99 μl de MS en el centro del plato 1 (figura 3a) para formar una gota.
- Recortar las puntas de 2 amarillos (10-100 μL) y 3 claras las puntas de pipeta (1-100 μL) de la colección de esferoides de la placa de 96 pocillos, mezcla de trombina con MS, colección precisa de los esferoides, inyección de los esferoides en el dispositivo e inyección de medios de comunicación en el dispositivo , respectivamente. El tamaño del poro de la punta debe ser ligeramente mayor que el diámetro de los agujeros 1A - 3B de los canales 1 y 3 o el esferoide en canal 2 para un ajuste preciso ajuste.
Nota: En adelante, a menos que se indique lo contrario, use las puntas de pipetas en este paso. La fotografía de corte puntas está disponible en la figura 4. - Recoger un esferoide con 100 μl de medio de la placa de 96 pocillos y agregar al plato 2 (figura 3a).
- Recoger el esferoide con volumen mínimo de los medios de comunicación del plato 2. Mientras sujeta la pipeta vertical, el esferoide debe moverse hacia la parte inferior de la punta de la pipeta por gravedad. Expulsar el esferoide tocando la punta de la pipeta en el menisco de la gota de MS en plato 1 (figura 3a).
Nota: Los pasos siguientes 4.1.10 y 4.1.11 deben realizarse rápidamente. - Añadir 1 μl de la trombina (50 U/mL) y mezclar suavemente con la punta de pipeta amarilla.
- Con la pipeta a 7 μl, recoger el esferoide y lentamente lo coloca en el pozo del esferoide (figura 3b).
- Incubar por 15 min a 37 ° C para la congelación de la fibrina.
- Inyecte lentamente el medio endotelial de agujeros 1A y 3A y llenar los canales 1 y 3 con los medios de comunicación (20 ~ 30 μL/canal).
- Coloque el dispositivo en un plato de 100 mm con un Kimwipe húmedo para evitar la evaporación de los medios desde el dispositivo (Figura 3C).
- Coloque el dispositivo en 37 ° C y 5% de CO2 durante 24 h eliminar las burbujas en la interfase entre los medios y la fibrina.
- Día 0) HUVECs carga
- Descongelar la GFP-HUVECs (3.0 x 105 células/vial) y añadir a 10 mL del medio endotelial. La cultura les en un plato de 100 mm a 37 ° C y 5% CO2 para 2-3 días llegar a sub-confluencia. Un plato de los confluentes GFP-HUVECs es suficiente para la preparación de dispositivos 8-10.
- Separar GFP-HUVECs de los platos con 2 mL de tripsina 0,05%-EDTA y detener la reacción de la tripsina con 4 mL de DMEM con 10% (v/v) de suero bovino fetal (FBS) y 1% (v/v) penicilina/estreptomicina.
- Después de la centrifugación a 220 x g durante 3 min, Resuspender el GFP-HUVECs en medio endotelial en 5.0 x 106 células/mL.
- Inyectar la suspensión de células HUVECs en canal 1 a través del agujero 1B (20 μl/canal).
- Incline el dispositivo de microfluidos 90°, coloque en el lado e incubar a 37 ° C por 30 minutos asegurar que el HUVECs se adhieren a la fibrina en el canal 2.
- Confirmar la fijación de HUVECs en la fibrina. Cuando el número de HUVECs en la interfaz entre el gel y el medio no es suficiente, la vasculatura puede desconectarse en la raíz vascular después de algunos días de la cultura del dispositivo (figura 5). En el protocolo, la tasa de éxito de la perfusión es > 50%.
- Repita los pasos 4.2.4 y 4.2.5 canal 3.
- Células en cultivo en un plato de 100 mm con un Kimwipe humedecido a 37 ° C y 5% de CO2 por 7-14 días.
- Día 1 ~) Media exchange
- La mitad de los medios de comunicación en canales 1 y 3 cambio de cada día.
5. tinción de núcleos
- Preparar 4% paraformaldehido (PFA) en PBS.
- Quitar los medios de comunicación de los canales 1 y 3 y añadir 20 μl del 4% PFA por canal. Para sustituir la solución en 4% PFA, repetir eliminar la solución desde el dispositivo y agregar 4% PFA tres veces.
- Incubar el dispositivo a 4 ° C durante la noche.
- Quitar 4% PFA desde el dispositivo y el lavado de los canales tres veces con PBS.
- Añadir 20 μl de 10 μg/mL del colorante fluorescente (Tabla de materiales) por canal para teñir los núcleos celulares. Para cambiar la solución en el dispositivo, repita el eliminar la solución desde el dispositivo y agregar 10 μg/mL el tinte fluorescente tres veces.
- Guarde el aparato a 4 ° C por 24 h.
6. líquida perfusión de un esferoide
- Preparar el esferoide después de cultivo de más de 7 días en el equipo de 37 ° C y 5% CO2 para la realización de una vía vascular continua.
- Retire el medio de 3B, 1B, 3A y 1A de los agujeros.
- Introducir 10 μl de solución 10 μm isotiocianato de fluoresceína (FITC)-dextrán en PBS en los agujeros 1A y 1B.
- Controlar el flujo de microesferas o tinte FITC bajo un microscopio invertido.
7. cuantificación de la longitud de brotes
Nota: Software versión 1.49 de ImageJ se utiliza para todos los análisis de la imagen en este estudio.
- Se superponen las imágenes de GFP HUVECs días 0, 1, 3, 5 y 7.
- Reste la posición de la punta de la vasculatura del día 0 de la misma posición en imágenes tomadas en los días 1, 3, 5 y 7.
- Determinar el crecimiento de la punta vascular desde la posición de la raíz (figura 6). La distancia entre la punta vascular y raíz se define como la longitud de brotes en este estudio (figura 7b).
8. cuantificación de los ángulos Vascular
Nota: El ángulo Vascular se definió como el ángulo consistió en ángulo vascular, raíz y el centro del esferoide (figura 7 c).
- Binarize las imágenes fluorescentes de la esferoide de cocultivo con RFP HUVECs y medir la posición de "centroide" por la función de análisis en ImageJ. En este estudio, la posición de medida "centroide" se define como el centro del esferoide (figura 6).
- Determinar la posición de los vasculares y las raíces de la misma manera en el paso 7.
- Medir los ángulos vasculares utilizando la función de análisis en el software ImageJ.
Resultados
La figura 1 muestra un diseño y una foto del dispositivo microfluídico. Tiene tres canales paralelos, en que canal 2 contiene el esferoide bien. Canales 1 y 3 se utilizan para el cultivo HUVEC y canal 2 es para el esferoide. Cada canal está separada por microposts trapezoidal diseñado para patrón de PDMS. Los microposts que no el hidrogel en canal 2 en canales 1 y 3 por tensión superficial y permiten el intercambio de sustancias entre el esferoide y HUVECs en microcanales28.
La Figura 7a muestra el centro de un dispositivo de microfluidos después de la siembra de la célula. Campo brillante y fluorescentes imágenes tomadas en el día 0 demuestran que el gel de fibrina llena sólo canal 2 sin pérdidas en los canales 1 y 3, y HUVECs correctamente conectado a la pared lateral del gel de fibrina. La imagen de campo claro está enfocado en el tanto el esferoide cargado y microposts, indicando que el esferoide correctamente colocado en la parte inferior del dispositivo. Los brotes angiogénicos se observan en el día 1 y la longitud de los brotes aumenta con el tiempo (figura 7b). El día 3, el brote más largo alcanza el esferoide y el día 7, la mayoría de los brotes angiogénicos alcanzó el esferoide (distancia media de los canales 1 y 3 para el esferoide < 500 μm). En el mejor de los casos, se observan después de 4 días en cultura de dispositivo, flujo a través de los lúmenes vasculares. El ángulo vascular se definió como las direcciones de la punta vascular y el centro del esferoide de la raíz vascular. C de la figura 7 muestra el ángulo vascular cuantificado durante 7 días en la cultura del dispositivo. Los ángulos vasculares disminución de una manera dependiente del tiempo, indicando que los brotes angiogénicos emigraron hacia el esferoide.
Figura 8 muestra la sección de la red vascular donde HUVECs RFP y GFP-HUVECs han fusionado. RFP-HUVECs y GFP-HUVECs coordinadamente formaron un solo lumen vascular como cabezas de la flecha, que claramente indican brotes angiogénicos de canales 1 y 3 anastomosada a HUVECs RFP en el esferoide y forman una red vascular continua. Para confirmar la perfusability de la red vascular, FITC-los dextranos se inyectan en el canal 1. FITC-los dextranos en canal 1 fluyeron en la construcción red vascular y el interior de la esferoide y finalmente llegaron a canal 3 (figura 9). Durante la perfusión de solución de FITC-los dextranos, no hay ninguna salida de la red vascular en el espacio extravascular. Previamente fue demostrado que inyectan en el lumen vascular las moléculas pequeñas pasan a través de la pared vascular y reaccionan con las células en las regiones extravasculares. Además, el coeficiente de permeabilidad de la red vascular fue demostrado para estar cerca de eso en vivo27. Estos resultados implican que la red vascular integradora podría suministrar los nutrientes para el esferoide y eliminar el residuo.
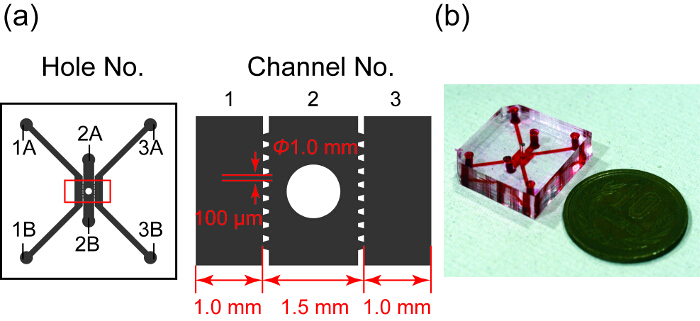
Figura 1 : Diseño y una fotografía del dispositivo microfluídico. (a) Resumen del diseño del dispositivo de microfluidos. Área gris indica tres canales de microfluidos separados por microposts trapezoidal. Canal 2 tiene un pozo para una cultura de esferoide. Figura derecha muestra la vista ampliada en el rectángulo rojo en la izquierda. (b) fotografía del dispositivo microfluídico cuyos canales están llenos de tinta roja. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2 : Experimental tiempo. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3 : Método para cargar un esferoide en el dispositivo de microfluidos. (a) haciendo una caída de MS y los medios de comunicación con un esferoide en dos platos separados. Luego, transferir el esferoide en MS con trombina. (b) vista seccional esquema del dispositivo durante la inyección del esferoide. Salga el exceso de gel a través de los agujeros 2A y 2B. Sin embargo, el esferoide permanece en la parte inferior del dispositivo debido al confinamiento físico. (c) esquema de los dispositivos cuando están en una incubadora. Kimwipe húmedo se coloca en un plato de 100 mm y dos platos de 35 mm con el dispositivo fueron puestos encendido el Kimwipe. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4 : Las fotografías de las puntas de pipeta de corte para siembra al dispositivo celular. La izquierda punta blanca es para agujeros 1A, 1B, 3A y 3C y transferencia esferoide a una gota de gel de fibrina (pasos 4.1.9, 4.1.13, 4.2.4 y 4.2.6). El media punta amarilla es para la colección del esferoide de 96 pocillos (paso 4.1.7). La punta derecha de color blanco es para el bien del esferoide (paso 4.1.11). En la fotografía también se muestran las puntas antes de corte. Haga clic aquí para ver una versión más grande de esta figura.
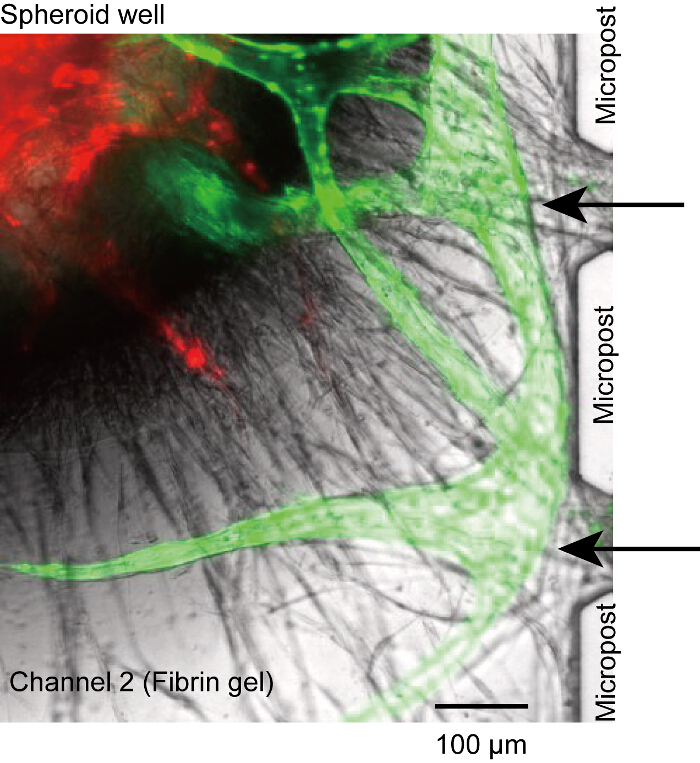
Figura 5 : No perfusable vasculatura. Brotes angiogénicos de microcanales no se conectaron a la abertura entre microposts y perdieron la conexión entre la luz y microcanales (flechas negras). Es causada por las insuficiente HUVECs sembradas en canales 1 y 3. Rojo: HUVECs de RFP en el esferoide, verde: GFP-HUVECs de microcanales. Las células fueron cultivadas en el dispositivo durante 14 días. Haga clic aquí para ver una versión más grande de esta figura.

Figura 6 : Definición de la raíz vascular, punta y el centro de la esferoide. (a) el método para determinar la posición de la raíz vascular y punta para medir la longitud de brotes. Después de alinear las imágenes fluorescentes Time-lapse, se resta la imagen fluorescente tomada pocos días después el cultivo en el dispositivo de la imagen en el día 0. Medimos la longitud de los brotes después de la sustracción por el software ImageJ. (b) definición del centro del esferoide. Las imágenes fluorescentes de las RFP HUVECs binarizadas y medidas en su centroide software ImageJ. Definimos el centroide es el centro del esferoide. Haga clic aquí para ver una versión más grande de esta figura.
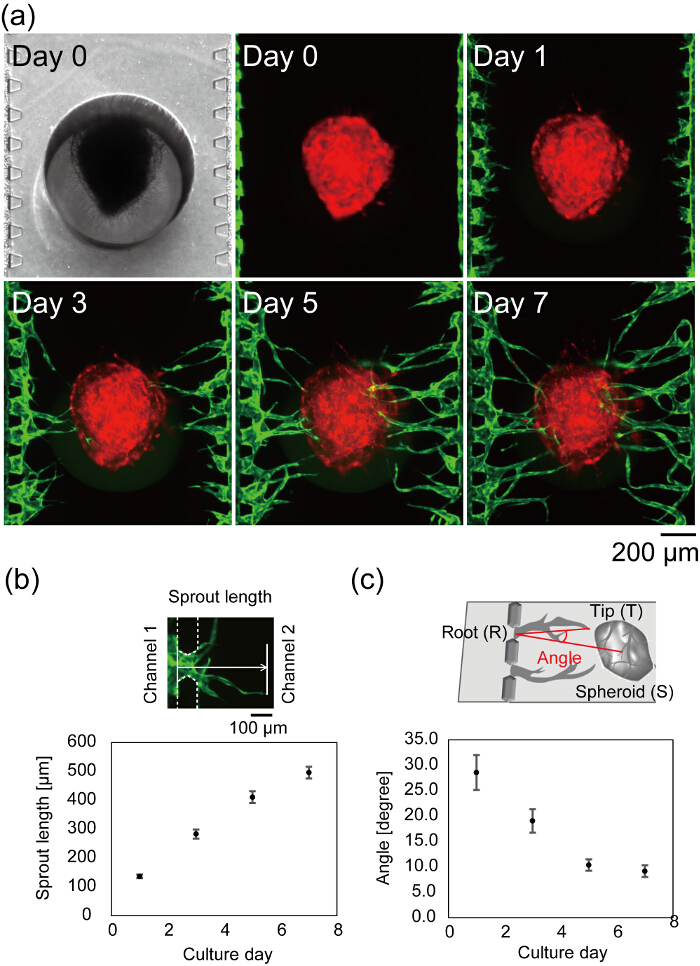
Figura 7 : Formación de una red vascular en el dispositivo de microfluidos. (a) imágenes Time-lapse de un centro de un dispositivo de microfluidos después de la siembra de la célula. Rojo: RFP HUVECs cultivan en el esferoide, verde: GFP-HUVECs cosechadas en canales 1 y 3. Análisis cuantitativo de la longitud de brotes (b) y el ángulo vascular (c) (n = 42 brotes de 3 dispositivos, las barras de error indican los errores estándar (S.E.)). La longitud del brote se definió como la distancia desde la posición de HUVECs en el día 0 hasta el extremo vascular (b, arriba). El ángulo (∠TRS) fue definido por la raíz vascular (R), punta (T) y el centro del esferoide (S) (c, arriba). Vea la figura 6 para la definición de raíz vascular, punta y el centro del esferoide. Estos datos se obtuvieron usando el software ImageJ. Se modifican los esquemas explicando la definición de la longitud del brote y el ángulo vascular de Nashimoto, Y. et al. 27. haga clic aquí para ver una versión más grande de esta figura.

Figura 8 : La formación del lumen vascular por HUVECs de microcanales y el esferoide. (a) imagen fluorescente de la descripción de la muestra después de 14 días en cultura de dispositivo. Rectángulo amarillo indica la posición x-y de la sección óptica que se muestra en (b). (b) x-y, y z y x z sección óptica de la red vascular construida. Las flechas blancas indican lumen vascular. Rojo: RFP HUVECs cultivan en el esferoide, verde: GFP-HUVECs cultivadas en los microcanales, azul: núcleos celulares. (a) no muestra ninguna fluorescencia azul porque (a) es la imagen antes de la fijación. Haga clic aquí para ver una versión más grande de esta figura.
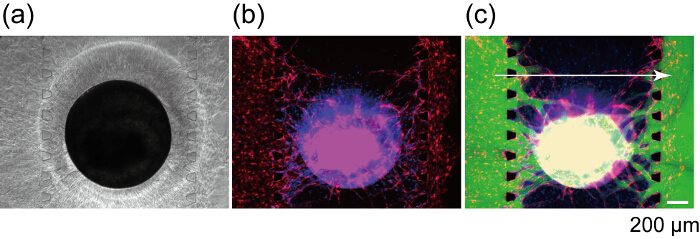
Figura 9 : Perfusión de un esferoide usando una red vascular construcción. Campo brillante (a) y fluorescentes (b) imágenes del esferoide después de 7 días en cultura de dispositivo. (c) imagen fluorescente de la esferoide mismo después de FITC-los dextranos (70 kDa) de carga. Rojo: HUVECs de RFP en el esferoide y canales 1 y 3, verde: FITC-los dextranos, azul: núcleos celulares. Haga clic aquí para ver una versión más grande de esta figura.
Archivo complementario 1: el diseño del dispositivo microfluídico. El archivo está en formato dxf. Haga clic aquí para descargar este archivo.
Discusión
Informes anteriores muestran que hLFs secretan un cóctel de varios factores angiogénicos, como angiopoyetina-1, angiogenina, factor de crecimiento, transformación de factor de crecimiento-α, factor de necrosis tumoral y algunas de las proteínas de matriz extracelular29, 30. Este ensayo se basa en la secreción de angiogenic del hLFs en un esferoide de cocultivo, que es la limitación de la técnica. Por lo tanto, es fundamental para una formación vascular estable definir un esferoide de cocultivo en el fondo de un pozo por lo que puede acortar la distancia entre el esferoide de cocultivo y HUVECs en canales 1 y 3. La longitud vascular de fibroblastos era inversamente proporcional a la distancia entre las células endoteliales y fibroblastos31, de modo que la distancia más corta es ventajosa para formación vascular estable. Sin embargo, para abrir un agujero de esferoide (1 mm de diámetro) sin dañar los canales 1 y 3, el ancho mínimo de canal 2 fue 1,5 mm.
Aunque el esferoide se instala en la parte inferior del pozo, raíces vasculares de vez en cuando se desconectaron de los microposts o microcanales (figura 5). En este caso, no reactivo podría alcanzar el lumen vascular a través de microcanales (canales 1 o 3). Aunque no podríamos solucionar completamente este problema, creemos que el problema es debido al número insuficiente de HUVECs en la superficie del gel de fibrina (paso 4.2.1-4.2.6). Asegúrese de que el HUVECs estable fije a la pared lateral del canal 2.
Hacia la inyección acertada de un esferoide en el pozo, optimizar el diámetro interior y exterior de puntas de micropipeta en paso 4.1.7 es importante: 1) el diámetro interior debe ser mayor que la del esferoide. 2) el diámetro exterior debe encajar en el borde del pozo para que ninguna salida del gel se produce en la parte superior del pozo durante la inyección y la punta se puede quitar fácilmente después de la inyección de gel. En el presente Protocolo (φ1 mm de un esferoide bien), unos 700 μm es el diámetro máximo para el esferoide inyectable. Si el diámetro del pozo se diseña más grande que en el presente Protocolo, esferoides más grandes se pueden inyectar porque la punta se puede cortar para diámetros interiores. Diámetros de esferoide pueden controlarse fácilmente cambiando el número de células en la placa de 96 pocillos.
En primer lugar, este protocolo muestra microfluídicos novela plataforma para construir una red vascular perfusable en un esferoide. Aunque el cocultivo con HUVECs permite la formación de estructuras de buques en un esferoide18,23,24, éstos no fueron perfusable por los callejones del lumina. Porque pueden esperarse fibroblastos células existen en versátiles tejidos (hueso, adipocito y cáncer, etcetera), mediante la adición de algunas otras células apuntados para el esferoide de cocultivo, una vascularización de diversos tipos de esferoides, que puede mímico el en vivo medio ambiente mejor que la cultura convencional esferoide. Para ampliar la aplicación de la técnica, trabajo futuro incluiría la vascularización de esferoides sin la adición de células de fibroblasto. Algunos recientes trabajos Informe médula ósea células stromal32 y músculo las células33 puede inducir angiogénesis en los dispositivos microfluídicos. Utilización de las células del estromales o del músculo en lugar de las células del fibroblasto aumentaría el número de tejidos que puede ser vascularizado en el dispositivo de microfluidos. Este protocolo proporciona una plataforma básica para la vascularización del tejido, que es una técnica largamente esperada en el campo de las tres culturas dimensionales.
Divulgaciones
El autor declara que no tienen intereses financieros que compiten.
Agradecimientos
Este trabajo fue apoyado por cresta JST (número JPMJCR14W4), sociedad para la promoción de la ciencia (JSP) KAKENHI (número de concesión 25600060, 16 16386 K), el centro de innovación programa de MEXT y TJS, se centró en el desarrollo de la tecnología de clave evaluación de Agencia de Japón para investigación médica y el desarrollo, AMED, Mizuho Fundación para el fomento de las ciencias. Microfabricación fue apoyado por el centro de tecnología de Nano de la Universidad de Kyoto.
Materiales
| Name | Company | Catalog Number | Comments |
| AutoCAD 2017 | Autodesk | AutoCAD 2017 | |
| A chromium mask coated with AZP 1350. | CLEAN SURFACE TECHNOLOGY | CBL2506Bu-AZP | |
| Micro pattern generator | Heidelberg | uPG101 | |
| MF CD-26 developer | Rohm and haas electronic materials | - | Developer in protocol 1.4 |
| S-Clean | Sasaki Chemical | S-24 | Chromium etchant in protocol 1.5 |
| Aceton | Wako | 012-00343 | |
| Silicon Wafer | Canosis | SiJ-4 | |
| Spin Coater | MIKASA | 1H-D7 | |
| Hexamethyldisilazane (HMDS) | Tokyo Ohka Kogyo | H0089 | |
| SU-8 3050 | MicroChem | - | Negative photoresist in protocol 1.9 |
| UV Exposure | Nanometric Technology Inc | LA310s | |
| SU-8 Developer | MicroChem | Y020100 | Developer for the negative photoresist in protocol 1.13 |
| 2-propanol | Wako | 163-04841 | |
| Surface profiler | Veeco | Veeco Dektak XT-S | |
| (Trichloro (1H, 1H, 2H, 2H-perfluorooctyl) silane | Sigma | 448931 | |
| Polydimethylsiloxane (PDMS) | Dow Corning Toray | 184W/C | |
| Biopsy Punch (1.0mm) | Kai Industries | BP-10F | |
| Biopsy Punch (2.0mm) | Kai Industries | BP-20F | |
| Plasma System | Femto Science | COVANCE | |
| Cover glass | MATSUNAMI GLASS | C024241 | |
| Culture Dishes | Iwaki | 1000-035 | |
| RFP Expressing Human Umbilical Vein Endothelial Cell | Angio Proteomie | cAP-0001RFP | |
| Normal Human Lung Fibroblasts | Lonza | CC-2512 | |
| Endothelial Cell Growth Medium | Lonza | CC-3162 | |
| Fibroblast Growth Media Kits | Lonza | CC-3132 | |
| DMEM | Thermo Fisher Scientific | 11965092 | |
| Fetal Bovine Serum | Thermo Fisher Scientific | 26140079 | |
| Penicillin-Streptomycin Solution | Wako | 168-23191 | |
| 0.05w/v% Trypsin-0.53mmol/l EDTA• 4Na Solution with Phenol Red | Wako | 204-16935 | |
| PBS (Phosphate Buffered Salts) | Takara bio | T900 | |
| 96-well plate | Sumitomo bakelite | 631-21031 | |
| 1000ul Chip | NIPPON Genetics | FG-402 | |
| 200ul Chip | NIPPON Genetics | FG-301 | |
| 10ul Chip | NIPPON Genetics | 37650 | |
| CO2 incubator | Thermo Fisher Scientific | Model 370 | |
| GFP Expressing Human Umbilical Vein Endothelial Cell | Angio Proteomie | cAP-0001GFP | |
| Fibrinogen from bovine plasma | Sigma | F8630 | |
| Aprotinin from bovine lung | Sigma | A6279 | |
| Collagen I | Corning | 354236 | |
| Thrombin from bovine plasma | Sigma | T4648 | |
| Hoechst 33342 | Invitrogen | H21492 | Fluorescent dye to stain nuclei in protocol 5.5 |
| Paraformaldehyde Solution | Wako | 163-25983 | |
| Inverted Fluorescence Microscope | OLYMPUS | IX71 | |
| Degital CCD Camera | OLYMPUS | ORCA-R2 | |
| Confocal Laser Scanning Biological Microscope | OLYMPUS | FV1000 | |
| Inverted Fluorescence Microscope | OLYMPUS | IX-83 | |
| Fluorescein isothiocyanate-dextran | Sigma | FD70S |
Referencias
- Abbott, A. Cell culture: Biology's new dimension. Nature. 424 (6951), 870-872 (2003).
- Pampaloni, F., Reynaud, E. G., Stelzer, E. H. K. The third dimension bridges the gap between cell culture and live tissue. Nature Reviews Molecular Cell Biology. 8 (10), 839-845 (2007).
- Shamir, E. R., Ewald, A. J. Three-dimensional organotypic culture: experimental models of mammalian biology and disease. Nature Reviews Molecular Cell Biology. 15 (10), 647-664 (2014).
- Abu-Absi, S. F., Friend, J. R., Hansen, L. K., Hu, W. S. Structural polarity and functional bile canaliculi in rat hepatocyte spheroids. Experimental Cell Research. 274 (1), 56-67 (2002).
- Bissell, M. J., Radisky, D. C., Rizki, A., Weaver, V. M., Petersen, O. W. The organizing principle: microenvironmental influences in the normal and malignant breast. Differentiation. 70 (9-10), 537-546 (2002).
- Liu, Y., et al. Novel role for netrins in regulating epithelial behavior during lung branching morphogenesis. Current Biology. 14 (10), 897-905 (2004).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-U147 (2009).
- Torisawa, Y. S., Shiku, H., Kasai, S., Nishizawa, M., Matsue, T. Proliferation assay on a silicon chip applicable for tumors extirpated from mammalians. International Journal of Cancer. 109 (2), 302-308 (2004).
- Fennema, E., Rivron, N., Rouwkema, J., van Blitterswijk, C., de Boer, J. Spheroid culture as a tool for creating 3D complex tissues. Trends in Biotechnology. 31 (2), 108-115 (2013).
- Sutherland, R. M. Cell And Environment Interactions In Tumor Microregions - The Multicell Spheroid Model. Science. 240 (4849), 177-184 (1988).
- Rothbauer, M., Zirath, H., Ertl, P. Recent advances in microfluidic technologies for cell-to-cell interaction studies. Lab on a Chip. , (2017).
- Matsuura, K., Utoh, R., Nagase, K., Okano, T. Cell sheet approach for tissue engineering and regenerative medicine. Journal of Controlled Release. 190, 228-239 (2014).
- Esch, E. W., Bahinski, A., Huh, D. Organs-on-chips at the frontiers of drug discovery. Nature Reviews Drug Discovery. 14 (4), 248-260 (2015).
- Bhatia, S. N., Ingber, D. E. Microfluidic organs-on-chips. Nature Biotechnology. 32 (8), 760-772 (2014).
- Lancaster, M. A., Knoblich, J. A. Organogenesis in a dish: Modeling development and disease using organoid technologies. Science. 345 (6194), (2014).
- Hirschhaeuser, F., et al. Multicellular tumor spheroids: An underestimated tool is catching up again. Journal of Biotechnology. 148 (1), 3-15 (2010).
- Lancaster, M. A., et al. Cerebral organoids model human brain development and microcephaly. Nature. 501 (7467), 373 (2013).
- Takebe, T., et al. Vascularized and functional human liver from an iPSC-derived organ bud transplant. Nature. 499 (7459), 481 (2013).
- Taguchi, A., et al. Redefining the In Vivo Origin of Metanephric Nephron Progenitors Enables Generation of Complex Kidney Structures from Pluripotent Stem Cells. Cell Stem Cell. 14 (1), 53-67 (2014).
- Takasato, M., et al. Kidney organoids from human iPS cells contain multiple lineages and model human nephrogenesis. Nature. 526 (7574), 564-568 (2015).
- Auger, F. A., Gibot, L., Lacroix, D., Yarmush, M. L. . Annual Review of Biomedical Engineering. 15, 177-200 (2013).
- Inamori, M., Mizumoto, H., Kajiwara, T. An Approach for Formation of Vascularized Liver Tissue by Endothelial Cell-Covered Hepatocyte Spheroid Integration. Tissue Engineering Part A. 15 (8), 2029-2037 (2009).
- Kunz-Schughart, L. A., et al. Potential of fibroblasts to regulate the formation of three-dimensional vessel-like structures from endothelial cells in vitro. American Journal of Physiology-Cell Physiology. 290 (5), C1385-C1398 (2006).
- Rouwkema, J., De Boer, J., Van Blitterswijk, C. A. Endothelial cells assemble into a 3-dimensional prevascular network in a bone tissue engineering construct. Tissue Engineering. 12 (9), 2685-2693 (2006).
- Kim, S., Lee, H., Chung, M., Jeon, N. L. Engineering of functional, perfusable 3D microvascular networks on a chip. Lab on a Chip. 13 (8), 1489-1500 (2013).
- Moya, M. L., Hsu, Y. H., Lee, A. P., Hughes, C. C. W., George, S. C. In Vitro Perfused Human Capillary Networks. Tissue Engineering Part C-Methods. 19 (9), 730-737 (2013).
- Nashimoto, Y., et al. Integrating perfusable vascular networks with a three-dimensional tissue in a microfluidic device. Integrative Biology. 9 (6), 506-518 (2017).
- Huang, C. P., et al. Engineering microscale cellular niches for three-dimensional multicellular co-cultures. Lab on a Chip. 9 (12), 1740-1748 (2009).
- Newman, A. C., et al. Analysis of Stromal Cell Secretomes Reveals a Critical Role for Stromal Cell-Derived Hepatocyte Growth Factor and Fibronectin in Angiogenesis. Arteriosclerosis Thrombosis and Vascular Biology. 33 (3), 513 (2013).
- Newman, A. C., Nakatsu, M. N., Chou, W., Gershon, P. D., Hughes, C. C. W. The requirement for fibroblasts in angiogenesis: fibroblast-derived matrix proteins are essential for endothelial cell lumen formation. Molecular Biology of the Cell. 22 (20), 3791-3800 (2011).
- Griffith, C. K., et al. Diffusion limits of an in vitro thick prevascularized tissue. Tissue Engineering. 11 (1-2), 257-266 (2005).
- Zheng, Y., et al. Angiogenesis in Liquid Tumors: An In Vitro Assay for Leukemic-Cell-Induced Bone Marrow Angiogenesis. Advanced Healthcare Materials. 5 (9), 1014-1024 (2016).
- Osaki, T., Sivathanu, V., Kamm, R. D. Crosstalk between developing vasculature and optogenetically engineered skeletal muscle improves muscle contraction and angiogenesis. Biomaterials. 156, 65-76 (2018).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados