Method Article
В естественных условиях Мониторинг суточного часов экспрессии генов в мыши Супрахиазмальное ядро с помощью флуоресценции Репортеры
В этой статье
Резюме
Этот недавно разработанный на основе флуоресценции технология позволяет долгосрочный мониторинг транскрипцию генов суточного часов в Супрахиазмальное ядро (SCN) свободно перемещения мыши в режиме реального времени и с высоким временным разрешением.
Аннотация
Этот метод сочетает в себе опосредованного волоконно-оптических флуоресценции записей с точной доставки рекомбинантных аденоассоциированный вирус на основе гена репортеров. Этот новый и простой в использовании в vivo флюоресценция системы мониторинга была разработана для записи transcriptional ритм часы гена, Cry1, в Супрахиазмальное ядро (SCN), свободно движущихся мышей. Чтобы сделать это, репортер флуоресценции транскрипции Cry1 был разработан и упакованы в аденоассоциированный вирус. Очищенных, концентрированных вирус был введен в ППП, следуют вставки оптического волокна, который затем был установлен на поверхности мозга мыши. Животные были возвращены их дома клетки и позволило послеоперационное восстановление 1-месячный период для обеспечения достаточной репортер выражение. Флуоресценции затем был записан в свободно перемещающихся мышей через в vivo система мониторинга, которая была построена в нашем заведении. В естественных условиях система записи 488 нм лазер был увязан с 1 × 4-splitter луча, разделить четыре лазерного возбуждения выходы равной силы света. Эта установка позволила нам запись из четырех животных одновременно. Каждый из сигналов испускаемого флуоресценции была собрана через трубу фотоэлектронный умножитель и сбор данных карты. В отличие от предыдущих биолюминесценции в естественных условиях технике суточного часов записи, этот флуоресценции в vivo система записи допускается запись выражения гена суточного часов во время свет цикла.
Введение
В млекопитающих Супрахиазмальное ядро (SCN) регулирует суточный ритм всего тела для координации реагирования индивида на экзогенных экологических изменений (например, свет, температура, напряжение и т.д.)1. Основные компоненты часы состоят из Per1-3, Cry1-2, будильники Bmal1и играть центральную роль в регулировании суточного часов каждой ячейки. Каждая ячейка в ППП содержит transcriptional активатор, часы/BMAL1, который действует как гетеродимера побудить выражение % и ПЛАКАТЬ. PER / CRY комплекс затем угнетает функции часы/BMAL1 для формирования обратной транскрипции перевод, что занимает около 24 ч до полного2,3.
Предыдущие исследования на СКС главным образом использовали ex vivo SCN ломтик культуры метод4,5,6 , и, хотя этот подход предоставляет ценную информацию, ее ограничения препятствуют нашей способности получение данных относительно влияния других ядер головного мозга на СКС, а также воздействия внешних раздражителей (например, свет) на клетки, проживающих в этой критической области. В 2001 году Хитоси Окамура группы был первым для использования системы биолюминесценции в vivo экспрессии генов монитор суточного часов в ППП в свободно перемещающихся мышей7. Кен ити Хонма группы провел за последние несколько лет, развивая биолюминесценции в vivo система записи в SCN8,9,10. Вместе эти исследования предоставили исследователям возможность контролировать суточного часов в постоянной темноты или после светового импульса. Однако потому что биолюминесценция слишком тусклыми, чтобы обеспечить непрерывный мониторинг во время цикла свет/темно, в сочетании с тем фактом, что свет является преобладающим сигнал, необходимые для СКС опосредованной уноса суточного часы11, есть растущий спрос на разработки экспериментальных методов, которые преодолеть ограничения, связанные с записью биолюминесценции. Текущий отчет описывает флуоресценции балльной системе, которая была построена для мониторинга суточного часов ППП в естественных условиях в свободно перемещающихся мышей. Этот простой в использовании метод позволяет непрерывный мониторинг во время цикла свет/темно и позволяет для долгосрочного наблюдения транскрипцию генов суточного часов в ППП в режиме реального времени и с высоким временным разрешением.
протокол
Все процедуры в этом протоколе были проведены с одобрения институциональный уход животных и использование Комитет (IACUC) Национальный институт биологических наук, Пекин, в соответствии с положениями правительства Китая.
1. Строительство Cry1 флуоресценции репортер
Примечание: Ранее суточного исследования с использованием биолюминесценции системы2,12,13 предохранитель суточного промоутер с дестабилизировали Люцифераза (dLuc), чтобы побудить художественной dLuc выражение. Разработка флуоресценции репортер, дестабилизировали Люцифераза был заменен дестабилизировали флуоресценции белков (dVenus) чтобы побудить художественной dVenus выражение. Поколение P (Cry1)-dВенера репортер описано ниже, конструкция которого представляется в настоящее время Addgene и будет доступна скоро для академического использования.
- Усилить функциональные мыши Cry1 промоутер (был регион-1208 bp гена Cry1 , транскрипция стартовый сайт назначен-'' 1 ''). Использование ПЦР фермента (код плюс Neo), грунты F1 и R1 (см. таблицу 2), мышь генома как шаблон и производителя ПЦР протокола для того чтобы усилить фрагмента ДНК промоутер Cry1 .
- Усилить Интрон 336 гена Cry1 , которая имеет важное значение для функции суточного часов Cry114. Использование ПЦР фермента, грунтовки F2 и R2, геном мыши как шаблон и производителя протокол PCR усиливает Интрон 336 фрагмент ДНК.
- Усилить Венеры. Использование ПЦР фермента, грунтовки F3 и R3, плазмида pVENUS-N1 как шаблон и производителя протокол PCR усиливает фрагмента ДНК Венеры .
- Усилить фрагмента ДНК NLS-D2. Использование ПЦР фермента, грунтовки F4 и R4, плазмида pcDNA3.3-d2eGFP как шаблон и производителя протокол PCR усиливает фрагмента ДНК NLS-D2.
- Синтезировать фрагмент ДНК 1 как экзона 1.
- Синтезировать фрагмент ДНК 2 как компоновщик между Интрон 336 и фрагмент ДНК Венеры .
- Вырезать-двойной pAAV EF1a floxed-hChR2 (H134R) - mCherry - WPRE-HGHpA вектор плазмиды с MluI и EcoRI ферменты. Используйте комплект для извлечения геля для очистки больших фрагментов ДНК. Используйте протокол изготовителя.
- Используя сочетание Ассамблеи Гибсон и его стандартный протокол, соберите все фрагменты ДНК вместе, чтобы произвести-intron336-Venus-NLS-D2-WPRE-HGHpA репортер pAAV-P (Cry1). Используйте протокол изготовителя.
2. производство аденоассоциированный вирус15
- Подготовить следующие плазмида ДНК запасов: 31.25 мкг pRV1, 31,25 мкг pH21, 125 мкг pFdelta6 и 62,5 мкг pAAV-P (Cry1) - intron336 - Венера-NLS - D2-WPRE-HGHpA.
- Подготовить пять блюд 15 см 293T клеток и подождать до тех пор, пока клетки становятся 90% притока.
- Transfect плазмид в после реагент протокол transfection клетки 297T. Для каждого блюдо, используйте 6,25 мкг pRV1, 6.25 мкг pH21, 25 мкг pFdelta6, 12,5 мкг pAAV-P (Cry1)-intron336-Venus-NLS-D2-WPRE-HGHpA и 120 мкл Реагента transfection.
- 72 ч после трансфекции, отсоединить клетки от каждой пластины с помощью пипетки пистолет; урожай клетки в две пробирки 50 мл.
- Пелле клетки на 800 x g 10 мин и удалить супернатант. Вымыть клетки, поместив 20 мл физиологического раствора фосфатного буфера (PBS) в каждую пробирку; Пелле клетки на 800 x g за 10 мин и отбросить супернатант.
- Ресуспензируйте окатышей в 150 мм NaCl и 20 мм трис раствор, рН 8,0; Использование 25 мл раствора/трубки. Добавьте 1,25 мл свежеприготовленные Дезоксихолат натрия 10% (в dH2O) к каждой трубе. Добавить benzonase Нуклеаза в конечной концентрации 50 единиц / мл и тщательно перемешать. Инкубируйте при 37 ° C в течение 1 ч.
- Удаление сотовой мусора центрифугированием в 3000 x g за 15 мин. Далее Убедитесь, что все мусора была удалена нажатием смесь через фильтр шприц 0,45 мкм; Этот шаг поможет предотвратить блокирование столбцов гепарина.
- Настройка колонок гепарина, с использованием перистальтического насоса; Установите скорость потока в 1 мл/мин, обеспечивая, что нет пузырьков воздуха вводятся в столбцы.
- Сбалансировать столбцы с 10 мл 150 мм NaCl, 20 мм трис раствор, рН 8.0. Добавьте решение, содержащее вирус для каждого столбца. Вымойте столбцы с 20 мл в 100 мм NaCl, 20 мм трис раствор, рН 8.0. Затем используя шприц 5 мл, вымойте столбцы с 1 мл раствора NaCl 200 мм и 20 мм трис раствор pH 8.0, следуют 1 мл 300 мм NaCl и 20 мм трис раствор, рН 8.0.
- Используйте шприц 5 мл для элюировать вирус с 3 мл 400 мм NaCl, 20 мм трис раствор, рН 8,0, следуют 4 мл 450 мм NaCl, 20 мм трис раствор, рН 8.0 и, наконец, 3 мл 500 мм NaCl , 20 мм трис раствор, рН 8.0. Соберите извлеченные материалы.
- Для концентрации рекомбинантных аденоассоциированный вирус (rAAV) Загрузите извлеченные материалы, 4 мл, в то время, в центробежного фильтра единиц с 100000 молекулярной массой отсечки. Центрифуга для каждого 4-мл образца в 2000 x g 5 мин при комнатной температуре, отбрасывая потока через.
- Когда все извлеченные материалы были выполнены через подразделения центробежного фильтра, добавить 4 мл PBS и центрифуги смесь в приблизительно 250 мкл. Удалить rAAVs (титр вирусных должно быть около 2-8 x 1012 вирусных частиц на мл) от центробежного фильтра единиц, Алиготе и хранить при температуре-80 ° C до использования. На данном этапе вирус может храниться в течение нескольких месяцев.
3. rAAV инъекции и оптические волокна вставки в взрослых SCN мыши
- Инъекции rAAVs репортер нося суточного флуоресценции в СКС
- Загрузить 5 мкл rAAV (титр вируса составляет около 2-8 x 1012 вирусных частиц на мл) в микро шприц.
- Анестезировать взрослых мышь (2 - до 5-месячного, фон C57BL/6) с нембуталовым (80 мг/кг) через внутрибрюшинной инъекции. Проверить наличие достаточной глубины анестезии, отсутствие реакции мыс пинча.
- Используйте ножницы, чтобы удалить меха из головы мыши, а затем смонтировать мыши в стереотаксического аппарата. Предоставлять источник тепла наркотизированных животных через одеяло циркулирующей горячей водой или другим нагревательным устройством.
Примечание: в качестве альтернативы используйте депиляционный крем или электрические машинки для стрижки для удаления мех. - Очистите хирургической сайта с соответствующей дезинфекции агентов. Например это может включать стерильную воду или алкоголь и йода, Бетадин, или разбавлять хлоргексидина в переменном скрабы. Повторите по крайней мере 3 раза. Драпировка хирургической сайта.
- Используйте ножницы, чтобы сделать надрез в коже головы и разоблачить черепа.
- Отрегулируйте стереотаксического аппарата, так что bregma и лямбда находятся в той же горизонтальной плоскости; сделать два симметричных точек bregma в той же горизонтальной плоскости.
- Использование стерильным ватным тампоном смоченной в 4% H2O2/h2O вытравить мозга надкостницы. Затем используйте чистый, стерильным ватным тампоном и сухой поверхности черепа.
- С помощью микро сверла, сделайте отверстие около 1 мм диаметром 0,46 мм задняя и 0,25 мм бокового к bregma.
- Интернет Используйте чистый хлопок стерильным тампоном с решением физиологического раствора для очистки костных фрагментов из внешней поверхности мозга.
- Вставьте микро шприц в мозг, обеспечение того, что кончик микро шприц 0,46 мм задняя и боковые 0,25 мм bregma, и 5,7 мм глубиной от поверхности черепа.
- Придать 500 nL rAAV (50 nL мин-1) в ППП, оставляя микро шприц в место для 10 мин после инъекции для обеспечения полного распространения rAAV.
- Медленно снять микро шприц.
- Вставьте оптического волокна в области СКС.
- Использование оптического волокна нож, вырезать волокна 17-мм в длину, убедившись, что каждой стороне оптического волокна гладкой.
- Вставьте оптического волокна керамические обойма и зафиксировать оптоволокна для керамических обойма с перекиси метилэтилкетона (AB клей), обеспечение потолочные поверхности оптического волокна и керамические обойма.
- Очистите волокно с холодной sterilant раствора или этилена оксид.
- После инъекции rAAV (шаг 3.1.11) Вставьте керамические обойма содержащих оптоволокна в ППП.
- Исправьте керамическая втулка и оптического волокна на череп, с использованием стоматологической смолы и дайте высохнуть.
- Мазок на поверхности стоматологической смолы с задней лак. Повторите процедуры, изложенные в 3.1.2 для 3.2.5, опуская фактические инъекции rAAV для элемента управления.
- Послеоперационный уход
- Предоставить мышей с послеоперационным анальгетики, такие как бупренорфин 2 мг/кг массы тела, подкожно, дважды в день.
- Место мыши в клетке восстановления, пока они приходят из наркоза.
- Дом мыши индивидуально под условие свет/темно 12 h (интенсивности света ~ 100 люкс в нижней части клетки) с продовольствие/вода доступна ad libitum. Восемь дней должно быть выделено до дальнейших экспериментов для предусмотреть достаточное количество времени восстановления и обеспечения оптимального флуоресценции репортер выражение.
4. в естественных условиях флуоресценции сигнал мониторинга и сбора данных
- Восемь дней после операции, подключите волокна на голове мыши с флуоресцентным сигнала монитор (например., ген наблюдателя). Проверьте сигнал флуоресценции в SCN управления мышей для создания фонового сигнала. Провести наблюдения и измерения этого сигнала с помощью флуоресценции сигнала монитора.
- Оцените флуоресценции сигнал экспериментальной мыши с той же операции управления мышью. Исключить мышей, которые получили вирусный вектор, но который только отображения фонового сигнала от анализа, как это скорее всего означает, что наконечник волоконно пропустили SCN. После этих первоначальных мер вернуть их домой клетки еще 3 недели позволить флуоресценции сигнал для стабилизации мышей.
- После 3 недель Подключите мышей с флуоресцентным сигнала монитора. Измерения флуоресценции для 15 s каждые 10 мин, с частотой 100 Гц. В ходе этих измерений мышей свободно двигаются в их клетках с продовольствие/вода доступна ad libitum. Используйте интенсивности света в нижней части клетки ~ 100 люкс и мощность лазера на кончике волоконно между 15-20 мкВт.
- После завершения всех записей perfuse мышей с параформальдегида 4% и удалить и кусок мозги, чтобы проверить размещение оптоволокна. Исключить из анализа мышей, если кончик волоконно правильно не имплантируется в ППП.
5. анализ данных и презентации
- Мера флуоресценции сигнал каждые 10 мин 15 сек, с частотой 100 Гц, приносить 1500 точек данных. Среднее значение этих 1500 точек переводит сигнал флуоресценции в любой данный момент времени точке. Печать нескольких средние со временем производит кривой сигнала к времени, которая соответствует транскрипционный анализ ритма Cry1 под света условие управления в ППП свободно двигать мышь.
Результаты
Флуоресценции репортер дизайн Cry1 был Показать на рисунке 1A. Используя подход подробно говорилось выше, 500 nL rAAV-P (Cry1) - intron336 - Венера-NLS-D2 был успешно введен в SCN взрослой мыши и выставлены надежные Венера выражение (рис. 1B, 1 C). Флуоресценции сигналов, записанная в 12h / 12h свет/темно (LD) и Темный/Темный (DD) условиях (рис. 2) принесли надежные Циркадный ритм в обоих условий. Наконец флуоресценции сигнал был записан в длинных и коротких фотопериода условиях (рис. 3).
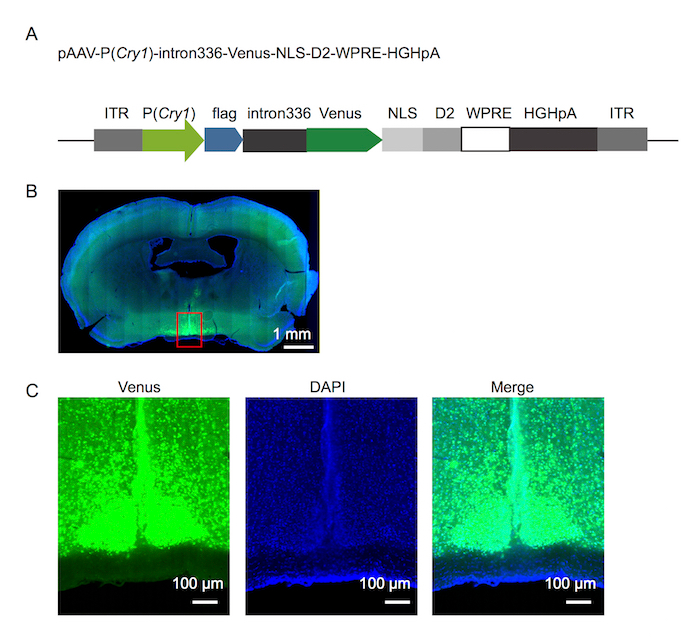
Рисунок 1. Флуоресценции репортер дизайн и его выражение в СКС
(A) флуоресценции репортер дизайн Cry1. (B) Микрофотография мозга мыши, показаны репортер выражение 8 дней после инъекции вируса. (C) увеличение площади в штучной упаковке в красном на Микрофотография, показано в пункте (B). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
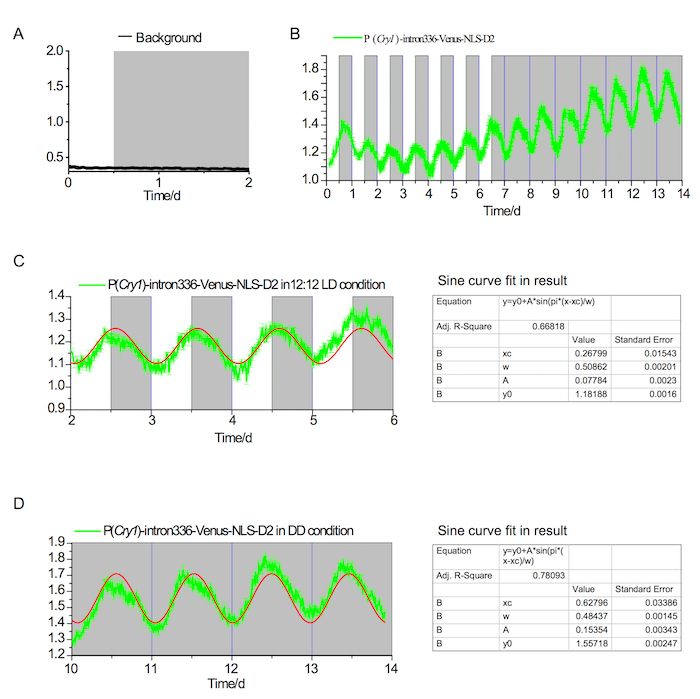
Рисунок 2. Флуоресценции в vivo записи в SCN условиях LD и DD
(A) фон флуоресценции в ППП, показаны не обнаружено ритм LD и DD условиях. Белые и серые области указывают на свет и свет офф периодов, соответственно. (B) P (Cry1) - intron336 - Венера-NLS-D2 выражение в течение 7 дней в состоянии LD 12-12 и 7 дней в состоянии ПД. (C) анализ циркадного ритма в состоянии LD (~24.4 h); Красная линия показывает конвергентных в кривой Синус (в результате fit показано на левой панели). (D) анализ циркадного ритма в состоянии DD (~23.25 h); Красная линия показывает конвергентных в кривой Синус (в результате fit показано на левой панели). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
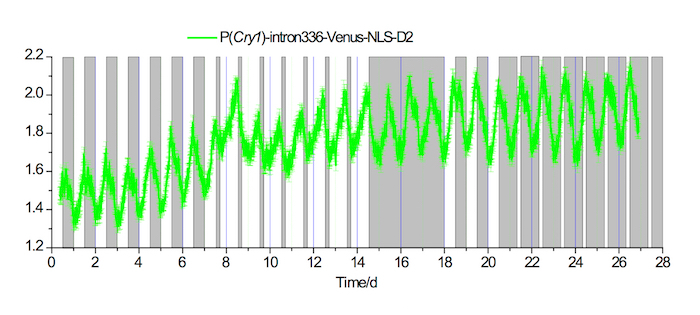
На рисунке 3. В естественных условиях записи флуоресценции в SCN под 20-4 длинный и короткий фотопериод условия 4-20
Пример записи флуоресценции P (Cry1) - intron336 - Венера-NLS-D2 выражение в ППП для 7 дней при условии LD 12-12, а затем 7 дней при условии длинный Фотопериод 20-4, 3 дня при условии DD, 3 дня при условии LD 12-12, и затем 7 дней при условии короткий фотопериод 4-20. Белые и серые области указывают на свет и свет офф периодов, соответственно. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Таблицы 1. Конкретные реагентов, необходимых для протокола (см. Таблицу материалы)
| Грунтовка имя | последовательность | ||
| Грунтовка F1 | cactaggggttcctgcggccgcACGCGTGTAAAGATGCACATGTG | ||
| Грунтовка R1 | TTGTAACCTTGATACTTACCTACTTAGATCGCAGATCTCGTCCGG | ||
| Грунтовка F2 | GTTATGACACAGTGTAGAAACTATGGCATAGGACAGATGACTGTG | ||
| Грунтовка R2 | CATGGTCTTTGTAGTCCATGGTGGGTACCtCTTGACAGCTCTACC | ||
| Грунтовка F3 | ctgtattttcagggcCCTGCAGGtGTGAGCAAGGGCGAGGAGCTG | ||
| Грунтовка R3 | TACCTTTCTCTTCTTTTTTGGAGGCTTGTACAGCTCGTCCATGCC | ||
| Грунтовка F4 | GCATGGACGAGCTGTACAAGCCTCCAAAAAAGAAGAGAAAGGTAG | ||
| Грунтовка R4 | tgatatcgaattcGGATCCCTACACATTGATCCTAGCAGAAGCAC | ||
Таблица 2. Грунтовка используется в протоколе
В таблице 3. Последовательности ДНК используется в протоколе пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
В отличие от ex vivo методы, такие, как кусок культуры4,5, RT-PCR16и в situ гибридизация17, которые требуют убитых животных, в естественных условиях записи метод позволяет следователей для изучения экспрессии генов суточного в живых животных. Таким образом эта технология обеспечивает возможность оценить эффект различных физических возмущения (например, лишение сна, стресс, пищи и т.д.) на нейронных суточного часов. В отличие от в vivo биолюминесценции7,8,10 метод, который может работать только в условиях постоянной темноты, флуоресценции в vivo записи метод может применяться под свет условия-ключевым преимуществом технологии как свет сигналы повторного уноса SCN суточного часов18. Хотя относительно постоянной, надежной циркадные ритмы могут быть обнаружены с помощью этого метода, следует отметить, что репортер технологии не предоставляют количественной информации и поэтому может не использоваться для измерения уровней транскрипции гена и перевод.
Есть много важных шагов этого протокола. Концентрированные rAAV титр должен быть выше, чем 2-8 x 1012 вирусных частиц на мл; Нижняя вирусный титры даст покинуть тусклый или даже обнаружить флуоресценции сигналов. При фиксации головы мыши в стереотаксического аппарата, что обеспечивает черепа горизонтальной безопасных точного позиционирования для инъекций и волоконно-оптических имплантации вирус. Инъекции вируса должно быть сделано медленно (≤50 nL мин-1) для обеспечения, что вирус остается в ППП. Обойма керамики и волоконно-оптических должны быть надежно зафиксирован на черепе и стоматологической смолы не следует связаться с кожи. Если должным образом не фиксированной керамическая втулка и волоконно-оптических, они будут постепенно отсоединить от мыши головы.
Эта техника может быть расширен для включать другие репортеры гена (например, Per2, Bmal1, C Фос, Pomcи т.д.), изменив промоутер и соответствующего Интрон19. Вспять флага inton336-Венера-NLS-D2 кассету с двумя последовательностями обратная аргона и объединения репортер с КРР мыши линии, эта технология может использоваться для записи активности в определенных нейронов. Например сочетая этот подход с Vip-cre мыши линии позволит для записи transcriptional Cry1 ритмы в вазоактивный кишечный полипептид выражая нейронов в СКС. Этот метод можно также использовать GCaMP6 как Ca2 + индикатор для записи Ca2 + Циркадный ритм в головном мозге.
Раскрытие информации
Авторы не имеют никаких конфликтов интересов раскрыть.
Благодарности
Мы благодарим членов в Чжан лаборатории для обеспечения стимулирования обсуждений и членов в Чжань лаборатории для оказания технической помощи. Это исследование было поддержано грантов 31500860 (чтобы циркон) NSFC, 2012CB837700 (для E.E.Z. и циркон) 973 программы от M.O.S.T. Китая и финансирование от Пекина муниципального правительства. E.E.Z. было поддержано китайской «Программа набора глобальных молодежных экспертов».
Материалы
| Name | Company | Catalog Number | Comments |
| KOD Plus Neo | TOYOBO | KOD-401 | Reagent |
| pVENUS-N1 | addgene | #61854 | Plasmid |
| pcDNA3.3_d2eGFP | addgene | #26821 | Plasmid |
| pAAV-EF1a-double floxed-hChR2(H134R)-mCherry-WPRE-HGHpA | addgene | #20297 | Plasmid |
| MluI | Thermo Scientific | FD0564 | Reagent |
| EcoRI | Thermo Scientific | FD0274 | Reagent |
| Gibson Assembly Mix | NEB | E2611s | Reagent |
| Lipofectamine 2000 | Thermo Scientific | 12566014 | Reagent |
| Syringe Filter | EMD Millipore | SLHV033RS | 0.45 µm |
| HiTrap heparin columns | gelifesciences | 17-0406-01 | 1 mL |
| Amicon ultra-4 centrifugal filter | EMD Millipore | UFC810024 | 100,000 MWCO |
| Benzonase nuclease | Sigma-Aldrich | E1014 | Reagent |
| Sodium deoxycholate | Sigma-Aldrich | D5670 | Make fresh solution for each batch |
| mouse stereotaxic apparatus | B&E TEKSYSTEMS LTD | #SR-5M/6M | Equipment |
| pentobarbital | SigmaAldrich | #1507002 | Reagent |
| mouse stereotaxic apparatus | B&E TEKSYSTEMS LTD | #SR-5M/6M | Equipment |
| Hydrogen peroxide solution | SigmaAldrich | #216763 | Reagent |
| Optical Fiber | Thorlabs | FT200EMT | 0.39 NA, Ø200 µm |
| microsyringe pump | Nanoliter 2000 Injector, WPI | Equipment | |
| ceramic ferrule | Shanghai Fiblaser | 230 μm I.D., 2.5 mm O.D. | |
| Gene Observer | BiolinkOptics | Equipment |
Ссылки
- Welsh, D. K., Takahashi, J. S., Kay, S. A. Suprachiasmatic nucleus: cell autonomy and network properties. Annual Review of Physiology. 72, 551-577 (2010).
- Zhang, E. E., Kay, S. A. Clocks not winding down: unravelling circadian networks. Nature Reviews Molecular Cell Biology. 11, 764-776 (2010).
- Takahashi, J. S. Transcriptional architecture of the mammalian circadian clock. Nature Reviews Genetics. 18, 164-179 (2017).
- Yoo, S. H., et al. PERIOD2::LUCIFERASE real-time reporting of circadian dynamics reveals persistent circadian oscillations in mouse peripheral tissues. Proceedings of the National Academy of Sciences U S A. 101, 5339-5346 (2004).
- Davidson, A. J., Castanon-Cervantes, O., Leise, T. L., Molyneux, P. C., Harrington, M. E. Visualizing jet lag in the mouse suprachiasmatic nucleus and peripheral circadian timing system. European Journal of Neuroscience. 29, 171-180 (2009).
- Savelyev, S. A., Larsson, K. C., Johansson, A. S., Lundkvist, G. B. Slice preparation, organotypic tissue culturing and luciferase recording of clock gene activity in the suprachiasmatic nucleus. Journal of Visualized Experiments. (48), (2011).
- Yamaguchi, S., et al. Gene expression: View of a mouse clock gene ticking. Nature. 409, 684-684 (2001).
- Ono, D., Honma, K. I., Honma, S. Circadian and ultradian rhythms of clock gene expression in the suprachiasmatic nucleus of freely moving mice. Science Reports. 5, 12310(2015).
- Ono, D., Honma, S., Honma, K. Circadian PER2::LUC rhythms in the olfactory bulb of freely moving mice depend on the suprachiasmatic nucleus but not on behaviour rhythms. European Journal of Neuroscience. 42, 3128-3137 (2015).
- Ono, D., et al. Dissociation of Per1 and Bmal1 circadian rhythms in the suprachiasmatic nucleus in parallel with behavioral outputs. Proceedings of the National Academy of Sciences U S A. 114, E3699-E3708 (2017).
- Reppert, S. M., Weaver, D. R. Coordination of circadian timing in mammals. Nature. 418, 935-941 (2002).
- Liu, A. C., et al. Redundant function of REV-ERBalpha and beta and non-essential role for Bmal1 cycling in transcriptional regulation of intracellular circadian rhythms. PLoS Genetics. 4, e1000023(2008).
- Maywood, E. S., et al. Analysis of core circadian feedback loop in suprachiasmatic nucleus of mCry1-luc transgenic reporter mouse. Proceedings of the National Academy of Sciences U S A. 110, 9547-9552 (2013).
- Ukai-Tadenuma, M., et al. Delay in feedback repression by cryptochrome 1 is required for circadian clock function. Cell. 144, 268-281 (2011).
- McClure, C., Cole, K. L., Wulff, P., Klugmann, M., Murray, A. J. Production and titering of recombinant adeno-associated viral vectors. Journal of Visualized Experiments. 57, e3348(2011).
- Yamaguchi, Y., et al. Mice genetically deficient in vasopressin V1a and V1b receptors are resistant to jet lag. Science. 342, 85-90 (2013).
- Nagano, M., et al. An abrupt shift in the day/night cycle causes desynchrony in the mammalian circadian center. Journal of Neuroscience. 23, 6141-6151 (2003).
- Golombek, D. A., Rosenstein, R. E. Physiology of Circadian Entrainment. Physiological Reviews. 90, 1063-1102 (2010).
- Mei, L., et al. Long-term in vivo recording of circadian rhythms in brains of freely moving mice. Proceedings of the National Academy of Sciences. 115, 4276-4281 (2018).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены