Method Article
En Vivo Control de la expresión de genes del reloj circadiano en el núcleo supraquiasmático de ratón usando fluorescencia Reporteros
En este artículo
Resumen
Esta nueva tecnología basada en la fluorescencia permite la monitorización a largo plazo de la transcripción de los genes del reloj circadiano en el núcleo supraquiasmático (SCN) de mover libremente ratones en tiempo real y con una alta resolución temporal.
Resumen
Esta técnica combina la fibra óptica mediada fluorescencia grabaciones con la entrega exacta de virus adeno-asociado recombinante basado en genes reporteros. Este nuevo y fácil de usar en vivo fluorescencia sistema de monitoreo fue desarrollado para grabar el ritmo transcripcional del gen reloj, Cry1, en el núcleo supraquiasmático (SCN) de la mudanza libremente ratones. Para ello, un reportero de fluorescencia Cry1 transcripción fue diseñado y empaquetado en virus Adeno-asociado. Virus purificado, concentrado fue inyectado en el ratón SCN seguido por la inserción de una fibra óptica, que luego se fija sobre la superficie del cerebro. Los animales fueron devueltos a sus jaulas hogar y permite un período de recuperación postoperatorio 1 mes asegurar suficiente expresión de reportero. La fluorescencia entonces se registró en libremente mover ratones vía un en vivo Monitoreo sistema que fue construido en nuestra institución. Para el en vivo sistema de grabación, a 488 nm láser fue juntada con un 1 x 4-divisor de viga que divide la luz en cuatro salidas de excitación láser de igual potencia. Esta configuración nos permitió grabar en cuatro animales simultáneamente. Cada una de las señales de fluorescencia emitida fue recogida a través de un tubo fotomultiplicador y una tarjeta de adquisición de datos. En contraste con la técnica de bioluminiscencia anterior en vivo grabación reloj circadiano, esta fluorescencia en vivo sistema de grabación que permite la grabación de la expresión de genes del reloj circadiano durante el ciclo de luz.
Introducción
En los mamíferos, el núcleo supraquiasmático (SCN) gobierna del ritmo circadiano del cuerpo entero para coordinar la respuesta de un individuo a los cambios ambientales exógenos (p. ej., luz, temperatura, estrés, etc.)1. Base reloj componentes consisten en Per1-3, 2 Cry1, Clocky Bmal1y desempeñan un papel central en la regulación del reloj circadiano de cada célula. Cada célula en el SCN contiene el activador transcripcional, reloj/BMAL1, que actúa como un heterodímero para inducir la expresión de por y grito. PER / grito complejo entonces inhibe la función de reloj/BMAL1 para formar un lazo de regeneración de transcripción-traducción que lleva alrededor de 24 h a completa2,3.
Estudios previos en el SCN han empleado principalmente el ex vivo SCN rebanada cultura método4,5,6 y, aunque este enfoque ha proporcionado información valiosa, sus limitaciones han inhibido nuestra capacidad de obtener datos con respecto a la influencia de otros núcleos del cerebro en el SCN, así como el efecto de estímulos exógenos (e.g., luz) en las células que residen en esta región crítica. En 2001, el grupo de Hitoshi Okamura fue el primero en utilizar el sistema de bioluminiscencia en vivo expresión génica monitor reloj circadiano en el SCN en el libre movimiento de ratones7. Grupo de Ken-ichi Honma ha pasado los últimos años desarrollando la bioluminiscencia en vivo sistema de grabación en el SCN8,9,10. Juntos, estos estudios han proporcionado a los investigadores con la capacidad para monitorear el reloj circadiano en constante oscuridad o después de un pulso de luz. Sin embargo, debido a bioluminescence es demasiado débil para permitir la monitorización continua durante el ciclo de luz/oscuridad, junto con el hecho de que la luz es la señal predominante para el arrastre de SCN-mediada de relojes circadianos11, hay aumento de la demanda para el desarrollo de métodos experimentales que superar las limitaciones asociadas con la grabación de la bioluminiscencia. El actual informe describe un sistema basado en la fluorescencia que se construyó para vigilar el reloj circadiano de la SCN en vivo libremente mover ratones. Este método fácil de usar permite monitoreo continuo durante el ciclo de luz/oscuridad y permite la observación a largo plazo de la transcripción de los genes del reloj circadiano en la escena en tiempo real y con alta resolución temporal.
Protocolo
Todos los procedimientos en este protocolo se llevaron a cabo con la aprobación de la institucional Animal Care y el Comité uso (IACUC) del Instituto Nacional de ciencias biológicas, Beijing, con arreglo a las normas gubernamentales de China.
1. construcción del reportero de fluorescencia Cry1
Nota: Los estudios utilizando el sistema de bioluminiscencia2,12,13 fusible promotora circadiana con una desestabilización luciferasa (dLuc) para inducir la expresión rítmica dLuc . Para desarrollar un reportero de la fluorescencia, desestabilizada luciferasa fue reemplazado con proteína de fluorescencia desestabilizada (dVenus) para inducir la expresión rítmica dVenus . La generación de la P (Cry1)-d reportero deVenus se describe a continuación, la construcción de la que se somete actualmente a Addgene y estará disponible pronto para su uso académico.
- Amplificar el promotor Cry1 de ratón funcional (+328 región-1208 bp del gen Cry1 , sitio de inicio de transcripción señalado como '' -1 ''). Uso de la enzima de la polimerización en cadena (KOD más Neo), primers F1 y R1 (ver tabla 2), genoma del ratón como protocolo de una plantilla y PCR del fabricante de la para amplificar el fragmento de ADN del promotor Cry1 .
- Amplificación del intrón 336 del gen Cry1 , que es importante para la función del reloj circadiano de Cry114. Utilizar la enzima PCR, cartillas F2 y R2, genoma del ratón como una plantilla y protocolo PCR del fabricante de la para amplificar el fragmento de ADN del intrón 336.
- Amplificar el Venus. Utilizar la enzima PCR primers F3 y R3, pVENUS-N1 plásmido como una plantilla y protocolo PCR del fabricante de la para amplificar el fragmento de ADN de Venus .
- Amplificar el fragmento de ADN de NLS-D2. Utilizar la enzima PCR, cartillas F4 y R4, pcDNA3.3-d2eGFP plásmido como una plantilla y protocolo PCR del fabricante de la para amplificar el fragmento de ADN de NLS-D2.
- Sintetizar el fragmento de ADN 1 como exón 1.
- Sintetizar el fragmento de ADN 2 como el vinculador entre el intrón 336 y el fragmento de ADN de Venus .
- Corte el pAAV-EF1a-doble floxed-hChR2 (H134R) - mCherry - WPRE-plásmido vector de HGHpA con las enzimas MluI y EcoRI. Utilice el Kit de extracción de Gel para purificar el fragmento de ADN más grande. Utilizar el protocolo del fabricante.
- Usando una mezcla de Asamblea de Gibson y su protocolo estándar, juntar todos los fragmentos de DNA para producir el reportero-intron336-Venus-NLS-D2-WPRE-HGHpA pAAV-P (Cry1). Utilizar el protocolo del fabricante.
2. producción de Virus Adeno-asociado15
- Preparar el plásmido siguiente acciones ADN: 31,25 μg de pRV1, 31,25 μg de pH21, 125 μg de pFdelta6 y 62.5 μg de pAAV-P (Cry1) - intron336 - Venus-NLS - D2-WPRE-HGHpA.
- Cinco platos de 15 cm de células 293T y esperar a que las células se convierten en 90% confluente.
- Transfectar la plásmidos a las células de 297T siguiendo el protocolo de reactivo de transfección. Para cada plato, utilizar 6,25 μg de pRV1, 6,25 μg de pH21, 25 μg de pFdelta6, 12.5 μg de pAAV-P (Cry1)-intron336-Venus-NLS-D2-WPRE-HGHpA y 120 μl de reactivo de transfección.
- 72 h después de la transfección, separar las células de cada placa con una pistola de la pipeta; cosecha de las células en dos tubos de 50 mL.
- Sedimenten las células a 800 x g por 10 min y descarte el sobrenadante. Lavar las células colocando 20 mL de solución salina tamponada con fosfato (PBS) en cada tubo; sedimenten las células a 800 x g por 10 min y descarte el sobrenadante.
- Resuspender el pellet en NaCl 150 mM y 20 mM solución de Tris, pH 8.0; utilizar 25 mL de tubo de solución. Añadir 1,25 mL de desoxicolato de sodio 10% recién preparada (en dH2O) a cada tubo. Añadir benzonase nucleasa a una concentración final de 50 unidades por mL y mezclar bien. Incubar a 37 ° C durante 1 h.
- Eliminar desechos celulares por centrifugación a 3000 x g durante 15 minutos. Asegurar que todos los escombros ha sido removido por empujar la mezcla por un filtro de jeringa de 0.45 μm; Este paso ayudará a evitar el bloqueo de las columnas de la heparina.
- Configurar las columnas de heparina mediante una bomba peristáltica; fijar el caudal a 1 mL/min, asegurando que no hay burbujas de aire son introducidas en las columnas.
- Equilibrar las columnas con 10 mL de 150 mM NaCl, 20 mM solución de Tris, pH 8.0. Añadir la solución que contiene el virus para cada columna. Lavar las columnas con 20 mL de 100 mM NaCl, 20 mM solución de Tris, pH 8.0. Luego, utilizando una jeringa de 5 mL, lavar las columnas con 1 mL de NaCl 200 mM y 20 mM Tris solución pH 8.0, seguidas de 1 mL de un 300 mM NaCl y solución de Tris 20 mM, pH 8.0.
- Utilizar una jeringa de 5 mL para eluir el virus con 3 mL de 400 mM NaCl, solución de 20 mM Tris, pH 8.0, seguido de 4 mL de 450 mM NaCl, solución de 20 mM Tris, pH 8.0 y finalmente por 3 mL de 500 mM NaCl , solución de 20 mM Tris, pH 8.0. Recoger los materiales extraídos.
- Para la concentración del virus adeno-asociado recombinante (rAAV), cargar los materiales extraídos, 4 mL a la vez, en unidades de centrífugas filtro 100.000 peso molecular límite. Cada muestra de 4 mL a 2000 x g durante 5 min a temperatura ambiente, descartando el flujo a través de la centrífuga.
- Cuando todos los materiales extraídos se han ejecutado a través de las unidades de filtro centrífugo, añadir 4 mL de PBS y centrifugar la mezcla a aproximadamente 250 μL. Quitar rAAVs (título viral debe ser de 2-8 x 1012 partículas virales por mL) de las unidades de filtro centrífugo, alícuota y tienda a-80 ° C hasta su uso. En esta etapa, el virus puede almacenarse durante varios meses.
3. rAAV inyección e inserción de fibra óptica en el SCN de ratón adulto
- Inyección de fluorescencia circadiano reportero-que lleva rAAVs en el SCN
- Carga 5 μl de rAAV (el título del virus es de 2-8 x 1012 partículas de virus por mL) en una micro jeringa.
- Anestesiar un ratón adulto (2 a 5 meses, C57BL/6 de fondo) con Nembutal (80 mg/kg) mediante inyección intraperitoneal. Si hay suficiente profundidad de la anestesia por la falta de una respuesta del pellizco del dedo del pie.
- Utilice tijeras para quitar la piel de la cabeza del ratón y luego montar el ratón en un aparato estereotáxicas. Proporcionar una fuente de calor a los animales anestesiados por medio de una manta de agua caliente circulante u otro aparato de la calefacción.
Nota: Como alternativa, utilice podadoras de pelo eléctricas o crema depilatoria para quitar la piel. - Limpiar el sitio quirúrgico con los agentes desinfectantes apropiados. Por ejemplo, podría incluir agua estéril o alcohol y yodo, betadine, o diluir clorhexidina alternando peelings. Repetir al menos 3 veces. Cubra el sitio quirúrgico.
- Utilice las tijeras para hacer una incisión en el cuero cabelludo y exponer el cráneo.
- Ajustar el aparato estereotáxicas que bregma y lambda son en el mismo plano horizontal; hacer dos puntos simétricos de vértice en el mismo plano horizontal.
- Usar un hisopo de algodón estéril empapado en el 4% H2O2/H2O corroer el periostio del cerebro. Luego use un hisopo de algodón limpio y estéril para limpiar y secar la superficie del cráneo.
- Usando un taladro micro, hacer un orificio de aproximadamente 1 mm en posterior 0,46 mm y 0,25 mm de diámetro lateral a bregma.
- fi Utilice un hisopo de algodón estéril con solución salina fisiológica para borrar fragmentos de hueso de la superficie expuesta del cerebro.
- Inserte una micro jeringa en el cerebro, asegurando que la punta de la jeringa de micro es 0.46 mm posterior y lateral de 0,25 mm a bregma y 5,7 mm de profundidad de la superficie del cráneo.
- Inyecte 500 nL de rAAV (nL 50 min-1) en la escena, dejando la jeringa micro en lugar de 10 minutos después de la inyección para asegurar la completa difusión de rAAV.
- Retire lentamente la jeringa micro.
- Inserte la fibra óptica en el área SCN.
- Usando un cuchillo de fibra óptica, corte una fibra 17 mm de longitud, asegurándose de que cada lado de la fibra óptica es lisa.
- Inserte la fibra óptica cerámica virola y fijar la fibra óptica a una férula cerámica con peróxido de metil etil cetona (pegamento del AB), asegurarse de que las superficies de la fibra óptica cerámica Virola al ras.
- Limpie la fibra con un óxido de solución o etileno esterilizante frío.
- Después de la inyección de rAAV (paso 3.1.11), inserte la fibra óptica cerámica Virola-que contienen en el SCN.
- Fijar la férula cerámica y fibra óptica en el cráneo usando resina dental y deje que se seque.
- Frotis de la superficie de la resina dental con posterior esmalte de uñas. Repita el procedimiento descrito en 3.1.2 a 3.2.5, omitiendo la inyección real de rAAV para control.
- Atención post quirúrgica
- Proporciona ratones analgésicos postoperatorios, como buprenorfina 2 mg/kg de peso, por vía subcutánea, dos veces al día.
- Lugar de ratones en una jaula de recuperación mientras que salen de la anestesia.
- Ratones de la casa individualmente bajo una condición de luz/oscuridad de 12 h (intensidad de la luz ~ 100 lux en la parte inferior de la jaula) con disposición de alimentos y agua ad libitum. Ocho días deben asignarse antes más experimentación para permitir suficiente tiempo de recuperación y para asegurar la expresión del reportero de fluorescencia óptima.
4. recolección de datos y monitoreo de señal en vivo la fluorescencia
- Ocho días después de la cirugía, conecte la fibra en la cabeza de ratón con el monitor de la señal de fluorescencia (e.g., Gene Observer). Comprobar la señal de fluorescencia en el SCN de los ratones de control para establecer la señal de fondo. Llevar a cabo la observación y la medición de esta señal usando el monitor de la señal de fluorescencia.
- Evaluar la señal de fluorescencia del ratón experimental con la misma operación de control del ratón. Excluir ratones que han recibido el vector viral pero que muestra sólo la señal de fondo del análisis, esto probablemente indica que la punta de la fibra óptica ha perdido la escena. Después de estas medidas iniciales, volver ratones a sus jaulas hogar para otras 3 semanas permitir que la señal de fluorescencia se estabilice.
- Después de 3 semanas, conecte los ratones con el monitor de la señal de fluorescencia. Medir la fluorescencia de 15 s cada 10 min, a una frecuencia de 100 Hz. Durante estas mediciones, los ratones circulen libremente en sus jaulas con disposición de alimentos y agua ad libitum. Utilizar una intensidad de luz en la parte inferior de la jaula de ~ 100 lux y la potencia del láser en la punta de la fibra óptica entre 15-20 MW.
- Después de la terminación de todas las grabaciones, perfusión ratones con paraformaldehído al 4%, saque y rebane los sesos para comprobar colocación de la fibra óptica. Excluir a ratones de análisis si la punta de la fibra óptica no se implanta correctamente en el SCN.
5. presentación y análisis de datos
- Medida fluorescencia señal cada 10 minutos durante 15 s, con una frecuencia de 100 Hz, a 1500 puntos. El promedio de estos 1500 puntos se traduce en la señal de fluorescencia en cualquier momento dado. Trazar múltiples promedios en el tiempo produce una curva de tiempo de señal que corresponde al ritmo transcripcional de Cry1 bajo una condición de control la luz en el SCN de libremente mover ratones.
Resultados
Diseño de reportero de fluorescencia de Cry1 fue ver en la figura 1A. Utilizando el enfoque detallado arriba, 500 nL de rAAV-P (Cry1) - intron336 - Venus-NLS-D2 fue inyectado con éxito en la escena de un ratón adulto y exhiben robusta expresión de Venus (figura 1B, 1C). Señales de fluorescencia registradas bajo condiciones de oscuridad/oscuridad (DD) (figura 2) y 12h / 12h luz/oscuridad (LD) rindieron robusto ritmo circadiano en ambas condiciones. Finalmente, la señal de fluorescencia se registró en condiciones de fotoperíodo largo y corto (figura 3).
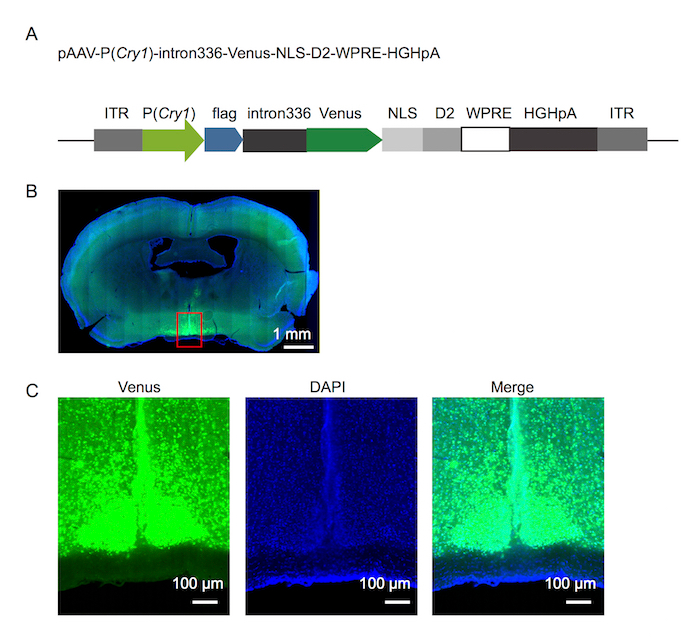
Figura 1. Diseño de reportero de fluorescencia y expresión en el SCN
(A) el diseño de reportero de fluorescencia de Cry1. (B) microfotografía del cerebro de ratón que muestra expresión reportero 8 días después de la inyección de virus. (C) ampliación del área de caja en rojo en la microfotografía que se muestra en (B). Haga clic aquí para ver una versión más grande de esta figura.
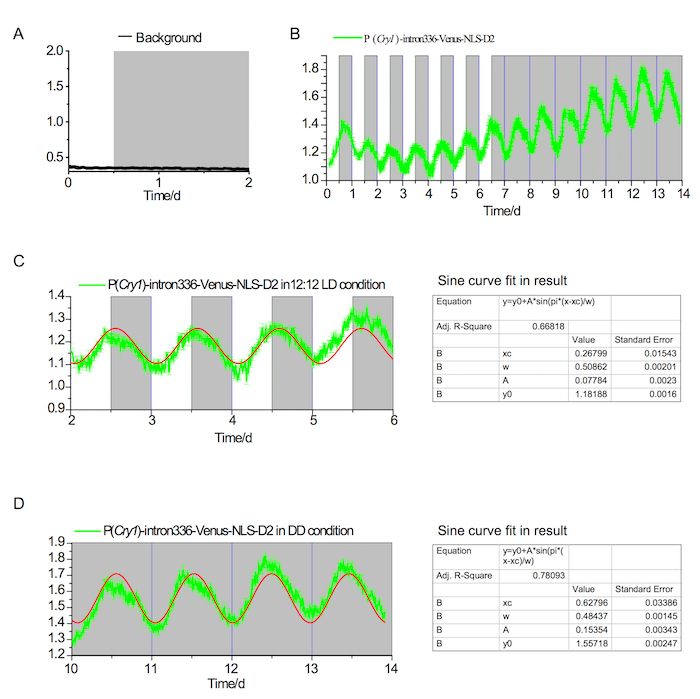
Figura 2. Fluorescencia en vivo en el SCN en LD y DD
(A) Fondo de fluorescencia en el SCN no mostrando ningún ritmo perceptible bajo condiciones de LD y DD. Las áreas blancas y grises indican períodos de luz y apagar la luz, respectivamente. (B) P (Cry1) - intron336 - Venus-NLS-expresión de D2 en el transcurso de 7 días en una condición de LD 12-12 y 7 días en un estado DD. (C) análisis del ritmo circadiano en la condición de LD (~24.4 h); la línea roja indica el convergente entra en la curva de seno (el resultado del ajuste se muestra en el panel izquierdo). (D) análisis del ritmo circadiano en la condición DD (~23.25 h); la línea roja indica el convergente entra en la curva de seno (el resultado del ajuste se muestra en el panel izquierdo). Haga clic aquí para ver una versión más grande de esta figura.
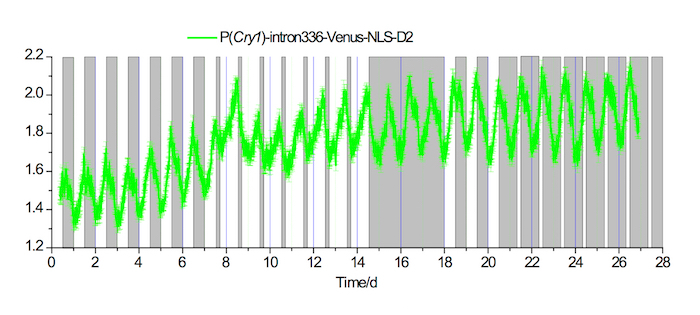
Figura 3. En vivo grabaciones de fluorescencia en el SCN en 20-4 largo y 4-20 condiciones de fotoperíodo corto
Ejemplo de un registro de la fluorescencia de la P (Cry1) - intron336 - Venus-NLS-expresión de D2 en el SCN para 7 días bajo una condición de LD 12-12, seguido por 7 días bajo una condición de fotoperiodo largo 20-4, 3 días en una condición DD, 3 días en una condición de LD 12-12, y luego de 7 días bajo una condición de fotoperiodo corto de 4-20. Las áreas blancas y grises indican los períodos de luz y apagar la luz, respectivamente. Haga clic aquí para ver una versión más grande de esta figura.
Tabla 1. Reactivos específicos para protocolo (véase Tabla de materiales)
| nombre de la cartilla | secuencia de | ||
| primer F1 | cactaggggttcctgcggccgcACGCGTGTAAAGATGCACATGTG | ||
| cartilla de R1 | TTGTAACCTTGATACTTACCTACTTAGATCGCAGATCTCGTCCGG | ||
| primer F2 | GTTATGACACAGTGTAGAAACTATGGCATAGGACAGATGACTGTG | ||
| cartilla de R2 | CATGGTCTTTGTAGTCCATGGTGGGTACCtCTTGACAGCTCTACC | ||
| primer F3 | ctgtattttcagggcCCTGCAGGtGTGAGCAAGGGCGAGGAGCTG | ||
| cartilla de R3 | TACCTTTCTCTTCTTTTTTGGAGGCTTGTACAGCTCGTCCATGCC | ||
| primer F4 | GCATGGACGAGCTGTACAAGCCTCCAAAAAAGAAGAGAAAGGTAG | ||
| primer R4 | tgatatcgaattcGGATCCCTACACATTGATCCTAGCAGAAGCAC | ||
Tabla 2. Utilizado en el protocolo de la cartilla
Tabla 3. Secuencia de la DNA usada en el protocolo haga clic aquí para descargar este archivo.
Discusión
En contraste con métodos ex vivo , como sector cultura4,5, RT-PCR16y en situ hibridación17, que mató a los animales, el en vivo método de grabación permite investigadores para el estudio de expresión de genes circadianos en un animal vivo. Así, esta tecnología proporciona la capacidad para evaluar el efecto de diferentes perturbaciones físicas (p. ej., privación del sueño, estrés, ingesta de alimentos, etc.) en el reloj circadiano neural. En contraste con el en vivo bioluminiscencia7,8,10 método que sólo puede trabajar en condiciones de oscuridad constante, la fluorescencia en vivo método de grabación se puede aplicar bajo luz condiciones, una ventaja clave de la tecnología como luz señales re-arrastre del reloj circadiano SCN18. Aunque relativamente constante, robusto circadiano puede detectarse con este método, cabe mencionar que la tecnología de reportero no proporciona información cuantitativa y por lo tanto no permite medir los niveles de transcripción genética y traducción.
Hay muchos pasos críticos de este protocolo. El título de rAAV concentrada debe ser tan alto como 2-8 x 1012 partículas virales por mL; Títulos virales baja daría señales de fluorescencia tenue o incluso imperceptible. Al fijar la cabeza del ratón dentro del aparato estereotáxicas, asegúrese de que el cráneo es horizontal segura colocación exacta para la implantación de la inyección y de fibra óptica de virus. Inyección del virus debe realizarse lentamente (≤50 nL min-1) para asegurarse de que el virus permanece en el SCN. La virola de cerámica y fibra óptica deben fijarse firmemente sobre el cráneo y resina dental no debe de estar en contacto con la piel. Si la férula cerámica y fibra óptica no están adecuadamente colocados, gradualmente se separará de la cabeza de ratón.
Esta técnica puede ampliarse para incluir otros reporteros del gene (e.g., Per2, Bmal1, c-Fos, Pomc, etc.) cambiando el promotor y el correspondiente del intrón19. Por revertir el casete de la bandera-inton336-Venus-NLS-D2 con dos secuencias lox invertida y combinando el reportero con una línea de ratón de Cre, esta tecnología puede utilizarse para registrar la actividad en las neuronas específicas. Por ejemplo, combinar este enfoque con una línea de ratón Vip-cre permitiría la grabación de los ritmos transcripcionales Cry1 en vasoactivas intestinales polipéptido expresando las neuronas en el SCN. Este método también puede utilizar GCaMP6 como un indicador de Ca2 + para registrar el ritmo circadiano de Ca2 + en el cerebro.
Divulgaciones
Los autores no tienen conflictos de interés divulgar.
Agradecimientos
Agradecemos a los miembros en el laboratorio de Zhang para proporcionar estimulantes discusiones y miembros en el laboratorio de Zhan para asistencia técnica. Esta investigación fue apoyada por concesiones 31500860 (a C.Z.) de la NSFC, 2012CB837700 (y E.E.Z. C.Z.) del programa 973 de M.O.S.T. de China y por fondos del Gobierno Municipal de Beijing. E.E.Z. fue apoyado por los chinos "Programa de reclutamiento de expertos de Juventud Global".
Materiales
| Name | Company | Catalog Number | Comments |
| KOD Plus Neo | TOYOBO | KOD-401 | Reagent |
| pVENUS-N1 | addgene | #61854 | Plasmid |
| pcDNA3.3_d2eGFP | addgene | #26821 | Plasmid |
| pAAV-EF1a-double floxed-hChR2(H134R)-mCherry-WPRE-HGHpA | addgene | #20297 | Plasmid |
| MluI | Thermo Scientific | FD0564 | Reagent |
| EcoRI | Thermo Scientific | FD0274 | Reagent |
| Gibson Assembly Mix | NEB | E2611s | Reagent |
| Lipofectamine 2000 | Thermo Scientific | 12566014 | Reagent |
| Syringe Filter | EMD Millipore | SLHV033RS | 0.45 µm |
| HiTrap heparin columns | gelifesciences | 17-0406-01 | 1 mL |
| Amicon ultra-4 centrifugal filter | EMD Millipore | UFC810024 | 100,000 MWCO |
| Benzonase nuclease | Sigma-Aldrich | E1014 | Reagent |
| Sodium deoxycholate | Sigma-Aldrich | D5670 | Make fresh solution for each batch |
| mouse stereotaxic apparatus | B&E TEKSYSTEMS LTD | #SR-5M/6M | Equipment |
| pentobarbital | SigmaAldrich | #1507002 | Reagent |
| mouse stereotaxic apparatus | B&E TEKSYSTEMS LTD | #SR-5M/6M | Equipment |
| Hydrogen peroxide solution | SigmaAldrich | #216763 | Reagent |
| Optical Fiber | Thorlabs | FT200EMT | 0.39 NA, Ø200 µm |
| microsyringe pump | Nanoliter 2000 Injector, WPI | Equipment | |
| ceramic ferrule | Shanghai Fiblaser | 230 μm I.D., 2.5 mm O.D. | |
| Gene Observer | BiolinkOptics | Equipment |
Referencias
- Welsh, D. K., Takahashi, J. S., Kay, S. A. Suprachiasmatic nucleus: cell autonomy and network properties. Annual Review of Physiology. 72, 551-577 (2010).
- Zhang, E. E., Kay, S. A. Clocks not winding down: unravelling circadian networks. Nature Reviews Molecular Cell Biology. 11, 764-776 (2010).
- Takahashi, J. S. Transcriptional architecture of the mammalian circadian clock. Nature Reviews Genetics. 18, 164-179 (2017).
- Yoo, S. H., et al. PERIOD2::LUCIFERASE real-time reporting of circadian dynamics reveals persistent circadian oscillations in mouse peripheral tissues. Proceedings of the National Academy of Sciences U S A. 101, 5339-5346 (2004).
- Davidson, A. J., Castanon-Cervantes, O., Leise, T. L., Molyneux, P. C., Harrington, M. E. Visualizing jet lag in the mouse suprachiasmatic nucleus and peripheral circadian timing system. European Journal of Neuroscience. 29, 171-180 (2009).
- Savelyev, S. A., Larsson, K. C., Johansson, A. S., Lundkvist, G. B. Slice preparation, organotypic tissue culturing and luciferase recording of clock gene activity in the suprachiasmatic nucleus. Journal of Visualized Experiments. (48), (2011).
- Yamaguchi, S., et al. Gene expression: View of a mouse clock gene ticking. Nature. 409, 684-684 (2001).
- Ono, D., Honma, K. I., Honma, S. Circadian and ultradian rhythms of clock gene expression in the suprachiasmatic nucleus of freely moving mice. Science Reports. 5, 12310(2015).
- Ono, D., Honma, S., Honma, K. Circadian PER2::LUC rhythms in the olfactory bulb of freely moving mice depend on the suprachiasmatic nucleus but not on behaviour rhythms. European Journal of Neuroscience. 42, 3128-3137 (2015).
- Ono, D., et al. Dissociation of Per1 and Bmal1 circadian rhythms in the suprachiasmatic nucleus in parallel with behavioral outputs. Proceedings of the National Academy of Sciences U S A. 114, E3699-E3708 (2017).
- Reppert, S. M., Weaver, D. R. Coordination of circadian timing in mammals. Nature. 418, 935-941 (2002).
- Liu, A. C., et al. Redundant function of REV-ERBalpha and beta and non-essential role for Bmal1 cycling in transcriptional regulation of intracellular circadian rhythms. PLoS Genetics. 4, e1000023(2008).
- Maywood, E. S., et al. Analysis of core circadian feedback loop in suprachiasmatic nucleus of mCry1-luc transgenic reporter mouse. Proceedings of the National Academy of Sciences U S A. 110, 9547-9552 (2013).
- Ukai-Tadenuma, M., et al. Delay in feedback repression by cryptochrome 1 is required for circadian clock function. Cell. 144, 268-281 (2011).
- McClure, C., Cole, K. L., Wulff, P., Klugmann, M., Murray, A. J. Production and titering of recombinant adeno-associated viral vectors. Journal of Visualized Experiments. 57, e3348(2011).
- Yamaguchi, Y., et al. Mice genetically deficient in vasopressin V1a and V1b receptors are resistant to jet lag. Science. 342, 85-90 (2013).
- Nagano, M., et al. An abrupt shift in the day/night cycle causes desynchrony in the mammalian circadian center. Journal of Neuroscience. 23, 6141-6151 (2003).
- Golombek, D. A., Rosenstein, R. E. Physiology of Circadian Entrainment. Physiological Reviews. 90, 1063-1102 (2010).
- Mei, L., et al. Long-term in vivo recording of circadian rhythms in brains of freely moving mice. Proceedings of the National Academy of Sciences. 115, 4276-4281 (2018).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados